Method Article
Séparation de bactéries par Capsule montant à l’aide d’un Gradient de densité discontinu
Dans cet article
Résumé
Nous montrons l’utilisation des gradients de densité discontinu pour séparer les populations bactériennes basées sur la production de la capsule. Cette méthode est utilisée pour comparer capsule montant entre les cultures, isoler des mutants ayant un phénotype capsule spécifique ou d’identifier des régulateurs de la capsules. Décrite ici est l’optimisation et le déroulement de l’essai.
Résumé
La capsule est un facteur de virulence essentiel dans de nombreuses espèces bactériennes, médiation immunitaire évasion et résistance aux divers stress physiques. Alors que de nombreuses méthodes sont disponibles pour quantifier et comparer capsule production entre différentes souches ou de mutants, il n’y a aucune méthode largement utilisée pour le tri des bactéries basés sur combien capsule qu’ils produisent. Nous avons développé une méthode pour séparer les bactéries par capsule montant, à l’aide d’un gradient de densité discontinu. Cette méthode est utilisée pour comparer les volumes de capsule semi quantitative entre les cultures, d’isoler des mutants avec production de capsule altérée et pour purifier les bactéries capsulées d’échantillons complexes. Cette méthode peut également être couplée avec le séquençage transposon-insertion pour identifier les gènes impliqués dans la régulation de capsule. Ici, la méthode est démontrée en détail, y compris la façon d’optimiser les conditions d’une nouvelle espèce bactérienne ou un souche du gradient et comment construire et exécuter le gradient de densité.
Introduction
Beaucoup d’espèces bactériennes produire une capsule polysaccharidique qui protège la cellule bactérienne de diverses contraintes physiques et de la reconnaissance et la mise à mort par le système immunitaire. Klebsiella pneumoniae, production de capsule est une exigence absolue pour infection1,2. Capsule de K. pneumoniae intervient dans la résistance aux peptides antimicrobiens, résistance au meurtre médiée par le complément, prévention de la phagocytose et suppression de la réponse immunitaire innée3. Surproduction de capsule est associée à une virulence accrue et d’infections contractées dans la communauté (plutôt que les infections nosocomiales)4.
Une gamme d’analyses quantitatives et qualitatives sont disponibles pour étudier la production de capsule. Pour les espèces Klebsiella , celles-ci incluent la chaîne test5, dans lequel un cure-dent, touché à une colonie est tiré vers le haut et la longueur de la chaîne produite mesurée et la mucoviscosity dosage6, qui implique la centrifugation lente de une culture suivie en mesurant la densité optique du liquide surnageant. Ces méthodes sont simples et rapides, mais manquent de sensibilité lorsqu’il est utilisé sur classique Klebsiella souches plutôt que des souches surproduisant capsules. Une autre méthode de quantification capsule est le dosage d’acide uronique, qui est techniquement difficile et nécessite l’utilisation de l’acide sulfurique concentré1. Enfin, la capsule est visible directement par microscopie (Figure 1 a). De ces méthodes, seule la microscopie permet à l’utilisateur d’observer les États capsulation différentes au sein d’une seule population, et aucune de ces méthodes permet la séparation physique des bactéries capsulées et non capsulées.
Axée sur la densité des ruptures par centrifugation en gradient sont couramment utilisés en biologie cellulaire pour purifier les cellules eucaryotes différents types7, mais sont rarement utilisées dans la recherche microbiologique. L’analyse mucoviscosity pour Klebsiella est basée sur l’observation que les bactéries capsulées hautement prennent plus de temps pour granuler par centrifugation, et nous avons pensé que cela pourrait être en raison de la diminution de la densité globale de cellules capsulées. La méthode présentée ici a été développée afin de séparer les populations de K. pneumoniae physiquement par capsule montant, en utilisant la centrifugation en gradient de densité (Figure 1). Cette méthode a été appliquée avec succès à Streptococcus pneumoniae, indiquant qu’elle s’applique à d’autres espèces bactériennes. Séparation de gradient de densité d’une bibliothèque de mutant de transposon saturés couplé avec le séquençage transposon-insertion (densité-TraDISort) a été utilisé pour identifier les gènes impliqués dans la production et la réglementation capsule8. De même, cette méthode était utilisée en conjonction avec aléatoire-prime amplification génique (PCR) des colonies individuelles d’isoler non capsulées K. pneumoniae mutants. Cette méthode peut également être utilisée pour des comparaisons rapides de capsule de production entre les conditions et les différentes populations ou pour purifier les bactéries capsulées d’échantillons complexes (Figure 1 b). Enfin, il y a la possibilité de doser d’autres phénotypes influant sur la densité, tels que la taille de la cellule ou l’agrégation.
Ce manuscrit montre comment optimiser la procédure pour une nouvelle espèce bactérienne ou un souche et illustre la construction et le fonctionnement d’un gradient de densité discontinu pour séparer les bactéries capsulées-hyper, capsulées et non capsulées.
Protocole
Remarque : S’assurer que les évaluations du risque applicables aux souches bactériennes sont respectées lorsque la culture et la manipulation des échantillons. Sachez que mise en place trop dégradés à un moment donné peut conduire à des troubles musculo-squelettiques dues à la pression sur les joints de la lente pipetage impliqués. Plan de travail et prendre des précautions pour éviter les blessures.
1. préparation des souches bactériennes ou bibliothèques Mutant
-
Rayure sur les souches à tester sur milieu gélosé approprié. Ce sont des plaques de stock pour l’expérience.
- Incuber les boîtes de nuit à la température voulue pour atteindre les colonies individuelles. Pour cette expérience,, K. pneumoniae (souches NTUH-K2044 et ATCC43816) la culture sur gélose de bouillon (LB) de Luria à 37 ° C et S. pneumoniae (type sauvage 23F et 23F Δcps) sur gélose au sang dans un bocal de bougie humidifiée à 37 ° C.
-
Choisir une seule colonie d’une plaque de stock (étape 1.1) pour ensemencer 10 mL de bouillon approprié à l’aide d’une anse stérile ou un bâtonnet. Pour le criblage de bibliothèques mutants aléatoires, ensemencer avec 10 µL du stock aléatoire bibliothèque mutante (bibliothèque TraDIS).
- Incuber les souches de Klebsiella pneumoniae dans les milieux LB sel peu à 37 ° C sous agitation et les souches de S. pneumoniae dans les médias de perfusion (BHI) coeur cerveau, statiquement à 37 ° C.
- Transférer la culture pendant la nuit dans un tube de 15 mL et centrifugeuse dans une centrifugeuse de paillasse pendant 10 min à 3 200 g x bat les seaux avec inserts de tube de 15 mL et couvercles hermétiques aérosol.
- Jeter le surnageant et resuspendre le culot dans 2 mL de 1 x solution saline tamponnée au phosphate (PBS).
Remarque : Disposer de surnageant via la voie des déchets biologique liquide appropriée dans le laboratoire. Les étapes de centrifugation et de la remise en suspension (1.2.2 et 1.2.3) vise à concentrer les bactéries pour faciliter la visualisation sur le gradient. Cultures bactériennes peuvent être chargés directement sur le dégradé, si vous préférez. Souches fortement capsulées peuvent ne pas faire une boulette serrée. Dans ce cas, retirer autant surnageant possible sans enlever toutes les cellules bactériennes, ajoutez 1 x PBS pour un volume final de 5 mL et resuspendre le culot. Continuer le protocole avec étape 1.2.5. - Pour les souches non-mucoïde, passez à l’étape 2.
- Centrifuger les tubes comme indiqué au point 1.2.2.
- Jeter le surnageant et resuspendre le culot dans 2 mL de PBS 1 x. Les cellules sont maintenant prêtes à l’emploi.
Remarque : La densité de la suspension de la cellule bactérienne n’est pas essentielle, mais doit être suffisante pour la visualisation dans le gradient. Un minimum de l’OD600 (densité optique à 600 nm) de 4 est suggéré.
2. préparation des Dilutions dégradées et gradient mini Test
-
Préparer des dilutions en dégradé.
Remarque : Les concentrations exactes du milieu gradient de densité (p. ex., Percoll) nécessaires dans les gradients de densité pour atteindre la bonne séparation différera en fonction des conditions de déformation et de la croissance bactériennes utilisées. Pente mini épreuves sont tout d’abord, afin de déterminer les concentrations qui donneront la meilleure séparation. Elles composent de 500 µL d’une seule dilution dans un tube de 2 mL. Si les bactéries seront extraites du gradient et repiqués pour applications en aval, ces étapes devraient être effectuées dans des conditions aseptiques.- Combiner les milieu de gradient de densité avec 1 x PBS pour faire des dilutions de gradient de densité. Préparer des dilutions de 20 %, 30 %, 40 %, 50 %, 60 %, 70 % et 80 % (par exemple, , 2 mL de densité moyen dégradé plus 8 mL de PBS 1 x = 10 mL de milieu gradient de densité 20 %).
- Aliquote 500 µL de la dilution de dégradé de 20 % dans un tube de 2 mL pour chaque souche à tester (par exemple, 4 souches = 4 tubes contenant 500 µL de dilution dégradé de 20 %).
- Répétez l’étape 2.1.2 pour le reste des dilutions dégradés.
-
Appliquer les bactéries au dégradé.
- Déposer 100 µL de cellules bactériennes, préparé à l’étape 1.2.3 et 1.2.6 jusqu’au sommet de chaque dilution dégradé suivant les étapes ci-dessous.
- Prendre 100 µL de cellules à l’aide d’une pipette µL 200 et placer l’embout de la pipette sur le côté du tube juste en dessous le ménisque du gradient mini.
- Aspirer les cellules bactériennes sur le gradient très lentement afin qu’elles forment une couche sur le dessus de la pente, sans n’importe quel mélange de l’interface.
- Répétez les étapes 2.2.1.1–2.2.1.2 pour toutes les souches à tester.
- À l’aide d’un rotor à angle fixe avec un couvercle hermétique de l’aérosol, centrifuger les tubes préparés dans une micro-centrifugeuse pendant 10 min à 8 000 x g.
- Après centrifugation, transférer les tubes dans un rack de visualiser la dilution gradient minimale requise pour conserver des cellules juste au-dessus du calque graduel après centrifugation.
- Si les résultats ne sont pas clairs, répéter l’essai de la mini-gradient avec incréments de dilutions moyennes gradient de densité 5 % ci-dessus et inférieure à la concentration définie dans l’étape 2.1.1 (p. ex., 25 % et 35 % des dilutions doivent être testées si le résultat de 30 % est ambigu).
Remarque : Voir la Figure 2A pour résultats typiques à une dilution moyenne gradient de densité unique. - Utiliser les résultats des mesures 2.2.3–2.2.4 pour déterminer les dilutions de dégradé idéales à utiliser pour séparer les cellules à plus grande échelle des gradients discontinus.
- Déposer 100 µL de cellules bactériennes, préparé à l’étape 1.2.3 et 1.2.6 jusqu’au sommet de chaque dilution dégradé suivant les étapes ci-dessous.
3. préparation des cellules pour l’expérience principale
-
Préparer des cultures fraîches pendant la nuit en inoculant 10 mL de bouillon approprié tel que décrit à l’étape 1.2.
- Incuber les cultures pendant la nuit dans des conditions appropriées, comme indiqué au point 1.2.1.
- Comme indiqué au point 1.2.2 de granule la culture pendant la nuit.
- Laver les cellules tel que décrit à l’étape 1.2.3.
- Jeter le surnageant et resuspendre le culot dans 1 mL de PBS 1 x. Si la souche est mucoïde et ne pas facilement pellet, resuspendre le culot dans jusqu'à 2 mL de PBS ou restes de fluides. Les cellules sont maintenant prêtes à l’emploi.
4. préparation des Gradients de densité discontinu
Remarque : Une autre méthode de préparation dégradée du bas (les plus concentrés) en haut (moins concentré) à l’aide d’une pipette est décrit à l’étape 7.
-
Pipette 1 mL de la dilution de gradient de densité plus diluée dans un polypropylène 5 mL rond tube inférieur pour former la couche supérieure, plus diluée, du dégradé.
Remarque : couches subséquentes de dilutions dégradées plus concentrées seront ajoutés sous cette couche à l’aide une aiguille, de manière à ne pas pour perturber les couches. Un minimum de deux et trois couches de gradients de 1 mL chacun au maximum sont recommandés pour la séparation solide et une visualisation facile des bactéries.- À l’aide d’une seringue jetable 1 mL avec une aiguille de 1,5 pouce attachée, prendre 1 mL de la prochaine plus concentrée densité gradient moyenne dilution dans la seringue. Évitez de prendre n’importe quel air, comme les bulles peuvent perturber les couches dégradés.
- Placer l’extrémité de l’aiguille au fond du tube contenant la première couche. Aspirez le contenu de la seringue très lentement pour éviter de mélanger l’interface.
Remarque : L’interface des deux dilutions se lèvera comme la dilution dégradée plus concentrée est ajoutée. Observer l’interface en le tenant à la lumière ou à l’extérieur d’un fenêtre. Si aucune interface distincte n’est observée, jetez le gradient et recommencer.- Retirez l’aiguille du gradient très doucement pour ne pas déranger l’interface entre les différentes dilutions dégradées. Placer le tube dans un support approprié pour le maintenir debout.
- Si vous utilisez trois différentes dilutions, répétez les étapes 4.1.1–4.1.2.1 afin que la dilution plus dense se trouve au bas. Si la pente a été construite avec succès, il y aura trois couches distinctes avec aucun mélange aux interfaces.
5. ajouter des cellules préparées à dégradés et séparation par Centrifugation
- Ajouter 600 µL de cellules préparées à l’étape 3.3 vers le haut du dégradé dans le tube très lentement et sans mélange de l’interface, comme indiqué au point 2.2.
-
Placer les tubes dans les adaptateurs de tube et peser les adaptateurs combinés et les tubes pour s’assurer qu’ils sont équilibrés.
- Placer les adaptateurs tube dans un rotor à angle fixe dans une centrifugeuse de paillasse. Centrifuger pendant 30 min à 3 000 x g.
- Après centrifugation, retirez délicatement les tubes, placez-les dans un panier adapté et photographier les résultats sous forme d’enregistrement.
-
Récupérer les fractions bactériennes pour dosage acide uronique ou extraction de l’ADN en suivant l’étape 6.
- Si les applications en aval ne sont pas nécessaires, éliminer les échantillons/dégradés via l’itinéraire des déchets biologique liquide approprié dans le laboratoire.
Remarque : Il est important de valider la séparation pour les nouvelles espèces/souches de bactéries. Différentes fractions de dégradé devraient être examinées au microscope, par dosage acide uronique (étape 8), ou un autre test quantitatif approprié pour confirmer le phénotype capsule de chaque fraction. Si le but est de séparer la fonction d’agrégation ou de la taille des cellules, des dosages appropriés indépendants doivent servir.
- Si les applications en aval ne sont pas nécessaires, éliminer les échantillons/dégradés via l’itinéraire des déchets biologique liquide approprié dans le laboratoire.
6. récupération des Fractions de l’échantillon et l’excroissance optionnel Step
-
Récupérer les fractions d’un gradient en enlevant et en jetant tout liquide à partir de la dilution supérieure si aucune fraction bactérienne n’est présente au sein de cette couche.
- Pour enlever une fraction supérieure, utiliser une pipette de P200 et doucement passer l’embout de la pipette dans le gradient de la fraction et prennent la fraction. Déposer la fraction dans un tube de 1,5 mL et étiqueter correctement.
- Pour récupérer les autres fractions, toujours à l’aide de la pipette P200, insérez la pointe doucement à travers le gradient, la fraction et récupérer la fraction d’un tube frais de 1,5 mL. Enlever excès dégradé comme les fractions plues bas du gradient sont accessibles.
- Si l’extraction de l’ADN d’une fraction contenant un nombre très faible de cellules est nécessaire (par exemple, pour la densité-TraDISort), sous-culture la fraction en suivant le protocole de l’étape 6.2 pour l’excroissance facultatif obtenir plus de cellules.
Remarque : Il y aura un faible niveau de contamination des cellules en haut de la pente en fractions inférieures, comme fractions sont supprimées du haut vers le bas. Réduire au minimum ceci en travaillant avec soin pour ne pas mélanger le dégradé, en utilisant une aiguille pour enlever des fractions plus bas et en effectuant des re-purification des échantillons de très faible abondance où report peut affecter les résultats.
-
Cellules de transfert de la fraction de faible abondance récupérés dans les étapes 6.1.1–6.1.2 dans 5 mL de milieu liquide approprié. Placer dans un incubateur et grandir pendant 2 h à 37 ° C.
- Après 2 h de croissance ou lorsque l’échantillon a atteint une OD600 des 1, transférer la culture dans un tube de 15 mL. Centrifuger le tube pendant 10 min à 3 200 x g dans une centrifugeuse avec swing, seaux et couvercles hermétiques aérosol. Jeter le surnageant
- Resuspendre le culot dans 1 mL de solution 1 PBS x.
-
Préparer un gradient de densité de concentration unique fraîche dans un tube en polypropylène 5 mL. Utiliser la concentration gradient de juste au-dessus de l’emplacement de la fraction dans la pente initiale (par exemple, pour la purification du mutantslyA Δ illustré à la Figure 2D, gradient moyen de 15 % densité serait utilisé).
Remarque : cette étape de re-purification est facultative.- Appliquer les cellules vers le haut de la pente et centrifuger comme décrit aux points 2.2 et 5.1.
- Retirer les tubes de la centrifugeuse et le placer dans un support approprié. Photographier le gradient et récupérer la fraction pour l’extraction de l’ADN comme décrit dans 6.1 – 6.1.2.
Remarque : L’échantillon est maintenant prêt pour l’extraction d’ADN ou d’autres applications en aval.
7. autre méthode de préparation dégradée du bas (les plus concentrés) en haut (moins concentré) à l’aide d’une Pipette
-
Utiliser les dilutions gradients déterminées à l’étape 2.2.3. À l’aide d’une pipette µL 1 000, ajouter 1 mL de la dilution dégradée plus dense dans un tube de 5 mL.
- À l’aide d’une pipette de 200 µL, ajouter 200 µL de la dilution suivante de gradient dense très lentement vers le haut de la couche dans le tube, de manière à ne pas mélanger l’interface. Ajouter un autre 200 µL et ensuite la finale 600 µL. ajoutant plusieurs petits volumes donne plus de contrôle de vitesse de pipetage et empêche le mélange de l’interface. Si l’interface mixes, jeter et recommencer.
- Répétez l’étape 7.1.1 avec la troisième, moins dense concentration gradient si trois dilutions sont utilisées. Le tube doit avoir maintenant des gradients de 2 mL ou 3 mL en fonction des résultats de l’étape 2.2.3.
- Passez à l’étape 5 du protocole à ajouter des cellules et de poursuivre l’expérience.
8. mesure de la quantité de Capsule par dosage de l’acide Uronique
- Ajuster l' OD600 de chaque fraction récupérée vers 4.0 par dilution avec du PBS. Procéder à la quantification des acides uroniques comme précédemment publiés1.
Résultats
Résultats représentatifs sont indiquées à la Figure 2. Le résultat exact d’attendre dépendra de l’espèce bactérienne, la mise en place des gradients de densité, et si l’utilisateur examine une souche unique ou un pool de mutants. La plupart des souches migrera vers un emplacement unique dans un dégradé, comme illustré à la Figure 2 a et 2D. Application de la méthode dans une bibliothèque de mutant bactérienne donneront lieu à une bande principale au-dessus de la pente, une bande moins dense, distribuée par le biais de la couche supérieure de la pente et une fraction mineure capsulée en bas (Figure 2B). Ces fractions différer de ceux capsule comme indiqué par un dosage des acides uroniques (Figure 2B). Séquençage d’insertion transposon de différentes fractions produit claire localisation des mutants spécifiques au sein de différentes fractions de dégradé, comme indiqué pour le locus de la biosynthèse de la capsule de ATCC43816 de K. pneumoniae (Figure 2C). Résultats représentatifs des cultures pures de K. pneumoniae NTUH-K2044 et S. pneumoniaeet différente biosynthèse capsule ou mutants réglementaires, sont indiquées dans la Figure 2D.
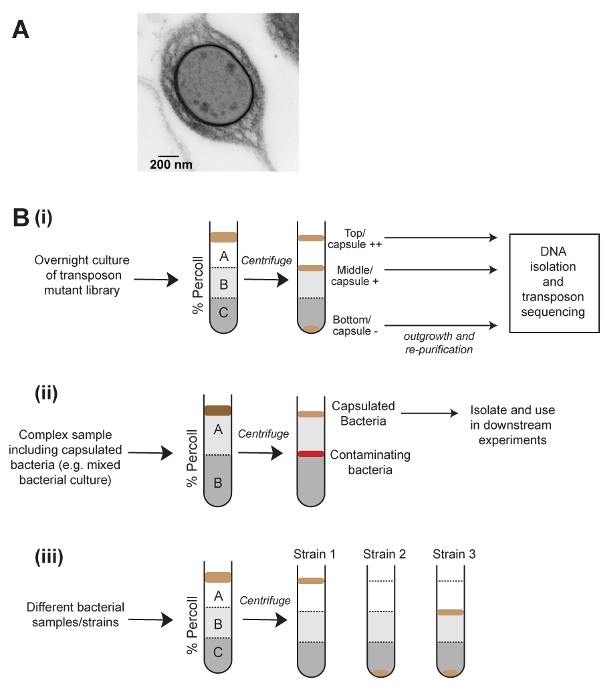
Figure 1 : Schématique de la méthode de centrifugation de densité pour séparer les bactéries basés sur la capsule et ses applications. (A) une image de microscopie électronique d’un prédosées Klebsiella pneumoniae cellulaire. La capsule apparaît sous forme d’une couche dense à l’extérieur de la cellule. (B) demandes de centrifugation de la densité à l’étude des bactéries capsulées. (Bi) Séparation de densité peut être utilisée pour générer des fractions élevé, faible et non-capsule d’une bibliothèque mutante transposon et suivie de séquençage d’insertion transposon pour définir les gènes qui influent sur la production de capsule. (Bii) Purification des bactéries capsulées auprès d’un échantillon complex. (Biii) Utilisation de séparation basée sur la densité des comparaisons rapides de capsule montant entre les échantillons. Cette méthode permet également la visualisation de la production de capsule hétérogène dans les populations bactériennes, comme indiqué dans (Biii). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
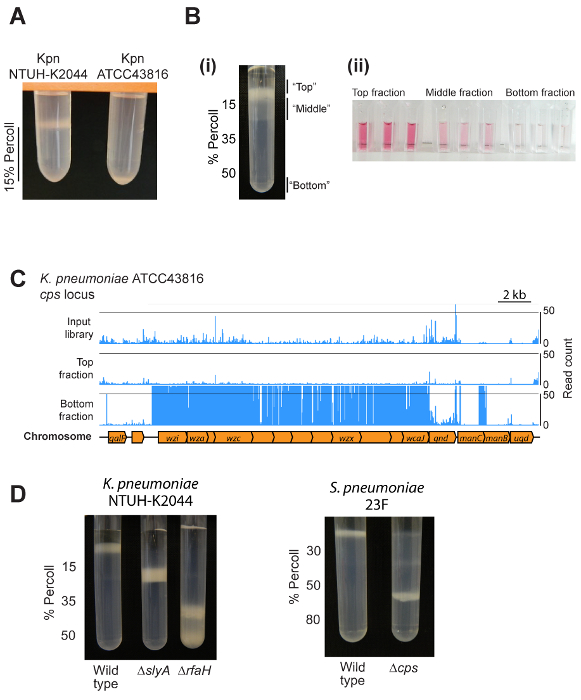
Figure 2 : Résultats représentatifs. (A) exemple de la sortie d’essais mini dégradé. Deux autres souches de K. pneumoniae ont été centrifugés à 1 mL de milieu gradient de densité 15 %. Le hypermucoviscous NTUH-K2044 souche est maintenue au-dessus de la couche moyenne gradient de densité, tandis que ATCC43816 (qui rend moins capsule) migre vers le fond de la couche. (Bi) Utilisation d’un gradient de densité pour séparer une bibliothèque mutante transposon en trois fractions. Notez que la fraction inférieure contient une faible proportion des mutants et n’est pas visible sur cette photo. (Bii) Validation des quantités différentes de capsule en haut, moyen et en fractions de fond à l’aide d’un dosage des acides uroniques. Cellules de bas en haut, au milieu et immature fractions ont été isolées et remis en suspension dans du PBS à une OD600 de 4, puis capsule polysaccharides extraits et acides uroniques mesure1. (C) résultats de densité-TraDISort exemple. Localisations de mutation identifiées sont illustrées par des lignes bleues au-dessus du diagramme du chromosome. Des mutants dépourvus de capsule peuvent être identifiés comme ceux qui sont présents dans la bibliothèque d’entrée mais sont épuisés dans la fraction supérieure tout en étant enrichi dans la fraction de bas, comme ici pour la biosynthèse de la capsule locus8. (D) un exemple d’utilisation de centrifugation en gradient de densité de comparer capsule quantité entre le type sauvage et les souches mutantes de K. pneumoniae NTUH-K2044 et S. pneumoniae 23F. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
La capsule est un facteur de virulence important dans de nombreuses espèces bactériennes, notamment K. pneumoniae3, Streptococcus pneumoniae9, Acinetobacter10et Neisseria11 espèces. Bien que différentes méthodes existent pour la quantification et la visualisation des capsules bactériennes, à l’heure actuelle il n’y a aucune méthode largement utilisée pour séparer physiquement les cellules capsulées et non capsulées. Dans cet article, nous avons démontré une méthode robuste à axée sur la capsule de séparation des populations bactériennes, ayant des applications potentielles multiples, en collaboration avec différents protocoles en amont ou en aval.
La présence d’une capsule de surface peut réduire la densité des cellules bactériennes, qui permet la séparation par centrifugation en gradient de densité (Figure 2D). Nous avons validé cette méthode à K. pneumoniae NTUH-K204412 ATCC4381613 ainsi qu’à Streptococcus pneumoniae 23F14 et son mutant de lacps Δ15. Cette méthode utilise Percoll16 car le principal constituant de la gradient de densité, qui est une suspension de particules enrobées de silice colloïdale qui a une viscosité faible et aucune toxicité vis-à-vis de bactéries - en principe, autres substances répondant à ces critères peut être permet d’établir le gradient de densité.
Il peut être difficile à faire en sorte que les couches de densité différente ne se mélangent pas lors de la construction des gradients de densité, et en cas de mélange, la méthode de séparation ne donnera pas de résultats nets. Nous avons inclus deux méthodes alternatives pour verser les gradients, à l’aide d’une aiguille ou une pipette — tous les deux sont efficaces, et la méthode à utiliser est simplement une question de préférence. Pour toutes les étapes qui implique le pipetage une substance (une suspension bactérienne, ou un calque graduel plus dilué) au-dessus d’une couche de gradient, pipetage plusieurs parties aliquotes de plus petits volumes peut rendent plus facile à réaliser une interface nette sans n’importe quel mélange de couches.
Une limitation du présent protocole est que ses performances avec d’autres espèces bactériennes n’est pas garantie. Par conséquent, il est essentiel lors de l’examen d’une nouvelle espèce bactérienne ou un souche pour valider la séparation basée sur la densité en utilisant une méthode de quantification capsule supplémentaire et indépendante. Visualiser les bactéries présentes dans chacune des fractions par microscopie avec des taches de capsule appropriés est une méthode fiable pour lesquels des protocoles détaillés sont disponibles17. Alternativement, des capsules contenant des acides uroniques (comme ceux d’Escherichia coli et K. pneumoniae) peuvent être quantifiés par un test spécifique tel qu’illustré à la Figure 2B1. Le test mucoviscosity axée sur la centrifugation ne convient pas comme une méthode de validation indépendante, comme ce dosage dépend aussi de la densité des cellules bactériennes.
Une autre limite de cette méthode est que production capsule est très sensible aux conditions de culture et même les petits changements de milieu de culture, température, ou aération susceptibles d’affecter les résultats de ce test. Pour minimiser ce problème, chercheurs peuvent utiliser un milieu de croissance défini ou un milieu complexe lots cohérents, garder tous les autres paramètres de croissance identique entre les expériences et comprennent des souches de contrôle approprié pour permettre l’interprétation des résultats inattendus . Quelques capsules bactériennes sont fragiles et peuvent de cisaillement de la cellule lorsque les cultures sont reversés. Pour éviter la tonte des capsules, cultures doivent être centrifugés et resuspendues pas plus de deux fois au cours de préparation pour le chargement sur le gradient. Si la perte de la capsule lors de la concentration des cultures demeure problématique, cultures bactériennes peuvent être appliquées à un gradient de densité directement, d’une plus grande quantité de suspension bactérienne ajoutée si nécessaire pour la visualisation.
Les applications futures de cette méthode sont pour l’appliquer à d’autres espèces bactériennes et d’utiliser cette séparation en conjonction avec différentes technologies en amont et en aval. En plus de densité-TraDISort8, nous suggérons que la séparation gradient de densité de bactéries capsulées pourrait être utilisée pour isoler des mutants avec capsule altérée, pour la purification de cellules capsulées de cultures mixtes ou des échantillons complexes et pour un profilage rapide de production capsule chez plusieurs souches. Enfin, cette technologie pourrait servir à examiner d’autres phénotypes bactériennes telles que l’agrégation.
Déclarations de divulgation
Les auteurs n’ont aucun intérêt financier à divulguer.
Remerciements
Nous remercions Wang Jin-ville et Susannah Salter pour l’approvisionnement des souches et des membres du groupe de discussion utile Parkhill. Ce travail a été financé par l’Institut de Sanger Wellcome (Wellcome grant 206194) et par une bourse de recherche postdoctorale de Sir Henry Wellcome à F.L.S. (subvention 106063/A/14/Z). M.J.D. est soutenu par une bourse de doctorat de Wellcome Sanger Institute.
matériels
| Name | Company | Catalog Number | Comments |
| Percoll | GE Healthcare | 17-0891-01 | |
| Centrifuge 5810R with Rotor A-4-81 and 500 mL buckets | Eppendorf | 5810 718.007 | |
| Adapters for 15 mL tubes | Eppendorf | 5810 722.004 | |
| Fixed andgle rotor F-34-6-38 | Eppendorf | 5804 727.002 | |
| 2.6 to 7 mL tube adapter | Eppendorf | 5804 739.000 | |
| Centrifuge 5424 including Rotor FA-45-24-11 | Eppendorf | 5424 000.460 | |
| 2 mL tubes | Eppendorf | 0030 120.094 | |
| 1.5 mL tubes | Eppendorf | 0030 120.086 | |
| 5 mL polypropylene round bottom tube | Falcon | 352063 | |
| 1 mL disposable syringe Luer slip | Becton Dickinson | 300013 | |
| AGANI Needle 21G Green x 1.5" | Terumo | AN 2138R1 | |
| P1000 pipette and tips | |||
| P200 pipette and tips |
Références
- Favre-Bonté, S., Licht, T. R., Forestier, C., Krogfelt, K. A. Klebsiella pneumoniae capsule expression is necessary for colonization of large intestines of streptomycin-treated mice. Infection and Immunity. 67 (11), 6152-6156 (1999).
- Bachman, M. A., et al. Genome-wide identification of Klebsiella pneumoniae fitness genes during lung infection. mBio. 6 (3), 1-9 (2015).
- Paczosa, M. K., Mecsas, J. Klebsiella pneumoniae: Going on the offense with a strong defense. Microbiology and Molecular Biology Reviews : MMBR. 80 (3), 629-661 (2016).
- Shon, A. S., Bajwa, R. P. S., Russo, T. A. Hypervirulent (hypermucoviscous) Klebsiella pneumoniae. Virulence. 4 (2), 107-118 (2014).
- Fang, C. -. T., Chuang, Y. -. P., Shun, C. -. T., Chang, S. -. C., Wang, J. -. T. A novel virulence gene in Klebsiella pneumoniae. strains causing primary liver abscess and septic metastatic complications. The Journal of Experimental Medicine. 199 (5), 697-705 (2004).
- Lai, Y. -. C., Peng, H. -. L., Chang, H. -. Y. RmpA2, an activator of capsule biosynthesis in Klebsiella pneumoniae CG43, regulates K2 cps gene expression at the transcriptional level. Journal of Bacteriology. 185 (3), 788-800 (2003).
- Menck, K., et al. Isolation of human monocytes by double gradient centrifugation and their differentiation to macrophages in Teflon-coated cell culture bags. Journal of Visualized Experiments. (91), 1-10 (2014).
- Dorman, M. J., Feltwell, T., Goulding, D. A., Parkhill, J., Short, F. L. . The capsule regulatory network of Klebsiella pneumoniae defined by density-TraDISort. , (2018).
- Geno, K. A., et al. Pneumococcal capsules and their types: Past, present, and future. Clinical Microbiology Reviews. 28 (3), 871-899 (2015).
- Weber, B. S., Harding, C. M., Feldman, M. F. Pathogenic Acinetobacter: From the cell surface to infinity and beyond. Journal of Bacteriology. 1986 (6), 880-887 (2016).
- Mubaiwa, T. D., Semchenko, E. A., Hartley-Tassell, L. E., Day, C. J., Jennings, M. P., Seib, K. L. The sweet side of the pathogenic Neisseria.: The role of glycan interactions in colonisation and disease. Pathogens and Disease. 75 (5), 1-9 (2017).
- Wu, K. -. M. M., et al. Genome sequencing and comparative analysis of Klebsiellapneumoniae. NTUH-K2044, a strain causing liver abscess and meningitis. Journal of Bacteriology. 191 (14), 4492-4501 (2009).
- Broberg, C. A., Wu, W., Cavalcoli, J. D., Miller, V. L., Bachman, M. A. Complete genome sequence of Klebsiellapneumoniae. Strain ATCC 43816 KPPR1, a rifampin-resistant mutant commonly used in animal, genetic, and molecular biology studies. Genome Announcements. 2 (5), (2014).
- Croucher, N. J., et al. Role of conjugative elements in the evolution of the multidrug-resistant pandemic clone Streptococcuspneumoniae Spain23F ST81. Journal of Bacteriology. 191 (5), 1480-1489 (2009).
- Croucher, N. J., et al. Selective and genetic constraints on Pneumococcal serotype switching. PLoS Genetics. 11 (3), 1-21 (2015).
- Pertoft, H., et al. Density gradients prepared from colloidal silica particles coated by polyvinylpyrrolidone (Percoll). Analytical Biochemistry. 88, 271-282 (1978).
- Breakwell, D. P., Moyes, R. B., Reynolds, J. Differential staining of bacteria: Capsule stain. Current Protocols in Microbiology. 15 (1), 1-4 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon