Method Article
不連続密度勾配を使用してカプセルの量による細菌の分離
要約
我々 はカプセルの生産に基づいて細菌の集団を分離する不連続密度勾配の使用を示します。文化間のカプセルの量を比較して、特定のカプセルの表現型の突然変異体を分離する、またはカプセルのレギュレータを識別するためにこのメソッドを使用します。ここで説明した、最適化と分析の実行です。
要約
カプセルは免疫回避と様々 な物理的なストレスへの抵抗を仲介する多くの細菌種の主要病原因子です。細菌に基づく並べ替えに広く使用されている方法はありません多くのメソッドは、定量化し、異なる系統の突然変異体のカプセルの生産を比較可能ですが、どのくらいのカプセルを出します。我々 は不連続密度勾配を使用してカプセルの量によって細菌を分離する方法を開発しました。このメソッドを使用して、変更されたカプセル生産の突然変異体を分離して複雑なサンプルからカプセル化された細菌を浄化する文化間半定量的のカプセルの量を比較します。このメソッドは、カプセルの調節に関与する遺伝子を識別するトランスポゾン挿入配列と結合することができます。ここでは、メソッドは、新しい菌種や株の勾配の条件を最適化する方法、および構築し、密度勾配を実行する方法を含め、詳細で示されます。
概要
多くの菌種は、免疫系によって認識および殺害から様々 な物理的なストレス、細菌の細胞を保護する多糖類のカプセルを生成します。カプセルの製造は、肺炎桿菌、感染1,2のための絶対条件です。Kカプセルは、抗菌ペプチドへの抵抗、耐補体を介した殺害、貪食能の防止、3生得の免疫反応の抑制を仲介します。過剰なカプセルの生産は、増加病原性と感染 (院内) ではなくコミュニティ取得4に関連付けられます。
カプセル生産を調査に量的・質的なテストの範囲があります。クレブシエラ属種の文字列テスト5、植民地に触れたつまようじは上向きに引っ張られ、生成される文字列の長さの測定、およびの低速遠心分離を含む、mucoviscosity のアッセイ6が含まれます上澄みの光学密度を測定することによって続いて文化。これらのメソッドは、シンプルで簡単なが欠けている古典的な桿菌で使用するときに感度はカプセルの高生産株ではなく系統します。カプセル定量化の別の方法は技術的に挑戦的な濃硫酸1の使用を要求するウロン酸アッセイ。最後に、カプセルは直接顕微鏡観察 (図 1 a) で表示です。これらのメソッドの顕微鏡のみ単一の人口内の異なるイーサ状態を観察することができます、これらのメソッドのどれもにより、カプセルとカプセル以外の細菌を物理的に分離。
勾配遠心法による密度ベースの分離は異なる真核細胞型7を浄化する細胞生物学が日常的に使用が、微生物学的研究で使用されることはほとんどありません。クレブシエラ属の mucoviscosity の試金は高いカプセル細菌、遠心分離によってペレットに時間がかかる、私たちはカプセル化細胞の減少の全体的な密度のために、これがあると考えた観測に基づいています。ここに示す方法は、密度勾配遠心法 (図 1) を使用して、カプセルの量によって物理的にk個体群を分離する開発されました。このメソッドは、肺炎連鎖球菌、他の細菌種に適用できることを示すに正常に適用されました。飽和トランスポゾン変異ライブラリーの密度勾配分離と相まってトランスポゾン挿入配列 (密度 TraDISort)8カプセル生産と規制に関与する遺伝子を識別するために使用されています。同様に、このメソッドは非カプセル化kを分離する個々 のコロニーのランダムな総理ポリメラーゼの連鎖反応 (PCR) と組み合わせて使用された突然変異体。このメソッドは、別の集団と条件、または複雑なサンプル (図 1 b) からカプセル化された細菌を浄化するカプセルの生産の急速な比較にも使用できます。最後に、セルのサイズや集計などの密度に影響を与える他の表現型を試金するオプションがあります。
本稿では新しい菌種やひずみの手順を最適化する方法を示し、建設してハイパー カプセル、カプセルとカプセル以外の細菌を分離する密度勾配の実行方法を示します。
プロトコル
注:養殖やサンプルを取り扱い、細菌の緊張に適用可能な任意のリスク評価を守ってとを確認します。一度にあまりにも多くのグラデーションを設定するは関与する低速ピペッティングから接合部の圧力のための筋骨格系障害につながることができます注意してください。作業を計画し、損傷を避けるために措置を講じる。
1. 細菌の緊張または変異ライブラリの準備
-
適切な寒天版でテストする系統を連勝。これらは実験のためのストック プレートです。
- シングル コロニーを達成するために必要な温度で一晩版を孵化させなさい。この実験,のため文化k (NTUH K2044 と ATCC43816 株) 37 ° C で加湿キャンドル瓶に血液寒天培地で 37 ° C、および肺炎球菌感染(23F 野生型および 23F Δcps) でルリア スープ (LB) 寒天の
-
滅菌ループまたはカクテル棒を使用して適切なスープのストック プレート (ステップ 1.1) 10 mL を接種するから単一コロニーを拾います。ランダム変異ライブラリの検診は、ランダムな変異ライブラリー ストック (TraDIS ライブラリ) の 10 μ L でスープを接種します。
- 揺れ、37 ° C で減塩 LB 媒体のk株と脳心注入 (BHI) メディア、37 ° C で静的に肺炎球菌感染株を孵化させなさい
- 15 mL の管と 15 mL チューブ挿入とエアロゾル タイトな蓋のバケットをスイング 3,200 x g で 10 分間、ベンチトップ遠心分離の遠心分離機に一晩かけて培養を転送します。
- 上澄みを廃棄し、リン酸緩衝生理食塩水 (PBS) x 1 の 2 mL にペレットを再懸濁します。
注:研究室では、適切な液体生物廃棄物ルートの上澄みで処分します。遠心分離の巻き上がり・ ステップ (1.2.2 と 1.2.3) の目的は、グラデーションで簡単に確認できる細菌を集中します。細菌文化は、好ましい場合グラデーションの上に直接読み込むことができます。大きくカプセル系統は可能性がありますタイトなペレットを形成しません。5 mL の最終巻に 1x PBS を追加この場合、任意の細菌細胞を削除せずできるだけ多く清に削除し、ペレットを再懸濁します。1.2.5 の手順とプロトコルを続行します。 - 非ムコイド株のためには、手順 2 に進みます。
- 1.2.2 の手順で説明するようにチューブを遠心分離機します。
- 上澄みを廃棄し、2 mL の 1x PBS でペレットを再懸濁します。電池は、使用する準備が整いました。
注:細菌の細胞懸濁液の密度は重要ではありませんが、グラデーションの可視化のために十分にする必要があります。最小外径600 (600 の光学濃度 nm) 4 が示唆されました。
2. グラデーション希釈とミニ グラデーション テストの準備
-
グラデーションの希釈液を準備します。
注:密度勾配の良好な分離を達成するために必要な密度勾配媒体 (例えばパーコール) の正確な濃度は、使用される細菌の歪みと成長の条件によって異なります。ミニ グラデーション テストは最高の分離を与える濃度を識別するために最初に実行されます。これらは 500 μ L の 2 mL チューブに単一希釈を構成します。細菌がグラデーションから抽出し、下流用継された場合、は、無菌条件の下でこれらの手順を実行する必要があります。- 1x PBS 密度勾配希釈をすると密度勾配媒体を組み合わせます。20%、30%、40%、50%、60%、70%、80% の希釈液を作る (例, 2 mL 密度勾配媒体に加えて、8 mL の 1x PBS 20% 密度勾配媒体の 10 mL を =)。
- テストする各緊張に 2 mL チューブに 20% 勾配希釈液の分注 500 μ L (例, 4 系統 = 20% 勾配希釈液 500 μ L を含む 4 つの管)。
- ステップ 2.1.2 グラデーションの希釈液の残りの部分に対して繰り返します。
-
細菌をグラデーションに適用されます。
- 以下の手順に従って各グラデーション希釈の先頭に手順 1.2.3 と 1.2.6 で作製した細菌細胞の 100 μ L を適用します。
- 200 μ L ピペットを使用してセルの 100 μ L を取るし、ミニのグラデーションのメニスカスの下管の側面にピペット チップを配置します。
- 彼らは、インターフェイスの任意の混合することがなくグラデーションの上に層を形成するようグラデーションに細菌の細胞を非常にゆっくりと吸引します。
- テストするすべての緊張のための手順 2.2.1.1–2.2.1.2 を繰り返します。
- エアロゾル タイトな蓋付き固定角ロータを使用して、遠心分離機の 8,000 の x gで 10 分間遠心機で準備されたチューブ。
- 遠心分離の後次の遠心傾斜層のすぐ上のセルを保持するために必要な最小勾配希釈を視覚化するラックにチューブを転送します。
- 結果が明白でない場合 5% 密度勾配中希釈上記の刻みミニ グラデーションのテストを繰り返し、2.1.1 のステップで定義された濃度以下 (例, 25%、35% の希釈テスト必要があります 30% で結果があいまいな場合)。
注:図 2は1 つの密度勾配の中希釈の典型的な結果を参照してください。 - 手順 2.2.3–2.2.4 からの結果を使用し、大規模な不連続勾配のセルを区切るために使用するのに理想的なグラデーション希薄。
- 以下の手順に従って各グラデーション希釈の先頭に手順 1.2.3 と 1.2.6 で作製した細菌細胞の 100 μ L を適用します。
3. 主な実験用細胞の調製
-
一晩の新しい文化を準備するには、1.2 の手順で説明されているように適切なスープの 10 mL を接種します。
- 1.2.1 手順の説明に従って、適切な条件で一晩文化を孵化させなさい。
- 1.2.2 の手順で説明されているように一晩文化をペレットします。
- 1.2.3 のステップで説明するようセルを洗浄してください。
- 上澄みを廃棄し、1 mL の 1x PBS でペレットを再懸濁します。ひずみがさきは、簡単に餌がない場合は、最大 2 mL の PBS か残留にペレットを再懸濁します。電池は、使用する準備が整いました。
4. 不連続密度勾配の準備
注:(少なくとも集中) ピペットを使用してトップへ (ほとんど集中している) 下からグラデーションの準備の代替方法は、ステップ 7 で説明されます。
-
ピペット 1 mL 最も希薄 5 mL ポリプロピレンに密度勾配希釈の丸い底部チューブ トップ、最も希薄、グラデーションの層を形成します。
注:のレイヤーを妨害しないように、針を使用してレイヤー下より濃度の濃いグラデーション希釈のそれに続く層に追加されます。堅牢な分離と菌の簡単な可視化の 2 つの最小値と最大 1 mL の 3 つのグラデーションのレイヤーのお勧めします。- 1 mL のシリンジを使用すると、接続されている 1.5 インチ針、次最も濃縮された密度勾配中希釈の注射器に 1 mL を取る。泡はグラデーションのレイヤーを破壊できるよう、空気の服用を避けます。
- 最初の層を含んでいる管の下部に針の端を置きます。インターフェイスの混合を避けるために非常にゆっくりと注射器の内容を吸引します。
注:2 つの希釈のインターフェイスより濃度の濃いグラデーション希釈が追加されると上昇します。光や外のウィンドウまで保持することによって、インターフェイスを観察します。明確なインターフェイスを認められなかった場合、グラデーションを破棄し、再実行します。- 異なるグラデーション希釈率間のインタ フェースの邪魔にならないので非常に軽くグラデーションから針を抜きます。それを直立した保つに適したラックにチューブを置きます。
- 3 つの異なる希釈率を使用して、手順 4.1.1–4.1.2.1 を繰り返して、密集の希釈は下部に。グラデーションが正常に構築されたインターフェイスでミックスなしで 3 つの層があります。
5. グラデーションや遠心分離によって分離する準備されたセルを追加
- 準備された細胞の 600 μ L から追加ステップ 3.3 管の勾配の上に非常にゆっくりと、インターフェイスを混合せず手順 2.2 で説明しました。
-
チューブ アダプターにチューブを置き、均衡を保っているように結合アダプターおよびチューブの重量を量る。
- ベンチトップ遠心分離機内の固定角ロータにチューブ アダプターを配置します。3,000 x gで 30 分間遠心します。
- 遠心分離の後に、慎重にチューブを削除、適切なラックに置いて、結果を記録として写真します。
-
次のステップ 6 でウロン酸定量または DNA の抽出の細菌の分数を回復します。
- 下流のアプリケーションは必要ない場合、実験室の適切な液体生物廃棄物ルート経由でサンプル/グラデーションの処分します。
注:細菌の新しい種・系統の分離を検証することが重要です。グラデーションから個々 の分数は、ウロン酸アッセイ (手順 8)、または各分画のカプセルの表現型を確認する別の適した定量法による顕微鏡観察検討すべき。目的は、別の集計やセル サイズに基づいて、独立した適切な試金が使わなければなりません。
- 下流のアプリケーションは必要ない場合、実験室の適切な液体生物廃棄物ルート経由でサンプル/グラデーションの処分します。
6. サンプル分数と省略可能な副産物のステップを回復します。
-
分数をグラデーションから削除と細菌の割合がそのレイヤー内に存在しない場合、トップの希釈から任意の液体を破棄によって回復します。
- 上部の一部を削除するには、P200 ピペットを使用して優しく分数にグラデーションをピペット チップを渡すし、分数を取る。1.5 mL チューブに分数を置き、適切にラベル付けします。
- まだ P200 ピペットを使用して、さらに分数を回復するには、ヒント優しく分数にグラデーションを挿入し、新しい 1.5 mL チューブに分数を回復します。グラデーションの下の分数は、余分なグラデーションを削除します。
- 場合は非常に低いセル番号を含む画分からの DNA の抽出より多くの細胞を取得するオプションの伸長に 6.2 のステップから次のプロトコル (例えば密度-TraDISort)、必要なサブカルチャー分数です。
注:分数が下に上から削除されると、上部下の分数にグラデーションの細胞からの持ち越しの低レベルがあります。慎重に作業してこれを最小限に抑える低分数を削除する針を使用して、持ち越しが結果に影響を与える可能性があります非常に低い豊富なサンプルの再精製を行いグラデーションをミックスしないように。
-
5 mL の適切な液体培に手順 6.1.1–6.1.2 で回復低豊富な分数から転送細胞。インキュベーターに配置し、37 ° C で 2 h の成長
- 成長またはサンプルが 1 の外径600に達したときの 2 時間後に、15 mL チューブに文化を転送します。バケットとエアロゾル タイトな蓋をスイングと遠心分離機で 3,200 x gで 10 分間のチューブを遠心します。上澄みを廃棄します。
- 1 mL の 1x PBS で細胞ペレットを再懸濁します。
-
5 mL ポリプロピレン チューブに新鮮な単一濃度密度勾配を準備します。(例えば 15% 密度勾配媒体使用図 2D に示すように ΔslyAの突然変異体の浄化) 元のグラデーション内の分数の場所のすぐ上からグラデーションの濃度を使用します。
注:この再精製の手順は省略できます。- グラデーションと手順 2.2 および 5.1 では遠心分離機の上にセルを適用します。
- 遠心分離機からチューブを取り外し、適切なラックに置きます。グラデーションを写真および 6.1-6.1.2 に記載の DNA の抽出の一部をリカバリします。
注:サンプルは、DNA の抽出や他のダウン ストリーム アプリケーションの準備が整いました。
7. (少なくとも集中) ピペットを使用して先頭に (ほとんど集中している) 下からグラデーションの準備のための方法
-
2.2.3 ステップで決定したグラデーションの希薄を使用します。1,000 μ L ピペットで、密度勾配希釈の 1 mL を 5 mL チューブに追加します。
- 200 μ L ピペットを使用すると、次の高密度勾配希釈 200 μ L はインタ フェースを混在させるように、チューブ内のレイヤーの上に非常にゆっくりと追加します。別の 200 μ L と、最終的な 600 μ L を与えるよりピペッティング速度制御し、インターフェイスの混合を防ぐ複数の小さいボリュームを追加するを追加します。インターフェイスをミックス、破棄し、再度開始。
- 3 つの希釈液を使用している場合は、第三に、最も少なく密グラデーション濃度 7.1.1 手順を繰り返します。チューブには 2 mL またはステップ 2.2.3 から結果に応じて 3 mL のグラデーションができました。
- セルを追加する実験を続行してプロトコルの手順 5 に進みます。
8. ウロン酸法によるカプセルの量の測定
- PBS で希釈して 4.0 に回復した各画分の外径600を調整します。以前に発行された1としてウロン酸の定量化を続行します。
結果
代表的な結果は、図 2のとおりです。細菌の種、密度勾配の設定を期待する正確な結果によって異なりますと単一のひずみや変異体のプールにユーザーを検証するかどうか。図 2 aに示すように、ほとんどの系統がグラデーション内の単一の場所に移行して2 D.細菌変異ライブラリにメソッドを適用すると、グラデーション、グラデーション、および下部 (図 2B) マイナーな acapsular 率の最上部の層を介して分散密度の低いバンド上の主要なバンドに上昇を与えます。これらの画分は、ウロン酸 (図 2B) の試金によって示すように、カプセルの量で異なります。K ATCC43816 のカプセルの生合成遺伝子座のように、留分のトランスポゾン挿入配列によって異なるグラデーション分数内特定の変異体の像の明確、(図 2C)。図 2Dのk NTUH K2044肺炎球菌感染と異なるカプセル生合成や規制変異体の純粋培養の代表の結果のとおりです。
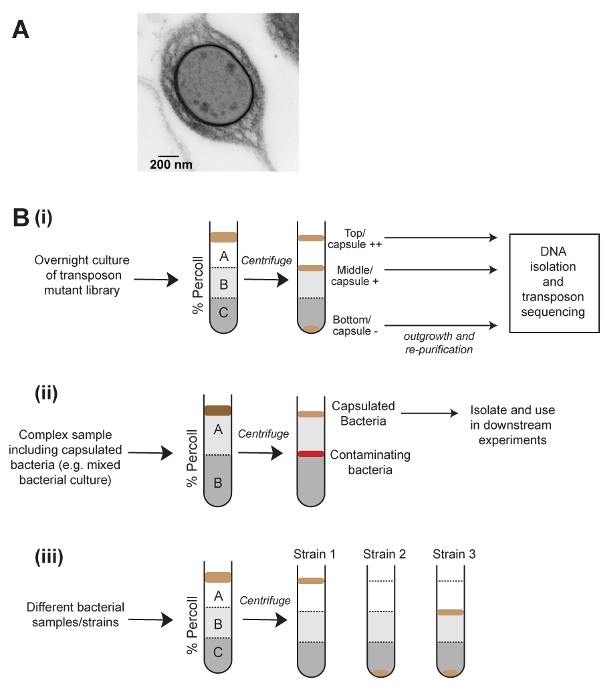
図 1: カプセルとその応用に基づく細菌を分離する密度遠心分離法の概略図。(A) カプセル化肺炎桿菌の電子顕微鏡画像のセルです。カプセルは細胞の外側に密なレイヤーとして表示されます。(B) アプリケーションのカプセル化された細菌の研究に密度遠心分離。(Bi)密度分離はトランスポゾン変異ライブラリーの高、低 - およびないカプセルの成分を生成するために使用され、カプセルの生産に影響を与える遺伝子を定義するトランスポゾン挿入シーケンスが続きます。(Bii)複雑なサンプルからカプセル化された細菌の浄化。(Biii)サンプル間のカプセルの量の迅速な比較のための密度ベースの分離の使用。(Biii) に示すように、この方法は細菌の集団で異種カプセル生産の可視化もできます。この図の拡大版を表示するのにはここをクリックしてください。
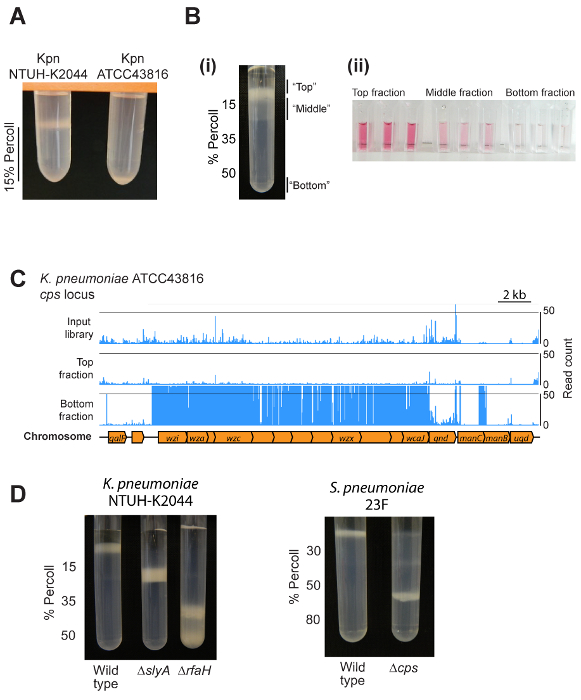
図 2: 代表結果。ミニ グラデーションのテストからの出力の例を (A)。2 つの異なるk系統 15% 密度勾配媒体の 1 mL の遠心分離しました。層の下に ATCC43816 (小さいカプセルになる) を移行しながら、密度勾配媒体層上 hypermucoviscous NTUH K2044 ひずみが保持されます。(Bi)トランスポゾン変異ライブラリーを 3 分画に分離する密度勾配を使用します。最終留分変異体の低い割合が含まれています、この写真に表示されていないことに注意してください。(Bii)上部、中間、および下部分数アッセイを用いたウロン酸のカプセル量の検証。分数が分離・ 4、外径 φ600に PBS で再停止される上、中間、および小さくなった下から細胞、カプセル抽出多糖とウロン酸測定1.(C) 密度 TraDISort の結果の例です。検出された変異の場所は、上の染色体図の青い線で示されます。カプセルに欠けている突然変異体は、入力ライブラリ内に存在しますが、カプセルの生合成の軌跡8のとおり下部分画に濃縮されている中トップの割合に尽きているとして識別できます。(D) 野生型とk NTUH K2044 と肺炎球菌感染23F の突然変異系統のカプセルの量を比較する密度勾配遠心法の使用例。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
カプセルk3、肺炎球菌9、アシネトバクター10、11種のナイセリアなど多くの菌種で病原性の重要な要因であります。細菌のカプセルの可視化と定量化に様々 な方法が存在するが現時点では無いカプセル化および非カプセル化細胞を物理的に分離する方法として広く。この記事では、上流または下流の異なるプロトコルと組み合わせて複数の潜在的なアプリケーションでの細菌集団のカプセル ベースの分離の手法を説明してきました。
表面のカプセルの存在は、密度勾配遠心法 (図 2D) によって分離を可能にする細菌の細胞密度を減らすことができます。K NTUH K204412と ATCC4381613同様に肺炎球菌23F14とその Δcps変異15このメソッドが検証されます。このメソッドはこれらの条件を満たす他の物質細菌 - 原則として、に向かって低粘度とない毒性を持つコーティングされたコロイド状シリカ粒子の懸濁液である密度勾配の主成分ができる Percoll16を使用してください。密度勾配を確立するために使用。
それは密度勾配を作成するときに別の密度の層が混ざらないように、分離法、きれいな結果が得られない混合が発生した場合ことを確認するために挑戦することができます。針やピペットを使用して、グラデーションを注ぐ 2 つの代替方法が含まれている我々-両方は有効であり、使用する方法は、単に好みの問題。ピペッティング グラデーションレイヤー上物質 (細菌懸濁液、または希薄なグラデーションの層) を含むすべてのステップ、小さいボリュームの複数の因数をピペッティングやすく鋭いインターフェイス レイヤーの任意の混合なしに達成するために。
このプロトコルの制限は他の菌種とその性能を保証することはできません。したがって、新種細菌または追加、独立したカプセルの定量化法を用いた密度ベースの分離を検証するひずみを調べるときに重要です。詳細なプロトコルが利用可能な17と、信頼性の高い方法は、適切なカプセルの汚れを顕微鏡による細菌の各分画での可視化します。また、1図 2Bに示すよう特定のアッセイによって (大腸菌, kなど) ウロン酸を含むカプセル、定量化することができます。この試金は細菌の細胞密度によっても異なりますので、遠心分離に基づく mucoviscosity テストは、独立した検証方法として適していません。
このメソッドのもう一つの制限は、カプセルの製造は培養条件、および成長培地、温度にも小さな変更に非常に敏感または曝気はこのアッセイの結果に影響を与えることです。できる研究者、この問題を最小限に抑える定義された成長媒体またはバッチ一貫性のある複雑なメディアを使用して、実験間で同じ他のすべての成長パラメーターを維持、適切なコントロール系統の予期しない結果の解釈を有効にするのには、.いくつかの細菌のカプセルは壊れやすい、文化を戻されるときセルからせん断することができます。カプセルの剪断を避けるため、文化は遠心分離し、グラデーションの読み込みのための準備中に 2 回以上再停止ください。文化の濃度の間にカプセルの損失が問題が残っている場合細菌文化に適用できる密度勾配、直接追加細菌懸濁液の量が多いと可視化のため必要な場合。
このメソッドの将来のアプリケーションは、異なる上流と下流の技術と共にこの分離を使用して他の細菌種に適用します。密度 TraDISort8、に加えてカプセル細菌の密度勾配分離がカプセル化細胞や混作や複雑なサンプルからの浄化のための変更されたカプセルの突然変異体の分離される可能性がありますをお勧めします。複数系統のカプセルの生産の急速なプロファイリングをします。最後に、この技術を使用して、集計など他の細菌の表現型を調べることができます。
開示事項
著者は明らかに金銭的な利益があります。
謝辞
株と役に立つ議論のザ ・ パークヒル グループのメンバーを供給、仁町王とスザンナ ソルターに感謝します。ウェルカム ・ サンガー研究所 (ウェルカム グラント 206194)、サー ・ ヘンリー ・ ウェルカムの員 F.L.S. (グラント 106063/A/14/Z) に資金が供給されたこの作品。M.J.D. は、ウェルカム サンガー研究所博士課程学生の身分によってサポートされます。
資料
| Name | Company | Catalog Number | Comments |
| Percoll | GE Healthcare | 17-0891-01 | |
| Centrifuge 5810R with Rotor A-4-81 and 500 mL buckets | Eppendorf | 5810 718.007 | |
| Adapters for 15 mL tubes | Eppendorf | 5810 722.004 | |
| Fixed andgle rotor F-34-6-38 | Eppendorf | 5804 727.002 | |
| 2.6 to 7 mL tube adapter | Eppendorf | 5804 739.000 | |
| Centrifuge 5424 including Rotor FA-45-24-11 | Eppendorf | 5424 000.460 | |
| 2 mL tubes | Eppendorf | 0030 120.094 | |
| 1.5 mL tubes | Eppendorf | 0030 120.086 | |
| 5 mL polypropylene round bottom tube | Falcon | 352063 | |
| 1 mL disposable syringe Luer slip | Becton Dickinson | 300013 | |
| AGANI Needle 21G Green x 1.5" | Terumo | AN 2138R1 | |
| P1000 pipette and tips | |||
| P200 pipette and tips |
参考文献
- Favre-Bonté, S., Licht, T. R., Forestier, C., Krogfelt, K. A. Klebsiella pneumoniae capsule expression is necessary for colonization of large intestines of streptomycin-treated mice. Infection and Immunity. 67 (11), 6152-6156 (1999).
- Bachman, M. A., et al. Genome-wide identification of Klebsiella pneumoniae fitness genes during lung infection. mBio. 6 (3), 1-9 (2015).
- Paczosa, M. K., Mecsas, J. Klebsiella pneumoniae: Going on the offense with a strong defense. Microbiology and Molecular Biology Reviews : MMBR. 80 (3), 629-661 (2016).
- Shon, A. S., Bajwa, R. P. S., Russo, T. A. Hypervirulent (hypermucoviscous) Klebsiella pneumoniae. Virulence. 4 (2), 107-118 (2014).
- Fang, C. -. T., Chuang, Y. -. P., Shun, C. -. T., Chang, S. -. C., Wang, J. -. T. A novel virulence gene in Klebsiella pneumoniae. strains causing primary liver abscess and septic metastatic complications. The Journal of Experimental Medicine. 199 (5), 697-705 (2004).
- Lai, Y. -. C., Peng, H. -. L., Chang, H. -. Y. RmpA2, an activator of capsule biosynthesis in Klebsiella pneumoniae CG43, regulates K2 cps gene expression at the transcriptional level. Journal of Bacteriology. 185 (3), 788-800 (2003).
- Menck, K., et al. Isolation of human monocytes by double gradient centrifugation and their differentiation to macrophages in Teflon-coated cell culture bags. Journal of Visualized Experiments. (91), 1-10 (2014).
- Dorman, M. J., Feltwell, T., Goulding, D. A., Parkhill, J., Short, F. L. . The capsule regulatory network of Klebsiella pneumoniae defined by density-TraDISort. , (2018).
- Geno, K. A., et al. Pneumococcal capsules and their types: Past, present, and future. Clinical Microbiology Reviews. 28 (3), 871-899 (2015).
- Weber, B. S., Harding, C. M., Feldman, M. F. Pathogenic Acinetobacter: From the cell surface to infinity and beyond. Journal of Bacteriology. 1986 (6), 880-887 (2016).
- Mubaiwa, T. D., Semchenko, E. A., Hartley-Tassell, L. E., Day, C. J., Jennings, M. P., Seib, K. L. The sweet side of the pathogenic Neisseria.: The role of glycan interactions in colonisation and disease. Pathogens and Disease. 75 (5), 1-9 (2017).
- Wu, K. -. M. M., et al. Genome sequencing and comparative analysis of Klebsiellapneumoniae. NTUH-K2044, a strain causing liver abscess and meningitis. Journal of Bacteriology. 191 (14), 4492-4501 (2009).
- Broberg, C. A., Wu, W., Cavalcoli, J. D., Miller, V. L., Bachman, M. A. Complete genome sequence of Klebsiellapneumoniae. Strain ATCC 43816 KPPR1, a rifampin-resistant mutant commonly used in animal, genetic, and molecular biology studies. Genome Announcements. 2 (5), (2014).
- Croucher, N. J., et al. Role of conjugative elements in the evolution of the multidrug-resistant pandemic clone Streptococcuspneumoniae Spain23F ST81. Journal of Bacteriology. 191 (5), 1480-1489 (2009).
- Croucher, N. J., et al. Selective and genetic constraints on Pneumococcal serotype switching. PLoS Genetics. 11 (3), 1-21 (2015).
- Pertoft, H., et al. Density gradients prepared from colloidal silica particles coated by polyvinylpyrrolidone (Percoll). Analytical Biochemistry. 88, 271-282 (1978).
- Breakwell, D. P., Moyes, R. B., Reynolds, J. Differential staining of bacteria: Capsule stain. Current Protocols in Microbiology. 15 (1), 1-4 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved