Method Article
Separando i batteri di capsula quantità utilizzando un gradiente di densità discontinua
In questo articolo
Riepilogo
Dimostriamo che l'uso di gradienti di densità discontinua per separare popolazioni batteriche basate sulla produzione di capsule. Questo metodo viene utilizzato per confrontare la capsula quantità tra culture, isolare mutanti con un fenotipo specifico capsula, o per identificare regolatori di capsula. È descritto qui l'ottimizzazione e l'esecuzione del test.
Abstract
La capsula è un fattore di virulenza chiave in molte specie batteriche, mediazione evasione immune e resistenza alle varie sollecitazioni fisiche. Mentre molti metodi sono disponibili per quantificare e confrontare produzione capsule tra diversi ceppi o mutanti, non esiste un metodo ampiamente utilizzato per l'ordinamento di batteri basati su quante capsule che producono. Abbiamo sviluppato un metodo per separare i batteri con capsula quantità, utilizzando un gradiente di densità discontinua. Questo metodo viene utilizzato per confrontare le quantità di capsula semi-quantitativamente tra le culture, per isolare mutanti con alterata produzione di capsule e per purificare i batteri capsulated da campioni complessi. Questo metodo può anche essere accoppiato con sequenziamento trasposone-inserimento per identificare i geni coinvolti nella regolazione della capsula. Qui, il metodo è illustrato in dettaglio, tra cui come ottimizzare le condizioni di pendenza per una nuova specie batterica o deformazione e come costruire ed eseguire il gradiente di densità.
Introduzione
Molte specie batteriche producono una capsula polisaccaridica, che protegge la cellula batterica da varie sollecitazioni fisiche e dal riconoscimento e uccisione dal sistema immunitario. Klebsiella pneumoniae, produzione capsule è un requisito assoluto per infezione1,2. K. pneumoniae capsula media resistenza di peptidi antimicrobici, all'uccisione di complemento-mediata, la prevenzione della fagocitosi e soppressione della risposta immunitaria innata3. Produzione di capsule in eccesso è associata con una maggiore virulenza e infezioni acquisite in comunità (piuttosto che di nosocomiali)4.
Una gamma di analisi quantitative e qualitative sono disponibili per studiare la produzione di capsule. Per le specie della Klebsiella , questi includono la stringa test5, in cui uno stuzzicadenti ha toccato una colonia è tirato verso l'alto e la lunghezza della stringa prodotta misurata e il mucoviscosity test6, che coinvolge la centrifugazione lenta di una cultura seguita misurando la densità ottica del surnatante. Questi metodi sono semplici e veloci, ma mancano di sensibilità quando utilizzato su classica della Klebsiella ceppi piuttosto che ceppi pagandole capsule. Un altro metodo di quantificazione capsula è il dosaggio di acido uronico, che è tecnicamente impegnativo e richiede l'uso di acido solforico concentrato1. Infine, la capsula è visibile direttamente da microscopia (Figura 1A). Di questi metodi, solo microscopia permette all'utente di osservare diversi lipooligosaccharide stati all'interno di una singola popolazione e nessuno di questi metodi consente la separazione fisica dei batteri capsulated e non capsulato.
Separazioni basate su densità di centrifugazione su gradiente sono abitualmente utilizzate in biologia cellulare per purificare di tipi differenti delle cellule eucariotiche7, ma sono raramente usate nella ricerca microbiologica. Il test di mucoviscosity per Klebsiella è basato sull'osservazione che batteri altamente capsulated richiedono più tempo a pellet mediante centrifugazione, e abbiamo ragionato che questo può essere a causa di ridotta densità complessiva di cellule capsulate. Il metodo illustrato qui è stato sviluppato per K. pneumoniae popolazioni separate fisicamente dalla capsula quantità, mediante centrifugazione in gradiente di densità (Figura 1). Questo metodo è stato applicato con successo per Streptococcus pneumoniae, che indica che è applicabile ad altre specie batteriche. Separazione di pendenza di densità di una libreria di mutante saturi trasposone accoppiato con sequenziamento trasposone-inserimento (densità-TraDISort) è stato usato per identificare i geni coinvolti nella produzione e regolamento capsula8. Allo stesso modo, questo metodo è stato usato in combinazione con casuale-prime polymerase chain reaction (PCR) di diverse colonie di isolare non capsulato K. pneumoniae mutanti. Questo metodo è utilizzabile anche per i confronti rapidi della produzione capsule tra popolazioni diverse e condizioni, o per purificare i batteri capsulated da campioni complessi (Figura 1B). Infine, c'è l'opzione altri fenotipi che influisce sulla densità, come ad esempio la dimensione della cella o aggregazione di test.
Questo manoscritto viene illustrato come ottimizzare la procedura per una nuova specie batterica o deformazione e dimostra la costruzione e l'esecuzione di un gradiente di densità discontinua per separare i batteri iper-capsulato, capsulati e non capsulato.
Protocollo
Nota: Assicurarsi che eventuali valutazioni di rischio applicabile ai ceppi batterici sono rispettate quando la coltura e la manipolazione dei campioni. Essere consapevoli del fatto che impostando troppe sfumature in una sola volta può portare a disturbi muscolo-scheletrici dovuto la pressione sulle articolazioni pipettatura lento coinvolti. Piano di lavoro e prendere precauzioni per evitare lesioni.
1. preparazione di ceppi batterici o librerie mutante
-
Striscia fuori i ceppi di essere testati su piastre di agar appropriato. Queste sono le piastre di stock per l'esperimento.
- Incubare le piastre durante la notte alla temperatura desiderata per ottenere singole colonie. Per questo esperimento, K. pneumoniae (ceppi NTUH-K2044 e ATCC43816) della coltura su agar di brodo (LB) di Luria a 37 ° C e S. pneumoniae (23F wild type e 23F Δcps) su agar-sangue in un vaso di candela umidificata a 37 ° C.
-
Scegliere una singola Colonia da una piastra d'archivio (punto 1.1) di inoculare 10 mL di brodo appropriato, utilizzando un'ansa sterile o stuzzicadenti. Per lo screening di librerie mutante casuale, inoculare il brodo con 10 µ l di stock casuale mutante biblioteca (TraDIS Library).
- Incubare K. pneumoniae ceppi a basso sale LB media a 37 ° C con agitazione e ceppi di S. pneumoniae nei media di cervello cuore infusione (BHI), in modo statico a 37 ° C.
- Trasferire la cultura durante la notte un tubo da 15 mL e centrifugare in una centrifuga di banco per 10 min a 3.200 x g in svolgimento fuori secchi con inserti in tubo da 15 mL e coperchi a tenuta aerosol.
- Eliminare il supernatante e risospendere il pellet in 2 mL di tampone fosfato salino (PBS): 1x.
Nota: Smaltire surnatante tramite il percorso dei rifiuti biologico liquido adeguato in laboratorio. Lo scopo dei passaggi centrifugazione e risospensione (1.2.2 e 1.2.3) è quello di concentrare i batteri per una visualizzazione semplice sul gradiente. Le colture batteriche possono essere caricate direttamente su sfumatura se si preferisce. Pesantemente capsulati ceppi non possono formare un pellet stretto. In questo caso, rimuovere tanto surnatante possibile senza rimuovere eventuali cellule batteriche, aggiungere 1X PBS ad un volume finale di 5 mL e risospendere il pellet. Continuare il protocollo con passo 1.2.5. - Per i ceppi non-mucoide, andare al passaggio 2.
- Centrifugare le provette come descritto al punto 1.2.2.
- Eliminare il supernatante e risospendere il pellet in 2 mL di PBS 1X. Le cellule sono ora pronte per l'uso.
Nota: La densità della sospensione delle cellule batteriche non è critica, ma deve essere sufficiente per la visualizzazione della sfumatura. Un minimo di OD600 (densità ottica a 600 nm) di 4 è suggerito.
2. preparazione del gradiente diluizioni e mini-gradiente Test
-
Preparare diluizioni gradiente.
Nota: Le concentrazioni esatte di medio gradiente di densità (ad es., Percoll) necessari nei gradienti di densità per ottenere una buona separazione saranno diverso a seconda delle condizioni di sforzo e crescita batteriche utilizzata. Mini-gradiente test vengono eseguiti in primo luogo, per identificare le concentrazioni che verranno darà la migliore separazione. Questi comprendono 500 µ l di una diluizione singola in una provetta da 2 mL. Se i batteri verranno estratta dal gradiente e una subcoltura per applicazioni a valle, questa procedura deve essere eseguita in condizioni asettiche.- Medio di gradienti di densità si combinano con 1x PBS per rendere le diluizioni di gradienti di densità. Effettuare diluizioni del 20%, 30%, 40%, 50%, 60%, 70% e 80% (ad esempio, 2 mL di densità gradiente medio e 8 mL di PBS 1x = 10 mL di 20% densità gradiente medio).
- Aliquotare 500 µ l della diluizione gradiente 20% in una provetta da 2 mL per ogni sforzo essere testati (ad es., 4 ceppi = 4 provette contenenti 500 µ l della diluizione gradiente 20%).
- Ripetere il passaggio 2.1.2 per il resto delle diluizioni gradiente.
-
Applicare i batteri alla sfumatura.
- Applicare 100 µ l di cellule batteriche preparato nei passaggi 1.2.3 e 1.2.6 alla parte superiore di ciascuna diluizione gradiente nel seguente modo.
- Prendere 100 µ l di cellule usando una pipetta a 200 µ l e inserire la punta della pipetta sul lato del tubo appena sotto il menisco della mini-sfumatura.
- Aspirare le cellule batteriche sulla sfumatura estremamente lentamente in modo che formano uno strato sulla parte superiore della sfumatura, senza alcuna miscelazione dell'interfaccia.
- Ripetere i passaggi 2.2.1.1–2.2.1.2 per tutti i ceppi da testare.
- Utilizza un rotore ad angolo fisso con un coperchio stretto di aerosol, centrifugare le provette preparate in una microcentrifuga per 10 min a 8.000 x g.
- Dopo la centrifugazione, trasferire i tubi a un rack per visualizzare la minima diluizione gradiente necessaria per mantenere le cellule appena sopra il livello di sfumatura dopo centrifugazione.
- Se i risultati non sono chiari, ripetere il test Mini-gradiente con incrementi di diluizioni medie gradienti di densità 5% sopra e sotto le concentrazioni definite nel passaggio 2.1.1 (ad es. diluizioni di 25% e 35%, dovrebbero essere testati se il risultato al 30% è ambiguo).
Nota: Vedere la Figura 2A per i risultati tipici ad una diluizione di medio gradiente di densità singola. - Utilizzare i risultati dal 2.2.3–2.2.4 alla seguente procedura per determinare le diluizioni gradiente ideale da utilizzare per separare le cellule in gradienti discontinui su larga scala.
- Applicare 100 µ l di cellule batteriche preparato nei passaggi 1.2.3 e 1.2.6 alla parte superiore di ciascuna diluizione gradiente nel seguente modo.
3. preparazione delle cellule per l'esperimento principale
-
Preparare colture fresche durante la notte inoculando 10 mL di brodo appropriato, come descritto al punto 1.2.
- Incubare le colture durante la notte in condizioni appropriate come descritto al punto 1.2.1.
- Pellet, la cultura durante la notte come descritto al punto 1.2.2.
- Lavare le cellule come descritto al punto 1.2.3.
- Eliminare il supernatante e risospendere il pellet in 1 mL di PBS 1X. Se il ceppo è mucoide e non facilmente a pellet, risospendere il pellet in fino a 2 mL di PBS o media residua. Le cellule sono ora pronte per l'uso.
4. preparazione dei gradienti di densità discontinua
Nota: Un metodo alternativo di preparazione gradiente dal basso (più concentrata) al top (meno concentrata) usando una pipetta è descritto nel passaggio 7.
-
Pipettare 1 mL della diluizione più diluita densità gradiente in un polipropilene da 5 mL tubo rotondo fondo per formare lo strato superiore, più diluito, della sfumatura.
Nota: strati successivi di più concentrati diluizioni gradiente verranno aggiunto sotto questo strato utilizzando un ago, per non disturbare gli strati. Un minimo di due e massimo gradiente tre strati di 1 mL ciascuno sono raccomandati per separazione robusta e facile visualizzazione dei batteri.- Usando una siringa monouso da 1 mL con un ago da 1,5 pollici, prelevare 1 mL della prossima più concentrato densità gradiente medio diluizione nella siringa. Evitare l'assunzione di qualsiasi aria, come bolle possono interferire con i livelli di pendenza.
- Posizionare l'estremità dell'ago nella parte inferiore del tubo contenente il primo strato. Aspirare il contenuto della siringa molto lentamente per evitare il mescolamento dell'interfaccia.
Nota: L'interfaccia delle due diluizioni aumenterà come la diluizione più concentrata di gradiente è aggiunto. Osservare l'interfaccia tenendolo fino a luce o una finestra esterna. Se non si è osservata alcuna interfaccia distinto, ignorare il gradiente e iniziare nuovamente.- Rimuovere l'ago dal gradiente molto delicatamente per non disturbare l'interfaccia tra le diverse diluizioni di gradiente. Porre la provetta in un rack adatto per tenerlo in posizione verticale.
- Se utilizza tre differenti diluizioni, ripetere passaggi 4.1.1–4.1.2.1 in modo che la diluizione più densa è nella parte inferiore. Se il gradiente è stato costruito con successo, ci saranno tre strati distinti con nessuna miscelazione alle interfacce.
5. aggiunta di preparati di cellule a gradienti e separazione per centrifugazione
- Aggiungere 600 µ l di cellule preparate dal punto 3.3 all'inizio della sfumatura nel tubo molto lentamente e senza mescolare l'interfaccia, come descritto al punto 2.2.
-
Posizionare i tubi adattatori di tubo e pesare il combinato adattatori e tubi per garantire che sono equilibrati.
- Inserire gli adattatori del tubo in un rotore ad angolo fisso all'interno di una centrifuga di banco. Centrifuga a 3.000 x gper 30 minuti.
- Dopo la centrifugazione, con attenzione rimuovere i tubi, metterli in un rack adatto e fotografare i risultati come un record.
-
Recuperare le frazioni batteriche per quantificazione Acidi uronici o estrazione del DNA dal passaggio 6.
- Se applicazioni a valle non sono necessari, smaltire i campioni/gradienti tramite il percorso dei rifiuti biologico liquido adeguato in laboratorio.
Nota: È importante convalidare la separazione per nuove specie/ceppi di batteri. Singole frazioni dal gradiente dovrebbero essere esaminate secondo microscopia, dosaggio acido uronico (passaggio 8), o un altro dosaggio quantitativo adatto per confermare il fenotipo capsula di ogni frazione. Se l'obiettivo è quello di separare basata su aggregazione o dimensioni della cella, indipendente analisi appropriate devono essere utilizzate.
- Se applicazioni a valle non sono necessari, smaltire i campioni/gradienti tramite il percorso dei rifiuti biologico liquido adeguato in laboratorio.
6. recupero frazioni di campione e passaggio opzionale escrescenza
-
Recuperare le frazioni da un gradiente rimuovendo e annullando qualsiasi liquido dalla diluizione superiore se nessuna frazione batterica è presente all'interno del livello.
- Per rimuovere la frazione superiore, utilizzare una pipetta P200 e delicatamente passare la punta della pipetta attraverso la sfumatura alla frazione e prendere la frazione. Posizionare la frazione in una provetta da 1,5 mL ed etichettare correttamente.
- Per recuperare ulteriori frazioni, ancora con la pipetta P200, inserire la punta delicatamente attraverso la sfumatura alla frazione e recuperare la frazione ad un tubo fresco 1,5 mL. Rimuovere la sfumatura in eccesso come le frazioni più in basso il gradiente sono accessibili.
- Se estrazione del DNA da una frazione contenente numeri molto bassi delle cellule è richiesto (ad esempio, per densità-TraDISort), sottocultura la frazione seguendo il protocollo dal punto 6.2 per escrescenza opzionale ottenere più cellule.
Nota: Ci sarà un basso livello di riporto dalle cellule nella parte superiore della sfumatura in frazioni inferiori, come le frazioni vengono rimossi dall'alto verso il basso. Ridurre al minimo questo lavorando con attenzione per non mescolare il gradiente, utilizzando un ago per rimuovere le frazioni inferiori ed eseguendo ri-purificazione di campioni molto bassa abbondanza dove riporto può influenzare i risultati.
-
Cellule di trasferimento dalla frazione bassa-abbondanza recuperati in passaggi 6.1.1–6.1.2 in 5 mL di supporto liquido appropriato. Posto in un'incubatrice e crescere per 2 ore a 37 ° C.
- Dopo 2 h di crescita o quando il campione ha raggiunto un OD600 di 1, è possibile trasferire la cultura in una provetta da 15 mL. Centrifugare la provetta per 10 min a 3.200 x g in una centrifuga con swing fuori secchi e coperchi a tenuta aerosol. Scartare il surnatante
- Risospendere il pellet cellulare in 1 mL di 1X PBS.
-
Preparare una pendenza di densità di singolo-concentrazione fresco in un tubo in polipropilene da 5 mL. Utilizzare il gradiente concentrazione da appena sopra la posizione della frazione della sfumatura originale (ad es., per la purificazione del mutanteslyA Δ illustrato nella Figura 2D, 15% densità gradiente medio sarebbe stato utilizzato).
Nota: questo passaggio di purificazione ri è facoltativo.- Applicare le celle nella parte superiore della sfumatura e centrifuga come descritto ai punti 2.2 e 5.1.
- Rimuovere le provette dalla centrifuga e inserire in un rack appropriato. Fotografare il gradiente e recuperare la frazione per estrazione del DNA come descritto in 6.1 – 6.1.2.
Nota: Il campione è ora pronto per l'estrazione del DNA o altre applicazioni a valle.
7. metodo alternativo per preparazione gradiente dal basso (più concentrata) al Top (meno concentrata) usando una pipetta
-
Utilizzare le diluizioni gradiente determinate al punto 2.2.3. Utilizzando una pipetta di 1.000 µ l, aggiungere 1 mL della diluizione gradiente più densa in una provetta da 5 mL.
- Utilizzando una pipetta 200 µ l, aggiungere 200 µ l della diluizione gradiente densa successiva molto lentamente nella parte superiore dello strato del tubo, per non mescolare l'interfaccia. Aggiungere un altro 200 µ l e quindi il finale 600 µ l. aggiunta di più volumi più piccoli dà più controllo sulla velocità di pipettaggio e impedisce la miscelazione dell'interfaccia. Se l'interfaccia si mescola, scartare e ricominciare.
- Ripetere il passaggio 7.1.1 con la terza, meno densa concentrazione gradiente se vengono utilizzati tre diluizioni. Il tubo dovrebbe ora avere sfumature di 2 mL o 3 mL a seconda dei risultati dal punto 2.2.3.
- Passare al punto 5 del protocollo per aggiungere celle e continuare l'esperimento.
8. misurazione della capsula quantità di dosaggio acido uronico
- Regolare il OD600 ogni frazione recuperata a 4.0 mediante diluizione con PBS. Procedere con quantificazione degli acidi uronici come precedentemente pubblicati1.
Risultati
Risultati rappresentativi sono mostrati nella Figura 2. Il risultato esatto aspettarsi dipenderà la specie batterica, il set-up dei gradienti di densità, e se l'utente sta esaminando un singolo ceppo o un pool di mutanti. Maggior parte dei ceppi eseguirà la migrazione in un'unica posizione all'interno di una sfumatura, come mostrato in Figura 2A e 2D. Applicazione del metodo in una libreria di mutanti batterica darà luogo a una band importante sopra la sfumatura, una fascia meno densa distribuita attraverso lo strato superiore della sfumatura e una frazione minore acapsular nella parte inferiore (Figura 2B). Queste frazioni differiscono nella capsula quantità come dimostrato da un'analisi di Acidi uronici (Figura 2B). Trasposone inserimento sequenziamento di singole frazioni si traduce in chiaro localizzazione di specifici mutanti all'interno delle frazioni di gradienti diverse, come mostrato per il locus di biosintesi capsula di ATCC43816 K. pneumoniae (Figura 2C). Risultati rappresentativi per colture pure di K. pneumoniae NTUH-K2044 e S. pneumoniaee diverse capsule biosintesi o regolamentazione mutanti, sono mostrati in Figura 2,D.
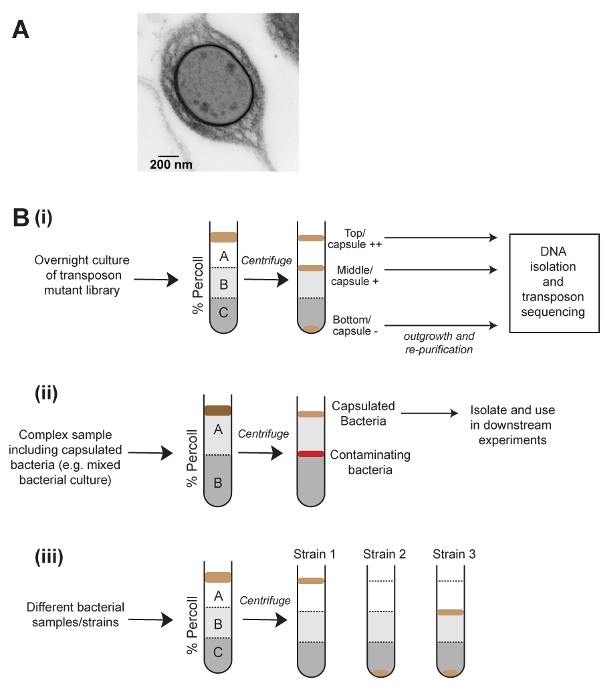
Figura 1 : Schematico del metodo di centrifugazione di densità per separare i batteri sulla capsula e le sue applicazioni basati. Cella (A) un'immagine di microscopia elettronica di un capsulated Klebsiella pneumoniae . La capsula è visibile come un denso strato sulla parte esterna della cellula. (B) per applicazioni di centrifugazione di densità allo studio dei batteri capsulated. (Bi) Separazione di densità possa essere utilizzati per generare alta - bassa- e no-capsula frazioni di una libreria di mutante trasposone e seguite dal sequenziamento di inserimento trasposone per definire geni che influenzano la produzione di capsule. (Bii) Purificazione dei batteri capsulated da un campione complesso. (Biii) Uso di separazione basato su densità per comparazioni rapide di capsula quantità tra i campioni. Questo metodo permette anche la visualizzazione di eterogenea produzione capsule in popolazioni batteriche, come mostrato in (Biii). Clicca qui per visualizzare una versione più grande di questa figura.
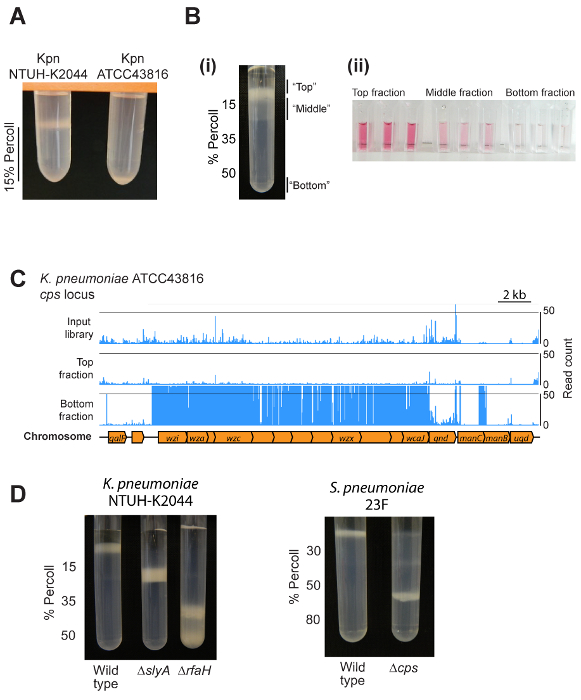
Figura 2 : Risultati rappresentativi. (A) esempio di output da mini-sfumatura test. Due differenti ceppi di K. pneumoniae sono stati centrifugati su 1 mL di 15% densità gradiente medio. Hypermucoviscous NTUH-K2044 ceppo è mantenuto sopra lo strato medio gradiente di densità, mentre ATCC43816 (il che rende meno capsula) migra verso il fondo dello strato. (Bi) Uso di un gradiente di densità per separare una libreria mutante trasposone in tre frazioni. Si noti che la frazione di fondo contiene una bassa percentuale di mutanti e non è visibile in questa immagine. (Bii) Convalida degli importi differenti capsula in alto, medio e le frazioni di fondo usando un'analisi di Acidi uronici. Cellule dal basso verso l'alto, medio e sovrasviluppata frazioni sono state isolate e risospesi in PBS per un OD600 di 4, quindi capsula polisaccaridi estratti e Acidi uronici misurato1. (C) risultati di densità-TraDISort di esempio. Posizioni di mutazione identificate sono rappresentati da linee blu sopra il diagramma del cromosoma. Mutanti privi di capsula possono essere identificati come quelli che sono presenti nella libreria di ingresso ma sono vuotati nella frazione superiore mentre arricchendosi nella frazione di fondo, come illustrato di seguito per il locus di biosintesi capsula8. (D) un esempio di utilizzo di centrifugazione in gradiente di densità per confrontare capsula quantità tra wild type e mutanti di K. pneumoniae NTUH-K2044 e S. pneumoniae 23F. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
La capsula è un fattore di virulenza importante in molte specie batteriche, tra cui3di K. pneumoniae, Streptococcus pneumoniae9, Acinetobacter10e Neisseria11 specie. Anche se esistono vari metodi per la quantificazione e la visualizzazione delle capsule batteriche, attualmente non c'è nessun metodo ampiamente usato per separare fisicamente le cellule capsulate e non capsulato. In questo articolo, abbiamo dimostrato un metodo affidabile per la separazione basata su capsula delle popolazioni batteriche, con più applicazioni potenziali in combinazione con diversi protocolli a Monte o a valle.
La presenza di una capsula di superficie può ridurre la densità delle cellule batteriche, che consente la separazione mediante centrifugazione in gradiente di densità (Figura 2D). Abbiamo convalidato questo metodo in K. pneumoniae NTUH-K204412 e ATCC4381613 , così come in Streptococcus pneumoniae 23F14 e sua Δcps mutante15. Questo metodo utilizza Percoll16 come potrebbe essere il costituente principale del gradiente di densità, che è una sospensione di particelle di silice colloidale rivestito che ha bassa viscosità e nessuna tossicità nei confronti di batteri - in linea di principio, altre sostanze che soddisfano questi criteri utilizzato per stabilire il gradiente di densità.
Può essere difficile per garantire livelli di diversa densità non mescolano durante la costruzione di gradienti di densità, che in caso di miscelazione, il metodo di separazione non darà risultati puliti. Abbiamo incluso due metodi alternativi per versare i gradienti, usando un ago o una pipetta — entrambi sono efficaci, e il metodo da utilizzare è semplicemente una questione di preferenza. Per tutti i passaggi che implicano una sostanza (una sospensione batterica, o un livello di sfumatura più diluito) sopra un livello di sfumatura di pipettaggio, il pipettaggio diverse aliquote di volumi più piccoli può rendere più facile per ottenere un'interfaccia nitida senza alcuna miscelazione degli strati.
Una limitazione di questo protocollo è che non possono essere garantite le prestazioni con altre specie batteriche. Di conseguenza, è fondamentale quando si esamina una nuova specie batterica o deformazione per convalidare la separazione basata su densità utilizzando un metodo di quantificazione capsula supplementare, indipendente. I batteri presenti in ogni frazione di visualizzazione tramite microscopia con macchie capsule appropriate è un metodo affidabile per cui protocolli dettagliati sono disponibili17. In alternativa, capsule contenenti Acidi uronici (come quelli di Escherichia coli e Klebsiella pneumoniae) possono essere quantificate da un'analisi specifica, come illustrato nella Figura 2B1. Il test di base di centrifugazione mucoviscosity non è adatto come metodo di convalida indipendente, come questo test dipende anche la densità delle cellule batteriche.
Un'altra limitazione di questo metodo è che la produzione di capsule è molto sensibile alle condizioni di coltura e anche piccoli cambiamenti al medium della crescita, temperatura, o aerazione può influenzare i risultati di questo test. Per ridurre al minimo questo problema, i ricercatori possono utilizzare un mezzo di sviluppo definito o un mezzo complesso batch-coerente, mantenere tutti gli altri parametri di crescita identici tra esperimenti e includere ceppi di controllo appropriato per consentire l'interpretazione di risultati imprevisti . Alcune capsule batteriche sono fragili e possono tagliare dalla cella quando sono pipettate culture. Per evitare la tosatura delle capsule, culture devono essere centrifugate e risospesi non più di due volte durante la preparazione per il caricamento sul gradiente. Se la perdita della capsula durante la concentrazione delle culture rimane problematica, colture batteriche possono essere applicate a un gradiente di densità direttamente, con un maggiore volume di sospensione batterica aggiunto se necessario per la visualizzazione.
Applicazioni future di questo metodo sono di applicarlo ad altre specie batteriche e utilizzare questa separazione in combinazione con diverse tecnologie di upstream e downstream. Oltre densità-TraDISort8, suggeriamo che la separazione gradienti di densità di batteri capsulated poteva essere utilizzati per l'isolamento di mutanti con capsula alterata, per la purificazione delle cellule capsulated da colture miste o campioni complessi e per Profilatura rapida della produzione capsule in più ceppi. Infine, questa tecnologia potrebbe essere utilizzata per esaminare altri fenotipi batterici quali l'aggregazione.
Divulgazioni
Gli autori non hanno nessun interessi finanziari di divulgare.
Riconoscimenti
Ringraziamo Wang Jin-Town e Susannah Salter per la fornitura di ceppi e i membri del gruppo di Parkhill per utili discussioni. Questo lavoro è stato finanziato dall'Istituto di Sanger di Wellcome (Wellcome grant 206194) e di una borsa di studio post-dottorato di Sir Henry Wellcome a F.L.S. (grant 106063/A/14/Z). MJD è supportato da un Wellcome Sanger Institute PhD Studentship.
Materiali
| Name | Company | Catalog Number | Comments |
| Percoll | GE Healthcare | 17-0891-01 | |
| Centrifuge 5810R with Rotor A-4-81 and 500 mL buckets | Eppendorf | 5810 718.007 | |
| Adapters for 15 mL tubes | Eppendorf | 5810 722.004 | |
| Fixed andgle rotor F-34-6-38 | Eppendorf | 5804 727.002 | |
| 2.6 to 7 mL tube adapter | Eppendorf | 5804 739.000 | |
| Centrifuge 5424 including Rotor FA-45-24-11 | Eppendorf | 5424 000.460 | |
| 2 mL tubes | Eppendorf | 0030 120.094 | |
| 1.5 mL tubes | Eppendorf | 0030 120.086 | |
| 5 mL polypropylene round bottom tube | Falcon | 352063 | |
| 1 mL disposable syringe Luer slip | Becton Dickinson | 300013 | |
| AGANI Needle 21G Green x 1.5" | Terumo | AN 2138R1 | |
| P1000 pipette and tips | |||
| P200 pipette and tips |
Riferimenti
- Favre-Bonté, S., Licht, T. R., Forestier, C., Krogfelt, K. A. Klebsiella pneumoniae capsule expression is necessary for colonization of large intestines of streptomycin-treated mice. Infection and Immunity. 67 (11), 6152-6156 (1999).
- Bachman, M. A., et al. Genome-wide identification of Klebsiella pneumoniae fitness genes during lung infection. mBio. 6 (3), 1-9 (2015).
- Paczosa, M. K., Mecsas, J. Klebsiella pneumoniae: Going on the offense with a strong defense. Microbiology and Molecular Biology Reviews : MMBR. 80 (3), 629-661 (2016).
- Shon, A. S., Bajwa, R. P. S., Russo, T. A. Hypervirulent (hypermucoviscous) Klebsiella pneumoniae. Virulence. 4 (2), 107-118 (2014).
- Fang, C. -. T., Chuang, Y. -. P., Shun, C. -. T., Chang, S. -. C., Wang, J. -. T. A novel virulence gene in Klebsiella pneumoniae. strains causing primary liver abscess and septic metastatic complications. The Journal of Experimental Medicine. 199 (5), 697-705 (2004).
- Lai, Y. -. C., Peng, H. -. L., Chang, H. -. Y. RmpA2, an activator of capsule biosynthesis in Klebsiella pneumoniae CG43, regulates K2 cps gene expression at the transcriptional level. Journal of Bacteriology. 185 (3), 788-800 (2003).
- Menck, K., et al. Isolation of human monocytes by double gradient centrifugation and their differentiation to macrophages in Teflon-coated cell culture bags. Journal of Visualized Experiments. (91), 1-10 (2014).
- Dorman, M. J., Feltwell, T., Goulding, D. A., Parkhill, J., Short, F. L. . The capsule regulatory network of Klebsiella pneumoniae defined by density-TraDISort. , (2018).
- Geno, K. A., et al. Pneumococcal capsules and their types: Past, present, and future. Clinical Microbiology Reviews. 28 (3), 871-899 (2015).
- Weber, B. S., Harding, C. M., Feldman, M. F. Pathogenic Acinetobacter: From the cell surface to infinity and beyond. Journal of Bacteriology. 1986 (6), 880-887 (2016).
- Mubaiwa, T. D., Semchenko, E. A., Hartley-Tassell, L. E., Day, C. J., Jennings, M. P., Seib, K. L. The sweet side of the pathogenic Neisseria.: The role of glycan interactions in colonisation and disease. Pathogens and Disease. 75 (5), 1-9 (2017).
- Wu, K. -. M. M., et al. Genome sequencing and comparative analysis of Klebsiellapneumoniae. NTUH-K2044, a strain causing liver abscess and meningitis. Journal of Bacteriology. 191 (14), 4492-4501 (2009).
- Broberg, C. A., Wu, W., Cavalcoli, J. D., Miller, V. L., Bachman, M. A. Complete genome sequence of Klebsiellapneumoniae. Strain ATCC 43816 KPPR1, a rifampin-resistant mutant commonly used in animal, genetic, and molecular biology studies. Genome Announcements. 2 (5), (2014).
- Croucher, N. J., et al. Role of conjugative elements in the evolution of the multidrug-resistant pandemic clone Streptococcuspneumoniae Spain23F ST81. Journal of Bacteriology. 191 (5), 1480-1489 (2009).
- Croucher, N. J., et al. Selective and genetic constraints on Pneumococcal serotype switching. PLoS Genetics. 11 (3), 1-21 (2015).
- Pertoft, H., et al. Density gradients prepared from colloidal silica particles coated by polyvinylpyrrolidone (Percoll). Analytical Biochemistry. 88, 271-282 (1978).
- Breakwell, D. P., Moyes, R. B., Reynolds, J. Differential staining of bacteria: Capsule stain. Current Protocols in Microbiology. 15 (1), 1-4 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon