需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
密度梯度离心法测定微分品质的精子
摘要
本文介绍了密度梯度离心技术的性能及其在精子生理研究中的应用。
摘要
在性繁殖中, 男性配子或精子细胞与雌性配子融合, 导致受精。然而, 大量具有受精能力的精子细胞需要与雌性配子相互作用, 以确保受精。因此, 单个精子细胞的受精能力对于成功的繁殖至关重要。密度梯度离心已被用作一种可重复、快速、高效、有效和适应性极强的方法, 只收集高质量精子用于辅助生殖技术。我们在这里描述的协议集中在利用不连续的渗透密度梯度离心 (pdgc) 技术, 以分离三个不同的种群的公鸡精子的质量。我们能够收集低、中、高质量的精子。我们还描述了可重复的协议, 这些协议需要通过评估精子的生存能力、流动性和渗透性来确定精子的生育潜力。利用 pdgc 技术收集精子的质量将有助于准确和彻底地表征具有差异生育潜力的精子。
引言
在脊椎动物中, 雄性配子承受巨大的选择性压力;因此, 男性的生殖健康是成功受精的关键。任何特定脊椎动物的雄性都必须能够大量和具有足够的质量来产生精子细胞, 以满足受精的需要。精子细胞, 同时有精子头和鞭毛, 是体内最极化的细胞。它们在精子质量上也非常异质 (活的和死的, 形态上正常和不正常的, 不动, 低移动和高流动性), 这表现在男性生殖效率的巨大差异。高质量精子的比例越大, 成功受精所需的交配次数就越少。然而, 为了实现生育能力, 形态正常的精子细胞依靠鞭毛产生的推进力到达受精部位, 并穿透透明带 1 (zp; 哺乳动物的情况下) 或内玻璃体周围在自然交配或人工授精 (ai) 之后, 卵子的第2层 (ipvl; 在鸟类和爬行动物的情况下)。确定精子质量是必要的, 用于辅助生殖技术3 (art) 和选择繁殖的雄性用于 ai 方案4。另一方面, 抗逆转录病毒疗法的成功完全取决于对精子质量的准确评估。已经开发了一些实验室测试来确定精子的功能特征。最重要的参数是精子形态、活力、流动性、容量 (鸟类精子不需要电容5)、顶体反应 (ar; 分泌物和从精子头部的顶部释放蛋白水解酶)、精子zp 或 ipvl 的渗透, 以及施肥6、7、8、9、10、11。仅衡量生育能力的指标并不能准确评估精子群体的受精能力11。导致卵子受精的几个事件的措施允许各自精母细胞的性能的适当的表示法7。
为测量精子功能而开发的方法主要是特定物种。例如, 在鸟类精子中, ipvl 的生存能力、流动性和渗透率是用于评估精子质量8、11、12 的最常见参数。射精中活精子的数量对精子的生存起着至关重要的作用, 因为精液中大量死亡精子的存在会影响精子的质量。这增强了精液中活性氧的产生, 并对活精子造成氧化损伤13。精子的流动性, 鸟类精子在体温下抵抗抵抗的鞭毛运动能力, 已知在导致受精方面起着直接的作用.众所周知, 流动与生育率呈正相关, 因此是生育率的主要决定因素8。然而, 移动精子还必须有能力接受 ar 和穿透 ipvl11。ipvl 渗透检测考虑到参与受精过程中的每一个精子 11.
在 art 的应用中, 射精通常是为了最大限度地提高高品质精子的浓度, 最大限度地减少低质量精子的浓度而进行的。采集精液后, 通过工业和研究实践中常用的精子分离程序, 可以丰富高质量精子的比例。许多这些程序已经开发, 都有各自的好处和限制, 但所有利用不同的性质, 精子收集只有具有高受精能力的精子。这些程序包括精子迁移方法、粘附柱过滤和密度梯度离心 (dgc) 14、15、16、17、18、 19,20. 在现有技术中, dgc 被认为是非常简单、可重复、具有成本效益和效率的, 可以分离出用于 art 的最大数量的高质量精子, 目的是最大限度地增加受精的机会14,15. 此外, dgc 对精子细胞膜无害。相反, 精子迁移方法只收集逐渐移动的精子18,19, 但收集精子的数量很低, 使其效率低下, 收集大量的精子 18,20. 粘附柱过滤在从精液中过滤高度流动的精子方面非常有效, 17然而, 它倾向于对精子膜20,21有害。
在 dgc 技术中, 产生密度梯度最常用的基板是 percoll, 它由涂覆在聚乙醛中的胶体二氧化硅颗粒组成。percoll 密度梯度离心 (pdgc) 可以是连续的, 也可以是不连续的, 但不连续梯度最常用于高流动性精子13、16、20的高产隔离。在不连续的渐变中, 较低密度的介质漂浮在高密度介质之上, 从而产生一个从锥形管的顶部到底部密度增加的梯度。这将在密度不同的两个介质之间的接口上创建边界。pdgc 的效率来自两个因素: 1) 单个精子细胞的推进能力; 2) 结构完整性高的精子细胞密度增加的趋势。流动性较高的精子能够更好地从低密度介质中交叉, 渗透到高密度介质中。较低的流动性精子更有可能被困在不同密度介质之间的界面所产生的边界上。具有较高结构完整性和流动性的精子细胞往往比死亡、异常或低移动精子细胞具有更高的密度。当离心力应用于 pdgc 时, 这有利于不同密度的精子在梯度中各自的位置移动。
在一般情况下, pdgc 后, 在锥形管底部收集具有高生育潜力的精子的软颗粒, 并丢弃其余的。然而, 这种技术的一个未充分利用的优势是它能够根据质量差异将精子细胞分成几个小组。为了研究目的, 利用 pdgc 技术按质量分离精子可以研究精子质量, 因为它涉及生理、代谢组学和蛋白质组学的差异。在这里, 我们的目标是详细介绍如何使用这种技术来分离精子的质量, 以及证明这些差异的质量, 使用以前建立的 eosin-nigrosin 重要染色的可行性, accudenz 检测的流动性, 和精子 ipvl渗透性的相互作用测定。
Access restricted. Please log in or start a trial to view this content.
研究方案
这里描述的所有方法都得到了佐治亚大学动物护理和使用机构委员会 (iacuc) 的批准。
1. 使用传统离心机清洗
- 准备磷酸盐缓冲液 (pbs)。加入8.0 克氯化钠、0.2 克的 kcl、1.44 克的 na 2 hpo 4 和 0.24 g的kh2po 4 至800毫升的蒸馏水 (dh2o).使用 0.1 n hcl 将 ph 值调整到 7.4, 并使用dh2o 将溶液调整到 1 l。
- 准备动力缓冲器。添加6.5 克氯化钠, 4.5 克葡萄糖, 0.444 g 的 cacl 2 和 11.5 g n-三-[羟基甲基] 甲基-2-氨基-乙氨酸磺酸 (tes) 到800毫升的 dh 2 o. 使用 1 m naoh将 ph 值调整到 7.4, 并使用 dh2 o 将溶液带到 1 l。
- 将0.5 毫升精液插入聚丙烯微离心管。加入1.0 毫升的 pbs, 轻轻搅拌。
- 在室温 (rt) 下以 1, 500 x 克离心 10分钟, 并丢弃上清液。用 pbs 重新选择精子颗粒, 最高可达 1.5 ml。
- 在 1, 500 x 克的离心条件下进行10分钟的离心, 将精子颗粒与运动缓冲液恢复到 0.5 ml。
2. 执行 pdgc 技术
注: 在室温下执行 pdgc 的整个过程。
- 在两个独立的管中制造 1.08 gml 和 1.08 gml percoll 溶液 3.0 ml。
- 在干净的试管中, 将 1.13 gml 原 percoll 的 1.712 ml 添加到 1.5 m ncl 溶液的 0.3 ml。加入 0.988 ml 的 dh2o, 并通过温和的倒置混合, 使 1.08 g/ml 密度溶液的 3.0 ml.
- 在干净的试管中, 将 1.13 gml 原 percoll 的 1.482 ml 添加到 1.5 m ncl 溶液的 0.3 ml。加入 1.218 ml 的 dh2o, 并通过温和的倒置混合, 使 1.218 gml 密度溶液的 3.0 ml.
- 在一个干净的试管中, 用 2.0 ml 的 pbs 稀释精液样品1:2。通过移液轻轻混合。
- 将 1.07 g/ml 密度溶液的管道 3.0 ml 放入无菌 15 ml 锥形管。在 1.08 g/ml 密度溶液下, 小心地将 1.08 gml 密度溶液的管道 3.0 ml。确保这两个图层不混合。长形 (9 英寸) 巴斯德移液器可以使这一步更容易。
- 稀释精液样品的皮板3.0 毫升在 pdg 之上。为确保精液样品不与 pdg 混合, 请在45°角轻轻倾斜含有 pdg 的锥形管。沿着管子的壁对样品进行移液, 使其沿着管子和 pdg 流动。
- 准备一个空白管, 以配合 pdg 的质量与覆盖的样品。以 1500 x g 离心两管 20分钟. 在将管从工作台转移到天平, 然后再输送到离心机时, 要注意保持不连续的梯度。
注: 不要在离心结束时使用制动器。 - 观察结果。确保在试管中形成了三个不同的精液层, 如图 1所示。
- 用移液器分离精液层。首先收集精液的顶层, 第二层收集中间层, 最后收集管底部的硬颗粒。将每个转移到一个干净和无菌的聚丙烯微离心管.
- 使用 pbs 将每个样品稀释到 1.5 ml。以 1500 x g 离心10分钟。
- 把上清液倒掉。通过温和的移液, 将精子颗粒与运动缓冲剂重新组成。
注: 可根据调查员的需要使用替代密度。确定与以下公式一起使用的成分量, 其中 v0是所使用的库存密度溶液的体积, v 是所需的最终解的体积, p 是所需的最终密度解的密度, p0是库存密度的密度解决 方案: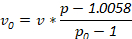
始终使用 0.3 ml 的 1.5 m 氯化钠制备密度溶液, 以匹配生理盐水的氯化钠浓度。
3. 精子质量的测定
- 计算精子浓度, 如前面描述的 22。
- 进行 eosin-nigrosin 重要染色, 如前面所述的12 , 并进行以下修改:
- 在浓度为 1 x 10 8 细胞的情况下制备100μl 的精子溶液.
- 在含有等量的香黑素染色的聚丙烯微离心管中的精子溶液中进行50μl 的移液。在室温下将混合物生也就是5分钟。
- 将20μl 滴的染色精子样本放在玻璃滑梯的一端, 并以类似于血液涂片的方式均匀涂抹。在室温下将涂抹的幻灯片风干3-5分钟。
- 在显微镜下观察涂片。计算活精子 (无污渍) 和死精子 (粉红色染色) 的数量, 并计算活精子的百分比。
- 执行 accudenz 检测, 如先前验证的鸡精子, 客观地评估精子的流动性8与以下修改:
- 将6% 的检测溶液的吡咯烷醇 1.0 ml 放入聚苯乙烯试剂盒中, 如图 2所示。产至41°c。
注: 41°c 用于匹配母鸡的内部温度。所研究物种的孵化温度应与雌性生殖道的孵育温度相匹配。 - 将预热的检测溶液覆盖在浓度为 5x10 8 细胞的100μl 精液样品中 。
- 将含有覆盖精子样本的立方放置在分光光度计中。将吸收率值记录在550纳米。
- 将6% 的检测溶液的吡咯烷醇 1.0 ml 放入聚苯乙烯试剂盒中, 如图 2所示。产至41°c。
- 按照前面描述的 11执行 ipvl 渗透分析, 并进行以下修改:
- 切割一块 (0.5 厘米 x 0.5 厘米) 的非萌发圆盘区域的完整 ipvl。
- 将精子浓度调整为 4 x10 6 细胞
- 在37°c 条件下, 用 ipvl 将精子在小玻璃瓶中的运动缓冲液中培养 15分钟, 如图 3所示。
- 将 ipvl 片浸入3% 的氯化钠中, 以停止 ipvl 与精子之间的相互作用。
- 将 ipvl 片安装在显微镜幻灯片上, 用 schiff 的试剂染色10分钟后固定, 固定时间为 10%, 甲酸率为10秒。
- 在显微镜下观察 ipvl 是否有成功的精子渗透孔, 并在40x 放大倍率下计算每 0.25 mm2的所有可见孔的数量。
Access restricted. Please log in or start a trial to view this content.
结果
pdgc 技术导致三层精子在所有参数中按质量程度进行了明显的分离。精子分为高密度溶液以下的高质量层、密度较高和较低密度溶液之间的中等质量层以及低密度溶液下方的低质量层。这些质量差异体现在可行性 (图 4)、移动性 (图 5) 和渗透性 (图 6) 方面的明显差异。与传统的洗涤样品相比, 从 pdg 的高质?...
Access restricted. Please log in or start a trial to view this content.
讨论
生育不仅决定了动物生产的盈利能力, 也成为自然选择物种生存的手段。精子细胞的最终功能是使卵子受精。女性的输卵管只选择那些适者生存的精子, 以确保卵子23,24的受精。体外研究还揭示了定性精子性状与受精成功 4、11、23、24 之间的密切相关关系.<...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
没有。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Accudenz | Accurate Chemical and Scientific Corporation, Westbury, NY, USA | AN7050 | |
| Percoll | Sigma-Aldrich, Corp., St. Louis, MO, USA | P7828 | |
| Schiff’s reagent | Sigma-Aldrich, Corp., St. Louis, MO, USA | 3952016 | |
| TES | Sigma-Aldrich, Corp., St. Louis, MO, USA | T1375 | |
| Eosin Y | Sigma-Aldrich, Corp., St. Louis, MO, USA | E4009 | |
| Nigrosin | Sigma-Aldrich, Corp., St. Louis, MO, USA | 198285 | |
| ST 40R Centrifuge | Thermo Scientific, Waltham, MA, USA | 75004524 | |
| DU 530 Life Sciences UV/Vis Spectrophotometer | Beckman Coulter, Brea, CA, USA | No catalogue is found | |
| Olympus IX 71 Inverted Fluorescence and Phase Contrast Microscope | Olympus America Inc., PA, USA | No catalogue is found |
参考文献
- Spargo, S. C., Hope, R. M. Evolution and nomenclature of the zona pellucida gene family. Biology Reproduction. 68, 358-362 (2003).
- Okamura, F., Nishiyama, H. The passage of spermatozoa through the vitelline membrane in the domestic fowl, Gallus gallus. Cell and Tissue Research. 188 (3), 497-508 (1978).
- Henkel, R., et al. Sperm function and assisted reproduction technology. Reproductive Medicine and Biology. 4, 7-30 (2005).
- Reddy, R. P. Artificial Insemination of broilers: Economic and management implications. Proceedings of 1st International Symposium on Artificial Insemination of Poultry. Poultry Science Association. Bakst, M. R., Wishart, G. J. , Savoy, Il. 73-89 (1995).
- Howarth, B. Jr An Examination for Sperm Capacitation in the Fowl. Biology of Reproduction. 3, 338-341 (1971).
- Menkveld, R., Holleboom, C. A. G., Rhemrev, J. P. T. Measurement and significance of sperm morphology. Asian Journal of Andrology. 13, 59-68 (2011).
- Kumaresan, A., Johannisson, A., Al-Essawe, E. M., Morrell, J. M. Sperm viability, reactive oxygen species, and DNA fragmentation index combined can discriminate between above- and below-average fertility bulls. Journal of Dairy Science. 100, 5824-5836 (2017).
- Froman, D. P., McLean, D. J. Objective measurement of sperm motility based upon sperm penetration of Accudenz. Poultry Science. 75, 776-784 (1996).
- Zaneveld, L. J., De Jonge, C. J., Anderson, R. A., Mack, S. R. Human sperm capacitation and the acrosome reaction. Human Reproduction. 6 (9), 1265-1274 (1991).
- Ahammad, M. U., et al. Acrosome reaction of fowl sperm: Evidence for shedding of acrosomal cap in intact form to release acrosomal enzyme. Poultry Science. 92 (3), 798-803 (2013).
- Ahammad, M. U., et al. Maturational changes in motility, acrosomal proteolytic activity, and penetrability of the inner perivitelline layer of fowl sperm, during their passage through the male genital tract. Theriogenology. 76 (6), 1100-1109 (2011).
- Chalah, T., Brillard, J. P. Comparison of assessment of fowl sperm viability by eosin-nigrosin and dual fluorescence. Theriogenology. 50 (3), 487-493 (1998).
- Aitken, R. J., West, K. M. Analysis of the relationship between reactive oxygen species production and leukocyte infiltration in fractions of human semen separated on Percoll gradients. International Journal of Andrology. 13, 433-451 (1990).
- Mortimer, D., Mortimer, S. T. Density Gradient Separation of Sperm for Artificial Insemination. Spermatogenesis. Methods in Molecular Biology (Methods and Protocols. Carrell, D., Aston, K. , Humana Press. Totowa, NJ, USA. 927(2013).
- Qingling, Y., et al. Processing of semen by density gradient centrifugation selects spermatozoa with longer telomeres for assisted reproduction techniques. Reproductive BioMedicine Online. 31, 44-50 (2015).
- Moohan, J. M., Lindsay, K. S. Spermatozoa selected by a discontinuous Percoll density gradient exhibit better motion characteristics, more hyperactivation, and longer survival than direct swim-up. Fertility and Sterility. 64 (1), 160-165 (1995).
- Paulson, J. D., Polakoski, K. L. A glass wool column procedure for removing extraneous material from human ejaculate. Fertility and Sterility. 28, 178-181 (1977).
- Ahammad, M. U., Chiaki, N., Tatemoto, H., Kawamoto, Y., Nakada, T. Utilization of the swim-up migration sedimentation technique to separate viable and progressively motile fowl spermatozoa. World's Poultry Science Association Proceedings. , Cambridge University Press. (2010).
- Lucena, E., et al. Recovery of motile sperm using the migration-sedimentation technique in an in vitro fertilization-embryo transfer programme. Human Reproduction. 4 (2), 163-165 (1989).
- Henkel, R. Sperm Processing for IVF. Clinical Embryology: A Practical Guide. , Springer Science and Business Media. New York, USA. (2013).
- Sherman, J., Paulson, D., Liu, K. Effect of glass wool filtration on ultrastructure of human spermatozoa. Fertility and Sterility. 36, 643-647 (1981).
- Freund, M., Carol, B. Factors affecting haemocytometer counts of sperm concentration in human semen. Journal of Reproduction and Fertility. 8, 149-155 (1964).
- Bakst, M. R., Wishart, G. J., Brillard, J. P. Oviducal sperm selection, transport and storage in poultry. Poultry Science Review. 5, 117-143 (1994).
- Ahammad, M. U., Okamoto, S., Kawamoto, Y., Nakada, T. The effects of regular fluid secretion from the uterus of laying hens on the longevity and fertilization ability of fowl sperm in the oviduct. Poultry Science Journal. 1 (1), 13-22 (2013).
- Ahammad, M. U., et al. Maturational changes in the survivability and fertility of fowl sperm during their passage through the male reproductive tract. Animal Reproduction Science. 128 (1-4), 129-136 (2011).
- Choi, K. H., Emery, D. A., Straub, D. E., Lee, C. S. Percoll process can improve semen quality and fertility in turkey breeders. Asian-Australasian Journal of Animal Sciences. 12 (5), 702-707 (1999).
- Chen, M. J., Bongso, A. Comparative evaluation of two density gradient preparations for sperm separation for medically assisted conception. Human Reproduction. 14 (3), 759-764 (1999).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。