Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Prélèvement du sperme de qualité différentielle en utilisant la Centrifugation en Gradient de densité
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Dans cet article, nous visons à décrire les performances de la technique de centrifugation en gradient de densité et de son application dans la recherche de la physiologie de sperme.
Résumé
Dans la reproduction sexuée, un gamète mâle ou spermatozoïde fusionne avec un gamète femelle pour parvenir à la fécondation. Toutefois, un grand nombre de spermatozoïdes avec capacité de fertilisation est requises pour interagir avec un gamète femelle pour assurer la fécondation. Par conséquent, la capacité fécondante des spermatozoïdes individuels est critique pour la reproduction réussie. Centrifugation en gradient de densité a été utilisée pendant plusieurs décennies comme une méthode reproductible, rapide, efficace et extrêmement adaptable pour recueillir seulement qualité sperme devant servir à la reproduction assistée. Les protocoles que nous décrit ci-après portent sur l’utilisation de la technique de centrifugation en gradient (PDGC) densité de Percoll discontinue pour isoler les trois populations distinctes de sperme du coq par leur qualité. Nous avons pu recueillir, faible, moyen et haute qualité sperme. Nous décrivons également les protocoles reproductibles qui entraînent déterminant potentiel de fertilité du sperme en évaluant leur viabilité, la mobilité et la pénétrabilité. Collection de spermatozoïdes par leur qualité à l’aide de la technique de PDGC serait utile à avec précision et caractériser complètement sperme avec différentielle fertilité potentielle.
Introduction
Chez les vertébrés, les gamètes mâles subissent une intense pression sélective ; reproduction remise en forme d’un mâle est donc essentiel pour la réalisation de fécondation réussie. Les hommes de toute espèce de vertébrés donnée doivent être en mesure de produire des spermatozoïdes en grande quantité et de qualité suffisante pour répondre aux besoins de fertilisation. Cellules du sperme, avoir une tête de sperme et d’un flagelle, sont des cellules plus polarisées dans le corps. Ils sont également très hétérogènes dans la qualité du sperme (vivant et mort, morphologiquement normal et anormal et immobile, low haut et mobile mobile), qui se révèle à travers la grande variation dans efficacité reproductive des mâles. Plus la proportion de spermatozoïdes de qualité, au moins le nombre d’accouplements pour avec succès de féconder l’ovule. Toutefois, pour atteindre la fertilité, des spermatozoïdes morphologiquement normaux comptent sur propulsion forces générées par leurs flagelles pour accéder au site de fertilisation ainsi quant à pénétrer la zone pellucide1 (ZP ; dans le cas des mammifères) ou intérieure périvitellin couche2 (IPVL ; dans le cas des oiseaux et reptiles) de l’ovule après l’accouplement naturel ou l’insémination artificielle (IA). Détermination de sperme qualité est nécessaire pour une utilisation dans les techniques de procréation assistée3 (ART) et des programmes de sélection des mâles reproducteurs pour être utilisé en intelligence artificielle4. En revanche, le succès de l’ART se fonde uniquement sur l’évaluation précise de la qualité du sperme. Un certain nombre de tests de laboratoire ont été développé afin de déterminer les caractéristiques fonctionnelles du sperme. Les paramètres les plus importants sont la morphologie des spermatozoïdes, de viabilité, de mobilité, de capacitation (sperme aviaire ne nécessite pas de capacitation des5), réaction de l’acrosome (AR ; l’exocytose et libération d’une enzyme protéolytique de l’acrosome, de la tête du spermatozoïde), Sodo, sperm pénétration de la ZP ou IPVL et fertilisation6,7,8,9,10,11. Mesures de fertilité seule ne fournissent pas une évaluation précise de la capacité fécondante d’un sperme population11. Les mesures des plusieurs événements menant à la fécondation d’un ovule permettre une représentation appropriée de la performance des spermatocytes individuel7.
La méthodologie développée pour mesurer la fonction spermatique est essentiellement propres à chaque espèce. Par exemple, dans le sperme aviaire, viabilité, la mobilité et la pénétration de IPVL sont les paramètres couramment utilisés pour évaluer la qualité de sperme pour8,11,12. Le nombre de spermatozoïdes vivants dans le sperme joue un rôle crucial pour la survie des spermatozoïdes, car la présence d’un grand nombre de spermatozoïdes morts dans le sperme affecte la qualité du sperme. Cela augmente la production d’espèces réactives de l’oxygène dans le sperme et provoque des dommages oxydatifs aux spermatozoïdes vivants13. Mobilité des spermatozoïdes, la capacité de mouvement flagellaire du sperme aviaire contre la résistance à la température corporelle, est connue pour jouer un rôle direct dans fertilisation8. Il est bien établi que la mobilité est en corrélation positive avec la fertilité et est donc déterminant de fertilité8. Toutefois, un spermatozoïde mobile doit avoir aussi la capacité de subir un AR et de pénétrer l' IPVL11. Essais de pénétration IPVL prennent en compte pour chaque spermatozoïde qui participe dans le processus de fécondation11.
Dans l’application de l’ART, l’éjaculat est généralement traitée afin de maximiser la concentration du sperme de qualité et de réduire la concentration de spermatozoïdes de mauvaise qualité. Après le prélèvement du sperme, la proportion de spermatozoïdes de qualité peut être enrichie par des procédures de séparation de sperme couramment utilisés dans les pratiques de l’industrie et la recherche. Beaucoup de ces procédures ont été développées, avec des avantages respectifs et les limites, mais tous utilisent la nature hétérogène du sperme pour recueillir uniquement le sperme avec haute capacité fécondante. Ces procédures incluent des méthodes de migration des spermatozoïdes, filtration de colonne de l’adhérence et densité centrifugation en gradient (DGC)14,15,16,17,18,19 , 20. parmi les techniques disponibles, DGC s’est avéré pour être très simple, reproductible, rentable et efficace pour isoler le montant maximal du sperme de haute qualité pour une utilisation dans l’ART dans le but de maximiser les chances de fécondation14 , 15. en outre, la DGC n’est pas préjudiciable à la membrane de la cellule de sperme. En revanche, recueillent des méthodes de migration de sperme sperme seulement progressivement mobile18,19, mais la quantité de sperme recueilli est très faible, rendant inefficace dans la collecte de grandes quantités de sperme18, 20. adhérence colonne filtration est très efficace pour le filtrage très mobiles spermatozoïdes du sperme17; Toutefois, elle tend à nuire aux spermatozoïdes membranes20,21.
Dans la technique de la Guilde canadienne des réalisateurs, le substrat le plus couramment utilisé pour générer le gradient de densité est Percoll, qui est composé de particules de silice colloïdale recouvert de polyvinylpryrolidone. Centrifugation en gradient de densité Percoll (PDGC) peut être continu ou discontinu, mais un gradient discontinu est plus couramment utilisé pour l’isolement de rendement élevé de spermatozoïdes mobiles13,16,20. Dans un gradient discontinu, média de densité inférieure plane au-dessus de média de densité supérieure, créant un gradient qui augmente la densité du haut vers le bas d’un tube conique. Cela crée des limites à l’interface entre les deux milieux de densité différente. L’efficacité de PDGC est dérivée de deux facteurs : 1) la capacité propulsive de spermatozoïdes individuels et 2) la tendance des spermatozoïdes avec haute intégrité structurale a une densité accrue. Sperme avec une plus grande mobilité est mieux capables de traverser des médias de densité plus faible et de pénétrer dans un média de densité plus élevé. Sperme de mobilité plus faible est plus susceptibles d’être coincé à la limite créée par l’interface entre les médias de densité différente. Spermatozoïdes à haute intégrité structurale et de la mobilité ont tendance à avoir une densité plus élevée que les spermatozoïdes mobiles morts, anormales ou faibles. Lorsque la force centrifuge est appliquée en PDGC, cela facilite le déplacement des spermatozoïdes avec des densités différentes à leur place respective dans le gradient.
En médecine générale, après PDGC, le pellet mou de sperme avec une fécondité élevée potentielle au fond du tube conique est recueillie, et le reste est ignoré. Cependant, un avantage sous-utilisées de cette technique est sa capacité à séparer les cellules spermatiques en plusieurs groupes fondés sur les différences de qualité. À des fins de recherche, séparation des spermatozoïdes par degré de qualité utilisant la technique PDGC permet d’étudier de la qualité du sperme en ce qui concerne les différences physiologiques, de métabolomique et protéomique. Ici, nous visons à détailler comment cette technique peut être utilisée pour séparer les spermatozoïdes de qualité, mais aussi de montrer ces différences de qualité, à l’aide de l’éosine-nigrosine préétablie coloration vitale pour la viabilité, Accudenz dosage pour la mobilité et sperme-IPVL analyse d’interaction pour la pénétration.
Protocole
Toutes les méthodes décrites ici ont été approuvés par l’animalier institutionnel et utilisation Comité (IACUC) de l’Université de Georgie.
1. laver à l’aide de Centrifugation traditionnel
- Préparer la solution de tampon phosphate (PBS). Ajouter 8,0 g de NaCl, 0,2 g de KCl, 1,44 g de Na2HPO4 et 0,24 g de KH2PO4 à 800 mL d’eau distillée (dH2O). Ajuster le pH à 7,4 avec 0,1 N HCl et porter la solution à 1 L avec dH2O.
- Préparer le tampon de la motilité. Ajouter 6,5 g de NaCl, 4,5 g de glucose, 0,444 g de CaCl2 et 11,5 g de N - tris-[hydroxyméthyl] acide méthyl-2-amino-ethanesulfonic (TES) à 800 mL de dH2O. ajuster le pH à 7.4 à l’aide de 1 NaOH M et porter la solution à 1 L avec dH2O.
- Pipetter 0,5 mL de sperme dans un tube en polypropylène microcentrifugeuse. Ajouter 1,0 mL de PBS et mélanger doucement.
- Centrifuger à 1 500 g pendant 10 min à température ambiante (RT) et éliminer le surnageant. Resuspendre le culot de sperme avec du PBS à 1,5 mL.
- Centrifuger à 1 500 x g pendant 10 min à RT. remettre en suspension le sperme à pellets avec motilité jusqu'à 0,5 mL de tampon.
2. effectuer la technique PDGC
Remarque : Effectuez toutes les étapes du PDGC à la température ambiante.
- Faites 3,0 mL de solutions Percoll 1,08 g/mL et 1,07 g/mL à deux tubes séparés.
- Dans un tube à essai propre, ajoutez 1,712 mL du 1,13 g/mL original Percoll à 0,3 mL de solution de NaCl à 1,5 M. Ajouter 0,988 mL de dH2O et mélanger par retournement doux à porter 3,0 mL d’un 1,08 g/mL solution de densité.
- Dans un tube à essai propre, ajoutez 1,482 mL du 1,13 g/mL original Percoll à 0,3 mL de solution de NaCl à 1,5 M. Ajouter 1,218 mL de dH2O et mélanger par retournement doux à porter 3,0 mL d’un 1,07 g/mL solution de densité.
- Dans un tube à essai propre, diluer 1,0 mL de l’échantillon de sperme 1:2 avec 2,0 mL de PBS. Mélanger doucement de pipetage.
- Pipeter 3,0 mL de la solution de densité 1,07 g/mL dans un tube conique stérile de 15 mL. Soigneusement Pipeter 3,0 mL de la solution de densité de 1,08 g/mL sous la solution de densité 1,07 g/mL. Veiller à ce que les deux couches ne se mélangent pas. Une longue durée (9 pouces) pipette Pasteur peut simplifier cette étape.
- Pipeter 3,0 mL de l’échantillon de sperme dilué par dessus le PDG. Pour s’assurer que l’échantillon de sperme ne se mélange pas avec le PDG, basculer doucement le tube conique contenant le PDG à un angle de 45°. Pipette de l’échantillon le long de la paroi du tube et laisser s’écouler dans le tube et le PDG.
- Préparer un tube vide pour correspondre à la masse de la PDG avec échantillon superposée. Centrifuger les deux tubes à 1500 x g pour 20 min. attention à maintenir le gradient discontinu tout en transférant les tubes à l’audience à l’équilibre, puis à la centrifugeuse.
Remarque : N’utilisez pas le frein à la fin de la centrifugation. - Observez les résultats. Veiller à ce que les trois couches distinctes de sperme ont formé dans le tube, comme on le voit à la Figure 1.
- Aspirer les couches isolées de sperme avec une pipette. Recueillir la couche supérieure de sperme tout d’abord, le milieu couche deuxième et dernière le culot dur au fond du tube. Transférer chacun d’un polypropylène propre et stériletubes de microcentrifuge.
- Diluer chaque échantillon à 1,5 mL avec du PBS. Centrifuger à 1500 x g pendant 10 min.
- Décanter le liquide surnageant. Reconstituer pellet de sperme avec le tampon de la motilité de pipetage doux.
Remarque : Autres densités peuvent servir aux besoins du chercheur. Déterminer les quantités d’ingrédients utilisés par l’équation suivante, où v0 est volume de solution de densité du stock utilisés, v est un volume final de la solution souhaitée, p est la densité de la solution finale de la densité souhaitée et p0 est la masse volumique de la densité du stock solution :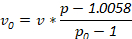
Toujours utiliser 0,3 mL de 1,5 M de NaCl dans la préparation des solutions de densité en fonction de la concentration de NaCl de sérum physiologique.
3. détermination de la qualité du sperme
- Calculer la concentration de sperme comme décrit plus haut22.
- Effectuez l’éosine-nigrosine vital coloration comme décrit précédemment12 avec les modifications suivantes :
- Préparer 100 µL de solution de sperme à une concentration de 1 x 108 cellules/mL.
- Pipetter 50 µL de solution de sperme dans un tube en polypropylène microcentrifugeuse contenant un volume égal d’éosine nigrosine tache. Incuber le mélange pendant 5 min à température ambiante.
- Place un 20 µL goutte de l’échantillon de sperme teinté à une extrémité d’une lame de verre et Enduire uniformément d’une manière similaire à celle utilisée pour le sang frottis. Sécher les diapositives barbouillés à température ambiante pendant 3 à 5 min.
- Observer le frottis au microscope. Compter le nombre de spermatozoïdes vivants (sans tache) et de spermatozoïdes morts (colorés en rose) et calculer le pourcentage de spermatozoïdes vivants.
- Effectuez le test de Accudenz, comme déjà validé pour le sperme de poulet, d’évaluer objectivement la mobilité de spermatozoïdes8 avec les modifications suivantes :
- Pipette 1,0 mL de solution de test de 6 % dans des cuvettes de polystyrène, comme illustré à la Figure 2. Incuber à 41 ° C.
NOTE : 41 ° C est utilisée pour correspondre à la température interne d’une poule. La température d’incubation doit correspondre à celui de l’appareil reproducteur femelle de l’espèce étudiée. - La solution de dosage préchauffé avec 100 µL de l’échantillon de sperme à une concentration de 5 x 108 cellules/mL de superposition.
- Place la cuvette contenant superposées échantillon de sperme dans le spectrophotomètre. Enregistrer la valeur d’absorbance à 550 nm.
- Pipette 1,0 mL de solution de test de 6 % dans des cuvettes de polystyrène, comme illustré à la Figure 2. Incuber à 41 ° C.
- Effectuez dosage IPVL-pénétration comme décrit précédemment11 avec les modifications suivantes :
- Couper un morceau (0,5 x 0,5 cm) de région de disque non germinales de IPVL intact.
- Ajuster la concentration du sperme à 4 x 106 cellules/mL
- Incuber le sperme dans un tampon de motilité avec IPVL dans un flacon en verre petit pendant 15 min à 37 ° C, comme illustré à la Figure 3.
- Immerger la pièce IPVL dans 3 % NaCl pour arrêter l’interaction entre l’IPVL et du sperme.
- Monter la pièce IPVL sur une lame de microscope et la tache avec du réactif de Schiff pendant 10 min après fixation par le formol 10 % pendant 20 s.
- Observer l’IPVL sous un microscope pour les spermatozoïdes réussi trous de pénétration et de compter le nombre de tous les trous visibles / 0,25 mm2 à un grossissement de 40 X.
Résultats
La technique PDGC a été nette séparation de trois couches de sperme par degré de qualité à travers tous les paramètres. Spermatozoïdes se sépare en une couche de qualité inférieure à la solution de densité plus élevée, une couche de qualité moyenne entre le supérieur et solution de densité plus faible et une couche de faible qualité au-dessus de la solution de densité plus faible. Ces différences de qualité sont mis en évidence de différences évidentes dans la via...
Discussion
Fécondité non seulement détermine la rentabilité de la production animale, mais agit également comme un moyen de sélection naturelle des espèces pour l’existence. La fonction ultime d’un spermatozoïde doit féconder un ovule. L’oviducte de la femelle choisit seulement ces spermatozoïdes plus forts afin d’assurer la fécondation de l’ovule23,24. Des études in vitro ont révélé également une étroite corrélation entre les caractéri...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Aucun.
matériels
| Name | Company | Catalog Number | Comments |
| Accudenz | Accurate Chemical and Scientific Corporation, Westbury, NY, USA | AN7050 | |
| Percoll | Sigma-Aldrich, Corp., St. Louis, MO, USA | P7828 | |
| Schiff’s reagent | Sigma-Aldrich, Corp., St. Louis, MO, USA | 3952016 | |
| TES | Sigma-Aldrich, Corp., St. Louis, MO, USA | T1375 | |
| Eosin Y | Sigma-Aldrich, Corp., St. Louis, MO, USA | E4009 | |
| Nigrosin | Sigma-Aldrich, Corp., St. Louis, MO, USA | 198285 | |
| ST 40R Centrifuge | Thermo Scientific, Waltham, MA, USA | 75004524 | |
| DU 530 Life Sciences UV/Vis Spectrophotometer | Beckman Coulter, Brea, CA, USA | No catalogue is found | |
| Olympus IX 71 Inverted Fluorescence and Phase Contrast Microscope | Olympus America Inc., PA, USA | No catalogue is found |
Références
- Spargo, S. C., Hope, R. M. Evolution and nomenclature of the zona pellucida gene family. Biology Reproduction. 68, 358-362 (2003).
- Okamura, F., Nishiyama, H. The passage of spermatozoa through the vitelline membrane in the domestic fowl, Gallus gallus. Cell and Tissue Research. 188 (3), 497-508 (1978).
- Henkel, R., et al. Sperm function and assisted reproduction technology. Reproductive Medicine and Biology. 4, 7-30 (2005).
- Reddy, R. P., Bakst, M. R., Wishart, G. J. Artificial Insemination of broilers: Economic and management implications. Proceedings of 1st International Symposium on Artificial Insemination of Poultry. Poultry Science Association. , 73-89 (1995).
- Howarth, B. An Examination for Sperm Capacitation in the Fowl. Biology of Reproduction. 3, 338-341 (1971).
- Menkveld, R., Holleboom, C. A. G., Rhemrev, J. P. T. Measurement and significance of sperm morphology. Asian Journal of Andrology. 13, 59-68 (2011).
- Kumaresan, A., Johannisson, A., Al-Essawe, E. M., Morrell, J. M. Sperm viability, reactive oxygen species, and DNA fragmentation index combined can discriminate between above- and below-average fertility bulls. Journal of Dairy Science. 100, 5824-5836 (2017).
- Froman, D. P., McLean, D. J. Objective measurement of sperm motility based upon sperm penetration of Accudenz. Poultry Science. 75, 776-784 (1996).
- Zaneveld, L. J., De Jonge, C. J., Anderson, R. A., Mack, S. R. Human sperm capacitation and the acrosome reaction. Human Reproduction. 6 (9), 1265-1274 (1991).
- Ahammad, M. U., et al. Acrosome reaction of fowl sperm: Evidence for shedding of acrosomal cap in intact form to release acrosomal enzyme. Poultry Science. 92 (3), 798-803 (2013).
- Ahammad, M. U., et al. Maturational changes in motility, acrosomal proteolytic activity, and penetrability of the inner perivitelline layer of fowl sperm, during their passage through the male genital tract. Theriogenology. 76 (6), 1100-1109 (2011).
- Chalah, T., Brillard, J. P. Comparison of assessment of fowl sperm viability by eosin-nigrosin and dual fluorescence. Theriogenology. 50 (3), 487-493 (1998).
- Aitken, R. J., West, K. M. Analysis of the relationship between reactive oxygen species production and leukocyte infiltration in fractions of human semen separated on Percoll gradients. International Journal of Andrology. 13, 433-451 (1990).
- Mortimer, D., Mortimer, S. T., Carrell, D., Aston, K. Density Gradient Separation of Sperm for Artificial Insemination. Spermatogenesis. Methods in Molecular Biology (Methods and Protocols. , 927 (2013).
- Qingling, Y., et al. Processing of semen by density gradient centrifugation selects spermatozoa with longer telomeres for assisted reproduction techniques. Reproductive BioMedicine Online. 31, 44-50 (2015).
- Moohan, J. M., Lindsay, K. S. Spermatozoa selected by a discontinuous Percoll density gradient exhibit better motion characteristics, more hyperactivation, and longer survival than direct swim-up. Fertility and Sterility. 64 (1), 160-165 (1995).
- Paulson, J. D., Polakoski, K. L. A glass wool column procedure for removing extraneous material from human ejaculate. Fertility and Sterility. 28, 178-181 (1977).
- Ahammad, M. U., Chiaki, N., Tatemoto, H., Kawamoto, Y., Nakada, T. Utilization of the swim-up migration sedimentation technique to separate viable and progressively motile fowl spermatozoa. World's Poultry Science Association Proceedings. , (2010).
- Lucena, E., et al. Recovery of motile sperm using the migration-sedimentation technique in an in vitro fertilization-embryo transfer programme. Human Reproduction. 4 (2), 163-165 (1989).
- Henkel, R. Sperm Processing for IVF. Clinical Embryology: A Practical Guide. , (2013).
- Sherman, J., Paulson, D., Liu, K. Effect of glass wool filtration on ultrastructure of human spermatozoa. Fertility and Sterility. 36, 643-647 (1981).
- Freund, M., Carol, B. Factors affecting haemocytometer counts of sperm concentration in human semen. Journal of Reproduction and Fertility. 8, 149-155 (1964).
- Bakst, M. R., Wishart, G. J., Brillard, J. P. Oviducal sperm selection, transport and storage in poultry. Poultry Science Review. 5, 117-143 (1994).
- Ahammad, M. U., Okamoto, S., Kawamoto, Y., Nakada, T. The effects of regular fluid secretion from the uterus of laying hens on the longevity and fertilization ability of fowl sperm in the oviduct. Poultry Science Journal. 1 (1), 13-22 (2013).
- Ahammad, M. U., et al. Maturational changes in the survivability and fertility of fowl sperm during their passage through the male reproductive tract. Animal Reproduction Science. 128 (1-4), 129-136 (2011).
- Choi, K. H., Emery, D. A., Straub, D. E., Lee, C. S. Percoll process can improve semen quality and fertility in turkey breeders. Asian-Australasian Journal of Animal Sciences. 12 (5), 702-707 (1999).
- Chen, M. J., Bongso, A. Comparative evaluation of two density gradient preparations for sperm separation for medically assisted conception. Human Reproduction. 14 (3), 759-764 (1999).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon