Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Коллекция спермы дифференциальной качества с использованием градиентного центрифугирования плотность
* Эти авторы внесли равный вклад
В этой статье
Резюме
В этой статье мы стремимся описывают производительность метода градиентного центрифугирования плотность и его применение в исследованиях физиологии спермы.
Аннотация
В половом размножении мужских гамет или сперматозоид предохранители с женские гаметы довести о оплодотворения. Однако большое количество сперматозоидов с подкормки способность обязаны взаимодействовать с женские гаметы обеспечить оплодотворения. Таким образом имеет решающее значение для успешного воспроизводства оплодотворяющая способность отдельных клеток спермы. Плотность градиентного центрифугирования была использована на протяжении нескольких десятилетий как воспроизводимость, быстрый, эффективный, действенный и чрезвычайно гибкой метод собирать только высокого качества спермы, чтобы использоваться в вспомогательных репродуктивных технологий. Протоколы, которые мы описали здесь сосредоточена на использовании разрывных Percoll плотность градиентного центрифугирования (PDGC) метода изолировать три отдельных популяций спермы петуха, их качество. Мы были в состоянии собрать низко-, средне - и высокое качество спермы. Мы также обсудим воспроизводимые протоколы, которые влекут за собой определяющих потенциал фертильности спермы путем оценки их жизнеспособности, мобильность и проницаемость. Коллекция спермы на их качество, с использованием метода PDGC будет полезно точно и тщательно характеризуют спермы с дифференциальной рождаемости потенциал.
Введение
В позвоночных мужские гаметы проходят интенсивный селективного давления; Поэтому репродуктивной мужского пола имеет решающее значение для достижения успешного оплодотворения. Мужчины любого заданного позвоночных видов должны быть в состоянии производить сперматозоиды в больших количествах и достаточно высокого качества для удовлетворения потребностей оплодотворения. Сперматозоиды, имеющие сперматозоида и жгутика, являются наиболее поляризованных клетки в организме. Они также являются весьма разнородными качества спермы (живой и мертвых, морфологически нормальной и ненормальной и неподвижной, низкий мобильных и высокой мобильный), которая раскрывается через широкий разброс в репродуктивной эффективности мужчин. Чем больше доля высокого качества спермы, меньшее количество вязки, необходимые для успешного оплодотворения яйцеклетки. Однако, для достижения плодородия, морфологически нормальных сперматозоидов полагаются на пропульсивной силы, порожденных их жгутики для доступа к сайту оплодотворения, а также проникают вителлинового1 (ZP; в случае млекопитающих) или внутренний наблюдаться слой2 (IPVL; в случае птиц и рептилий) яйцеклетки после природных спаривания или искусственного оплодотворения (МА). Определение спермы качества необходима для использования в вспомогательных репродуктивных технологий3 (искусство) и выбор размножения самцы использоваться в AI программ4. С другой стороны успех искусства исключительно зависит от точной оценки качества спермы. Чтобы определить функциональные характеристики спермы были разработаны ряд лабораторных тестов. Наиболее важными параметрами являются морфологии сперматозоидов, жизнеспособность, мобильность, капацитации (птичий спермы не требуют капацитации5), реакция Акросома (AR; экзоцитоз и выпуска протеолитического фермента от Акросома сперматозоида), спермы проникновение ZP или IPVL и оплодотворение6,,78,9,10,11. Меры плодородия только не обеспечивают точную оценку оплодотворяющей способности спермы населения11. Меры несколько событий, приведших к оплодотворению яйцеклетки позволяют соответствующее представление производительности отдельных сперматоцитах7.
Методология, разработанная для измерения спермы функция главным образом вегетационных. Например в птичий спермы, жизнеспособность, мобильность и проникновения IPVL являются наиболее распространенные параметры, используемые для оценки спермы качества8,,1112. Количество живых сперматозоидов в эякуляте играет решающую роль для выживания спермы, потому что наличие большого числа погибших сперматозоидов в сперме влияет на качество спермы. Это усиливает производство реактивнооксигенных видов в сперме и вызывает оксидативного повреждения живых сперматозоидов13. Спермы мобильности, емкости для flagellar движения птичьего спермы против сопротивления при температуре тела, как известно играть непосредственную роль в обеспечении оплодотворение8. Хорошо известно, что мобильность положительно коррелирует с уровнем рождаемости и, таким образом, основным фактором, определяющим рождаемости8. Однако мобильный спермы также должны иметь возможность пройти AR и проникать IPVL11. IPVL проникновения анализов учитывать каждый спермы, которая участвует в процессе оплодотворения11.
В применении искусства эякулята обычно обрабатывается максимальной концентрации спермы высокого качества и свести к минимуму концентрацию низкого качества спермы. После сбора спермы доля спермы высокого качества можно обогатить через процедуры разделения спермы, широко используется в промышленности и научно-исследовательских методов. Многие из этих процедур были разработаны, все с соответствующие преимущества и недостатки, но все они используют неоднородный характер спермы, чтобы собирать только спермы с высокой оплодотворяющей способности. Эти процедуры включают в себя методы миграции сперматозоидов, присоединение столбца фильтрации и плотности градиентного центрифугирования (ДГК)14,,1516,,1718,19 , 20. среди доступных методов, было установлено быть очень простой, повторяемые, экономически эффективным и эффективным в изоляции максимальное количество спермы высокого качества для использования в искусстве с целью максимизации шансов оплодотворение14 ДГК , 15. Кроме того, ДГК не вредные для спермы клеточной мембраны. Напротив методы миграции спермы собирают только постепенно мобильных спермы18,19, но количество спермы собраны очень низка, что делает его неэффективным в сборе большого количества спермы18, 20. присоединение столбца фильтрации является очень эффективным в фильтрации высокомобильных спермы сперма17; Однако она стремится быть injurious к спермы мембраны20,21.
В технике ДГК наиболее часто используемые субстрат для генерации градиент плотности — Percoll, который состоит из кремнезема коллоидных частиц в polyvinylpryrolidone. Percoll плотность градиентного центрифугирования (PDGC) может быть либо непрерывные или дискретные но Дискретные градиент наиболее часто используется для изоляции высокодоходных высокомобильных спермы13,16,20. В дискретные градиент ниже плотности СМИ плавает выше выше плотность средств массовой информации, создавая градиент, увеличение плотности от верхней до нижней части Конические трубки. Это создает границы на стыке двух СМИ различной плотности. Эффективность PDGC является производным от двух факторов: 1) движителя способность отдельных клеток спермы и 2) тенденцию иметь увеличение плотности клеток спермы с высокой структурной целостности. Сперматозоиды с более высокой мобильностью способны лучше крест из нижней плотности СМИ и проникать в более высокой плотности СМИ. Нижняя подвижность сперматозоидов, скорее всего, попасть в ловушку на границе, созданный интерфейс между СМИ различной плотности. Сперматозоиды с высокой структурной целостности и мобильность, как правило, имеют более высокую плотность, чем мертвым, ненормальное или низкой мобильных клеток спермы. Когда центробежная сила применяется в PDGC, это облегчает движение сперматозоидов с различной плотности в их соответствующие места в градиенте.
В общей практике после PDGC, мягкие лепешки спермы с высокой рождаемостью потенциал в нижней части Конические трубки собирается, и остаток отбрасывается. Однако недостаточно преимуществом этого метода является его способность разделения клетки спермы на несколько групп, основанные на качественных различий. Для исследовательских целей разделение спермы по степени качества, используя метод PDGC позволяет для изучения качества спермы как она относится к физиологической, Метаболомные и протеомных различия. Здесь мы стремимся к деталям, как эта техника может использоваться для разделения спермы по качеству, а также продемонстрировать эти различия в качестве, используя ранее установленных эозина nigrosin жизненно пятная для жизнеспособности, Accudenz assay для мобильности и сперма IPVL assay взаимодействия для проницаемость.
протокол
Все методы, описанные здесь были одобрены институциональный уход животных и использование Комитет (IACUC) из университета штата Джорджия.
1. Мойка с использованием традиционных центрифугирования
- Подготовьте фосфатного буферного раствора (PBS). Добавление 8,0 г NaCl, 0,2 г KCl, 1,44 г Na2HPO4 и 0,24 г х2PO4 до 800 мл дистиллированной воды (dH2O). Отрегулируйте пэ-аш до 7,4, используя 0,1 N HCl и довести решение до 1 Л, с использованием dH2O.
- Подготовьте моторики буфера. Добавить 6,5 г NaCl, 4,5 г глюкозы, 0,444 g CaCl2 и 11,5 g N - трис-[гидроксиметил] метил-2-амино ethanesulfonic кислота (TES) до 800 мл dH2O. скорректировать рН 7,4, используя 1 M NaOH и довести решение до 1 Л, с использованием dH2O.
- Пипетка 0,5 мл спермы в полипропиленовые microcentrifuge трубку. Добавьте 1,0 мл PBS и осторожно перемешать.
- Центрифуга на 1500 g x 10 мин при комнатной температуре (RT) и удалить супернатант. Ресуспензируйте спермы лепешка с PBS до 1,5 мл.
- Центрифуги на 1500 x g 10 мин на RT. Ресуспензируйте спермы на гранулах с моторики буфера до 0,5 мл.
2. выполнение метода PDGC
Примечание: Выполните весь процесс PDGC при комнатной температуре.
- Сделайте 3,0 мл 1.08 г/мл и 1,07 г/мл Percoll решений в двух отдельных труб.
- В чистую пробирку, добавить 1.712 мл 1,13 г/мл оригинального Percoll до 0,3 мл раствора NaCl 1.5 М. Добавьте 0.988 мл dH2O и смешайте нежно инверсии сделать 3,0 мл 1.08 г/мл раствора плотностью.
- В чистую пробирку, добавить 1.482 мл 1,13 г/мл оригинального Percoll до 0,3 мл раствора NaCl 1.5 М. Добавьте 1.218 мл dH2O и смешайте нежно инверсии сделать 3,0 мл 1,07 г/мл раствора плотностью.
- В чистую пробирку развести 1,0 мл спермы образец 1:2 с 2.0 мл ФСБ. Смешайте нежно закупорить.
- Накапайте 3.0 мл раствора плотностью 1,07 г/мл в стерильных 15 мл Конические трубки. Тщательно накапайте 3,0 мл раствора плотностью 1.08 г/мл под раствор плотностью 1,07 г/мл. Убедитесь, что не следует смешивать два слоя. Лонг формы (9 в) пипетка Пастера может сделать этот шаг легче.
- Накапайте 3,0 мл пробы разреженных Семен возвышаться PDG. Чтобы гарантировать, что образца спермы не смешивать с ПДГ, Аккуратно наклоните коническую пробирку, содержащую ПДГ под углом 45°. Накапайте образца по стенке трубки и позволить ей поток вниз по трубе и над PDG.
- Подготовьте пустую трубку соответствует масса ПДГ с накладными образца. Центрифуга обеих трубок на 1500 x g 20 мин быть осторожны, чтобы сохранить Дискретные градиент при передаче трубы со скамейки запасных на баланс и затем в центрифуге.
Примечание: Не используйте тормоз в конце центрифугирования. - Просмотрите результаты. Убедитесь, что три отдельных Семен слои сформировали в трубу, как показано на рисунке 1.
- Аспирационная изолированных Семен слои с пипеткой. Сначала собирают верхний слой спермы, среднего слоя второй и последний жесткий гранулы в нижней части трубки. Передачи каждой чистой и стерильные полипропиленапробки microcentrifuge.
- Развести каждого образца до 1,5 мл с PBS. Центрифуга на 1500 g x 10 мин.
- Слить супернатант. Воссоздания Пелле спермы с буфером моторики, нежный закупорить.
Примечание: Альтернативные плотности может использоваться для нужд следователь. Определить количество ингредиентов, используемых с следующее уравнение, где v0 является объем запасов плотность раствора, v окончательный объем раствора желаемого, p плотность раствора окончательной плотности желаемого и p0 плотность фондовых плотности решение: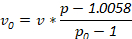
Всегда используйте 0,3 мл 1,5 М NaCl в подготовке плотности растворов для соответствия концентрации физиологического раствора NaCl.
3. Определение качества спермы
- Вычислить, что концентрация сперматозоидов как описано22.
- Выполните эозина nigrosin жизненно пятнать ранее описанных12 со следующими изменениями:
- Подготовка 100 мкл раствора спермы в концентрации 1 x 108 кл/мл.
- Накапайте 50 мкл раствора спермы в тубы полипропиленовые microcentrifuge с равным объемом эозина nigrosin пятно. Инкубируйте смесь для 5 мин при комнатной температуре.
- 20 мкл падение окрашенных спермы образца на одном конце стеклянное скольжение и равномерно смазать аналогично используемому для крови мазки. Просушите смазывают слайды при комнатной температуре 3-5 мин.
- Наблюдать под микроскопом мазка. Подсчитать количество живых сперматозоидов (не пятно) и мертвых спермы (окрашенные розовым) и рассчитать процент живых сперматозоидов.
- Выполните Accudenz assay, как ранее проверены для курицы спермы, чтобы объективно оценить подвижности спермы8 со следующими изменениями:
- Накапайте 1,0 мл 6% пробирного решения в Кюветы полистирольные, как показано на рисунке 2. Инкубируйте на 41 ° C.
Примечание: 41 ° C используется для сопоставления внутренней температуры курицу. Температура инкубации должна соответствовать женского репродуктивного тракта видов ведется расследование. - Наложение разогретой пробирного решение с 100 мкл образца спермы в концентрации 5 x 108 кл/мл.
- Место кювет содержащие обложил образца спермы в спектрофотометра. Запишите значение поглощения 550 Нм.
- Накапайте 1,0 мл 6% пробирного решения в Кюветы полистирольные, как показано на рисунке 2. Инкубируйте на 41 ° C.
- Выполните IPVL-проникновение пробирного как описано11 со следующими изменениями:
- Отрежьте кусок (0,5 х 0,5 см) не зародышевого диска региона нетронутыми IPVL.
- Отрегулируйте концентрация сперматозоидов до 4 х 106 клеток/мл
- Инкубируйте в буфер подвижность спермы с IPVL в небольшой стеклянный флакон для 15 минут при 37 ° C, как показано на рисунке 3.
- Погрузите IPVL кусок в 3% NaCl прекратить взаимодействие между IPVL и спермы.
- Маунт IPVL кусок на микроскопа и пятно с Шиффа в реагент для 10 мин, после фиксации с формалина 10% для 20 s.
- Соблюдать IPVL под микроскопом для спермы успешного проникновения отверстия и подсчитать количество всех видимых отверстий на 40 кратном 0.25 мм2 .
Результаты
PDGC техника привела к собственный разделения трех слоев спермы по степени качества всех параметров. Спермы отделяет в слой высокого качества ниже выше плотность раствора, среднего качества слой между тем выше и ниже плотности раствора и низкого качества слой выше нижн...
Обсуждение
Рождаемость не только определяет рентабельность животноводства, но и действует как средство естественного отбора видов для существования. Конечная функция сперматозоид является оплодотворить яйцеклетку. Маточных труб женщина выбирает только те приспособленных спермы с целью обесп?...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Нет.
Материалы
| Name | Company | Catalog Number | Comments |
| Accudenz | Accurate Chemical and Scientific Corporation, Westbury, NY, USA | AN7050 | |
| Percoll | Sigma-Aldrich, Corp., St. Louis, MO, USA | P7828 | |
| Schiff’s reagent | Sigma-Aldrich, Corp., St. Louis, MO, USA | 3952016 | |
| TES | Sigma-Aldrich, Corp., St. Louis, MO, USA | T1375 | |
| Eosin Y | Sigma-Aldrich, Corp., St. Louis, MO, USA | E4009 | |
| Nigrosin | Sigma-Aldrich, Corp., St. Louis, MO, USA | 198285 | |
| ST 40R Centrifuge | Thermo Scientific, Waltham, MA, USA | 75004524 | |
| DU 530 Life Sciences UV/Vis Spectrophotometer | Beckman Coulter, Brea, CA, USA | No catalogue is found | |
| Olympus IX 71 Inverted Fluorescence and Phase Contrast Microscope | Olympus America Inc., PA, USA | No catalogue is found |
Ссылки
- Spargo, S. C., Hope, R. M. Evolution and nomenclature of the zona pellucida gene family. Biology Reproduction. 68, 358-362 (2003).
- Okamura, F., Nishiyama, H. The passage of spermatozoa through the vitelline membrane in the domestic fowl, Gallus gallus. Cell and Tissue Research. 188 (3), 497-508 (1978).
- Henkel, R., et al. Sperm function and assisted reproduction technology. Reproductive Medicine and Biology. 4, 7-30 (2005).
- Reddy, R. P., Bakst, M. R., Wishart, G. J. Artificial Insemination of broilers: Economic and management implications. Proceedings of 1st International Symposium on Artificial Insemination of Poultry. Poultry Science Association. , 73-89 (1995).
- Howarth, B. An Examination for Sperm Capacitation in the Fowl. Biology of Reproduction. 3, 338-341 (1971).
- Menkveld, R., Holleboom, C. A. G., Rhemrev, J. P. T. Measurement and significance of sperm morphology. Asian Journal of Andrology. 13, 59-68 (2011).
- Kumaresan, A., Johannisson, A., Al-Essawe, E. M., Morrell, J. M. Sperm viability, reactive oxygen species, and DNA fragmentation index combined can discriminate between above- and below-average fertility bulls. Journal of Dairy Science. 100, 5824-5836 (2017).
- Froman, D. P., McLean, D. J. Objective measurement of sperm motility based upon sperm penetration of Accudenz. Poultry Science. 75, 776-784 (1996).
- Zaneveld, L. J., De Jonge, C. J., Anderson, R. A., Mack, S. R. Human sperm capacitation and the acrosome reaction. Human Reproduction. 6 (9), 1265-1274 (1991).
- Ahammad, M. U., et al. Acrosome reaction of fowl sperm: Evidence for shedding of acrosomal cap in intact form to release acrosomal enzyme. Poultry Science. 92 (3), 798-803 (2013).
- Ahammad, M. U., et al. Maturational changes in motility, acrosomal proteolytic activity, and penetrability of the inner perivitelline layer of fowl sperm, during their passage through the male genital tract. Theriogenology. 76 (6), 1100-1109 (2011).
- Chalah, T., Brillard, J. P. Comparison of assessment of fowl sperm viability by eosin-nigrosin and dual fluorescence. Theriogenology. 50 (3), 487-493 (1998).
- Aitken, R. J., West, K. M. Analysis of the relationship between reactive oxygen species production and leukocyte infiltration in fractions of human semen separated on Percoll gradients. International Journal of Andrology. 13, 433-451 (1990).
- Mortimer, D., Mortimer, S. T., Carrell, D., Aston, K. Density Gradient Separation of Sperm for Artificial Insemination. Spermatogenesis. Methods in Molecular Biology (Methods and Protocols. , 927 (2013).
- Qingling, Y., et al. Processing of semen by density gradient centrifugation selects spermatozoa with longer telomeres for assisted reproduction techniques. Reproductive BioMedicine Online. 31, 44-50 (2015).
- Moohan, J. M., Lindsay, K. S. Spermatozoa selected by a discontinuous Percoll density gradient exhibit better motion characteristics, more hyperactivation, and longer survival than direct swim-up. Fertility and Sterility. 64 (1), 160-165 (1995).
- Paulson, J. D., Polakoski, K. L. A glass wool column procedure for removing extraneous material from human ejaculate. Fertility and Sterility. 28, 178-181 (1977).
- Ahammad, M. U., Chiaki, N., Tatemoto, H., Kawamoto, Y., Nakada, T. Utilization of the swim-up migration sedimentation technique to separate viable and progressively motile fowl spermatozoa. World's Poultry Science Association Proceedings. , (2010).
- Lucena, E., et al. Recovery of motile sperm using the migration-sedimentation technique in an in vitro fertilization-embryo transfer programme. Human Reproduction. 4 (2), 163-165 (1989).
- Henkel, R. Sperm Processing for IVF. Clinical Embryology: A Practical Guide. , (2013).
- Sherman, J., Paulson, D., Liu, K. Effect of glass wool filtration on ultrastructure of human spermatozoa. Fertility and Sterility. 36, 643-647 (1981).
- Freund, M., Carol, B. Factors affecting haemocytometer counts of sperm concentration in human semen. Journal of Reproduction and Fertility. 8, 149-155 (1964).
- Bakst, M. R., Wishart, G. J., Brillard, J. P. Oviducal sperm selection, transport and storage in poultry. Poultry Science Review. 5, 117-143 (1994).
- Ahammad, M. U., Okamoto, S., Kawamoto, Y., Nakada, T. The effects of regular fluid secretion from the uterus of laying hens on the longevity and fertilization ability of fowl sperm in the oviduct. Poultry Science Journal. 1 (1), 13-22 (2013).
- Ahammad, M. U., et al. Maturational changes in the survivability and fertility of fowl sperm during their passage through the male reproductive tract. Animal Reproduction Science. 128 (1-4), 129-136 (2011).
- Choi, K. H., Emery, D. A., Straub, D. E., Lee, C. S. Percoll process can improve semen quality and fertility in turkey breeders. Asian-Australasian Journal of Animal Sciences. 12 (5), 702-707 (1999).
- Chen, M. J., Bongso, A. Comparative evaluation of two density gradient preparations for sperm separation for medically assisted conception. Human Reproduction. 14 (3), 759-764 (1999).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены