È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Raccolta di sperma di qualità differenziale mediante centrifugazione in gradiente di densità
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
In questa carta, ci proponiamo di descrivere le prestazioni della tecnica di centrifugazione su gradiente di densità e la sua applicazione nella ricerca di fisiologia di sperma.
Abstract
Nella riproduzione sessuale, un gamete maschile o spermatozoo si fonde con un gamete femminile per portare sulla fertilizzazione. Tuttavia, un gran numero di spermatozoi con capacità fecondante è necessario interagire con un gamete femminile per garantire la fecondazione. Come tale, la capacità fecondante degli spermatozoi individuale è fondamentale per riproduzione riuscita. Centrifugazione in gradiente di densità è stata utilizzata per diversi decenni come un metodo riproducibile, veloce, efficiente, efficace ed estremamente adattabile per raccogliere solo alta qualità sperma per essere utilizzato in riproduzione assistita. I protocolli che abbiamo descritto nel presente documento si concentrano sull'utilizzazione della tecnica di centrifugazione su gradiente (PDGC) di densità Percoll discontinua per isolare tre distinte popolazioni di sperma Gallo per la loro qualità. Siamo stati in grado di raccogliere basso, medio e alta qualità sperma. Descriviamo anche protocolli riproducibile che comportano determinante potenziale di fertilità dello sperma di valutazione della loro vitalità, la mobilità e la penetrabilità. Raccolta dello sperma per la loro qualità tecnica PDGC sarebbe utile per accuratamente e caratterizzare accuratamente sperma con differenziale fertilità potenziale.
Introduzione
Nei vertebrati, gameti maschili sottoposti a forte pressione selettiva; pertanto la fitness riproduttiva di un maschio è fondamentale per il raggiungimento di fecondazione. I maschi di qualsiasi specie di vertebrati determinato devono essere in grado di produrre spermatozoi in grandi quantità e di qualità sufficiente per soddisfare le esigenze di fecondazione. Spermatozoi, avendo sia una testa di sperma e un flagello, sono le cellule più polarizzate nel corpo. Essi sono anche molto eterogenei nella qualità dello sperma (bassa dal vivo e morto, morfologicamente normale e anormale e immobile, mobile e alta mobile), che si rivela attraverso la variazione larga nella efficienza riproduttiva dei maschi. Maggiore è la percentuale degli spermatozoi di qualità, minore è il numero di accoppiamenti per fecondare con successo l'ovulo necessaria. Tuttavia, per ottenere la fertilità, spermatozoi morfologicamente normali si basano su forze propulsive generate da loro flagelli per raggiungere il sito di fecondazione anche da penetrare la zona pellucida1 (ZP; nel caso di mammiferi) o interno perivitellino strato2 (IPVL; nel caso di uccelli e rettili) dell'ovulo dopo accoppiamento naturale o inseminazione artificiale (AI). Determinazione dello sperma è necessaria per l'utilizzo in riproduzione assistita3 (arte) qualità e selezione di maschi di allevamento da utilizzarsi in AI programmi4. D'altra parte, il successo dell'arte si basa esclusivamente sulla valutazione accurata della qualità dello sperma. Un numero di prove di laboratorio è stato sviluppato per determinare le caratteristiche funzionali degli spermatozoi. I parametri più importanti sono la morfologia degli spermatozoi, viabilità, mobilità, capacitazione (aviaria sperma non richiedono capacitazione5), reazione acrosomiale (AR; esocitosi e rilascio di un enzima proteolitico da acrosomiale della testa degli spermatozoi), sperma penetrazione di ZP o IPVL e la fecondazione6,7,8,9,10,11. Misure della fertilità da solo non forniscono una valutazione accurata della capacità fecondante di una popolazione di sperma11. Misure di diversi eventi che portarono alla fecondazione di un uovo consentono un'adeguata rappresentazione delle prestazioni dei singoli spermatociti7.
La metodologia sviluppata per misurare la funzione dello sperma è principalmente specie-specifica. Ad esempio, nello sperma aviaria, vitalità, la mobilità e la penetrazione di IPVL sono i più comuni parametri utilizzati per valutare la qualità di sperma8,11,12. Il numero di live spermatozoi nell'eiaculato gioca un ruolo cruciale per la sopravvivenza degli spermatozoi perché la presenza di un gran numero di morti degli spermatozoi nel liquido seminale influisce la qualità dello sperma. Questo aumenta la produzione di specie reattive dell'ossigeno nel liquido seminale e provoca danno ossidativo al sperma in tensione13. Mobilità dello sperma, la capacità di movimento flagellare di aviaria sperma contro resistenza a temperatura corporea, è conosciuto per svolgere un ruolo diretto nel portare su fecondazione8. È affermato che la mobilità è correlato positivamente con la fertilità e dunque, è un determinante primario di fertilità8. Tuttavia, un spermatozoi mobili anche devono avere la capacità di subire un AR e di penetrare il IPVL11. Saggi di penetrazione IPVL tengano conto per ogni spermatozoo che partecipa al processo di fertilizzazione11.
L'applicazione dell'arte, eiaculare è solitamente trattati al fine di massimizzare la concentrazione degli spermatozoi di qualità e ridurre al minimo la concentrazione di spermatozoi di bassa qualità. Dopo la raccolta dello sperma, la percentuale degli spermatozoi di qualità può essere arricchita attraverso procedure di separazione degli spermatozoi comunemente usate nelle pratiche di ricerca e industria. Molte di queste procedure sono state sviluppate, tutte con i rispettivi vantaggi e limitazioni, ma tutti utilizzano la natura eterogenea di sperma per raccogliere solo gli spermatozoi con alta capacità fecondante. Queste procedure includono metodi di migrazione dello sperma, filtrazione di colonna di aderenza e densità mediante centrifugazione in gradiente (DGC)14,15,16,17,18,19 , 20. tra le tecniche disponibili, DGC è stato trovato per essere molto semplice, ripetibile, conveniente ed efficiente nell'isolare la quantità massima di sperma di alta qualità per uso nell'arte con l'obiettivo di massimizzare le possibilità di fecondazione14 , 15. Inoltre, DGC non è pregiudizievole alla membrana delle cellule dello sperma. Al contrario, metodi di migrazione dello sperma raccolgono lo sperma solo progressivamente mobile18,19, ma la quantità di sperma raccolto è molto bassa, che lo rende inefficiente nella raccolta di grandi volumi di sperma18, 20. aderenza colonna filtrazione è molto efficiente nel filtraggio altamente mobili spermatozoi dal liquido seminale17; Tuttavia, tende ad essere pregiudizievole a sperma membrane20,21.
Nella tecnica del DGC, il substrato più comunemente usato per generare il gradiente di densità è Percoll, che consiste di particelle di silice colloidale rivestite in polyvinylpryrolidone. Percoll centrifugazione in gradiente di densità (PDGC) può essere continuo o discontinuo ma una pendenza discontinua è più comunemente usata per l'isolamento ad alto rendimento di spermatozoi mobili altamente13,16,20. In un gradiente discontinuo, media densità inferiore galleggia sopra supporti di densità superiori, creando un gradiente che aumenta di densità dall'alto verso il basso di un tubo conico. Questo crea confini all'interfaccia fra i due mezzi di diversa densità. L'efficienza di PDGC è derivato da due fattori: 1) la capacità propulsiva di singole cellule dello sperma e 2) la tendenza delle cellule dello sperma con alta integrità strutturale ad avere una densità aumentata. Spermatozoi con maggiore mobilità sono meglio in grado di attraversare dal supporto di densità bassa e penetrare in una più alta densità media. Bassa mobilità spermatozoi sono più probabili di diventare intrappolati al confine creato dall'interfaccia tra media di differenti densità. Spermatozoi con elevata integrità strutturale e mobilità tendono ad avere una più alta densità che morti, anormali o basse spermatozoi mobili. Quando la forza centrifuga è applicato in PDGC, questo facilita il movimento degli spermatozoi con densità differenti al loro posto rispettivo della sfumatura.
Nella pratica generale, dopo PDGC viene eseguita, il morbido pellet di spermatozoi con elevata fertilità potenziale nella parte inferiore del tubo conico è raccolti, e il resto viene scartato. Tuttavia, un vantaggio sottoutilizzato di questa tecnica è la sua capacità di separare spermatozoi in diversi gruppi in base alle differenze qualitative. Per scopi di ricerca, separazione degli spermatozoi dal grado di qualità utilizzando la tecnica PDGC permette per lo studio della qualità dello sperma per quanto concerne le differenze fisiologiche, di metabolomica e proteomica. Qui, ci proponiamo di dettaglio come questa tecnica può essere utilizzata per separare lo sperma di qualità, nonché di dimostrare queste differenze in termini di qualità, utilizzando il precedentemente stabilito eosina-Nigrosina colorazione vitale per la redditività, analisi Accudenz per la mobilità e sperma-IPVL dosaggio di interazione per la penetrabilità.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutti i metodi descritti qui sono stati approvati dal istituzionale Animal Care e uso Committee (IACUC) dell'Università di Georgia.
1. lavaggio utilizzando una centrifuga tradizionale
- Preparare la soluzione tampone fosfato (PBS). Aggiungere 8,0 g di NaCl, 0,2 g di KCl, 1,44 g di Na2HPO4 e 0,24 g di KH2PO4 a 800 mL di acqua distillata (dH2O). Regolare il pH a 7.4 utilizzo 0,1 N HCl e portare la soluzione a 1 L utilizzo dH2O.
- Preparare il tampone di motilità. Aggiungere 6,5 g di NaCl, 4,5 g di glucosio, 0,444 g di CaCl2 e 11,5 g di N - tris-[idrossimetilico] metil-2-ammino-ethanesulfonic acido (TES) a 800 mL di dH2O. regolare il pH a 7.4 utilizzo 1 M NaOH e portare la soluzione a 1 L utilizzo dH2O.
- Pipettare 0,5 mL di liquido seminale in un tubo del microcentrifuge in polipropilene. Aggiungere 1,0 mL di PBS e mescolare delicatamente.
- Centrifugare a 1.500 x g per 10 min a temperatura ambiente (TA) e scartare il surnatante. Risospendere il pellet di spermatozoi con PBS fino a 1,5 mL.
- Centrifuga a 1.500 x g per 10 min a RT. Risospendere il pellet di spermatozoi con motilità del buffer fino a 0,5 mL.
2. eseguire la tecnica PDGC
Nota: Eseguire l'intero processo di PDGC a temperatura ambiente.
- Fai 3,0 mL delle soluzioni di Percoll 1,08 g/mL e 1,07 g/mL in due tubi separati.
- In una provetta pulita, aggiungere mL 1,712 di 1,13 g/mL originale Percoll a 0,3 mL di soluzione di NaCl di 1,5 M. Aggiungere mL 0,988 di dH2O e mescolare capovolgendo delicatamente per rendere 3,0 mL di 1,08 g/mL di soluzione di densità.
- In una provetta pulita, aggiungere mL 1,482 di 1,13 g/mL originale Percoll a 0,3 mL di soluzione di NaCl di 1,5 M. Aggiungere mL 1,218 di dH2O e mescolare capovolgendo delicatamente per rendere 3,0 mL di 1,07 g/mL di soluzione di densità.
- In una provetta pulita, diluire 1,0 mL di sperma campione 1:2 con 2,0 mL di PBS. Mescolare delicatamente pipettando.
- Pipettare 3,0 mL della soluzione di densità 1,07 g/mL in una provetta conica sterile 15 mL. Attentamente Pipettare 3,0 mL di soluzione di densità 1,08 g/mL sotto la soluzione di densità 1,07 g/mL. Assicurarsi che i due strati non si mescolano. Un long-form (9 in) pipetta Pasteur può semplificare questo passaggio.
- Pipettare 3,0 mL di campione di sperma diluito sovrastano il PDG. Per garantire che il campione di sperma non si mescola con il PDG, inclinare delicatamente il tubo conico contenente il PDG un'angolazione di 45°. Dispensare il campione lungo la parete del tubo e permettono di fluire verso il basso il tubo e sopra il PDG.
- Preparare una provetta vuota per abbinare la massa del PDG con campione sovrapposto. Centrifugare, entrambi i tubi a 1500 x g per 20 min. Fate attenzione a mantenere il gradiente discontinuo durante il trasferimento i tubi dalla panchina per l'equilibrio e poi per la centrifuga.
Nota: Non utilizzare il freno alla fine della centrifugazione. - Osservare i risultati. Garantire che i tre strati distinti sperma hanno formato nel tubo, come si vede nella Figura 1.
- Aspirare i livelli di sperma isolato con una pipetta. Raccogliere lo strato superiore di sperma prima, mezzo strato secondo e ultimo il pellet duro nella parte inferiore del tubo. Trasferire ciascuna per un pulito e sterile in polipropilenetubo del microcentrifuge.
- Diluire ogni campione a 1,5 mL con PBS. Centrifugare a 1500 x g per 10 min.
- Versare il sovranatante. Ricostituire il pellet di spermatozoi con buffer di motilità pipettando delicato.
Nota: Densità alternativi possono essere utilizzati per soddisfare le esigenze di investigatore. Determinare la quantità di ingredienti utilizzati con l'equazione seguente, dove v0 è il volume della soluzione stock densità utilizzati, v è volume finale della soluzione desiderata, p è la densità della soluzione finale densità desiderata e p0 è la densità della densità d'archivio soluzione: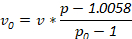
Utilizzare sempre 0,3 mL di 1,5 M di NaCl in preparazione delle soluzioni di densità per abbinare la concentrazione di NaCl di soluzione fisiologica.
3. determinazione della qualità dello sperma
- Calcolare che la concentrazione di spermatozoi come precedentemente descritto22.
- Eseguire eosina-Nigrosina vitale colorazione come descritto in precedenza12 con le seguenti modifiche:
- Preparare 100 µ l di soluzione di sperma ad una concentrazione di 1 x 108 cellule/mL.
- Pipettare 50 µ l di soluzione di sperma in una microcentrifuga in polipropilene contenenti un volume uguale di macchia dell'eosina-Nigrosina. Incubare la miscela per 5 min a temperatura ambiente.
- Sbavature di posto un 20 µ l goccia di campione di sperma macchiato a un'estremità di un vetrino e spalmare uniformemente in un modo simile a quello usato per il sangue. Asciugare i vetrini spalmati a temperatura ambiente per 3-5 min.
- Osservare lo striscio sotto il microscopio. Contare il numero di sperma in tensione (nessuna macchia) e spermatozoi morti (macchiati rosa) e calcolare la percentuale di sperma in tensione.
- Eseguire l'analisi di Accudenz, come precedentemente convalidato per gli spermatozoi di pollo, valutare oggettivamente la mobilità di sperma8 con le seguenti modifiche:
- Pipettare 1,0 mL di soluzione di saggio del 6% in provette in polistirene, come illustrato nella Figura 2. Incubare a 41 ° C.
Nota: 41 ° C viene utilizzato per abbinare la temperatura interna di una gallina. La temperatura di incubazione deve corrispondere a quello del tratto riproduttivo femminile delle specie oggetto di indagine. - Sovrapporre la soluzione di saggio preriscaldato con 100 µ l di campione di sperma ad una concentrazione di 5 x 108 cellule/mL.
- Posto la provetta contenente il overlaid campione di sperma nello spettrofotometro. Registrare il valore di assorbanza a 550 nm.
- Pipettare 1,0 mL di soluzione di saggio del 6% in provette in polistirene, come illustrato nella Figura 2. Incubare a 41 ° C.
- IPVL-penetrazione saggio può essere eseguito come descritto in precedenza11 con le seguenti modifiche:
- Tagliare un pezzo (0,5 x 0,5 cm) della regione del disco non-germinal di IPVL intatta.
- Regolare la concentrazione di spermatozoi a 4 x 106 cellule/mL
- Incubare sperma nel buffer di motilità con IPVL in una piccola fiala di vetro per 15 min a 37 ° C, come illustrato nella Figura 3.
- Immergere il pezzo IPVL in 3% NaCl per interrompere l'interazione tra le IPVL e lo sperma.
- Montare il pezzo IPVL su un vetrino da microscopio e macchia con reagente di Schiff per 10 min segue fissazione con formalina al 10% per 20 s.
- Osservare il IPVL sotto un microscopio per sperma successo fori di penetrazione e contare il numero di tutti i fori visibili a 0,25 mm2 a 40 ingrandimenti.
Access restricted. Please log in or start a trial to view this content.
Risultati
La tecnica PDGC ha provocato la separazione dei tre strati di sperma distinti da grado di qualità attraverso tutti i parametri. Lo sperma si separa in un livello di alta qualità sotto la soluzione di densità superiore, uno strato di qualità media tra il superiore e inferiore densità soluzione e un livello di bassa qualità sopra la soluzione di densità inferiore. Queste differenze di qualità sono evidenziate mediante chiare differenze di redditività (Figura 4<...
Access restricted. Please log in or start a trial to view this content.
Discussione
Fertilità non solo determina la redditività della produzione animale, ma anche agisce come un mezzo della selezione naturale delle specie per l'esistenza. La funzione di una cellula di sperma è quella di fecondare un ovulo. Nell'ovidotto di una femmina seleziona solo quegli spermatozoi più adatti al fine di garantire la fecondazione dell'ovulo23,24. Studi in vitro hanno rivelato inoltre una stretta correlazione tra tratti qualitativi degli spermatozo...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Nessuno.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Accudenz | Accurate Chemical and Scientific Corporation, Westbury, NY, USA | AN7050 | |
| Percoll | Sigma-Aldrich, Corp., St. Louis, MO, USA | P7828 | |
| Schiff’s reagent | Sigma-Aldrich, Corp., St. Louis, MO, USA | 3952016 | |
| TES | Sigma-Aldrich, Corp., St. Louis, MO, USA | T1375 | |
| Eosin Y | Sigma-Aldrich, Corp., St. Louis, MO, USA | E4009 | |
| Nigrosin | Sigma-Aldrich, Corp., St. Louis, MO, USA | 198285 | |
| ST 40R Centrifuge | Thermo Scientific, Waltham, MA, USA | 75004524 | |
| DU 530 Life Sciences UV/Vis Spectrophotometer | Beckman Coulter, Brea, CA, USA | No catalogue is found | |
| Olympus IX 71 Inverted Fluorescence and Phase Contrast Microscope | Olympus America Inc., PA, USA | No catalogue is found |
Riferimenti
- Spargo, S. C., Hope, R. M. Evolution and nomenclature of the zona pellucida gene family. Biology Reproduction. 68, 358-362 (2003).
- Okamura, F., Nishiyama, H. The passage of spermatozoa through the vitelline membrane in the domestic fowl, Gallus gallus. Cell and Tissue Research. 188 (3), 497-508 (1978).
- Henkel, R., et al. Sperm function and assisted reproduction technology. Reproductive Medicine and Biology. 4, 7-30 (2005).
- Reddy, R. P. Artificial Insemination of broilers: Economic and management implications. Proceedings of 1st International Symposium on Artificial Insemination of Poultry. Poultry Science Association. Bakst, M. R., Wishart, G. J. , Savoy, Il. 73-89 (1995).
- Howarth, B. Jr An Examination for Sperm Capacitation in the Fowl. Biology of Reproduction. 3, 338-341 (1971).
- Menkveld, R., Holleboom, C. A. G., Rhemrev, J. P. T. Measurement and significance of sperm morphology. Asian Journal of Andrology. 13, 59-68 (2011).
- Kumaresan, A., Johannisson, A., Al-Essawe, E. M., Morrell, J. M. Sperm viability, reactive oxygen species, and DNA fragmentation index combined can discriminate between above- and below-average fertility bulls. Journal of Dairy Science. 100, 5824-5836 (2017).
- Froman, D. P., McLean, D. J. Objective measurement of sperm motility based upon sperm penetration of Accudenz. Poultry Science. 75, 776-784 (1996).
- Zaneveld, L. J., De Jonge, C. J., Anderson, R. A., Mack, S. R. Human sperm capacitation and the acrosome reaction. Human Reproduction. 6 (9), 1265-1274 (1991).
- Ahammad, M. U., et al. Acrosome reaction of fowl sperm: Evidence for shedding of acrosomal cap in intact form to release acrosomal enzyme. Poultry Science. 92 (3), 798-803 (2013).
- Ahammad, M. U., et al. Maturational changes in motility, acrosomal proteolytic activity, and penetrability of the inner perivitelline layer of fowl sperm, during their passage through the male genital tract. Theriogenology. 76 (6), 1100-1109 (2011).
- Chalah, T., Brillard, J. P. Comparison of assessment of fowl sperm viability by eosin-nigrosin and dual fluorescence. Theriogenology. 50 (3), 487-493 (1998).
- Aitken, R. J., West, K. M. Analysis of the relationship between reactive oxygen species production and leukocyte infiltration in fractions of human semen separated on Percoll gradients. International Journal of Andrology. 13, 433-451 (1990).
- Mortimer, D., Mortimer, S. T. Density Gradient Separation of Sperm for Artificial Insemination. Spermatogenesis. Methods in Molecular Biology (Methods and Protocols. Carrell, D., Aston, K. , Humana Press. Totowa, NJ, USA. 927(2013).
- Qingling, Y., et al. Processing of semen by density gradient centrifugation selects spermatozoa with longer telomeres for assisted reproduction techniques. Reproductive BioMedicine Online. 31, 44-50 (2015).
- Moohan, J. M., Lindsay, K. S. Spermatozoa selected by a discontinuous Percoll density gradient exhibit better motion characteristics, more hyperactivation, and longer survival than direct swim-up. Fertility and Sterility. 64 (1), 160-165 (1995).
- Paulson, J. D., Polakoski, K. L. A glass wool column procedure for removing extraneous material from human ejaculate. Fertility and Sterility. 28, 178-181 (1977).
- Ahammad, M. U., Chiaki, N., Tatemoto, H., Kawamoto, Y., Nakada, T. Utilization of the swim-up migration sedimentation technique to separate viable and progressively motile fowl spermatozoa. World's Poultry Science Association Proceedings. , Cambridge University Press. (2010).
- Lucena, E., et al. Recovery of motile sperm using the migration-sedimentation technique in an in vitro fertilization-embryo transfer programme. Human Reproduction. 4 (2), 163-165 (1989).
- Henkel, R. Sperm Processing for IVF. Clinical Embryology: A Practical Guide. , Springer Science and Business Media. New York, USA. (2013).
- Sherman, J., Paulson, D., Liu, K. Effect of glass wool filtration on ultrastructure of human spermatozoa. Fertility and Sterility. 36, 643-647 (1981).
- Freund, M., Carol, B. Factors affecting haemocytometer counts of sperm concentration in human semen. Journal of Reproduction and Fertility. 8, 149-155 (1964).
- Bakst, M. R., Wishart, G. J., Brillard, J. P. Oviducal sperm selection, transport and storage in poultry. Poultry Science Review. 5, 117-143 (1994).
- Ahammad, M. U., Okamoto, S., Kawamoto, Y., Nakada, T. The effects of regular fluid secretion from the uterus of laying hens on the longevity and fertilization ability of fowl sperm in the oviduct. Poultry Science Journal. 1 (1), 13-22 (2013).
- Ahammad, M. U., et al. Maturational changes in the survivability and fertility of fowl sperm during their passage through the male reproductive tract. Animal Reproduction Science. 128 (1-4), 129-136 (2011).
- Choi, K. H., Emery, D. A., Straub, D. E., Lee, C. S. Percoll process can improve semen quality and fertility in turkey breeders. Asian-Australasian Journal of Animal Sciences. 12 (5), 702-707 (1999).
- Chen, M. J., Bongso, A. Comparative evaluation of two density gradient preparations for sperm separation for medically assisted conception. Human Reproduction. 14 (3), 759-764 (1999).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon