A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
אוסף זרע באיכות דיפרנציאלית בעזרת צנטריפוגה הדרגתיות צפיפות
* These authors contributed equally
In This Article
Summary
בנייר זה, אנו שואפים לתאר את הביצועים של הטכניקה צנטריפוגה הדרגתיות צפיפות ויישומו בחקר הפיזיולוגיה של זרע.
Abstract
ברבייה מינית, תא רבייה גברית או תא הזרע בין עם תא רבייה נקבה על הפריה. עם זאת, מספר רב של תאי זרע בעלי יכולת להפרות נדרשים לקיים אינטראקציה עם תא רבייה נקבה כדי לוודא הפריה. ככזה, היכולת המפרה של תאי זרע בודדים הוא קריטי עבור רבייה מוצלחת. צנטריפוגה הדרגתיות צפיפות ניצל במשך כמה עשורים כשיטה לשחזור מהיר, יעיל, אפקטיבי, וישימה מאוד לאסוף רק באיכות גבוהה הזרע כדי לשמש הטכנולוגיה סייעה הרבייה. הפרוטוקולים שאנו המתואר במסמך זה מתמקדים הניצול של הטכניקה הדרגתיות צנטריפוגה (PDGC) צפיפות Percoll רציף כדי לבודד שלוש אוכלוסיות נפרדות של זרע רוסטר מאת האיכות שלהם. הצלחנו לאסוף נמוך - בינוני, זרע באיכות גבוהה. אנו מתארים גם פרוטוקולים לשחזור שכרוכים הקובע פוטנציאל הפוריות של זרע על-ידי הערכת הכדאיות שלהם, ניידות, חדירות. אוסף של זרע על ידי איכות שלהם בטכניקה PDGC להיות שימושי במדויק, ביסודיות לאפיין זרע עם פוטנציאל דיפרנציאלית פוריות.
Introduction
גולגולת, זכר גמטות עוברים אינטנסיבי הלחץ הסלקטיבי; לכן כושר הרבייה של הזכר הוא מרכזי להשגת הפריה מוצלחת. הזכרים של כל מין חוליות נתון חייב להיות מסוגל לייצר תאי זרע בכמויות גדולות ושל באיכות טובה דיה על מנת לענות על הצרכים של הפריה. תאי זרע, יש ראש הזרע והן של שוטון, הם התאים מקוטב ביותר בגוף. הם גם מאוד הטרוגנית באיכות הזרע (נמוך בשידור חי ולא מת, מורפולוגית נורמלי חריג ואני משותק, ניידים וגבוה ניידים), אשר מתגלה וריאציה רחב יעילות הרבייה של הזכרים. גדול יותר חלקם של זרע באיכות גבוהה, פחות המספר של matings נדרשים בהצלחה להפרות את הביצית. עם זאת, כדי להשיג פוריות, תאי זרע נורמלי מורפולוגית להסתמך על כוחות-חליפת שנוצר על ידי שוטון שלהם כדי להגיע לאתר של הפריה גם כדי לחדור את zona pellucida1 (מסוג ZP; במקרה של יונקים) או perivitelline הפנימי שכבה2 (IPVL; במקרה של ציפורים וזוחלים) של הביצית לאחר ההזדווגות טבעי או הזרעה מלאכותית (AI). קביעת זרע באיכות הדרושים לשימוש בטכנולוגיות הרבייה בסיוע3 (אמנות), בחירה של הרבייה הזכרים כדי לשמש AI תוכניות4. מצד שני, ההצלחה של אמנות מתבססת אך ורק הערכה מדויקת של איכות הזרע. מספר בדיקות מעבדה פותחו כדי לקבוע את המאפיינים הפונקציונליים של זרע. הפרמטרים החשובים ביותר הם זרע-מורפולוגיה, הכדאיות, ניידות, capacitation (זרע העופות אינן דורשות capacitation5), תגובה acrosome (AR; אקסוציטוזה, שחרור של אנזים הפרוטאוליטי acrosome הראש זרע), זרע חדירה מסוג ZP או IPVL, הפריה6,7,8,9,10,11. מדדי פריון לבד אינם מספקים הערכה מדויקת של היכולת המפרה של האוכלוסייה זרע11. מדדים של מספר האירועים שהובילו הפריה של ביצית לאפשר ייצוג הולם של הביצועים של הפרט spermatocytes7.
המתודולוגיה פיתח למדידת תפקוד הזרע הוא בעיקר ספציפית. לדוגמה, זרע העופות, הכדאיות, ניידות, חדירה של IPVL הם הפרמטרים הנפוץ ביותר להערכת זרע באיכות8,11,12. המספר של זרע חי ב השפיכה ממלא תפקיד מכריע להישרדותה של הזרע כי הנוכחות של מספר גדול של הזרע מת ב הזרע משפיע על איכות הזרע. זה מגביר את הייצור של מינים חמצן תגובתי ב הזרע וגורם נזק חמצוני זרע חיים13. זרע ניידות, יכולת השוטוניים תנועת הזרע העופות נגד התנגדות בטמפרטורה של הגוף, ידוע כדי לשחק תפקיד ישיר מביא על הפריה8. היא מבוססת היטב כי ניידות בקורלציה חיובית עם פוריות, ולכן, דטרמיננטה העיקרי של פוריות8. עם זאת, זרע נייד צריך גם את היכולת לעבור על AR לחדור IPVL11. מבחני חדירה IPVL לקחת בחשבון עבור כל זרע המשתתפת בתהליך ההפריה11.
ביישום של אמנות, לפלוט מעובד בדרך כלל על מנת למקסם את הריכוז של זרע באיכות גבוהה, למזער את הריכוז של זרע באיכות נמוכה. לאחר איסוף זרע, יכול להעשיר את הפרופורציה של זרע באיכות גבוהה באמצעות הליכים הפרדת זרע נפוץ בשיטות המחקר והתעשייה. רבים של הליכים אלה פותחו, כל עם הטבות בהתאמה, מגבלות, אך כל לנצל את הטבע הטרוגנית של הזרע כדי לאסוף רק את הזרע עם יכולת גבוהה המפרה. הליכים אלה כוללים שיטות ההעברה זרע, סינון העמודה הדבקות, צפיפות הדרגתיות צנטריפוגה (DGC)14,15,16,17,18,19 , 20. בין הטכניקות הזמינות, DGC נמצאה להיות מאוד פשוטים, הדיר, חסכונית ויעילה לבודד את הסכום המקסימלי של זרע באיכות גבוהה לשימוש באמנות במטרה למקסם את הסיכוי הפריה14 , 15. בנוסף, DGC אינו מזיק קרום תא הזרע. לעומת זאת, שיטות ההעברה זרע לאסוף זרע רק בהדרגה ניידים18,19, אבל כמות הזרע שנאסף הוא נמוך מאוד, שהופך אותו לא יעיל באיסוף כמויות גדולות של זרע18, 20. הדבקות בעמודה סינון יעיל מאוד של סינון הזרע ניידים במיוחד של זרע17; עם זאת, הוא נוטה להיות מזיק זרע ממברנות20,21.
בשיטה DGC, המצע הנפוץ ביותר ליצירת מעבר הצבע צפיפות הוא Percoll, אשר מורכב של סיליקה colloidal חלקיקי מצופה polyvinylpryrolidone. Percoll צפיפות הדרגתיות צנטריפוגה (PDGC) יכול להיות רציף או מקוטע אבל הדרגתי מקוטע משמשת בעיקר לבידוד תשואה גבוהה של זרע ניידים במיוחד13,16,20. ב הדרגתי מקוטע, מדיה צפיפות נמוכה יותר צף מעל מדיה צפיפות גבוהה יותר, יצירת מעבר צבע מגבירה צפיפות מהחלק העליון לחלק התחתון של צינור חרוטי. פעולה זו יוצרת גבולות בין התקשורת שני של צפיפות שונות. היעילות של PDGC נגזרת בשני גורמים: 1) היכולת-חליפת בין 2) הנטייה של תאי זרע בעלי שלמות מבנית גבוהה יש צפיפות מוגברת של תאי זרע בודדים. זרע עם ניידות גבוהה יותר טובים מסוגלים לחצות ממדיה צפיפות נמוכה יותר, לחדור לתוך בתקשורת צפיפות גבוהה יותר. זרע ניידות נמוכה יותר נוטים יותר להיות לכודים על הגבול שנוצר על ידי הממשק בין המדיה של צפיפות שונות. תאי זרע בעלי שלמות מבנית גבוהה וניידות נוטים להיות בעלי צפיפות גבוהה יותר מאשר מת, לא תקין או נמוך תאי זרע ניידים. כאשר כוח צנטריפוגלי מוחל ב PDGC, זה מקל על תנועת הזרע בצפיפויות שונות למקומן המתאים המילוי ההדרגתי.
בפועל כללית, לאחר PDGC מבוצע, בגדר רך של זרע עם פוטנציאל בחלק התחתון של צינור חרוטי גבוה פוריות נאסף, היתרה נמחקת. עם זאת, יש יתרון חקלאות לא מנוצלים של טכניקה זו היא היכולת שלה להפריד בין תאי הזרע לתוך מספר קבוצות מבוסס על ההבדלים באיכות. למטרות מחקר, הפרדת זרע על ידי מידת איכות ניצול הטכניקה PDGC מאפשר לימוד של איכות הזרע כפי שהוא נוגע להבדלים הפיזיולוגיות, metabolomic ופרוטיאומיה מבנית. כאן, אנו שואפים לפרט איך טכניקה זו עשוי לשמש כדי להפריד את הזרע על-ידי איכות, כמו גם להדגים את ההבדלים באיכות, באמצעות צביעת חיוני אאוזין שנקבעו קודם-nigrosin, עבור הכדאיות, Accudenz assay ניידות, זרע-IPVL האינטראקציה assay עבור חדירות.
Access restricted. Please log in or start a trial to view this content.
Protocol
כל השיטות המתוארות כאן אושרו על ידי טיפול בעלי חיים מוסדיים ועל שימוש הוועדה (IACUC) של האוניברסיטה של גאורגיה.
1. שטיפה באמצעות צנטריפוגה מסורתי
- להכין את בופר פוספט (PBS). הוסף 8.0 גר' NaCl, 0.2 גרם אשלגן כלורי, 1.44 g של Na-2-HPO-4 ו- g 0.242פו ח'4 800 מ ל מים מזוקקים (dH2O). להתאים את ה-pH ל 7.4 באמצעות 0.1 N HCl ולהביא את הפתרון 1 ליטר באמצעות dH2O.
- להכין מאגר תנועתיות. להוסיף 6.5 גרם של NaCl, 4.5 גר' גלוקוז, 0.444 g CaCl2 ו- 11.5 g של N - טריס-[hydroxymethyl] חומצה מתיל-2-אמינו-ethanesulfonic (מלון טס) 800 מ של dH2O. להתאים את ה-pH ל 7.4 באמצעות 1 M NaOH ולהביא את הפתרון 1 ליטר באמצעות dH2O.
- פיפטה 0.5 מ של זרע לתוך צינור פוליפרופילן microcentrifuge. מוסיפים 1.0 מ"ל של PBS ומערבבים בעדינות.
- צנטריפוגה ב g x 1,500 10 דקות בטמפרטורת החדר (RT) וזורקים את תגובת שיקוע. Resuspend בגדר זרע עם PBS עד 1.5 מ ל.
- צנטריפוגה ב 1,500 x g 10 דקות ב- RT. Resuspend הזרע גלולה עם תנועתיות מאגר עד 0.5 mL.
2. ביצוע הטכניקה PDGC
הערה: בצע את התהליך כולו של PDGC בטמפרטורת החדר.
- להפוך מ 3.0 ל- 1.08 גרם/mL ופתרונות Percoll 1.07 g/mL שני צינורות נפרדת.
- במבחנה נקי, להוסיף 1.712 מיליליטר 1.13 g/mL Percoll המקורי עד 0.3 מ"ל של 1.5 M NaCl פתרון. מוסיפים 0.988 מ ל dH2O ומערבבים על ידי היפוך עדין לעשות מ 3.0 ל- 1.08 גרם/mL צפיפות פתרון.
- במבחנה נקי, להוסיף 1.482 מיליליטר 1.13 g/mL Percoll המקורי עד 0.3 מ"ל של 1.5 M NaCl פתרון. מוסיפים 1.218 מ ל dH2O ומערבבים על ידי היפוך עדין לעשות מ 3.0 ל 1.07 g/mL צפיפות פתרון.
- במבחנה נקי, לדלל 1.0 מ"ל של זרע מדגם 1:2 מ ל 2.0 ל- PBS. מערבבים בעדינות על-ידי pipetting.
- Pipet מ 3.0 ל הפתרון צפיפות 1.07 g/mL לתוך צינור חרוטי סטרילי 15 מ"ל. בזהירות pipet מ 3.0 ל הפתרון צפיפות 1.08 גרם/mL מתחת הפתרון צפיפות 1.07 g/mL. ודא כי שתי שכבות לא לערבב. לונג-טופס (9 אינץ ') פסטר פיפטה יכול להקל על שלב זה.
- Pipet מ 3.0 ל מדולל זרע מדגם overtop את PDG. כדי להבטיח כי דגימת הזרע לא לערבב עם PDG, להטות בעדינות את צינור חרוטי המכיל את PDG בזווית של 45°. Pipet המדגם לאורך החומה של הצינור ולאפשר לו לזרום דרך צינור ושוב את PDG.
- להכין את שפופרת ריק כדי להתאים את המסה של PDG עם דגימת הלשונית. Centrifuge שני צינורות ב 1500 x g עבור 20 דקות יש מקפידים על מעבר הצבע מקוטע בעת העברת הצינורות מהספסל את האיזון ולאחר מכן לצנטריפוגה.
הערה: אין להשתמש בבלמים בסוף צנטריפוגה. - צפו בתוצאות. ודא כי שלוש שכבות נפרדות זרע נוצר הצינור, כפי שניתן לראות באיור1.
- האחות זרע מבודד שכבות עם פיפטה. לאסוף את השכבה העליונה של זרע קודם, באמצע שכבה שנייה, והאחרונה בגדר קשה בתחתית הצינורית. להעביר לכל נקי, סטרילי פוליפרופילןצינור microcentrifuge.
- לדלל כל מדגם 1.5 מ עם PBS. צנטריפוגה ב g x 1500 למשך 10 דקות.
- יוצקים את תגובת שיקוע. לשקם צניפה זרע עם תנועתיות מאגר מאת pipetting עדין.
הערה: צפיפות אלטרנטיבית עשוי לשמש לצרכים החוקר. לקבוע כמויות החומרים בשימוש עם המשוואה הבאה, איפה v0 נפח של צפיפות מניות פתרון להשתמש, v הוא נפח סופי של הפתרון הרצוי, p הוא צפיפות של פתרון צפיפות הסופי הרצוי ו- p0 היא הצפיפות של צפיפות מניות פתרון: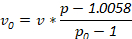
השתמש תמיד mL 0.3 של 1.5 M NaCl בהכנה של צפיפות פתרונות כדי להתאים את NaCl הריכוז של תמיסת מלח פיזיולוגית.
3. קביעת איכות הזרע
- חשב שריכוז הזרע כאמור תיאר22.
- לבצע eosin-nigrosin חיוני מכתים כמו שתואר לעיל12 עם השינויים הבאים:
- להכין µL 100 של פתרון הזרע ריכוז עונה 1 פרק 108 תאים/מ ל....
- Pipet 50 µL של פתרון הזרע צינור פוליפרופילן microcentrifuge המכילים אמצעי אחסון שווה של eosin nigrosin כתם. דגירה את התערובת למשך 5 דקות בטמפרטורת החדר.
- המקום µL 20 טיפת דגימת זרע מוכתם בקצה אחד של זכוכית, למרוח בצורה אחידה באופן דומה לזה המשמש לדם מטושטש. מילה נהדרת השקופיות מרוח בטמפרטורת החדר למשך 3-5 דקות.
- להתבונן על השמצות תחת מיקרוסקופ. לספור את כמות הזרע בשידור חי (ללא כתמים), הזרע מת (מוכתם ורוד) ולחשב את האחוז של זרע בשידור חי.
- לבצע את הבדיקה Accudenz, כאמור תוקף של הזרע עוף, להעריך באופן אובייקטיבי את הניידות זרע8 עם השינויים הבאים:
- Pipet 1.0 מ"ל של 6% assay פתרון לתוך וואקום פוליסטירן, כמופיע באיור2. דגירה עד 41 מעלות צלזיוס.
הערה: 41 ° C משמש כדי להתאים את הטמפרטורה הפנימית של תרנגולת. הטמפרטורה הדגירה צריך להתאים את זה של מערכת הרבייה הנשית של המין נחקר. - כיסוי הפתרון assay טרופה עם 100 µL זרע מדגם-ריכוז של 5 x 108 תאים/מ ל....
- המקום המכיל cuvette בשכבות זרע מדגם ספקטרופוטומטרים. להקליט את הערך ספיגת 550 ננומטר.
- Pipet 1.0 מ"ל של 6% assay פתרון לתוך וואקום פוליסטירן, כמופיע באיור2. דגירה עד 41 מעלות צלזיוס.
- לבצע חדירה-IPVL assay כפי שתואר לעיל11 עם השינויים הבאים:
- לחתוך חתיכה (0.5 ס מ x 0.5 ס מ) של אזור דיסק שאינו נבטי IPVL ללא פגע.
- להתאים את ריכוז הזרע 4 x 106 תאים/מ ל...
- דגירה זרע במאגר תנועתיות עם IPVL ב בקבוקון זכוכית קטן למשך 15 דקות ב 37 מעלות צלזיוס, כמופיע באיור3.
- לטבול את החתיכה IPVL ב 3% NaCl לעצור את האינטראקציה בין IPVL לבין הזרע.
- הר החלק IPVL שקופיות מיקרוסקופ, הכתם עם שיף ריאגנט של 10 דקות לאחר קיבוע עם פורמלין 10% 20 s.
- לבחון את IPVL תחת מיקרוסקופ לזרע מוצלחת חדירה חורים, לספור את כל החורים גלוי לכל 0.25 מ מ2 -40 X הגדלה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
הטכניקה PDGC הביא הפרדה ברורה של שלוש שכבות של זרע על ידי מידת איכות על פני כל הפרמטרים. זרע מפריד לשכבה באיכות גבוהה להלן הפתרון צפיפות גבוהה יותר, שכבה באיכות בינונית בין פתרון צפיפות נמוכה יותר גבוה יותר ובין שכבה באיכות נמוכה מעל התמיסה צפיפות נמוכה יותר. ההבדלים באיכות...
Access restricted. Please log in or start a trial to view this content.
Discussion
פוריות לא רק קובעת את הרווחיות של ייצור בעלי החיים, אלא פועלת גם כאמצעי הברירה הטבעית של מינים לקיום. הפונקציה האולטימטיבי של תא זרע היא להפרות את הביצית. Oviduct של הנקבה בוחרת רק את הזרע בכושר כדי להבטיח הפריה של ביצית23,24. מחקרים במבחנה נחשפו גם מתאם קרוב ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים אין לחשוף.
Acknowledgements
. לא-
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Accudenz | Accurate Chemical and Scientific Corporation, Westbury, NY, USA | AN7050 | |
| Percoll | Sigma-Aldrich, Corp., St. Louis, MO, USA | P7828 | |
| Schiff’s reagent | Sigma-Aldrich, Corp., St. Louis, MO, USA | 3952016 | |
| TES | Sigma-Aldrich, Corp., St. Louis, MO, USA | T1375 | |
| Eosin Y | Sigma-Aldrich, Corp., St. Louis, MO, USA | E4009 | |
| Nigrosin | Sigma-Aldrich, Corp., St. Louis, MO, USA | 198285 | |
| ST 40R Centrifuge | Thermo Scientific, Waltham, MA, USA | 75004524 | |
| DU 530 Life Sciences UV/Vis Spectrophotometer | Beckman Coulter, Brea, CA, USA | No catalogue is found | |
| Olympus IX 71 Inverted Fluorescence and Phase Contrast Microscope | Olympus America Inc., PA, USA | No catalogue is found |
References
- Spargo, S. C., Hope, R. M. Evolution and nomenclature of the zona pellucida gene family. Biology Reproduction. 68, 358-362 (2003).
- Okamura, F., Nishiyama, H. The passage of spermatozoa through the vitelline membrane in the domestic fowl, Gallus gallus. Cell and Tissue Research. 188 (3), 497-508 (1978).
- Henkel, R., et al. Sperm function and assisted reproduction technology. Reproductive Medicine and Biology. 4, 7-30 (2005).
- Reddy, R. P. Artificial Insemination of broilers: Economic and management implications. Proceedings of 1st International Symposium on Artificial Insemination of Poultry. Poultry Science Association. Bakst, M. R., Wishart, G. J. , Savoy, Il. 73-89 (1995).
- Howarth, B. Jr An Examination for Sperm Capacitation in the Fowl. Biology of Reproduction. 3, 338-341 (1971).
- Menkveld, R., Holleboom, C. A. G., Rhemrev, J. P. T. Measurement and significance of sperm morphology. Asian Journal of Andrology. 13, 59-68 (2011).
- Kumaresan, A., Johannisson, A., Al-Essawe, E. M., Morrell, J. M. Sperm viability, reactive oxygen species, and DNA fragmentation index combined can discriminate between above- and below-average fertility bulls. Journal of Dairy Science. 100, 5824-5836 (2017).
- Froman, D. P., McLean, D. J. Objective measurement of sperm motility based upon sperm penetration of Accudenz. Poultry Science. 75, 776-784 (1996).
- Zaneveld, L. J., De Jonge, C. J., Anderson, R. A., Mack, S. R. Human sperm capacitation and the acrosome reaction. Human Reproduction. 6 (9), 1265-1274 (1991).
- Ahammad, M. U., et al. Acrosome reaction of fowl sperm: Evidence for shedding of acrosomal cap in intact form to release acrosomal enzyme. Poultry Science. 92 (3), 798-803 (2013).
- Ahammad, M. U., et al. Maturational changes in motility, acrosomal proteolytic activity, and penetrability of the inner perivitelline layer of fowl sperm, during their passage through the male genital tract. Theriogenology. 76 (6), 1100-1109 (2011).
- Chalah, T., Brillard, J. P. Comparison of assessment of fowl sperm viability by eosin-nigrosin and dual fluorescence. Theriogenology. 50 (3), 487-493 (1998).
- Aitken, R. J., West, K. M. Analysis of the relationship between reactive oxygen species production and leukocyte infiltration in fractions of human semen separated on Percoll gradients. International Journal of Andrology. 13, 433-451 (1990).
- Mortimer, D., Mortimer, S. T. Density Gradient Separation of Sperm for Artificial Insemination. Spermatogenesis. Methods in Molecular Biology (Methods and Protocols. Carrell, D., Aston, K. , Humana Press. Totowa, NJ, USA. 927(2013).
- Qingling, Y., et al. Processing of semen by density gradient centrifugation selects spermatozoa with longer telomeres for assisted reproduction techniques. Reproductive BioMedicine Online. 31, 44-50 (2015).
- Moohan, J. M., Lindsay, K. S. Spermatozoa selected by a discontinuous Percoll density gradient exhibit better motion characteristics, more hyperactivation, and longer survival than direct swim-up. Fertility and Sterility. 64 (1), 160-165 (1995).
- Paulson, J. D., Polakoski, K. L. A glass wool column procedure for removing extraneous material from human ejaculate. Fertility and Sterility. 28, 178-181 (1977).
- Ahammad, M. U., Chiaki, N., Tatemoto, H., Kawamoto, Y., Nakada, T. Utilization of the swim-up migration sedimentation technique to separate viable and progressively motile fowl spermatozoa. World's Poultry Science Association Proceedings. , Cambridge University Press. (2010).
- Lucena, E., et al. Recovery of motile sperm using the migration-sedimentation technique in an in vitro fertilization-embryo transfer programme. Human Reproduction. 4 (2), 163-165 (1989).
- Henkel, R. Sperm Processing for IVF. Clinical Embryology: A Practical Guide. , Springer Science and Business Media. New York, USA. (2013).
- Sherman, J., Paulson, D., Liu, K. Effect of glass wool filtration on ultrastructure of human spermatozoa. Fertility and Sterility. 36, 643-647 (1981).
- Freund, M., Carol, B. Factors affecting haemocytometer counts of sperm concentration in human semen. Journal of Reproduction and Fertility. 8, 149-155 (1964).
- Bakst, M. R., Wishart, G. J., Brillard, J. P. Oviducal sperm selection, transport and storage in poultry. Poultry Science Review. 5, 117-143 (1994).
- Ahammad, M. U., Okamoto, S., Kawamoto, Y., Nakada, T. The effects of regular fluid secretion from the uterus of laying hens on the longevity and fertilization ability of fowl sperm in the oviduct. Poultry Science Journal. 1 (1), 13-22 (2013).
- Ahammad, M. U., et al. Maturational changes in the survivability and fertility of fowl sperm during their passage through the male reproductive tract. Animal Reproduction Science. 128 (1-4), 129-136 (2011).
- Choi, K. H., Emery, D. A., Straub, D. E., Lee, C. S. Percoll process can improve semen quality and fertility in turkey breeders. Asian-Australasian Journal of Animal Sciences. 12 (5), 702-707 (1999).
- Chen, M. J., Bongso, A. Comparative evaluation of two density gradient preparations for sperm separation for medically assisted conception. Human Reproduction. 14 (3), 759-764 (1999).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved