É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Coleção de esperma de qualidade diferencial usando centrifugação gradiente de densidade
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Neste trabalho, pretendemos descrever o desempenho da técnica de centrifugação gradiente de densidade e sua aplicação na investigação de fisiologia de esperma.
Resumo
Na reprodução sexuada, um gameta masculino ou espermatozoide funde-se com um gameta feminino para trazer sobre fertilização. No entanto, um grande número de espermatozoides com capacidade de fertilização é necessárias para interagir com um gameta feminino para garantir a fecundação. Como tal, a capacidade de fertilização dos espermatozoides individuais é fundamental para a reprodução bem sucedida. Centrifugação de gradiente de densidade tem sido utilizada por várias décadas como um método reprodutível, rápido, eficiente, eficaz e extremamente adaptável para recolher o esperma, só alta qualidade para ser usado em tecnologia de reprodução assistida. Os protocolos que descrevemos aqui centrar-se na utilização da técnica de centrifugação gradiente (PDGC) de densidade Percoll descontínua para isolar três populações distintas de esperma do galo por sua qualidade. Fomos capazes de coletar baixo, médio e alta qualidade esperma. Descrevemos também protocolos reprodutíveis que impliquem determinante potencial de fertilidade do esperma, avaliando sua viabilidade, a mobilidade e a penetração. Coleta de esperma por sua qualidade técnica PDGC seria útil com precisão e caracterizar completamente esperma com fertilidade diferencial potencial.
Introdução
Nos vertebrados, gametas masculinos passam por intensa pressão seletiva; Portanto a aptidão reprodutiva de um macho é crucial para alcançar a fecundação bem sucedida. Os machos de qualquer espécie de vertebrados determinado devem ser capazes de produzir espermatozoides em grandes quantidades e de qualidade suficiente para satisfazer as necessidades de fertilização. As células de esperma, para ter uma cabeça de esperma e um flagelo, são as células mais polarizadas no corpo. Eles também são muito heterogêneos na qualidade do esperma (ao vivo e morta, morfologicamente normal e anormal e imóvel, baixa, alta e móvel móvel), que é revelada através da ampla variação na eficiência reprodutiva dos machos. Quanto maior a proporção de espermatozoides de alta qualidade, o menos o número de acasalamentos necessários para com êxito fertilizar o óvulo. No entanto, para alcançar a fertilidade, espermatozoides morfologicamente normais dependem propulsiva forças geradas pelos seus flagelos para chegar ao local da fertilização, bem como para penetrar a zona pelúcida1 (ZP; no caso dos mamíferos) ou perivitelline interna camada2 (IPVL; no caso de aves e répteis) o óvulo após o acasalamento natural ou inseminação artificial (AI). Determinação de esperma qualidade é necessária para uso em técnicas de reprodução assistida3 (arte) e4programas de seleção de machos reprodutores para ser usado no AI. Por outro lado, o sucesso da arte depende unicamente a avaliação precisa da qualidade do esperma. Um número de testes de laboratório foram desenvolvido para determinar as características funcionais de esperma. Os parâmetros mais importantes são a morfologia do esperma, a viabilidade, a mobilidade, a capacitação (aviária esperma não exigem capacitação5), reacção acrossómica (AR; exocitose e liberação de uma enzima proteolítica de acrossoma da cabeça do espermatozoide), esperma penetração de ZP ou IPVL e fertilização6,7,8,9,10,11. Medidas de fertilidade sozinha não fornecem uma avaliação exata da capacidade fertilização de um esperma população11. As medidas dos vários eventos que antecederam a fecundação de um óvulo permitem uma representação adequada do desempenho de espermatócitos individuais7.
A metodologia desenvolvida para medir a função do esperma é principalmente espécie-específicos. Por exemplo, no esperma, aviária, viabilidade, a mobilidade e a penetração de IPVL são os parâmetros mais comuns utilizados para avaliar a qualidade de esperma a8,11,12. O número de esperma vivo na ejaculação desempenha um papel crucial para a sobrevivência do esperma, porque a presença de um grande número de esperma morto no sêmen afeta a qualidade do esperma. Isto aumenta a produção de espécies reactivas de oxigénio no sêmen e causa dano oxidativo para o esperma vivo13. Mobilidade do esperma, a capacidade para o movimento flagelar de esperma aviária contra resistência a temperatura do corpo, é conhecida por desempenhar um papel direto em trazer sobre fertilização8. Está bem estabelecido que a mobilidade é positivamente correlacionada com a fertilidade e é, portanto, um determinante primário da fertilidade8. No entanto, um espermatozoide móvel também deve ter a capacidade de se submeter a um AR e penetrar o IPVL11. Ensaios de penetração de IPVL tem em conta para todo o esperma que participa no processo de fertilização11.
Na aplicação da arte, ejaculação é normalmente processada a fim de maximizar a concentração de espermatozoides de alta qualidade e minimizar a concentração de espermatozoides de baixa qualidade. Após a colheita de sémen, a proporção de espermatozoides de alta qualidade pode ser enriquecida através de procedimentos de separação de espermatozoides comumente usados em práticas tanto a indústria e a investigação. Muitos desses procedimentos têm sido desenvolvidos, todos com os respectivos benefícios e limitações, mas todos utilizam a heterogeneidade de esperma para coletar apenas o esperma com alta capacidade de fertilização. Estes procedimentos incluem métodos de migração de esperma, filtragem de coluna de aderência e densidade gradiente centrifugação (DGC)14,15,16,17,18,19 , 20. entre as técnicas disponíveis, DGC foi encontrada para ser muito simples, repetível, rentável e eficiente no isolamento do montante máximo de espermatozoides de alta qualidade para uso na arte com o objetivo de maximizar a chance de fertilização14 , 15. Além disso, a DGC não é prejudicial para a membrana da célula de esperma. Em contraste, métodos de migração de esperma coletar esperma só progressivamente móvel18,19, mas a quantidade de esperma coletada é muito baixa, tornando-se ineficiente coleta de grandes volumes de esperma18, 20. filtragem de coluna de aderência é muito eficiente na filtragem de espermatozoides altamente móveis de sémen17; no entanto, tende a ser prejudicial ao esperma membranas20,21.
A técnica da DGC, o substrato mais comumente usado para gerar o gradiente de densidade é Percoll, que consiste de partículas de sílica coloidal, revestidas em polyvinylpryrolidone. Percoll centrifugação gradiente de densidade (PDGC) pode ser contínua ou descontínua, mas um gradiente descontínuo é mais comumente usado para isolamento de alto rendimento de espermatozoides altamente móveis13,16,20. Em um gradiente descontínuo, mídia de densidade inferior flutua sobre mídia de densidade mais elevada, criando um gradiente que aumenta a densidade do topo para o fundo de um tubo cônico. Isso cria limites na interface entre os dois meios de densidade diferente. A eficiência de PDGC é derivada de dois fatores: 1) a capacidade de propulsão dos espermatozoides individuais e 2) a tendência dos espermatozoides com alta integridade estrutural para ter um aumento da densidade. Esperma com maior mobilidade é mais capazes de atravessar de mídia de densidade mais baixa e penetrar em uma mídia de densidade mais elevada. Baixa mobilidade de espermatozoides é mais propensos a ficar presas no limite do criado pela interface entre meios de densidade diferente. Espermatozoides com alta integridade estrutural e mobilidade tendem a ter uma maior densidade do que morto, anormais ou baixas espermatozoides móveis. Quando a força centrífuga é aplicada em PDGC, isto facilita a movimentação dos espermatozoides com diferentes densidades para seus respectivos lugares no gradiente.
Na prática geral, depois PDGC é executada, a pelota macia de esperma com alta fertilidade potencial na parte inferior do tubo cónico é coletada, e o restante é Descartado. No entanto, uma vantagem desta técnica subutilizada é sua capacidade de separar as células de esperma em vários grupos, com base nas diferenças de qualidade. Para fins de pesquisa, separação de espermatozoides pelo grau de qualidade, utilizando a técnica PDGC permite para estudo da qualidade do esperma no que tange a fisiológica, metabolómica e proteomic diferenças. Aqui, pretendemos detalhar como esta técnica pode ser usada para separar o esperma pela qualidade, bem como demonstrar estas diferenças de qualidade, utilizando a coloração vital nigrosin-eosina estabelecida anteriormente para viabilidade, ensaio de Accudenz para mobilidade e esperma-IPVL ensaio de interação para penetração.
Protocolo
Todos os métodos descritos aqui foram aprovados pelo Comitê de uso (IACUC) da Universidade da Geórgia e institucional Cuidado Animal.
1. lavar usando centrifugação tradicional
- Prepare a solução de tampão fosfato (PBS). Adicione 8,0 g de NaCl, 0,2 g de KCl, 1,44 g de Na2HPO4 e 0,24 g de KH2PO4 a 800 mL de água destilada (dH2O). Ajustar o pH para 7,4 usando 0.1 N HCl e trazer a solução para 1 L com dH2O.
- Prepare o tampão de motilidade. Adicionar 6,5 g de NaCl, 4,5 g de glicose, 0,444 g de CaCl2 e 11,5 g de N - hidroximetil - metil-2-amino-etanesulfónico ácido (TES) a 800 mL de dH2O. ajustar o pH para 7,4 usando 1 M de NaOH e trazer a solução para 1 L com dH2O.
- Pipete 0,5 mL de sêmen para um tubo de polipropileno microcentrifuga. Adicionar 1,0 mL de PBS e misture delicadamente.
- Centrifugar a 1.500 x g durante 10 minutos à temperatura ambiente (RT) e descartar o sobrenadante. Ressuspender o esperma com PBS até 1,5 mL.
- Centrifugar a 1.500 x g por 10 min a RT. Ressuspender o esperma de pelotas com motilidade buffer até 0,5 mL.
2. executar a técnica PDGC
Nota: Execute todo o processo de PDGC em temperatura ambiente.
- Faça 3,0 mL das soluções de Percoll 1,08 g/mL e 1,07 g/mL em dois tubos separados.
- Em um tubo de ensaio limpo, adicionar 1,712 mL da 1,13 g/mL Percoll original de 0,3 mL de solução de NaCl de 1,5 M. Adicionar 0,988 mL de dH2O e misture gentilmente por inversão tornar 3,0 mL de um 1,08 g/mL de solução de densidade.
- Em um tubo de ensaio limpo, adicionar 1,482 mL da 1,13 g/mL Percoll original de 0,3 mL de solução de NaCl de 1,5 M. Adicionar 1,218 mL de dH2O e misture gentilmente por inversão tornar 3,0 mL de um 1,07 g/mL de solução de densidade.
- Em um tubo de ensaio limpo, dilua 1,0 mL de amostra de sêmen 1:2 com 2,0 mL de PBS. Misture suavemente pipetando.
- Pipetar 3,0 mL da solução de densidade de 1,07 g/mL em um tubo cônico estéril 15 mL. Pipetar cuidadosamente 3,0 mL da solução sob a 1,07 g/mL de solução de densidade densidade 1,08 g/mL. Certifique-se de que as duas camadas não se misturam. Uma forma longa (9 dentro) pipeta Pasteur pode facilitar essa etapa.
- Pipetar 3,0 mL de amostra de sêmen diluído por cima do PDG. Para garantir que a amostra de sêmen não se misturam com o PDG, incline suavemente o tubo cônico contendo o PDG em um ângulo de 45°. Pipeta de amostra ao longo da parede do tubo e deixe-a fluir pelo tubo e sobre o PDG.
- Prepare um tubo em branco para combinar com a massa da PDG com amostra sobreposta. Centrifuga os dois tubos a 1500 x g por 20 min. tenha cuidado para manter o gradiente descontínuo enquanto transfere os tubos do banco para o equilíbrio e depois para a centrífuga.
Nota: Não use o freio no final da centrifugação. - Observe os resultados. Certifique-se que três camadas distintas de sêmen tem formado no tubo, como visto na Figura 1.
- Aspire isolado do sêmen de camadas com uma pipeta. Primeiro a receber a camada superior de sémen, meio segundo de camada e por último o sedimento duro na parte inferior do tubo. Transferência de cada um para um limpo e esterilizado polipropilenotubo de microcentrifugadora.
- Dilua cada amostra a 1,5 mL com PBS. Centrifugar a 1500 x g durante 10 minutos.
- Decantar o sobrenadante. Reconstitua a pelota de esperma com buffer de motilidade pipetando suave.
Nota: Densidades alternativas podem ser usadas para atender às necessidades do investigador. Determinar quantidades de ingredientes utilizados com a seguinte equação, onde v0 é o volume da solução estoque densidade usado, v é o volume final da solução desejada, p é a densidade da solução de densidade final desejada e p0 é a densidade do estoque de densidade solução: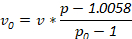
Sempre use 0,3 mL de 1,5 M de NaCl na preparação de soluções de densidade para coincidir com a concentração de NaCl de soro fisiológico.
3. determinar a qualidade do esperma
- Calcule a concentração de espermatozoides como descrito anteriormente22.
- Execute nigrosin-eosina vital de coloração como descrito anteriormente12 com as seguintes modificações:
- Prepare-se 100 µ l de solução de esperma em uma concentração de 1 x 108 células/mL.
- Pipetar 50 µ l de solução de esperma em um tubo de polipropileno microcentrifuga contendo um volume igual de mancha de nigrosin-eosina. Incube a mistura durante 5 min à temperatura ambiente.
- Mancha de lugar um 20 µ l gota de amostra de esperma manchado em uma extremidade de uma lâmina de vidro e espalhar uniformemente de maneira semelhante à utilizada para o sangue. Secar os esfregaço slides em temperatura ambiente por 3-5 min.
- Observe o esfregaço sob microscópio. Contar o número de esperma vivo (sem manchas) e esperma morto (manchadas de rosa) e calcular a porcentagem de espermatozoides vivos.
- Realize o ensaio de Accudenz, como previamente validado para o esperma de frango, para avaliar objetivamente a mobilidade de esperma8 com as seguintes modificações:
- Pipetar 1,0 mL da solução de 6% de ensaio em poliestireno cubetas, como ilustrado na Figura 2. Incubar a 41 ° C.
Nota: a 41 ° C é usado para igualar a temperatura interna de uma galinha. A temperatura de incubação deve corresponder do tracto reprodutivo feminino da espécie a ser investigado. - Sobrepor a solução de ensaio pré-aquecido com 100 µ l de amostra de sêmen em uma concentração de 5 x 108 células/mL.
- Lugar a cubeta contendo sobreposto a amostra de esperma no espectrofotómetro. Registre o valor de absorvância em 550 nm.
- Pipetar 1,0 mL da solução de 6% de ensaio em poliestireno cubetas, como ilustrado na Figura 2. Incubar a 41 ° C.
- Realizar o ensaio de penetração de IPVL como descrito anteriormente11 com as seguintes modificações:
- Corte um pedaço (0,5 x 0,5 cm) da região de disco não-germinativo de IPVL intacto.
- Ajustar a concentração de espermatozoides de 4 x 106 células/mL
- Incube o esperma no buffer de motilidade com IPVL em um frasco de vidro pequeno por 15 min a 37 ° C, conforme ilustrado na Figura 3.
- Mergulhe a peça IPVL em 3% NaCl para parar a interação entre o IPVL e o esperma.
- Montar a peça IPVL em uma lâmina de microscópio e mancha com do reagente de Schiff durante 10 minutos, após fixação em formol a 10% por 20 s.
- Observar o IPVL sob um microscópio para esperma bem sucedida buracos de penetração e contar o número de todos os buracos visíveis por 0,25 mm2 ampliação de 40 X.
Resultados
A técnica PDGC resultou na separação distinta de três camadas de esperma pelo grau de qualidade em todos os parâmetros. Separa o esperma em uma camada de alta qualidade abaixo a solução de densidade mais elevada, uma camada de qualidade média entre o maior e solução de densidade menor e uma camada de baixa qualidade acima a solução de menor densidade. Estas diferenças de qualidade são evidenciadas diferenças claras de viabilidade (Figura 4), mo...
Discussão
Fertilidade não só determina a rentabilidade da produção animal, mas também atua como um meio de seleção natural das espécies para a existência. A função final de uma célula de esperma é fertilizar um óvulo. O oviduto de uma fêmea seleciona somente as mais aptas esperma para garantir a fertilização do óvulo23,24. Estudos in vitro também revelaram uma estreita correlação entre características qualitativas esperma e fertilização suc...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Nenhum.
Materiais
| Name | Company | Catalog Number | Comments |
| Accudenz | Accurate Chemical and Scientific Corporation, Westbury, NY, USA | AN7050 | |
| Percoll | Sigma-Aldrich, Corp., St. Louis, MO, USA | P7828 | |
| Schiff’s reagent | Sigma-Aldrich, Corp., St. Louis, MO, USA | 3952016 | |
| TES | Sigma-Aldrich, Corp., St. Louis, MO, USA | T1375 | |
| Eosin Y | Sigma-Aldrich, Corp., St. Louis, MO, USA | E4009 | |
| Nigrosin | Sigma-Aldrich, Corp., St. Louis, MO, USA | 198285 | |
| ST 40R Centrifuge | Thermo Scientific, Waltham, MA, USA | 75004524 | |
| DU 530 Life Sciences UV/Vis Spectrophotometer | Beckman Coulter, Brea, CA, USA | No catalogue is found | |
| Olympus IX 71 Inverted Fluorescence and Phase Contrast Microscope | Olympus America Inc., PA, USA | No catalogue is found |
Referências
- Spargo, S. C., Hope, R. M. Evolution and nomenclature of the zona pellucida gene family. Biology Reproduction. 68, 358-362 (2003).
- Okamura, F., Nishiyama, H. The passage of spermatozoa through the vitelline membrane in the domestic fowl, Gallus gallus. Cell and Tissue Research. 188 (3), 497-508 (1978).
- Henkel, R., et al. Sperm function and assisted reproduction technology. Reproductive Medicine and Biology. 4, 7-30 (2005).
- Reddy, R. P., Bakst, M. R., Wishart, G. J. Artificial Insemination of broilers: Economic and management implications. Proceedings of 1st International Symposium on Artificial Insemination of Poultry. Poultry Science Association. , 73-89 (1995).
- Howarth, B. An Examination for Sperm Capacitation in the Fowl. Biology of Reproduction. 3, 338-341 (1971).
- Menkveld, R., Holleboom, C. A. G., Rhemrev, J. P. T. Measurement and significance of sperm morphology. Asian Journal of Andrology. 13, 59-68 (2011).
- Kumaresan, A., Johannisson, A., Al-Essawe, E. M., Morrell, J. M. Sperm viability, reactive oxygen species, and DNA fragmentation index combined can discriminate between above- and below-average fertility bulls. Journal of Dairy Science. 100, 5824-5836 (2017).
- Froman, D. P., McLean, D. J. Objective measurement of sperm motility based upon sperm penetration of Accudenz. Poultry Science. 75, 776-784 (1996).
- Zaneveld, L. J., De Jonge, C. J., Anderson, R. A., Mack, S. R. Human sperm capacitation and the acrosome reaction. Human Reproduction. 6 (9), 1265-1274 (1991).
- Ahammad, M. U., et al. Acrosome reaction of fowl sperm: Evidence for shedding of acrosomal cap in intact form to release acrosomal enzyme. Poultry Science. 92 (3), 798-803 (2013).
- Ahammad, M. U., et al. Maturational changes in motility, acrosomal proteolytic activity, and penetrability of the inner perivitelline layer of fowl sperm, during their passage through the male genital tract. Theriogenology. 76 (6), 1100-1109 (2011).
- Chalah, T., Brillard, J. P. Comparison of assessment of fowl sperm viability by eosin-nigrosin and dual fluorescence. Theriogenology. 50 (3), 487-493 (1998).
- Aitken, R. J., West, K. M. Analysis of the relationship between reactive oxygen species production and leukocyte infiltration in fractions of human semen separated on Percoll gradients. International Journal of Andrology. 13, 433-451 (1990).
- Mortimer, D., Mortimer, S. T., Carrell, D., Aston, K. Density Gradient Separation of Sperm for Artificial Insemination. Spermatogenesis. Methods in Molecular Biology (Methods and Protocols. , 927 (2013).
- Qingling, Y., et al. Processing of semen by density gradient centrifugation selects spermatozoa with longer telomeres for assisted reproduction techniques. Reproductive BioMedicine Online. 31, 44-50 (2015).
- Moohan, J. M., Lindsay, K. S. Spermatozoa selected by a discontinuous Percoll density gradient exhibit better motion characteristics, more hyperactivation, and longer survival than direct swim-up. Fertility and Sterility. 64 (1), 160-165 (1995).
- Paulson, J. D., Polakoski, K. L. A glass wool column procedure for removing extraneous material from human ejaculate. Fertility and Sterility. 28, 178-181 (1977).
- Ahammad, M. U., Chiaki, N., Tatemoto, H., Kawamoto, Y., Nakada, T. Utilization of the swim-up migration sedimentation technique to separate viable and progressively motile fowl spermatozoa. World's Poultry Science Association Proceedings. , (2010).
- Lucena, E., et al. Recovery of motile sperm using the migration-sedimentation technique in an in vitro fertilization-embryo transfer programme. Human Reproduction. 4 (2), 163-165 (1989).
- Henkel, R. Sperm Processing for IVF. Clinical Embryology: A Practical Guide. , (2013).
- Sherman, J., Paulson, D., Liu, K. Effect of glass wool filtration on ultrastructure of human spermatozoa. Fertility and Sterility. 36, 643-647 (1981).
- Freund, M., Carol, B. Factors affecting haemocytometer counts of sperm concentration in human semen. Journal of Reproduction and Fertility. 8, 149-155 (1964).
- Bakst, M. R., Wishart, G. J., Brillard, J. P. Oviducal sperm selection, transport and storage in poultry. Poultry Science Review. 5, 117-143 (1994).
- Ahammad, M. U., Okamoto, S., Kawamoto, Y., Nakada, T. The effects of regular fluid secretion from the uterus of laying hens on the longevity and fertilization ability of fowl sperm in the oviduct. Poultry Science Journal. 1 (1), 13-22 (2013).
- Ahammad, M. U., et al. Maturational changes in the survivability and fertility of fowl sperm during their passage through the male reproductive tract. Animal Reproduction Science. 128 (1-4), 129-136 (2011).
- Choi, K. H., Emery, D. A., Straub, D. E., Lee, C. S. Percoll process can improve semen quality and fertility in turkey breeders. Asian-Australasian Journal of Animal Sciences. 12 (5), 702-707 (1999).
- Chen, M. J., Bongso, A. Comparative evaluation of two density gradient preparations for sperm separation for medically assisted conception. Human Reproduction. 14 (3), 759-764 (1999).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados