Method Article
化学抑制剂库筛选 t 细胞受体信号的中介识别
* 这些作者具有相同的贡献
摘要
本文采用基于流式细胞仪的检测方法筛选化学抑制剂文库, 用于鉴定影响 t 细胞受体信号转导的抑制剂及其靶点。此处描述的方法也可以扩展为高通量筛选。
摘要
t 细胞受体 (tcr) 信号通路包括多种介质, 这些介质在 tcr 激活后传输信号。为确定 tcr 信号的新介质, 提出并实施了不同的策略, 这将提高对 t 细胞过程的了解, 包括激活和胸腺选择。我们描述了一种筛选方法, 该方法能够根据胸腺细胞的激活来识别影响 tcr 信号的分子。强 tcr 信号会导致胸腺细胞发育, 从而激活凋亡机制, 这一过程被称为负选择。通过激酶抑制剂的应用, 那些有目标影响 tcr 信号的抑制剂能够覆盖负选择过程。本文详细介绍的方法可用于识别在 tcr 信号通路中具有既定作用的规范激酶抑制剂, 以及在 tcr 信号通路中尚未建立的新激酶抑制剂。本文的筛选策略可应用于高通量较高的屏幕, 用于 tcr 信号中新型可吸毒目标的识别。
引言
t 细胞是淋巴细胞的谱系, 在维持适应性免疫方面发挥着关键作用。他们表达 tcr, 使他们能够识别他们的配体, 复合物组成的一个主要组织相容性复合物分子 (mhc) 与结合肽, 这是在抗原呈现细胞 (apc) 的表面上发现。tcr 信号转导通路通过 tcr/mhc 相互作用的触发对 t 细胞的活化和发育至关重要 1。
在 t 细胞发育过程中, 骨髓造血干细胞 (hsc) 迁移到胸腺, 在胸腺中进行分化并经历 t 细胞谱系进展2的各个阶段。双阳性胸腺细胞, 表达 cd4 和 cd8 受体, 与自肽 mhc 上的自肽 mhc 接触。胸腺细胞与自身的亲和性有一定的亲和力, 其自身的充体成熟, 成为单阳性 (sp) cd4 或 cd8 胸腺细胞, 这一过程被称为阳性选择。相反, 通过自肽 mhc 接受过度 tcr 刺激的胸腺细胞通过阴性选择3,4进行凋亡。这种刺激诱导的、依赖于拉斯帕塞的细胞凋亡的过程可以通过刺激胸腺细胞在体外进行模拟, 例如抗 caspase-dependent 28 抗体涂层珠 5。通过选择过程的成熟 t 细胞被来自周围的 apc 的非自肽 mhc 配体激活。自肽 mhc 仍然与外周 t 细胞相关, 在对生存和稳态增殖的针信号、辅助 t 细胞的分化以及增强 t 细胞对非自肽 mhc 的反应的背景下, 通过共同主义6,7,8,9。高亲和力的 tcr 结合到肽 mhc 配体激活了几个下游信号通路, 其中涉及许多信号分子形成一个复杂的 tcr 信号网络10。tcr 信号通路已经研究了几十年, 然而发现新的途径介质并没有减弱的迹象, 11,12。tcr 信号通路的调节具有临床相关性, 可能涉及免疫治疗应用的 t 细胞反应的增强或对自身免疫13控制的 t 细胞反应的抑制。t 细胞反应的调控策略主要取决于激酶或磷酸酶活性的中断14,15,16。
我们描述了一种基于流式细胞仪的检测方法在筛选小化合物的应用中, 以确保它们能够调节 tcr 信号和 t 细胞活化17。该检测方法取决于胸腺细胞在暴露于强 tcr 信号时激活细胞凋亡途径的现象。该试验具有足够的敏感性, 可识别刺激强度的变化;培养胸腺细胞表达转基因 tcr 与肽/mhc 四聚体以增加亲和力导致 caspase 活性的相应增加, 作为一个测量凋亡反应 5.对于屏幕, 我们使用了激酶抑制剂库, 并评估了它们调节胸腺细胞对强大 tcr 信号的反应的能力。
介绍了几种基于流-细胞仪或基于荧光-报告的策略, 用于对各种 t 细胞亚群中的各种外周激活表型进行高通量筛选。这些策略包括使用基因荧光记者评估 t 细胞活化的时间和大小 18, 使用脱粒作为细胞毒性 t 细胞活性的读数 19,20, 以及分析细胞信号中涉及的各种蛋白质的磷酸化21。
这里提出的筛选分析能够成功地识别抑制 tcr 信号通路规范分子的化合物, 以及对 tcr 信号信号具有抑制作用的潜在的新型化合物。例如, 我们确定 gsk3β和 hsp90 抑制剂为影响 t 细胞反应17的新化合物。该检测方法能够区分由于凋亡反应的降低而干扰信号转导的抑制剂与抑制剂对细胞毒性的 tcr 无关效应。除了诱导细胞凋亡外, 我们还测量 cd69 的诱导和 tcr 下调作为激活的标志物。由于 tcr 信令网络是复杂的, 使用多个读数可以增加发现分子对单一路径有特定影响的机会。在这里, 我们还介绍了在细胞染色过程中使用独立于离心机的协议作为原始协议的高通量替代方案, 为流式细胞仪分析做准备。本文所描述的检测方法采用了少量的激酶抑制剂复合库, 但原则上可用于较高的吞吐量筛选。选择的文库还可以包含各种抑制剂或其他分子。
研究方案
在这项研究中, 使用了6至8周大的雄性和雌性 c57bl 6只小鼠。这些老鼠是在新加坡国立大学 (新加坡) 的动物设施中繁殖的。新加坡国立大学动物护理和使用机构委员会 (iacuc) 批准了所有动物实验。
1. 胸腺细胞悬浮液的制备
- 在二氧化碳室里对老鼠进行安乐死。
- 在组织培养罩中执行后续步骤, 以避免细胞培养物受到任何污染。用针脚将鼠标尸体固定在解剖板上, 并向鼠标喷洒70% 的乙醇。
- 用一把剪刀, 在腹侧做一个垂直切口, 从腹部到下巴。沿着每条后腿做进一步的切口。伸展皮肤, 露出肋骨, 并将其固定下来。
- 用剪刀将隔膜和肋骨的两侧从后端剪下来。提起肋骨笼, 并将其固定下来, 以暴露胸腺。分离附着在胸腺上的结缔组织, 并使用一对弯曲的钳子提取胸腺。
- 将胸腺放入一个6孔板的井, 其中包含5毫升的完整 rpmi 介质。
注: 考虑添加10% 的带字符的胎儿牛血清 (fbs) 培养基, 以提高胸腺细胞的活力, 如果预计在解剖和刺激试验之间的等待时间很长。 - 用注射器的钝器轻轻捣碎胸腺, 并通过70μm 细胞过滤器将细胞穿过。或者, 要在更健康的条件下收集胸腺细胞, 可以考虑使用两对钳子挤压胸腺, 并收集从胸腺上皮流出的胸腺细胞。
- 使用血细胞计或任何自动细胞计数仪进行细胞计数。
2. 激酶抑制剂对无毒浓度的滴定
注: 本节重点介绍准备用于 t 细胞活化屏幕的抑制剂。在高浓度下使用的抑制剂会导致细胞死亡, 这是对 t 细胞激活屏幕的读出。一系列的稀释剂旨在确定不应该诱导细胞凋亡独立于 tcr 刺激的个别抑制剂的最终浓度。本研究中使用的激酶抑制剂库是从外部供应商处购买的。抑制剂的清单包括在材料表中。
-
低浓度激酶抑制剂板的制备
- 在 1 mm 的情况下制备一盘抑制剂, 在所有抑制剂的90μl 二甲基亚硫醚 (dmso) 中加入10μl 的抑制剂。
注: 本研究中使用的小分子库中的抑制剂的库存浓度为 10 mm。如果抑制剂是颗粒形式, 请按照供应商建议的重组步骤进行。如果抑制剂没有在 10 mm 提供, 则以替代适当的浓度制备抑制剂板, 并制备具有适当稀释因子的抑制剂的单独系列稀释。
注意: 在有毒抑制剂的情况下, 请遵循制造商关于安全处理和处置的说明。 - 在 0.1 mm 的情况下制备阻剂板, 在 dmso 中加入 1 mm 抑制剂板中的10μl 抑制剂。
- 在 0.01 mm 的情况下制备阻剂板, 在 dmso 中加入 0.1 mm 抑制剂板中的10μl 抑制剂。
- 在 1 mm 的情况下制备一盘抑制剂, 在所有抑制剂的90μl 二甲基亚硫醚 (dmso) 中加入10μl 的抑制剂。
-
激酶抑制剂治疗胸腺细胞
- 根据第1节准备胸腺细胞悬浮液。
- 将胸腺细胞稀释在完全 rpmi 中, 获得 5 x10 6 细胞的胸腺细胞悬浮液。
- 使用多通道移液器, 将胸腺细胞悬浮液添加到96孔板的所有井中。
- 在每口井中, 从含有 1 mm 抑制剂的板材的相应井中加入2μl 的抑制剂 (抑制剂的最终浓度为 10μm)。
- 在同一板块中, 通过添加 2μl dmso, 制备四口未经处理的控制井、四口5μm 地塞米松处理的阳性对照井和四口经过车辆处理的负控制井。
- 将胸腺细胞孵育 37°c, 5% co2孵化器 17-20小时 (或过夜)。
-
个别抑制剂适当浓度的测定
- 将胸腺细胞板在 300 x g和4°c 下旋转 5分钟, 将细胞重新移植到25μl 的流式细胞仪洗涤缓冲液中。
- 运行流式细胞仪分析样品, 并使用流式细胞仪分析程序对结果进行分析。
- 根据 fsc-ssc 门控确定活细胞的百分比。门控策略如图 1 b 所示。
- 根据 dmso 处理的控件计算活细胞的平均百分比, 这些控件的归一化为100%。设置可接受细胞死亡的任意窗口 (例如, 12.20%)。导致活细胞低于此窗口的百分比的抑制剂 (即低于 dmso处理过的控制的 80%) 将在较低的浓度下再次进行测试。
- 对于未在步骤2.3.4 中通过生存能力标准的抑制剂, 重复步骤 2.2.1-2.3.4, 但使用 0.1 mm 的抑制剂板进行步进2.2.4 而不是含有 1 mm 抑制剂的板。这里使用的抑制剂的最终浓度为1μm。
- 对于仍能在1μm 下产生高水平细胞死亡的抑制剂, 在0.1μm 时测试抑制剂, 重复步骤 2.2.1-2.3.4, 但在 0.01 mm 的情况下, 2.2.4 使用 0.01 mm 的抑制剂板。这里使用的抑制剂的最终浓度为0.1μm。
-
激酶抑制剂的制备
- 对于要在10μm 下使用的抑制剂, 在 10μl dmso 中加入10μl 的 10μl 10 mm 抑制剂。
- 对于在1μm 下使用的抑制剂, 在19μl 的 dmso 中加入1μl 的 10 mm 抑制剂。
- 对于在0.1μm 下使用的抑制剂, 在199μl 的 dmso 中加入1μl 的 10 mm 抑制剂 (图 1c)。
注: 制备的抑制剂库存板是在胸腺细胞悬浮液中添加的预期最终浓度的500x。抑制剂的股票板可以在 pcr 条或96孔板中制备。 - 激酶抑制剂的股票板可应用于胸腺细胞, 以便在传统的离心依赖系统中进行筛选 (第3节; 见图 1a, 方法1和 2), 也可应用于与离心无关的替代系统 (第4节; 见图 1a, 方法 3)。
3. 激酶抑制剂图书馆筛选 (常规离心法分析)
-
激酶抑制剂治疗胸腺细胞
- 根据第1节准备胸腺细胞悬浮液。
- 将胸腺细胞稀释在完全 rpmi 中, 获得 5 x10 6 细胞的胸腺细胞悬浮液。
- 使用多通道移液器, 将200μl 的胸腺细胞添加到96孔板的每一口井中。把盘子放在冰上。
- 从第2.4 节制备的抑制剂板的相应井中加入0.5μl 的抑制剂。
- 准备8口未经处理的控制井。通过添加0.5μl 的 dmso, 准备四口经过车辆处理的控制井。准备四口5微米地塞米松处理控制的井 (图 2)。
-
抗 cd驻28微珠刺激胸腺细胞
- 取1毫升珠子, 用2毫升的 pbs 清洗珠子。使用磁性支架分离珠子, 并吸入溶液。将珠子重新用于5毫升的完整 rpmi 中。
注: 珠子与细胞的比率为1比2.5。根据要刺激的井的数量和使用的胸腺细胞的数量, 调整要吃的珠子的数量。 - 在每个经抑制剂处理的样品、4个 dmso 处理的样品和8个未经处理的样品中添加50μl 珠子。在剩余的四口未经处理的油井中加入50μl 的完整 rpmi。图 2显示了板材的总体布局。
- 使用多通道移液器混合井的内容物。
- 将胸腺细胞孵育 37°c, 5% co2孵化器 17-20小时 (或过夜)。
- 取1毫升珠子, 用2毫升的 pbs 清洗珠子。使用磁性支架分离珠子, 并吸入溶液。将珠子重新用于5毫升的完整 rpmi 中。
-
表面抗原的染色
- 制备含有抗 tcrβ、抗 cd4、抗 cd8 和抗 cd69 抗体的抗体染色混合物。在 facs 洗涤缓冲液中稀释抗体 (pbs 补充0.5% 的牛血清白蛋白 [bsa]), 比例为 1:200 (v/v)。
注: 考虑优化用于染色的抗体滴度, 而不是使用固定抗体稀释剂, 以最大限度地减少不同实验中染色的变化, 并提高信噪比。 - 将板材旋转到300 x g和 4°c, 5分钟。
- 轻扫板以丢弃溶液。
- 此时, 该协议可以遵循传统的与离心相关的协议 (继续执行步骤 3.3.5; 参见图 1a, 方法 1) 或与离心有关的替代协议 (继续执行步骤 4.4.4; 请参见图 1a, 方法2)。
- 在步骤3.3.1 制备的染色抗体混合物的75μl 中重新移植细胞。
- 用多通道移液器混合样品, 在冰上孵育 3 0分钟。
- 制备含有抗 tcrβ、抗 cd4、抗 cd8 和抗 cd69 抗体的抗体染色混合物。在 facs 洗涤缓冲液中稀释抗体 (pbs 补充0.5% 的牛血清白蛋白 [bsa]), 比例为 1:200 (v/v)。
-
固定细胞
- 用200μl 的流式细胞仪清洗井, 在 300 x g和4°c 下旋转板, 5分钟。
- 轻扫板以丢弃溶液。
- 加入固定-渗透缓冲液 (随活性酪蛋白-3 凋亡试剂盒一起; 与步骤3.5.1 中提到的 10倍 perm/dhuthasuber 和步骤3.5.2 的抗 caspase-3 抗体相同), 每口200μl。
- 在冰上孵化30分钟。
-
活性酪蛋白3的细胞内染色
- 在45毫升的超纯水中稀释5毫升的 10x perm/wash 洗涤缓冲液, 制备 1x perm从洗缓冲液。
- 在 1x perm2 洗缓冲液的 6.5 ml 中加入 1.3 ml 抗卡斯帕塞-3 抗体, 制备细胞内活性酪蛋白酶染色。抗体与洗液缓冲液的比例为1:5。
- 将板材旋转到 300 x g和 4°c, 5分钟内滑动板丢弃溶液。用 1x perm1 洗缓冲液清洗板200μl。
- 重复步骤3.5.3。
- 将板材旋转到 300 x g和 4°c, 5分钟内滑动板丢弃溶液。在所有井3.5.2 加入步骤制备的细胞内酪蛋白酶染色75μl。
- 用多通道移液器混合样品, 在冰上孵育1小时。
- 用200μl 的 1x perm/washkashbashbashel 清洗样品, 并在 300 x g和4°c 下旋转板, 时间为5分钟。
- 轻扫板以丢弃溶液。用 1x perm1 洗缓冲液清洗板200μl。将板材旋转到300 x g和 4°c, 5分钟。
- 轻按板材丢弃溶液, 然后在200μl 的流式细胞仪洗涤缓冲液中重新悬浮样品。
- 运行样品的流式细胞仪分析, 并使用流式细胞仪分析程序对结果进行分析。
- 使用 cd4与cd8 图, 在 dp 胸腺细胞的种群上进行门, 并有 cd4 和 cd8 的阳性表达 (图 2, 下半部分)。在 dp 胸腺细胞门内, 以无刺激样品为阴性对照, 地塞米松为阳性对照, 测定活化卡斯帕西-3 细胞的百分比。为分析 cd69 在 dp 胸腺细胞门中的表达, 以未受激样本为阴性对照, 以受激样本为阳性对照。
注: 在 dp 胸腺细胞上浇注时, 验证单个样本的 dp 胸腺细胞的数量是否正确地门控。被刺激的细胞向下调节表面受体, 如果使用紧密的 dp 门, 可能会意外排除事件。
4. 激酶抑制剂图书馆筛选 (离心独立检测)
-
激酶抑制剂治疗胸腺细胞
- 根据第1节准备胸腺细胞悬浮液。
- 稀释完全 rpmi 中的胸腺细胞, 获得 25 x10 6 细胞的胸腺细胞悬浮液。
- 使用多通道移液器, 将胸腺细胞加入 40μl, 加入小体积板的每口井中。把盘子放在冰上。
- 将总盘、dmso 和地塞米松中的抑制剂稀释为完全 rpmi, 比例为全 rpmi 的四个部分, 与抑制 dmsow-地塞米松 (稀释系数为 5) 的比例。
注: 由于这个小体积板使用的体积比传统方法小 5倍, 抑制剂和控制试剂在加入板的胸腺细胞之前被稀释了五倍。 - 从步进4.1.4 制备的阻托板相应井中, 在96孔板中加入0.5μl 的抑制剂。
- 准备8口未经处理的控制井。通过添加步进4.1.4 制备的 dmso 的 0.5μl, 准备四口经过车辆处理的控制井。准备四口5微米地塞米松处理控制, 使用步骤4.1.4 制备的稀释地塞米松 (图 2)。
-
抗 cd驻28微珠刺激胸腺细胞
- 确保珠子均匀地重新悬浮。取1毫升珠子, 用2毫升的 pbs 清洗。使用磁性支架分离珠子, 并吸入溶液。将珠子重新用于1毫升的完整 rpmi 中。
注: 珠子与细胞的比率为1比2.5。根据要刺激的井的数量和使用的胸腺细胞的数量, 调整珠子的数量。 - 在每个经抑制剂处理的样品、4个 dmso 处理的样品和8个未经处理的样品中添加10μl 的珠子悬浮液。在剩余的四口未经处理的油井中加入10μl 的完整 rpmi。图 2显示了一般的板布局。
注: 井的最终体积为 50μl, 在井的最大容量范围内。重要的是要谨慎行事, 并保持板直立, 以避免交叉井溢出。 - 要混合, 使用微板轨道振动台搅拌板。或者, 使用多通道移液器混合井的内容物。
- 用抗蒸发盖将胸腺细胞孵育 37°c, 5% co 2 孵化器 17-20小时 (或过夜)。
- 确保珠子均匀地重新悬浮。取1毫升珠子, 用2毫升的 pbs 清洗。使用磁性支架分离珠子, 并吸入溶液。将珠子重新用于1毫升的完整 rpmi 中。
-
板式垫圈的设置
注: 设置板式垫圈的说明由制造商提供。下文简要介绍了这些步骤。每个启动步骤大约需要150毫升的解决方案。- 用含有1% 特温20的70% 乙醇清洗系统。
- 用含有1% 补间20的去离子水清洗系统。
- 使用流式细胞仪清洗缓冲液提供清洗系统。
-
表面抗原的染色
- 制备含有抗 tcrβ、抗 cd4、抗 cd8 和抗 cd69 抗体的抗体染色混合物。以 1:100 (v2) 的比例稀释流式细胞仪洗涤缓冲液中的抗体。
- 清洗板 9x, 使用55μl 的流式细胞仪清洗缓冲液每次清洗, 使用自动层流清洗系统。
注: 在洗涤结束时, 每口井的剩余体积为25μl。 - 在步骤4.4.1 制备的染色抗体混合物中, 将细胞重新移植到25μl 中。
- 如果样品从96孔板 (从步骤 3.3.4) 转移, 将细胞重新悬浮在步骤3.3.1 制备的抗体混合物50μl 中, 然后将样品转移到小体积板。此步骤对应于方法编号 2, 如图 1 a所示。
- 要混合, 用微板轨道振动台搅拌板, 或使用多通道移液器混合样品, 并在冰上孵育 3 0分钟。
-
固定细胞
- 清洗板 9x, 使用55μl 的流式细胞仪清洗缓冲液每次清洗, 使用自动层流清洗系统。
- 加入固定-渗透缓冲液 (随活性酪蛋白-3 凋亡试剂盒一起; 与步骤4.6.1 中提到的 10倍 perm/dhuthasuber 和步进4.6.2 的抗卡斯帕塞-3 抗体相同), 每口每口50μl。
- 在冰上孵化30分钟。
-
活性酪蛋白3的细胞内染色
- 在225毫升的超纯水中稀释25毫升的 10x perm/wash 洗涤缓冲液, 制备 1x perm从洗缓冲液。
- 在 1x perm2 洗缓冲液的2毫升中加入 1 ml 抗卡斯帕塞-3 抗体, 制备细胞内活性酪蛋白酶染色。抗体与洗液缓冲液的比例为1:2。
- 使用 1x perm·洗涤缓冲液来冲洗系统。
- 用1x 的 perm/洗净缓冲液清洗板 9x, 每次清洗时为55μl。
- 在所有井4.6.2 加入步骤制备的细胞内酪蛋白酶染色25μl。
- 要混合, 用微板轨道振动台搅拌板, 或使用多通道移液器混合样品, 在冰上孵育1小时。
- 用1x 的 perm/洗净缓冲液清洗板 9x, 每次清洗时为55μl。
- 在所有井中添加25μl 的流式细胞仪洗涤缓冲液。
- 通过移液充分混合后,将样品转移到微滴管中。
- 在气井中加入50μl 的流式细胞仪洗涤缓冲液, 并重复步骤4.6.9。
- 重复步骤 4.6.9, 4.6.10 2x, 直到在微滴定管中采集200μl 的样品。
注: 步骤4.6.10 和4.6.11 中描述的过程的目的是确保细胞从小体积板中得到最大程度的恢复。如果不考虑细胞数量, 在4.6.10 步骤后, 只需使用流式细胞仪洗涤缓冲液将微滴管加满200μl 即可。 - 按照3.5.11 的步骤, 对样品进行流式细胞仪分析, 并使用流式细胞仪分析程序对结果进行分析。分析了含有 cd4+cd8+dp 胸腺细胞的闸门中的里海-3 活化和 cd69 表达。
结果
图 1 a总结了筛选方法。首次筛选激酶抑制剂对胸腺细胞活力的潜在影响。地塞米松作为细胞凋亡的阳性对照, 被用作原凋亡剂。活细胞群体的门控是根据未经治疗的阴性对照和地塞米松治疗的阳性对照确定的 (图 1b)。在胸腺细胞上首次用10μm 对抑制剂进行检测, 孵育18小时后测定活细胞的百分比。选择了20% 的细胞死亡窗口, 以便在较低浓度的情况下测试导致活细胞门细胞损失大于20% 的化合物 (图 1b)。选定的抑制剂处理样品的代表性流式细胞仪图可以说明可行性测定。ry294002 (2-(4-吗啡基)-8-苯基-4h-1-苯甲酯----1;cas 15447-36-6), 一种 pi3k 抑制剂22, 并没有显著增加细胞死亡在 10μm, 并且该抑制剂在10μm 用于随后的检测。CAY10626 (n-[二甲胺) 乙基]-n-甲基-4-[[[[4-[4-(4----吗啡基)-7-(2, 2, 2-三氟乙基)-7h-pyrrolo[2,3-d] 吡啶-2-基] 苯基] 氨基] 氨基]-苯胺;cas 1202884-94-3) 是 pi3kα-mtor23的双重抑制剂, 在10μm 和1μm 时引起高浓度的细胞死亡, 但在0.1μm 时不引起高水平的细胞死亡, 0.1μm 被确定为适用于下游检测的合适浓度。Staurosporine (2, 3, 10, 11, 12, 13-六氢-10r-甲基-11r-甲胺-913r-环氧-diindolo[1,2,3-gh;3',2',1'-lm]pyrrolo[3,4-j][1,7]benzodiazonin-1;cas 62996-74-1) 是一种具有诱导细胞凋亡24的既定能力的泛蛋白激酶 c 抑制剂,在所有检测浓度下, 即使在0.1 微米时也能导致明显的细胞死亡。它被用于随后的0.1μm 的检测中, 作为额外的阳性对照。
最终浓度的抑制剂选择的基础上, 最高浓度, 其中他们不放大细胞死亡超过20% 的 dmso 处理的样本。在确定了抑制剂的最终浓度后, 制备了一个库存的抑制剂板, 使所有抑制剂在应用于细胞时的浓度都是细胞的500倍。图 1c说明了股票板块的板块布局, 以及抑制剂的最终浓度。在将细胞直接孵育在小体积板中进行层流洗涤试验的替代方案中, 小体积的使用需要进一步稀释抑制剂。为确保抑制剂添加后培养物的 dmso 含量不会对细胞过高, 抑制剂在完全 rpmi 中进一步稀释, 稀释系数为 5, 因此在应用于细胞时, 它们的浓度是预期浓度的100倍。细胞。
将稀释为无毒浓度的抑制剂用于 tcr 刺激诱导胸腺细胞凋亡的检测 5,17。在 cd4 + 和 cd8 + dp 胸腺细胞群中, 用抗 cdhn/cd28珠进行了18小时的刺激 , 并对细胞进行染色, 使其激活为 caspase-3 (图 2)。与非受刺激样品相比, 抗 cdn/cd28 受刺激和 dmso-mt 处理的抗 cd 受刺激样品均增加了帕西-3 激活和 cd69 表达, 并出现了 tcr 下调。地塞米松处理的样品表明, 与 cd69 增强的不一样, 酪菌素-3 的活化程度增加, 预计凋亡诱导效应与 tcr 刺激无关。
图 3a总结了选定抑制剂的库筛选分析结果。caspase-3 激活和 cd69 都可以用来识别由于表达抑制而产生兴趣的潜在抑制剂。正如所料, tcr 信号的规范介质抑制剂在屏幕上显示为正命中。这些抑制剂表现出不同程度的抑制作用, 包括针对多种激酶的广谱抑制剂, 以及更具体的抑制剂。一些抑制剂能够抑制 caspase-3 激活和 cd69 提高 (图 3b, 上行, 左面板)。其中一种抑制剂是双丁丁基马来酰亚胺 ii ((1H-因多醇-3-基)-4-[1-[1-[1-(1-2-吡咯烷基) 乙基]-1h-立多醇-3-基]-1 h-pyrrolle-2-二酮;cas 137592-45-1), 除蛋白激酶 a 和 pdk1 25、26、27外,还能抑制所有蛋白激酶c等形式。这一类别的另一个抑制剂是 CAY10657 (3-[(氨基氨基甲酯) 氨基]-5-[4-(4-甲磺酰甲基) 苯基]-2-硫苯甲酰胺;cas 494772-86-0), ik228的拟议抑制剂。
有一些化合物抑制 cd69 的预凝, 但没有损害 caspase-3 激活 (图 3b, 顶行, 右面板)。ky10626, pi3kα和 mtor23 抑制剂,以及 u-0126 (2, 3 bis[amino[(2-氨基苯基) 乙基]-丁二腈;cas 109511-58-2) 是一种 mek 抑制剂29, 是一些已确定的抑制剂。结果表明, 不同的抑制剂针对不同的激酶从特定分支的 tcr 信号转导途径, 特别是那些针对后期激酶, 可以导致选择性损害 t 细胞活化现象。
也有一些抑制剂, 没有抑制 cd69 upregulation 和 caspase-3 激活 (图 3b, 下行, 左面板)。紫杉醇 (β-(苯甲氨基)-α-羟基苯丙酸, (2ra, 4a, 6ra, 6ra, 9ra, 11, 11, 4s.12, as2-6, 12, bs")-6, 12b-之二 (乙酰二氧基)-12-(benzoylolol xy)-2, 4, 4, 4, 4, 6, 6, 1, 11, 112, 十二 b-十二氢, 4, 000, 13 13-四甲基-5-os-7, 11-甲醇-cyclodeca[3,4]benz[1,2-b] 氧-9-乙酯;cas 33069-62-4), 微管动力学30和铁沙定蛋白 5 (2-[3, 4, 5, 6, 7, 8-六氢-3-(4-甲氧基苯基)-4-oxo[1]benzothieno[2,3-d] 吡啶-2-基] 硫苯腈的干扰物;cas 337349-54-9) 是 rip1 激酶31的抑制剂, 是被确定属于这一类的两种抑制剂。在这种情况下, cd69 upre假定和酪菌素-3 激活没有受损, 这可能是由于抑制剂不针对 tcr 信号通路的相关激酶。
如前所述, 在屏幕上使用了 stauro研, 浓度仍然诱导胸腺细胞凋亡。如预期的那样, 经石孢菌素处理的样品显示出高水平的酪蛋白酶-3激活 (图 3b, 下一行, 右列)。cd69 表达水平低可归因于足孢菌素介导的 pkc 抑制, 而另一种泛 pkc 抑制剂双丁烯基马来酰亚胺 ii 也抑制了 cd69 的表达。另外, 同时, 斯陶丝波林诱导细胞凋亡, 然后才能够提高 cd69 的表达。
为了提高协议的吞吐量和自动化程度, 编写了并行协议, 其中涉及通过层流使用自动板材清洗系统。对使用这种自动洗板装置的两种独立的协议进行了试验, 并与传统的96孔板培养细胞的方法进行了比较, 并在与离心相关的协议中对细胞进行了染色。一种方法是按照标准程序将细胞培养成96孔板, 然后将细胞转移到与自动板材垫圈兼容的板材中, 用于染色步骤 (图 4, da-wing 样品)。另一种方法是直接在与洗板兼容的板中培养细胞, 并继续在同一板上使用染色协议 (图 4, da-gening 样品)。与传统的离心相关协议相比, 与传统的离心相关协议相比, 与传统的离心相关协议相比, 与传统的离心相关协议相比, 与传统的离心相关协议相比, 在不同样本中, 与离心无关的协议在活性酪蛋白-3、cd69 或 tcrβ染色方面没有太多可感知的差异 (图 4)。染色强度的差异可归因于在染色步骤中使用浓度略有不同的抗体。
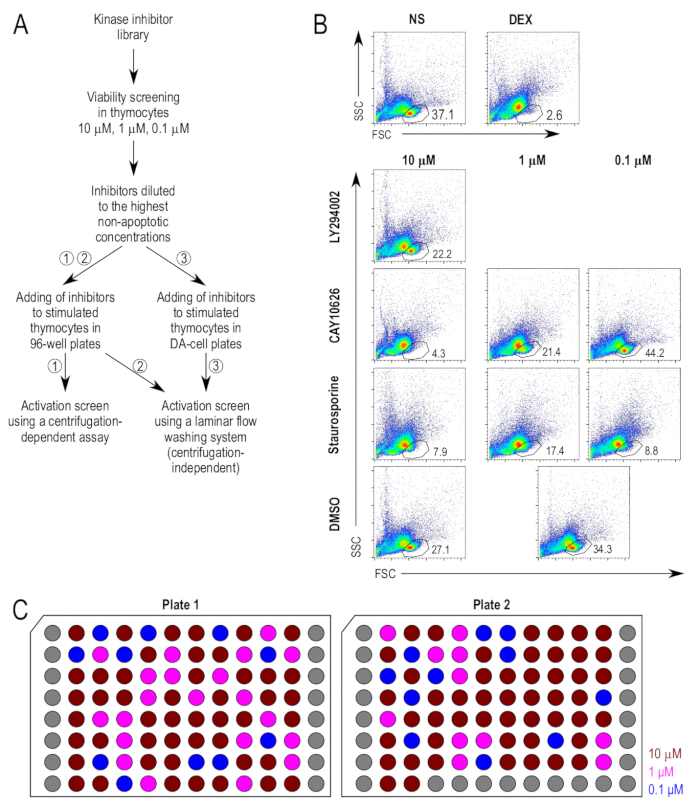
图 1: 胸腺细胞活力用抑制剂治疗后的活力.(a) 筛选试验主要步骤的实验大纲。在活化试验中使用的胸腺细胞的刺激和染色有三种方法, 即 (1) 在标准96孔板中培养胸腺细胞, 然后使用传统的离心协议进行染色, (2)在标准的96孔板中培养胸腺细胞, 然后使用与离心无关的洗涤协议进行染色, (3) 在小体积板中培养胸腺细胞, 然后用与离心无关的洗涤协议。(b) 可行性检测中使用的分注策略。活细胞门来源于前向散射 (fsc) 和侧向散射 (ssc) 图, 如前面所述的17。在被检测浓度下被认为毒性过大的抑制剂会受到浓度低10倍的进一步可行性检测。显示了具有代表性的抑制剂处理样品。请注意用于1μm 和0.1μm 样品的常用控制 (dmso 处理 [dmso])。(c) 稀释抑制剂的板材布局。在 dmso 中稀释到浓度为预期最终浓度500x 的抑制剂板的示意图。每口井都代表一个独特的抑制剂;灰色的井是空的。所显示的浓度是添加到细胞培养物中的最终浓度, 即 10μm (暗红色)、1μm (紫红色) 和 0.1μm (蓝色)。请点击这里查看此图的较大版本.
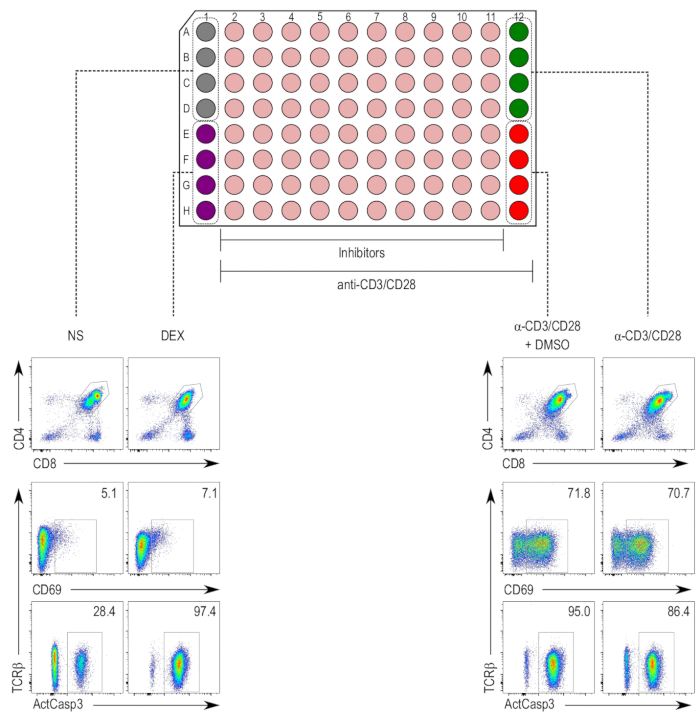
图 2: 胸腺细胞活化法的平板布局.(上图)第1列和第12列保留给控件, 而第2至第11列是经过抑制的样本 (米色)。负对照 (无受激 [ns]; 灰色) 占据 a1 至 d1 井, 对细胞死亡的阳性对照 (地塞米松处理 [dex]; 紫色) 占据 e1 至 h1 井。第2至第12列含有抗 cdh/cd28 微珠刺激的胸腺细胞。胸腺细胞活化的阳性对照 (受刺激样本 [α-cdcdi/cd28; green) 占据 a12 至 d12 井, 车辆控制 (受激和 dmso 处理 [α-ccd28 + dmso]; 红色) 占据 e12 至 h12 井。(底部)双阳性 (dp) 门内胸腺细胞的活性囊-3 (actcask3)、cd69 和 tcrβ染色流式细胞仪。显示了不同控件的代表性图。ns = 未受刺激;dex = 地塞米松处理的样品;α-cdh-cd28 + dmso = 用 cdcd28 包覆珠子刺激并经 dmso 处理的样品;α-cdi-cd28 = 用 cdcd28 涂层珠子刺激的样品。请点击这里查看此图的较大版本.
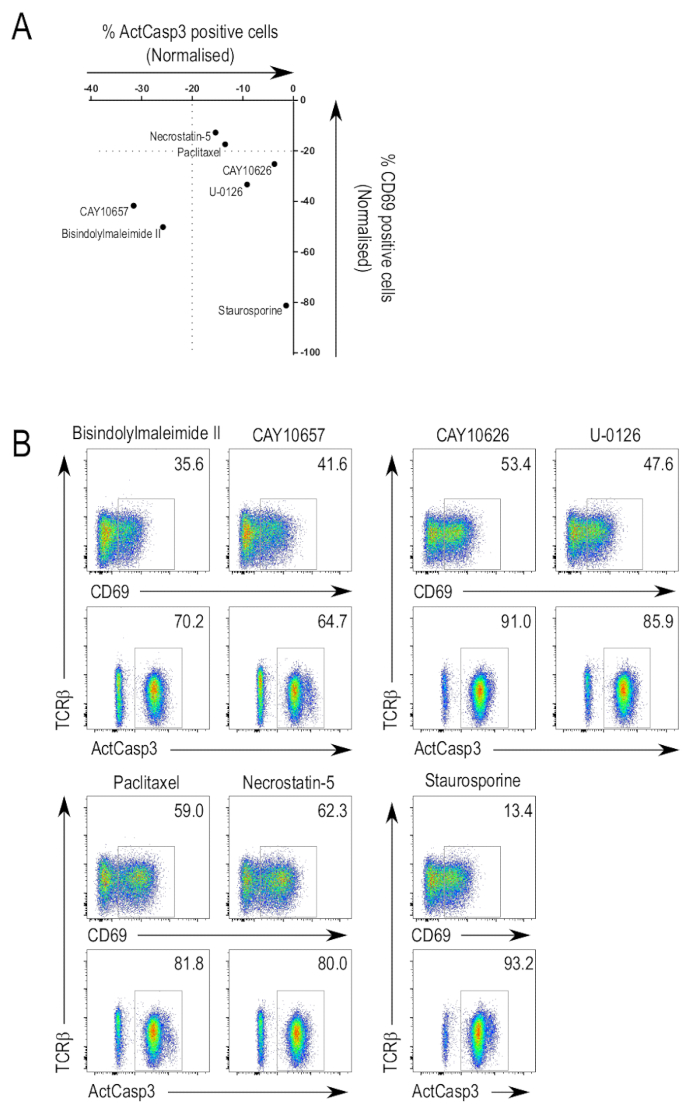
图 3: 筛选胸腺细胞活化抑制剂库.(a) 活化分析的汇总数据。这些是一个有代表性的实验的结果, 显示了细胞的归一化值与激活的酪蛋白酶-3 和 cd69 表达的选定抑制剂。通过将活性-卡斯派斯3阳性或 cd69 正门中的细胞百分比与 Normalization 处理的控件的值进行比较, 该值在图形中设置为0。(b) 选定的外地资产管制图。流式细胞仪的抑制剂, 抑制国际公约-3 活化和 cd69 上吸 (左上角), 抑制 cd69 上吸 (右上角), 或对 caspase-3 活化和 cd69 upre葡萄 (左下角) 没有影响。通过对石孢菌素处理样品的研究, 说明了在有毒浓度 (右下角) 使用抑制剂的效果。请点击这里查看此图的较大版本.
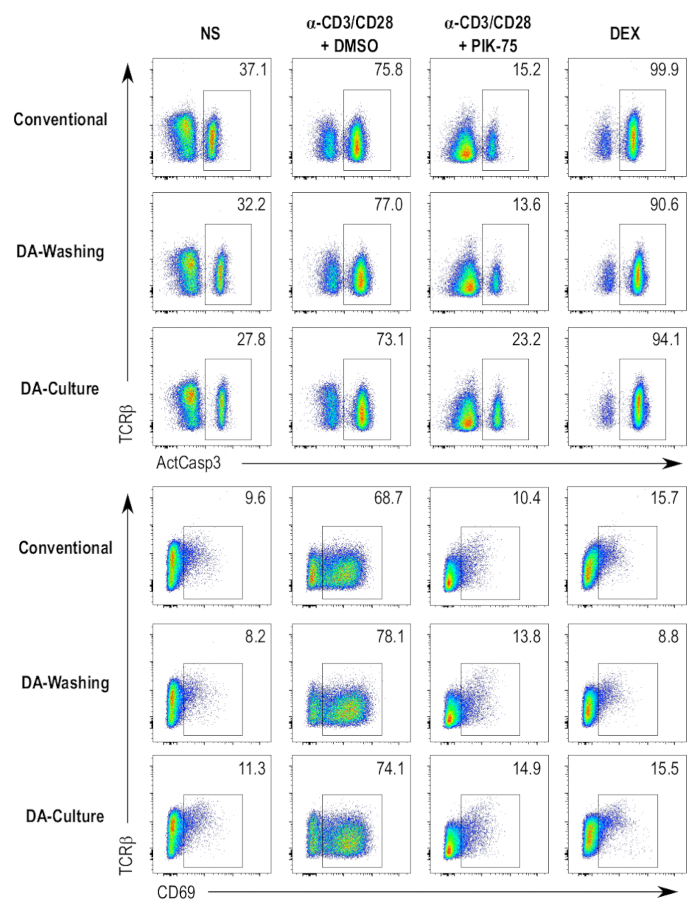
图 4: 比较不同的检测方案.根据三种不同的检测方案, 对 dp 胸腺细胞的活性酪细胞素-3 (actcas3)、cd69 和 tcrβ染色进行流式细胞仪测定。测试了四种不同的条件, 即阴性对照 (非受激 [ns])、细胞死亡阳性对照 (地塞米松处理 [dex])、车辆控制 (α-cdcd28/dmso 处理 [α-cdcg28 + dmso]) 和抑制剂处理)样本 (受刺激和 pik-75 处理 [α-cdh-cd28 + pik-75])。常规 = 在标准96孔板中培养胸腺细胞, 并采用传统的离心协议染色;da-wing = 在标准96孔板中培养胸腺细胞, 并使用层流清洗协议进行染色;da 培养 = 在小体积板中培养胸腺细胞, 并使用层流洗涤协议在相同的板中染色。 请点击这里查看此图的较大版本.
讨论
这里提出的筛选策略评估小分子抑制剂在刺激后抑制胸腺细胞凋亡作用的能力, 以及更传统的 t 细胞激活标记-cd69 可抑制和 tcr 下调.还可以包括其他标记, 以便能够分析不同的胸腺细胞亚群 32.目前的分析的一个有趣的方面在于, 阻碍 tcr 信号的抑制剂也会抑制细胞凋亡的诱导, 进一步突出了这些抑制剂可能对诱导细胞死亡产生的 tcr 独立作用的区别。此外, 基于流式细胞仪的检测允许使用多个读数作为不同的激活标记, 这可以报告抑制剂对 tcr 信号的单独分支的影响。在这里介绍的情况下, 有抑制剂显示差异抑制酪蛋白酶-3 激活和 cd69 uprec0假定。由于某些化合物可能会影响室内管理功能, 如蛋白质合成或水泡贩运, 因此观察到新合成标记 (如 cd69) 对重新合成标记 (如cd69) 的影响并不奇怪, 但对翻译后的影响并不重要。修饰 (例如,酪蛋白酶-3 的蛋白溶解性活化).
由于这里介绍的检测是将细胞凋亡作为读数, 因此, 抑制剂的潜在毒性作用必须不掩盖结果。例如, 在屏幕上, 我们没有稀释超过 1 nm 的菌黄素, 尽管它在这种浓度下对细胞仍然有毒。有代表性的结果与斯陶尔孢菌素是一种交交激酶抑制剂和细胞凋亡的诱导剂33一致.如果不充分稀释测试到无毒浓度的化合物, 就有可能忽视潜在的打击。
这里详细介绍的筛查策略将很难适用于人类, 因为与获得足够数量的胸腺细胞进行高通量筛选有关的并发症。然而, 它是可能的获得人类胸腺样本从小儿心脏活检 34,35或从胎儿36,37。然而, 由于 tcr 信号通路和信号蛋白的氨基酸序列在很大程度上在小鼠和人类之间是保守的, 胸腺细胞检测提供了一个有用的初步筛选策略, 并使用小鼠使用该检测获得的任何结果胸腺细胞, 然后, 可以在人类原代淋巴细胞中得到证实。
传统的依赖离心的协议的一个局限性涉及细胞丢失的前景, 这可归因于过程的多步骤性质, 其中涉及细胞渗透和离心等步骤。每个离心和再悬浮步骤不可避免地导致细胞的丢失。虽然这种损失对于涉及数量有限的样本的研究可能并不重要, 但在应用于高通量筛选时, 特别是在检测格式从96-384-1536 井逐步进入的情况下, 可能会带来问题。解决这一问题的一种方法是使用细胞渗透荧光 caspase 传感器38 , 该传感器能够检测到酪蛋白的激活, 同时避免细胞渗透和多次清洗的并发症 5。或者, 采用与离心无关的方法通过层流清洗细胞也是可能的, 以最大限度地减少细胞损失。有了一个自动的盘子清洗站和一个无壁的盘子, 细胞就可以用层流清洗, 而不用离心机。试剂的指数稀释允许在不到3分钟的时间内彻底有效地冲洗细胞, 这代表了相当于两轮离心清洗的稀释。在没有离心引起的外部应力的情况下, 细胞更有活力, 细胞损失最小化。
我们还探讨了在96井 u 底板培养胸腺细胞后使用自动板材清洗站的可能性, 以及直接在与自动板材清洗站兼容的无壁板中培养细胞的可能性。在无壁板中培养细胞, 消除了所有离心步骤, 并通过消除了在板上进行样品转移的需要, 最大限度地减少了细胞丢失。一般来说, 这三种不同的协议在刺激效率和染色方面都是可比的。自动清洗站提供了自动化、速度和效率的优势, 使其更容易进行高吞吐量分析。此外, 随着自动化程度的提高, 清洗步骤可以更快地进行, 实验或实验者之间也有更大的一致性。但是, 洗涤站也有一定的缺点: 洗衣机启动需要大量的洗涤缓冲液 (每缓冲液更换150毫升, 其中50毫升用于洗涤);在处理板材时需要格外小心, 以避免由于小体积板材井间的有限分配而造成的井的任何交叉污染;清洗后在井中的残留缓冲液为 25μl, 因此必须使用浓度高于1x 的试剂。为了解决板材剩余体积和体积容量有限的问题, 可以添加一个附件, 将培养体积从70μl 扩大到 150μl, 从而促进常规协议的采用。虽然目前有自动板材处理系统, 但与层流清洗系统相比, 它们的占地面积很大, 这是一个小单位 ~ 1 立方英尺 (约0.028 米3)。此外, 将离心装置集成到自动板材处理系统中具有挑战性, 限制了其在细胞清洗中的使用。据我们所知, 目前还没有其他独立于离心机的细胞清洗仪器。
这里提出的筛选策略能够识别小分子及其所谓的目标激酶, 这些小分子会影响 tcr 信号和 t 细胞的激活。这里使用的库主要由小分子的激酶抑制剂组成, 能够产生一些潜在的有趣的打击。该协议还可以很容易地应用于其他酶类的抑制剂库或其他类型的小分子, 以及其他化合物的文库 (例如, 各种大分子)。该协议还可用于筛选其他细胞类型, 如外周 t 淋巴细胞或永生细胞, 包括那些表达转基因 tcr 或携带记者系统的细胞。确定和描述 t 细胞信号的新介质可以提高我们对信号通路的了解, 也有助于免疫疾病的靶向治疗发展 13, 14,15,16. 总之, 这项研究增加了通过高通量筛选检测检测 t 细胞信号介质的现有选择范围。
披露声明
作者 chyan ying ke 是 curiox 生物系统公司的员工, 该公司生产本文中使用的 dau 电池垫圈和 da 电池板。
致谢
这项工作得到了新加坡卫生部国家医学研究委员会、nmrc CBRG15may017 和新加坡教育部的赠款, 2014年-t2-1-136 (至 n. r. j. g.)。
材料
| Name | Company | Catalog Number | Comments |
| RPMI | HyClone | SH30027FS | |
| FBS | HyClone | SH3007103 | |
| L-Glutamine | HyClone | SH3003401 | |
| Sodium pyruvate | HyClone | SH3023901 | |
| Penicillin/Streptomycin | HyClone | SV30010 | |
| b-mercaptoethanol | Sigma Aldrich | 516732 | |
| 10X PBS | Vivantis | PB0344 – 1L | |
| Kinase Screening Library (96-Well) | Cayman Chemical | 10505 | Exact contents of the library may vary |
| DMSO | Sigma Aldrich | D2650 | |
| Dexamethasone | Sigma Aldrich | D4902 | |
| anti-CD3/CD28 beads | Thermo Fisher Scientific | 11452D | |
| FITC Active Caspase-3 Apoptosis Kit | BD Pharmingen | 550480 | Contains Fixation/Permeabilisation buffer, 10X Perm/Wash buffer and anti-caspase 3 antibody |
| DA-Cell Washer | CURIOX | HT1000 | |
| 96-well DA-Cell Plate | CURIOX | 96-DC-CL-05 | |
| Antibodies | |||
| CD3e | BioLegend | 100236 | |
| TCRb | BD Biosciences | 553174 | |
| CD4 | BD Biosciences | 740007 | |
| CD8 | BD Biosciences | 563786 | |
| CD69 | eBioscience | 25-0699-42 | |
| Inhibitors | |||
| TG003 | Cayman Chemical | - | From the Kinase Screening Library |
| PKC 412 | Cayman Chemical | - | From the Kinase Screening Library |
| Doramapimod | Cayman Chemical | - | From the Kinase Screening Library |
| Paclitaxel | Cayman Chemical | - | From the Kinase Screening Library |
| Erlotinib | Cayman Chemical | - | From the Kinase Screening Library |
| Necrostatin-5 | Cayman Chemical | - | From the Kinase Screening Library |
| NVP-BEZ235 | Cayman Chemical | - | From the Kinase Screening Library |
| Phthalazinone pyrazole | Cayman Chemical | - | From the Kinase Screening Library |
| AG-879 | Cayman Chemical | - | From the Kinase Screening Library |
| 1-NA-PP1 | Cayman Chemical | - | From the Kinase Screening Library |
| Torin 1 | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide II | Cayman Chemical | - | From the Kinase Screening Library |
| BIBF 1120 | Cayman Chemical | - | From the Kinase Screening Library |
| SMI-4a | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide XI (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10657 | Cayman Chemical | - | From the Kinase Screening Library |
| AS-703026 | Cayman Chemical | - | From the Kinase Screening Library |
| Chelerythrine chloride | Cayman Chemical | - | From the Kinase Screening Library |
| Tunicamycin | Cayman Chemical | - | From the Kinase Screening Library |
| GSK 1059615 | Cayman Chemical | - | From the Kinase Screening Library |
| Ruxolitinib | Cayman Chemical | - | From the Kinase Screening Library |
| Necrostatin-1 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 505124 | Cayman Chemical | - | From the Kinase Screening Library |
| INK128 | Cayman Chemical | - | From the Kinase Screening Library |
| Canertinib (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| SB 431542 | Cayman Chemical | - | From the Kinase Screening Library |
| PD 173074 | Cayman Chemical | - | From the Kinase Screening Library |
| Valproic Acid (sodium salt) | Cayman Chemical | - | From the Kinase Screening Library |
| PD 0325901 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 203580 | Cayman Chemical | - | From the Kinase Screening Library |
| VX-702 | Cayman Chemical | - | From the Kinase Screening Library |
| Emodin | Cayman Chemical | - | From the Kinase Screening Library |
| CHIR99021 | Cayman Chemical | - | From the Kinase Screening Library |
| BIO | Cayman Chemical | - | From the Kinase Screening Library |
| Imatinib (mesylate) | Cayman Chemical | - | From the Kinase Screening Library |
| Sunitinib Malate | Cayman Chemical | - | From the Kinase Screening Library |
| Gefitinib | Cayman Chemical | - | From the Kinase Screening Library |
| PP2 | Cayman Chemical | - | From the Kinase Screening Library |
| 3-Methyladenine | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide I | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide IV | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide V | Cayman Chemical | - | From the Kinase Screening Library |
| NSC 663284 | Cayman Chemical | - | From the Kinase Screening Library |
| D 4476 | Cayman Chemical | - | From the Kinase Screening Library |
| NU 7026 | Cayman Chemical | - | From the Kinase Screening Library |
| H-9 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Indirubin-3'-monoxime | Cayman Chemical | - | From the Kinase Screening Library |
| KN-62 | Cayman Chemical | - | From the Kinase Screening Library |
| KN-93 | Cayman Chemical | - | From the Kinase Screening Library |
| CGP 57380 | Cayman Chemical | - | From the Kinase Screening Library |
| Iso-Olomoucine | Cayman Chemical | - | From the Kinase Screening Library |
| (S)-Glycyl-H-1152 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide VIII (acetate) | Cayman Chemical | - | From the Kinase Screening Library |
| ST638 | Cayman Chemical | - | From the Kinase Screening Library |
| SU 6656 | Cayman Chemical | - | From the Kinase Screening Library |
| LY364947 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 203580 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10621 | Cayman Chemical | - | From the Kinase Screening Library |
| YM-201636 | Cayman Chemical | - | From the Kinase Screening Library |
| ZM 447439 | Cayman Chemical | - | From the Kinase Screening Library |
| AS-041164 | Cayman Chemical | - | From the Kinase Screening Library |
| NVP-AEW541 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| PP242 | Cayman Chemical | - | From the Kinase Screening Library |
| ABT-869 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10622 | Cayman Chemical | - | From the Kinase Screening Library |
| 17β-hydroxy Wortmannin | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10626 | Cayman Chemical | - | From the Kinase Screening Library |
| SU 6668 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10572 | Cayman Chemical | - | From the Kinase Screening Library |
| N,N-Dimethylsphingosine | Cayman Chemical | - | From the Kinase Screening Library |
| LY294002 | Cayman Chemical | - | From the Kinase Screening Library |
| U-0126 | Cayman Chemical | - | From the Kinase Screening Library |
| Staurosporine | Cayman Chemical | - | From the Kinase Screening Library |
| KN-92 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| AS-605240 (potassium salt) | Cayman Chemical | - | From the Kinase Screening Library |
| O-1918 | Cayman Chemical | - | From the Kinase Screening Library |
| Y-27632 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Leelamine | Cayman Chemical | - | From the Kinase Screening Library |
| PD 98059 | Cayman Chemical | - | From the Kinase Screening Library |
| PD 169316 | Cayman Chemical | - | From the Kinase Screening Library |
| TGX-221 | Cayman Chemical | - | From the Kinase Screening Library |
| (S)-H-1152 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| AS-605240 | Cayman Chemical | - | From the Kinase Screening Library |
| D-erythro-Sphingosine C-18 | Cayman Chemical | - | From the Kinase Screening Library |
| OSU03012 | Cayman Chemical | - | From the Kinase Screening Library |
| JNJ-10198409 | Cayman Chemical | - | From the Kinase Screening Library |
| Leelamine (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Arachidonic Acid Leelamide | Cayman Chemical | - | From the Kinase Screening Library |
| Lauric Acid Leelamide | Cayman Chemical | - | From the Kinase Screening Library |
| AS-252424 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10505 | Cayman Chemical | - | From the Kinase Screening Library |
| PI-103 | Cayman Chemical | - | From the Kinase Screening Library |
| PIK-75 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Sphingosine Kinase Inhibitor 2 | Cayman Chemical | - | From the Kinase Screening Library |
| Piceatannol | Cayman Chemical | - | From the Kinase Screening Library |
| SC-1 | Cayman Chemical | - | From the Kinase Screening Library |
| (R)-Roscovitine | Cayman Chemical | - | From the Kinase Screening Library |
| BAY-43-9006 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10561 | Cayman Chemical | - | From the Kinase Screening Library |
| AS-604850 | Cayman Chemical | - | From the Kinase Screening Library |
| PI3-Kinase α Inhibitor 2 | Cayman Chemical | - | From the Kinase Screening Library |
| ML-9 | Cayman Chemical | - | From the Kinase Screening Library |
| Triciribine | Cayman Chemical | - | From the Kinase Screening Library |
| Erbstatin Analog | Cayman Chemical | - | From the Kinase Screening Library |
| Kenpaullone | Cayman Chemical | - | From the Kinase Screening Library |
| Olomoucine | Cayman Chemical | - | From the Kinase Screening Library |
| AG-494 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-825 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-1478 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 216763 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 415286 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-17 | Cayman Chemical | - | From the Kinase Screening Library |
| H-8 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| LFM-A13 | Cayman Chemical | - | From the Kinase Screening Library |
| SC-514 | Cayman Chemical | - | From the Kinase Screening Library |
| Apigenin | Cayman Chemical | - | From the Kinase Screening Library |
| AG-18 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10554 | Cayman Chemical | - | From the Kinase Screening Library |
| DRB | Cayman Chemical | - | From the Kinase Screening Library |
| RG-13022 | Cayman Chemical | - | From the Kinase Screening Library |
| RG-14620 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-490 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-82 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-99 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-213 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-183 | Cayman Chemical | - | From the Kinase Screening Library |
| Lavendustin C | Cayman Chemical | - | From the Kinase Screening Library |
| ZM 336372 | Cayman Chemical | - | From the Kinase Screening Library |
| 5-Iodotubercidin | Cayman Chemical | - | From the Kinase Screening Library |
| SB 202190 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10571 | Cayman Chemical | - | From the Kinase Screening Library |
| Nilotinib | Cayman Chemical | - | From the Kinase Screening Library |
| SP 600125 | Cayman Chemical | - | From the Kinase Screening Library |
| L-threo-Sphingosine C-18 | Cayman Chemical | - | From the Kinase Screening Library |
| H-89 | Cayman Chemical | - | From the Kinase Screening Library |
| HA-1077 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| AG-370 | Cayman Chemical | - | From the Kinase Screening Library |
| Wortmannin | Cayman Chemical | - | From the Kinase Screening Library |
| AG-1296 | Cayman Chemical | - | From the Kinase Screening Library |
| KT 5823 | Cayman Chemical | - | From the Kinase Screening Library |
| Janex 1 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10574 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10575 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10576 | Cayman Chemical | - | From the Kinase Screening Library |
| NH125 | Cayman Chemical | - | From the Kinase Screening Library |
| TWS119 | Cayman Chemical | - | From the Kinase Screening Library |
| NSC 210902 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10577 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10578 | Cayman Chemical | - | From the Kinase Screening Library |
| PD 184161 | Cayman Chemical | - | From the Kinase Screening Library |
| CCT018159 | Cayman Chemical | - | From the Kinase Screening Library |
| Myricetin | Cayman Chemical | - | From the Kinase Screening Library |
参考文献
- Gascoigne, N. R., Rybakin, V., Acuto, O., Brzostek, J. TCR Signal Strength and T Cell Development. Annual Review of Cell and Developmental Biology. 32, 327-348 (2016).
- Rothenberg, E. V., Moore, J. E., Yui, M. A. Launching the T-cell-lineage developmental programme. Nature Reviews Immunology. 8 (1), 9-21 (2008).
- Klein, L., Hinterberger, M., Wirnsberger, G., Kyewski, B. Antigen presentation in the thymus for positive selection and central tolerance induction. Nature Reviews Immunology. 9 (12), 833-844 (2009).
- Starr, T. K., Jameson, S. C., Hogquist, K. A. Positive and negative selection of T cells. Annual Review of Immunology. 21, 139-176 (2003).
- Rybakin, V., Gascoigne, N. R. Negative selection assay based on stimulation of T cell receptor transgenic thymocytes with peptide-MHC tetramers. PLoS One. 7 (8), e43191 (2012).
- Krogsgaard, M., Juang, J., Davis, M. M. A role for "self" in T-cell activation. Seminars in Immunology. 19 (4), 236-244 (2007).
- Nakayama, T., Yamashita, M. The TCR-mediated signaling pathways that control the direction of helper T cell differentiation. Seminars in Immunology. 22 (5), 303-309 (2010).
- Hoerter, J. A., et al. Coreceptor affinity for MHC defines peptide specificity requirements for TCR interaction with coagonist peptide-MHC. The Journal of Experimental Medicine. 210 (9), 1807-1821 (2013).
- Zhao, X., et al. Nonstimulatory peptide-MHC enhances human T-cell antigen-specific responses by amplifying proximal TCR signaling. Nature Communications. 9 (1), 2716 (2018).
- Fu, G., et al. Fine-tuning T cell receptor signaling to control T cell development. Trends in Immunology. 35 (7), 311-318 (2014).
- Wang, D., et al. Tespa1 is involved in late thymocyte development through the regulation of TCR-mediated signaling. Nature Immunology. 13 (6), 560-568 (2012).
- Fu, G., et al. Themis sets the signal threshold for positive and negative selection in T-cell development. Nature. 504 (7480), 441-445 (2013).
- Rosenblum, M. D., Gratz, I. K., Paw, J. S., Abbas, A. K. Treating human autoimmunity: current practice and future prospects. Science Translational Medicine. 4 (125), (2012).
- Hebeisen, M., et al. SHP-1 phosphatase activity counteracts increased T cell receptor affinity. The Journal of Clinical Investigation. 123 (3), 1044-1056 (2013).
- Wang, R. E., et al. An immunosuppressive antibody-drug conjugate. Journal of the American Chemical Society. 137 (9), 3229-3232 (2015).
- Borroto, A., et al. First-in-class inhibitor of the T cell receptor for the treatment of autoimmune diseases. Science Translational Medicine. 8 (370), (2016).
- Chen, E. W., Brzostek, J., Gascoigne, N. R. J., Rybakin, V. Development of a screening strategy for new modulators of T cell receptor signaling and T cell activation. Scientific Reports. 8 (1), 10046 (2018).
- Fouda, A., Tahsini, M., Khodayarian, F., Al-Nafisah, F., Rafei, M. A Fluorescence-based Lymphocyte Assay Suitable for High-throughput Screening of Small Molecules. Journal of Visualized Experiments. (121), e55199 (2017).
- Zhao, Z., et al. A high-throughput phenotypic screen of cytotoxic T lymphocyte lytic granule exocytosis reveals candidate immunosuppressants. Journal of Biomolecular Screening. 20 (3), 359-371 (2015).
- Florian, A. E., et al. Flow cytometry enables a high-throughput homogeneous fluorescent antibody-binding assay for cytotoxic T cell lytic granule exocytosis. Journal of Biomolecular Screening. 18 (4), 420-429 (2013).
- Krutzik, P. O., Crane, J. M., Clutter, M. R., Nolan, G. P. High-content single-cell drug screening with phosphospecific flow cytometry. Nature Chemical Biology. 4 (2), 132-142 (2008).
- Vlahos, C. J., Matter, W. F., Hui, K. Y., Brown, R. F. A specific inhibitor of phosphatidylinositol 3-kinase, 2-(4-morpholinyl)-8-phenyl-4H-1-benzopyran-4-one (LY294002). The Journal of Biological Chemistry. 269 (7), 5241-5248 (1994).
- Chen, Z., et al. Synthesis and SAR of novel 4-morpholinopyrrolopyrimidine derivatives as potent phosphatidylinositol 3-kinase inhibitors. Journal of Medicinal Chemistry. 53 (8), 3169-3182 (2010).
- Ruegg, U. T., Burgess, G. M. Staurosporine, K-252 and UCN-01: potent but nonspecific inhibitors of protein kinases. Trends in Pharmacological Sciences. 10 (6), 218-220 (1989).
- Davis, P. D., et al. Inhibitors of protein kinase C. 1. 2,3-Bisarylmaleimides. Journal of Medicinal Chemistry. 35 (1), 177-184 (1992).
- Komander, D., et al. Interactions of LY333531 and other bisindolyl maleimide inhibitors with PDK1. Structure (London, England: 1993). 12 (2), 215-226 (2004).
- Gassel, M., et al. The protein kinase C inhibitor bisindolyl maleimide 2 binds with reversed orientations to different conformations of protein kinase A. The Journal of Biological Chemistry. 279 (22), 23679-23690 (2004).
- Faull, A., Johnstone, C., Morley, A., et al. . Novel compounds. , (2003).
- Favata, M. F., et al. Identification of a novel inhibitor of mitogen-activated protein kinase kinase. The Journal of Biological Chemistry. 273 (29), 18623-18632 (1998).
- Woods, C. M., Zhu, J., McQueney, P. A., Bollag, D., Lazarides, E. Taxol-induced mitotic block triggers rapid onset of a p53-independent apoptotic pathway. Molecular Medicine (Cambridge, MA). 1 (5), 506-526 (1995).
- Teng, X., et al. Structure-activity relationship study of novel necroptosis inhibitors. Bioorganic & Medicinal Chemistry Letters. 15 (22), 5039-5044 (2005).
- Saini, M., et al. Regulation of Zap70 expression during thymocyte development enables temporal separation of CD4 and CD8 repertoire selection at different signaling thresholds. Science Signaling. 3 (114), ra23 (2010).
- Chae, H. J., et al. Molecular mechanism of staurosporine-induced apoptosis in osteoblasts. Pharmacological Research. 42 (4), 373-381 (2000).
- Varas, A., et al. Analysis of the human neonatal thymus: evidence for a transient thymic involution. Journal of Immunology (Baltimore, MD:1950). 164 (12), 6260-6267 (2000).
- Verstichel, G., et al. The checkpoint for agonist selection precedes conventional selection in human thymus. Science Immunology. 2 (8), (2017).
- Yamaguchi, E., de Vries, J., Yssel, H. Differentiation of human single-positive fetal thymocytes in vitro into IL-4- and/or IFN-gamma-producing CD4+ and CD8+ T cells. International Immunology. 11 (4), 593-603 (1999).
- Farley, A. M., et al. Dynamics of thymus organogenesis and colonization in early human development. Development (Cambridge, UK). 140 (9), 2015-2026 (2013).
- Cali, J. J., et al. Bioluminescent assays for ADMET. Expert Opinion on Drug Metabolism & Toxicology. 4 (1), 103-120 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。