Method Article
T 세포 수용 체 신호를 통해 화학 억제제 라이브러리의 심사의 중재자의 식별
* 이 저자들은 동등하게 기여했습니다
요약
이 종이 저 해제 및 T 세포 수용 체 신호에 영향을 주는 그들의 목표의 확인에 대 한 화학 억제제의 스크린 라이브러리에 교류 cytometry 기반 분석 결과 사용 합니다. 여기서 설명 하는 방법 또한 높은 처리량 검사에 대 한 확장할 수 있습니다.
초록
T-세포 수용 체 (TCR) 신호 통로 구성 하 고 다양 한 전송 하는 중재자는 TCR의 활성화 신호. 다른 전략을 제안 하 고 활성화 등 thymic 선택 T-셀 프로세스의 이해 개선 하는 것의 TCR 신호, 새로운 중재자의 식별을 위해 구현 되었습니다. TCR thymocytes 개발의 활성화에 따라 신호에 영향을 주는 분자의 식별을 가능 하 게 하는 심사 분석 결과 설명 합니다. 강력한 TCR 신호 부정적인 선택 이라는 프로세스에 apoptotic 기계를 활성화 하기 위해 개발 thymocytes 발생할. Kinase 억제제의 응용 프로그램을 통해 TCR 신호에 영향을 주는 목표와 그 부정적인 선택의 과정을 무시할 수 있습니다. 이 문서에 자세히 설명 하는 방법의 TCR 신호 경로에 설립 역할과 정식 kinases 억제제와 억제제의 TCR 신호 경로에 설립 되 고 아직 새로운 kinases 식별 하 사용할 수 있습니다. 여기에 심사 전략 TCR 신호에 소설 druggable 대상의 id 위한 높은 처리량의 화면에 적용할 수 있습니다.
서문
T 세포는 적응 면역 유지에 중추적인 역할을 하는 림프 톨의 혈통. 그들은 표현 수 있게 그들의 ligands, 단지 중요 한 조직 적합성 복잡 한 분자 (MHC)의 구성 된 인식 바운드 펩 티 드와 함께, TCR, 항 원 제시의 표면에서 발견 되는 세포 (Apc). TCR/MHC 상호 작용을 통해 통로 신호 하는 TCR의 발생 하는 것은 T 세포 활성화 및 개발1에 대 한 중요 합니다.
T-셀 개발, 뼈 골 수 유래 조 혈 줄기 세포 (HSCs) 마이그레이션할 thymus, 그들은 차별화를 받아야 하 고 T 세포 계보 진행2의 단계를 통해 이동. 더블-양성 (DP) thymocytes, c d 4와 CD8 coreceptors 표현 자체-펩 티 드 MHC는 APCs에 참여 합니다. 그들의 자기-펩 티 드/MHC ligands에 대 한 적당 한 선호도 thymocytes 성숙 될 단일 포지티브 (SP) CD4 또는 CD8 thymocytes, 긍정적인 선택으로 불리는 과정. 반대로, 자기-펩 티 드/MHCs 통해 과도 한 TCR 자극 받을 thymocytes apoptosis를 통해 부정적인 선택3,4를 받 다. 자극 유발, caspase 종속 apoptosis의이 과정은 안티-CD3/28 항 체 코팅 구슬5와 예 thymocytes를 자극 하 여 도출 생체 외에서 수 있습니다. 성숙한 T 세포 선택 과정을 통과 하는 주변에 있는 APCs에서 비-자체-펩 티 드/MHC ligands에 의해 활성화 됩니다. 자기-펩 티 드/MHCs는 여전히 비-자체-펩 티 드/MHCs 통해 T 세포 응답의 향상, 보조 T 세포의 분화 및 항상성 확산, 생존 신호 토 닉의 맥락에서 주변 T 세포에 대 한 관련 coagonism6,7,,89. 펩 티 드/MHC 리간드에 대 한 높은 선호도 TCR 바인딩을 여러 다운스트림 신호 경로 포함 하는 복잡 한 TCR 신호 네트워크10를 형성 하는 많은 신호 분자를 활성화 합니다. TCR 신호 경로 몇 십년 동안 연구 하 고 아직 통로의 새로운 중재자의 발견11,12사 그러의 흔적을 보여줍니다. TCR 신호 통로의 변조 임상 관련성을가지고 있으며 potentiating immunotherapeutic 응용 프로그램 또는 면역13의 컨트롤에 대 한 T 세포 응답의 억제에 대 한 T 세포 응답을 포함할 수 있다. T 세포 응답의 변조에 대 한 전략은 주로 키 또는 인산 가수분해 효소 활동14,,1516의 중단에 따라 달라 집니다.
우리는 TCR 신호 및 T 세포 활성화17을 조절 하는 능력에 대 한 작은 화합물의 심사에 대 한 흐름-cytometry 기반 분석 결과의 응용 프로그램을 설명 합니다. 분석 결과 thymocytes 강한 TCR 신호에 노출 되 면 apoptosis 통로 활성화의 현상에 경첩. 분석 결과 충분히 자극 강도; 변경 사항을 식별합니다 caspase apoptotic 응답5의 정품 인증 사용 증가 결과 선호도 증가 함께 펩 티 드/MHC tetramers와 유전자 변형 TCR 표현 thymocytes 잠복기. 화면에 대 한 우리 도서관 kinase 억제제를 사용 하 고 강한 TCR 신호 thymocyte 응답을 조절 하는 능력을 평가.
여러 흐름-cytometry-또는 형광 기자-기반 전략 다양 한 주변 활성화 고기 다양 한 T 세포 부분 집합에서의 높은 처리량 검열에 대 한 설명 했습니다. 타이밍 및 T 세포 활성화18의 진도 평가 하기 위해 유전자 형광 기자를 사용 하 여, 세포 독성 T 세포 활동19,의20, 판독 및 분석으로 degranulation 사용 하 여 이러한 전략 등은 21를 신호 하는 세포에 관련 된 다양 한 단백질의 인 산화.
여기에 제시 된 심사 분석 결과 성공적으로 TCR 신호에 대 한 억제 효과와 잠재적인, 소설 화합물으로 서 통로 신호 하는 TCR의 정식 분자를 억제 하는 화합물을 식별 할 수 있다. 예를 들어 우리는 T 세포 응답17에 영향을 미치는 새로운 화합물으로 GSK3β의 Hsp90 억제제를 식별. 분석 결과 신호 변환, 세포 독성에는 억제제의 TCR 독립적인 효과에서 apoptotic 응답에 있는 감소 때문에 방해가 억제제를 구별할 수 있다. Apoptosis 유도 이외에 우리 또한 측정 CD69 upregulation와 TCR downregulation 활성화의 표식. 네트워크는 복잡 한 신호 하는 TCR로 여러 정보를 사용 하 여 단일 통로에 특정 효과와 분자를 발견의 기회를 증가할 수 있다. 여기, 우리는 또한 흐름 cytometric 분석에 대 한 준비에 있는 세포의 착 색 하는 동안 원래 프로토콜에는 높은 처리량으로 원심 분리 독립 프로토콜의 사용을 소개 합니다. 이 문서에서 설명 하는 분석 결과 kinase 억제제의 작은 화합물 라이브러리를 사용 하지만, 원칙적으로, 그것은 더 높은 처리량 검열에 대 한 사용할 수 있습니다. 선택의 라이브러리 억제제 또는 다른 분자의 다양 한을 통합 수 있습니다.
프로토콜
이 연구에서 6에 8-주 된 남성과 여성의 C57Bl/6 마우스 사용 되었다. 생쥐는 싱가포르 국립 대학 (싱가포르)에서 동물 시설에서 자란 했다. 싱가포르의 국가 대학 제도 동물 보호와 사용 위원회 (IACUC) 모든 동물 실험 승인.
1입니다. Thymocyte 현 탁 액의 준비
- CO2 챔버에 쥐 안락사
- 세포 배양의 어떤 오염 든 지 피하기 위하여 조직 문화 후드에서 다음 단계를 수행 합니다. 해 부 보드, 핀를 사용 하 여 마우스 시체를 보호 하 고 70% 에탄올과 마우스 스프레이.
- 가 위를 사용 하 여, 턱으로 복 부에서 시작 복 부 측에 수직 절 개를 확인 합니다. 뒷 다리의 각을 따라 절 개를 추가 확인 합니다. 흉 곽을 노출 하 고 그것을 아래로 핀 피부를 스트레칭.
- 가 위와 횡 경 막과 흉 곽 후부 끝에서의 양쪽을 잘라. 흉 곽 들어올린 노출 thymus 아래로 핀. Thymus에 연결 하는 결합 조직 고 thymus 곡선된 집게의 쌍을 사용 하 여 추출 합니다.
- Thymus를 포함 하는 완전 한 RPMI 미디어의 5 mL 6 잘 플레이트의 넣으십시오.
참고: 경우 긴 thymocyte 생존 능력을 개선 하기 위해 미디어를 10% 숯 박탈 태아 둔감 한 혈 청 (FBS)를 추가 하십시오 대기 시간 사이는 절 개 및 자극 시험으로 예상 된다. - 부드럽게 thymus, 주사기의 무뚝뚝한 끝을 사용 하 여 매 시 고 70 µ M 셀 스 트레이너를 통해 세포를 전달 합니다. 또는, thymocytes 건강 상태에서 수집 하 thymic 상피에서 그 흐름 thymus를 짜 내 고는 thymocytes 수집 집게의 두 쌍을 사용 하십시오.
- hemocytometer 또는 악기 계산 자동화 된 셀을 사용 하 여 계산, 셀로 이동 합니다.
2. 비 독성 농도 Kinase 억제제의 적정
참고:이 섹션은 억제제 T 세포 활성화 스크린에 사용 하기 위해 준비에 중점을 둡니다. 높은 농도에서 사용 하는 저 해제의 T-세포 활성화 화면 판독은 세포 죽음을 발생할 수 있습니다. 시리즈는 저 해제의 희석의 TCR 자극의 독립적인 apoptosis를 유도 하지 해야 개별 억제제의 최종 농도 결정 하는 것을 목표로. 이 연구에 사용 된 kinase 억제제의 라이브러리는 외부 공급 업체에서 구입 했다. 억제제의 목록 테이블의 자료에 포함 됩니다.
-
낮은 농도에서 kinase 억제제의 접시의 준비
- 1mm에서 억제제의 접시를 준비 하려면 모든 억제제에 대 한 디 메 틸 sulfoxide (DMSO)의 90 µ L를 억제제의 10 µ L를 추가 합니다.
참고:이 연구에서 사용 하는 작은 분자 라이브러리에서 억제제 10 m m 재고 농도에서 온다. 펠 릿 형태로 억제제 인 경우 공급 업체에서 권장된 재구성 단계를 따르십시오. 억제제는 10mm에서 제공 되지 않습니다, 대신, 다른 적절 한 농도에서 억제 물 접시를 준비 하 고 적당 한 희석 인자 억제제의 별도 직렬 희석을 준비.
주의: 독성 억제제의 경우, 안전한 취급 및 폐기에 제조업체의 지침을 따르십시오. - 억제제 0.1 m m의 접시를 준비 하려면 DMSO의 90 µ L을 사용 1 m m 억제제의 접시에서 억제제의 10 µ L을 추가 합니다.
- 억제제 0.01 m m의 접시를 준비 하려면 DMSO의 90 µ L를 사용 0.1 m m 억제제의 접시에서 억제제의 10 µ L을 추가 합니다.
- 1mm에서 억제제의 접시를 준비 하려면 모든 억제제에 대 한 디 메 틸 sulfoxide (DMSO)의 90 µ L를 억제제의 10 µ L를 추가 합니다.
-
Kinase 억제제와 thymocytes의 치료
- 섹션 1에 의하여 thymocyte 정지를 준비 합니다.
- 5 x 106 셀/mL thymocyte 정지를 완전 한 RPMI에 thymocytes 희석.
- 멀티 채널 피 펫을 사용 하 여 96 잘 접시의 모든 우물을 thymocyte 서 스 펜 션의 200 µ L를 추가 합니다.
- 각 잘 하려면 1mm 억제제 (는 억제제의 최종 농도 10 µ M)를 포함 하는 접시의 해당에서 억제제의 2 µ L를 추가 합니다.
- 같은 접시에서 DMSO의 2 µ L을 추가 하 여 치료 컨트롤의 4 개의 우물, 5 µ M dexamethasone 취급 긍정적인 컨트롤, 4 개의 우물과 부정적인 컨트롤 차량 취급의 4 개의 우물을 준비 합니다.
- 37 ° C, 5% CO2 배양 기 17-20 h에 대 한에 thymocytes를 품 어 (또는 밤새 껏).
-
개별 억제제의 적당 한 농도의 결정
- 300 x g 에서 thymocytes 접시를 회전 하 고 4 ° C, 5 분 Resuspend FACS 워시 버퍼의 250 µ L에 셀.
- 샘플의 흐름 cytometric 분석을 실행 하 고 교류 cytometry 분석 프로그램 결과 분석.
- FSC SSC 게이팅 기반 라이브 세포의 백분율을 결정 합니다. 제어 전략은 그림 1B에서 표시 됩니다.
- 100%에서 정규화는 DMSO 치료 컨트롤을 기반으로 라이브 셀의 비율의 평균을 계산 합니다. 허용 가능한 세포 죽음 (e.g.,20%)의 임의의 창 설정. 억제제 (즉,., DMSO 처리 컨트롤의 80%)이이 창 아래 라이브 셀의 비율 결과 낮은 농도에서 다시 테스트할 수 있습니다.
- 단계 2.3.4에서에서 생존 조건을 통과 하지 못한 억제제에 대 한 단계 2.2.1-2.3.4에서 단계를 반복 하지만 단계 2.2.4 1mm 억제제를 포함 하는 접시 대신 0.1 m m 억제제의 접시를 사용 하 여. 여기에서 사용 하는 저 해제의 최종 농도 1 µ M.
- 억제제는 여전히 세포 죽음 1 µ M에서의 높은 수준의 생산, 테스트에서 0.1 µ M. 저 해제에 대 한 단계 2.2.1-2.3.4, 반복 하지만 단계 2.2.4에서에서 0.01 m m 억제제의 접시를 사용 합니다. 여기에서 사용 하는 저 해제의 최종 농도 0.1 µ M.
-
Kinase 억제제의 주식 접시의 준비
- 10 µ M에서 사용 될 억제제, DMSO의 10 µ L를 10 m m 억제제의 10 µ L를 추가 합니다.
- 1 µ M에서 사용 될 억제제, 1 µ L 10 m m 억제제의 DMSO의 19 µ L를 추가 합니다.
- 억제제 0.1 µ M에서 사용할 수, DMSO (그림 1C)의 199 µ L를 10 m m 억제제의 1 µ L를 추가 합니다.
참고: 억제제의 준비 재고 접시 의도 최종 농도 thymocyte 정지에 추가 될 때의 농도 x 500입니다. 억제제의 주식 접시 PCR 스트립 또는 96 잘 접시에 준비 될 수 있다. - Kinase 억제제의 주식 판에 적용할 수 있는 thymocytes 심사에 대 한 기존의 원심 분리-종속 시스템 (섹션 3; 참조 그림 1A, 방법 1 및 2) 또는 대체 원심 분리 독립 시스템 (제 4; 참조 그림 1A, 방법 3).
3. kinase 억제제 라이브러리 (기존의 원심 분리기 기반 분석 결과) 심사
-
Kinase 억제제와 thymocytes의 치료
- 섹션 1에 의하여 thymocyte 정지를 준비 합니다.
- 5 x 106 셀/mL thymocyte 정지를 완전 한 RPMI에 thymocytes 희석.
- 멀티 채널 피 펫을 사용 하 여 96 잘 접시의 각 음에 thymocytes의 200 µ L를 추가 합니다. 얼음에 접시를 놓습니다.
- 억제제 주식 접시의 해당 우물에서 96 잘 접시에 억제제의 0.5 µ L 준비 섹션 2.4에에서 추가 합니다.
- 치료 컨트롤의 8 개의 우물을 준비 합니다. DMSO의 0.5 µ L을 추가 하 여 차량 처리 컨트롤의 4 개의 우물을 준비 합니다. 5 µ M dexamethasone 처리 컨트롤 (그림 2)의 4 개의 우물을 준비 합니다.
-
안티-CD3/CD28 비즈를 사용 하 여 thymocytes의 자극
- 구슬의 1 mL를가지고 고 2 mL PBS의와 구슬 세척. 마그네틱 스탠드를 사용 하 여 구슬 하 고 솔루션을 발음 합니다. 완전 한 RPMI의 5 mL에 구슬 resuspend.
참고: 셀에 구슬의 비율은 1 ~ 2.5입니다. 려, thymocytes 사용의 수와 자극 하는 우물의 수에 따라 구슬의 크기를 조정 합니다. - 각 억제제 치료 샘플, 4 DMSO 치료 샘플, 그리고 8 개의 치료 샘플 4 구슬의 50 µ L를 추가 합니다. 나머지 4 개의 치료 우물을 완전 한 RPMI의 50 µ L를 추가 합니다. 그림 2 접시의 일반적인 레이아웃을 보여 줍니다.
- 멀티 채널 피 펫을 사용 하 우물의 내용을 혼합.
- 37 ° C, 5% CO2 배양 기 17-20 h에 대 한에 thymocytes를 품 어 (또는 밤새 껏).
- 구슬의 1 mL를가지고 고 2 mL PBS의와 구슬 세척. 마그네틱 스탠드를 사용 하 여 구슬 하 고 솔루션을 발음 합니다. 완전 한 RPMI의 5 mL에 구슬 resuspend.
-
표면 항 원의 얼룩
- 안티-TCRβ, 안티-CD4, 안티-CD8, 및 안티-CD69 항 체를 포함 하는 항 체 얼룩 혼합물을 준비 합니다. 1: 200 (v/v)의 비율로 FACS 워시 버퍼 (PBS 0.5% 소 혈 청 알 부 민 [BSA] 보충)에서 항 체를 희석.
참고: 최적화는 얼룩, 다른 실험에서 얼룩에 변화를 최소화 하 고 신호 대 잡음 비율을 개선 하기 위해 고정 된 항 체 희석을 사용 하는 대신에 사용 되는 항 체 titers 보십시오. - 300 x g 와 4 ° C, 5 분 동안 접시를 회전 합니다.
- 솔루션을 삭제 하는 접시를 터치 합니다.
- 이 시점에서, 프로토콜 기존의 원심 분리기-의존 프로토콜을 따를 수 있습니다 (3.3.5 단계로 진행; 그림 1A, 방법 1 참조) 또는 대체 원심 분리 독립 프로토콜 (4.4.4 단계로 진행; 그림 1A, 메서드를 참조 하십시오 2)입니다.
- 3.3.1 단계에서 준비 착 항 체 혼합물의 75 µ L 셀 resuspend
- 멀티 채널 피 펫을 사용 하 여 샘플을 혼합 하 고 30 분 동안 얼음에 그들을 품 어.
- 안티-TCRβ, 안티-CD4, 안티-CD8, 및 안티-CD69 항 체를 포함 하는 항 체 얼룩 혼합물을 준비 합니다. 1: 200 (v/v)의 비율로 FACS 워시 버퍼 (PBS 0.5% 소 혈 청 알 부 민 [BSA] 보충)에서 항 체를 희석.
-
셀의 고정
- FACS 워시 버퍼의 200 µ L로 우물을 세척 하 고 g 와 5 분 동안 4 ° C x 300에 접시를 회전.
- 솔루션을 삭제 하는 접시를 터치 합니다.
- 고정/permeabilization 버퍼를 추가 (활성 caspase 3 apoptosis 키트;와 함께 제공 3.5.1 및 단계 3.5.2에서에서 안티-caspase-3 항 체 파 마/워시 버퍼 x 10와 같은 단계에서 언급 한) 잘 당 200 µ L에서.
- 30 분 동안 얼음에 품 어.
-
세포내 활성 caspase 3에 대 한 얼룩
- 초순의 45 ml에서 10 x 파 마/워시 버퍼의 5 mL를 희석 하 여 1 x 파 마/워시 버퍼를 준비 합니다.
- 파 마/워시 버퍼 x 1의 6.5 mL를 안티-caspase-3 항 체의 1.3 mL를 추가 하 여 세포내 활성 caspase 얼룩을 준비 합니다. 파 마/워시 버퍼에 항 체의 비율은 1:5입니다.
- 300 x g 에서 접시를 회전 하 고 4 ° C, 5 분 터치 솔루션을 삭제 하는 접시. 1 x 파 마/워시 버퍼의 200 µ L와 접시 세척.
- 3.5.3 단계를 반복 합니다.
- 300 x g 에서 접시를 회전 하 고 4 ° C, 5 분 터치 솔루션을 삭제 하는 접시. 세포내 caspase 얼룩 단계 3.5.2 모든 우물에서에서 준비의 75 µ L를 추가 합니다.
- 멀티 채널 피 펫을 사용 하 여 샘플을 혼합 하 고 1 시간에 대 한 얼음에 품 어.
- 샘플 1 x 파 마/워시 버퍼의 200 µ L 세척 하 고 300 x g 와 4 ° C, 5 분 동안 접시를 회전.
- 솔루션을 삭제 하는 접시를 터치 합니다. 1 x 파 마/워시 버퍼의 200 µ L와 접시 세척. 300 x g 와 4 ° C, 5 분 동안 접시를 회전 합니다.
- 솔루션을 삭제 및 FACS 워시 버퍼의 200 µ L에서 샘플을 resuspend 접시를 터치 합니다.
- 샘플의 흐름 cytometric 분석을 실행 하 고 FACS 분석 프로그램 결과 분석.
- C d 4와 CD8 긍정적인 표현으로 DP thymocytes의 인구에 게이트 CD4 또는 CD8 플롯을 사용 하 여 (그림 2, 아래쪽 절반). DP thymocyte 게이트 내에서 활성화 된 caspase 3, 긍정적인 컨트롤로 부정적인 제어 및 dexamethasone unstimulated 샘플을 사용 하 여 포함 된 셀의 비율을 결정 합니다. DP thymocyte 게이트에서 CD69의 발현의 분석에 대 한 부정적인 제어 및 자극된 샘플으로 unstimulated 샘플을 사용 하 여 긍정적인 통제로.
참고: 때 DP thymocytes에 게이팅, DP thymocytes 인구 개별 샘플 제대로 문이 됩니다 확인 합니다. 자극된을 세포 downregulate 표면 coreceptors, 그리고 이벤트의 의도 하지 않은 제외 꽉 DP 게이트 사용 하는 경우 발생할 수 있습니다.
4. kinase 억제제 라이브러리 (원심 분리기-독립 분석 결과) 심사
-
Kinase 억제제와 thymocytes의 치료
- 섹션 1에 의하여 thymocyte 정지를 준비 합니다.
- 25 x 106 셀/mL thymocyte 정지를 완전 한 RPMI에 thymocytes 희석.
- 멀티 채널 피 펫을 사용 하 여 작은 볼륨 판의 각 우물에 thymocytes의 40 µ L를 추가 합니다. 얼음에 접시를 놓습니다.
- 억제제/DMSO/dexamethasone (5 배 희석)의 한 부분에 주식 접시, DMSO, 및 완전 한 RPMI의 4 개 부품의 비율로 전체 RPMI에 dexamethasone 억제제를 희석.
참고:이 작은 볼륨 플레이트에 사용 된 볼륨은 종래의 방법에 보다 작은 x 5는 억제제 및 제어 시 약 희석 하는 접시에 thymocytes에 그들을 추가 하기 전에 오부. - 4.1.4 단계에서 준비 억제제 판의 해당 우물에서 96 잘 접시에 억제제의 0.5 µ L를 추가 합니다.
- 치료 컨트롤의 8 개의 우물을 준비 합니다. 4.1.4 단계에서 DMSO의 0.5 µ L을 추가 하 여 차량 처리 컨트롤의 4 개의 우물을 준비 합니다. 5 µ M dexamethasone 처리를 사용 하 여 컨트롤 단계 4.1.4 (그림 2)에서 준비 하는 희석된 dexamethasone의 4 개의 우물을 준비 합니다.
-
안티-CD3/CD28 비즈를 사용 하 여 thymocytes의 자극
- 구슬 균일 하 게 resuspended는 다는 것을 확인 하십시오. 구슬의 1 mL 고 2 mL PBS의와 함께 그들을 씻어. 마그네틱 스탠드를 사용 하 여 구슬 하 고 솔루션을 발음 합니다. 완전 한 RPMI의 1 mL에 구슬 resuspend.
참고: 셀에 구슬의 비율은 1 ~ 2.5입니다. 구슬, thymocytes 사용의 수와 자극 하는 우물의 수에 따라 양을 조절 됩니다. - 각 억제제 치료 샘플, 4 DMSO 치료 샘플, 그리고 8 개의 치료 샘플의 4 구슬 서 스 펜 션의 10 µ L를 추가 합니다. 나머지 4 개의 치료 우물을 완전 한 RPMI의 10 µ L를 추가 합니다. 그림 2 일반적인 접시 레이아웃을 보여 줍니다.
참고: 우물의 최종 볼륨은 50 µ L, 우물의 최대 용량 내. 그것은 주의 운동 하 고 판 간 잘 흘림 방지를 똑바로 잡아 중요 하다. - 혼합, microplate 궤도 셰이 커를 사용 하 여 접시를 교 반 하십시오. 또는, 멀티 채널 피 펫을 사용 하 우물의 내용을 혼합.
- 37 ° C, 5% CO2 배양 기 17-20 h에 대 한에 thymocytes를 품 어 (또는 하룻밤) 증발 방지 뚜껑.
- 구슬 균일 하 게 resuspended는 다는 것을 확인 하십시오. 구슬의 1 mL 고 2 mL PBS의와 함께 그들을 씻어. 마그네틱 스탠드를 사용 하 여 구슬 하 고 솔루션을 발음 합니다. 완전 한 RPMI의 1 mL에 구슬 resuspend.
-
접시 와셔의 설치
참고: 접시 세탁기를 설정 하기 위한 지침이 제조 업체에 의해 제공 됩니다. 단계는 아래에 간단히 언급 된다. 대략 150 mL 솔루션의 각 못쓰게 단계 필요 합니다.- 1%를 포함 하는 70% 에탄올으로 세척 시스템을 프라임 트윈 20.
- 1%를 포함 하는 이온된 수로 세척 시스템을 프라임 트윈 20.
- 프라임 FACS 워시 버퍼 세척 시스템.
-
표면 항 원의 얼룩
- 안티-TCRβ, 안티-CD4, 안티-CD8, 및 안티-CD69 항 체를 포함 하는 항 체 얼룩 혼합물을 준비 합니다. 1: 100 (v/v)의 비율로 FACS 워시 버퍼에서 항 체 희석.
- 세척 접시 9 x, 세척, 세척 시스템 자동된 층 류를 사용 하 여 당 FACS 워시 버퍼의 55 µ L를 사용 하 여.
참고:은 세척의 끝에 있을 것입니다 각 우물에서 잔여 볼륨의 25 µ L. - 4.4.1 단계에서 준비 착 항 체 혼합물의 25 µ L에 셀 resuspend
- 샘플 (3.3.4 단계)에서 96 잘 접시에서 전송 하는 경우 준비 단계, 3.3.1 항 체 혼합물의 50 µ L에 셀 resuspend 그리고 작은 볼륨 플레이트에 샘플을 전송. 그림 1A에서와 같이이 단계 방법 수를 2에 해당 합니다.
- 혼합, microplate 궤도 통으로 접시를 선동 또는 멀티 채널 피 펫을 사용 하 여 샘플을 혼합 하 고 30 분 동안 얼음에 품 어.
-
셀의 고정
- 세척 접시 9 x, 세척, 세척 시스템 자동된 층 류를 사용 하 여 당 FACS 워시 버퍼의 55 µ L를 사용 하 여.
- 고정/permeabilization 버퍼를 추가 (활성 caspase 3 apoptosis 키트;와 함께 제공 4.6.1 및 단계 4.6.2에서에서 안티-caspase-3 항 체 파 마/워시 버퍼 x 10와 같은 단계에서 언급 한) 잘 당 50 µ L에서.
- 30 분 동안 얼음에 품 어.
-
세포내 활성 caspase 3에 대 한 얼룩
- 초순의 225 ml에서 10 x 파 마/워시 버퍼의 25 mL를 희석 하 여 1 x 파 마/워시 버퍼를 준비 합니다.
- 안티-caspase-3 항 체의 1 mL 파 마/워시 버퍼 x 1의 2 개 mL를 추가 하 여 세포내 활성 caspase 얼룩을 준비 합니다. 파 마/워시 버퍼에 항 체의 비율은 1:2입니다.
- 프라임 1 파 마/워시 버퍼 x 세척 시스템.
- 세척 접시 9 파 마/워시 버퍼, 각 세척에 대 한 55 µ L x 1과 x.
- 준비 단계 4.6.2 모든 우물에서에서 세포내 caspase 얼룩의 25 µ L를 추가 합니다.
- 혼합, microplate 궤도 통으로 접시를 선동 또는 멀티 채널 피 펫을 사용 하 여 샘플을 혼합 하 고 1 시간에 대 한 얼음에 품 어.
- 세척 접시 9 파 마/워시 버퍼, 각 세척에 대 한 55 µ L x 1과 x.
- 모든 우물에 FACS 워시 버퍼의 25 µ L를 추가 합니다.
- 적절 한 혼합 을 통해 pipetting 후 결정 관에 샘플을 전송.
- 빈 우물에 FACS 워시 버퍼의 또 다른 50 µ L을 추가 하 고 단계 4.6.9 반복.
- 반복 단계 4.6.9 4.6.10 2 배까지 샘플의 200 µ L 결정 튜브에 수집 됩니다.
참고: 작은 볼륨 판에서 셀의 최대 복구 되도록 4.6.10 및 4.6.11 단계에서 설명 하는 절차의 목적이입니다. 핸드폰 번호 단계 4.6.10 후 하지 우려 하는, 경우는 결정을 단순히 가기 튜브 FACS 워시 버퍼 200 µ L를 합니다. - 샘플의 흐름 cytometric 분석을 실행 하 고 단계 3.5.11 당 FACS 분석 프로그램 결과 분석. Caspase 3 활성화 및 CD69 식 게이트를 포함 하는 CD4 분석은+CD8+DP thymocytes.
결과
심사 분석 결과에 대 한 접근은 그림 1A에 요약 됩니다. Kinase 억제제 thymocyte 생존에 그들의 잠재적인 효과 대 한 처음 상영 되었다. Apoptosis에 대 한 긍정적인 컨트롤로 dexamethasone proapoptotic 요원으로 사용 되었다. 라이브 세포 인구를 위한 게이팅 치료 부정적인 컨트롤 및 dexamethasone 취급 긍정적인 컨트롤 (그림 1B)에 따라 하는 것을 결정 했다. 억제제 thymocytes에 10 µ M에서 먼저 테스트 하 고 실행 가능한 세포의 비율 18 시간 배양 후 측정 했다. 세포 죽음에 대 한 20% 창 화합물을 유발 되도록 선정 되었다 큰 20% 보다 라이브 셀 게이트, DMSO 처리 샘플에 비해 셀의 손실 낮은 농도 (그림 1B)에서 시험 되었다. 선택한 억제제 치료 샘플의 대표적인 FACS 플롯 생존 능력 분석 결과 설명 하기 위해 표시 됩니다. LY294002 (2-(4-morpholinyl)-8-phenyl-4H-1-benzopyran-4-one; CAS 154447-36-6), PI3K 억제제22, 10 µ M에서 세포 죽음을 크게 증가 하지 않았다 고는 억제제 10 µ M에 후속 분석을 위해 사용 되었다. CAY10626 (N-[2-(dimethylamino)ethyl]-N-methyl-4-[[[4-[4-(4-morpholinyl)-7-(2,2,2-trifluoroethyl)-7H-pyrrolo[2,3-d]pyrimidin-2-yl]phenyl]amino]carbonyl]amino]-benzamide; CAS 1202884-94-3),23, PI3Kα/mTOR 이중 억제 물 유도 10 µ M에서 세포 죽음의 상부와 1 µ M에서만에 0.1 µ M와 0.1 µ M 다운스트림 분석 응용 프로그램에 대 한 적당 한 농도을 결정 했다. Staurosporine (2,3,10,11,12,13-hexahydro-10R-methoxy-9S-methyl-11R-methylamino-9S,13R-epoxy-1H,9H-diindolo[1,2,3-gh;3',2',1'-lm]pyrrolo[3,4-j][1,7]benzodiazonin-1-one; CAS 62996-74-1),24, apoptosis 유도 하기 위해 설립 능력 팬 단백질 키 니 아 제 C 억제 물 유도 모든 농도 0.1 µ M에도 테스트에서 중요 한 세포 죽음. 그것은 추가적인 긍정적인 컨트롤로 0.1 µ M에 후속 분석 실험에서 사용 되었다.
저 해제의 최종 농도 어떤 점에서 그들은 하지 DMSO 처리 샘플의 20% 이상 세포 죽음 증폭 않았다 높은 농도에 따라 선정 됐다. 억제제 결정의 최종 농도와 억제제의 사진 플레이트는 모든 억제제 했다 500 배 농도 있는 셀에 적용 될 때 준비 되었다. 그림 1C 는 억제제의 최종 농도와 주식 접시의 접시 레이아웃을 보여 줍니다. 분석 결과 세척 층 류 흐름에 대 한 작은 볼륨 번호판에서 직접 세포 배양의 대체 프로토콜에서 작은 볼륨의 사용은 억제제의 추가 희석 필요한. 되도록 DMSO는 문화 콘텐츠의 억제제의 추가 셀에 대 한 너무 높은 되지 않을 것 이라고 후는 억제제 했다 더 희석 완전 RPMI에 5, 희석 배 100 배는 원하는 농도에 적용 될 때에 그들이 그런는 셀입니다.
억제제, 비 독성 농도 희석 thymocytes5,17TCR 자극 유도 된 apoptosis에 대 한 분석 결과에서 사용 되었다. 자극 18 h에 대 한 안티-CD3/CD28 비즈를 사용 하 여 실시 되었다 그리고 셀 이후에 caspase 3는 CD4에 활성화에 대 한 스테인드 했다+ 와 CD8+ DP thymocyte 인구 (그림 2). Caspase 3 활성화 CD69 식 및 TCR downregulation의 증가 안티-CD3/CD28-자극 및 nonstimulated 샘플에 비해 DMSO 모의 치료 안티-CD3/28-자극 샘플, 모두에서 관찰 되었다. Dexamethasone 처리 샘플 CD69 upregulation TCR 자극의 독립적인 apoptosis 유도 효과의 예상 되는의 독립적인 caspase 3 활성화에 증가 보여주었다.
그림 3A 선택한 억제제에 대 한 분석 결과 심사 하는 라이브러리의 결과 요약 합니다. Caspase 3 활성화 및 CD69 식의 탄압으로 관심의 잠재적인 억제제를 식별 하기 위해 사용할 수 있습니다. 예상 했던 대로, TCR 신호의 정식 중재자의 저 해제 화면에서 긍정적인 명 중으로 나타났다. 전시 금지 힘의 다양 한 각도, 같은 억제제 포함 여러 kinases 및 또한, 더 많은 대상으로 넓 스펙트럼 억제제 특정 억제제. 일부 억제제 caspase 3 활성화와 CD69 upregulation (그림 3B, 맨 위 행, 왼쪽된 패널)을 억제할 수 있었다. 이러한 한 억제제는 bisindolylmaleimide II (3-(1H-Indol-3-yl)-4-[1-[2-(1-methyl-2-pyrrolidinyl)ethyl]-1H-indol-3-yl]-1H-pyrrole-2,5-dione; CAS 137592-45-1), 있는 모든 단백질 키 니 아 제 C isoforms 단백질 키 니 아 제 A와 PDK125,,2627억제. 이 범주에 다른 억제제는 CAY10657 (3-[(aminocarbonyl)amino]-5-[4-(4-morpholinylmethyl)phenyl]-2-thiophenecarboxamide; CAS 494772-86-0), IKK228의 제안 된 억제 물.
CD69 upregulation 저해 하지만 caspase 3 활성화 (그림 3B, 위쪽, 오른쪽 패널)을 손상 하지 않은 화합물을 확인 하 고 있었다. CAY10626, PI3Kα 및 mTOR23및 U-0126의 억제제 (2, 3-두번째 [아미노 [(2-aminophenyl) thio] methylene]-butanedinitrile; CAS 109511-58-2), 한 MEK 억제제29, 확인 된 억제제의 일부를 했다. 결과 표시 다른 억제제 TCR 신호 통로의 특정 지점에서 다른 kinases 특히 그 단계의 kinases 타겟팅 대상으로 T-세포 활성화 현상의 선택적 장애가 발생할 수 있습니다.
억제제 CD69 upregulation 및 caspase 3 활성화 (그림 3B, 맨 아래, 왼쪽된 패널)을 억제 하지 않았다 했다. Paclitaxel (βS-(benzoylamino)-αR-hydroxy-benzenepropanoic 산, (2aR,4S,4aS,6R,9S,11S,12S,12aR,12bS)-6,12b-bis(acetyloxy)-12-(benzoyloxy)-2a,3,4,4a,5,6,9,10,11,12,12a,12b-dodecahydro-4,11-dihydroxy-4a,8,13,13-tetramethyl-5-oxo-7 11-methano-1H-cyclodeca[3,4]benz[1,2-b]oxet-9-yl 에스테 르; CAS 33069-62-4), microtubule 역학30및 necrostatin-5 (2-[[3,4,5,6,7,8-hexahydro-3-(4-methoxyphenyl)-4-oxo[1]benzothieno[2,3-d]pyrimidin-2-yl]thio]-acetonitrile;의 방해는 CAS 337349-54-9), RIP1 니31, 억제제는이 카테고리에 식별 하는 두 억제제. 어디 CD69 upregulation 및 caspase 3 활성화 되지 않은 장애인 같은 경우에이 수 수는 억제제 인 하지 타겟팅 통로 신호 하는 TCR의 관련 키.
앞에서 설명 했 듯이, staurosporine는 여전히 thymocytes는에 있는 apoptosis를 유도 하는 농도에 스크린에 사용 되었다. 예상 했던 대로, staurosporine 처리 샘플 caspase 3 활성화 (그림 3B, 맨 아래, 오른쪽 열)의 높은 수준을 보여주었다. CD69 식의 저급 bisindolylmaleimide II, 다른 팬 PKC 억제제, 또한 억압 CD69 표현으로 PKC의 staurosporine 중재 금지를 지정할 수 있습니다. 또는, staurosporine 유도 된 세포에 있는 apoptosis 그들은 upregulate 수 있었다 전에 CD69 식.
처리량 및 자동화 프로토콜의 증가, 병렬 프로토콜 시스템 통해 층 류를 세척 하는 자동화 된 플레이트의 사용을 포함 하는 준비 되었다. 이 자동화 된 접시 세척 장치를 사용 하 여 두 개의 별도 프로토콜 trialed 되었고 96 잘 접시에서 세포를 배양 하 고 원심 분리-의존 프로토콜에서 세포를 얼룩이 지기의 종래의 방법에 비해. 한 가지 방법은 표준 절차, 당 96 잘 접시에 세포 배양 및 다음, (그림 4, 다 세척 샘플) 단계는 얼룩에 대 한 번호판 자동된 접시 세탁기와 호환 셀을 전송. 다른 방법은 배양 접시-세탁기-호환 접시에 직접 셀와 같은 접시 (그림 4, 다 문화 샘플)에 얼룩 프로토콜을 계속 관여. 원심 분리 독립 프로토콜 활성 caspase 3, CD69, 또는 TCRβ는 다른 테스트 샘플, 기존의 원심 분리-의존 프로토콜 (그림 4)에 비해 전체 얼룩에 많은 인지할 수 차이 영향을 주지 않는다. 착 강도 차이 착 단계 동안 약간 다른 농도에서 항 체를 사용 하 여 지정할 수 있습니다.
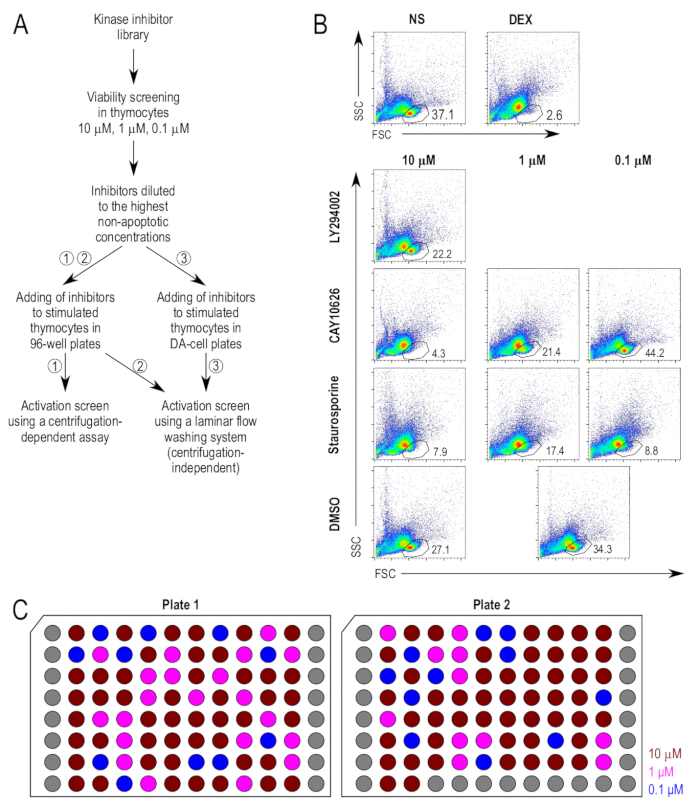
그림 1 : 억제제로 치료 후 thymocyte 생존. 심사 분석 결과 주요 단계 (A) 실험 개요. 세 가지 제안된 방법 자극 하 고 활성화 분석 결과, 즉 (1) 배양 thymocytes 기존의 원심 기반 프로토콜을 사용 하 여 얼룩 다음 표준 96 잘 접시에서의 사용 thymocytes의 얼룩에 대 한 (2)는 사용 하 여 동일한 격판덮개에 얼룩이 다음 작은 볼륨 접시, thymocytes 경작 thymocytes 얼룩 원심 분리 독립 세척 프로토콜 (3)을 사용 하 여 다음 표준 96 잘 접시에서의 경작을 원심 분리 독립 세척 프로토콜입니다. (B) 게이팅 생존 능력 분석 실험에서 사용 되는 전략. 라이브 셀 게이트 앞으로 분산형 (FSC)에서 파생 된 고 측 (SSC) 점도, 앞에서 설명한17. 억제제 너무 시험된 농도에서 독성 간주 했다 10 낮은 농도에서 더 생존 능력 분석 실험 대상이 됐다. 대표 억제제 치료 샘플 표시 됩니다. 1 µ M와 0.1 µ M 샘플에 사용 되는 공용 컨트롤 (DMSO 치료 [DMSO]) note (C) 희석된 억제제의 플레이트 레이아웃. DMSO에 의도 된 최종 농도 x 500의 농도를 희석 하는 저 해제의 접시의 도식 적인 표현입니다. 각 잘 한 독특한 억제제를;를 나타냅니다. 회색 웰 스 비어 있습니다. 표시 된 농도 최종 농도 세포 배양, 즉 10 µ M (짙은 빨간색), 1 µ M (적자 색), 그리고 0.1 µ M (블루)에 추가 될 때. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
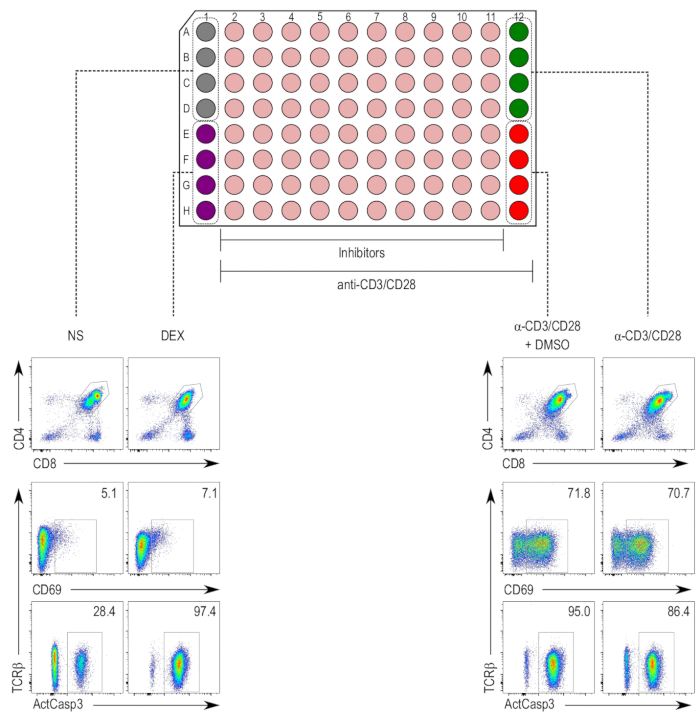
그림 2 : Thymocyte 활성화 분석 결과의 플레이트 레이아웃. (맨 위) 열 1 및 12 열 2 11 억제제 치료 샘플 (베이지색) 동안 컨트롤에 대 한 예약 되어 있습니다. 부정적인 제어 (nonstimulated [NS]; 그레이) D1, 하 웰 스 a 1을 차지 하 고 세포 죽음 (dexamethasone 취급 [덱 스]; 자주색)에 대 한 긍정적인 통제 우물 E1 H1 차지. 열 2 ~ 12 thymocytes 안티-CD3/CD28 구슬 자극된 포함 되어 있습니다. Thymocyte 활성화 (자극된 샘플 [α-CD3/CD28]; 녹색)에 대 한 긍정적인 제어 차지 웰 스 A12 D12, 및 차량 제어를 (자극과 DMSO 치료 [α-CD3/CD28 + DMSO] 빨간색;) 우물 E12 H12 차지. (아래) 활성 caspase-3 (ActCasp3), CD69, cytometry 플롯 흐름 및 TCRβ thymocytes 이중 양성 (DP) 게이트 내 문이의 얼룩. 다른 컨트롤의 대표 작이 표시 됩니다. NS = nonstimulated; 덱 스 = dexamethasone 처리 샘플; Α-CD3/CD28 + DMSO 샘플 CD3/CD28-코팅 구슬 자극과 DMSO; 치료 = Α-CD3/CD28 = 샘플 CD3/CD28-코팅 구슬 자극된. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
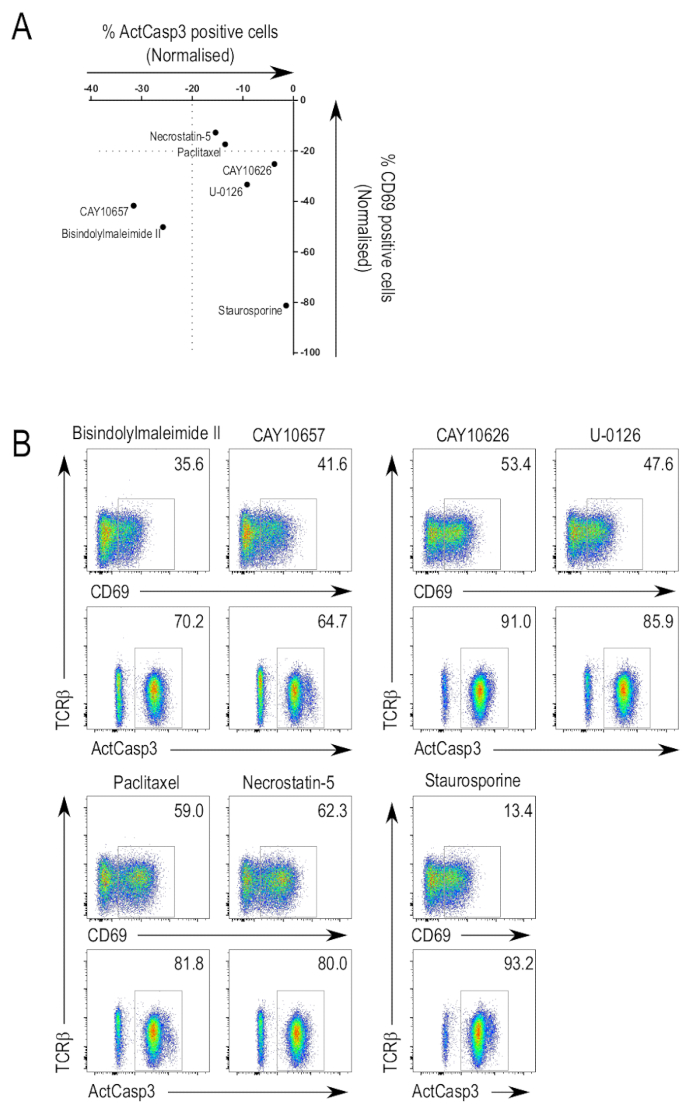
그림 3 : Thymocyte 활성화에 억제제 라이브러리의 심사. (A) 데이터 활성화 분석 결과의 요약. 이 활성화 된 caspase 3와 CD69 식을 선택한 억제제에 대 한 셀의 정규화 된 값을 보여주는 대표적인 실험의 결과입니다. 정규화는 액티브 caspase 3 양성 또는 CD69 포지티브 게이트 그래프에서 0의 상대적인 값으로 설정 되어 있는 DMSO 처리 컨트롤의 값을 셀의 비율을 비교 하 여 이루어졌다. (B) 선택 FACS 플롯합니다. 억제제 caspase 3 활성화와 CD69 upregulation (왼쪽 상단), 억압의 흐름 cytometry 플롯만 CD69 upregulation (오른쪽 위), 억제 또는 caspase 3 활성화 및 CD69 upregulation (왼쪽 아래)에 영향을 주지 않습니다를 했다. Staurosporine 처리 샘플의 플롯 억제제를 사용 하 여 독성 농도 (오른쪽 하단)에서 효과 설명 하기 위해 표시 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
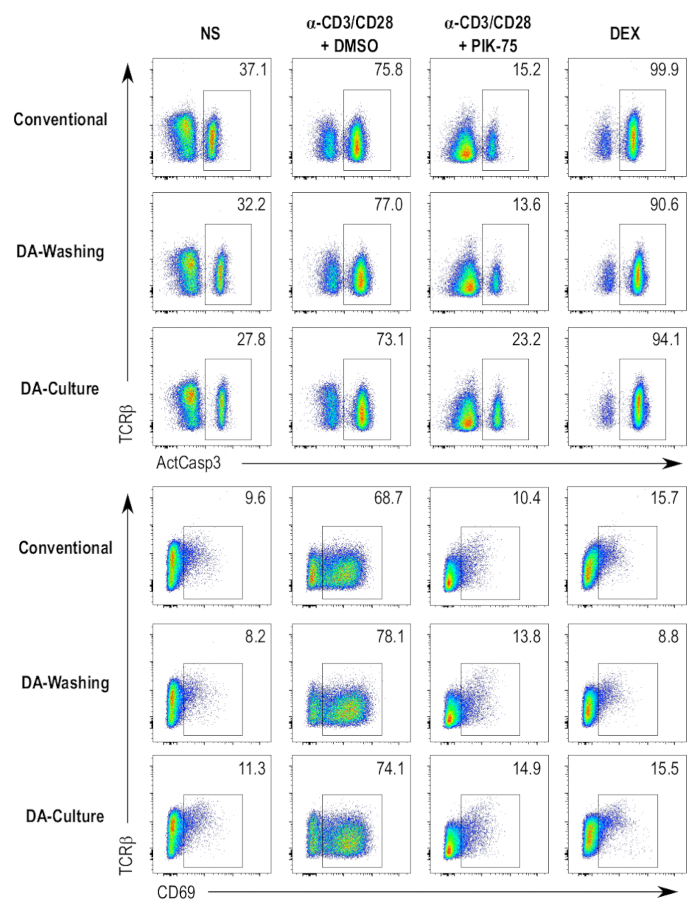
그림 4 : 다른 분석 결과 프로토콜의 비교. 활성 caspase-3 (ActCasp3), CD69, cytometry 플롯 흐름 그리고 프로토콜 분석 결과 TCRβ DP thymocytes 다음 다른 3의 얼룩. 4 다른 조건 테스트, 즉 부정적인 제어 (nonstimulated [NS]), 세포 죽음 (dexamethasone 취급 [덱 스])에 대 한 긍정적인 제어, 차량 제어 (자극과 DMSO 치료 [α-CD3/CD28 + DMSO]), 억제제 치료 샘플 (자극 그리고 PIK 75 취급 [α-CD3/CD28 + PIK-75]). 기존의 표준 96 잘 접시에서 thymocytes의 경작 및 기존의 원심 기반 프로토콜; 얼룩 = 다 세척 = thymocytes 표준 96 잘 접시에서의 경작 및 프로토콜; 세척 층 류를 사용 하 여 얼룩 다 문화 = thymocytes 작은 볼륨 판에서의 경작 및 세척 프로토콜 층 류를 사용 하 여 동일한 격판덮개에 얼룩. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
여기 제안 심사 전략 T 세포 활성화 CD69 upregulation와 TCR downregulation의 전통적인 마커 뿐만 아니라 자극 후 thymocytes에 apoptotic 효과 억제 하는 작은 분자 억제제의 기능 평가 . 추가 마커 다른 thymocyte 하위32의 분석을 포함 될 수 있습니다. 현재 분석 결과의 흥미로운 측면 TCR 신호 방해 억제제 또한 apoptosis, 더 TCR 독립적인 효과 억제제에 세포 죽음을 유도 할 수 있습니다의 구별을 강조의 유도 저해할 것 사실에서 속 인 다. 또한, cytometry 기반 시작 흐름 분석 결과 별도 개별 분기의 TCR 신호에 억제제의 효과 보고 수 고유 활성화 마커로 여러 표시기를 사용 하 여가 있습니다. 여기에 제시 된 경우, caspase 3 활성화 CD69 upregulation의 차동 저해는 저 해제 했다. 일부 화합물 단백질 합성 또는 기공을 밀매 같은 가사 기능에 영향을 미칠 수 있습니다, 때문에 그것은 놀라운 합성 드 노 보 마커 (예를 들어, CD69)의 upregulation에 하지만 posttranslational 효과 관찰 하 수정 (예를 들어, caspase 3의 분해 활성화).
분석 결과 제시로 여기 측정 apoptosis를 판독으로는 저 해제의 잠재 독성 효과 결과 가리지 않도록 할 필수적입니다. 예를 들어 화면에서 우리가 않았다 하지 희석 staurosporine 1 nM, 여전히 그 농도에서 세포에 독성이 되 고 그것에 불구 하 고. 대표 결과 무차별 kinase 억제제 및 apoptosis33의 유도 되 고 staurosporine와는. 비 독성 농도 시험 화합물의 충분 한 희석 하지 않고 잠재적인 안타를 간과 하기 가능 하다.
여기 상세한 심사 전략 높은 처리량 검열을 위한 thymocytes의 충분 한 숫자를 얻기와 관련 된 합병증으로 인해 인 간에 게 적용 하기 어려운 것입니다. 그러나, 그것이 소아 심장 biopsies34,35 또는 태아36,37에서 인간의 thymus 샘플을 얻을 수 있습니다. 그럼에도 불구 하 고, TCR 신호 경로 및 신호 단백질의 아미노산 시퀀스는 주로 쥐와 인간 사이 보존으로 thymocyte 분석 결과 유용한 예비 심사 전략을 제공 하 고 마우스를 사용 하 여이 분석 결과 얻은 모든 결과 thymocytes 다음, 기본 인간 림프 톨에 확인할 수 있습니다.
기존의 원심 분리-의존 프로토콜의 한계가 셀 permeabilization 및 원심 분리 단계를 포함 하는 과정의 다단계 성격에 기 인할 수 있다 세포 손실의 장래성에 적용 됩니다. 각 원심 분리 및 물의 resuspension 단계 필연적으로 하지 셀의 손실에 결과. 이러한 손실을 제한 된 수의 샘플을 포함 하는 연구에 대 한 중요 한 되지 않을 수도 있습니다, 그것은 문제를 384-에 1536-잘에서 96-분석 결과 형식 진행으로 특히 높은 처리량 검열에서 적용 될 때를 내포할 수 있습니다. 이 문제를 우회 하는 한 가지 방법은 셀 permeabilization 및 여러 세척5의 합병증을 피하는 동안 caspase 활성화의 감지 하는 세포 침투성 형광 caspase 센서38 사용입니다. 또는, 고용 층 흐름에 의해 세포를 세척 하는 원심 분리 독립 방법 셀 손실 최소화에 대 한 가능성도 있다. 자동화 된 플레이트 벽 없는 접시와 함께에서 역 세척 세포 분리기의 사용 없이 층 흐름에 의해 세척 된다. 시 약의 지 수 희석 3 분 미만, 원심 세척의 2 라운드에 동등한 희석을 나타내는 셀의 철저 하 고 효율적인 rinsing에 대 한 수 있습니다. 원심 분리로 인해 외부 스트레스 없이 셀 더 실용적 이며 셀 손실 최소화 됩니다.
우리는 또한 96 잘 U-하단에 thymocytes 경작 후 역 세척 자동화 된 접시를 사용의 가능성을 탐험 접시와, 또한, 벽 없는 접시 역 세척 자동화 된 플레이트와 호환에서 직접 셀의 경작. 벽 없는 판에 셀의 경작의 모든 원심 분리 단계 제거 고 접시에 걸쳐 샘플 전송에 대 한 필요성을 제거 하 여 세포 손실 최소화. 일반적으로, 세 가지 다른 프로토콜 자극 효율성과 얼룩에 비교할 수 있습니다. 자동된 세척 역 자동화, 속도, 그리고 쉽게 더 높은 처리량 분석 효율의 이점을 제공 한다. 또한, 증가 자동화 세척 단계 수행할 수 있습니다 더 빨리, 그리고 실험 또는 경험 사이 큰 일관성. 그러나, 세척 역은 특정 단점: 대용량 버퍼 세척의 세탁기 못쓰게 버퍼 변경, 50 mL에 사용 되는 당 (150 mL);에 대 한 필요는 여분 배려; 작은 볼륨 판의 우물 사이의 제한 된 분할 때문에 우물의 어떤 상호 오염을 피하기 위해 접시를 처리할 때 필요 높은에서 준비 하는 시 약의 사용을 필요로 하는 세척 후 스에서 25 µ L의 잔여 버퍼 1 x 농도 보다. 해결 하기 위해 잔류 볼륨의 문제와 접시의 한정 된 볼륨 용량, 150 µ L 70 µ L에서 인큐베이션 볼륨 확장을 추가할 수 있습니다, 기존 프로토콜의 도입을 촉진. 자동된 판 처리 시스템 현재 사용할 수 있지만, 그들은 ~ 1 입방 피트 (~0.028 m3)의 작은 단위 층 류 세척 시스템에 비해 상당한 풋프린트가 있다. 또한, 시스템을 처리 하는 자동화 된 접시에 원심 분리의 통합, 셀 세척에서 그들의 사용을 제한 하는 도전 이다. 현재 다른 분리기 독립 셀 우리가 아는 악기, 세척이 있다.
여기에 제시 된 검사 전략은 작은 분자, TCR 신호 및 T 세포 활성화에 영향을 주는 그들의 의도적인된 목표 kinases 식별할 수 있습니다. 여기에 사용 하는 라이브러리 kinases의 주로 작은 분자 억제제를 구성 하 고 잠재적으로 흥미로운 안타의 숫자를 생성 하 수 있었다. 억제제 라이브러리 다른 효소 클래스 또는 작은 분자의 다른 종류 뿐만 아니라 다른 화합물 (예를 들어, 다양 한 고분자)의 라이브러리가 프로토콜은 또한 쉽게 적용 수 있습니다. 프로토콜 또한 주변 T 세포 또는 유전자 변형 TCRs 표현 또는 기자 시스템을 들고 그를 포함 하 여 불멸 하 게 셀 등 다른 세포 유형, 화면을 사용할 수 있습니다. 식별 및 T-세포 신호 통로의 우리의 지식을 향상 시킬 수 있으며 또한 면역 질환13,,1415, 에 타겟된 치료의 개발에 도움이 신호의 새로운 중재자 16. T 세포 신호 를 통해 높은 처리량 검열 분석 실험의 중재자의 검출에 대 한 사용할 수 있는 옵션의 범위를 추가,이 연구.
공개
저자 Chyan 잉 애 다 셀 세탁기를 생산 하 고이 문서에서 사용 되는 다 셀 접시 Curiox 농의 직원입니다.
감사의 말
이 작품은 (N.R.J.G.)에 싱가포르 사역의 건강의 국립 의학 연구 위원회, NMRC CBRG15may017는 싱가포르 교육부의 교육, 2014-t 2-1-136에서 교부 금에 의해 지원 되었다.
자료
| Name | Company | Catalog Number | Comments |
| RPMI | HyClone | SH30027FS | |
| FBS | HyClone | SH3007103 | |
| L-Glutamine | HyClone | SH3003401 | |
| Sodium pyruvate | HyClone | SH3023901 | |
| Penicillin/Streptomycin | HyClone | SV30010 | |
| b-mercaptoethanol | Sigma Aldrich | 516732 | |
| 10X PBS | Vivantis | PB0344 – 1L | |
| Kinase Screening Library (96-Well) | Cayman Chemical | 10505 | Exact contents of the library may vary |
| DMSO | Sigma Aldrich | D2650 | |
| Dexamethasone | Sigma Aldrich | D4902 | |
| anti-CD3/CD28 beads | Thermo Fisher Scientific | 11452D | |
| FITC Active Caspase-3 Apoptosis Kit | BD Pharmingen | 550480 | Contains Fixation/Permeabilisation buffer, 10X Perm/Wash buffer and anti-caspase 3 antibody |
| DA-Cell Washer | CURIOX | HT1000 | |
| 96-well DA-Cell Plate | CURIOX | 96-DC-CL-05 | |
| Antibodies | |||
| CD3e | BioLegend | 100236 | |
| TCRb | BD Biosciences | 553174 | |
| CD4 | BD Biosciences | 740007 | |
| CD8 | BD Biosciences | 563786 | |
| CD69 | eBioscience | 25-0699-42 | |
| Inhibitors | |||
| TG003 | Cayman Chemical | - | From the Kinase Screening Library |
| PKC 412 | Cayman Chemical | - | From the Kinase Screening Library |
| Doramapimod | Cayman Chemical | - | From the Kinase Screening Library |
| Paclitaxel | Cayman Chemical | - | From the Kinase Screening Library |
| Erlotinib | Cayman Chemical | - | From the Kinase Screening Library |
| Necrostatin-5 | Cayman Chemical | - | From the Kinase Screening Library |
| NVP-BEZ235 | Cayman Chemical | - | From the Kinase Screening Library |
| Phthalazinone pyrazole | Cayman Chemical | - | From the Kinase Screening Library |
| AG-879 | Cayman Chemical | - | From the Kinase Screening Library |
| 1-NA-PP1 | Cayman Chemical | - | From the Kinase Screening Library |
| Torin 1 | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide II | Cayman Chemical | - | From the Kinase Screening Library |
| BIBF 1120 | Cayman Chemical | - | From the Kinase Screening Library |
| SMI-4a | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide XI (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10657 | Cayman Chemical | - | From the Kinase Screening Library |
| AS-703026 | Cayman Chemical | - | From the Kinase Screening Library |
| Chelerythrine chloride | Cayman Chemical | - | From the Kinase Screening Library |
| Tunicamycin | Cayman Chemical | - | From the Kinase Screening Library |
| GSK 1059615 | Cayman Chemical | - | From the Kinase Screening Library |
| Ruxolitinib | Cayman Chemical | - | From the Kinase Screening Library |
| Necrostatin-1 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 505124 | Cayman Chemical | - | From the Kinase Screening Library |
| INK128 | Cayman Chemical | - | From the Kinase Screening Library |
| Canertinib (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| SB 431542 | Cayman Chemical | - | From the Kinase Screening Library |
| PD 173074 | Cayman Chemical | - | From the Kinase Screening Library |
| Valproic Acid (sodium salt) | Cayman Chemical | - | From the Kinase Screening Library |
| PD 0325901 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 203580 | Cayman Chemical | - | From the Kinase Screening Library |
| VX-702 | Cayman Chemical | - | From the Kinase Screening Library |
| Emodin | Cayman Chemical | - | From the Kinase Screening Library |
| CHIR99021 | Cayman Chemical | - | From the Kinase Screening Library |
| BIO | Cayman Chemical | - | From the Kinase Screening Library |
| Imatinib (mesylate) | Cayman Chemical | - | From the Kinase Screening Library |
| Sunitinib Malate | Cayman Chemical | - | From the Kinase Screening Library |
| Gefitinib | Cayman Chemical | - | From the Kinase Screening Library |
| PP2 | Cayman Chemical | - | From the Kinase Screening Library |
| 3-Methyladenine | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide I | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide IV | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide V | Cayman Chemical | - | From the Kinase Screening Library |
| NSC 663284 | Cayman Chemical | - | From the Kinase Screening Library |
| D 4476 | Cayman Chemical | - | From the Kinase Screening Library |
| NU 7026 | Cayman Chemical | - | From the Kinase Screening Library |
| H-9 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Indirubin-3'-monoxime | Cayman Chemical | - | From the Kinase Screening Library |
| KN-62 | Cayman Chemical | - | From the Kinase Screening Library |
| KN-93 | Cayman Chemical | - | From the Kinase Screening Library |
| CGP 57380 | Cayman Chemical | - | From the Kinase Screening Library |
| Iso-Olomoucine | Cayman Chemical | - | From the Kinase Screening Library |
| (S)-Glycyl-H-1152 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide VIII (acetate) | Cayman Chemical | - | From the Kinase Screening Library |
| ST638 | Cayman Chemical | - | From the Kinase Screening Library |
| SU 6656 | Cayman Chemical | - | From the Kinase Screening Library |
| LY364947 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 203580 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10621 | Cayman Chemical | - | From the Kinase Screening Library |
| YM-201636 | Cayman Chemical | - | From the Kinase Screening Library |
| ZM 447439 | Cayman Chemical | - | From the Kinase Screening Library |
| AS-041164 | Cayman Chemical | - | From the Kinase Screening Library |
| NVP-AEW541 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| PP242 | Cayman Chemical | - | From the Kinase Screening Library |
| ABT-869 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10622 | Cayman Chemical | - | From the Kinase Screening Library |
| 17β-hydroxy Wortmannin | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10626 | Cayman Chemical | - | From the Kinase Screening Library |
| SU 6668 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10572 | Cayman Chemical | - | From the Kinase Screening Library |
| N,N-Dimethylsphingosine | Cayman Chemical | - | From the Kinase Screening Library |
| LY294002 | Cayman Chemical | - | From the Kinase Screening Library |
| U-0126 | Cayman Chemical | - | From the Kinase Screening Library |
| Staurosporine | Cayman Chemical | - | From the Kinase Screening Library |
| KN-92 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| AS-605240 (potassium salt) | Cayman Chemical | - | From the Kinase Screening Library |
| O-1918 | Cayman Chemical | - | From the Kinase Screening Library |
| Y-27632 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Leelamine | Cayman Chemical | - | From the Kinase Screening Library |
| PD 98059 | Cayman Chemical | - | From the Kinase Screening Library |
| PD 169316 | Cayman Chemical | - | From the Kinase Screening Library |
| TGX-221 | Cayman Chemical | - | From the Kinase Screening Library |
| (S)-H-1152 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| AS-605240 | Cayman Chemical | - | From the Kinase Screening Library |
| D-erythro-Sphingosine C-18 | Cayman Chemical | - | From the Kinase Screening Library |
| OSU03012 | Cayman Chemical | - | From the Kinase Screening Library |
| JNJ-10198409 | Cayman Chemical | - | From the Kinase Screening Library |
| Leelamine (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Arachidonic Acid Leelamide | Cayman Chemical | - | From the Kinase Screening Library |
| Lauric Acid Leelamide | Cayman Chemical | - | From the Kinase Screening Library |
| AS-252424 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10505 | Cayman Chemical | - | From the Kinase Screening Library |
| PI-103 | Cayman Chemical | - | From the Kinase Screening Library |
| PIK-75 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Sphingosine Kinase Inhibitor 2 | Cayman Chemical | - | From the Kinase Screening Library |
| Piceatannol | Cayman Chemical | - | From the Kinase Screening Library |
| SC-1 | Cayman Chemical | - | From the Kinase Screening Library |
| (R)-Roscovitine | Cayman Chemical | - | From the Kinase Screening Library |
| BAY-43-9006 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10561 | Cayman Chemical | - | From the Kinase Screening Library |
| AS-604850 | Cayman Chemical | - | From the Kinase Screening Library |
| PI3-Kinase α Inhibitor 2 | Cayman Chemical | - | From the Kinase Screening Library |
| ML-9 | Cayman Chemical | - | From the Kinase Screening Library |
| Triciribine | Cayman Chemical | - | From the Kinase Screening Library |
| Erbstatin Analog | Cayman Chemical | - | From the Kinase Screening Library |
| Kenpaullone | Cayman Chemical | - | From the Kinase Screening Library |
| Olomoucine | Cayman Chemical | - | From the Kinase Screening Library |
| AG-494 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-825 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-1478 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 216763 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 415286 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-17 | Cayman Chemical | - | From the Kinase Screening Library |
| H-8 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| LFM-A13 | Cayman Chemical | - | From the Kinase Screening Library |
| SC-514 | Cayman Chemical | - | From the Kinase Screening Library |
| Apigenin | Cayman Chemical | - | From the Kinase Screening Library |
| AG-18 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10554 | Cayman Chemical | - | From the Kinase Screening Library |
| DRB | Cayman Chemical | - | From the Kinase Screening Library |
| RG-13022 | Cayman Chemical | - | From the Kinase Screening Library |
| RG-14620 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-490 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-82 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-99 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-213 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-183 | Cayman Chemical | - | From the Kinase Screening Library |
| Lavendustin C | Cayman Chemical | - | From the Kinase Screening Library |
| ZM 336372 | Cayman Chemical | - | From the Kinase Screening Library |
| 5-Iodotubercidin | Cayman Chemical | - | From the Kinase Screening Library |
| SB 202190 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10571 | Cayman Chemical | - | From the Kinase Screening Library |
| Nilotinib | Cayman Chemical | - | From the Kinase Screening Library |
| SP 600125 | Cayman Chemical | - | From the Kinase Screening Library |
| L-threo-Sphingosine C-18 | Cayman Chemical | - | From the Kinase Screening Library |
| H-89 | Cayman Chemical | - | From the Kinase Screening Library |
| HA-1077 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| AG-370 | Cayman Chemical | - | From the Kinase Screening Library |
| Wortmannin | Cayman Chemical | - | From the Kinase Screening Library |
| AG-1296 | Cayman Chemical | - | From the Kinase Screening Library |
| KT 5823 | Cayman Chemical | - | From the Kinase Screening Library |
| Janex 1 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10574 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10575 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10576 | Cayman Chemical | - | From the Kinase Screening Library |
| NH125 | Cayman Chemical | - | From the Kinase Screening Library |
| TWS119 | Cayman Chemical | - | From the Kinase Screening Library |
| NSC 210902 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10577 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10578 | Cayman Chemical | - | From the Kinase Screening Library |
| PD 184161 | Cayman Chemical | - | From the Kinase Screening Library |
| CCT018159 | Cayman Chemical | - | From the Kinase Screening Library |
| Myricetin | Cayman Chemical | - | From the Kinase Screening Library |
참고문헌
- Gascoigne, N. R., Rybakin, V., Acuto, O., Brzostek, J. TCR Signal Strength and T Cell Development. Annual Review of Cell and Developmental Biology. 32, 327-348 (2016).
- Rothenberg, E. V., Moore, J. E., Yui, M. A. Launching the T-cell-lineage developmental programme. Nature Reviews Immunology. 8 (1), 9-21 (2008).
- Klein, L., Hinterberger, M., Wirnsberger, G., Kyewski, B. Antigen presentation in the thymus for positive selection and central tolerance induction. Nature Reviews Immunology. 9 (12), 833-844 (2009).
- Starr, T. K., Jameson, S. C., Hogquist, K. A. Positive and negative selection of T cells. Annual Review of Immunology. 21, 139-176 (2003).
- Rybakin, V., Gascoigne, N. R. Negative selection assay based on stimulation of T cell receptor transgenic thymocytes with peptide-MHC tetramers. PLoS One. 7 (8), e43191 (2012).
- Krogsgaard, M., Juang, J., Davis, M. M. A role for "self" in T-cell activation. Seminars in Immunology. 19 (4), 236-244 (2007).
- Nakayama, T., Yamashita, M. The TCR-mediated signaling pathways that control the direction of helper T cell differentiation. Seminars in Immunology. 22 (5), 303-309 (2010).
- Hoerter, J. A., et al. Coreceptor affinity for MHC defines peptide specificity requirements for TCR interaction with coagonist peptide-MHC. The Journal of Experimental Medicine. 210 (9), 1807-1821 (2013).
- Zhao, X., et al. Nonstimulatory peptide-MHC enhances human T-cell antigen-specific responses by amplifying proximal TCR signaling. Nature Communications. 9 (1), 2716 (2018).
- Fu, G., et al. Fine-tuning T cell receptor signaling to control T cell development. Trends in Immunology. 35 (7), 311-318 (2014).
- Wang, D., et al. Tespa1 is involved in late thymocyte development through the regulation of TCR-mediated signaling. Nature Immunology. 13 (6), 560-568 (2012).
- Fu, G., et al. Themis sets the signal threshold for positive and negative selection in T-cell development. Nature. 504 (7480), 441-445 (2013).
- Rosenblum, M. D., Gratz, I. K., Paw, J. S., Abbas, A. K. Treating human autoimmunity: current practice and future prospects. Science Translational Medicine. 4 (125), (2012).
- Hebeisen, M., et al. SHP-1 phosphatase activity counteracts increased T cell receptor affinity. The Journal of Clinical Investigation. 123 (3), 1044-1056 (2013).
- Wang, R. E., et al. An immunosuppressive antibody-drug conjugate. Journal of the American Chemical Society. 137 (9), 3229-3232 (2015).
- Borroto, A., et al. First-in-class inhibitor of the T cell receptor for the treatment of autoimmune diseases. Science Translational Medicine. 8 (370), (2016).
- Chen, E. W., Brzostek, J., Gascoigne, N. R. J., Rybakin, V. Development of a screening strategy for new modulators of T cell receptor signaling and T cell activation. Scientific Reports. 8 (1), 10046 (2018).
- Fouda, A., Tahsini, M., Khodayarian, F., Al-Nafisah, F., Rafei, M. A Fluorescence-based Lymphocyte Assay Suitable for High-throughput Screening of Small Molecules. Journal of Visualized Experiments. (121), e55199 (2017).
- Zhao, Z., et al. A high-throughput phenotypic screen of cytotoxic T lymphocyte lytic granule exocytosis reveals candidate immunosuppressants. Journal of Biomolecular Screening. 20 (3), 359-371 (2015).
- Florian, A. E., et al. Flow cytometry enables a high-throughput homogeneous fluorescent antibody-binding assay for cytotoxic T cell lytic granule exocytosis. Journal of Biomolecular Screening. 18 (4), 420-429 (2013).
- Krutzik, P. O., Crane, J. M., Clutter, M. R., Nolan, G. P. High-content single-cell drug screening with phosphospecific flow cytometry. Nature Chemical Biology. 4 (2), 132-142 (2008).
- Vlahos, C. J., Matter, W. F., Hui, K. Y., Brown, R. F. A specific inhibitor of phosphatidylinositol 3-kinase, 2-(4-morpholinyl)-8-phenyl-4H-1-benzopyran-4-one (LY294002). The Journal of Biological Chemistry. 269 (7), 5241-5248 (1994).
- Chen, Z., et al. Synthesis and SAR of novel 4-morpholinopyrrolopyrimidine derivatives as potent phosphatidylinositol 3-kinase inhibitors. Journal of Medicinal Chemistry. 53 (8), 3169-3182 (2010).
- Ruegg, U. T., Burgess, G. M. Staurosporine, K-252 and UCN-01: potent but nonspecific inhibitors of protein kinases. Trends in Pharmacological Sciences. 10 (6), 218-220 (1989).
- Davis, P. D., et al. Inhibitors of protein kinase C. 1. 2,3-Bisarylmaleimides. Journal of Medicinal Chemistry. 35 (1), 177-184 (1992).
- Komander, D., et al. Interactions of LY333531 and other bisindolyl maleimide inhibitors with PDK1. Structure (London, England: 1993). 12 (2), 215-226 (2004).
- Gassel, M., et al. The protein kinase C inhibitor bisindolyl maleimide 2 binds with reversed orientations to different conformations of protein kinase A. The Journal of Biological Chemistry. 279 (22), 23679-23690 (2004).
- Faull, A., Johnstone, C., Morley, A., et al. . Novel compounds. , (2003).
- Favata, M. F., et al. Identification of a novel inhibitor of mitogen-activated protein kinase kinase. The Journal of Biological Chemistry. 273 (29), 18623-18632 (1998).
- Woods, C. M., Zhu, J., McQueney, P. A., Bollag, D., Lazarides, E. Taxol-induced mitotic block triggers rapid onset of a p53-independent apoptotic pathway. Molecular Medicine (Cambridge, MA). 1 (5), 506-526 (1995).
- Teng, X., et al. Structure-activity relationship study of novel necroptosis inhibitors. Bioorganic & Medicinal Chemistry Letters. 15 (22), 5039-5044 (2005).
- Saini, M., et al. Regulation of Zap70 expression during thymocyte development enables temporal separation of CD4 and CD8 repertoire selection at different signaling thresholds. Science Signaling. 3 (114), ra23 (2010).
- Chae, H. J., et al. Molecular mechanism of staurosporine-induced apoptosis in osteoblasts. Pharmacological Research. 42 (4), 373-381 (2000).
- Varas, A., et al. Analysis of the human neonatal thymus: evidence for a transient thymic involution. Journal of Immunology (Baltimore, MD:1950). 164 (12), 6260-6267 (2000).
- Verstichel, G., et al. The checkpoint for agonist selection precedes conventional selection in human thymus. Science Immunology. 2 (8), (2017).
- Yamaguchi, E., de Vries, J., Yssel, H. Differentiation of human single-positive fetal thymocytes in vitro into IL-4- and/or IFN-gamma-producing CD4+ and CD8+ T cells. International Immunology. 11 (4), 593-603 (1999).
- Farley, A. M., et al. Dynamics of thymus organogenesis and colonization in early human development. Development (Cambridge, UK). 140 (9), 2015-2026 (2013).
- Cali, J. J., et al. Bioluminescent assays for ADMET. Expert Opinion on Drug Metabolism & Toxicology. 4 (1), 103-120 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유