Method Article
T 細胞受容体を介してライブラリ化学阻害剤のスクリーニングのメディエーターの同定
* これらの著者は同等に貢献しました
要約
本稿は、化学剤のスクリーン ライブラリに阻害剤と T 細胞受容体のシグナル伝達に影響を与えるそれらのターゲットを識別するためフロー ベース フローサイトメトリー分析を使用します。ここで説明する方法は、ハイスループットス クリーニングにも拡張できます。
要約
T 細胞受容体 (TCR) シグナリング経路を送信するメディエーターの多数で構成されては、TCR の活性化に通知します。さまざまな戦略を提案し、TCR シグナル、T 細胞活性化や胸腺選択を含むプロセスの理解を改善する新しいの仲介人を識別するために実装します。TCR シグナルに基づいて開発胸腺細胞の活性化に影響を与える分子の同定を可能にする検定法について述べる。強い TCR 信号が起こす開発胸腺細胞アポトーシス機構負の淘汰と呼ばれるプロセスでをアクティブにします。キナーゼ阻害剤のアプリケーションを介して TCR シグナルに影響を与えるターゲットとのそれらは否定的な選択のプロセスを無効にすることができます。本稿で詳説した方法は、TCR シグナル伝達経路の確立された役割を持つ標準的なキナーゼの阻害剤とも TCR シグナル伝達経路の確立にまだ新しいキナーゼの阻害剤を識別するために使用できます。スクリーニング戦略をここでは、TCR シグナル伝達に新たな druggable 標的の同定のための高いスループットの画面に適用できます。
概要
T 細胞は適応免疫の維持に極めて重要な役割を果たすリンパ球の系統です。抗原提示の表面に見られるバインドされたペプチド ligands、主要組織適合遺伝子複合体分子 (MHC) から成る複合体を認識することができます、TCR を表する細胞 (APCs)。TCR TCR/MHC の相互作用を通してシグナリングパスのトリガーは、T 細胞の活性化と開発1にとって重要です。
T 細胞の開発、骨由来骨髄造血幹細胞 (造血) は胸腺、彼らが分化し、T 細胞系列の進行2の段階を経るに移行します。ダブル ポジティブ (DP) 胸腺細胞の CD4 および CD8 の両方のコレセプターを表現する自己ペプチド/MHC Apc に従事します。自己ペプチド/MHC リガンドの中程度の親和性を持つ胸腺細胞成熟単一正 (SP) CD4 や CD8 胸腺細胞の正の選択と呼ばれるプロセスになります。逆に、自己ペプチド/非自己を過剰な TCR 刺激を受ける胸腺細胞アポトーシスを介して負の淘汰3,4を受けます。抗 CD3/28 抗体をコートしたビーズ5でたとえば、胸腺細胞を刺激することにより体外模倣できる刺激誘起、カスパーゼ依存性のアポトーシスのこのプロセスです。選択プロセスを通過する成熟した T 細胞は、周囲の Apc から非自己ペプチド/MHC リガンドによってアクティブ化されます。自己ペプチド/非自己、生存とホメオスタシス増殖、ヘルパー T 細胞の分化、非-自己-ペプチド/非自己を介して T 細胞応答の向上のためのシグナリングの強壮剤のコンテキストで、末梢の T 細胞にも関連します。coagonism6,7,8,9。高親和性ペプチド/MHC リガンド TCR 結合は、複雑な TCR シグナリング ネットワーク10を形成多くのシグナル伝達分子を含むいくつかのダウン ストリーム信号経路をアクティブにします。経路の新しい仲介の発見が11,12の印を示さないまだや TCR シグナル伝達経路は数十年、検討されています。TCR シグナル伝達経路の変調は、臨床関連性を持って、免疫療法のアプリケーションまたは自己免疫13の制御のための T 細胞の応答の抑制のための T 細胞の応答を増強を伴います。T 細胞反応の調節のための戦略は主にキナーゼやホスファターゼ活性14,15,16の中断によって異なります。
TCR シグナルと17T 細胞活性化を調節する能力の小さな化合物のスクリーニング フロー ベース フローサイトメトリー分析の応用について述べる。アッセイは、強力な TCR 信号にさらされるアポトーシス経路を活性化する胸腺細胞の現象にかかっています。刺激強度の変化を識別するために十分に敏感であります。インキュベート胸腺細胞との親和性を増加ペプチド/MHC テトラマー トランスジェニック TCR を表現するカスパーゼはアポトーシス応答5の対策としてアクティベーション使用の対応する増加で起因しました。画面のキナーゼ阻害剤のライブラリを使用し、強い TCR シグナルに胸腺細胞応答を調整する能力を評価します。
いくつかの流れ cytometry ベースまたは蛍光レポーター ベースの戦略は、さまざまな T 細胞サブセットにおける周辺活性化表現型の品揃えの高スループット スクリーニングのため記載されています。このような戦略は、タイミングと T 細胞活性化18の大きさを評価するために遺伝的蛍光レポーターの使用、脱顆粒を細胞傷害性 T 細胞の活動19、20読み出しとの分析として使用、細胞シグナリング21に関与する様々 な蛋白質のリン酸化。
ここに示すスクリーニング アッセイは正常に TCR シグナル伝達経路として TCR シグナル抑制効果と潜在的な新規化合物の標準的な分子を阻害する化合物を識別することができます。たとえば、T 細胞応答17に影響を与える新規化合物として GSK3β と Hsp90 阻害剤がわかりました。アッセイのシグナル、細胞毒性の抑制剤の TCR に依存しない効果からのアポトーシス応答の減少による干渉抑制剤を区別することです。アポトーシスの誘導、に加えてまた測定 CD69 アップレギュレーションと TCR ダウンレギュレーション活性化のマーカーとして。TCR シグナル伝達ネットワークは複雑、として複数読み出しの使用は、単一経路に対する特異的効果を持つ分子の発見のチャンスを増やすことができます。ここでは、元のプロトコルの高速代替として染色、フローサイトメトリーによる解析のための準備でのセルの中に遠心分離独立したプロトコルの使用を紹介します。このペーパーで説明アッセイ キナーゼ阻害剤の小さな化合物ライブラリーを使用されますが、原則として、高スループット スクリーニングのため使用することができます。選択したライブラリも様々 な阻害剤や他の分子を組み込むことができます。
プロトコル
本研究では 6-8 週齢のオスとメスの c57bl/6 マウスは使用されました。シンガポール国立大学 (シンガポール) での動物実験施設で飼育されたマウス。シンガポール国立大学制度アニマル ・ ケアおよび使用委員会 (IACUC)、すべての動物実験を承認しました。
1. 胸腺細胞懸濁液の準備
- CO2チャンバーにマウスを安楽死させます。
- 細胞培養の汚染を避けるためにティッシュ文化フードの後続の手順を実行します。マウス死体解剖基板にピンを使用してセキュリティで保護された、70% エタノールでマウスをスプレーします。
- はさみのペアを使用して、顎に向かって腹部腹側縦切開を行います。さらに後ろ足の各々 に沿って切開を加えます。胸郭を公開し、それを突き止めるのために皮膚をストレッチします。
- はさみのペアで横隔膜と肋骨後端からの両側をカットします。胸郭を持ち上げて公開胸腺にピンします。胸腺を結び付ける結合組織を分離・ カーブタイプ鉗子のペアを使用して胸腺を抽出します。
- 5 mL の完全な RPMI 培を含む 6 ウェル プレートのウェルに胸腺を配置します。
注: を考慮 10% 炭除去牛胎児血清 (FBS) を場合長い胸腺細胞生存率を改善するためにメディアに追加する郭清と刺激試験の間の待ち時間を期待します。 - 優しく、注射器の鈍い端を使用して、胸腺をマッシュ アップして、70 μ M の細胞ストレーナーをセルを通過します。また、健康的な状態で胸腺細胞を収集する胸腺上皮から流れ、胸腺を絞るし、胸腺細胞を収集する鉗子の 2 つのペアを使用して検討してください。
- 診断または楽器を数える自動セルを使用してセルのカウントに進みます。
2. 毒性濃度キナーゼ阻害剤の滴定
注: このセクションは、T 細胞の活性化の画面で使用する阻害剤を準備に焦点を当てください。阻害剤は高濃度で使用は、T 細胞活性化スクリーンの読み出しである細胞死を引き起こすことができます。阻害剤の希釈液のシリーズを目指す TCR 刺激から独立してアポトーシスを誘導する必要があります個々 の阻害剤の最終濃度を決定します。本研究で使用されるキナーゼ阻害剤のライブラリは、外部のベンダーから購入しました。阻害剤のリストは、テーブルの材料に含まれます。
-
低濃度でキナーゼ阻害剤のプレートの準備
- 阻害剤 1 mM の板を準備するには、ジメチルスルホキシド (DMSO) すべての阻害剤の 90 μ L に阻害剤の 10 μ L を追加します。
注: 本研究で使用される低分子ライブラリから阻害剤は、10 mM のストック濃度で来る。阻害剤が餌の形態にある場合、サプライヤーから推奨再構成手順に従います。阻害剤が 10 mM でない場合、代わりに、代替の適切な濃度で阻害剤プレートを準備し、適切な希釈倍率と阻害剤の別のシリアル希薄を準備します。
注意: 毒性阻害剤の場合は、安全な取り扱いと廃棄に製造元の指示に従ってください。 - 阻害剤 0.1 mM のプレートを準備するには、DMSO の 90 μ L に 1 mM 阻害剤のプレートから阻害剤の 10 μ L を追加します。
- 0.01 mM で阻害剤のプレートを準備するには、DMSO の 90 μ L に阻害剤 0.1 mM の板から阻害剤の 10 μ L を追加します。
- 阻害剤 1 mM の板を準備するには、ジメチルスルホキシド (DMSO) すべての阻害剤の 90 μ L に阻害剤の 10 μ L を追加します。
-
胸腺細胞キナーゼ阻害剤の治療
- セクション 1 に従って胸腺細胞懸濁液を準備します。
- 5 x 10 の6セル/mL の胸腺細胞懸濁液を取得する完全な RPMI 胸腺細胞を希釈します。
- 96 ウェル プレート、マルチ チャンネル ピペットを使用してのすべてのウェルに胸腺細胞懸濁液 200 μ L を追加します。
- 各ウェルにも 1 mM 阻害 (抑制剤の最終濃度は 10 μ M) を含むプレートへの対応から阻害剤の 2 μ L を追加します。
- 同じ板で DMSO の 2 μ L の追加によって未処理のコントロールの 4 つの井戸、5 μ M デキサメサゾン治療ポジティブ コントロール、4 つの井戸、マイナス コントロールの車両処理の 4 つの井戸を準備します。
- 37 ° c、5% CO2インキュベーター 17-20 h の胸腺細胞を孵化させなさい (または夜通し)。
-
個々 の阻害剤の適切な濃度の定量
- 300 x gで胸腺の皿を回し、4 ° C、5 分は、FACS 洗浄バッファーの 250 μ L で細胞を再懸濁します。
- サンプルのフローサイトを実行し、流れフローサイトメトリー解析プログラムで結果を分析します。
- FSC SSC ゲートに基づいて生きているセルの割合を決定します。ゲートの戦略を図 1 bに示します。
- 100% で正規化されます DMSO 処理コントロールに基づいて生きているセルの割合の平均値を計算します。許容可能な細胞死 (e.g.,20%) の任意のウィンドウを設定します。このウィンドウ (すなわち.、DMSO 処理コントロールの 80% 以下) の下の生きているセルの割合を発生させた阻害剤は、低濃度で再テストすることです。
- 2.3.4 のステップの実行可能性の基準を通過しなかった阻害剤、手順 2.2.1 - 2.3.4, からの手順を繰り返しますが、0.1 mM で 1 mM 阻害剤を含むプレートではなくステップ 2.2.4 で阻害剤のプレートを使用します。ここで使用される抑制剤の最終濃度は 1 μ M です。
- まだ 1 μ M で細胞死の高レベルを生成、0.1 μ M で阻害剤をテストする阻害剤の 2.2.1 - 2.3.4,、手順ステップ 2.2.4 で 0.01 mM で阻害剤のプレートを使用します。ここで使用される抑制剤の最終濃度は、0.1 μ M です。
-
キナーゼ阻害剤のストック プレートの準備
- 10 μ M で使用する阻害剤、DMSO の 10 μ L を 10 mM 阻害剤の 10 μ L を追加します。
- 1 μ M で使用する阻害剤、DMSO の 19 μ L に 10 mM の阻害剤の 1 μ L を追加します。
- 0.1 μ M で使用する阻害剤、DMSO (図 1) の 199 μ L に 10 mM 阻害剤の 1 μ L を追加します。
注: 阻害剤の準備のストック プレートは胸腺細胞懸濁液に追加する目的の最終濃度濃度 × 500 です。阻害剤のストック プレートは、PCR ストリップまたは 96 ウェル プレートで用意できます。 - キナーゼ阻害剤のストック プレートは、従来の遠心分離に依存したシステム (セクション 3; 参照図 1 a方法 1 および 2)、または代替の遠心分離独立システム (セクション 4; 参照胸腺細胞のスクリーニングのために適用できます。図 1 a、方法 3)。
3 キナーゼ阻害剤ライブラリ (従来型遠心分離機を用いた測定) をスクリーニング
-
胸腺細胞キナーゼ阻害剤の治療
- セクション 1 に従って胸腺細胞懸濁液を準備します。
- 5 x 10 の6セル/mL の胸腺細胞懸濁液を取得する完全な RPMI 胸腺細胞を希釈します。
- マルチ チャンネル ピペットを使用して 96 ウェル プレートの各ウェルに胸腺細胞の 200 μ L を追加します。氷の上の皿を配置します。
- セクション 2.4 で 0.5 μ L 阻害剤のストック プレートの対応する井戸から 96 ウェル プレートに阻害剤の準備に追加します。
- 8 井戸の未処理のコントロールを準備します。DMSO の 0.5 μ L を追加することによって、車両処理コントロールの 4 つの井戸を準備します。5 μ M デキサメサゾン治療コントロール (図 2) の 4 つの井戸を準備します。
-
抗 CD3/CD28 ビーズを用いた胸腺細胞の刺激
- ビーズの 1 mL をとり、2 ml の PBS のビーズを洗浄します。磁気スタンドを使用してビーズを分離し、ソリューションを吸引します。完全な RPMI 5 mL にビーズを再懸濁します。
注: セルにビーズの比は、1 〜 2.5 です。刺激する井戸の数と使用される胸腺細胞数に応じて実行するビーズの量を調整します。 - 各阻害剤のサンプル、4 つの DMSO 処理サンプル、および 8 個の未処理のサンプルの 4 つにビーズの 50 μ L を追加します。残りの 4 つの未処理井戸に完全な RPMI の 50 μ L を追加します。図 2は、プレートの一般的なレイアウトを示します。
- マルチ チャンネル ピペットを使用して井戸の内容をミックスします。
- 37 ° c、5% CO2インキュベーター 17-20 h の胸腺細胞を孵化させなさい (または夜通し)。
- ビーズの 1 mL をとり、2 ml の PBS のビーズを洗浄します。磁気スタンドを使用してビーズを分離し、ソリューションを吸引します。完全な RPMI 5 mL にビーズを再懸濁します。
-
細胞表面抗原の染色
- 反 TCRβ、抗 cd4 抗体、抗 CD8、アンチ CD69 抗体を含む抗体染色混合物を準備します。1: 200 (v/v) の割合で FACS 洗浄バッファー (0.5% ウシ血清アルブミン [BSA] を添加した PBS) の抗体を希釈します。
注: は、異なる実験で染色の変動を最小限に抑えるため、信号対雑音比を改善するために、固定抗体の希薄を使用する代わりに、染色用抗体の最適化を検討します。 - 300 × gで 5 分のための 4 ° C のプレートをスピンします。
- 液を捨てプレートをフリックします。
- プロトコルは、従来の遠心分離機依存プロトコルを従うことができますこの時点で (3.3.5 ステップへ進みます;図 1 a方法 1 を参照してください) または代替の遠心分離に依存しないプロトコル (4.4.4 をステップへ進みます;図 1 aメソッドを参照してください2)。
- 3.3.1 準備した染色の抗体の混合物の 75 μ L で細胞を再懸濁します。
- マルチ チャンネル ピペットを使用してサンプルを混ぜ、30 分間氷の上にそれらを孵化させなさい。
- 反 TCRβ、抗 cd4 抗体、抗 CD8、アンチ CD69 抗体を含む抗体染色混合物を準備します。1: 200 (v/v) の割合で FACS 洗浄バッファー (0.5% ウシ血清アルブミン [BSA] を添加した PBS) の抗体を希釈します。
-
細胞の固定
- FACS 洗浄バッファーの 200 μ L で井戸を洗浄し、 gおよび 4 ° C、5 分 × 300 でプレートをスピンします。
- 液を捨てプレートをフリックします。
- 固定/透過バッファーを追加 (アクティブなカスパーゼ 3 アポトーシス キットが付属してパーマ/洗浄バッファー x 10 と同じで述べたステップ 3.5.1 3.5.2 の手順でアンチ カスパーゼ 3 抗体) 200 μ L/ウェルで。
- 氷上で 30 分間インキュベートします。
-
アクティブなカスパーゼ 3 のために汚れる細胞内
- 1 x パーマ/洗浄バッファーを準備するには、5 mL の超純水水 45 mL に 10 の x パーマ/洗浄バッファーを希釈します。
- パーマ/洗浄バッファー x 1 6.5 mL にアンチ カスパーゼ 3 抗体の 1.3 mL を追加することによって細胞内のアクティブなカスパーゼ汚れを準備します。パーマ/洗浄バッファーに対する抗体の比は 1:5 です。
- 300 x gでプレートをスピンし、4 ° C、5 分フリック ソリューションを破棄するプレート。1 x パーマ/洗浄バッファーの 200 μ L で洗浄します。
- 3.5.3 のステップを繰り返します。
- 300 x gでプレートをスピンし、4 ° C、5 分フリック ソリューションを破棄するプレート。細胞内のカスパーゼ染色手順 3.5.2 すべての井戸で準備の 75 μ L を追加します。
- マルチ チャンネル ピペットを使用してサンプルをミックスし、氷上で 1 時間インキュベートします。
- 1 x パーマ/洗浄バッファーの 200 μ L のサンプルを洗って 300 × gで 5 分のための 4 ° C のプレートをスピンします。
- 液を捨てプレートをフリックします。1 x パーマ/洗浄バッファーの 200 μ L で洗浄します。300 × gで 5 分のための 4 ° C のプレートをスピンします。
- 液を捨て、FACS 洗浄バッファーの 200 μ L のサンプルを再懸濁しますにプレートをフリックします。
- サンプルのフローサイトを実行し、FACS 解析プログラムで結果を分析します。
- CD4 および CD8 の肯定的な表現と DP 胸腺細胞の人口にゲート CD4とCD8 プロットを使用すると、(図 2、下半分)。DP 胸腺細胞ゲート内で活性化されたカスパーゼ 3、陽性対照としてネガティブ コントロールとデキサメタゾン処理サンプルを使用して細胞の割合を決定します。DP 胸腺細胞ゲートで CD69 の表現の分析のため肯定的な制御として負の制御および刺激のサンプルとして些細のサンプルを使用します。
注: DP 胸腺細胞のゲーティングしているとき、は、DP 胸腺細胞の人口は個々 のサンプルのため正しく区切られてことを確認します。刺激細胞レセプター表面コレセプターおよびイベントの意図しない除外は、タイトな DP のゲートを使用する場合に発生します。
4. キナーゼ阻害剤ライブラリ (遠心分離独立スクリーニングアッセイ)
-
胸腺細胞キナーゼ阻害剤の治療
- セクション 1 に従って胸腺細胞懸濁液を準備します。
- 25 x 106セル/mL の胸腺細胞懸濁液を取得する完全な RPMI で胸腺細胞を希釈します。
- マルチ チャンネル ピペットを使用して少量プレートの各ウェルに胸腺細胞の 40 μ L を追加します。氷の上の皿を配置します。
- ストック プレート、DMSO、および完全な RPMI の 4 つの部分の比率で完全に RPMI でデキサメタゾンから阻害剤/DMSO/デキサメタゾン (5 倍希釈) の一部に阻害剤を希釈します。
注: この小さなボリューム プレートで使用されるボリュームは従来より小さい x 5、阻害剤およびコントロール試薬が希釈プレートの胸腺細胞にそれらを追加する前に 5 倍。 - 4.1.4 準備した阻害剤板の対応する井戸から 96 ウェル プレートに阻害剤の 0.5 μ L を追加します。
- 8 井戸の未処理のコントロールを準備します。4.1.4 準備した DMSO の 0.5 μ L を追加することによって、車両処理コントロールの 4 つの井戸を準備します。5 μ M デキサメサゾン治療コントロールの 4.1.4 (図 2) のステップで準備希薄化後のデキサメタゾンを使用して 4 つの井戸を準備します。
-
抗 CD3/CD28 ビーズを用いた胸腺細胞の刺激
- ビードが均一に再停止されることを確認します。ビーズの 1 mL をとり、2 mL の PBS で洗浄します。磁気スタンドを使用してビーズを分離し、ソリューションを吸引します。完全な RPMI 1 mL にビーズを再懸濁します。
注: セルにビーズの比は、1 〜 2.5 です。刺激する井戸の数や使用される胸腺細胞の数によって、ビーズの量を調整します。 - 各阻害剤のサンプル、4 つの DMSO 処理サンプル、および 8 個の未処理のサンプルの 4 つにビーズ懸濁液の 10 μ L を追加します。残りの 4 つの未処理井戸に完全な RPMI の 10 μ L を追加します。図 2は、一般的なプレート レイアウトを示しています。
注: 井戸の最終巻は 50 μ L、井戸の最大の容量であります。注意を行使して直立した、クロスも流出を避けるためにプレートを保持するために重要です。 - ミックス、マイクロ プレート軌道シェーカーを使用してプレートを揺り動かしなさい。また、マルチ チャンネル ピペットを使用して井戸の内容をミックスします。
- 37 ° c、5% CO2インキュベーター 17-20 h の胸腺細胞を孵化させなさい (または一晩) 反蒸発ふた付き。
- ビードが均一に再停止されることを確認します。ビーズの 1 mL をとり、2 mL の PBS で洗浄します。磁気スタンドを使用してビーズを分離し、ソリューションを吸引します。完全な RPMI 1 mL にビーズを再懸濁します。
-
プレート洗浄機のセットアップ
注: プレート ワッシャーをセットアップする手順は、製造元によって提供されます。手順は、簡単に言うと以下に記載されています。約 150 mL の溶液は、ごとのプライミングの手順が必要です。- 含有 1% 70% エタノールで洗浄システムをプライム トゥイーン 20。
- 1% を含む脱イオン水洗浄システムをプライム トゥイーン 20。
- プライム FACS 洗浄バッファーで洗浄システム。
-
細胞表面抗原の染色
- 反 TCRβ、抗 cd4 抗体、抗 CD8、アンチ CD69 抗体を含む抗体染色混合物を準備します。1: 100 (v/v) の割合で FACS 洗浄バッファーで抗体を希釈します。
- プレート 9 x、洗浄、洗浄システム自動化された層流を用いたあたり FACS 洗浄バッファーの 55 μ L を使用して洗ってください。
注意: 洗浄の最後に、各ウェルに残気量を 25 μ l 添加があるでしょう。 - 4.4.1 のステップで準備染色抗体の混合物の 25 μ L で細胞を再懸濁します。
- サンプルを (ステップ 3.3.4) から 96 ウェル プレートから転送した場合 3.3.1 の手順で作製した抗体の混合物の 50 μ L で細胞を再懸濁し、サンプルを少量プレートに転送します。この手順は、図 1 aに示されている、メソッド数 2 に対応します。
- ミックス、軌道マイクロ プレート シェーカーにプレートを扇動またはマルチ チャンネル ピペットを使用してサンプルをミックスし、氷上で 30 分間インキュベートします。
-
細胞の固定
- プレート 9 x、洗浄、洗浄システム自動化された層流を用いたあたり FACS 洗浄バッファーの 55 μ L を使用して洗ってください。
- 固定/透過バッファーを追加 (アクティブなカスパーゼ 3 アポトーシス キットが付属していますパーマ/洗浄バッファー x 10 と同じで述べたステップ 4.6.1 ステップ 4.6.2 でアンチ カスパーゼ 3 抗体) ウェルあたり 50 μ L で。
- 氷上で 30 分間インキュベートします。
-
アクティブなカスパーゼ 3 のために汚れる細胞内
- 225 mL の純水で 10 x パーマ/洗浄バッファーの 25 mL を希釈して 1 x パーマ/洗浄バッファーを準備します。
- パーマ/洗浄バッファー x 1 の 2 mL にアンチ カスパーゼ 3 抗体の 1 つの mL を追加することによって細胞内のアクティブなカスパーゼ汚れを準備します。パーマ/洗浄バッファーに対する抗体の比率は 1:2 です。
- プライム パーマ/洗浄バッファー × 1 洗浄システム。
- 9、洗浄各洗浄のため 55 μ L でのパーマ/洗浄バッファー x 1 x。
- すべての井戸にステップ 4.6.2 で準備細胞内のカスパーゼ汚れの 25 μ L を追加します。
- ミックスするには、軌道マイクロ プレート シェーカーにプレートを扇動またはマルチ チャンネル ピペットを使用してサンプルをミックスし、氷上で 1 時間インキュベートします。
- 9、洗浄各洗浄のため 55 μ L でのパーマ/洗浄バッファー x 1 x。
- すべての井戸に FACS 洗浄バッファーの 25 μ L を追加します。
- マイクロタイター チューブに十分な混合によるピペッティングした後サンプルを転送します。
- 空井戸に FACS 洗浄バッファーの別の 50 μ L を追加し、手順 4.6.9.
- 4.6.9 と 4.6.10 手順を繰り返します 2 倍マイクロタイター チューブで 200 μ L のサンプルが収集されるまで。
注: 4.6.10 と 4.6.11 の手順で説明されている手順の目的は、小ボリューム プレートからセルの最大回復を確保するためです。セル番号をステップ 4.6.10 後心配ない場合、単のトップアップ、マイクロタイター チューブ FACS 洗浄バッファーで 200 μ L。 - サンプルのフローサイトを実行し、ステップ 3.5.11 に従っての FACS 解析プログラムで結果を分析します。カスパーゼ 3 活性化と CD69 式 CD4 を含むゲートで分析し、+CD8+DP 胸腺細胞。
結果
スクリーニングの試金へのアプローチは、図 1 aのとおりです。キナーゼ阻害剤は、胸腺細胞生存率への潜在的な影響の最初上映されました。アポトーシスのポジティブ コントロールとしてデキサメタゾンはアポトーシス剤として使用されました。生きているセル人口のゲートには、未処理のネガティブ コントロールとデキサメサゾン治療の肯定的なコントロール (図 1 b) に基づき決定されました。阻害剤は、胸腺細胞、10 μ M でテストされた最初と 18 時間培養後の生菌数の割合を測定しました。細胞死の 20% ウィンドウが化合物を誘導するように選ばれた大きい 20% 以上 DMSO 処理したサンプルと比較して、生細胞ゲートの細胞の損失は、低濃度 (図 1 b) でテストされました。生存分析を説明するために選択した阻害剤サンプルの代表の FACS プロットが表示されます。LY294002 (2-(4-morpholinyl)-8-phenyl-4H-1-benzopyran-4-one;CA 154447-36-6)、PI3K 阻害剤22、10 μ M で細胞死を大幅に増加しなかった、阻害物質は、その後の試金のため 10 μ M で使用されました。CAY10626 (N-[2-(dimethylamino)ethyl]-N-methyl-4-[[[4-[4-(4-morpholinyl)-7-(2,2,2-trifluoroethyl)-7H-pyrrolo[2,3-d]pyrimidin-2-yl]phenyl]amino]carbonyl]amino]-benzamide;CA 1202884-94-3)、PI3Kα/mTOR23、デュアル阻害剤誘導細胞死 10 μ M での高レベルおよび μ M が下流の試金のアプリケーションに適した濃度に決定した 1 μ M で 0.1 μ M、0.1 ではなく。スタウロスポリン (2,3,10,11,12,13-hexahydro-10R-methoxy-9S-methyl-11R-methylamino-9S,13R-epoxy-1H,9H-diindolo[1,2,3-gh;3',2',1'-lm]pyrrolo[3,4-j][1,7]benzodiazonin-1-one;CA 62996-74-1)、24、アポトーシスを誘導するために確立された能力を持つパン蛋白質キナーゼ C 阻害剤は、すべての濃度が 0.1 μ M でも、テストで重要な細胞死を誘導します。それは、追加の肯定的な制御として 0.1 μ M で後続の試金で使用されました。
阻害剤の最終濃度は、前記ない DMSO 処理サンプルの 20% 以上細胞死を増幅した彼らの最高濃度に基づいて選ばれました。決定阻害剤の最終濃度と阻害剤のストック プレートは、すべての阻害剤が 500 倍濃度のセルに適用されるようなものを調製しました。図 1は、阻害剤の最終濃度のストック プレートのプレート レイアウトを示しています。アッセイを洗い流流れの小さなボリューム プレートに直接細胞の培養の代替プロトコル、小さなボリュームの使用量は阻害剤のさらに希釈を必要とします。ように DMSO コンテンツ文化の阻害剤の添加は、セルの高すぎるだろう後、阻害剤さらに希釈された完全な RPMI で 5 の希釈倍率で 100 回目的濃度に適用されるときに、セルです。
無毒の濃度に希釈して、阻害剤は、胸腺細胞5,17の TCR 刺激誘発アポトーシスの試金で使用されました。刺激を 18 h の抗 CD3/CD28 ビーズを使用して実施し、, CD4 のカスパーゼ 3 の活性化のための後染色された+および CD8+ DP 胸腺細胞人口 (図 2)。カスパーゼ 3 活性化および CD69 式とも TCR ダウンレギュレーションの増加は、抗 CD3/CD28-刺激と DMSO モック治療抗 CD3/28 刺激サンプル、nonstimulated のサンプルと比較してみ。デキサメタゾン処理サンプル TCR 刺激の独立しているアポトーシス誘導効果の期待されている CD69 アップレギュレーションの独立したカスパーゼ 3 活性化の増加を示した。
図 3 aは、ライブラリ選択阻害剤に対するスクリーニングの結果をまとめたものです。カスパーゼ 3 活性化および CD69 を発現の抑制のための関心の潜在的な抑制剤を識別するために使用できます。予想通り、TCR シグナルの標準的なメディエーターの阻害剤は画面で正のヒットとして現れた。このような阻害剤は、抑制力の度合いを表わしたにターゲットに複数のキナーゼ、またより広域の阻害剤が含まれている特異的阻害剤。いくつかの阻害剤 CD69 アップレギュレーション (図 3 b、一番上の行、左側パネル) カスパーゼ 3 の活性化を抑制することができた。このような 1 つの阻害剤は bisindolylmaleimide (3-(1H-Indol-3-yl)-4-[1-[2-(1-methyl-2-pyrrolidinyl)ethyl]-1H-indol-3-yl]-1H-pyrrole-2,5-dione; II です。CA 137592-45-1)、プロテインキナーゼ A および PDK125,26,27に加えてすべての蛋白質キナーゼ C アイソ阻害。このカテゴリの別の阻害剤は CAY10657 (3-[(aminocarbonyl)amino]-5-[4-(4-morpholinylmethyl)phenyl]-2-thiophenecarboxamide;CAS 494772-86-0) IKK228, 阻害剤。
CD69 アップレギュレーションを抑制したが、カスパーゼ 3 の活性化 (図 3 b上段、右パネル) を損なわないかの化合物があった。CAY10626、PI3Kα と mTOR23、および U-0126 の阻害剤 (2, 3-ビス [アミノ [(2-aminophenyl) チオ] メチレン]-butanedinitrile;CA 109511-58-2)、MEK 阻害剤29の場合は、識別された抑制剤のいくつかであった。T 細胞活性化の現象の選択的障害でとりわけ後期キナーゼ標的 TCR シグナル伝達経路の特定の分岐から別のキナーゼをターゲットと異なる阻害させる可能性がある結果を示します。
CD69 アップレギュレーションとカスパーゼ 3 活性化 (図 3 b下段、左パネル) の両方を抑制しなかった阻害剤もあった。パクリタ キセル (βS-(ベンゾイルアミノ) - αR - ヒドロキシ-benzenepropanoic 酸、(2aR,4S,4aS,6R,9S,11S,12S,12aR,12bS)-6,12b-bis(acetyloxy)-12-(benzoyloxy)-2a,3,4,4a,5,6,9,10,11,12,12a,12b-dodecahydro-4,11-dihydroxy-4a,8,13,13-tetramethyl-5-oxo-7、11-methano-1H-cyclodeca[3,4]benz[1,2-b]oxet-9-yl のエステル。CA 33069-62-4)、微小管ダイナミクス30、および necrostatin-5 (2-[[3,4,5,6,7,8-hexahydro-3-(4-methoxyphenyl)-4-oxo[1]benzothieno[2,3-d]pyrimidin-2-yl]thio]-acetonitrile; の撹乱をCA 337349-54-9)、31RIP1 キナーゼの阻害剤がこのカテゴリーにある識別される 2 つの阻害剤。CD69 アップレギュレーションとカスパーゼ 3 の活性化が障害されていない場所においても、このことができます阻害剤による目標としないこと TCR シグナル伝達経路の関連するキナーゼ。
前述のとおり、スタウロスポリンはまだ、胸腺細胞のアポトーシスを誘導した濃度で、画面で使用されました。予想通り、スタウロスポリン処理サンプルはカスパーゼ 3 活性化 (図 3 b、一番下の行、右の列) の高レベルを示した。CD69 式の低レベルは、bisindolylmaleimide II、別のパン PKC 阻害剤も CD69 の発現を抑制、PKC、スタウロスポリンを介した抑制に帰することができます。また、スタウロスポリン アポトーシス細胞の活性を上昇させることができた前に CD69 式。
スループットの向上、およびプロトコルの自動化、システム経由で層流を洗浄自動プレートの使用を含んだパラレル プロトコルを調製しました。この自動プレート洗浄装置を使用して 2 つの独立したプロトコルは試験的と 96 ウェルプレートでの細胞を培養し、遠心分離依存プロトコルのセルを汚すの従来の方法と比較して.1 つの方法標準的な手順に従って、96 ウェル プレートで細胞を培養、その後、染色自動プレート洗濯機と互換性のあるプレートにセルを転送する手順 (図 4、DA 洗濯サンプル)。他の方法では、プレート-洗濯機-互換性のあるプレートに直接細胞を培養と同じプレート (図 4、DA 文化サンプル) の汚損のプロトコルを続行を関与しています。遠心分離に依存しないプロトコルはアクティブなカスパーゼ 3、CD69 または従来の遠心分離依存プロトコル (図 4) と比較して、別の試料にわたって染色 TCRβ で多くの知覚の違いを与えること。染色の手順の中にわずかに異なる濃度の抗体を使用する染色強度の違いを帰することができます。
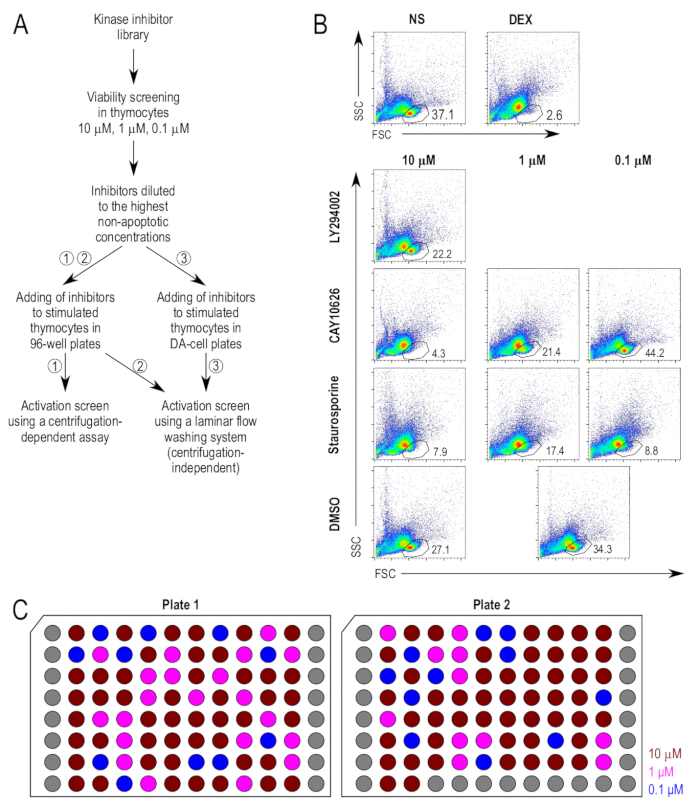
図 1: 阻害剤で治療後胸腺細胞生存率。(A) スクリーニング アッセイの主な手順の実験の概要です。刺激、すなわち (1) の従来の遠心分離に基づくプロトコルを使用して染色に続いて、標準の 96 ウェル プレートで胸腺細胞の培養、活性化の試金で使用される胸腺細胞の染色の 3 つの手法がある (2)同じプレートを使用して染色に続いて少量平板における胸腺細胞の培養染色法による遠心分離独立洗濯プロトコル、および (3) に続いて、標準の 96 ウェル プレートで胸腺細胞の培養、遠心分離独立洗濯プロトコル。(B) 実行可能性の試金で使用される戦略をゲートします。生きているセル ゲート前方散乱 (FSC) から派生したし、側方散乱 (SSC) プロット、前述の17として。阻害剤テストの濃度でも毒性が認められるものは、10 倍濃度のさらなる生存率アッセイに応じてあった。代表的な阻害剤のサンプルが表示されます。1 μ M と 0.1 μ M の試料に使用される一般的なコントロール (DMSO 処理 [DMSO]) に注意してください。(C) 希釈剤のプレート レイアウト。目的の最終濃度 x 500 の濃度に希釈して DMSO の阻害剤のプレートの略図。それぞれ、よく 1 つのユニークな阻害剤;灰色の井戸は空です。表示濃度は、最終濃度培養細胞、すなわち 10 μ M (濃い赤)、1 μ M (フクシア) と 0.1 μ M (ブルー) に追加されたときです。この図の拡大版を表示するのにはここをクリックしてください。
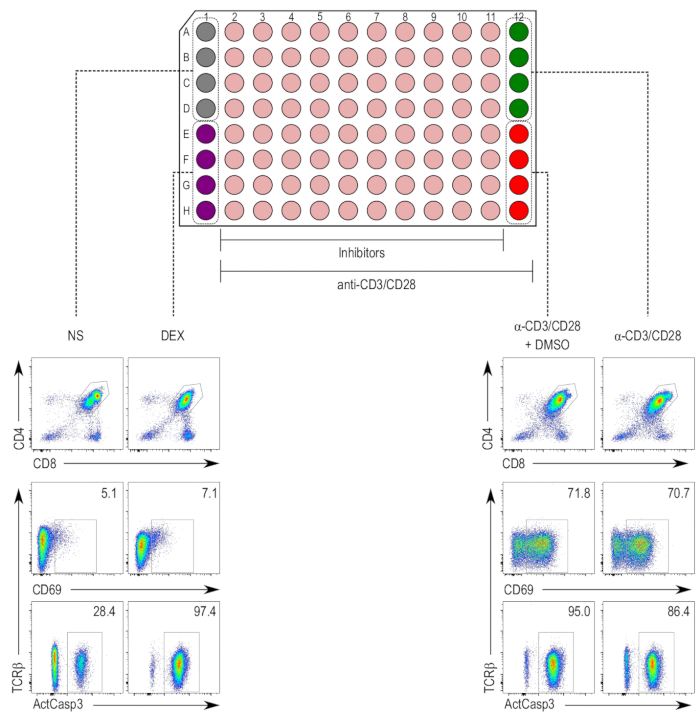
図 2: 胸腺細胞活性化アッセイ プレート レイアウトします。(Top)列 1 と 12 はコントロール、予約 2 を 11 列が阻害剤サンプル (ベージュ)。ネガティブ コントロール (nonstimulated [NS]; グレー) 占める井戸 A1 d1 と H1 E1 井戸に細胞死 (デキサメタゾン治療 [DEX]; 紫) の肯定的なコントロールが占めます。列 2 に 12 には、胸腺細胞抗 CD3/CD28 ビーズで刺激にはが含まれています。井戸 A12 D12 と車両制御に胸腺細胞活性化 (刺激サンプル [α-CD3/CD28]; グリーン) の肯定的なコントロールが占める (刺激と DMSO 処理 [α-CD3/CD28 + DMSO] 赤) 井戸 E12 H12 を占めています。(下)アクティブなカスパーゼ-3 (ActCasp3)、CD69 のフローサイトメトリー プロットの流れと TCRβ ダブル ポジティブ (DP) ゲート内ゲート胸腺細胞の染色します。さまざまなコントロールの代表的なプロットが表示されます。NS = nonstimulated;DEX デキサメタゾン処理のサンプルを =Α-CD3/CD28 + DMSO CD3/CD28 をコートしたビーズで刺激し、DMSO の処理のサンプルを =Α-CD3/CD28 CD3/CD28 をコートしたビーズで刺激のサンプルを =。この図の拡大版を表示するのにはここをクリックしてください。
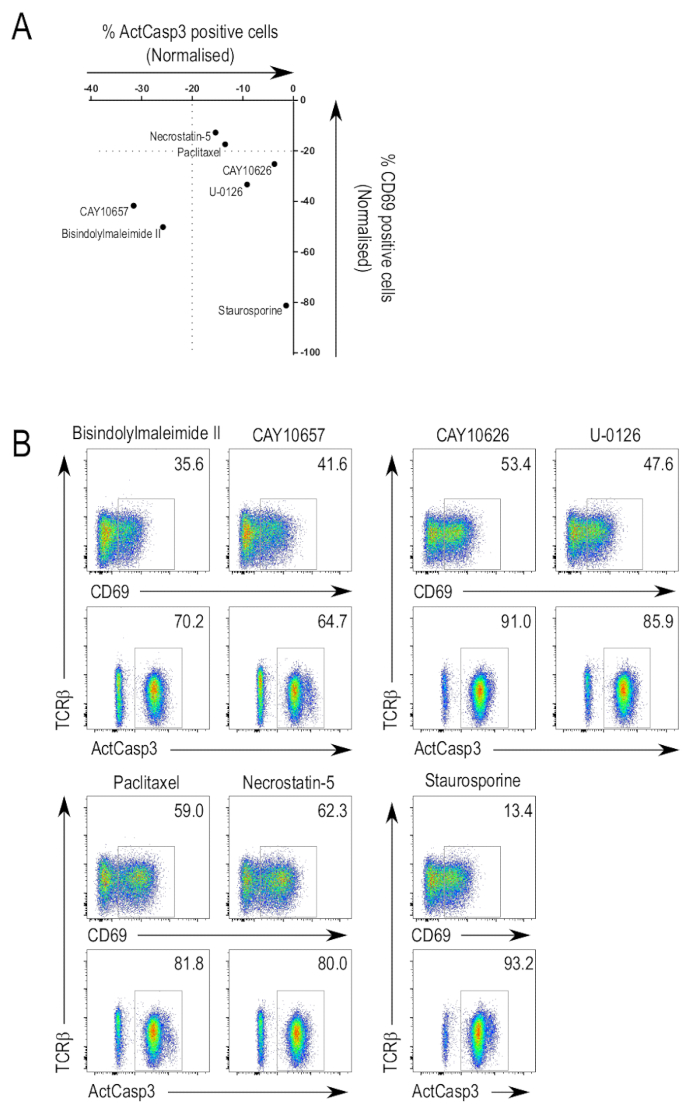
図 3: 胸腺細胞活性化阻害剤ライブラリのスクリーニングします。(A) 活発化アッセイのデータを要約します。これらの活性化されたカスパーゼ 3 と選択した阻害剤の CD69 式セルの正規化された値を示す代表的な実験の結果です。正規化は、アクティブなカスパーゼ 3 陽性または CD69 正ゲート DMSO 処理コントロールの相対値のグラフで 0 に設定されている値のセルの割合を比較することによって行われていた。(B) 選択 FACS がプロットされます。カスパーゼ 3 活性化 CD69 アップレギュレーション (左上) を抑圧した阻害剤の流れ cytometry プロットのみ CD69 アップレギュレーション (右上) を抑制またはカスパーゼ 3 活性化および CD69 アップレギュレーション (左下) に影響を与えなかった。スタウロスポリン処理サンプルのプロットは、有毒な濃度 (右下) の阻害剤を使用する効果を説明するために表示されます。この図の拡大版を表示するのにはここをクリックしてください。
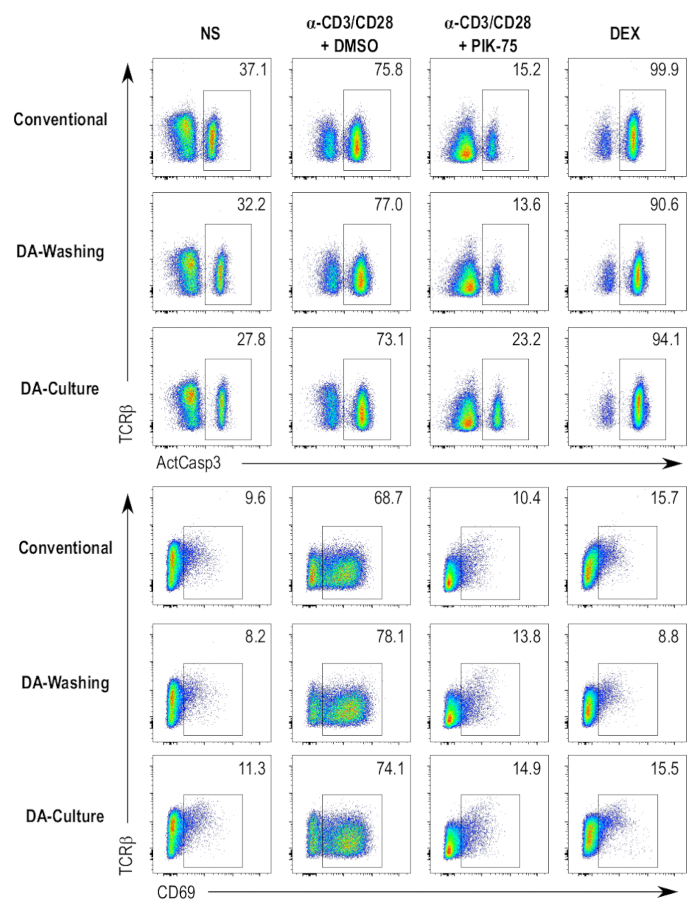
図 4: 別の試金のプロトコルの比較。アクティブなカスパーゼ-3 (ActCasp3)、CD69 のフローサイトメトリー プロットの流れし、TCRβ は次の 3 種類の異なる DP 胸腺細胞の染色プロトコルを試金。4 つの異なる条件をテストすると、すなわちネガティブ コントロール (nonstimulated [NS])、細胞死 (デキサメタゾン治療 [DEX]) の肯定的な制御、車両制御 (刺激と DMSO 処理 [α-CD3/CD28 + DMSO])、阻害剤治療サンプル (刺激、PIK 75 治療 [α-CD3/CD28 + PIK-75])。従来 = 標準の 96 ウェル プレートで胸腺細胞の培養と従来の遠心分離に基づくプロトコル; 染色DA 洗濯 = 標準の 96 ウェル プレートで胸腺細胞の培養および染色法による層流のプロトコルを洗浄DA 文化 = 少量平板における胸腺細胞の培養とプロトコルを洗浄層流を用いた同じ板で染色します。 この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
ここで提案されたスクリーニングの作戦は T 細胞活性化 CD69 アップレギュレーションと TCR ダウンレギュレーションのより従来のマーカーに加え、刺激後胸腺細胞におけるアポトーシス効果を抑制する小分子阻害剤の能力を評価します。.その他のマーカーは異なる胸腺細胞サブセット32の分析を有効に含めることもできます。現在アッセイの興味深い側面に TCR シグナルを阻害する阻害剤とアポトーシス、細胞死を誘導する阻害剤が TCR に依存しない効果の区別をさらに強調を湿らしても実際にはあります。さらに、cytometry 流れベースのアッセイでは、TCR シグナリングの別の個々 の枝に、阻害剤の効果を報告可能性があります異なる活性化マーカーとして複数読み出しの使用ができます。ここで紹介する場合、カスパーゼ 3 の活性化と CD69 アップレギュレーションの差動抑制を示した阻害剤があった。翻訳ではなく (例えばCD69)デノボ合成マーカーのアップレギュレーションの効果を観察する意外じゃないので、いくつかの化合物はタンパク質合成や小胞の売買などのハウスキーピング関数に影響を与える、変更 (例えばカスパーゼ 3 のプロテアーゼの活性化).
発表したアッセイとしてここにアポトーシス対策読み出し、それは命令型阻害剤の潜在的な毒性に結果が見えにくくならないようにします。たとえば、画面で、我々 は薄めないで 1 を超えてスタウロスポリン nM の, まだその濃度で細胞に有毒であるそれにもかかわらず。代表的な結果は、スタウロスポリン無差別キナーゼ阻害とアポトーシス33のインデューサと一致しています。毒性濃度テスト化合物の十分な希釈、せず、潜在的なヒットを見過ごすことは不可能です。
ここでの詳細なスクリーニング戦略は高スループットス クリーニングの胸腺細胞の十分な数を取得するのに関連付けられている合併症のために人間に適用することは困難でしょう。ただし、小児心臓生検34,35または胎児36,37からひと胸腺のサンプルを入手することが可能です。それにもかかわらず、TCR シグナリング経路とシグナル伝達タンパク質のアミノ酸配列はマウスとヒトの間保存主として胸腺細胞アッセイに有用なスクリーニング戦略が用意されています、このアッセイをマウスを使って任意の結果得られました。胸腺細胞は、一次ヒトリンパで、確認できます。
従来の遠心分離依存プロトコルの 1 つの制限は、セル透過や遠心分離などの手順を含むプロセスの多段階の性質に起因することができます、セルの損失の見通しに関係します。各遠心分離と再懸濁のステップの結果必然的にない細胞の損失で。そのような損失はサンプルの限られた数を含む調査のために重大ではないかもしれないが、それは高スループット スクリーニングに 384-1536 ウェルから 96 - アッセイ フォーマット進行に特に適用する場合の問題をもたらす可能性があります。この問題を回避する方法の 1 つは、カスパーゼ活性化細胞透過の複数の洗浄5合併症を回避しながらの検出を有効にすると細胞膜透過性の蛍光カスパーゼ センサー38を使用しています。また、層流によって細胞を洗浄遠心分離独立方式を採用したも可能ですセル損失を最小にするため。洗浄壁のないプレートと組み合わせてステーション自動プレート、遠心分離機を使用せず流でセルを洗浄しています。試薬の指数希釈遠心洗浄の 2 つのラウンドに相当希釈を表します、3 分未満のセルの徹底と効率的な洗浄が可能です。遠心分離の外部応力なし細胞はより現実的なセル損失が最小限に抑えられます。
96 ウェル U 下に胸腺細胞を培養後洗浄ステーション自動プレートを使用しての可能性を探検したプレートと、また、洗浄ステーション自動プレートと互換性がある壁のない板で直接細胞の培養します。壁のない板で細胞の培養遠心分離のすべてのステップの除去を有効に、プレート全体サンプル転送の必要性を排除することでセル損失を最小化します。一般的には、3 つの異なるプロトコルは両方の刺激効率と染色で対等であります。自動洗浄ステーションは、オートメーション、速度、および容易により高いスループット分析のための効率の利点を提供します。さらに、高められたオートメーションを使って洗浄のステップはより速く、遂行することができる、実験や実験者間のより大きい一貫性があります。ただし、洗濯駅特定の欠点があります: 大量のバッファーを洗うは洗濯機プライミング (うち 50 mL は洗濯で使用される、バッファー変更あたり 150 mL); に必要な余分なケアは少量プレートのウェル間限定分配による井戸の任意のクロス汚染を避けるためにプレートを処理するときに必要な井戸洗浄で高い検査用試薬の使用が必要になります後に 25 μ L の残留バッファー 1 倍の濃度よりも。プレートの限られた容量と残気量の問題に対処するため、従来のプロトコルの採用を促進する、70 μ から 150 μ L の培養容量を拡張するアクセサリーを追加できます。自動プレート処理システムは、現在入手可能な 〜 1 立方フィート (~0.028 m3) の小さな単位である層流洗浄システムと比較して大幅な足跡があります。また、遠心自動プレート処理システムの統合は困難、細胞洗浄における彼らの使用を制限することです。洗浄する機器利用可能な我々 は知っている限りでは、他の遠心分離機に依存しないセルは現在ありません。
ここに示すスクリーニングの作戦が小さい分子と TCR シグナリングと T 細胞の活性化に影響を与える彼らの主張されたターゲット キナーゼを識別すること。ここで使用されるライブラリ キナーゼの主に低分子阻害剤と潜在的面白いヒットの数を生成することができた。プロトコルは、他の化合物 (例えば、様々 な高分子) のライブラリだけでなく、酵素の他のクラスのまたは他の種類の小分子阻害剤ライブラリにも容易に適用します。プロトコルは、T リンパ球や不死化細胞、トランスジェニック Tcr を表現またはレポーター系を運ぶ含めなど、他の細胞型の画面にも使用できます。識別し、T 細胞のシグナル伝達経路の知識を向上させることができも免疫疾患13,14,15,でターゲットを絞った治療法の開発を支援するシグナル伝達の新しい仲介の特徴16. すべてでは、この研究は、T 細胞シグナル伝達を介して高速スクリーニング アッセイのメディエーターの検出のための使用可能なオプションの範囲に追加します。
開示事項
著者 Chyan 英 Ke は、DA 細胞の洗濯機とこの記事で使用される DA 細胞プレートを生成する Curiox バイオシス テムズの社員です。
謝辞
この作品は、(N.R.J.G.) にシンガポール教育省, 2014年-T2-1-136、ナノ材研 CBRG15may017、シンガポール保健省の医学研究評議会からの補助金によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| RPMI | HyClone | SH30027FS | |
| FBS | HyClone | SH3007103 | |
| L-Glutamine | HyClone | SH3003401 | |
| Sodium pyruvate | HyClone | SH3023901 | |
| Penicillin/Streptomycin | HyClone | SV30010 | |
| b-mercaptoethanol | Sigma Aldrich | 516732 | |
| 10X PBS | Vivantis | PB0344 – 1L | |
| Kinase Screening Library (96-Well) | Cayman Chemical | 10505 | Exact contents of the library may vary |
| DMSO | Sigma Aldrich | D2650 | |
| Dexamethasone | Sigma Aldrich | D4902 | |
| anti-CD3/CD28 beads | Thermo Fisher Scientific | 11452D | |
| FITC Active Caspase-3 Apoptosis Kit | BD Pharmingen | 550480 | Contains Fixation/Permeabilisation buffer, 10X Perm/Wash buffer and anti-caspase 3 antibody |
| DA-Cell Washer | CURIOX | HT1000 | |
| 96-well DA-Cell Plate | CURIOX | 96-DC-CL-05 | |
| Antibodies | |||
| CD3e | BioLegend | 100236 | |
| TCRb | BD Biosciences | 553174 | |
| CD4 | BD Biosciences | 740007 | |
| CD8 | BD Biosciences | 563786 | |
| CD69 | eBioscience | 25-0699-42 | |
| Inhibitors | |||
| TG003 | Cayman Chemical | - | From the Kinase Screening Library |
| PKC 412 | Cayman Chemical | - | From the Kinase Screening Library |
| Doramapimod | Cayman Chemical | - | From the Kinase Screening Library |
| Paclitaxel | Cayman Chemical | - | From the Kinase Screening Library |
| Erlotinib | Cayman Chemical | - | From the Kinase Screening Library |
| Necrostatin-5 | Cayman Chemical | - | From the Kinase Screening Library |
| NVP-BEZ235 | Cayman Chemical | - | From the Kinase Screening Library |
| Phthalazinone pyrazole | Cayman Chemical | - | From the Kinase Screening Library |
| AG-879 | Cayman Chemical | - | From the Kinase Screening Library |
| 1-NA-PP1 | Cayman Chemical | - | From the Kinase Screening Library |
| Torin 1 | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide II | Cayman Chemical | - | From the Kinase Screening Library |
| BIBF 1120 | Cayman Chemical | - | From the Kinase Screening Library |
| SMI-4a | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide XI (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10657 | Cayman Chemical | - | From the Kinase Screening Library |
| AS-703026 | Cayman Chemical | - | From the Kinase Screening Library |
| Chelerythrine chloride | Cayman Chemical | - | From the Kinase Screening Library |
| Tunicamycin | Cayman Chemical | - | From the Kinase Screening Library |
| GSK 1059615 | Cayman Chemical | - | From the Kinase Screening Library |
| Ruxolitinib | Cayman Chemical | - | From the Kinase Screening Library |
| Necrostatin-1 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 505124 | Cayman Chemical | - | From the Kinase Screening Library |
| INK128 | Cayman Chemical | - | From the Kinase Screening Library |
| Canertinib (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| SB 431542 | Cayman Chemical | - | From the Kinase Screening Library |
| PD 173074 | Cayman Chemical | - | From the Kinase Screening Library |
| Valproic Acid (sodium salt) | Cayman Chemical | - | From the Kinase Screening Library |
| PD 0325901 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 203580 | Cayman Chemical | - | From the Kinase Screening Library |
| VX-702 | Cayman Chemical | - | From the Kinase Screening Library |
| Emodin | Cayman Chemical | - | From the Kinase Screening Library |
| CHIR99021 | Cayman Chemical | - | From the Kinase Screening Library |
| BIO | Cayman Chemical | - | From the Kinase Screening Library |
| Imatinib (mesylate) | Cayman Chemical | - | From the Kinase Screening Library |
| Sunitinib Malate | Cayman Chemical | - | From the Kinase Screening Library |
| Gefitinib | Cayman Chemical | - | From the Kinase Screening Library |
| PP2 | Cayman Chemical | - | From the Kinase Screening Library |
| 3-Methyladenine | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide I | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide IV | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide V | Cayman Chemical | - | From the Kinase Screening Library |
| NSC 663284 | Cayman Chemical | - | From the Kinase Screening Library |
| D 4476 | Cayman Chemical | - | From the Kinase Screening Library |
| NU 7026 | Cayman Chemical | - | From the Kinase Screening Library |
| H-9 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Indirubin-3'-monoxime | Cayman Chemical | - | From the Kinase Screening Library |
| KN-62 | Cayman Chemical | - | From the Kinase Screening Library |
| KN-93 | Cayman Chemical | - | From the Kinase Screening Library |
| CGP 57380 | Cayman Chemical | - | From the Kinase Screening Library |
| Iso-Olomoucine | Cayman Chemical | - | From the Kinase Screening Library |
| (S)-Glycyl-H-1152 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide VIII (acetate) | Cayman Chemical | - | From the Kinase Screening Library |
| ST638 | Cayman Chemical | - | From the Kinase Screening Library |
| SU 6656 | Cayman Chemical | - | From the Kinase Screening Library |
| LY364947 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 203580 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10621 | Cayman Chemical | - | From the Kinase Screening Library |
| YM-201636 | Cayman Chemical | - | From the Kinase Screening Library |
| ZM 447439 | Cayman Chemical | - | From the Kinase Screening Library |
| AS-041164 | Cayman Chemical | - | From the Kinase Screening Library |
| NVP-AEW541 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| PP242 | Cayman Chemical | - | From the Kinase Screening Library |
| ABT-869 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10622 | Cayman Chemical | - | From the Kinase Screening Library |
| 17β-hydroxy Wortmannin | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10626 | Cayman Chemical | - | From the Kinase Screening Library |
| SU 6668 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10572 | Cayman Chemical | - | From the Kinase Screening Library |
| N,N-Dimethylsphingosine | Cayman Chemical | - | From the Kinase Screening Library |
| LY294002 | Cayman Chemical | - | From the Kinase Screening Library |
| U-0126 | Cayman Chemical | - | From the Kinase Screening Library |
| Staurosporine | Cayman Chemical | - | From the Kinase Screening Library |
| KN-92 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| AS-605240 (potassium salt) | Cayman Chemical | - | From the Kinase Screening Library |
| O-1918 | Cayman Chemical | - | From the Kinase Screening Library |
| Y-27632 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Leelamine | Cayman Chemical | - | From the Kinase Screening Library |
| PD 98059 | Cayman Chemical | - | From the Kinase Screening Library |
| PD 169316 | Cayman Chemical | - | From the Kinase Screening Library |
| TGX-221 | Cayman Chemical | - | From the Kinase Screening Library |
| (S)-H-1152 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| AS-605240 | Cayman Chemical | - | From the Kinase Screening Library |
| D-erythro-Sphingosine C-18 | Cayman Chemical | - | From the Kinase Screening Library |
| OSU03012 | Cayman Chemical | - | From the Kinase Screening Library |
| JNJ-10198409 | Cayman Chemical | - | From the Kinase Screening Library |
| Leelamine (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Arachidonic Acid Leelamide | Cayman Chemical | - | From the Kinase Screening Library |
| Lauric Acid Leelamide | Cayman Chemical | - | From the Kinase Screening Library |
| AS-252424 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10505 | Cayman Chemical | - | From the Kinase Screening Library |
| PI-103 | Cayman Chemical | - | From the Kinase Screening Library |
| PIK-75 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Sphingosine Kinase Inhibitor 2 | Cayman Chemical | - | From the Kinase Screening Library |
| Piceatannol | Cayman Chemical | - | From the Kinase Screening Library |
| SC-1 | Cayman Chemical | - | From the Kinase Screening Library |
| (R)-Roscovitine | Cayman Chemical | - | From the Kinase Screening Library |
| BAY-43-9006 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10561 | Cayman Chemical | - | From the Kinase Screening Library |
| AS-604850 | Cayman Chemical | - | From the Kinase Screening Library |
| PI3-Kinase α Inhibitor 2 | Cayman Chemical | - | From the Kinase Screening Library |
| ML-9 | Cayman Chemical | - | From the Kinase Screening Library |
| Triciribine | Cayman Chemical | - | From the Kinase Screening Library |
| Erbstatin Analog | Cayman Chemical | - | From the Kinase Screening Library |
| Kenpaullone | Cayman Chemical | - | From the Kinase Screening Library |
| Olomoucine | Cayman Chemical | - | From the Kinase Screening Library |
| AG-494 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-825 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-1478 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 216763 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 415286 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-17 | Cayman Chemical | - | From the Kinase Screening Library |
| H-8 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| LFM-A13 | Cayman Chemical | - | From the Kinase Screening Library |
| SC-514 | Cayman Chemical | - | From the Kinase Screening Library |
| Apigenin | Cayman Chemical | - | From the Kinase Screening Library |
| AG-18 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10554 | Cayman Chemical | - | From the Kinase Screening Library |
| DRB | Cayman Chemical | - | From the Kinase Screening Library |
| RG-13022 | Cayman Chemical | - | From the Kinase Screening Library |
| RG-14620 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-490 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-82 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-99 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-213 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-183 | Cayman Chemical | - | From the Kinase Screening Library |
| Lavendustin C | Cayman Chemical | - | From the Kinase Screening Library |
| ZM 336372 | Cayman Chemical | - | From the Kinase Screening Library |
| 5-Iodotubercidin | Cayman Chemical | - | From the Kinase Screening Library |
| SB 202190 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10571 | Cayman Chemical | - | From the Kinase Screening Library |
| Nilotinib | Cayman Chemical | - | From the Kinase Screening Library |
| SP 600125 | Cayman Chemical | - | From the Kinase Screening Library |
| L-threo-Sphingosine C-18 | Cayman Chemical | - | From the Kinase Screening Library |
| H-89 | Cayman Chemical | - | From the Kinase Screening Library |
| HA-1077 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| AG-370 | Cayman Chemical | - | From the Kinase Screening Library |
| Wortmannin | Cayman Chemical | - | From the Kinase Screening Library |
| AG-1296 | Cayman Chemical | - | From the Kinase Screening Library |
| KT 5823 | Cayman Chemical | - | From the Kinase Screening Library |
| Janex 1 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10574 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10575 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10576 | Cayman Chemical | - | From the Kinase Screening Library |
| NH125 | Cayman Chemical | - | From the Kinase Screening Library |
| TWS119 | Cayman Chemical | - | From the Kinase Screening Library |
| NSC 210902 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10577 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10578 | Cayman Chemical | - | From the Kinase Screening Library |
| PD 184161 | Cayman Chemical | - | From the Kinase Screening Library |
| CCT018159 | Cayman Chemical | - | From the Kinase Screening Library |
| Myricetin | Cayman Chemical | - | From the Kinase Screening Library |
参考文献
- Gascoigne, N. R., Rybakin, V., Acuto, O., Brzostek, J. TCR Signal Strength and T Cell Development. Annual Review of Cell and Developmental Biology. 32, 327-348 (2016).
- Rothenberg, E. V., Moore, J. E., Yui, M. A. Launching the T-cell-lineage developmental programme. Nature Reviews Immunology. 8 (1), 9-21 (2008).
- Klein, L., Hinterberger, M., Wirnsberger, G., Kyewski, B. Antigen presentation in the thymus for positive selection and central tolerance induction. Nature Reviews Immunology. 9 (12), 833-844 (2009).
- Starr, T. K., Jameson, S. C., Hogquist, K. A. Positive and negative selection of T cells. Annual Review of Immunology. 21, 139-176 (2003).
- Rybakin, V., Gascoigne, N. R. Negative selection assay based on stimulation of T cell receptor transgenic thymocytes with peptide-MHC tetramers. PLoS One. 7 (8), e43191 (2012).
- Krogsgaard, M., Juang, J., Davis, M. M. A role for "self" in T-cell activation. Seminars in Immunology. 19 (4), 236-244 (2007).
- Nakayama, T., Yamashita, M. The TCR-mediated signaling pathways that control the direction of helper T cell differentiation. Seminars in Immunology. 22 (5), 303-309 (2010).
- Hoerter, J. A., et al. Coreceptor affinity for MHC defines peptide specificity requirements for TCR interaction with coagonist peptide-MHC. The Journal of Experimental Medicine. 210 (9), 1807-1821 (2013).
- Zhao, X., et al. Nonstimulatory peptide-MHC enhances human T-cell antigen-specific responses by amplifying proximal TCR signaling. Nature Communications. 9 (1), 2716 (2018).
- Fu, G., et al. Fine-tuning T cell receptor signaling to control T cell development. Trends in Immunology. 35 (7), 311-318 (2014).
- Wang, D., et al. Tespa1 is involved in late thymocyte development through the regulation of TCR-mediated signaling. Nature Immunology. 13 (6), 560-568 (2012).
- Fu, G., et al. Themis sets the signal threshold for positive and negative selection in T-cell development. Nature. 504 (7480), 441-445 (2013).
- Rosenblum, M. D., Gratz, I. K., Paw, J. S., Abbas, A. K. Treating human autoimmunity: current practice and future prospects. Science Translational Medicine. 4 (125), (2012).
- Hebeisen, M., et al. SHP-1 phosphatase activity counteracts increased T cell receptor affinity. The Journal of Clinical Investigation. 123 (3), 1044-1056 (2013).
- Wang, R. E., et al. An immunosuppressive antibody-drug conjugate. Journal of the American Chemical Society. 137 (9), 3229-3232 (2015).
- Borroto, A., et al. First-in-class inhibitor of the T cell receptor for the treatment of autoimmune diseases. Science Translational Medicine. 8 (370), (2016).
- Chen, E. W., Brzostek, J., Gascoigne, N. R. J., Rybakin, V. Development of a screening strategy for new modulators of T cell receptor signaling and T cell activation. Scientific Reports. 8 (1), 10046 (2018).
- Fouda, A., Tahsini, M., Khodayarian, F., Al-Nafisah, F., Rafei, M. A Fluorescence-based Lymphocyte Assay Suitable for High-throughput Screening of Small Molecules. Journal of Visualized Experiments. (121), e55199 (2017).
- Zhao, Z., et al. A high-throughput phenotypic screen of cytotoxic T lymphocyte lytic granule exocytosis reveals candidate immunosuppressants. Journal of Biomolecular Screening. 20 (3), 359-371 (2015).
- Florian, A. E., et al. Flow cytometry enables a high-throughput homogeneous fluorescent antibody-binding assay for cytotoxic T cell lytic granule exocytosis. Journal of Biomolecular Screening. 18 (4), 420-429 (2013).
- Krutzik, P. O., Crane, J. M., Clutter, M. R., Nolan, G. P. High-content single-cell drug screening with phosphospecific flow cytometry. Nature Chemical Biology. 4 (2), 132-142 (2008).
- Vlahos, C. J., Matter, W. F., Hui, K. Y., Brown, R. F. A specific inhibitor of phosphatidylinositol 3-kinase, 2-(4-morpholinyl)-8-phenyl-4H-1-benzopyran-4-one (LY294002). The Journal of Biological Chemistry. 269 (7), 5241-5248 (1994).
- Chen, Z., et al. Synthesis and SAR of novel 4-morpholinopyrrolopyrimidine derivatives as potent phosphatidylinositol 3-kinase inhibitors. Journal of Medicinal Chemistry. 53 (8), 3169-3182 (2010).
- Ruegg, U. T., Burgess, G. M. Staurosporine, K-252 and UCN-01: potent but nonspecific inhibitors of protein kinases. Trends in Pharmacological Sciences. 10 (6), 218-220 (1989).
- Davis, P. D., et al. Inhibitors of protein kinase C. 1. 2,3-Bisarylmaleimides. Journal of Medicinal Chemistry. 35 (1), 177-184 (1992).
- Komander, D., et al. Interactions of LY333531 and other bisindolyl maleimide inhibitors with PDK1. Structure (London, England: 1993). 12 (2), 215-226 (2004).
- Gassel, M., et al. The protein kinase C inhibitor bisindolyl maleimide 2 binds with reversed orientations to different conformations of protein kinase A. The Journal of Biological Chemistry. 279 (22), 23679-23690 (2004).
- Faull, A., Johnstone, C., Morley, A., et al. . Novel compounds. , (2003).
- Favata, M. F., et al. Identification of a novel inhibitor of mitogen-activated protein kinase kinase. The Journal of Biological Chemistry. 273 (29), 18623-18632 (1998).
- Woods, C. M., Zhu, J., McQueney, P. A., Bollag, D., Lazarides, E. Taxol-induced mitotic block triggers rapid onset of a p53-independent apoptotic pathway. Molecular Medicine (Cambridge, MA). 1 (5), 506-526 (1995).
- Teng, X., et al. Structure-activity relationship study of novel necroptosis inhibitors. Bioorganic & Medicinal Chemistry Letters. 15 (22), 5039-5044 (2005).
- Saini, M., et al. Regulation of Zap70 expression during thymocyte development enables temporal separation of CD4 and CD8 repertoire selection at different signaling thresholds. Science Signaling. 3 (114), ra23 (2010).
- Chae, H. J., et al. Molecular mechanism of staurosporine-induced apoptosis in osteoblasts. Pharmacological Research. 42 (4), 373-381 (2000).
- Varas, A., et al. Analysis of the human neonatal thymus: evidence for a transient thymic involution. Journal of Immunology (Baltimore, MD:1950). 164 (12), 6260-6267 (2000).
- Verstichel, G., et al. The checkpoint for agonist selection precedes conventional selection in human thymus. Science Immunology. 2 (8), (2017).
- Yamaguchi, E., de Vries, J., Yssel, H. Differentiation of human single-positive fetal thymocytes in vitro into IL-4- and/or IFN-gamma-producing CD4+ and CD8+ T cells. International Immunology. 11 (4), 593-603 (1999).
- Farley, A. M., et al. Dynamics of thymus organogenesis and colonization in early human development. Development (Cambridge, UK). 140 (9), 2015-2026 (2013).
- Cali, J. J., et al. Bioluminescent assays for ADMET. Expert Opinion on Drug Metabolism & Toxicology. 4 (1), 103-120 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved