Method Article
Identifikation von Mediatoren der T-Zell-Rezeptor Signalgebung über das Screening von chemischen Inhibitors Bibliotheken
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Papier verwendet ein Flow-Zytometrie-based Assays auf Bildschirm Bibliotheken chemische Inhibitoren für die Identifizierung von Inhibitoren und ihre Ziele, die T-Zell-Rezeptor Signalisierung beeinflussen. Die hier beschriebenen Methoden können auch für Hochdurchsatz-Screenings erweitert werden.
Zusammenfassung
Der T-Zell-Rezeptor (TCR) signalisieren, dass Weg umfasst eine Vielzahl von Mediatoren, die übertragen Signale auf die Aktivierung des TCR. Unterschiedliche Strategien wurden vorgeschlagen und für die Identifizierung von neuen Mediatoren der TCR-Signalisierung, die Verbesserung des Verständnisses der T-Zell-Prozesse, einschließlich Aktivierung und Zebrafischembryonen Auswahl würde umgesetzt. Wir beschreiben eine Screening-Test, die es die Identifikation von Molekülen, die TCR Signalisierung basierend auf die Aktivierung ermöglicht der Thymozyten Entwicklung zu beeinflussen. Strong TCR Signale führen Entwicklung Thymozyten Apoptose Maschinen in einem Prozeß bekannt als negative Auswahl aktivieren. Durch die Anwendung der Kinase-Inhibitoren sind die mit den Zielen, die TCR-Signalisierung betreffen, den Prozess der negativen Auslese zu überschreiben. Die Methode detailliert in diesem Papier kann verwendet werden, um Inhibitoren der kanonischen Kinasen mit etablierten Rollen in die TCR-Signalwege und auch Inhibitoren der neuen Kinasen noch, sich in die TCR-Signalwege aufzustellen zu identifizieren. Die Screeningstrategie hier kann auf Bildschirmen der höheren Durchsatz für die Identifizierung von Roman druggable Ziele in TCR Signalisierung angewendet werden.
Einleitung
T-Zellen sind eine Linie von Lymphozyten, die eine Schlüsselrolle bei der Aufrechterhaltung der adaptiven Immunität zu spielen. Sie drücken die TCR, ermöglicht ihnen, ihrer Liganden, komplexe, bestehend aus einem großen Histocompatibility komplexes Molekül (MHC) zu erkennen mit ein gebundenes Peptid, die befinden sich auf der Oberfläche von Antigen-präsentierenden Zellen (APCs). Die Auslösung der TCR Signalweg durch die TCR/MHC-Interaktion ist entscheidend für die T-Zell-Aktivierung und Entwicklung1.
In T-Zell-Entwicklung migrieren Bone-Marrow-derived hämatopoetischen Stammzellen (HSCs) zu den Thymus, wo sie unterziehen, Differenzierung und gehen durch die Stadien der T-Zell-Linie Fortschreiten2. Doppel-positiv (DP) Thymozyten, mit dem Ausdruck der CD4 und CD8 Corezeptoren engagieren mit selbst-Peptid/MHC auf die APCs. Thymozyten mit mäßiger Affinität für ihre selbst-Peptid/MHC-Liganden Reifen Single-positiv (SP) CD4 oder CD8 Thymozyten, einen Prozess als positive Selektion bezeichnet werden. Im Gegensatz dazu unterziehen Thymozyten, die übermäßige TCR Stimulation durch die selbst-Peptid/MHCs erhalten Apoptose über negative Auslese3,4. Dieser Prozess der Stimulation induzierte, Caspase-abhängigen Apoptose kann durch die Stimulierung der Thymozyten, zum Beispiel mit Anti-CD3/28 Antikörper-beschichtete Perlen5nachgeahmt in Vitro . Reife T-Zellen, die das Auswahlverfahren bestehen werden durch nicht-selbst-Peptid/MHC-Liganden von APCs in der Peripherie aktiviert. Selbst-Peptid/MHCs sind immer noch relevant für die peripheren T-Zellen, im Rahmen des Tonikums Signalisierung für überleben und homöostatische Proliferation, Differenzierung der T-Helferzellen und die Verbesserung der T-Zell-Reaktionen auf nicht-selbst-Peptid/MHCs durch Coagonism6,7,8,9. Hohe Affinität TCR Bindung an das Peptid/MHC-Liganden aktiviert mehrere nachgeschaltete Signalwege, die viele Signalmoleküle bilden eine komplexe TCR Signalisierung Netzwerk10beinhalten. Die TCR-Signalwege sind seit mehreren Jahrzehnten untersucht worden, und doch zeigt die Entdeckung von neuen Mediatoren des Weges ungebrochen11,12. Die Modulation des TCR Signalwege hat klinischen Relevanz und kann mit T-Zell-Reaktionen für Immuntherapie Anwendungen oder die Hemmung der T-Zell-Reaktionen für die Kontrolle der Autoimmunität13potenzierende. Strategien für die Modulation des T-Zell-Reaktionen hängen hauptsächlich von der Störung der Kinase oder Phosphatase-Aktivität14,15,16ab.
Wir beschreiben eine Anwendung eines Flow-Zytometrie-based Assays für das Screening von kleinen chemischen Verbindungen für ihre Fähigkeit, TCR Signal- und T-Zell-Aktivierung-17zu modulieren. Der Test steht und fällt auf das Phänomen der Thymozyten Apoptose-Signalweg wenn starke TCR Signale ausgesetzt aktivieren. Der Test ist ausreichend empfindlich auf Veränderungen in der Stärke der Stimulation zu identifizieren; eine entsprechende Zunahme der Aktivierung verwendet als Maß für die Apoptotic Antwort5Caspase führte Inkubation Thymozyten transgenen TCR mit Peptid/MHC-Tetramers mit zunehmender Affinität zum Ausdruck zu bringen. Für den Bildschirm wir nutzten eine Bibliothek von Kinase-Inhibitoren und bewertet ihre Fähigkeit, die Thymocyte Reaktion auf starke Signale TCR modulieren.
Für den Hochdurchsatz-Screening von einem Sortiment von peripheren Aktivierung Phänotypen in verschiedenen T-Zell-Subsets wurden mehrere Flow-Zytometrie-based oder Fluoreszenz-Reporter-basierte Strategien beschrieben. Solche Strategien umfassen die Verwendung von genetischen fluoreszierende Reporter, der Zeitpunkt und das Ausmaß des T-Zell-Aktivierung-18zu bewerten, die Verwendung von Degranulation ein Auslesen der zytotoxischen T-Zell-Aktivität19,20, sowie die Analyse von der Phosphorylierung von verschiedenen Proteinen in Cellular signaling21beteiligt.
Der Screening-Test hier vorgestellten kann erfolgreich Verbindungen zu identifizieren, die kanonische Moleküle des TCR Signalisierung Weg sowie potenzielle, neue Verbindungen mit hemmenden Effekte auf TCR Signalisierung zu hemmen. Beispielsweise haben wir als neue Verbindungen beeinflussen T-Zell-Antworten-17Inhibitoren der GSK3β und Hsp90 identifiziert. Der Test ist in der Lage, die Inhibitoren zu unterscheiden, die Signaltransduktion durch Reduzierung der Apoptotic Antwort, die TCR-unabhängige Effekte der Inhibitoren auf zelluläre Toxizität stören. Neben der Induktion der Apoptose messen wir auch CD69 Hochregulation und TCR Downregulation als Marker der Aktivierung. Als TCR signalisiert, dass Netzwerke komplex sind kann die Verwendung von mehreren Anzeigen die Chancen Moleküle mit speziellen Wirkungen auf einen einzigen Weg zu entdecken erhöhen. Hier stellen wir auch die Verwendung eines Protokolls Zentrifugation-unabhängige als Hochdurchsatz-Alternative zu dem ursprünglichen Protokoll während der Färbung der Zellen zur Vorbereitung der durchflusszytometrischen Analyse. Der in diesem Dokument beschriebenen Test verwendet eine kleine Verbindung Bibliothek von Kinase-Inhibitoren, aber im Prinzip, es kann für höheren Durchsatz-Screening verwendet werden. Die Bibliothek der Wahl kann auch eine Vielzahl von Inhibitoren oder andere Moleküle enthalten.
Protokoll
In dieser Studie wurden 6 bis 8 Wochen alten männliche und weibliche C57Bl/6 Mäusen verwendet. Die Mäuse wurden in der Tierstation an der National University of Singapore (Singapore) gezüchtet. Die National University of Singapore institutionelle Pflege der Tiere und Nutzung Committee (IACUC) genehmigt alle Tierversuche.
1. Vorbereitung der Thymocyte Aussetzung
- Die Mäuse in einer CO-2 -Kammer einschläfern.
- Führen Sie nachfolgende Schritte in einer Gewebekultur Haube, eine Kontamination der Zellkulturen zu vermeiden. Sichern Sie den Maus Kadaver an die Dissektion mit Stiften, und sprühen Sie die Maus mit 70 % Ethanol.
- Mit einer Schere, machen Sie einen vertikalen Schnitt auf der Bauchseite, aus dem Bauch in Richtung der Kiefer ab. Stellen Sie weitere Einschnitte entlang jeder der Hinterbeine. Spannen Sie die Haut um den Brustkorb und es festzunageln.
- Schneiden Sie das Zwerchfell und beide Seiten des Brustkorbs vom hinteren Ende mit einer Schere. Heben Sie den Brustkorb und hängen sie auf Expose der Thymus. Separate das Bindegewebe an der Thymus und extrahieren die Thymusdrüse mit einer gebogenen Zange.
- Legen Sie die Thymusdrüse in einen Brunnen von einer 6-Well-Platte mit 5 mL der komplette RPMI-Medien.
Hinweis: Überlegen 10 % Holzkohle abgestreift fetalen bovine Serum (FBS) zu den Medien, der Thymocyte Rentabilität zu verbessern, wenn eine lange Wartezeit wird zwischen der Präparation und die Stimulation Assay erwartet. - Sanft den Thymus, mit dem stumpfen Ende eine Spritze, zerdrücken und die Zellen durch ein 70 µM Zelle Sieb passieren. Alternativ um Thymozyten in einem gesünderen Zustand zu sammeln, erwägen Sie zwei Paare der Zange quetschen die Thymusdrüse und sammeln die Thymozyten, fließen aus Zebrafischembryonen Epithel.
- Gehen Sie zu zählen, Zelle mit einer Hemocytometer oder einer automatisierten Zelle zählen Instrument.
2. Titration der Kinase-Inhibitoren, nicht toxische Konzentrationen
Hinweis: Dieser Abschnitt konzentriert sich auf die Vorbereitung der Inhibitoren für den Einsatz in der T-Zell-Aktivierung-Bildschirme. Inhibitoren verwendet bei hohen Konzentrationen können Zelltod, wodurch ein Auslesen der T-Zell-Aktivierung-Bildschirme ist. Die Serie von Verdünnungen der Inhibitoren soll die Endkonzentration der einzelnen Inhibitoren zu bestimmen, die nicht unabhängig von TCR Stimulation Apoptose induzieren sollte. Die Bibliothek der Kinase-Inhibitoren, die in dieser Studie wurde von einem externen Lieferanten gekauft. Die Liste der Hemmstoffe ist in der Tabelle der Materialienenthalten.
-
Vorbereitung der Platten der Kinase-Inhibitoren bei niedrigeren Konzentrationen
- Zur Vorbereitung einer Platte von Inhibitoren bei 1 mM fügen Sie 10 µL-Inhibitoren zu 90 µL Dimethyl Sulfoxid (DMSO) für alle Inhibitoren hinzu.
Hinweis: Die Inhibitoren aus der klein-Molekül-Bibliothek, die in dieser Studie verwendeten kommen in ein Lager Konzentration von 10 mM. Wenn die Inhibitoren in Form von Pellets sind, die empfohlene Wiederherstellung Schritte von den Lieferanten. Wenn die Inhibitoren bei 10 mM nicht vorgesehen sind, bereiten Sie die Inhibitor-Platten bei alternativen entsprechende Konzentrationen stattdessen vor, und bereiten Sie separate serielle Verdünnungen der Inhibitoren mit einem geeigneten Verdünnungsfaktor.
Achtung: Im Falle von giftigen Inhibitoren, folgen Sie den Anweisungen des Herstellers zur sicheren Handhabung und Entsorgung. - Zur Vorbereitung einer Platte von Inhibitoren bei 0,1 mM fügen Sie hinzu, 10 µL Inhibitoren von der Platte von 1 mM-Hemmern 90 µL von DMSO.
- Zur Vorbereitung einer Platte von Inhibitoren bei 0,01 mM fügen Sie hinzu, 10 µL Inhibitoren von der Platte von 0,1 mM-Hemmern 90 µL von DMSO.
- Zur Vorbereitung einer Platte von Inhibitoren bei 1 mM fügen Sie 10 µL-Inhibitoren zu 90 µL Dimethyl Sulfoxid (DMSO) für alle Inhibitoren hinzu.
-
Behandlung von Thymozyten mit Kinase-Inhibitoren
- Bereiten Sie eine Thymocyte Aussetzung gemäß Abschnitt 1.
- Thymozyten in komplette RPMI Thymocyte Aussetzung von 5 x 106 Zellen/mL zu verdünnen.
- Fügen Sie 200 µL Thymocyte Suspension in alle Vertiefungen einer 96-Well-Platte mit einer Mehrkanal-Pipette.
- Fügen Sie in jede Vertiefung 2 µL Inhibitoren aus den entsprechenden gut der Platte mit 1 mM-Inhibitoren (Endkonzentration der Inhibitoren ist 10 µM hinzu).
- Bereiten Sie in der gleichen Platte vier Vertiefungen der unbehandelten Kontrollen, vier Brunnen von 5 µM Dexamethason behandelt Positivkontrollen und vier Vertiefungen der Fahrzeug behandelt Negativkontrollen, durch Zugabe von 2 µL von DMSO.
- Inkubieren der Thymozyten in einem 37 ° C, 5 % CO2 Inkubator für 17-20 h (oder über Nacht).
-
Ermittlung der geeigneten Konzentrationen der einzelnen Inhibitoren
- Drehen Sie die Platte der Thymozyten bei 300 X g und 4 ° C für 5 min. Aufschwemmen der Zellen in 250 µL Waschpuffer FACS.
- Führen Sie eine durchflusszytometrischen Analyse der Proben und analysieren Sie die Ergebnisse mit einem Flow Cytometry Analyseprogramm.
- Den Anteil der lebenden Zellen basierend auf FSC-SSC gating zu bestimmen. Abbildung 1 bzeigt die gating-Strategie.
- Berechnen eines Mittelwerts des Prozentsatzes von lebenden Zellen basierend auf die DMSO behandelt-Steuerelemente, die zu 100 % normalisiert werden. Legen Sie eine beliebige Fenster akzeptabel Zelltod (e.g.,20%). Inhibitoren, die in einem Prozentsatz von lebenden Zellen unterhalb dieses Fensters (dh., unter 80 % DMSO behandelt Steuerelemente) geführt sind erneut bei niedrigeren Konzentrationen getestet werden.
- Wiederholen Sie für die Inhibitoren, die nicht die Rentabilitätskriterien im Schritt 2.3.4 bestanden haben die Schritte von Schritten 2.2.1 - 2.3.4, aber verwenden Sie die Platte von Inhibitoren bei 0,1 mM für Schritt 2.2.4 anstelle der Platte mit der 1 mM-Inhibitoren. Die Endkonzentration von Inhibitoren verwendet, hier ist 1 µM.
- Für die Inhibitoren, die immer noch hohe Konzentrationen von Zelltod bei 1 µM zu produzieren, testen die Inhibitoren bei 0,1 µM. Wiederholen Sie die Schritte 2.2.1 - 2.3.4, aber verwenden Sie die Platte von Inhibitoren bei 0,01 mM im Schritt 2.2.4. Die Endkonzentration von Inhibitoren verwendet hier ist 0,1 µM.
-
Vorbereitung einer Aktie Platte der Kinase-Inhibitoren
- Fügen Sie für Inhibitoren bei 10 µM verwendet werden 10 µL 10 mM-Inhibitoren zu 10 µL von DMSO hinzu.
- Fügen Sie für Inhibitoren bei 1 µM verwendet werden 1 µL 10 mM Inhibitoren 19 µL von DMSO hinzu.
- Fügen Sie für Inhibitoren bei 0,1 µM verwendet werden 1 µL 10 mM Inhibitoren 199 µL DMSO (Abbildung 1 hinzu).
Hinweis: Die vorbereitete Lager Platte von Inhibitoren ist 500 x die Konzentration der gewünschten Endkonzentration wenn Thymocyte Suspensionen hinzugefügt. Die Lager Platte von Inhibitoren kann in PCR-Streifen oder in 96-Well Platten vorbereitet werden. - Die Lager Platte der Kinase-Inhibitoren kann auf Thymozyten für das Screening angewendet werden, in einem herkömmlichen Zentrifugation-abhängige System (Abschnitt 3; siehe Abbildung 1A, Methoden 1 und 2) oder ein alternatives System der Zentrifugation-unabhängige (Abschnitt 4; siehe Abbildung 1A, Methode 3).
(3)-Kinase-Inhibitor Bibliothek Screening (konventionelle Zentrifuge-basierte Assay)
-
Behandlung von Thymozyten mit Kinase-Inhibitoren
- Bereiten Sie eine Thymocyte Aussetzung gemäß Abschnitt 1.
- Thymozyten in komplette RPMI Thymocyte Aussetzung von 5 x 106 Zellen/mL zu verdünnen.
- Fügen Sie 200 µL der Thymozyten in jede Vertiefung einer 96-Well-Platte mit einer Mehrkanal-Pipette. Legen Sie die Platte auf dem Eis.
- Fügen Sie 0,5 µL Hemmnisse für die 96-Well-Platte aus den entsprechenden Vertiefungen der Inhibitor Lager Platte in Abschnitt 2.4 vorbereitet.
- Acht Brunnen der unbehandelten Kontrollen vorbereiten. Bereiten Sie vier Vertiefungen der Fahrzeug-behandelten Kontrollen durch Zugabe von 0,5 µL von DMSO. Bereiten Sie vier Brunnen von 5 µM Dexamethason behandelt Kontrollen (Abbildung 2).
-
Stimulation der Thymozyten mit Anti-CD3/CD28-Perlen
- Nehmen Sie 1 mL von Perlen und waschen Sie Perlen mit 2 mL PBS. Trennen Sie die Perlen mit einem Magnetstativ und aspirieren Sie die Lösung. Die Perlen in 5 mL komplette RPMI aufzuwirbeln.
Hinweis: Das Verhältnis von Perlen auf Zellen beträgt 1 bis 2,5. Passen Sie die Menge an Perlen zu nehmen, je nach Anzahl der Bohrungen zu stimulieren und die Anzahl der Thymozyten verwendet. - Verleihen Sie 50 µL Perlen jeder Inhibitor behandelten Probe, die vier DMSO-behandelten Proben und vier der acht unbehandelten Proben. Die restlichen vier unbehandelten Brunnen 50 µL kompletten RPMI hinzufügen. Abbildung 2 zeigt das allgemeine Layout des Tellers.
- Mischen Sie den Inhalt der Brunnen mit einer Mehrkanal-Pipette.
- Inkubieren der Thymozyten in einem 37 ° C, 5 % CO2 Inkubator für 17-20 h (oder über Nacht).
- Nehmen Sie 1 mL von Perlen und waschen Sie Perlen mit 2 mL PBS. Trennen Sie die Perlen mit einem Magnetstativ und aspirieren Sie die Lösung. Die Perlen in 5 mL komplette RPMI aufzuwirbeln.
-
Färbung von Oberflächenantigenen
- Bereiten Sie eine Antikörper Färbung Mischung mit Anti-TCRβ, Anti-CD4, Anti-CD8 und Anti-CD69 Antikörper. Verdünnen Sie Antikörper in FACS Waschpuffer (PBS ergänzt mit 0,5 % Rinderserumalbumin [BSA]) in einem Verhältnis von 1: 200 (V/V).
Hinweis: Betrachten Sie Optimierung Antikörpertiter verwendet für die Färbung, anstelle von festen Antikörper-Verdünnungen, um Unterschiede in der Färbung über verschiedene Experimente zu minimieren und das Signal-Rausch-Verhältnis zu verbessern. - Drehen Sie die Platte bei 300 X g und 4 ° C für 5 min.
- Streichen Sie die Platte, um die Lösung zu verwerfen.
- An diesem Punkt kann das Protokoll der konventionellen Zentrifuge-abhängige Protokoll folgen (fahren Sie mit Schritt 3.3.5; siehe Abbildung 1A, Methode 1) oder das alternative Zentrifugation-unabhängiges Protokoll (fahren Sie mit Schritt 4.4.4; siehe Abbildung 1A, Methode (2).
- Aufzuwirbeln Sie die Zellen in 75 µL der Färbung Antikörper-Mischung zubereitet im Schritt 3.3.1.
- Mischen Sie die Proben unter Verwendung einer Mehrkanal-Pipette und inkubieren sie für 30 min auf Eis.
- Bereiten Sie eine Antikörper Färbung Mischung mit Anti-TCRβ, Anti-CD4, Anti-CD8 und Anti-CD69 Antikörper. Verdünnen Sie Antikörper in FACS Waschpuffer (PBS ergänzt mit 0,5 % Rinderserumalbumin [BSA]) in einem Verhältnis von 1: 200 (V/V).
-
Fixierung der Zellen
- Waschen Sie die Brunnen mit 200 µL Waschpuffer FACS und Schleudern Sie die Platte bei 300 x g und 4 ° C für 5 Minuten.
- Streichen Sie die Platte, um die Lösung zu verwerfen.
- Fixierung/Permeabilisierung Puffer (kommt mit dem aktiven Caspase-3 Apoptose Kit; gleich mit dem 10 x Perm/Waschpuffer in Schritt erwähnt, 3.5.1 und der Antikörper Anti-Caspase-3 im Schritt 3.5.2) bei 200 µL pro Bohrloch.
- Inkubation für 30 min auf Eis.
-
Intrazelluläre Färbung für aktive Caspase 3
- Bereiten Sie 1 X Perm/Waschpuffer durch Verdünnung 5 mL 10 X Perm/Waschpuffer in 45 mL Reinstwasser vor.
- Bereiten Sie intrazelluläre aktive Caspase Fleck durch Hinzufügen von 1,3 mL des Antikörpers Anti-Caspase-3 bis 6,5 mL 1 x Perm/Waschpuffer vor. Das Verhältnis des Antikörpers zu Perm/Puffer waschen beträgt 1:5.
- Drehen Sie die Platte auf 300 X g und 4 ° C für 5 min. Flick die Platte, die Lösung zu verwerfen. Waschen Sie die Platte mit 200 µL 1 X Perm/Waschpuffer.
- Wiederholen Sie Schritt 3.5.3.
- Drehen Sie die Platte auf 300 X g und 4 ° C für 5 min. Flick die Platte, die Lösung zu verwerfen. Fügen Sie 75 µL des intrazellulären Caspase Fleck im Schritt 3.5.2 in alle Vertiefungen vorbereitet.
- Mischen Sie die Proben unter Verwendung einer Mehrkanal-Pipette und inkubieren Sie für 1 Stunde auf Eis.
- Waschen Sie die Proben mit 200 µL 1 X Perm/Waschpuffer und Schleudern Sie die Platte bei 300 X g und 4 ° C für 5 min.
- Streichen Sie die Platte, um die Lösung zu verwerfen. Waschen Sie die Platte mit 200 µL 1 X Perm/Waschpuffer. Drehen Sie die Platte bei 300 X g und 4 ° C für 5 min.
- Streichen Sie die Platte, um die Lösung zu verwerfen und die Proben in 200 µL Waschpuffer FACS aufzuwirbeln.
- Führen Sie eine durchflusszytometrischen Analyse der Proben und analysieren Sie die Ergebnisse mit einem FACS-Analyse-Programm.
- Mit einem CD4 versus CD8 Grundstück, Tor auf die Bevölkerung von DP Thymozyten mit einem positiven Ausdruck von CD4 und CD8 (Abbildung 2, untere Hälfte). Bestimmen Sie innerhalb der DP Thymocyte Tor den Anteil der Zellen mit aktivierter Caspase-3, mit der unstimulierte Probe als Negativkontrolle und Dexamethason als die positive Kontrolle. Verwenden Sie für die Analyse des Ausdrucks von CD69 im DP Thymocyte Tor die unstimulierte Probe als die negativ-Kontrolle und der stimulierten Probe als die positive Kontrolle.
Hinweis: Wenn auf der DP-Thymozyten gating, überprüfen Sie, ob die Bevölkerung von DP Thymozyten korrekt für Einzelproben eingezäunt ist. Stimulierten Zellen Downregulate Oberfläche Corezeptoren und eine unbeabsichtigte Ausschluss von Veranstaltungen kann auftreten, wenn eine enge DP Tor verwendet wird.
(4)-Kinase-Inhibitor Bibliothek Screening (Zentrifuge-unabhängige Assay)
-
Behandlung von Thymozyten mit Kinase-Inhibitoren
- Bereiten Sie eine Thymocyte Aussetzung gemäß Abschnitt 1.
- Verdünnen Sie die Thymozyten in komplette RPMI Thymocyte Aussetzung von 25 x 106 Zellen/mL zu erhalten.
- Fügen Sie 40 µL der Thymozyten in jede Vertiefung der kleinvolumigen Platte, mit einer Mehrkanal-Pipette. Legen Sie die Platte auf dem Eis.
- Verdünnen Sie die Inhibitoren vom Lager Platte, DMSO und Dexamethason in komplette RPMI in einem Verhältnis von vier Teile des kompletten RPMI zu einem Teil der Inhibitor/DMSO/Dexamethason (Verdünnungsfaktor von 5).
Hinweis: Da die Volumes verwendet in diesem kleinvolumigen Platte 5 x kleiner als bei der konventionellen Methode sind, die Inhibitoren und der Kontrollreagenzien werden verdünnt Fünffache vor Aufnahme in die Thymozyten in der Platte. - Fügen Sie hinzu, 0,5 µL von Inhibitoren der 96-Well-Platte aus den entsprechenden Vertiefungen der Inhibitor Platte in Schritt 4.1.4 vorbereitet.
- Acht Brunnen der unbehandelten Kontrollen vorbereiten. Bereiten Sie vier Vertiefungen der Fahrzeug-behandelten Kontrollen durch Zugabe von 0,5 µL der DMSO in Schritt 4.1.4 vorbereitet. Bereiten Sie vier Brunnen von 5 µM Dexamethason behandelt Steuerelementen, mit der verdünnten Dexamethason in Schritt 4.1.4 (Abbildung 2) vorbereitet.
-
Stimulation der Thymozyten mit Anti-CD3/CD28-Perlen
- Stellen Sie sicher, dass die Perlen sind einheitlich Nukleinsäuretablette. Nehmen Sie 1 mL der Perlen und waschen Sie sie mit 2 mL PBS. Trennen Sie die Perlen mit einem Magnetstativ und aspirieren Sie die Lösung. Die Perlen in 1 mL der komplette RPMI aufzuwirbeln.
Hinweis: Das Verhältnis von Perlen auf Zellen beträgt 1 bis 2,5. Passen Sie die Menge an Perlen, je nach Anzahl der Bohrungen zu stimulieren und die Anzahl der Thymozyten verwendet. - 10 µL der Wulst Aussetzung zu jeder Inhibitor behandelten Probe, die vier DMSO-behandelten Proben und vier der acht unbehandelten Proben hinzufügen. Die restlichen vier unbehandelten Brunnen 10 µL kompletten RPMI hinzufügen. Abbildung 2 zeigt die allgemeine Teller-Layout.
Hinweis: Der letzte Band der Brunnen ist 50 µL, die innerhalb der maximalen Kapazität der Brunnen ist. Es ist wichtig, Vorsicht walten lassen und die Platten halten aufrecht, um Kreuz-Brunnen Verschütten zu vermeiden. - Mischen, rühren Sie die Platte mit einer Mikrotestplatte Orbitalschüttler. Alternativ mischen Sie den Inhalt der Brunnen mit einer Mehrkanal-Pipette.
- Inkubieren der Thymozyten in einem 37 ° C, 5 % CO2 Inkubator für 17-20 h (oder über Nacht) mit einem Anti-Verdunstung-Deckel.
- Stellen Sie sicher, dass die Perlen sind einheitlich Nukleinsäuretablette. Nehmen Sie 1 mL der Perlen und waschen Sie sie mit 2 mL PBS. Trennen Sie die Perlen mit einem Magnetstativ und aspirieren Sie die Lösung. Die Perlen in 1 mL der komplette RPMI aufzuwirbeln.
-
Aufbau der Platte Scheibe
Hinweis: Die Anweisungen zum Einrichten der Platte Scheibe sind vom Hersteller bereitgestellt. Die Schritte sind nachfolgend kurz aufgeführt. Grob ist 150 mL der Lösung für jeden Schritt der Grundierung erforderlich.- Prime die Waschanlage mit 70 % Ethanol enthält 1 % Tween 20.
- Prime die Waschanlage mit entionisiertem Wasser mit 1 % Tween 20.
- Entlüften Sie das System zu waschen mit Waschpuffer FACS.
-
Färbung von Oberflächenantigenen
- Bereiten Sie eine Antikörper Färbung Mischung mit Anti-TCRβ, Anti-CD4, Anti-CD8 und Anti-CD69 Antikörper. Verdünnen Sie die Antikörper in FACS Waschpuffer bei einem Verhältnis von 1: 100 (V/V).
- Waschen Sie die Platte 9 x, mit 55 µL Waschpuffer FACS pro Waschgang, mit Hilfe der automatisierten Laminar-Flow Spülsystem.
Hinweis: Am Ende der Wäschen werden 25 µL Restvolumen in jede Vertiefung. - Aufzuwirbeln Sie die Zellen in 25 µL der Färbung Antikörper-Mischung zubereitet im Schritt 4.4.1.
- Wenn die Proben aus einer 96-Well-Platte (aus Schritt 3.3.4) übertragen werden, Aufschwemmen der Zellen in 50 µL der Antikörper-Mischung in Schritt 3.3.1 vorbereitet, und übertragen Sie die Proben auf die kleinvolumigen Teller. Dieser Schritt entspricht Methodennummer 2, wie in Abbildung 1Adargestellt.
- Zu mischen, schütteln die Platte mit einer Mikrotestplatte Orbitalschüttler oder mischen Sie die Proben unter Verwendung einer Mehrkanal-Pipette und inkubieren Sie für 30 min auf Eis.
-
Fixierung der Zellen
- Waschen Sie die Platte 9 x, mit 55 µL Waschpuffer FACS pro Waschgang, mit Hilfe der automatisierten Laminar-Flow Spülsystem.
- Fixierung/Permeabilisierung Puffer (kommt mit dem aktiven Caspase-3 Apoptose Kit; gleich mit dem 10 x Perm/Waschpuffer in Schritt 4.6.1 und der Antikörper Anti-Caspase-3 im Schritt 4.6.2 erwähnt) zu 50 µL pro Bohrloch.
- Inkubation für 30 min auf Eis.
-
Intrazelluläre Färbung für aktive Caspase 3
- Bereiten Sie 1 X Perm/Waschpuffer durch Verdünnung 25 mL 10 X Perm/Waschpuffer in 225 mL Reinstwasser vor.
- Bereiten Sie intrazelluläre aktive Caspase Fleck durch Zugabe von 1 mL der Antikörper Anti-Caspase-3 zu 2 mL 1 x Perm/Waschpuffer vor. Das Verhältnis des Antikörpers zu Perm/Puffer waschen ist 1:2.
- Entlüften Sie das System mit 1 x Perm/Waschpuffer waschen.
- Waschen Sie die Platte 9 X mit 1 x Perm/Waschpuffer bei 55 µL für jede Wäsche.
- Fügen Sie 25 µL der intrazellulären Caspase-Fleck im Schritt 4.6.2 in alle Vertiefungen vorbereitet.
- Zu mischen, schütteln die Platte mit einer Mikrotestplatte Orbitalschüttler oder mischen Sie die Proben unter Verwendung einer Mehrkanal-Pipette und Inkubation für 1 h auf Eis.
- Waschen Sie die Platte 9 X mit 1 x Perm/Waschpuffer bei 55 µL für jede Wäsche.
- Alle Brunnen 25 µL Waschpuffer FACS hinzufügen.
- Übertragen Sie die Proben nach angemessene mischen über Pipettieren Mikrotiter-Rohre.
- Die leeren Brunnen ein weiteres 50 µL Waschpuffer FACS hinzu, und wiederholen Sie Schritt 4.6.9.
- Wiederholen Sie die Schritte 4.6.9 und 4.6.10 2 X bis 200 µL der Proben sind in den Mikrotiter-Rohren gesammelt.
Hinweis: Die die nachfolgend beschriebenen Schritte 4.6.10 und 4.6.11 soll eine maximale Regeneration der Zellen von der kleinvolumigen Platte zu gewährleisten. Wenn Zelle Zahlen kein Problem, nach Schritt 4.6.10 sind, Röhren einfach oben bis die Mikrotiter zu 200 µL mit FACS Waschpuffer. - Führen Sie eine durchflusszytometrischen Analyse der Proben und analysieren Sie die Ergebnisse mit einem FACS-Analyse-Programm, wie pro Schritt 3.5.11. Aktivierung von Caspase-3 und CD69 Ausdruck im Tor mit CD4 analysiert+CD8+DP Thymozyten.
Ergebnisse
Der Ansatz der Screening-Test ist in Figur 1Azusammengefasst. Die Kinase-Inhibitoren wurden zuerst für ihre latente Wirkung auf Thymocyte Lebensfähigkeit untersucht. Dexamethason wurde als Positivkontrolle für die Apoptose als Proapoptotic Mittel verwendet. Die Anspritzung für live Zellpopulation wurde basierend auf den unbehandelten Negativkontrollen und Dexamethason behandelt Positivkontrollen (Abbildung 1 b) bestimmt. Die Inhibitoren wurden zunächst bei 10 µM auf Thymozyten getestet, und der Anteil der lebensfähigen Zellen nach Inkubation für 18 h gemessen wurde. Eine 20 %-Fenster für Zelltod wurde so gewählt, dass die Verbindungen, die induziert einen größeren als 20 % Verlust von Zellen im live Zelle Tor, im Vergleich zu DMSO-behandelten Proben, bei niedrigeren Konzentrationen (Abbildung 1 b) getestet wurden. Repräsentative FACS Grundstücke von ausgewählten Inhibitor behandelten Proben werden angezeigt, um die Lebensfähigkeit Assay zu veranschaulichen. LY294002 (2-(4-morpholinyl)-8-phenyl-4H-1-benzopyran-4-one; CAS-154447-36-6), eine PI3K Inhibitor22, nicht stark erhöhte Zelltod bei 10 µM und die Inhibitor wurde bei 10 µM für die nachfolgenden Tests verwendet. CAY10626 (N-[2-(dimethylamino)ethyl]-N-methyl-4-[[[4-[4-(4-morpholinyl)-7-(2,2,2-trifluoroethyl)-7H-pyrrolo[2,3-d]pyrimidin-2-yl]phenyl]amino]carbonyl]amino]-benzamide; CAS-1202884-94-3), eine duale Inhibitor des PI3Kα/mTOR23, induziert hohe Zelltod bei 10 µM und bei 1 µM, aber nicht bei 0,1 µM und 0,1 µM war entschlossen, die geeignete Konzentration für den Einsatz in nachgeschalteten Assays. Staurosporine (2,3,10,11,12,13-hexahydro-10R-methoxy-9S-methyl-11R-methylamino-9S,13R-epoxy-1H,9H-diindolo[1,2,3-gh;3',2',1'-lm]pyrrolo[3,4-j][1,7]benzodiazonin-1-one; CAS 62996-74-1), ein Pan-Protein-Kinase C-Inhibitor mit einer etablierten Fähigkeit induzieren Apoptose24, induziert signifikante Zelltod bei allen Konzentrationen getestet, auch bei 0,1 µM. Es wurde in nachfolgenden Tests bei 0,1 µM als eine zusätzliche Positivkontrolle verwendet.
Die Endkonzentrationen der Inhibitoren wurden anhand der höchsten Konzentrationen, wobei sie Zelltod nicht um mehr als 20 % der DMSO-behandelten Proben verstärken ausgewählt. Mit die Endkonzentrationen der Inhibitoren bestimmt war eine Lager Platte von Inhibitoren vorbereitet, so dass die Inhibitoren 500 Mal die Konzentration bei den Zellen zugewiesen wurden. Abbildung 1 zeigt die Platte Layout der Lager Platte, mit die Endkonzentrationen der Inhibitoren. In der alternativen Protokoll der Inkubation der Zellen direkt in den kleinvolumigen Platten für die laminare Strömung waschen Assay erforderte die Verwendung von kleinen Mengen eine weitere Verdünnung der Inhibitoren. Um sicherzustellen, dass den DMSO-Inhalt der Kulturen nach Inhibitor Ergänzung nicht zu hoch für die Zellen wäre, die Inhibitoren wurden weiter verdünnt in komplette RPMI, durch ein Verdünnungsfaktor von 5, so dass sie bei 100 Mal die beabsichtigte Konzentration angewandt auf waren die Zellen.
Die Inhibitoren, nicht toxische Konzentrationen verdünnt dienten im Test TCR-Stimulation-induzierte Apoptose in Thymozyten5,17. Die Stimulation erfolgte mit Anti-CD3/CD28 Perlen für 18 h, und die Zellen wurden anschließend zur Aktivierung der Caspase-3 in der CD4 befleckt+ und CD8+ DP Thymocyte Bevölkerung (Abbildung 2). Zunahme der Caspase-3-Aktivierung und CD69 Ausdruck, und auch ein TCR Herabregulation wurden in die Anti-CD3/CD28-stimuliert und DMSO Mock-imprägnierte Anti-CD3/28-stimulierten Proben, im Vergleich zu den nonstimulated Proben beobachtet. Dexamethason-behandelten Proben zeigten eine Zunahme Caspase-3-Aktivierung unabhängig von CD69 Hochregulation, die der Apoptose-induzierende Wirkung unabhängig von TCR Stimulation erwartet wird.
Abbildung 3A fasst die Ergebnisse der screening-Test für ausgewählte Inhibitoren Bibliothek. Aktivierung von Caspase-3 und CD69 kann verwendet werden, um potenzielle Inhibitoren des Interesses durch die Unterdrückung der Meinungsfreiheit zu identifizieren. Wie erwartet, zeigte sich Inhibitoren der kanonischen Mediatoren der TCR-Signal als positive Treffer auf den Bildschirmen. Diese Inhibitoren, die unterschiedliche Grade der inhibitorischen Potenz ausgestellt, inklusive Breitspektrum-Inhibitoren, die auf mehrere Kinasen und auch spezifische Inhibitoren. Einige Inhibitoren konnten Caspase-3-Aktivierung und CD69 Hochregulation (Abb. 3 b, obere Reihe, links Platten) zu unterdrücken. Ein solcher Inhibitor ist Bisindolylmaleimide II (3-(1H-Indol-3-yl)-4-[1-[2-(1-methyl-2-pyrrolidinyl)ethyl]-1H-indol-3-yl]-1H-pyrrole-2,5-dione; CAS 137592-45-1), die hemmt alle Protein Kinase C-Isoformen, neben Proteinkinase A und PDK125,26,27. Ein weiterer Hemmstoff in dieser Kategorie ist CAY10657 (3-[(aminocarbonyl)amino]-5-[4-(4-morpholinylmethyl)phenyl]-2-thiophenecarboxamide; CAS-494772-86-0), eine vorgeschlagene Inhibitor des IKK228.
Es gab Verbindungen, die gehemmt CD69 Hochregulation aber Tat keinen Abbruch, Aktivierung der Caspase-3 (Abb. 3 b, obere Reihe, richtigen Platten). CAY10626, ein Inhibitor der PI3Kα und mTOR23und U-0126 (2,3-Bis [amino [(2-aminophenyl) Thio] Methylenblau]-Butanedinitrile; CAS 109511-58-2), ein MEK-Inhibitor29, waren einige der identifizierten-Inhibitoren. Die Ergebnisse zeigen, dass verschiedene Inhibitoren gezielt verschiedene Kinasen aus bestimmten Branchen der TCR-Signalweg, vor allem diejenigen, die gezielt Spätstadium Kinasen, die selektive Beeinträchtigung der T-Zell-Aktivierung-Erscheinungen führen können.
Es gab auch Inhibitoren, die nicht CD69 Hochregulation und Aktivierung der Caspase-3 (Abb. 3 b, untere Reihe, links Platten) unterdrückt. Paclitaxel (β-(Benzoylamino) - αR - hydroxy-Benzenepropanoic Acid, (2aR,4S,4aS,6R,9S,11S,12S,12aR,12bS)-6,12b-bis(acetyloxy)-12-(benzoyloxy)-2a,3,4,4a,5,6,9,10,11,12,12a,12b-dodecahydro-4,11-dihydroxy-4a,8,13,13-tetramethyl-5-oxo-7 , 11-methano-1H-cyclodeca[3,4]benz[1,2-b]oxet-9-yl Ester; CAS-33069-62-4), ein Disruptor Mikrotubuli Dynamik30und Necrostatin-5 (2-[[3,4,5,6,7,8-hexahydro-3-(4-methoxyphenyl)-4-oxo[1]benzothieno[2,3-d]pyrimidin-2-yl]thio]-acetonitrile; CAS-337349-54-9), ein Inhibitor der RIP1 Kinase31, sind zwei Inhibitoren identifiziert, um in dieser Kategorie werden. In solchen Fällen, wo CD69 Hochregulation und Caspase-3-Aktivierung nicht beeinträchtigt wurden, kann dies aufgrund der Inhibitoren keinen entsprechenden Kinase Signalweg TCR ausgerichtet.
Wie bereits erwähnt, diente Staurosporine auf den Bildschirmen in einer Konzentration, die noch in der Thymozyten Apoptose induziert. Wie erwartet, die Staurosporine-behandelten Probe zeigte ein hohes Maß der Caspase-3-Aktivierung (Abb. 3 b, untere Reihe, rechts). Das niedrige Niveau der CD69 Ausdruck können die Staurosporine-vermittelte Hemmung der PKC, zugeschrieben werden, wie Bisindolylmaleimide II, eine andere Pfanne-PKC-Hemmer, auch den Ausdruck CD69 unterdrückt. Alternativ induzierte Staurosporine Apoptose in den Zellen bevor sie Upregulate konnten den Ausdruck CD69.
Um den Durchsatz und die Automatisierung des Protokolls zu erhöhen, wurden parallel Protokolle, die die Verwendung eines automatisierten Platte waschen über Laminar-Flow-System beteiligt vorbereitet. Zwei getrennte Protokolle verwenden diese automatisierten Platte Waschvorrichtung wurden erprobt und im Vergleich zur herkömmlichen Methode der Kultivierung von Zellen in 96-Well-Platten und Färbung der Zellen in einem Zentrifugation-abhängige-Protokoll. Eine Methode beteiligt Kultivierung der Zellen in 96-Well-Platten, nach Standardverfahren, und dann, die Zellen auf Platten kompatibel mit der automatisierten Platte Scheibe übertragen, für die Färbung tritt (Abbildung 4, DA waschen Proben). Die andere Methode beteiligt Kultivierung der Zellen direkt in die Platte-Waschmaschine-kompatiblen Platten und Weiterbildung mit der Färbung Protokoll auf der gleichen Platte (Abbildung 4, DA Kultur Proben). Die Zentrifugation-unabhängige Protokolle geben nicht viele wahrnehmbare Unterschiede in aktive Caspase-3, CD69 oder TCRβ Färbung in den verschiedenen Proben getestet, im Vergleich zu den herkömmlichen Zentrifugation-abhängige Protokoll (Abbildung 4). Unterschiede in der Intensität der Färbung können mit Antikörpern bei leicht unterschiedlichen Konzentrationen während der Färbung Schritte zugeschrieben werden.
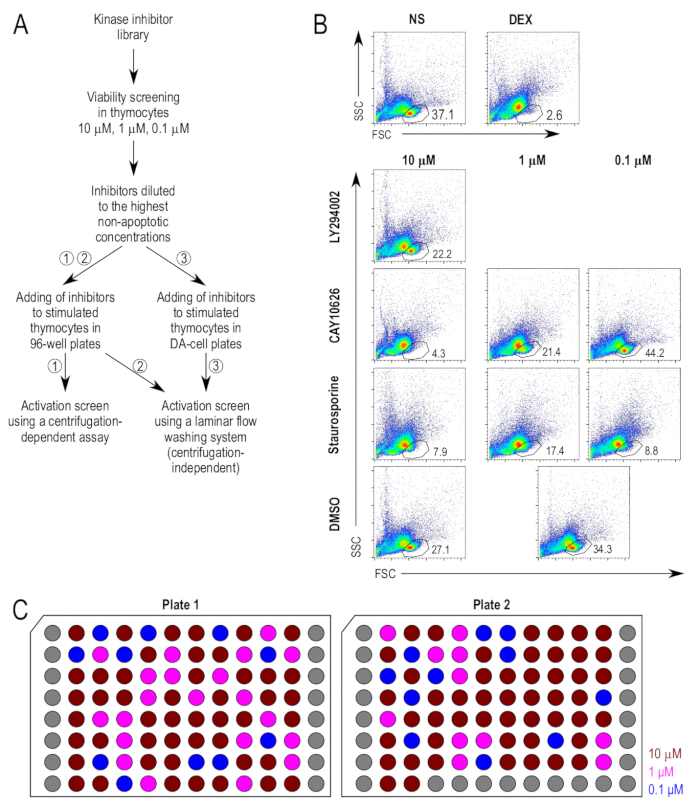
Abbildung 1 : Thymocyte Rentabilität nach der Behandlung mit Inhibitoren. (A) experimentelle Überblick über die wichtigsten Schritte in der Screening-Test. Es gibt drei vorgeschlagene Methoden für die Stimulation und Färbung von der Thymozyten in die Aktivierung-Assay, nämlich (1) die Kultivierung von Thymozyten in standard 96-Well-Platten, gefolgt von Färbung mit einem konventionellen Zentrifugation-basierten Protokoll verwendet (2) Kultivierung von Thymozyten in standard 96-Well-Platten, gefolgt von Färbung mit einer Zentrifugation-unabhängige waschen-Protokoll, und (3) die Kultivierung von Thymozyten in kleinvolumigen Platten, gefolgt von Färbung in den gleichen Platten mit einer Zentrifugation-unabhängige waschen Protokoll. (B) Gating Strategien in die Lebensfähigkeit Assays verwendet. Live Cell Tor stammt aus der forward Scatter (FSC) und Side Scatter (SSC) geplottet wird, wie zuvor beschrieben17. Inhibitoren, die als galten auch giftig bei der getesteten Konzentration wurden weitere Lebensfähigkeit Assays in 10-divisibel niedrigeren Konzentrationen. Repräsentative Inhibitor behandelten Proben werden angezeigt. Beachten Sie die gemeinsame Kontrolle (DMSO behandelt [DMSO]) für 1 µM und 0,1 µM Proben verwendet. (C) Platte Layout von verdünnten Inhibitoren. Eine schematische Darstellung der Platten von Inhibitoren in DMSO zu einer Konzentration von 500 x die gewünschte Endkonzentration verdünnt. Jeder stellt auch eine einzigartige Inhibitor; die grauen Brunnen sind leer. Die Konzentrationen gezeigt sind die Endkonzentration wenn die Zellkulturen, nämlich 10 µM (dunkelrot), 1 µM (Fuchsia) und 0,1 µM (blau) hinzugefügt. Bitte klicken Sie hier für eine größere Version dieser Figur.
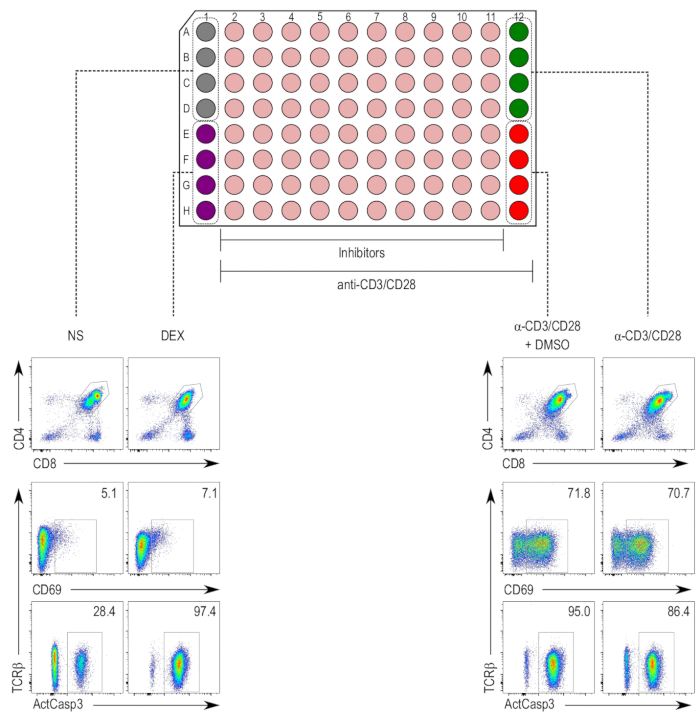
Abbildung 2 : Platte Layout des Thymocyte Aktivierung Assays. (Oben) Spalten 1 und 12 sind für Steuerelemente, vorbehalten, während die Spalten 2 bis 11-Inhibitor behandelten Proben (Beige) sind. Die negative-Kontrolle (nonstimulated [NS]; grau) belegt Brunnen A1 auf D1 und die Positivkontrolle für Zelltod (Dexamethason behandelt [DEX]; lila) nimmt Brunnen E1 auf H1. Spalten 2 bis 12 enthalten Thymozyten mit Anti-CD3/CD28 Perlen stimuliert. Die Positivkontrolle für Thymocyte Aktivierung (stimulierten Proben [α-CD3/CD28]; grün) nimmt Brunnen A12 D12 und die Fahrzeugkontrolle (angeregt und DMSO behandelt [α-CD3/CD28 + DMSO]; rot) nimmt Brunnen E12, H12. (Unten) Flow Cytometry aktive Caspase-3 (ActCasp3), CD69, Grundstücke und TCRβ Färbung der Thymozyten gated innerhalb der Doppel-positiv (DP) Tor. Repräsentative Darstellungen der verschiedenen Steuerelemente werden angezeigt. NS = nonstimulated; DEX = Dexamethason-behandelten Proben; Α-CD3/CD28 + DMSO = Proben mit CD3/CD28-beschichtete Perlen stimuliert und behandelt mit DMSO; Α-CD3/CD28 = Proben mit CD3/CD28-beschichtete Perlen stimuliert. Bitte klicken Sie hier für eine größere Version dieser Figur.
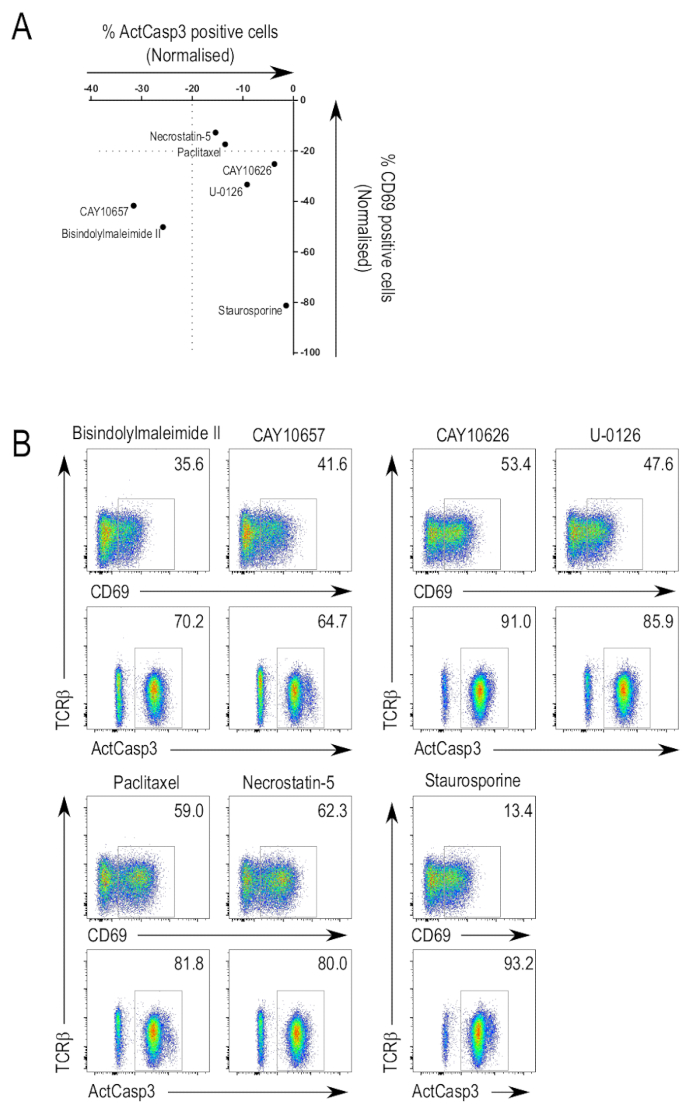
Abbildung 3 : Der Inhibitor Bibliothek auf Thymocyte Aktivierung screening. (A) Daten des Assays Aktivierung zusammengefasst. Dies sind die Ergebnisse einer repräsentativen Experiment zeigt die normalisierte Werte der Zellen mit aktivierter Caspase-3 und CD69 Ausdruck für ausgewählte Inhibitoren. Normierung erfolgte durch den Vergleich des Anteil der Zellen in der aktiven-Caspase-3-positiven oder CD69-Positive Tor auf den Wert des Steuerelements DMSO behandelt, die auf einen relativen Wert 0 in das Diagramm gesetzt ist. (B) ausgewählte FACS Grundstücke. Flow Cytometry Grundstücke von Inhibitoren, die Aktivierung von Caspase-3 und CD69 Hochregulation (oben links), unterdrückt nur CD69 Hochregulation (oben rechts) unterdrückt oder hatte keinen Einfluss auf die Aktivierung der Caspase-3 und CD69 Hochregulation (unten links). Grundstücke der Staurosporine behandelten Probe werden angezeigt, um die Auswirkungen der Verwendung eines Inhibitors bei toxischen Konzentrationen (unten rechts) zu illustrieren. Bitte klicken Sie hier für eine größere Version dieser Figur.
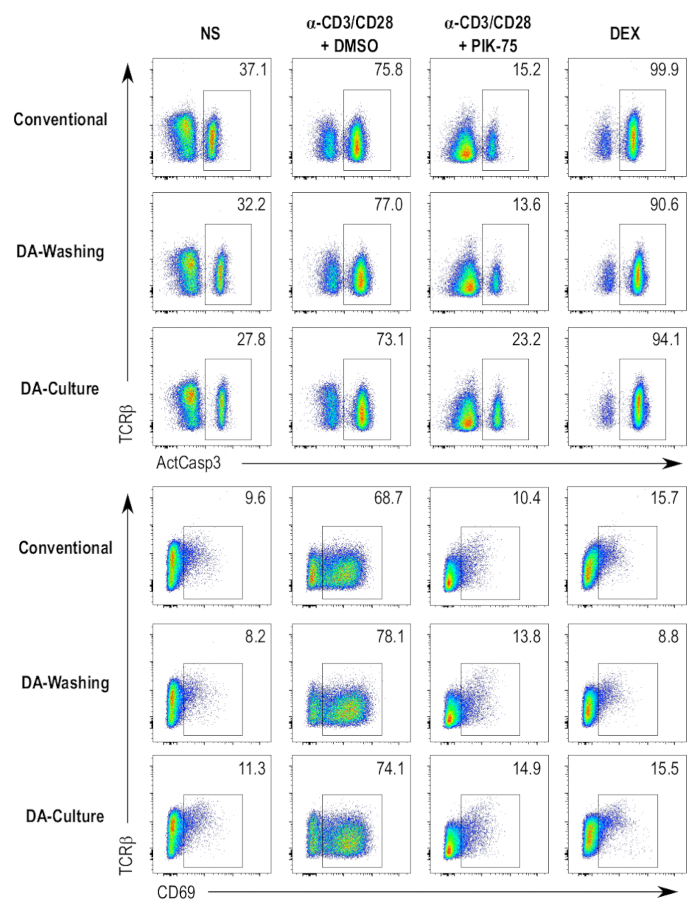
Abbildung 4 : Vergleich der verschiedenen Test-Protokolle. Flow Cytometry aktive Caspase-3 (ActCasp3), CD69, Grundstücke und TCRβ Färbung der DP Thymozyten nach drei verschiedene Protokolle assay. Vier verschiedene Bedingungen getestet werden, nämlich die negativ-Kontrolle (nonstimulated [NS]), die Positivkontrolle für Zelltod (Dexamethason behandelt [DEX]), die Fahrzeugkontrolle (angeregt und DMSO behandelt [α-CD3/CD28 + DMSO]), und ein Inhibitor behandelt Probe (angeregt und PIK-75-behandelt [α-CD3/CD28 + PIK-75]). Konventionelle = die Kultivierung von Thymozyten in standard 96-Well-Platten und Färbung mit einer konventionellen Zentrifugation-basiertes Protokoll; DA waschen = die Kultivierung von Thymozyten in standard 96-Well-Platten und Färbung mit einem Laminar-Flow waschen Protokoll; DA-Kultur = die Kultivierung von Thymozyten in kleinvolumigen Platten und Färbung in den gleichen Platten mit einem Laminar-Flow-Protokoll waschen. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Die hier vorgeschlagene Screeningstrategie bewertet die Fähigkeit des Small-Molecule-Inhibitoren, die Apoptotic Effekte in Thymozyten nach Stimulation, neben eher konventionellen Marker der T-Zell-Aktivierung-CD69-Hochregulation und TCR Herabregulation unterdrücken . Zusätzliche Marker können auch ermöglichen die Analyse der verschiedenen Thymocyte Teilmengen32einbezogen werden. Ein interessanter Aspekt des aktuellen Tests liegt in der Tatsache, dass Inhibitoren, die TCR-Signalisierung behindern auch die Induktion der Apoptose, weitere Hervorhebung die Unterscheidung des TCR-unabhängige Effekte haben die Inhibitoren auf Zelltod induzieren dämpfen würde. Darüber hinaus ermöglicht ein Flow-Zytometrie-based Assays die Verwendung von mehrere Messwerte als unterschiedliche Aktivierungsmarker, die die Auswirkungen der Inhibitoren auf getrennten einzelnen Zweigen der TCR-Signalisierung berichten könnte. Im hier vorgestellten Fall gab es Hemmstoffe, die eine differenzierte Hemmung der Aktivierung von Caspase-3 und CD69 Hochregulation zeigte. Da einige Verbindungen Funktionen wie Proteinsynthese oder vesikuläre Menschenhandel auswirken können, ist es nicht verwunderlich, Auswirkungen auf die Hochregulation der de Novo synthetisiert Marker (z. B. CD69) aber nicht auf posttranslationale beobachten Änderungen (z. B. die proteolytische Aktivierung von Caspase-3).
Als der Test präsentiert hier Maßnahmen Apoptose als eine Anzeige, ist es unerlässlich, dass die latente toxischen Wirkungen der Inhibitoren die Ergebnisse nicht verdecken. Zum Beispiel auf dem Bildschirm wir nicht verdünnen Staurosporine über 1 nM, obwohl es immer noch für die Zellen in dieser Konzentration giftig. Die repräsentativen Ergebnisse sind in Übereinstimmung mit Staurosporine wird ein promiscuous Kinase-Inhibitor und einem Induktor von Apoptose33. Ohne eine ausreichende Verdünnung der Verbindungen nicht toxische Konzentrationen getestet ist es möglich, potentielle Hits zu übersehen.
Die Screeningstrategie hier wäre schwierig anzuwenden, Menschen aufgrund von Komplikationen im Zusammenhang mit der Erlangung ausreichender Zahl von Thymozyten für Hochdurchsatz-Screening. Jedoch ist es möglich, menschlichen Thymus Proben von pediatric cardiac Biopsien34,35 oder von Föten36,37zu erhalten. Dennoch als TCR signalisiert, dass die Wege und die Aminosäure-Sequenzen von Signalproteinen zwischen Mäusen und Menschen, größtenteils erhalten geblieben sind der Thymocyte-Test bietet eine nützliche Vorauswahl-Strategie und Ergebnisse mit dieser Assay mit Maus Thymozyten können, dann, im primären menschlichen Lymphozyten überprüft werden.
Eine Einschränkung des herkömmlichen Zentrifugation-abhängige Protokolls bezieht sich auf die Perspektive des Zellverlustes, die mehrstufige Natur des Prozesses, zugeschrieben werden kann die Schritte wie Zelle Permeabilisierung und Zentrifugation beinhaltet. Jede Zentrifugation und Wiederfreisetzung Schritt führt unweigerlich zum Verlust von Zellen. Während solche Verluste nicht für Studien, die eine begrenzte Anzahl von Proben von entscheidender Bedeutung sein können, könnte es Probleme bei Anwendung im höheren Durchsatz Screening, insbesondere Fortschreiten der Assay-Format von 96 -, 384-1536 gut darstellen. Eine Möglichkeit zur Umgehung dieses Problems ist die Verwendung von Zelle durchlässig fluoreszierende Caspase Sensoren38 , die den Nachweis von Caspase-Aktivierung unter Vermeidung von Komplikationen der Zelle Permeabilisierung und mehrere Wäschen5ermöglichen. Alternativ ist es auch möglich, zur Minimierung der Zellverlust, beschäftigt eine Zentrifugation-unabhängige Methode Zellen durch laminare Strömung zu waschen. Mit einer automatisierten Platte Waschplatz in Verbindung mit einem Wand-weniger Teller werden Zellen von Laminar-Flow ohne den Einsatz einer Zentrifuge gewaschen. Die exponentielle Verdünnung der Reagenzien ermöglicht die gründliche und effiziente Spülung von Zellen in weniger als 3 min, die eine entsprechende Verdünnung auf zwei Runden der zentrifugalen waschen darstellt. Ohne äußere Belastungen durch Zentrifugation die Zellen sind rentabler und Zelle Verluste minimiert.
Wir haben auch die Möglichkeit der Verwendung der automatisierten Platte Waschstation nach Kultivierung der Thymozyten in 96-Well U-Boden Platten und auch die Kultivierung der Zellen direkt in Wand-weniger Platten kompatibel mit der automatisierten Platte Waschplatz. Die Kultivierung von Zellen in der Wand weniger Platten aktiviert die Beseitigung aller Schritte, Zentrifugation und Zellverlust durch den Wegfall der Notwendigkeit einer Probentransfer über Platten minimiert. In der Regel sind drei verschiedene Protokolle vergleichbar Stimulation Effizienz und Färbung. Die automatische Waschanlage bietet den Vorteil der Automatisierung, Geschwindigkeit und Effizienz, höherer Durchsatz Analyse erleichtert. Darüber hinaus mit erhöhte Automatisierung, die Waschschritte können schneller durchgeführt werden, und gibt es eine größere Kohärenz zwischen den Experimenten oder Experimentatoren. Die Waschanlage hat jedoch einige Nachteile: große Mengen an Wäsche Puffer sind erforderlich für Waschmaschine Grundierung (150 mL pro Puffer wechseln, von denen 50 mL zum Waschen dient); besondere Vorsicht ist beim Umgang mit der Plattenrandes notwendig, um Kreuzkontamination der Brunnen durch begrenzte Partitionierung zwischen den Brunnen der kleinvolumigen Platte zu vermeiden; verbleibende Puffer von 25 µL in den Vertiefungen nach Waschen erfordert die Verwendung von Reagenzien mit einer höheren vorbereitet als 1 X Konzentration. Um die Fragen der Restvolumen und begrenzte Kapazität der Platte, kann ein Accessoire, um die Inkubation Volumen von 70 µL bis 150 µL erweitern hinzugefügt werden, um die Annahme von herkömmlichen Protokollen erleichtern. Automatisierte Platte-Handling-Systeme derzeit verfügbar sind, haben sie einen bedeutenderen Fußabdruck im Vergleich zu der laminaren waschen System, das eine kleine Einheit von ~ 1 Kubikfuß (~0.028 m3). Darüber hinaus ist die Integration der Zentrifugation in automatisierte Handlingsysteme Platte anspruchsvoll, Begrenzung ihrer Verwendung in Zelle waschen. Derzeit gibt es keine andere Zentrifuge-unabhängige Zelle waschen Instrumente zur Verfügung, soweit wir wissen.
Hier vorgelegte Screeningstrategie ist in der Lage, kleine Moleküle und ihre angeblichen Ziel Kinasen, die TCR-Signalisierung und T-Zell-Aktivierung zu identifizieren. Die hier verwendete Bibliothek umfasst vor allem kleine Molekül Inhibitoren der Kinasen und war in der Lage, eine Reihe von potenziell interessante Treffer zu generieren. Das Protokoll kann auch ohne weiteres Inhibitor Bibliotheken anderer Enzym-Klassen oder auf andere Arten von kleinen Molekülen sowie Bibliotheken von anderen Verbindungen (z.B. verschiedene Makromoleküle) angewendet werden. Das Protokoll kann auch verwendet werden, andere Zelltypen wie peripheren T-Lymphozyten oder verewigt Zellen, einschließlich derjenigen mit dem Ausdruck transgenen TCR oder Reporter Tragesysteme auf den Bildschirm. Identifizierung und Charakterisierung neue Mediatoren der T-Zell-Signalisierung verbessern unser Wissen über den Signalweg und auch Hilfe bei der Entwicklung von gezielten Therapie bei Immunerkrankungen13,14,15, 16., fügt dieser Studie auf die Palette der verfügbaren Optionen für den Nachweis von Mediatoren der T-Zelle Signalisierung über Hochdurchsatz-Screening-Assays.
Offenlegungen
Der Autor Chyan Ying Ke ist ein Mitarbeiter des Curiox Biosystems, die DA-Zelle Unterlegscheibe und DA Zellplatten in diesem Artikel verwendeten produziert.
Danksagungen
Diese Arbeit wurde durch Zuschüsse aus Singapur Gesundheitsministeriums National Medical Research Council, NMRC CBRG15may017 und die Singapore Ministry of Education, 2014-T2-1-136 (zu N.R.J.G.) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| RPMI | HyClone | SH30027FS | |
| FBS | HyClone | SH3007103 | |
| L-Glutamine | HyClone | SH3003401 | |
| Sodium pyruvate | HyClone | SH3023901 | |
| Penicillin/Streptomycin | HyClone | SV30010 | |
| b-mercaptoethanol | Sigma Aldrich | 516732 | |
| 10X PBS | Vivantis | PB0344 – 1L | |
| Kinase Screening Library (96-Well) | Cayman Chemical | 10505 | Exact contents of the library may vary |
| DMSO | Sigma Aldrich | D2650 | |
| Dexamethasone | Sigma Aldrich | D4902 | |
| anti-CD3/CD28 beads | Thermo Fisher Scientific | 11452D | |
| FITC Active Caspase-3 Apoptosis Kit | BD Pharmingen | 550480 | Contains Fixation/Permeabilisation buffer, 10X Perm/Wash buffer and anti-caspase 3 antibody |
| DA-Cell Washer | CURIOX | HT1000 | |
| 96-well DA-Cell Plate | CURIOX | 96-DC-CL-05 | |
| Antibodies | |||
| CD3e | BioLegend | 100236 | |
| TCRb | BD Biosciences | 553174 | |
| CD4 | BD Biosciences | 740007 | |
| CD8 | BD Biosciences | 563786 | |
| CD69 | eBioscience | 25-0699-42 | |
| Inhibitors | |||
| TG003 | Cayman Chemical | - | From the Kinase Screening Library |
| PKC 412 | Cayman Chemical | - | From the Kinase Screening Library |
| Doramapimod | Cayman Chemical | - | From the Kinase Screening Library |
| Paclitaxel | Cayman Chemical | - | From the Kinase Screening Library |
| Erlotinib | Cayman Chemical | - | From the Kinase Screening Library |
| Necrostatin-5 | Cayman Chemical | - | From the Kinase Screening Library |
| NVP-BEZ235 | Cayman Chemical | - | From the Kinase Screening Library |
| Phthalazinone pyrazole | Cayman Chemical | - | From the Kinase Screening Library |
| AG-879 | Cayman Chemical | - | From the Kinase Screening Library |
| 1-NA-PP1 | Cayman Chemical | - | From the Kinase Screening Library |
| Torin 1 | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide II | Cayman Chemical | - | From the Kinase Screening Library |
| BIBF 1120 | Cayman Chemical | - | From the Kinase Screening Library |
| SMI-4a | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide XI (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10657 | Cayman Chemical | - | From the Kinase Screening Library |
| AS-703026 | Cayman Chemical | - | From the Kinase Screening Library |
| Chelerythrine chloride | Cayman Chemical | - | From the Kinase Screening Library |
| Tunicamycin | Cayman Chemical | - | From the Kinase Screening Library |
| GSK 1059615 | Cayman Chemical | - | From the Kinase Screening Library |
| Ruxolitinib | Cayman Chemical | - | From the Kinase Screening Library |
| Necrostatin-1 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 505124 | Cayman Chemical | - | From the Kinase Screening Library |
| INK128 | Cayman Chemical | - | From the Kinase Screening Library |
| Canertinib (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| SB 431542 | Cayman Chemical | - | From the Kinase Screening Library |
| PD 173074 | Cayman Chemical | - | From the Kinase Screening Library |
| Valproic Acid (sodium salt) | Cayman Chemical | - | From the Kinase Screening Library |
| PD 0325901 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 203580 | Cayman Chemical | - | From the Kinase Screening Library |
| VX-702 | Cayman Chemical | - | From the Kinase Screening Library |
| Emodin | Cayman Chemical | - | From the Kinase Screening Library |
| CHIR99021 | Cayman Chemical | - | From the Kinase Screening Library |
| BIO | Cayman Chemical | - | From the Kinase Screening Library |
| Imatinib (mesylate) | Cayman Chemical | - | From the Kinase Screening Library |
| Sunitinib Malate | Cayman Chemical | - | From the Kinase Screening Library |
| Gefitinib | Cayman Chemical | - | From the Kinase Screening Library |
| PP2 | Cayman Chemical | - | From the Kinase Screening Library |
| 3-Methyladenine | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide I | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide IV | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide V | Cayman Chemical | - | From the Kinase Screening Library |
| NSC 663284 | Cayman Chemical | - | From the Kinase Screening Library |
| D 4476 | Cayman Chemical | - | From the Kinase Screening Library |
| NU 7026 | Cayman Chemical | - | From the Kinase Screening Library |
| H-9 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Indirubin-3'-monoxime | Cayman Chemical | - | From the Kinase Screening Library |
| KN-62 | Cayman Chemical | - | From the Kinase Screening Library |
| KN-93 | Cayman Chemical | - | From the Kinase Screening Library |
| CGP 57380 | Cayman Chemical | - | From the Kinase Screening Library |
| Iso-Olomoucine | Cayman Chemical | - | From the Kinase Screening Library |
| (S)-Glycyl-H-1152 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide VIII (acetate) | Cayman Chemical | - | From the Kinase Screening Library |
| ST638 | Cayman Chemical | - | From the Kinase Screening Library |
| SU 6656 | Cayman Chemical | - | From the Kinase Screening Library |
| LY364947 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 203580 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10621 | Cayman Chemical | - | From the Kinase Screening Library |
| YM-201636 | Cayman Chemical | - | From the Kinase Screening Library |
| ZM 447439 | Cayman Chemical | - | From the Kinase Screening Library |
| AS-041164 | Cayman Chemical | - | From the Kinase Screening Library |
| NVP-AEW541 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| PP242 | Cayman Chemical | - | From the Kinase Screening Library |
| ABT-869 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10622 | Cayman Chemical | - | From the Kinase Screening Library |
| 17β-hydroxy Wortmannin | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10626 | Cayman Chemical | - | From the Kinase Screening Library |
| SU 6668 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10572 | Cayman Chemical | - | From the Kinase Screening Library |
| N,N-Dimethylsphingosine | Cayman Chemical | - | From the Kinase Screening Library |
| LY294002 | Cayman Chemical | - | From the Kinase Screening Library |
| U-0126 | Cayman Chemical | - | From the Kinase Screening Library |
| Staurosporine | Cayman Chemical | - | From the Kinase Screening Library |
| KN-92 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| AS-605240 (potassium salt) | Cayman Chemical | - | From the Kinase Screening Library |
| O-1918 | Cayman Chemical | - | From the Kinase Screening Library |
| Y-27632 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Leelamine | Cayman Chemical | - | From the Kinase Screening Library |
| PD 98059 | Cayman Chemical | - | From the Kinase Screening Library |
| PD 169316 | Cayman Chemical | - | From the Kinase Screening Library |
| TGX-221 | Cayman Chemical | - | From the Kinase Screening Library |
| (S)-H-1152 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| AS-605240 | Cayman Chemical | - | From the Kinase Screening Library |
| D-erythro-Sphingosine C-18 | Cayman Chemical | - | From the Kinase Screening Library |
| OSU03012 | Cayman Chemical | - | From the Kinase Screening Library |
| JNJ-10198409 | Cayman Chemical | - | From the Kinase Screening Library |
| Leelamine (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Arachidonic Acid Leelamide | Cayman Chemical | - | From the Kinase Screening Library |
| Lauric Acid Leelamide | Cayman Chemical | - | From the Kinase Screening Library |
| AS-252424 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10505 | Cayman Chemical | - | From the Kinase Screening Library |
| PI-103 | Cayman Chemical | - | From the Kinase Screening Library |
| PIK-75 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Sphingosine Kinase Inhibitor 2 | Cayman Chemical | - | From the Kinase Screening Library |
| Piceatannol | Cayman Chemical | - | From the Kinase Screening Library |
| SC-1 | Cayman Chemical | - | From the Kinase Screening Library |
| (R)-Roscovitine | Cayman Chemical | - | From the Kinase Screening Library |
| BAY-43-9006 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10561 | Cayman Chemical | - | From the Kinase Screening Library |
| AS-604850 | Cayman Chemical | - | From the Kinase Screening Library |
| PI3-Kinase α Inhibitor 2 | Cayman Chemical | - | From the Kinase Screening Library |
| ML-9 | Cayman Chemical | - | From the Kinase Screening Library |
| Triciribine | Cayman Chemical | - | From the Kinase Screening Library |
| Erbstatin Analog | Cayman Chemical | - | From the Kinase Screening Library |
| Kenpaullone | Cayman Chemical | - | From the Kinase Screening Library |
| Olomoucine | Cayman Chemical | - | From the Kinase Screening Library |
| AG-494 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-825 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-1478 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 216763 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 415286 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-17 | Cayman Chemical | - | From the Kinase Screening Library |
| H-8 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| LFM-A13 | Cayman Chemical | - | From the Kinase Screening Library |
| SC-514 | Cayman Chemical | - | From the Kinase Screening Library |
| Apigenin | Cayman Chemical | - | From the Kinase Screening Library |
| AG-18 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10554 | Cayman Chemical | - | From the Kinase Screening Library |
| DRB | Cayman Chemical | - | From the Kinase Screening Library |
| RG-13022 | Cayman Chemical | - | From the Kinase Screening Library |
| RG-14620 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-490 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-82 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-99 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-213 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-183 | Cayman Chemical | - | From the Kinase Screening Library |
| Lavendustin C | Cayman Chemical | - | From the Kinase Screening Library |
| ZM 336372 | Cayman Chemical | - | From the Kinase Screening Library |
| 5-Iodotubercidin | Cayman Chemical | - | From the Kinase Screening Library |
| SB 202190 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10571 | Cayman Chemical | - | From the Kinase Screening Library |
| Nilotinib | Cayman Chemical | - | From the Kinase Screening Library |
| SP 600125 | Cayman Chemical | - | From the Kinase Screening Library |
| L-threo-Sphingosine C-18 | Cayman Chemical | - | From the Kinase Screening Library |
| H-89 | Cayman Chemical | - | From the Kinase Screening Library |
| HA-1077 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| AG-370 | Cayman Chemical | - | From the Kinase Screening Library |
| Wortmannin | Cayman Chemical | - | From the Kinase Screening Library |
| AG-1296 | Cayman Chemical | - | From the Kinase Screening Library |
| KT 5823 | Cayman Chemical | - | From the Kinase Screening Library |
| Janex 1 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10574 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10575 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10576 | Cayman Chemical | - | From the Kinase Screening Library |
| NH125 | Cayman Chemical | - | From the Kinase Screening Library |
| TWS119 | Cayman Chemical | - | From the Kinase Screening Library |
| NSC 210902 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10577 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10578 | Cayman Chemical | - | From the Kinase Screening Library |
| PD 184161 | Cayman Chemical | - | From the Kinase Screening Library |
| CCT018159 | Cayman Chemical | - | From the Kinase Screening Library |
| Myricetin | Cayman Chemical | - | From the Kinase Screening Library |
Referenzen
- Gascoigne, N. R., Rybakin, V., Acuto, O., Brzostek, J. TCR Signal Strength and T Cell Development. Annual Review of Cell and Developmental Biology. 32, 327-348 (2016).
- Rothenberg, E. V., Moore, J. E., Yui, M. A. Launching the T-cell-lineage developmental programme. Nature Reviews Immunology. 8 (1), 9-21 (2008).
- Klein, L., Hinterberger, M., Wirnsberger, G., Kyewski, B. Antigen presentation in the thymus for positive selection and central tolerance induction. Nature Reviews Immunology. 9 (12), 833-844 (2009).
- Starr, T. K., Jameson, S. C., Hogquist, K. A. Positive and negative selection of T cells. Annual Review of Immunology. 21, 139-176 (2003).
- Rybakin, V., Gascoigne, N. R. Negative selection assay based on stimulation of T cell receptor transgenic thymocytes with peptide-MHC tetramers. PLoS One. 7 (8), e43191 (2012).
- Krogsgaard, M., Juang, J., Davis, M. M. A role for "self" in T-cell activation. Seminars in Immunology. 19 (4), 236-244 (2007).
- Nakayama, T., Yamashita, M. The TCR-mediated signaling pathways that control the direction of helper T cell differentiation. Seminars in Immunology. 22 (5), 303-309 (2010).
- Hoerter, J. A., et al. Coreceptor affinity for MHC defines peptide specificity requirements for TCR interaction with coagonist peptide-MHC. The Journal of Experimental Medicine. 210 (9), 1807-1821 (2013).
- Zhao, X., et al. Nonstimulatory peptide-MHC enhances human T-cell antigen-specific responses by amplifying proximal TCR signaling. Nature Communications. 9 (1), 2716 (2018).
- Fu, G., et al. Fine-tuning T cell receptor signaling to control T cell development. Trends in Immunology. 35 (7), 311-318 (2014).
- Wang, D., et al. Tespa1 is involved in late thymocyte development through the regulation of TCR-mediated signaling. Nature Immunology. 13 (6), 560-568 (2012).
- Fu, G., et al. Themis sets the signal threshold for positive and negative selection in T-cell development. Nature. 504 (7480), 441-445 (2013).
- Rosenblum, M. D., Gratz, I. K., Paw, J. S., Abbas, A. K. Treating human autoimmunity: current practice and future prospects. Science Translational Medicine. 4 (125), (2012).
- Hebeisen, M., et al. SHP-1 phosphatase activity counteracts increased T cell receptor affinity. The Journal of Clinical Investigation. 123 (3), 1044-1056 (2013).
- Wang, R. E., et al. An immunosuppressive antibody-drug conjugate. Journal of the American Chemical Society. 137 (9), 3229-3232 (2015).
- Borroto, A., et al. First-in-class inhibitor of the T cell receptor for the treatment of autoimmune diseases. Science Translational Medicine. 8 (370), (2016).
- Chen, E. W., Brzostek, J., Gascoigne, N. R. J., Rybakin, V. Development of a screening strategy for new modulators of T cell receptor signaling and T cell activation. Scientific Reports. 8 (1), 10046 (2018).
- Fouda, A., Tahsini, M., Khodayarian, F., Al-Nafisah, F., Rafei, M. A Fluorescence-based Lymphocyte Assay Suitable for High-throughput Screening of Small Molecules. Journal of Visualized Experiments. (121), e55199 (2017).
- Zhao, Z., et al. A high-throughput phenotypic screen of cytotoxic T lymphocyte lytic granule exocytosis reveals candidate immunosuppressants. Journal of Biomolecular Screening. 20 (3), 359-371 (2015).
- Florian, A. E., et al. Flow cytometry enables a high-throughput homogeneous fluorescent antibody-binding assay for cytotoxic T cell lytic granule exocytosis. Journal of Biomolecular Screening. 18 (4), 420-429 (2013).
- Krutzik, P. O., Crane, J. M., Clutter, M. R., Nolan, G. P. High-content single-cell drug screening with phosphospecific flow cytometry. Nature Chemical Biology. 4 (2), 132-142 (2008).
- Vlahos, C. J., Matter, W. F., Hui, K. Y., Brown, R. F. A specific inhibitor of phosphatidylinositol 3-kinase, 2-(4-morpholinyl)-8-phenyl-4H-1-benzopyran-4-one (LY294002). The Journal of Biological Chemistry. 269 (7), 5241-5248 (1994).
- Chen, Z., et al. Synthesis and SAR of novel 4-morpholinopyrrolopyrimidine derivatives as potent phosphatidylinositol 3-kinase inhibitors. Journal of Medicinal Chemistry. 53 (8), 3169-3182 (2010).
- Ruegg, U. T., Burgess, G. M. Staurosporine, K-252 and UCN-01: potent but nonspecific inhibitors of protein kinases. Trends in Pharmacological Sciences. 10 (6), 218-220 (1989).
- Davis, P. D., et al. Inhibitors of protein kinase C. 1. 2,3-Bisarylmaleimides. Journal of Medicinal Chemistry. 35 (1), 177-184 (1992).
- Komander, D., et al. Interactions of LY333531 and other bisindolyl maleimide inhibitors with PDK1. Structure (London, England: 1993). 12 (2), 215-226 (2004).
- Gassel, M., et al. The protein kinase C inhibitor bisindolyl maleimide 2 binds with reversed orientations to different conformations of protein kinase A. The Journal of Biological Chemistry. 279 (22), 23679-23690 (2004).
- Faull, A., Johnstone, C., Morley, A., et al. . Novel compounds. , (2003).
- Favata, M. F., et al. Identification of a novel inhibitor of mitogen-activated protein kinase kinase. The Journal of Biological Chemistry. 273 (29), 18623-18632 (1998).
- Woods, C. M., Zhu, J., McQueney, P. A., Bollag, D., Lazarides, E. Taxol-induced mitotic block triggers rapid onset of a p53-independent apoptotic pathway. Molecular Medicine (Cambridge, MA). 1 (5), 506-526 (1995).
- Teng, X., et al. Structure-activity relationship study of novel necroptosis inhibitors. Bioorganic & Medicinal Chemistry Letters. 15 (22), 5039-5044 (2005).
- Saini, M., et al. Regulation of Zap70 expression during thymocyte development enables temporal separation of CD4 and CD8 repertoire selection at different signaling thresholds. Science Signaling. 3 (114), ra23 (2010).
- Chae, H. J., et al. Molecular mechanism of staurosporine-induced apoptosis in osteoblasts. Pharmacological Research. 42 (4), 373-381 (2000).
- Varas, A., et al. Analysis of the human neonatal thymus: evidence for a transient thymic involution. Journal of Immunology (Baltimore, MD:1950). 164 (12), 6260-6267 (2000).
- Verstichel, G., et al. The checkpoint for agonist selection precedes conventional selection in human thymus. Science Immunology. 2 (8), (2017).
- Yamaguchi, E., de Vries, J., Yssel, H. Differentiation of human single-positive fetal thymocytes in vitro into IL-4- and/or IFN-gamma-producing CD4+ and CD8+ T cells. International Immunology. 11 (4), 593-603 (1999).
- Farley, A. M., et al. Dynamics of thymus organogenesis and colonization in early human development. Development (Cambridge, UK). 140 (9), 2015-2026 (2013).
- Cali, J. J., et al. Bioluminescent assays for ADMET. Expert Opinion on Drug Metabolism & Toxicology. 4 (1), 103-120 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten