Method Article
Identification des médiateurs du récepteur des cellules T signalisation via la projection des bibliothèques inhibiteur chimique
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cet article utilise un écoulement cytometry-test aux bibliothèques d’écran d’inhibiteurs chimiques pour l’identification des inhibiteurs et leurs objectifs qui influent sur la signalisation de récepteur de T-cellule. Les méthodes décrites ici peuvent aussi être étendues pour des projections de haut débit.
Résumé
Le récepteur des cellules T (TCR) signalisation voie comprend une multitude de médiateurs qui transmettent les signaux lors de l’activation du TCR. Différentes stratégies ont été proposées et mises en œuvre pour l’identification de nouveaux médiateurs de signalisation de la TCR, qui permettrait d’améliorer la compréhension des processus de lymphocytes T, y compris l’activation et la sélection thymique. Nous décrivons un test de dépistage qui permet l’identification de molécules qui influencent la TCR signalisation basée sur l’activation du développement des thymocytes. TCR de forts signaux provoquent des thymocytes en développement activer la machinerie apoptotique dans un processus appelé sélection négative. Grâce à l’application des inhibiteurs de la kinase, ceux avec des cibles qui affectent le TCR de signalisation sont en mesure de substituer le processus de sélection négative. La méthode détaillée dans cet article peut servir à identifier les inhibiteurs de kinases canoniques avec des rôles établis dans les voies de signalisation de TCR et aussi les inhibiteurs de kinases nouveau qui doit encore être mis en place dans les voies de signalisation de TCR. La stratégie de dépistage ici peut être appliquée aux écrans de débit plus élevé pour l’identification de nouvelles cibles thérapeutiques dans la signalisation de TCR.
Introduction
Les cellules T sont une lignée des lymphocytes qui jouent un rôle essentiel dans le maintien de l’immunité adaptative. Ils expriment le TCR, qui leur permet de reconnaître leurs ligands, complexes consistant en une molécule complexe majeur d’histocompatibilité (MHC) avec un peptide lié, qui se trouvent sur les surfaces des présentatrices d’antigène (CPA) des cellules. Le déclenchement du TCR voie grâce à l’interaction TCR/MHC de signalisation est indispensable pour l’activation des lymphocytes T et développement1.
Dans le développement des lymphocytes T, OS-moelle osseuse des cellules souches hématopoïétiques (CSH) migrent vers le thymus, où ils subissent une différenciation et passent par les étapes de lymphocytes de progression lineage2. Les thymocytes double-positifs de (DP), exprimant le CD4 et CD8 corécepteurs, s’engager avec self-peptide/MHC sur les véhicules. Thymocytes avec une affinité modérée pour leurs ligands du soi-peptide/MHC mature pour devenir les thymocytes (SP) CD4 ou CD8 positifs single, un processus qualifié de sélection positive. À l’inverse, les thymocytes qui reçoivent une stimulation excessive de TCR par le biais de la self-peptide/CML subissent l’apoptose via une sélection négative3,4. Ce processus de l’apoptose induite par stimulation, dépendante de la caspase peut être simulée en vitro en stimulant les thymocytes, par exemple avec des perles de recouverts d’anticorps anti-CD3/285. Des cellules T matures qui passent le processus de sélection sont activées par des ligands non-soi-peptide/MHC de TTB dans la périphérie. Self-peptide/CML est toujours d’actualité pour les cellules T périphériques, dans le cadre de la tonique de signalisation de survie et prolifération homéostatique, la différenciation des cellules T helper et l’amélioration des réponses de cellules T à non-soi-peptide/CML à travers coagonism6,7,8,9. Fixation de TCR de haute affinité pour le ligand de peptide/MHC active plusieurs voies de signalisation en aval, qui impliquent de nombreuses molécules de signalisation formant un complexe TCR signalisation réseau10. Les voies de signalisation de TCR ont été étudiés pendant plusieurs décennies, et encore la découverte de nouveaux médiateurs de la voie ne montre aucun signe de ralentissement11,12. La modulation des voies de signalisation de TCR a une pertinence clinique et peut impliquer potentialisant T-lymphocytes pour applications immunothérapeutiques ou l’inhibition des réponses de lymphocytes T pour le contrôle de l’auto-immunité,13. Stratégies pour la modulation des réponses des cellules T dépendent principalement de la perturbation de la kinase ou phosphatase activité14,15,16.
Les auteurs décrivent une application d’un écoulement cytometry-axée sur les test de screening de composés chimiques petits pour leur capacité à moduler la signalisation de TCR et activation de lymphocytes T17. Le test repose sur le phénomène des thymocytes activation de la voie de l’apoptose lorsqu’ils sont exposés à des signaux forts de TCR. L’essai est suffisamment sensible pour identifier les changements dans l’intensité de la stimulation ; incubant thymocytes exprimant le TCR transgénique avec tétramères peptide/MHC avec l’affinité a entraîné une augmentation correspondante de caspase activation-utilisé comme une mesure de l’apoptose réponse5. Pour l’écran, nous avons utilisé une bibliothèque des inhibiteurs de la kinase et évalué leur capacité à moduler la réponse de thymocytes à des signaux forts de TCR.
Plusieurs stratégies d’écoulement cytometry- ou fluorescence-journaliste ont été décrites pour le criblage à haut débit d’un assortiment de phénotypes d’activation périphérique dans divers sous-ensembles de T-cellule. Ces stratégies comprennent l’utilisation de génétiques reporters fluorescents pour évaluer le moment et l’ampleur de l' activation de lymphocytes T18, l’utilisation de dégranulation comme une lecture de cytotoxique lymphocytes activité19,20et l’analyse de la phosphorylation de diverses protéines impliquées dans21de signalisation cellulaire.
Le test de dépistage présenté ici est en mesure d’identifier correctement composés qui inhibent les molécules canoniques du TCR signalisation voie, mais aussi de potentiels, de nouveaux composés avec des effets inhibiteurs sur la signalisation de TCR. Par exemple, nous avons identifié des inhibiteurs de GSK3β et Hsp90 comme de nouveaux composés qui affectent les cellules T réponses17. Le test est capable de distinguer les inhibiteurs de transduction du signal, due à une diminution de la réponse apoptotique, contre les effets de la TCR-indépendant des inhibiteurs sur la toxicité cellulaire de gêner. En plus de l’induction de l’apoptose, nous mesurons l’upregulation CD69 et TCR downregulation comme marqueurs d’activation. Comme TCR signalisation réseaux sont complexes, l’utilisation des affichages multiples peut augmenter les chances de découvrir des molécules ayant des effets spécifiques sur une voie unique. Ici, nous présentons également l’utilisation d’un protocole indépendant de centrifugation comme une alternative de haut débit pour le protocole initial pendant la coloration des cellules en vue de la cytométrie. Le test décrit dans cet article utilise une petite bibliothèque composée des inhibiteurs de la kinase, mais, en principe, il peut être utilisé pour le dépistage de débit plus élevé. La bibliothèque de choix peut également incorporer une variété d’inhibiteurs ou d’autres molécules.
Protocole
Dans cette étude, des souris de C57Bl/6 mâles et femelles âgés de 6 à 8 semaines ont été utilisés. Les souris ont été élevés dans l’animalerie à l’Université nationale de Singapour (Singapour). Le Comité de l’emploi (IACUC) et le soin des animaux institutionnel National University of Singapore a approuvé toutes les expériences sur animaux.
1. préparation des thymocytes Suspension
- Euthanasier les souris dans une chambre de CO2 .
- Effectuez les étapes suivantes dans une hotte de culture de tissus pour éviter toute contamination des cultures cellulaires. Sécuriser la carcasse de la souris à l’Office de dissection, à l’aide d’épingles et pulvériser la souris avec l’éthanol à 70 %.
- À l’aide d’une paire de ciseaux, faire une incision verticale sur la face ventrale, à partir de l’abdomen vers la mâchoire. Font des incisions le long de chacun des membres postérieurs. Tendez la peau pour exposer la cage thoracique et circonscrire.
- Avec une paire de ciseaux, couper le diaphragme et les deux côtés de la cage thoracique de l’extrémité postérieure. Soulever la cage thoracique et épinglez-le vers le bas pour exposer le thymus. Séparer les tissus conjonctifs attachés vers le thymus et extraire le thymus à l’aide d’une paire de pinces courbées.
- Placez le thymus dans un puits d’une plaque de 6 puits contenant 5 mL de médias RPMI complet.
Remarque : Pensez à ajouter 10 % charcoal-dépouillé bovine sérum fœtal (SVF) aux médias afin d’améliorer la viabilité des thymocytes si un long temps d’attente est prévu entre la dissection et l’analyse de la stimulation. - Doucement, écraser le thymus, à l’aide de l’extrémité arrondie d’une seringue et passer les cellules à travers un tamis de cellule de 70 µM. Sinon, pour collecter les thymocytes dans un état plus sain, envisagez d’utiliser deux paires de pinces d’appuyer sur le thymus et recueillir les thymocytes qui se jettent sur l’épithélium thymique.
- Procéder à la cellule de comptage, en utilisant un hémocytomètre ou n’importe quelle cellule automatisée instrument de comptage.
2. titrage des inhibiteurs de la Kinase à des Concentrations non toxiques
Remarque : Cette section se concentre sur la préparation les inhibiteurs pour utilisation dans les écrans d’activation de lymphocytes T. Inhibiteurs utilisés à des concentrations élevées peuvent provoquer la mort cellulaire, qui est une lecture des écrans d’activation de lymphocytes T. La série de dilutions des inhibiteurs vise à déterminer la concentration finale des inhibiteurs individuelles qui ne doit pas induire l’apoptosis indépendante de la stimulation du TCR. La bibliothèque des inhibiteurs de la kinase utilisée dans cette étude a été achetée auprès d’un fournisseur externe. La liste des inhibiteurs est incluse dans la Table des matières.
-
Préparation des plaques des inhibiteurs de la kinase à des concentrations inférieures
- Pour préparer une plaque d’inhibiteurs à 1 mM, ajouter 10 µL d’inhibiteurs à 90 µL du diméthylsulfoxyde (DMSO) pour tous les inhibiteurs.
NOTE : Les inhibiteurs de la bibliothèque de petit-molécule utilisée dans cette étude sont livrés à une concentration de stock de 10 mM. Si les inhibiteurs sont sous forme de granulés, suivez les étapes de la reconstitution recommandée auprès des fournisseurs. Si les inhibiteurs ne sont pas fournis à 10 mM, préparer les plaques inhibiteur à des concentrations appropriées alternatives au lieu de cela et préparer des dilutions en série distinctes des inhibiteurs avec un facteur de dilution convenable.
Attention : En cas d’inhibiteurs de toxiques, suivez les instructions du fabricant sur la manipulation et l’élimination. - Pour préparer une plaque d’inhibiteurs à 0,1 mM, ajouter 10 µL d’inhibiteurs de la plaque des inhibiteurs de 1 mM à 90 µL de DMSO.
- Pour préparer une plaque d’inhibiteurs à 0,01 mM, ajouter 10 µL d’inhibiteurs de la plaque des inhibiteurs de 0,1 mM à 90 µL de DMSO.
- Pour préparer une plaque d’inhibiteurs à 1 mM, ajouter 10 µL d’inhibiteurs à 90 µL du diméthylsulfoxyde (DMSO) pour tous les inhibiteurs.
-
Traitement des thymocytes avec inhibiteurs de kinases
- Préparer une suspension de thymocytes conformément à l’article 1.
- Diluer les thymocytes dans RPMI complète pour obtenir une suspension de thymocytes de 5 x 106 cellules/mL.
- Ajouter 200 µL de suspension de thymocytes dans tous les puits d’une plaque 96 puits, à l’aide d’une pipette multicanaux.
- Dans chaque puits, ajouter 2 µL d’inhibiteurs des puits de la plaque contenant des inhibiteurs de 1 mM (la concentration finale des inhibiteurs est 10 µM).
- Dans la même assiette, préparer les quatre puits des témoins, quatre puits de 5 µM traités au dexaméthasone des témoins positifs et quatre puits des témoins négatifs imprégnées sur le véhicule, en ajoutant 2 µL de DMSO.
- Incuber les thymocytes en a 37 ° C, 5 % CO2 incubateur pour les 17-20 h (ou toute la nuit).
-
Détermination des concentrations appropriées d’inhibiteurs individuels
- Faites tourner la plaque des thymocytes à 300 x g et 4 ° C, pendant 5 min. remettre en suspension les cellules 250 µL de tampon de lavage des FACS.
- Exécuter une cytométrie des échantillons et d’analyser les résultats avec un programme d’analyse de cytométrie en flux.
- Déterminer le pourcentage de cellules vivantes issu des FSC-SSC Gate. La stratégie de blocage est montrée dans la Figure 1 b.
- Calculer le pourcentage de cellules vivantes, basée sur les contrôles de DMSO-traités, qui sont normalisés à 100 % en moyenne. Choisir une fenêtre arbitraire de la mort des cellules acceptable (e.g.,20%). Inhibiteurs qui ont abouti à un pourcentage de cellules vivantes sous cette fenêtre (i.e., dessous de 80 % des commandes traitées DMSO) doivent être testés à nouveau à des concentrations plus faibles.
- Pour les inhibiteurs qui n’a pas les critères de viabilité dans l’étape 2.3.4, répétez les étapes des étapes 2.2.1 - 2.3.4, mais utiliser la plaque d’inhibiteurs à 0,1 mM pour étape 2.2.4 au lieu de la plaque contenant les inhibiteurs de 1 mM. La concentration finale d’inhibiteurs utilisé ici est de 1 µM.
- Pour les inhibiteurs qui toujours produire des niveaux élevés de mort cellulaire à 1 µM, tester les inhibiteurs à 0,1 µM. Répétez les étapes 2.2.1 - 2.3.4, mais utiliser la plaque d’inhibiteurs à 0,01 mM à l’étape 2.2.4. La concentration finale d’inhibiteurs utilisé ici est de 0,1 µM.
-
Préparation d’une plaque de stock des inhibiteurs de la kinase
- Inhibiteurs de la servir à 10 µM, ajouter 10 µL d’inhibiteurs de 10 mM à 10 µL de DMSO.
- Inhibiteurs de la servir à 1 µM, ajouter 1 µL d’inhibiteurs de 10 mM à 19 µL de DMSO.
- Inhibiteurs de la servir à 0,1 µM, ajouter 1 µL d’inhibiteurs de 10 mM à 199 µL de DMSO (Figure 1).
Remarque : La plaque stock prête d’inhibiteurs est 500 fois la concentration de la concentration finale prévue lors de l’ajout à des suspensions de thymocytes. La plaque de stock d’inhibiteurs peut être préparée en bandes PCR ou en plaques de 96 puits. - La plaque de stock des inhibiteurs de la kinase peut être appliquée aux thymocytes de dépistage dans un système conventionnel de centrifugation-dépendante (chapitre 3 ; voir Figure 1 a, méthodes 1 et 2) ou dans un autre système indépendant de centrifugation (section 4, voir Figure 1 a, la méthode 3).
3. bibliothèque d’inhibiteur de la kinase dépistage (essai centrifugeuse conventionnel)
-
Traitement des thymocytes avec inhibiteurs de kinases
- Préparer une suspension de thymocytes conformément à l’article 1.
- Diluer les thymocytes dans RPMI complète pour obtenir une suspension de thymocytes de 5 x 106 cellules/mL.
- Ajouter 200 µL de thymocytes dans chaque puits d’une plaque 96 puits, à l’aide d’une pipette multicanaux. Placer la plaque sur la glace.
- Ajouter 0,5 µL d’inhibiteurs de la plaque à 96 puits des puits de la plaque de stock inhibiteur correspondants préparé à la section 2.4.
- Préparer huit puits de témoins non traités. Préparer quatre puits de témoins traités véhicule en ajoutant 0,5 µL de DMSO. Préparer quatre puits de 5 commandes sur traités au dexaméthasone µM (Figure 2).
-
Stimulation des thymocytes billes anti-CD3/CD28
- Prélever 1 mL de perles et laver les billes avec 2 mL de PBS. Séparer les billes à l’aide d’un support magnétique et aspirer la solution. Remettre en suspension les perles dans 5 mL de RPMI complet.
Remarque : Le ratio de perles aux cellules est de 1 à 2,5. Ajuster la quantité de perles à prendre, selon le nombre de puits pour stimuler et le nombre de thymocytes utilisée. - Ajouter 50 µL de billes dans chaque échantillon imprégnées d’inhibiteur, quatre échantillons traités DMSO et quatre des huit échantillons non traités. Ajouter 50 µL de RPMI complet pour les autres quatre cupules non traitées. La figure 2 montre la disposition générale de la plaque.
- Mélanger le contenu des puits à l’aide d’une pipette multicanaux.
- Incuber les thymocytes en a 37 ° C, 5 % CO2 incubateur pour les 17-20 h (ou toute la nuit).
- Prélever 1 mL de perles et laver les billes avec 2 mL de PBS. Séparer les billes à l’aide d’un support magnétique et aspirer la solution. Remettre en suspension les perles dans 5 mL de RPMI complet.
-
La coloration des antigènes de surface
- Préparer un mélange de coloration anticorps contenant des anticorps anti-CD69, anti-CD8, anti-TCRβ et anti-CD4. Diluer les anticorps dans le tampon de lavage de FACS (PBS additionné de 0,5 % d’albumine sérique bovine [BSA]) à un ratio de 1 : 200 (v/v).
Remarque : Pensez à optimiser les titres d’anticorps utilisés pour la coloration, au lieu d’utiliser des dilutions anticorps fixe, afin de minimiser les variations de coloration à travers différentes expériences et à améliorer le rapport signal-bruit. - Faites tourner la plaque à 300 x g et 4 ° C, pendant 5 min.
- Mettez la plaque pour prélever la solution.
- À ce stade, le protocole peut suivre le protocole de fonction centrifugeuse conventionnel (passer à l’étape 3.3.5 ; voir Figure 1 a, méthode 1) ou le protocole de centrifugation indépendant alternatif (passer à l’étape 4.4.4 ; voir Figure 1 a, méthode (2).
- Remettre en suspension les cellules de 75 µL du mélange coloration anticorps préparé à l’étape 3.3.1.
- Mélanger les échantillons à l’aide d’une pipette multicanaux et les incuber sur glace pendant 30 min.
- Préparer un mélange de coloration anticorps contenant des anticorps anti-CD69, anti-CD8, anti-TCRβ et anti-CD4. Diluer les anticorps dans le tampon de lavage de FACS (PBS additionné de 0,5 % d’albumine sérique bovine [BSA]) à un ratio de 1 : 200 (v/v).
-
Fixation des cellules
- Laver les puits avec 200 µL de tampon de lavage FACS et faites tourner la plaque à 300 x g et 4 ° C, pendant 5 min.
- Mettez la plaque pour prélever la solution.
- Ajouter le tampon de fixation/perméabilisation (livré avec le kit actif caspase-3 l’apoptose ; même avec 10 x tampon de perm/lavage mentionné à l’étape 3.5.1 et l’anticorps anti-caspase-3 à l’étape 3.5.2) à 200 µL / puits.
- Incuber sur glace pendant 30 min.
-
Intracellulaire de coloration pour l’actif caspase 3
- Préparer 1 tampon de perm/lavage x diluer 5 mL de tampon de perm/lavage 10 x dans 45 mL d’eau ultrapure.
- Préparer intracellulaire active caspase tache en ajoutant 1,3 mL d’anticorps anti-caspase-3 à 6,5 mL 1 x tampon de perm/lavage. Le taux d’anticorps à perm/lavage tampon est de 1:5.
- Faites tourner la plaque à 300 x g et 4 ° C, pendant 5 min. Mettez la plaque à jeter la solution. Laver la plaque avec 200 µL de tampon de perm/lavage 1 x.
- Répétez l’étape 3.5.3.
- Faites tourner la plaque à 300 x g et 4 ° C, pendant 5 min. Mettez la plaque à jeter la solution. Ajouter 75 µL de caspase intracellulaire tache préparée à l’étape 3.5.2 dans toutes les loges.
- Mélanger les échantillons à l’aide d’une pipette multicanaux et incuber sur la glace pendant 1 h.
- Laver les échantillons avec 200 µL de tampon de perm/lavage de x 1 et faites tourner la plaque à 300 x g et 4 ° C, pendant 5 min.
- Mettez la plaque pour prélever la solution. Laver la plaque avec 200 µL de tampon de perm/lavage 1 x. Faites tourner la plaque à 300 x g et 4 ° C, pendant 5 min.
- Mettez la plaque pour ignorer la solution et remettre en suspension les échantillons dans 200 µL de tampon de lavage des FACS.
- Exécuter une cytométrie des échantillons et d’analyser les résultats avec un programme d’analyse de FACS.
- En utilisant un CD4 et CD8 terrain, porte sur la population de thymocytes DP avec une expression positive de CD4 et CD8 (Figure 2, la moitié inférieure). Au sein de la porte de thymocytes DP, déterminer le pourcentage de cellules activées caspase-3, à l’aide de l’échantillon non stimulé comme contrôle négatif et dexaméthasone comme contrôle positif. Pour l’analyse de l’expression de CD69 dans la porte de thymocytes DP, utiliser l’échantillon non stimulé comme contrôle négatif et l’échantillon stimulée comme contrôle positif.
Remarque : Lorsque le processus de blocage sur les thymocytes DP, vérifiez que la population de thymocytes DP est fermée correctement pour des échantillons individuels. Cellules stimulées downregulate corécepteurs de surface et une exclusion involontaire d’événements peuvent se produire si une porte étanche de DP est utilisée.
4. bibliothèque d’inhibiteur de la kinase dépistage (test de centrifugeuse-indépendant)
-
Traitement des thymocytes avec inhibiteurs de kinases
- Préparer une suspension de thymocytes conformément à l’article 1.
- Diluer les thymocytes dans RPMI complète pour obtenir une suspension de thymocytes de 25 x 106 cellules/mL.
- Ajouter 40 µL de thymocytes dans chaque puits d’une plaque de petit volume, à l’aide d’une pipette multicanaux. Placer la plaque sur la glace.
- Diluer les inhibiteurs de la plaque de stock, DMSO et dexaméthasone dans RPMI complète à un ratio de quatre pièces de RPMI complète à une partie du DMSO/inhibiteur/dexaméthasone (facteur de dilution de 5).
Remarque : Comme les volumes utilisés dans cette assiette de petits volumes sont 5 fois plus faible que dans la méthode conventionnelle, les inhibiteurs et les réactifs de contrôle sont dilués cinq fois avant de les ajouter aux thymocytes dans la plaque. - Ajouter 0,5 µL d’inhibiteurs à la plaque à 96 puits des puits de la plaque d’inhibiteur préparées à l’étape 4.1.4 correspondants.
- Préparer huit puits de témoins non traités. Préparer quatre puits de témoins traités véhicule en ajoutant 0,5 µL du DMSO préparées à l’étape 4.1.4. Préparer quatre puits de 5 contrôles traités au dexaméthasone µM, à l’aide de la dexaméthasone diluée préparée à l’étape 4.1.4 (Figure 2).
-
Stimulation des thymocytes billes anti-CD3/CD28
- Assurez-vous que les perles sont uniformément remises en suspension. Prélever 1 mL de perles et lavez-les avec 2 mL de PBS. Séparer les billes à l’aide d’un support magnétique et aspirer la solution. Remettre en suspension les perles dans 1 mL de milieu RPMI complet.
Remarque : Le ratio de perles aux cellules est de 1 à 2,5. Ajuster la quantité de perles de verre, selon le nombre de puits pour stimuler et le nombre de thymocytes utilisée. - Ajouter 10 µL de la suspension de la perle à chaque échantillon imprégnées d’inhibiteur, quatre échantillons traités DMSO et quatre des huit échantillons non traités. Ajouter 10 µL de RPMI complet pour les autres quatre cupules non traitées. La figure 2 illustre le schéma général.
Remarque : Le volume final des puits est 50 µL, qui relève de la capacité maximale des puits. Il est important de faire preuve de prudence et de tenir les plaques de droite, pour éviter tout débordement de puits. - Pour mélanger, agiter la plaque à l’aide d’un agitateur orbital de microplaque. Vous pouvez également mélanger le contenu des puits à l’aide d’une pipette multicanaux.
- Incuber les thymocytes en a 37 ° C, 5 % CO2 incubateur pour les 17-20 h (ou toute la nuit) avec un couvercle anti-évaporation.
- Assurez-vous que les perles sont uniformément remises en suspension. Prélever 1 mL de perles et lavez-les avec 2 mL de PBS. Séparer les billes à l’aide d’un support magnétique et aspirer la solution. Remettre en suspension les perles dans 1 mL de milieu RPMI complet.
-
Programme d’installation de la rondelle plaque
Remarque : Les instructions pour mettre en place la rondelle plaque sont fournies par le fabricant. Les étapes sont brièvement mentionnées ci-dessous. Environ 150 mL de solution est nécessaire pour chaque étape d’amorçage.- Amorcer le système de lavage avec de l’éthanol 70 % contenant 1 % Tween 20.
- Amorcer le système de lavage à l’eau désionisée contenant 1 % Tween 20.
- Amorcez le système de lavage avec tampon de lavage des FACS.
-
La coloration des antigènes de surface
- Préparer un mélange de coloration anticorps contenant des anticorps anti-CD69, anti-CD8, anti-TCRβ et anti-CD4. Diluer les anticorps dans le tampon de lavage de FACS à un ratio de 1 : 100 (v/v).
- Laver la plaque 9 x, avec 55 µL de tampon de lavage FACS / cycle de lavage, à l’aide de l’écoulement laminaire automatisé, système de lavage.
Remarque : À la fin de la lave, il y aura 25 µL du volume résiduel dans chaque puits. - Remettre en suspension les cellules de 25 µL du mélange coloration anticorps préparé à l’étape 4.4.1.
- Si les échantillons sont transférés d’une plaque à 96 puits (de l’étape 3.3.4), remettre en suspension les cellules dans 50 µL du mélange anticorps préparé à l’étape 3.3.1 et transférer les échantillons à la plaque de petit volume. Cette étape correspond à la méthode 2, comme illustré à la Figure 1 a.
- Pour mélanger, agiter la plaque avec un agitateur orbital de microplaque ou mélanger les échantillons à l’aide d’une pipette multicanaux et incuber sur glace pendant 30 min.
-
Fixation des cellules
- Laver la plaque 9 x, avec 55 µL de tampon de lavage FACS / cycle de lavage, à l’aide de l’écoulement laminaire automatisé, système de lavage.
- Ajouter le tampon de fixation/perméabilisation (livré avec le kit actif caspase-3 l’apoptose ; même avec 10 x tampon de perm/lavage mentionné à l’étape 4.6.1 et l’anticorps anti-caspase-3 à l’étape 4.6.2) à 50 µL / puits.
- Incuber sur glace pendant 30 min.
-
Intracellulaire de coloration pour l’actif caspase 3
- Préparer 1 tampon de perm/lavage x diluer 25 mL de tampon de perm/lavage 10 x dans 225 mL d’eau ultrapure.
- Préparer intracellulaire active caspase tache en ajoutant 1 mL d’anticorps anti-caspase-3 à 2 mL de 1 x tampon de perm/lavage. Le taux d’anticorps à perm/lavage tampon est 1:2.
- Amorcez le système de lavage avec 1 x tampon de perm/lavage.
- Laver la plaque 9 x avec 1 x tampon de perm/lavage, à 55 µL pour chaque lavage.
- Ajouter 25 µL de la tache de caspase intracellulaire préparée à l’étape 4.6.2 dans toutes les loges.
- Pour mélanger, agiter la plaque avec un agitateur orbital de microplaque ou mélanger les échantillons à l’aide d’une pipette multicanaux et incuber sur glace pendant 1 h.
- Laver la plaque 9 x avec 1 x tampon de perm/lavage, à 55 µL pour chaque lavage.
- Ajouter 25 µL de tampon de lavage FACS dans toutes les loges.
- Transférer les échantillons pour microplaques tubes après adéquate mixage via pipetage.
- Ajouter un autre 50 µL de tampon de lavage FACS aux puits vides et répétez l’étape 4.6.9.
- Répétez les étapes 4.6.9 et 4.6.10 x 2 jusqu'à 200 µL des échantillons sont prélevés dans les tubes de microplaques.
Remarque : Des procédures décrites aux étapes 4.6.10 et 4.6.11 vise à garantir une récupération maximale des cellules de la plaque de petit volume. Si nombre de cellules n’est pas une préoccupation, après l’étape 4.6.10, simplement rajouter la microplaque tubes de 200 µL avec tampon de lavage des FACS. - Exécuter une cytométrie des échantillons et d’analyser les résultats avec un programme d’analyse de FACS, comme par l’Etape 3.5.11. Activation de la caspase-3 et CD69 expression sont analysés dans la porte contenant CD4+CD8+DP thymocytes.
Résultats
L’approche pour le test de dépistage est résumée dans la Figure 1 a. Les inhibiteurs de la kinase ont tout d’abord examinés leurs effets latents sur la viabilité des thymocytes. Comme témoin positif pour l’apoptosis, dexaméthasone a été utilisé comme agent pro-apoptotique. Le processus de blocage pour la population de cellules vivantes a été déterminé à l’issu des contrôles positifs traités au dexaméthasone (Figure 1 b) et le groupe témoin négatif. Les inhibiteurs ont été testés tout d’abord à 10 µM sur les thymocytes, et le pourcentage de cellules viables a été mesuré après incubation pendant 18 heures. Une fenêtre de 20 % pour la mort cellulaire a été choisie tels que les composés qui induit une plus grande que 20 % perte de cellules dans la barrière de cellules vivantes, par rapport aux échantillons traités DMSO, ont été testés à des concentrations plus faibles (Figure 1 b). Parcelles de FACS représentatifs des échantillons choisis imprégnées d’insecticide inhibiteur sont présentés pour illustrer l’analyse de la viabilité. LY294002 (2-(4-morpholinyl)-8-phenyl-4H-1-benzopyran-4-one ; CAS 154447-36-6), un inhibiteur de PI3K22, n’augmente pas considérablement la mort cellulaire à 10 µM, et l’inhibiteur servait à 10 µM pour les analyses ultérieures. CAY10626 (N-[2-(dimethylamino)ethyl]-N-methyl-4-[[[4-[4-(4-morpholinyl)-7-(2,2,2-trifluoroethyl)-7H-pyrrolo[2,3-d]pyrimidin-2-yl]phenyl]amino]carbonyl]amino]-benzamide ; CAS 1202884-94-3), un inhibiteur double de PI3Kα/mTOR23, provoquée par des niveaux élevés de mort cellulaire à 10 µM et à 1 µM, mais pas à 0,1 µM et 0,1 µM était déterminé à la concentration appropriée pour application dans les essais en aval. Staurosporine (2,3,10,11,12,13-hexahydro-10R-methoxy-9S-methyl-11R-methylamino-9S,13R-epoxy-1H,9H-diindolo[1,2,3-gh;3',2',1'-lm]pyrrolo[3,4-j][1,7]benzodiazonin-1-one ; CAS 62996-74-1), un inhibiteur de kinase C pan-avec une capacité établie à induire l’apoptose24, induit une apoptose significative à toutes les concentrations testées, même à 0,1 µM. Il a été utilisé pour des tests ultérieurs à 0,1 µM comme un contrôle positif supplémentaire.
Les concentrations finales des inhibiteurs ont été sélectionnées selon les concentrations plus élevées dans lequel ils ne pas amplifier la mort cellulaire par plus de 20 % des échantillons traités DMSO. Avec les concentrations finales des inhibiteurs déterminés, une plaque de stock d’inhibiteurs a été préparée tel que tous les inhibiteurs sont 500 fois la concentration lorsqu’il est appliqué aux cellules. La figure 1 illustre le schéma de la plaque de stock avec les concentrations finales des inhibiteurs. Dans le protocole alternatif d’incubation des cellules directement dans les plaques de faible volume de l’écoulement laminaire, test de lavage, l’utilisation de petits volumes ont nécessité une dilution supplémentaire des inhibiteurs. Pour s’assurer que le contenu de DMSO des cultures après ajout de l’inhibiteur ne serait pas trop élevé pour les cellules, les inhibiteurs ont été davantage dilués dans RPMI complète, par un facteur de dilution de 5, tels qu’ils étaient à 100 fois la concentration prévue lorsqu’il est appliqué à la cellules.
Les inhibiteurs, dilués à des concentrations non toxiques, ont été utilisés dans le test pour induites par la stimulation-TCR apoptose des thymocytes5,17. La stimulation a été réalisée à l’aide de perles de l’anti-CD3/CD28 pendant 18 h, et les cellules ont été colorés par la suite pour l’activation de la caspase-3 dans le CD4+ et CD8+ DP population de thymocytes (Figure 2). Une augmentation de l’activation de la caspase-3, l’expression CD69 et une régulation négative du RCT, ont été observés dans l’anti-CD3/CD28-stimulée tant les DMSO mock-anti-CD3/28-stimulée échantillons traités, comparés aux échantillons non stimulées. Les échantillons traités au dexaméthasone ont montré une augmentation de l’activation de la caspase-3 indépendant de CD69 upregulation, qui est attendue de l’effet inducteur de l’apoptose étant indépendante de la stimulation du TCR.
Figure 3 résume les résultats de la bibliothèque de dosage pour certains inhibiteurs de dépistage. Activation de la caspase-3 tant CD69 peuvent servir à identifier les inhibiteurs potentiels d’intérêt due à la suppression de l’expression. Comme prévu, inhibiteurs des médiateurs canoniques de la signalisation de TCR a montré comme positifs hits dans les écrans. Ces inhibiteurs, qui présentaient des degrés de puissance inhibitrice, inclus des inhibiteurs à large spectre qui ciblent plusieurs kinases et, en outre, plus des inhibiteurs spécifiques. Certains inhibiteurs ont pu supprimer l’activation de la caspase-3 tant upregulation CD69 (Figure 3 b, rangée du haut, panneaux de gauche). Un inhibiteur de tel est bisindolylmaléimide II (3-(1H-Indol-3-yl)-4-[1-[2-(1-methyl-2-pyrrolidinyl)ethyl]-1H-indol-3-yl]-1H-pyrrole-2,5-dione ; CAS 137592-45-1), qui inhibe toute protéine kinase C isoformes, en plus de la protéine kinase A et PDK125,26,27. Un autre inhibiteur de cette catégorie est CAY10657 (3-[(aminocarbonyl)amino]-5-[4-(4-morpholinylmethyl)phenyl]-2-thiophenecarboxamide ; CAS 494772-86-0), un inhibiteur proposé de l’IKK228.
Il y avait des composés qui inhibent CD69 upregulation mais ne portait pas atteinte d’activation de la caspase-3 (Figure 3 b, rangée du haut, panneaux de droite). CAY10626, un inhibiteur de mTOR et PI3Kα23et U-0126 (2, 3-bis [amino [(2-aminophenyl) thio] méthylène]-butanedinitrile ; CAS 109511-58-2), un inhibiteur MEK29, ont été quelques-uns des inhibiteurs identifiés. Les résultats montrent que différents inhibiteurs ciblant différentes kinases des branches spécifiques de la voie de signalisation de TCR, surtout celles qui visent les kinases de stade avancé, peuvent entraîner une dégradation sélective des phénomènes d’activation de lymphocytes T.
Il y avait aussi des inhibiteurs qui n’a pas supprimé les CD69 upregulation et activation de la caspase-3 (Figure 3 b, rangée du bas, panneaux de gauche). Paclitaxel (βS-(benzoylamino) - αR - hydroxy-acide bis, (2aR,4S,4aS,6R,9S,11S,12S,12aR,12bS)-6,12b-bis(acetyloxy)-12-(benzoyloxy)-2a,3,4,4a,5,6,9,10,11,12,12a,12b-dodecahydro-4,11-dihydroxy-4a,8,13,13-tetramethyl-5-oxo-7 , 11-methano-1H-cyclodeca[3,4]benz[1,2-b]oxet-9-yl ester ; CAS 33069-62-4), un perturbateur de microtubules dynamiques30et necrostatin-5 (2-[[3,4,5,6,7,8-hexahydro-3-(4-methoxyphenyl)-4-oxo[1]benzothieno[2,3-d]pyrimidin-2-yl]thio]-acetonitrile ; CAS 337349-54-9), un inhibiteur de kinase de RIP131, sont deux inhibiteurs identifiés pour être dans cette catégorie. Dans ce cas où l’upregulation CD69 et activation de la caspase-3 n’étaient pas affaiblies, cela peut être due à des inhibiteurs de la pas ciblant une kinase pertinente du TCR voie de signalisation.
Comme mentionné précédemment, la staurosporine a été utilisée dans les écrans, à une concentration qui a encore induit l’apoptose dans les thymocytes. Comme prévu, l’échantillon de la staurosporine traités a montré des niveaux élevés d’activation de la caspase-3 (Figure 3 b, rangée du bas, colonne de droite). Les faibles niveaux d’expression CD69 peuvent être attribuées à l’inhibition par la staurosporine de PKC, comme bisindolylmaléimide II, un autre inhibiteur de PKC-pan, supprima également l’expression de CD69. Par ailleurs, la staurosporine induit l’apoptose dans les cellules avant ils ont réussi à réguler positivement l’expression CD69.
Pour augmenter le débit et l’automatisation du protocole, des protocoles parallèles qui impliquait l’utilisation d’une plaque automatisée système via flux laminaire de lavage ont été préparés. Deux protocoles distincts à l’aide de cet appareil de lavage automatique plaque ont été testés et comparés à la méthode conventionnelle de cultivant les cellules en plaques 96 puits et de coloration des cellules dans un protocole de centrifugation-dépendant. Une méthode consistait à cultiver des cellules dans des plaques de 96 puits, conformément à la procédure standard, et ensuite, transférer les cellules aux plaques compatibles avec la rondelle plaque automatisé pour la coloration les étapes (Figure 4, DA-lavage échantillons). L’autre méthode impliquée cultivant les cellules directement dans les plaques plaque rondelle-compatible et en continuant avec le protocole de coloration sur la même plaque (Figure 4, échantillons de DA-Culture). Les protocoles de centrifugation indépendant ne donnent pas beaucoup de différences perceptibles dans active caspase-3, CD69 ou TCRβ coloration à travers les différents échantillons testés, contre le protocole conventionnel de centrifugation-dépendante (Figure 4). Différences dans l’intensité de coloration peuvent être attribuées à l’utilisation des anticorps à des concentrations légèrement différentes au cours des étapes de coloration.
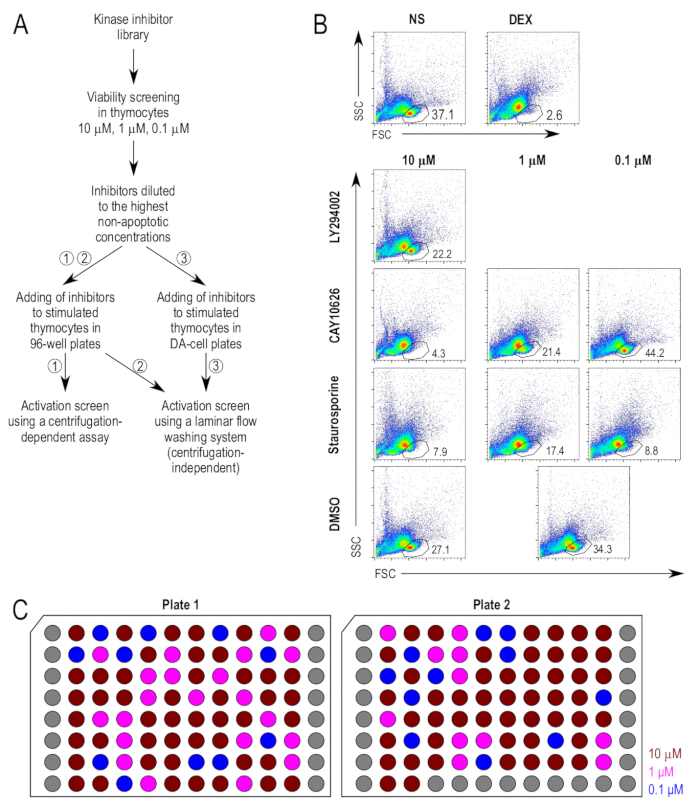
Figure 1 : Viabilité des thymocytes après traitement avec des inhibiteurs de. (A) schéma expérimental des principales étapes dans le test de dépistage. Il y a trois méthodes proposées pour la stimulation et la coloration des thymocytes utilisées dans le test de l’activation, à savoir (1) la mise en culture des thymocytes dans des plaques de 96 puits standards, suivies d’une coloration à l’aide d’un protocole centrifugation conventionnels, (2) les cultivant des thymocytes en plaques 96 puits standard, suivies d’une coloration à l’aide d’un protocole de lavage indépendants de centrifugation et (3) la mise en culture des thymocytes dans des petits plats, suivie de coloration dans les mêmes plaques en utilisant un protocole de lavage indépendants de centrifugation. (B) Gating stratégies utilisées dans les dosages de viabilité. La porte des cellules vivantes a été dérivée de la dispersion vers l’avant (FSC) et trace de diffusion latérale (SSC), comme décrit précédemment17. Inhibiteurs qui étaient considérées comme trop toxique à la concentration d’essai ont été soumis à plus amples essais de viabilité à 10 fois plus faibles concentrations. Imprégnées d’insecticide inhibiteur des échantillons représentatifs sont présentés. Remarque le contrôle commun (DMSO traités [DMSO]) utilisé pour la 1 µM et 0,1 µM échantillons. (C) schéma d’inhibiteurs dilués. Une représentation schématique des plaques d’inhibiteurs diluées dans le DMSO à une concentration de 500 fois la concentration finale prévue. Chacun représente bien un inhibiteur unique ; les puits gris sont vides. Les concentrations de montré sont la concentration finale lors de l’ajout de cultures cellulaires, à savoir 10 µM (rouge foncé), 1 µM (fuchsia) et 0,1 µM (bleu). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
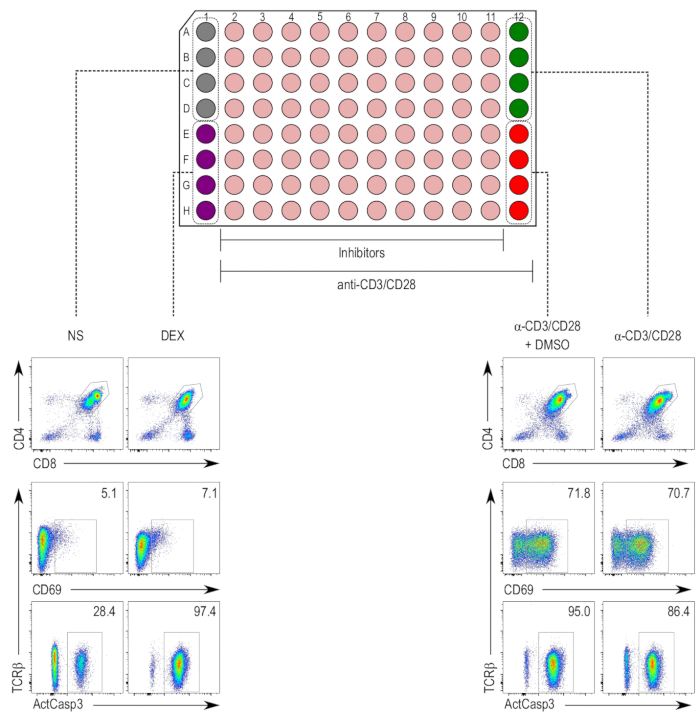
Figure 2 : Schéma de l’essai d’activation thymocyte. (En haut) Colonnes 1 et 12 sont réservés pour les contrôles, tandis que les colonnes 2 à 11 sont imprégnées d’insecticide inhibiteur échantillons (beige). Le contrôle négatif (non stimulé [NS] ; gris) occupe puits A1 à D1, et le contrôle positif pour la mort des cellules (traités au dexaméthasone [DEX] ; violet) occupe puits E1 à H1. Colonnes 2 à 12 contiennent des thymocytes stimulées avec des perles de l’anti-CD3/CD28. Le contrôle positif pour l’activation du thymocyte (échantillons stimulés [α-CD3/CD28] ; vert) occupe puits A12 à D12 et le contrôle du véhicule (stimulée et imprégnées de DMSO [α-CD3/CD28 + DMSO] ; rouge) occupe les puits E12 à H12. (En bas) Flow cytometry parcelles de la caspase-3 actif (ActCasp3), CD69 et TCRβ la coloration des thymocytes bloquées dans la porte (DP) de double-positifs. Des emplacements représentatifs des différents contrôles apparaissent. NS = non stimulé ; DEX = échantillons traités au dexaméthasone ; Α-CD3/CD28 + DMSO = échantillons stimulée avec perles CD3/CD28-enduit et traité avec le DMSO ; Α-CD3/CD28 = échantillons stimulés avec perles CD3/CD28-enduit. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
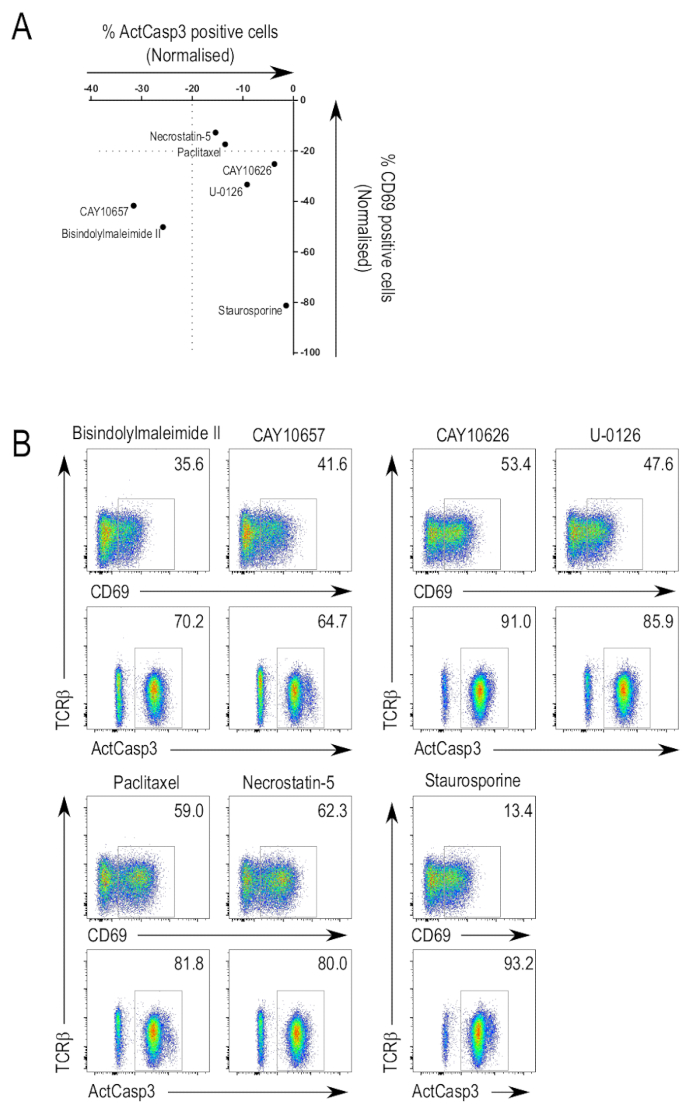
Figure 3 : Sélection de la bibliothèque de l’inhibiteur sur l’activation des thymocytes. (A) résume les données du test de l’activation. Ce sont les résultats d’une expérience représentative montrant les valeurs normalisées des cellules activées caspase-3 et expression CD69 pour certains inhibiteurs. Normalisation a été faite en comparant le pourcentage de cellules dans l’active-caspase-3-positives ou porte CD69 positifs pour la valeur du contrôle imprégnées de DMSO, qui a une valeur relative de 0 dans le graphique. (B) sélectionné FACS parcelles. Flow cytometry parcelles d’inhibiteurs qui suppriment les activation de la caspase-3 et CD69 upregulation (en haut à gauche), supprimée seulement CD69 upregulation (en haut à droite), ou n’avait aucun effet sur l’activation de la caspase-3 et CD69 upregulation (en bas à gauche). Parcelles de l’échantillon la staurosporine traités sont présentés pour illustrer les effets de l’utilisation d’un inhibiteur à des concentrations toxiques (en bas à droite). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
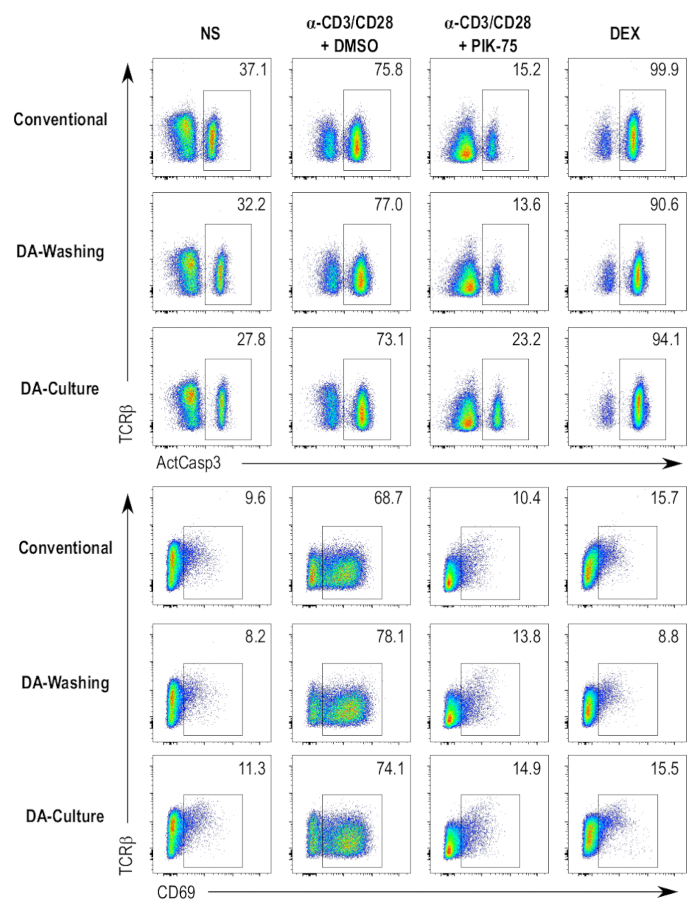
Figure 4 : Comparaison des protocoles différents test. Flow cytometry parcelles de la caspase-3 actif (ActCasp3), CD69, et TCRβ la coloration des thymocytes DP suivant les trois différents protocoles de dosage. Quatre différentes conditions sont testées, à savoir le contrôle négatif (non stimulé [NS]), le contrôle positif pour la mort de cellules (traités au dexaméthasone [DEX]), le contrôle du véhicule (stimulée et imprégnées de DMSO [α-CD3/CD28 + DMSO]) et imprégnées d’un inhibiteur de échantillon (stimulée et traités PIK-75 [α-CD3/CD28 + PIK-75]). Classique = la mise en culture des thymocytes dans des plaques de 96 puits standard et coloration avec un protocole centrifugation conventionnels ; DA-lavage = la mise en culture des thymocytes dans des plaques de 96 puits standard et les taches à l’aide d’un flux laminaire lavage protocole ; DA-Culture = la mise en culture des thymocytes dans des petits plats et coloration dans les mêmes plaques à l’aide d’un protocole de lavage à flux laminaire. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
La stratégie de dépistage proposée ici évalue la capacité des inhibiteurs de petites molécules à supprimer les effets de l’apoptose dans les thymocytes après stimulation, en plus des marqueurs plus conventionnelles de lymphocytes activation-CD69 upregulation et downregulation TCR . Marqueurs additionnels peuvent être également inclus pour permettre l’analyse des thymocytes différents sous-ensembles32. Un aspect intéressant du test actuel réside dans le fait que les inhibiteurs qui entravent la TCR signalisation atténuerait également l’induction de l’apoptose, soulignant davantage la distinction des effets indépendants TCR que les inhibiteurs peuvent avoir à induire la mort cellulaire. En outre, un écoulement cytometry-test permet l’utilisation de multiples lectures comme marqueurs d’activation distinctes, qui pourront faire rapport les effets des inhibiteurs sur des branches individuelles distinctes du TCR de signalisation. Dans le cas présenté ici, il y avait des inhibiteurs qui ont montré une inhibition différentielle de l’activation de la caspase-3 et CD69 upregulation. Parce que certains composés peuvent affecter les fonctions domestiques tels que la synthèse des protéines ou le trafic vésiculaire, il n’est pas étonnant d’observer les effets sur la stimulation de l’expression des marqueurs de novo synthétisés (p. ex., CD69) mais pas sur post-traductionnelle modifications (par exemple, l’activation protéolytique de la caspase-3).
Comme l’essai présenté ici mesure l’apoptose comme une lecture, il est impératif que les effets toxiques latentes des inhibiteurs ne masquent pas les résultats. Par exemple, dans l’écran, on a fait pas diluer la staurosporine au-delà de 1 nM, bien qu’il soit toujours toxique pour les cellules à cette concentration. Les résultats représentatifs sont en accord avec la staurosporine étant un inhibiteur de la kinase de promiscuité et d’un inducteur de l’apoptose,33. Sans une dilution suffisante des composés testés à des concentrations non toxiques, il est possible d’oublier les hits potentiels.
La stratégie de dépistage détaillée ici serait difficile à appliquer à l’homme en raison de complications liées à l’obtention d’un nombre suffisant de thymocytes de criblage à haut débit. Toutefois, il est possible d’obtenir des échantillons de thymus humain de biopsies cardiaques pédiatriques34,35 ou de foetus36,37. Néanmoins, comme le RCT de signalisation des voies et des séquences d’acides aminés des protéines de signalisation sont conservés en grande partie entre les souris et les humains, le dosage de thymocytes fournit une stratégie de criblage préliminaire utile, et les résultats obtenus avec ce dosage à l’aide de la souris les thymocytes peuvent, ensuite, être vérifiées dans les lymphocytes humains primaires.
Une des limitations du protocole dépendante de centrifugation conventionnelle se rapporte à la perspective de la perte de cellules, qui peut être attribuée à la nature de plusieurs étapes du processus, qui implique des étapes comme la perméabilisation de la cellule et centrifugation. Chaque centrifugation et l’étape de la remise en suspension se traduisent inévitablement par la perte de cellules. Bien que ces pertes ne soient pas critiques pour les études portant sur un nombre limité d’échantillons, il pourrait poser des problèmes lorsqu’il est appliqué dans le dépistage des débits plus élevés, en particulier fur le dosage format de 96 - à 384 à 1536-puits. Une façon de contourner ce problème consiste à utiliser des perméable à la cellule fluorescente caspase capteurs38 qui permettent la détection d’activation de la caspase tout en évitant les complications de la perméabilisation de la cellule et plusieurs lavages5. Alternativement, utilisant une méthode indépendante de centrifugation de lavage des cellules à flux laminaire est également possible pour minimiser la perte de cellules. Avec une plaque automatisée station en conjonction avec une plaque de mur-moins de lavage, les cellules sont baignées par flux laminaire sans l’aide d’une centrifugeuse. La dilution exponentielle des réactifs permet le rinçage minutieux et efficace des cellules en moins de 3 min, ce qui représente une dilution équivalente à deux cycles de lavage centrifuge. Sans les sollicitations extérieures en raison de la centrifugation, les cellules ne sont plus viables et réduire au minimum les pertes des cellules.
Nous avons également examiné la possibilité d’utiliser la plaque automatisée station de lavage après les thymocytes en fond U 96 puits de culture plaques et, en outre, la mise en culture des cellules directement dans le mur sans plaques compatibles avec la plaque automatisée station de lavage. La mise en culture des cellules dans les plaques du mur sans permis l’élimination de toutes les étapes de centrifugation et réduit au minimum la perte de cellules en éliminant la nécessité d’un transfert de l’échantillon à travers des plaques. En général, les trois protocoles différents sont comparables en efficacité de la stimulation et la coloration. La station de lavage automatisé offre l’avantage de l’automatisation, la vitesse et efficacité, ce qui rend plus facile pour l’analyse des débits plus élevés. En outre, avec une automatisation accrue, les étapes de lavage peuvent être effectuées plus rapidement, et il y a une plus grande cohérence entre les expériences ou les expérimentateurs. Toutefois, la station de lavage a certains inconvénients : grands volumes de mémoires tampon de lavage sont requises pour rondelle d’amorçage (150 mL / changement de tampon, dont 50 mL est utilisée pour le lavage) ; Redoublez de prudence est nécessaire lors de la manipulation de la plaque pour éviter toute contamination croisée des puits en raison de la répartition limitée entre les puits de la plaque de petit volume ; tampon résiduel de 25 µL dans les puits après lavage nécessite l’utilisation de réactifs préparés à un niveau plus élevé que la concentration de 1 x. Pour aborder les questions du volume résiduel et capacité de volume limité de la plaque, un accessoire pour augmenter le volume de l’incubation de 70 µL à 150 µL peut être ajouté, facilitant l’adoption de protocoles classiques. Tandis que les systèmes de manutention automatisés plaque sont actuellement disponibles, ils ont une empreinte significative par rapport au système de lavage laminaire, qui est une petite unité de ~ 1 pi (~0.028 m3). En outre, l’intégration de la centrifugation en plaque automatisée des systèmes de manutention est un défi, limitant leur utilisation dans le lavage de la cellule. Il n’y a actuellement aucune autre cellule indépendante de centrifugeuse lavage des instruments disponibles, autant que nous sachions.
La stratégie de dépistage présentée ici est en mesure d’identifier des petites molécules et leurs kinases cible prétendue, qui affectent la signalisation de TCR et l’activation des lymphocytes T. La bibliothèque utilisée ici est composé principalement de petites molécules inhibiteurs de kinases et a réussi à générer un certain nombre de potentiellement intéressant hits. Le protocole peut également être facilement appliqué aux bibliothèques d’inhibiteur d’autres classes d’enzymes ou d’autres types de petites molécules, ainsi qu’aux bibliothèques d’autres composés (par exemple, diverses macromolécules). Le protocole permet également à l’écran des autres types de cellules, telles que les lymphocytes T périphériques ou des cellules immortalisées, y compris ceux exprimant TCRs transgéniques ou transportant des systèmes de journaliste. Identifier et caractériser de nouveaux médiateurs de T-cellule signalisation peut améliorer notre connaissance de la voie de signalisation ainsi que l’aide au développement de la thérapie ciblée en maladies immunitaires13,14,15, 16. dans l’ensemble, cette étude s’ajoute à la gamme des options disponibles pour la détection des médiateurs de T-cellule signalisation par criblage à haut débit des essais.
Déclarations de divulgation
L’auteur Chyan Ying Ke est un employé de Curiox Biosystems, qui produit la rondelle DA-cellulaire et plaques de DA-cellulaires utilisés dans cet article.
Remerciements
Ce travail a été soutenu par les subventions accordées par le ministère de l’éducation, 2014-T2-1-136 Singapour Conseil du Singapour ministère de la santé National de recherches médicales et NMRC CBRG15may017 (pour N.R.J.G.).
matériels
| Name | Company | Catalog Number | Comments |
| RPMI | HyClone | SH30027FS | |
| FBS | HyClone | SH3007103 | |
| L-Glutamine | HyClone | SH3003401 | |
| Sodium pyruvate | HyClone | SH3023901 | |
| Penicillin/Streptomycin | HyClone | SV30010 | |
| b-mercaptoethanol | Sigma Aldrich | 516732 | |
| 10X PBS | Vivantis | PB0344 – 1L | |
| Kinase Screening Library (96-Well) | Cayman Chemical | 10505 | Exact contents of the library may vary |
| DMSO | Sigma Aldrich | D2650 | |
| Dexamethasone | Sigma Aldrich | D4902 | |
| anti-CD3/CD28 beads | Thermo Fisher Scientific | 11452D | |
| FITC Active Caspase-3 Apoptosis Kit | BD Pharmingen | 550480 | Contains Fixation/Permeabilisation buffer, 10X Perm/Wash buffer and anti-caspase 3 antibody |
| DA-Cell Washer | CURIOX | HT1000 | |
| 96-well DA-Cell Plate | CURIOX | 96-DC-CL-05 | |
| Antibodies | |||
| CD3e | BioLegend | 100236 | |
| TCRb | BD Biosciences | 553174 | |
| CD4 | BD Biosciences | 740007 | |
| CD8 | BD Biosciences | 563786 | |
| CD69 | eBioscience | 25-0699-42 | |
| Inhibitors | |||
| TG003 | Cayman Chemical | - | From the Kinase Screening Library |
| PKC 412 | Cayman Chemical | - | From the Kinase Screening Library |
| Doramapimod | Cayman Chemical | - | From the Kinase Screening Library |
| Paclitaxel | Cayman Chemical | - | From the Kinase Screening Library |
| Erlotinib | Cayman Chemical | - | From the Kinase Screening Library |
| Necrostatin-5 | Cayman Chemical | - | From the Kinase Screening Library |
| NVP-BEZ235 | Cayman Chemical | - | From the Kinase Screening Library |
| Phthalazinone pyrazole | Cayman Chemical | - | From the Kinase Screening Library |
| AG-879 | Cayman Chemical | - | From the Kinase Screening Library |
| 1-NA-PP1 | Cayman Chemical | - | From the Kinase Screening Library |
| Torin 1 | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide II | Cayman Chemical | - | From the Kinase Screening Library |
| BIBF 1120 | Cayman Chemical | - | From the Kinase Screening Library |
| SMI-4a | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide XI (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10657 | Cayman Chemical | - | From the Kinase Screening Library |
| AS-703026 | Cayman Chemical | - | From the Kinase Screening Library |
| Chelerythrine chloride | Cayman Chemical | - | From the Kinase Screening Library |
| Tunicamycin | Cayman Chemical | - | From the Kinase Screening Library |
| GSK 1059615 | Cayman Chemical | - | From the Kinase Screening Library |
| Ruxolitinib | Cayman Chemical | - | From the Kinase Screening Library |
| Necrostatin-1 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 505124 | Cayman Chemical | - | From the Kinase Screening Library |
| INK128 | Cayman Chemical | - | From the Kinase Screening Library |
| Canertinib (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| SB 431542 | Cayman Chemical | - | From the Kinase Screening Library |
| PD 173074 | Cayman Chemical | - | From the Kinase Screening Library |
| Valproic Acid (sodium salt) | Cayman Chemical | - | From the Kinase Screening Library |
| PD 0325901 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 203580 | Cayman Chemical | - | From the Kinase Screening Library |
| VX-702 | Cayman Chemical | - | From the Kinase Screening Library |
| Emodin | Cayman Chemical | - | From the Kinase Screening Library |
| CHIR99021 | Cayman Chemical | - | From the Kinase Screening Library |
| BIO | Cayman Chemical | - | From the Kinase Screening Library |
| Imatinib (mesylate) | Cayman Chemical | - | From the Kinase Screening Library |
| Sunitinib Malate | Cayman Chemical | - | From the Kinase Screening Library |
| Gefitinib | Cayman Chemical | - | From the Kinase Screening Library |
| PP2 | Cayman Chemical | - | From the Kinase Screening Library |
| 3-Methyladenine | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide I | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide IV | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide V | Cayman Chemical | - | From the Kinase Screening Library |
| NSC 663284 | Cayman Chemical | - | From the Kinase Screening Library |
| D 4476 | Cayman Chemical | - | From the Kinase Screening Library |
| NU 7026 | Cayman Chemical | - | From the Kinase Screening Library |
| H-9 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Indirubin-3'-monoxime | Cayman Chemical | - | From the Kinase Screening Library |
| KN-62 | Cayman Chemical | - | From the Kinase Screening Library |
| KN-93 | Cayman Chemical | - | From the Kinase Screening Library |
| CGP 57380 | Cayman Chemical | - | From the Kinase Screening Library |
| Iso-Olomoucine | Cayman Chemical | - | From the Kinase Screening Library |
| (S)-Glycyl-H-1152 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide VIII (acetate) | Cayman Chemical | - | From the Kinase Screening Library |
| ST638 | Cayman Chemical | - | From the Kinase Screening Library |
| SU 6656 | Cayman Chemical | - | From the Kinase Screening Library |
| LY364947 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 203580 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10621 | Cayman Chemical | - | From the Kinase Screening Library |
| YM-201636 | Cayman Chemical | - | From the Kinase Screening Library |
| ZM 447439 | Cayman Chemical | - | From the Kinase Screening Library |
| AS-041164 | Cayman Chemical | - | From the Kinase Screening Library |
| NVP-AEW541 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| PP242 | Cayman Chemical | - | From the Kinase Screening Library |
| ABT-869 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10622 | Cayman Chemical | - | From the Kinase Screening Library |
| 17β-hydroxy Wortmannin | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10626 | Cayman Chemical | - | From the Kinase Screening Library |
| SU 6668 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10572 | Cayman Chemical | - | From the Kinase Screening Library |
| N,N-Dimethylsphingosine | Cayman Chemical | - | From the Kinase Screening Library |
| LY294002 | Cayman Chemical | - | From the Kinase Screening Library |
| U-0126 | Cayman Chemical | - | From the Kinase Screening Library |
| Staurosporine | Cayman Chemical | - | From the Kinase Screening Library |
| KN-92 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| AS-605240 (potassium salt) | Cayman Chemical | - | From the Kinase Screening Library |
| O-1918 | Cayman Chemical | - | From the Kinase Screening Library |
| Y-27632 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Leelamine | Cayman Chemical | - | From the Kinase Screening Library |
| PD 98059 | Cayman Chemical | - | From the Kinase Screening Library |
| PD 169316 | Cayman Chemical | - | From the Kinase Screening Library |
| TGX-221 | Cayman Chemical | - | From the Kinase Screening Library |
| (S)-H-1152 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| AS-605240 | Cayman Chemical | - | From the Kinase Screening Library |
| D-erythro-Sphingosine C-18 | Cayman Chemical | - | From the Kinase Screening Library |
| OSU03012 | Cayman Chemical | - | From the Kinase Screening Library |
| JNJ-10198409 | Cayman Chemical | - | From the Kinase Screening Library |
| Leelamine (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Arachidonic Acid Leelamide | Cayman Chemical | - | From the Kinase Screening Library |
| Lauric Acid Leelamide | Cayman Chemical | - | From the Kinase Screening Library |
| AS-252424 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10505 | Cayman Chemical | - | From the Kinase Screening Library |
| PI-103 | Cayman Chemical | - | From the Kinase Screening Library |
| PIK-75 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Sphingosine Kinase Inhibitor 2 | Cayman Chemical | - | From the Kinase Screening Library |
| Piceatannol | Cayman Chemical | - | From the Kinase Screening Library |
| SC-1 | Cayman Chemical | - | From the Kinase Screening Library |
| (R)-Roscovitine | Cayman Chemical | - | From the Kinase Screening Library |
| BAY-43-9006 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10561 | Cayman Chemical | - | From the Kinase Screening Library |
| AS-604850 | Cayman Chemical | - | From the Kinase Screening Library |
| PI3-Kinase α Inhibitor 2 | Cayman Chemical | - | From the Kinase Screening Library |
| ML-9 | Cayman Chemical | - | From the Kinase Screening Library |
| Triciribine | Cayman Chemical | - | From the Kinase Screening Library |
| Erbstatin Analog | Cayman Chemical | - | From the Kinase Screening Library |
| Kenpaullone | Cayman Chemical | - | From the Kinase Screening Library |
| Olomoucine | Cayman Chemical | - | From the Kinase Screening Library |
| AG-494 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-825 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-1478 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 216763 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 415286 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-17 | Cayman Chemical | - | From the Kinase Screening Library |
| H-8 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| LFM-A13 | Cayman Chemical | - | From the Kinase Screening Library |
| SC-514 | Cayman Chemical | - | From the Kinase Screening Library |
| Apigenin | Cayman Chemical | - | From the Kinase Screening Library |
| AG-18 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10554 | Cayman Chemical | - | From the Kinase Screening Library |
| DRB | Cayman Chemical | - | From the Kinase Screening Library |
| RG-13022 | Cayman Chemical | - | From the Kinase Screening Library |
| RG-14620 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-490 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-82 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-99 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-213 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-183 | Cayman Chemical | - | From the Kinase Screening Library |
| Lavendustin C | Cayman Chemical | - | From the Kinase Screening Library |
| ZM 336372 | Cayman Chemical | - | From the Kinase Screening Library |
| 5-Iodotubercidin | Cayman Chemical | - | From the Kinase Screening Library |
| SB 202190 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10571 | Cayman Chemical | - | From the Kinase Screening Library |
| Nilotinib | Cayman Chemical | - | From the Kinase Screening Library |
| SP 600125 | Cayman Chemical | - | From the Kinase Screening Library |
| L-threo-Sphingosine C-18 | Cayman Chemical | - | From the Kinase Screening Library |
| H-89 | Cayman Chemical | - | From the Kinase Screening Library |
| HA-1077 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| AG-370 | Cayman Chemical | - | From the Kinase Screening Library |
| Wortmannin | Cayman Chemical | - | From the Kinase Screening Library |
| AG-1296 | Cayman Chemical | - | From the Kinase Screening Library |
| KT 5823 | Cayman Chemical | - | From the Kinase Screening Library |
| Janex 1 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10574 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10575 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10576 | Cayman Chemical | - | From the Kinase Screening Library |
| NH125 | Cayman Chemical | - | From the Kinase Screening Library |
| TWS119 | Cayman Chemical | - | From the Kinase Screening Library |
| NSC 210902 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10577 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10578 | Cayman Chemical | - | From the Kinase Screening Library |
| PD 184161 | Cayman Chemical | - | From the Kinase Screening Library |
| CCT018159 | Cayman Chemical | - | From the Kinase Screening Library |
| Myricetin | Cayman Chemical | - | From the Kinase Screening Library |
Références
- Gascoigne, N. R., Rybakin, V., Acuto, O., Brzostek, J. TCR Signal Strength and T Cell Development. Annual Review of Cell and Developmental Biology. 32, 327-348 (2016).
- Rothenberg, E. V., Moore, J. E., Yui, M. A. Launching the T-cell-lineage developmental programme. Nature Reviews Immunology. 8 (1), 9-21 (2008).
- Klein, L., Hinterberger, M., Wirnsberger, G., Kyewski, B. Antigen presentation in the thymus for positive selection and central tolerance induction. Nature Reviews Immunology. 9 (12), 833-844 (2009).
- Starr, T. K., Jameson, S. C., Hogquist, K. A. Positive and negative selection of T cells. Annual Review of Immunology. 21, 139-176 (2003).
- Rybakin, V., Gascoigne, N. R. Negative selection assay based on stimulation of T cell receptor transgenic thymocytes with peptide-MHC tetramers. PLoS One. 7 (8), e43191 (2012).
- Krogsgaard, M., Juang, J., Davis, M. M. A role for "self" in T-cell activation. Seminars in Immunology. 19 (4), 236-244 (2007).
- Nakayama, T., Yamashita, M. The TCR-mediated signaling pathways that control the direction of helper T cell differentiation. Seminars in Immunology. 22 (5), 303-309 (2010).
- Hoerter, J. A., et al. Coreceptor affinity for MHC defines peptide specificity requirements for TCR interaction with coagonist peptide-MHC. The Journal of Experimental Medicine. 210 (9), 1807-1821 (2013).
- Zhao, X., et al. Nonstimulatory peptide-MHC enhances human T-cell antigen-specific responses by amplifying proximal TCR signaling. Nature Communications. 9 (1), 2716 (2018).
- Fu, G., et al. Fine-tuning T cell receptor signaling to control T cell development. Trends in Immunology. 35 (7), 311-318 (2014).
- Wang, D., et al. Tespa1 is involved in late thymocyte development through the regulation of TCR-mediated signaling. Nature Immunology. 13 (6), 560-568 (2012).
- Fu, G., et al. Themis sets the signal threshold for positive and negative selection in T-cell development. Nature. 504 (7480), 441-445 (2013).
- Rosenblum, M. D., Gratz, I. K., Paw, J. S., Abbas, A. K. Treating human autoimmunity: current practice and future prospects. Science Translational Medicine. 4 (125), (2012).
- Hebeisen, M., et al. SHP-1 phosphatase activity counteracts increased T cell receptor affinity. The Journal of Clinical Investigation. 123 (3), 1044-1056 (2013).
- Wang, R. E., et al. An immunosuppressive antibody-drug conjugate. Journal of the American Chemical Society. 137 (9), 3229-3232 (2015).
- Borroto, A., et al. First-in-class inhibitor of the T cell receptor for the treatment of autoimmune diseases. Science Translational Medicine. 8 (370), (2016).
- Chen, E. W., Brzostek, J., Gascoigne, N. R. J., Rybakin, V. Development of a screening strategy for new modulators of T cell receptor signaling and T cell activation. Scientific Reports. 8 (1), 10046 (2018).
- Fouda, A., Tahsini, M., Khodayarian, F., Al-Nafisah, F., Rafei, M. A Fluorescence-based Lymphocyte Assay Suitable for High-throughput Screening of Small Molecules. Journal of Visualized Experiments. (121), e55199 (2017).
- Zhao, Z., et al. A high-throughput phenotypic screen of cytotoxic T lymphocyte lytic granule exocytosis reveals candidate immunosuppressants. Journal of Biomolecular Screening. 20 (3), 359-371 (2015).
- Florian, A. E., et al. Flow cytometry enables a high-throughput homogeneous fluorescent antibody-binding assay for cytotoxic T cell lytic granule exocytosis. Journal of Biomolecular Screening. 18 (4), 420-429 (2013).
- Krutzik, P. O., Crane, J. M., Clutter, M. R., Nolan, G. P. High-content single-cell drug screening with phosphospecific flow cytometry. Nature Chemical Biology. 4 (2), 132-142 (2008).
- Vlahos, C. J., Matter, W. F., Hui, K. Y., Brown, R. F. A specific inhibitor of phosphatidylinositol 3-kinase, 2-(4-morpholinyl)-8-phenyl-4H-1-benzopyran-4-one (LY294002). The Journal of Biological Chemistry. 269 (7), 5241-5248 (1994).
- Chen, Z., et al. Synthesis and SAR of novel 4-morpholinopyrrolopyrimidine derivatives as potent phosphatidylinositol 3-kinase inhibitors. Journal of Medicinal Chemistry. 53 (8), 3169-3182 (2010).
- Ruegg, U. T., Burgess, G. M. Staurosporine, K-252 and UCN-01: potent but nonspecific inhibitors of protein kinases. Trends in Pharmacological Sciences. 10 (6), 218-220 (1989).
- Davis, P. D., et al. Inhibitors of protein kinase C. 1. 2,3-Bisarylmaleimides. Journal of Medicinal Chemistry. 35 (1), 177-184 (1992).
- Komander, D., et al. Interactions of LY333531 and other bisindolyl maleimide inhibitors with PDK1. Structure (London, England: 1993). 12 (2), 215-226 (2004).
- Gassel, M., et al. The protein kinase C inhibitor bisindolyl maleimide 2 binds with reversed orientations to different conformations of protein kinase A. The Journal of Biological Chemistry. 279 (22), 23679-23690 (2004).
- Faull, A., Johnstone, C., Morley, A., et al. . Novel compounds. , (2003).
- Favata, M. F., et al. Identification of a novel inhibitor of mitogen-activated protein kinase kinase. The Journal of Biological Chemistry. 273 (29), 18623-18632 (1998).
- Woods, C. M., Zhu, J., McQueney, P. A., Bollag, D., Lazarides, E. Taxol-induced mitotic block triggers rapid onset of a p53-independent apoptotic pathway. Molecular Medicine (Cambridge, MA). 1 (5), 506-526 (1995).
- Teng, X., et al. Structure-activity relationship study of novel necroptosis inhibitors. Bioorganic & Medicinal Chemistry Letters. 15 (22), 5039-5044 (2005).
- Saini, M., et al. Regulation of Zap70 expression during thymocyte development enables temporal separation of CD4 and CD8 repertoire selection at different signaling thresholds. Science Signaling. 3 (114), ra23 (2010).
- Chae, H. J., et al. Molecular mechanism of staurosporine-induced apoptosis in osteoblasts. Pharmacological Research. 42 (4), 373-381 (2000).
- Varas, A., et al. Analysis of the human neonatal thymus: evidence for a transient thymic involution. Journal of Immunology (Baltimore, MD:1950). 164 (12), 6260-6267 (2000).
- Verstichel, G., et al. The checkpoint for agonist selection precedes conventional selection in human thymus. Science Immunology. 2 (8), (2017).
- Yamaguchi, E., de Vries, J., Yssel, H. Differentiation of human single-positive fetal thymocytes in vitro into IL-4- and/or IFN-gamma-producing CD4+ and CD8+ T cells. International Immunology. 11 (4), 593-603 (1999).
- Farley, A. M., et al. Dynamics of thymus organogenesis and colonization in early human development. Development (Cambridge, UK). 140 (9), 2015-2026 (2013).
- Cali, J. J., et al. Bioluminescent assays for ADMET. Expert Opinion on Drug Metabolism & Toxicology. 4 (1), 103-120 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon