Method Article
Identificación de mediadores del Receptor de células T de señalización a través de la proyección de las bibliotecas del inhibidor químico
* Estos autores han contribuido por igual
En este artículo
Resumen
Este papel utiliza un ensayo basado en la citometría de flujo para las bibliotecas de la pantalla de inhibidores químicos para la identificación de los inhibidores y los objetivos que influyen en la del receptor de células T de señalización. Los métodos descritos aquí pueden ampliarse también para proyecciones de alto rendimiento.
Resumen
El receptor de células T (TCR) señalización vía comprende una multitud de mediadores que transmiten señales sobre la activación del TCR. Diferentes estrategias han sido propuestos y aplicado para la identificación de nuevos mediadores de la señalización del TCR, que mejoraría la comprensión de los procesos T-cell, incluyendo activación y selección tímica. Se describe un ensayo de cribado que permita la identificación de moléculas que influyen en la TCR señalización basado en la activación del desarrollo de los timocitos. Señales de fuerte TCR provocan timocitos en desarrollo activar la maquinaria apoptótica en un proceso conocido como selección negativa. A través de la aplicación de inhibidores de la cinasa, los objetivos que afectan la señalización del TCR son capaces de anular el proceso de selección negativa. El método detallado en este documento puede utilizarse para identificar inhibidores de quinasas canónicas con papeles establecidos en las vías de señalización del TCR y también inhibidores de quinasas nuevo aún por establecerse en las vías de señalización del TCR. Aquí la estrategia de investigación se puede aplicar a pantallas de mayor rendimiento para la identificación de nuevas dianas druggable en la señalización del TCR.
Introducción
Las células T son un linaje de linfocitos que desempeñan un papel fundamental en el mantenimiento de la inmunidad adaptativa. Expresan el TCR, que les permite reconocer sus ligandos, complejos consisten en una molécula compleja de la histocompatibilidad (MHC) con un péptido encuadernado, que se encuentran en la superficie del antígeno que presenta las células (APCs). La activación del TCR de señalización a través de la interacción TCR/MHC es crucial para la activación del T-cell y desarrollo1.
En el desarrollo del T-cell, derivadas de médula ósea de células madre hematopoyéticas (HSCs) migran al timo, donde sufren diferenciación y pasar por las etapas del T-cell lineage progresión2. Los timocitos doble positivo (DP), expresar el CD4 y CD8 correceptores, comprometen con uno mismo-péptido/MHC de la APC. Timocitos con una moderada afinidad por sus ligandos de la uno mismo-péptido/MHC maduran para convertirse en los timocitos (SP) CD4 o CD8 positivo solo, un proceso denominado como selección positiva. Por el contrario, los timocitos que reciben excesiva estimulación del TCR a través de las uno mismo-peptide/MHCs experimentan apoptosis vía selección negativa3,4. Este proceso de la apoptosis inducida por estimulación, caspase-dependiente puede ser mímico en vitro por estimulación de los timocitos, por ejemplo con los granos recubiertos de anticuerpos anti-CD3/285. Las células T maduras que pasan el proceso de selección son activadas por ligandos no-self-péptido/MHC de la APC en la periferia. Uno mismo-peptide/MHCs son todavía relevantes para las células T periféricas, en el contexto de tónico para la supervivencia y proliferación homeostática, la diferenciación de las células T auxiliares y la mejora de las respuestas de células T a no-uno mismo-peptide/MHCs a través coagonism6,7,8,9. Enlace de TCR de alta afinidad para el ligando péptido/MHC activa varias vías de señalización corriente abajo, que incluyen muchas moléculas de señalización formando un complejo TCR señalización red10. Las vías de señalización del TCR se han estudiado durante varias décadas, y todavía el descubrimiento de nuevos mediadores de la vía no da señales de disminuir11,12. La modulación de vías de señalización del TCR tiene relevancia clínica y puede potenciar las respuestas de células T para aplicaciones inmunoterapia o la inhibición de las respuestas de células T para el control de la autoinmunidad13. Estrategias para la modulación de las respuestas de células T dependen principalmente de la interrupción de cinasa o fosfatasa actividad14,15,16.
Se describe una aplicación de un análisis basado en la citometría de flujo para la detección de pequeños compuestos químicos por su capacidad modular la señalización del TCR y de la activación de células T17. El ensayo se basa en el fenómeno de la activación de la vía de apoptosis cuando se exponen a fuertes señales TCR de los timocitos. El ensayo es suficientemente sensible para identificar cambios en la fuerza del estímulo; incubación de timocitos que expresan TCR transgénico con tetrámeros de péptido/MHC con el aumento de afinidad dio lugar a un aumento correspondiente en caspasa activación utilizado como una medida de la respuesta apoptótica del5. Para la pantalla, utiliza una biblioteca de inhibidores de la cinasa y evaluaron su capacidad para modular la respuesta del anti-thymocyte fuertes señales del TCR.
Se han descrito varias estrategias basado en la citometría de flujo o basadas en fluorescencia-reportero para el cribado de alto rendimiento de una variedad de fenotipos de activación periférica en diferentes subconjuntos de células T. Tales estrategias incluyen el uso de reporteros fluorescentes genéticos para determinar el momento y la magnitud de la activación de células T18, el uso de degranulación como una lectura de citotóxico t-célula actividad19,20y el análisis de la fosforilación de diversas proteínas implicadas en la señalización21celular.
El análisis de la proyección presentado aquí es capaz de identificar con éxito compuestos que inhiben la canónicas moléculas de señalización de la vía, así como potenciales, nuevos compuestos con efectos inhibitorios sobre la señalización del TCR TCR. Por ejemplo, consideran inhibidores de GSK3β y Hsp90 nuevos compuestos que afectan a las respuestas de células T17. El ensayo es capaz de distinguir los inhibidores que interfieren con la transducción de la señal, debido a una reducción en la respuesta apoptótica de los efectos de la TCR-independiente de los inhibidores sobre la toxicidad celular. Además de la inducción de la apoptosis, también medimos el upregulation de CD69 y downregulation del TCR como marcadores de la activación. Como TCR señalización redes son complejas, el uso de múltiples lecturas puede aumentar las posibilidades de descubrir moléculas con efectos específicos sobre una sola vía. Aquí, presentamos el uso de un protocolo independiente de la centrifugación como una alternativa de alto rendimiento en el protocolo original durante la tinción de las células en la preparación para el análisis de citometría de flujo. El ensayo descrito en el presente trabajo utiliza una pequeña biblioteca compuesta de inhibidores de la cinasa pero, en principio, puede ser utilizado para la detección de rendimiento superior. La biblioteca de elección también puede incorporar una variedad de inhibidores o de otras moléculas.
Protocolo
En este estudio, se utilizaron ratones de 6 a 8 semanas de edad machos y hembras C57Bl/6. Los ratones fueron criados en el centro de animales en la Universidad Nacional de Singapur (Singapur). El cuidado de los animales institucional Universidad Nacional de Singapur y el Comité uso (IACUC) aprobaron todos los experimentos con animales.
1. preparación de suspensión de Anti-Thymocyte
- Eutanasia a los ratones en una cámara de CO2 .
- Realice los pasos siguientes en una campana de cultivo de tejidos para evitar cualquier contaminación de los cultivos celulares. Asegurar el cadáver del ratón a la Junta Directiva de la disección, con pernos y rociar el ratón con etanol al 70%.
- Usando un par de tijeras, haga una incisión vertical en el lado ventral, desde el abdomen hacia la mandíbula. Realizar nuevas incisiones a lo largo de cada una de las patas traseras. Estirar la piel para exponer la caja torácica y perno hacia abajo.
- Cortar el diafragma y a ambos lados de la caja torácica desde el extremo posterior con un par de tijeras. Levantar la caja torácica y la clavija hasta exponer el timo. Separar los tejidos conectivos atados timo y extraer el timo con un par de fórceps curvado.
- Coloca el timo en un pozo de una placa de 6 pozos que contienen 5 mL de Medio RPMI completo.
Nota: Considerar la adición de 10% carbón despojado suero bovino fetal (FBS) a los medios de comunicación para mejorar la viabilidad del anti-thymocyte si un largo tiempo de espera se espera que entre la disección y el análisis del estímulo. - Puré del timo, con el extremo romo de una jeringa y pasar las células a través de un tamiz celular de 70 μm. Alternativamente, para recolectar los timocitos en una condición más saludable, considere el uso de dos pares de pinzas para exprimir el timo y recoger los timocitos que fluyen fuera del epitelio tímico.
- Proceder a la célula contando, utilizando un hemocitómetro o cualquier célula automatizada contando instrumento.
2. titulación de inhibidores de la cinasa a concentraciones no tóxicos
Nota: Esta sección se centra en la preparación de los inhibidores para uso en las pantallas de activación del T-cell. Inhibidores utilizados en altas concentraciones pueden causar la muerte celular, que es una lectura de las pantallas de activación del T-cell. La serie de diluciones de los inhibidores tiene como objetivo determinar la concentración final de los inhibidores individuales que no se debe inducir apoptosis independiente de la estimulación del TCR. La biblioteca de inhibidores de la cinasa utilizados en este estudio fue adquirida a un proveedor externo. La lista de inhibidores está incluida en la Tabla de materiales.
-
Preparación de placas de inhibidores de la cinasa en concentraciones más bajas
- Para preparar un plato de inhibidores en 1 mM, añadir 10 μl de inhibidores a 90 μl de dimetilsulfóxido (DMSO) para todos los inhibidores.
Nota: Los inhibidores de la biblioteca de moléculas pequeñas utilizadas en este estudio vienen en una concentración stock de 10 mM. Si los inhibidores son en forma de pellets, siga los pasos de reconstitución recomendada de los proveedores. Si los inhibidores no son proporcionados en 10 mM, preparar las placas de inhibidor en las concentraciones adecuadas alternativas en su lugar y preparar diluciones seriadas separadas de los inhibidores con un factor de dilución adecuado.
PRECAUCIÓN: En caso de tóxicos inhibidores, siga las instrucciones del fabricante sobre manipulación segura y disposición. - Para preparar un plato de inhibidores a 0,1 mM, añadir 10 μl de los inhibidores de la placa de los inhibidores de 1 mM a 90 μl de DMSO.
- Para preparar un plato de inhibidores en 0,01 mM, añadir 10 μl de los inhibidores de la placa de los inhibidores de 0,1 mM a 90 μl de DMSO.
- Para preparar un plato de inhibidores en 1 mM, añadir 10 μl de inhibidores a 90 μl de dimetilsulfóxido (DMSO) para todos los inhibidores.
-
Tratamiento de los timocitos con inhibidores de la cinasa
- Preparar una suspensión de anti-thymocyte según sección 1.
- Diluir los timocitos en RPMI completo para obtener una suspensión de timocitos de 5 x 106 células/mL.
- Añadir 200 μL de suspensión de anti-thymocyte en todos los pocillos de una placa de 96 pozos, utilizando una pipeta multicanal.
- A cada pocillo, añadir 2 μl de inhibidores de la correspondiente de la placa que contiene inhibidores de 1 mM (la concentración final de los inhibidores es 10 μm).
- En el mismo plato, prepare cuatro pozos de controles no tratados, cuatro pozos de 5 μm tratados con dexametasona controles positivos y cuatro pozos de los controles negativos tratados con vehículo, agregando 2 μl de DMSO.
- Incubar los timocitos en a 37 ° C, 5% CO2 incubadora para 17-20 h (o toda la noche).
-
Determinación de las concentraciones adecuadas de inhibidores individuales
- Hacer girar la placa de los timocitos a 300 x g y 4 ° C, durante 5 minutos resuspender las células en 250 μl de tampón de lavado FACS.
- Realizar un análisis de citometría de flujo de las muestras y analizar los resultados con un programa de análisis de citometría de flujo.
- Determinar el porcentaje de células vivas basado en FSC-SSC gating. La estrategia bloquea se muestra en la figura 1B.
- Calcular un promedio del porcentaje de células vivas, basado en los controles tratados con DMSO, que se normalizaron al 100%. Establecer una ventana arbitraria de la muerte de celular aceptable (e.g.,20%). Inhibidores que resultó en un porcentaje de células vivas por debajo de esta ventana (es decir,., por debajo del 80% de los controles tratados con DMSO) son ser probados otra vez en concentraciones más bajas.
- Para los inhibidores que no pasó los criterios de viabilidad en el paso 2.3.4, repita los pasos de pasos 2.2.1 - 2.3.4, pero utilizar la placa de los inhibidores de 0,1 mm para paso 2.2.4 en lugar de la placa que contiene los inhibidores de 1 mM. La concentración final de inhibidores se usan aquí es 1 μm.
- Para los inhibidores que todavía producen altos niveles de muerte celular en 1 μm, prueba de los inhibidores de a 0,1 μm. Repita los pasos 2.2.1 - 2.3.4, pero utilizar la placa de inhibidores en 0,01 mM de paso 2.2.4. La concentración final de inhibidores se usan aquí es 0.1 μm.
-
Preparación de un plato común de inhibidores de la cinasa
- Inhibidores ser utilizado en 10 μm, añadir 10 μl de los inhibidores de 10 mM a 10 μl de DMSO.
- Inhibidores para usarse en 1 μm, añadir 1 μl de inhibidores de 10 mM a 19 μl de DMSO.
- Inhibidores ser usado a 0.1 μm, añadir 1 μl de inhibidores de 10 mM a 199 μl de DMSO (figura 1).
Nota: La placa común preparada de inhibidores es 500 x la concentración de la concentración final deseada cuando se añade a las suspensiones de timocitos. La placa común de inhibidores puede ser preparada en placas de 96 pocillos o tiras PCR. - La placa común de inhibidores de la cinasa puede aplicarse a timocitos para proyección en un sistema dependiente de la centrifugación convencional (sección 3; véase figura 1A, métodos 1 y 2) o en un sistema de centrifugación-independiente alternativo (sección 4; ver Figura 1A, método 3).
3. kinasa inhibidor biblioteca proyección (ensayo de centrífuga-basado convencional)
-
Tratamiento de los timocitos con inhibidores de la cinasa
- Preparar una suspensión de anti-thymocyte según sección 1.
- Diluir los timocitos en RPMI completo para obtener una suspensión de timocitos de 5 x 106 células/mL.
- Añadir 200 μL de los timocitos en cada pocillo de una placa de 96 pozos, utilizando una pipeta multicanal. Coloque la placa de hielo.
- Añadir 0,5 μl de inhibidores a la placa de 96 pocillos de los correspondientes pozos de la placa de acción inhibidor preparado en la sección 2.4.
- Preparar ocho pozos de controles no tratados. Preparar cuatro pozos de los controles tratados con vehículo añadiendo 0,5 μl de DMSO. Prepare cuatro pocillos de 5 controles tratados con dexametasona μm (figura 2).
-
Estimulación de los timocitos con perlas de anti-CD3/CD28
- Tomar 1 mL de granos y lavar los granos con 2 mL de PBS. Separe los granos con un soporte magnético y aspirar la solución. Resuspender los granos en 5 mL de RPMI completo.
Nota: La proporción de granos a las células es de 1 a 2,5. Ajustar la cantidad de granos para tomar, según el número de pozos a estimular y el número de timocitos utilizado. - Añadir 50 μl de los granos de cada muestra tratada con inhibidor, las cuatro muestras tratados con DMSO y cuatro de las ocho muestras sin tratar. Añadir 50 μl de RPMI completo a los restantes cuatro pozos sin tratar. La figura 2 muestra la disposición general de la placa.
- Mezcle el contenido de los pozos mediante una pipeta multicanal.
- Incubar los timocitos en a 37 ° C, 5% CO2 incubadora para 17-20 h (o toda la noche).
- Tomar 1 mL de granos y lavar los granos con 2 mL de PBS. Separe los granos con un soporte magnético y aspirar la solución. Resuspender los granos en 5 mL de RPMI completo.
-
Tinción de antígenos de superficie de
- Preparar una mezcla de tinción de anticuerpos que contiene anticuerpos anti-CD69, TCRβ anti, anti-CD4 y anti-CD8. Diluir los anticuerpos en tampón de lavado FACS (PBS suplementado con 0.5% albúmina de suero bovino [BSA]) en una proporción de 1: 200 (v/v).
Nota: Considerar la optimización de los títulos del anticuerpo utilizados para la coloración, en lugar de utilizar diluciones de anticuerpos fijos, para minimizar la variación en la tinción a través de diferentes experimentos y mejorar la relación señal a ruido. - Haga girar la placa a 300 x g y 4 ° C, durante 5 minutos.
- Flick la placa para descartar la solución.
- En este punto, el protocolo puede seguir el protocolo dependiente de la centrífuga convencional (proceda al paso 3.3.5; vea la figura 1A, método 1) o el protocolo de centrifugación-independiente alternativo (proceda al paso 4.4.4; vea la figura 1A, método 2).
- Resuspender las células en 75 μl de la mezcla tinción de anticuerpos preparada en el paso 3.3.1.
- Mezclar las muestras con una pipeta multicanal e incubar en hielo durante 30 minutos.
- Preparar una mezcla de tinción de anticuerpos que contiene anticuerpos anti-CD69, TCRβ anti, anti-CD4 y anti-CD8. Diluir los anticuerpos en tampón de lavado FACS (PBS suplementado con 0.5% albúmina de suero bovino [BSA]) en una proporción de 1: 200 (v/v).
-
Fijación de las células
- Lavar los pocillos con 200 μL de tampón de lavado FACS y centrifugar la placa a 300 x g y 4 ° C, durante 5 minutos.
- Flick la placa para descartar la solución.
- Añadir el tampón de fijación/permeabilización (viene con el kit de apoptosis caspasa-3 activa; igual con 10 x buffer de perm/lavado mencionado en el paso 3.5.1 y el anticuerpo anti-caspase-3 en el paso 3.5.2) en 200 μL por pozo.
- Incubar en hielo durante 30 minutos.
-
Intracelular para caspasa activa 3
- Preparar el tampón de lavado de perm x 1 diluyendo 5 mL de tampón de perm/lavado de 10 x 45 ml de agua ultrapura.
- Preparar mancha caspasa activa intracelular al agregar 1,3 mL de anticuerpo anti-caspase-3 a 6,5 mL de 1 x de tampón de lavado/perm. La proporción de anticuerpo de perm/wash buffer es 1:5.
- Hacer girar la placa a 300 x g y 4 ° C, durante 5 minutos quitar la placa para descartar la solución. Lave la placa con 200 μL de tampón de lavado de perm x 1.
- Repetir el punto 3.5.3.
- Hacer girar la placa a 300 x g y 4 ° C, durante 5 minutos quitar la placa para descartar la solución. Añadir 75 μl de caspasas intracelulares mancha preparada en el paso 3.5.2 en todos los pocillos.
- Mezclar las muestras con una pipeta multicanal e incubar en hielo durante 1 hora.
- Lavar las muestras con 200 μL de tampón de lavado de perm x 1 y centrifugar la placa a 300 x g y 4 ° C, durante 5 minutos.
- Flick la placa para descartar la solución. Lave la placa con 200 μL de tampón de lavado de perm x 1. Haga girar la placa a 300 x g y 4 ° C, durante 5 minutos.
- Flick la placa para eliminar la solución y resuspender las muestras en 200 μL de tampón de lavado FACS.
- Realizar un análisis de citometría de flujo de las muestras y analizar los resultados con un programa de análisis FACS.
- Con una parcela de CD4 y CD8, la puerta en la población de timocitos DP con una expresión positiva de CD4 y CD8 (figura 2, la mitad inferior). Dentro de la puerta de timocitos DP, determinar el porcentaje de células con activado caspase-3, usando la muestra sin estimular como control negativo y dexametasona como control positivo. Para el análisis de la expresión de CD69 en la puerta de timocitos DP, utilizar la muestra sin estimular como control negativo y la muestra estimulada como control positivo.
Nota: Cuando se bloquean en los timocitos DP, verificar que la población de timocitos DP está cerrada correctamente para muestras individuales. Las células estimuladas downregulate correceptores superficial y una exclusión involuntaria de acontecimientos pueden ocurrir si se utiliza una estrecha puerta de DP.
4. kinasa inhibidor biblioteca proyección (ensayo de centrífuga-independiente)
-
Tratamiento de los timocitos con inhibidores de la cinasa
- Preparar una suspensión de anti-thymocyte según sección 1.
- Diluir los timocitos en RPMI completo para obtener una suspensión de timocitos de 25 x 106 células/mL.
- Agregar 40 μl de los timocitos en cada pocillo de una placa de pequeño volumen, usando una pipeta multicanal. Coloque la placa de hielo.
- Diluir los inhibidores de la placa común, DMSO y dexametasona en RPMI completo en una proporción de cuatro partes de RPMI completo en una parte del inhibidor/DMSO/dexametasona (factor de dilución de 5).
Nota: Como los volúmenes utilizados en esta placa de pequeño volumen 5 veces menor que en el método convencional, los inhibidores de los reactivos de control se diluyen y cinco veces antes de añadirlos a los timocitos de la placa. - Añadir 0,5 μl de inhibidores a la placa de 96 pocillos de los correspondientes pozos de la placa de inhibidor en paso 4.1.4.
- Preparar ocho pozos de controles no tratados. Preparar cuatro pozos de los controles tratados con vehículo añadiendo 0,5 μl de DMSO en paso 4.1.4. Prepare cuatro pocillos de 5 μm tratados con dexametasona controles, usando la dexametasona diluida preparada en el paso 4.1.4 (figura 2).
-
Estimulación de los timocitos con perlas de anti-CD3/CD28
- Asegúrese de que las cuentas son suspendidas uniformemente. Tomar 1 mL de granos y lavar con 2 mL de PBS. Separe los granos con un soporte magnético y aspirar la solución. Resuspender los granos en 1 mL de RPMI completo.
Nota: La proporción de granos a las células es de 1 a 2,5. Ajustar la cantidad de granos, según el número de pozos a estimular y el número de timocitos utilizado. - Añadir 10 μl de suspensión de grano para cada muestra tratada con inhibidor, las cuatro muestras tratados con DMSO y cuatro de las ocho muestras sin tratar. Añadir 10 μl de RPMI completo a los restantes cuatro pozos sin tratar. Figura 2 muestra la disposición general de la placa.
Nota: El volumen final de los pozos es de 50 μL, que está dentro de la capacidad máxima de los pozos. Es importante tener cuidado y mantener las placas verticales, para evitar el derrame del pozo Cruz. - Para mezclar, agitar la placa con un agitador de microplacas orbital. Por otra parte, mezclar el contenido de los pozos mediante una pipeta multicanal.
- Incubar los timocitos en a 37 ° C, 5% CO2 incubadora para 17-20 h (o toda la noche) con una tapa de la evaporación.
- Asegúrese de que las cuentas son suspendidas uniformemente. Tomar 1 mL de granos y lavar con 2 mL de PBS. Separe los granos con un soporte magnético y aspirar la solución. Resuspender los granos en 1 mL de RPMI completo.
-
Instalación de la lavadora de placa
Nota: Las instrucciones para configurar la placa arandela son proporcionadas por el fabricante. Los pasos se mencionan brevemente a continuación. Aproximadamente 150 mL de solución se necesita para cada fase de cebado.- Cebe el sistema de lavado con etanol al 70% que contiene 1% Tween 20.
- Cebe el sistema de lavado con agua desionizada que contenga 1% Tween 20.
- Cebe el sistema de lavado con tampón de lavado FACS.
-
Tinción de antígenos de superficie de
- Preparar una mezcla de tinción de anticuerpos que contiene anticuerpos anti-CD69, TCRβ anti, anti-CD4 y anti-CD8. Diluir los anticuerpos en tampón de lavado FACS en una proporción de 1: 100 (v/v).
- Lave la placa 9 x, utilizando 55 μl de tampón de lavado FACS por lavado, utilizando el flujo laminar automatizado sistema de lavado.
Nota: Al final de los lavados, habrá 25 μl de volumen residual en cada pozo. - Resuspender las células en 25 μl de la mezcla tinción de anticuerpos preparada en el paso 4.4.1.
- Si las muestras se transfieren de una placa de 96 pocillos (de paso 3.3.4), resuspender las células en 50 μl de la mezcla de anticuerpos preparada en el paso 3.3.1 y transferir las muestras a la placa de pequeño volumen. Este paso corresponde al método número 2, como se muestra en la figura 1A.
- Para mezclar, agitar la placa con un agitador de microplacas orbital o mezclar las muestras con una pipeta multicanal e incubar en hielo durante 30 minutos.
-
Fijación de las células
- Lave la placa 9 x, utilizando 55 μl de tampón de lavado FACS por lavado, utilizando el flujo laminar automatizado sistema de lavado.
- Añadir el tampón de fijación/permeabilización (viene con el kit de apoptosis caspasa-3 activa; igual con 10 x buffer de perm/lavado mencionado en el paso 4.6.1 y el anticuerpo anti-caspase-3 en el paso 4.6.2) en 50 μL por pocillo.
- Incubar en hielo durante 30 minutos.
-
Intracelular para caspasa activa 3
- Preparar el tampón de lavado de perm x 1 diluyendo 25 mL de tampón de lavado de perm x 10 en 225 mL de agua ultrapura.
- Preparar mancha caspasa activa intracelular mediante la adición de 1 mL de anticuerpo anti-caspase-3 a 2 mL de 1 x de tampón de lavado/perm. La proporción de anticuerpo de perm/wash buffer es 1:2.
- Cebe el sistema de lavado con 1 x de tampón de lavado/perm.
- Lave la placa de 9 x 1 x buffer lavado de perm, en 55 μL para cada lavado.
- Añada 25 μl de la mancha de caspasas intracelulares preparada en el paso 4.6.2 en todos los pocillos.
- Para mezclar, agitar la placa con un agitador de microplacas orbital o mezclar las muestras con una pipeta multicanal e incubar en hielo durante 1 hora.
- Lave la placa de 9 x 1 x buffer lavado de perm, en 55 μL para cada lavado.
- Añada 25 μl de tampón de lavado FACS en todos los pocillos.
- Transferir las muestras a tubos de microtitulación después adecuado mezclar mediante pipeteo.
- Añadir otro 50 μl de tampón de lavado FACS a los pozos vacíos y repita paso 4.6.9.
- Repita los pasos 4.6.9 y 4.6.10 2 x hasta 200 μL de las muestras se recogen en los tubos de microtitulación.
Nota: El propósito de los procedimientos descritos en los pasos 4.6.10 y 4.6.11 es asegurar una máxima recuperación de las células de la placa de pequeño volumen. Si un número de células es no un problema, después paso 4.6.10, simplemente recarga la microtitulación tubos a 200 μL de tampón de lavado FACS. - Realizar un análisis de citometría de flujo de las muestras y analizar los resultados con un programa de análisis FACS, según paso 3.5.11. Activación de la caspasa-3 y la expresión de CD69 se analizan en la puerta que contiene CD4+CD8+DP timocitos.
Resultados
El enfoque para el análisis de la investigación se resume en la figura 1A. Los inhibidores de la cinasa primero fueron defendidos por sus efectos latentes sobre viabilidad de timocitos. Como control positivo para apoptosis, dexametasona fue utilizada como un agente proapoptóticas. La compuerta para la población de células vivas se determinó con base en los controles negativos no tratados y los controles positivos tratados con dexametasona (figura 1B). Los inhibidores se probaron en 10 μm en timocitos, y se midió el porcentaje de células viables después de incubar durante 18 h. Una ventana de 20% de muerte celular fue elegida tales que los compuestos que indujo una mayor al 20% pérdida de células en la puerta de la célula viva, en comparación con las muestras tratadas con DMSO, se probaron en concentraciones más bajas (figura 1B). Parcelas representativas FACS tratados con inhibidor de las muestras seleccionadas se muestran para ilustrar el análisis de viabilidad. LY294002 (2-(4-morpholinyl)-8-phenyl-4H-1-benzopyran-4-one; CAS 154447-36-6), un inhibidor de PI3K22, no aumentar considerablemente la muerte celular en 10 μm, y el inhibidor fue utilizado en 10 μm para los ensayos posteriores. CAY10626 (N-[2-(dimethylamino)ethyl]-N-methyl-4-[[[4-[4-(4-morpholinyl)-7-(2,2,2-trifluoroethyl)-7H-pyrrolo[2,3-d]pyrimidin-2-yl]phenyl]amino]carbonyl]amino]-benzamide; CAS 1202884-94-3), un inhibidor dual de PI3Kα/mTOR23, inducida por altos niveles de muerte celular en 10 μm y 1 μm pero no a 0.1 μm y 0,1 μm se determinó la concentración adecuada para su aplicación en ensayos posteriores. Estaurosporina (2,3,10,11,12,13-hexahydro-10R-methoxy-9S-methyl-11R-methylamino-9S,13R-epoxy-1H,9H-diindolo[1,2,3-gh;3',2',1'-lm]pyrrolo[3,4-j][1,7]benzodiazonin-1-one; CAS 62996-74-1), un inhibidor de la cinasa C de proteína pan con una capacidad establecida para inducir apoptosis24, indujo muerte celular importante en todas las concentraciones probadas, incluso a 0.1 μm. Fue utilizado en los ensayos posteriores en 0.1 μm como control positivo adicional.
Las concentraciones finales de los inhibidores se seleccionaron con base en las concentraciones más altas en donde ellos no amplifican muerte celular por más de 20% de las muestras tratadas con DMSO. Con las concentraciones finales de los inhibidores determinados, un plato común de inhibidores se preparó tal que todos los inhibidores fueron 500 veces la concentración cuando se aplica a las células. Figura 1 ilustra el diseño de la placa de la placa común, con las concentraciones finales de los inhibidores. En el protocolo alternativo de incubación las células directamente en placas de pequeño volumen para el ensayo de lavado de flujo laminar, el uso de pequeños volúmenes requería una mayor dilución de los inhibidores de la. Para asegurarse de que el contenido de DMSO de las culturas después de adición de inhibidor no sería demasiado alto para las células, los inhibidores fueron aún más diluidos en RPMI completo, por un factor de dilución de 5, que estaban en 100 veces la concentración prevista cuando se aplica a la células.
Los inhibidores, diluidos a concentraciones no tóxicas, fueron utilizados en el ensayo para TCR-estimulación-induced apoptosis en timocitos5,17. La estimulación se realizó con anti-CD3/CD28 granos durante 18 h, y posteriormente se tiñeron las células para la activación de la caspasa-3 en el CD4+ y CD8+ DP población de timocitos (figura 2). Se observaron un aumento en la activación de caspasa-3 y expresión de CD69 y también un downregulation del TCR, en el anti-CD3/CD28-estimulados y las tratados con DMSO y mofa de anti-CD3/28-estimulados muestras, en comparación con las muestras nonstimulated. Las muestras tratadas con dexametasona mostraron un aumento en la activación de caspasa-3 independiente de upregulation de CD69, que se espera el efecto de inducción de apoptosis independiente de la estimulación del TCR.
Figura 3A resume los resultados de la biblioteca de investigación análisis de inhibidores de los. Activación de la caspasa-3 y CD69 pueden utilizarse para identificar inhibidores potenciales de interés debido a la supresión de la expresión. Como era de esperar, inhibidores de mediadores canónicas de la señalización del TCR demostraron para arriba como positivos resultados en las pantallas. Estos inhibidores, que exhiben diferentes grados de potencia inhibitoria, incluyen inhibidores de amplio espectro que atacan múltiples cinasas y, también, más inhibidores específicos. Algunos inhibidores fueron capaces de suprimir la activación de caspasa-3 y upregulation de CD69 (figura 3B, fila superior, paneles de la izquierda). Un tal inhibidor es bisindolylmaleimide II (3-(1H-Indol-3-yl)-4-[1-[2-(1-methyl-2-pyrrolidinyl)ethyl]-1H-indol-3-yl]-1H-pyrrole-2,5-dione; CAS 137592-45-1), que inhibe todas isoformas de cinasa C de proteína, además de kinase de proteína A y PDK125,26,27. Otro inhibidor de esta categoría es CAY10657 (3-[(aminocarbonyl)amino]-5-[4-(4-morpholinylmethyl)phenyl]-2-thiophenecarboxamide; CAS 494772-86-0), un inhibidor de la propuesta de IKK228.
Había compuestos que inhibición upregulation de CD69 pero no afectar a la activación de caspasa-3 (figura 3B, fila superior, derecha paneles). CAY10626, un inhibidor de PI3Kα y mTOR23y U-0126 (2, 3-bis [amino [(2-aminophenyl) tio] metileno]-butanedinitrile; CAS 109511-58-2), un inhibidor de la MEK29, fueron algunos de los inhibidores identificados. Los resultados muestran que diferentes inhibidores dirigidos a diferentes quinasas de ramas específicas de la vía de señalización del TCR, especialmente aquellos dirigidos a las quinasas de la última etapa, pueden resultar en el deterioro selectivo de los fenómenos de activación del T-cell.
También fueron los inhibidores que no suprimió upregulation de CD69 y activación de caspasa-3 (figura 3B, fila inferior, paneles de la izquierda). Paclitaxel (βS-(benzoylamino) - αR - hidroxi-ácido benzenepropanoic, (2aR,4S,4aS,6R,9S,11S,12S,12aR,12bS)-6,12b-bis(acetyloxy)-12-(benzoyloxy)-2a,3,4,4a,5,6,9,10,11,12,12a,12b-dodecahydro-4,11-dihydroxy-4a,8,13,13-tetramethyl-5-oxo-7 , ester 11-methano-1H-cyclodeca[3,4]benz[1,2-b]oxet-9-yl; CAS 33069-62-4), un disruptor de microtubule dynamics30y necrostatin-5 (2-[[3,4,5,6,7,8-hexahydro-3-(4-methoxyphenyl)-4-oxo[1]benzothieno[2,3-d]pyrimidin-2-yl]thio]-acetonitrile; CAS 337349-54-9), un inhibidor de la cinasa de RIP131, son dos inhibidores identificados en esta categoría. En tales casos donde upregulation de CD69 y activación de caspasa-3 no fueron deterioradas, esto puede debido a los inhibidores no apuntando a una quinasa relevante del TCR vía de señalización.
Como se mencionó anteriormente, staurosporina fue utilizado en las pantallas, en una concentración que todavía indujo apoptosis en los timocitos. Como era de esperar, la muestra tratada con staurosporina mostraron altos niveles de activación de la caspasa-3 (figura 3B, fila inferior, la columna de la derecha). Los niveles bajos de expresión de CD69 pueden atribuirse a la estaurosporina mediada por la inhibición de PKC, como bisindolylmaleimide II, otro inhibidor de la PKC de pan, también suprime la expresión de CD69. Alternativamente, staurosporina indujo apoptosis en las células antes de que fueran capaces de alza la expresión de CD69.
Para aumentar el rendimiento y la automatización del Protocolo, se prepararon protocolos paralelos que implicó el uso de una placa automatizada de lavado sistema mediante flujo laminar. Dos protocolos separados usando este dispositivo de lavado automático de la placa fueron probado y Comparado con el método convencional de cultivo de células en placas de 96 pocillos y tinción de las células en un protocolo dependiente de la centrifugación. Un método consistía en cultivar las células en placas de 96 pocillos, según el procedimiento estándar, y luego, transferir las células a las placas compatibles con la arandela de placa automatizada para tinción (figura 4, las muestras de lavado DA). El otro método consistía en cultivar las células directamente en las placa-arandela-compatible con placas y continuando con el protocolo de tinción en la misma placa (figura 4, las muestras DA cultura). Los protocolos de centrifugación-independiente no da muchas diferencias perceptibles en caspasa-3 activa, CD69 y TCRβ tinción a través de las diferentes muestras analizadas, en comparación con el protocolo dependiente de la centrifugación convencional (figura 4). Diferencias en la intensidad de la tinción pueden atribuirse al uso de anticuerpos en concentraciones ligeramente diferentes durante los pasos de tinción.
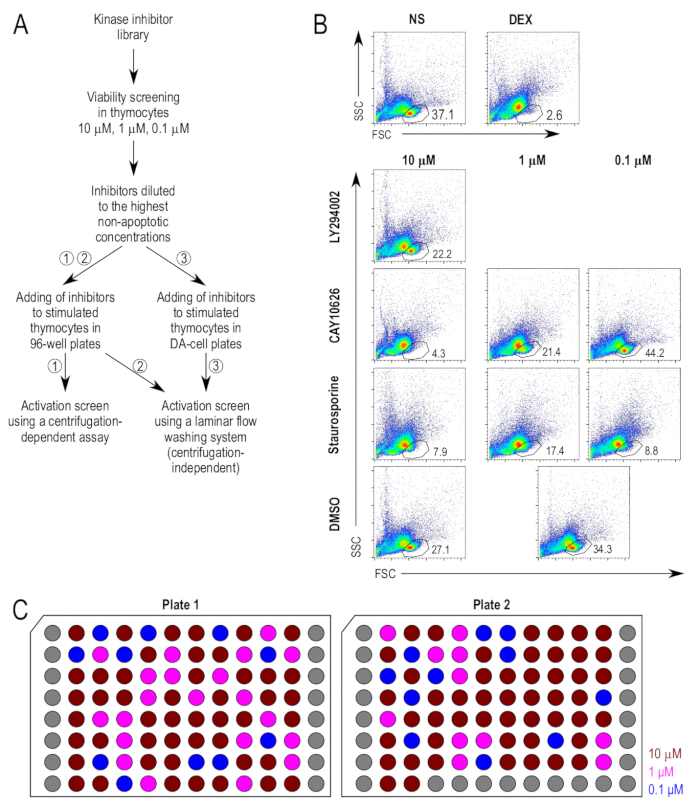
Figura 1 : Viabilidad de timocitos después del tratamiento con inhibidores de la. (A) esquema Experimental de los pasos más importantes en el análisis de la proyección. Hay tres métodos propuestos para la estimulación y la coloración de los timocitos en el ensayo de activación, es decir, (1) el cultivo de los timocitos en placas de 96 pocillos estándar, seguidos por la coloración mediante un protocolo basado en la centrifugación convencional, (2) el cultivo de los timocitos en placas de 96 pocillos estándar, seguidos de tinción utilizando un protocolo de lavado independiente de la centrifugación y (3) el cultivo de los timocitos en placas de pequeño volumen, seguido por la coloración de las placas mismas utilizando un Protocolo de lavado independiente de la centrifugación. (B) compuerta estrategias utilizadas en los ensayos de viabilidad. La puerta de la vivo de la célula se deriva del forward scatter (FSC) y diagramas scatter (SSC) de lado, como se describió anteriormente17. Inhibidores que se consideran demasiado tóxicos en la concentración probada fueron objeto de más análisis de viabilidad en concentraciones menores de 10 veces. Se presentan muestras representativas tratados con inhibidor. Nota el control común (tratados con DMSO [DMSO]) utilizado para 1 μm y 0,1 μm muestras. (C) diseño de placa de los inhibidores de la diluida. Una representación esquemática de las placas de inhibidores diluidos en DMSO a una concentración de 500 x la concentración final deseada. Cada uno representa así un único inhibidor; los pozos de gris están vacíos. Las concentraciones que se muestran son la concentración final cuando se agrega a los cultivos celulares, es decir, 10 μm (rojo oscuro) (fucsia) 1 μm y 0,1 μm (azul). Haga clic aquí para ver una versión más grande de esta figura.
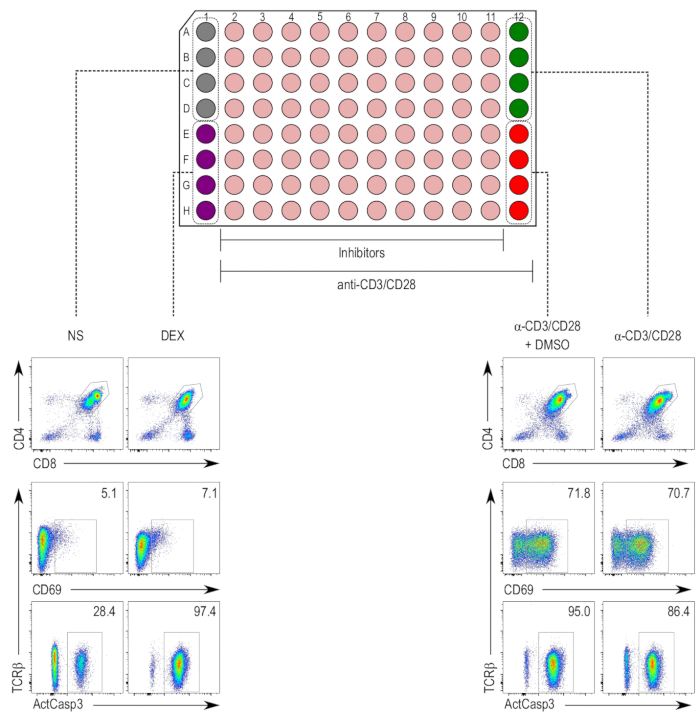
Figura 2 : Diseño de placa de la prueba de activación del anti-thymocyte. (Top) Columnas 1 y 12 son reservados para los controles, mientras que las columnas 2 a 11 son tratados con inhibidor de muestras (beige). El control negativo (nonstimulated [NS]; gris) ocupa pozos A1 a D1, y el control positivo para muerte celular (tratados con dexametasona [DEX]; púrpura) ocupa pozos E1 H1. Las columnas 2 a 12 contienen timocitos estimulados con anti-CD3/CD28 granos. El control positivo para la activación de timocitos (muestras estimuladas [α-CD3/CD28]; verde) ocupa pozos A12 a D12 y el control del vehículo (estimulado y tratados con DMSO [α-CD3/CD28 + DMSO]; rojo) ocupa pozos E12 a H12. (Parte inferior) Flow cytometry parcelas activa caspase-3 (ActCasp3), CD69 y TCRβ tinción de timocitos cerrados dentro de la puerta de doble-positivo (DP). Parcelas representativas de los diferentes controles se muestran. NS = nonstimulated; DEX = muestras tratadas con dexametasona; Α-CD3/CD28 + DMSO = las muestras estimuladas con granos de CD3/CD28-revestido y tratados con DMSO; Α-CD3/CD28 = muestras estimuladas con CD3/CD28-cubierto de granos. Haga clic aquí para ver una versión más grande de esta figura.
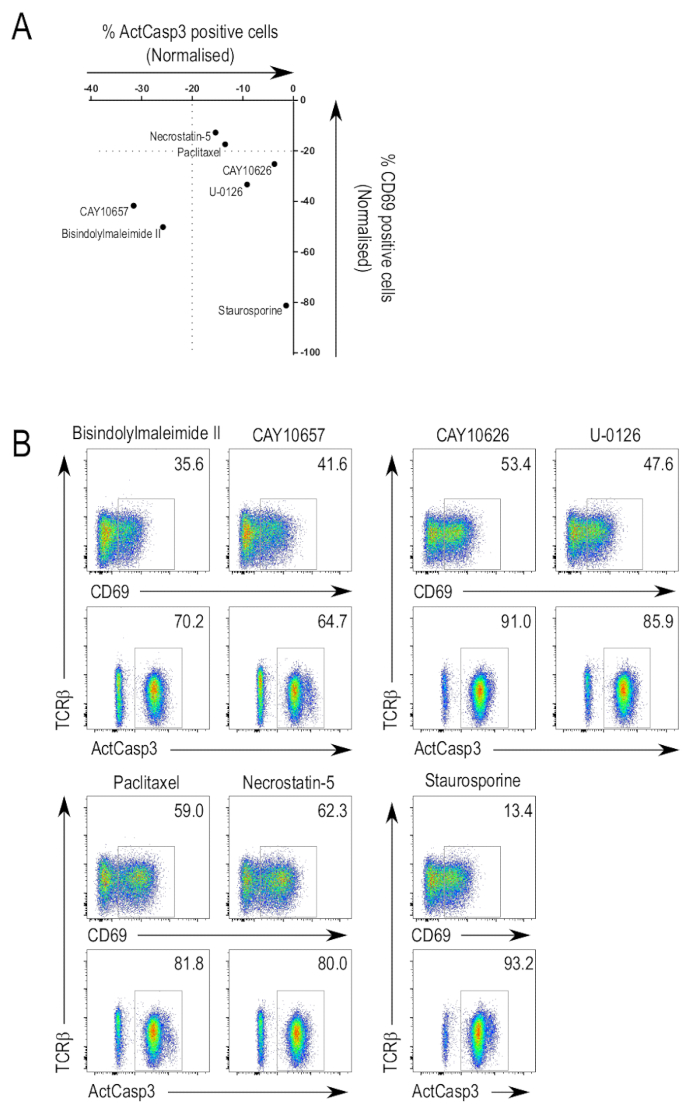
Figura 3 : Proyección de la biblioteca de inhibidor de la activación del anti-thymocyte. (A) resume datos de la prueba de activación. Estos son los resultados de un experimento representativo mostrando los valores normalizados de las células y expresión de CD69 seleccionados inhibidores de caspasa-3 activa. Normalización se realizó comparando el porcentaje de células en la activa caspase-3 positivo o CD69 positivo cancela el valor del control tratados con DMSO, que se establece en un valor relativo de 0 en el gráfico. (B) seleccionado FACS parcelas. Parcelas de citometría de flujo de inhibidores que suprimieron la activación de caspasa-3 y upregulation de CD69 (arriba izquierda), había suprimido sólo upregulation de CD69 (arriba a la derecha), o no tuvo efecto sobre la activación de caspasa-3 y upregulation de CD69 (inferior izquierda). Parcelas de la muestra tratada con staurosporina se muestran para ilustrar los efectos de la utilización de un inhibidor en concentraciones tóxicas (abajo a la derecha). Haga clic aquí para ver una versión más grande de esta figura.
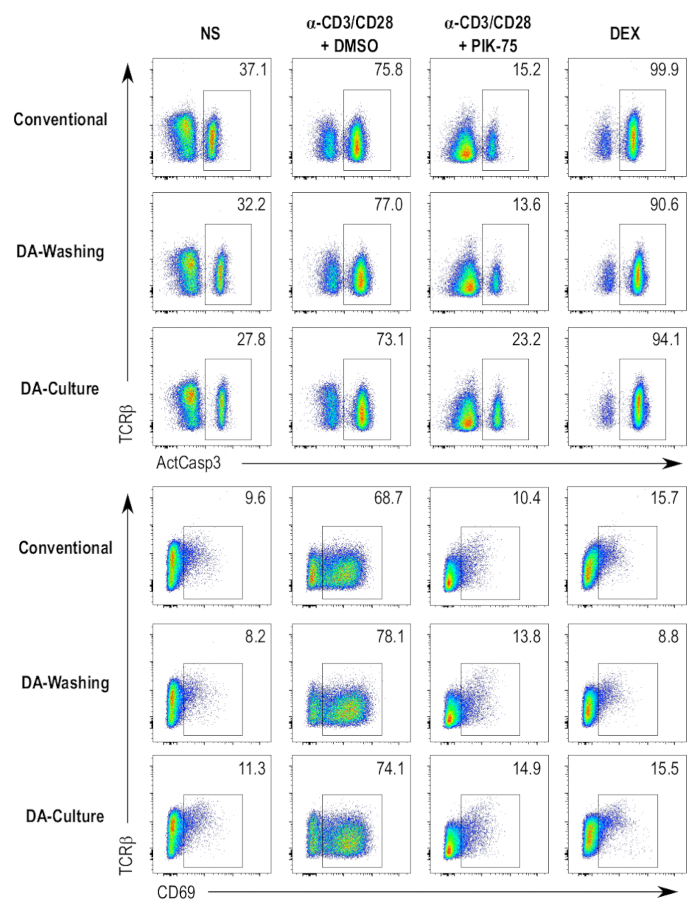
Figura 4 : Comparación de los protocolos de ensayo diferentes. Flujo cytometry parcelas activa caspase-3 (ActCasp3), CD69, y TCRβ tinción de los timocitos DP después de los tres diferentes protocolos de ensayo. Se prueban cuatro condiciones diferentes, a saber, el control negativo (nonstimulated [NS]), el control positivo para muerte celular (tratados con dexametasona [DEX]), el control del vehículo (estimulado y tratados con DMSO [α-CD3/CD28 + DMSO]) y tratados con un inhibidor de la muestra (estimulado y PIK-75-tratado [α-CD3/CD28 + PIK-75]). Convencional = el cultivo de los timocitos en placas de 96 pocillos estándar y la coloración con un protocolo basado en la centrifugación convencional; Lavado de DA = el cultivo de los timocitos en placas de 96 pocillos estándar y manchando con un flujo laminar lavado protocolo; DA cultura = cultivo de timocitos en placas de pequeño volumen y coloración de las placas mismas usando un protocolo de lavado de flujo laminar. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La estrategia de investigación aquí propuesta evalúa la capacidad de los inhibidores de molécula pequeña para suprimir los efectos de la apoptosis en timocitos después del estímulo, además de más convencionales marcadores de activación CD69 upregulation de la célula de T y downregulation del TCR . También se pueden incluidos para permitir el análisis del anti-thymocyte diferentes subconjuntos32marcadores adicionales. Un aspecto interesante del análisis actual se encuentra en el hecho de que los inhibidores que impiden la señalización del TCR también humedezca la inducción de apoptosis, destacando además la distinción de los efectos de la TCR-independiente los inhibidores que tenga de inducir muerte celular. Además, un análisis basado en la citometría de flujo permite el uso de múltiples lecturas como marcadores de activación distintas, que podían informar los efectos de los inhibidores en diferentes ramas individuales de la señalización del TCR. En el caso presentado aquí, había inhibidores que mostró una inhibición diferencial de activación de la caspasa-3 y upregulation de CD69. Porque algunos compuestos pueden afectar las funciones de limpieza como la síntesis de proteínas o tráfico vesicular, no es de extrañar observar efectos en la regulación al alza de de novo sintetizado marcadores (por ejemplo, CD69) pero no en postraduccional modificaciones (por ejemplo, la activación proteolítica de caspasa-3).
Como el análisis presentado aquí mide la apoptosis como una lectura, es imprescindible que los latentes efectos tóxicos de los inhibidores de no oscurecer los resultados. Por ejemplo, en la pantalla, que no diluir estaurosporina más allá de 1 nM, a pesar de aún ser tóxicos a las células a esa concentración. Resultados representativos están de acuerdo con ser un inhibidor de la cinasa promiscuo y un inductor de apoptosis33estaurosporina. Sin una dilución suficiente de los compuestos probados a concentraciones no tóxicas, es posible pasar por alto posibles golpes.
La estrategia de investigación detallada aquí sería difícil de aplicar a los seres humanos debido a las complicaciones asociadas con la obtención de un número suficiente de timocitos para detección de alto rendimiento. Sin embargo, es posible obtener muestras de timo humano de biopsias cardíacas pediátrica34,35 o de fetos36,37. Sin embargo, como TCR señalización de caminos y las secuencias de aminoácidos de las proteínas de señalización en gran parte se conservan entre ratones y humanos, el análisis del anti-thymocyte proporciona una estrategia de cribado preliminar útil, y cualquier resultados obtenidos con este ensayo usando el ratón timocitos se pueden, entonces, verificar en linfocitos humanos primarios.
Una limitación del protocolo dependiente de la centrifugación convencional se refiere a la posibilidad de pérdida de la célula, que puede ser atribuida a la naturaleza varias fases del proceso, que implica medidas como la permeabilización celular y centrifugación. Cada centrifugación y resuspensión paso inevitablemente resulta en la pérdida de células. Mientras que esas pérdidas no pueden ser críticas para los estudios que involucran a un número limitado de muestras, pueden plantear problemas cuando se aplica en la detección de un mayor rendimiento, en particular como ensayo formato avanza la de 96 a 384 - a 1536-bien. Una forma de eludir este problema es mediante el uso de sensores permeable a la célula caspase fluorescente38 que permiten la detección de la activación de caspasas, evitando las complicaciones de la permeabilización celular y múltiples lavados5. Por otra parte, también es posible para reducir al mínimo pérdida de la célula empleando un método independiente de la centrifugación de las células se lavan por flujo laminar. Con una placa automatizada de lavado estación junto con la placa sin muros, las células se lavan por flujo laminar sin el uso de una centrífuga. La exponencial dilución de los reactivos permite el lavado exhaustivo y eficiente de células en menos de 3 minutos, lo que representa una dilución equivalente a dos rondas de lavado centrífugo. Sin tensiones externas debido a la centrifugación, las células son más viables y se reducen al mínimo las pérdidas de la célula.
También exploramos la posibilidad de utilizar la placa automatizada estación de lavado después de cultivo de los timocitos en U 96 pozos de fondo las placas y, también, el cultivo de células en las placas de pared menos compatibles con la placa automatizada estación de lavado. El cultivo de células en las placas de pared menos permitió la eliminación de todos los pasos de centrifugación y reduce al mínimo pérdida de la célula mediante la eliminación de la necesidad de una transferencia de la muestra a través de las placas. En general, los tres diferentes protocolos son comparables en eficacia de la estimulación y la coloración. La estación de lavado automatizado proporciona el beneficio de la automatización, la velocidad y eficiencia, lo que facilita el análisis de un mayor rendimiento. Además, con la automatización creciente, los pasos de lavado pueden realizarse más rápidamente, y hay una mayor consistencia entre los experimentos o experimentadores. Sin embargo, la estación de lavado tiene ciertos inconvenientes: grandes volúmenes de tampones de lavado se requieren para lavadora cebado (150 mL por cambio de tampón, de los cuales 50 mL se utiliza para lavarse); cuidado es necesario al manejar la placa para evitar cualquier contaminación de los pozos debido a la limitada repartir entre los pocillos de la placa de pequeño volumen; buffer residual de 25 μL en los pozos después de lavado requiere el uso de reactivos en un más alto que la concentración de 1 x. Para abordar las cuestiones de volumen residual y capacidad limitada de la placa, puede añadirse un accesorio para expandir el volumen de incubación de 70 μl a 150 μL, facilitar la adopción de protocolos convencionales. Mientras que los sistemas de manejo de placa automatizada están disponibles actualmente, tienen una huella significativa en comparación con el sistema de lavado laminar, que es una pequeña unidad de ~ 1 pie cúbico (~0.028 m3). Por otra parte, la integración de la centrifugación en placa automatizada de sistemas de manejo es un reto, limitando su uso en lavado de células. No hay ninguna otra célula de centrífuga independiente lavado instrumentos disponibles, por lo que sabemos.
La estrategia de proyección presentada aquí es capaz de identificar moléculas pequeñas y sus quinasas objetivo pretendido, que afectan la señalización del TCR y la activación del T-cell. La biblioteca utilizada aquí comprende principalmente moléculas pequeñas inhibidores de quinasas y fue capaz de generar un número potencialmente interesantes hits. El protocolo puede fácilmente aplicarse también a las bibliotecas de inhibidor de otras clases de enzima o a otros tipos de moléculas pequeñas, así como a bibliotecas de otros compuestos (por ejemplo, varias macromoléculas). El protocolo también puede utilizarse para detectar otros tipos de células, como linfocitos T periféricos o las células inmortalizadas, incluyendo aquellas expresan TCR transgénico o llevar sistemas de reportero. Identificación y caracterización de nuevos mediadores de células T de señalización puede mejorar nuestro conocimiento de la vía de señalización y también ayudar en el desarrollo de la terapia dirigida en enfermedades inmunitarias13,14,15, 16. en total, este estudio añade a la gama de opciones disponibles para la detección de mediadores de señalización a través de proyección de alto rendimiento análisis de T-cell.
Divulgaciones
El autor Chyan Ying Ke es un empleado de Curiox Biosystems, que produce la lavadora DA células y placas de células DA en este artículo.
Agradecimientos
Este trabajo fue financiado por becas del Consejo Nacional de investigación médica del Ministerio de salud de Singapur, NMRC CBRG15may017 y Singapur Ministerio de educación, 2014-T2-1-136 (a N.R.J.G.).
Materiales
| Name | Company | Catalog Number | Comments |
| RPMI | HyClone | SH30027FS | |
| FBS | HyClone | SH3007103 | |
| L-Glutamine | HyClone | SH3003401 | |
| Sodium pyruvate | HyClone | SH3023901 | |
| Penicillin/Streptomycin | HyClone | SV30010 | |
| b-mercaptoethanol | Sigma Aldrich | 516732 | |
| 10X PBS | Vivantis | PB0344 – 1L | |
| Kinase Screening Library (96-Well) | Cayman Chemical | 10505 | Exact contents of the library may vary |
| DMSO | Sigma Aldrich | D2650 | |
| Dexamethasone | Sigma Aldrich | D4902 | |
| anti-CD3/CD28 beads | Thermo Fisher Scientific | 11452D | |
| FITC Active Caspase-3 Apoptosis Kit | BD Pharmingen | 550480 | Contains Fixation/Permeabilisation buffer, 10X Perm/Wash buffer and anti-caspase 3 antibody |
| DA-Cell Washer | CURIOX | HT1000 | |
| 96-well DA-Cell Plate | CURIOX | 96-DC-CL-05 | |
| Antibodies | |||
| CD3e | BioLegend | 100236 | |
| TCRb | BD Biosciences | 553174 | |
| CD4 | BD Biosciences | 740007 | |
| CD8 | BD Biosciences | 563786 | |
| CD69 | eBioscience | 25-0699-42 | |
| Inhibitors | |||
| TG003 | Cayman Chemical | - | From the Kinase Screening Library |
| PKC 412 | Cayman Chemical | - | From the Kinase Screening Library |
| Doramapimod | Cayman Chemical | - | From the Kinase Screening Library |
| Paclitaxel | Cayman Chemical | - | From the Kinase Screening Library |
| Erlotinib | Cayman Chemical | - | From the Kinase Screening Library |
| Necrostatin-5 | Cayman Chemical | - | From the Kinase Screening Library |
| NVP-BEZ235 | Cayman Chemical | - | From the Kinase Screening Library |
| Phthalazinone pyrazole | Cayman Chemical | - | From the Kinase Screening Library |
| AG-879 | Cayman Chemical | - | From the Kinase Screening Library |
| 1-NA-PP1 | Cayman Chemical | - | From the Kinase Screening Library |
| Torin 1 | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide II | Cayman Chemical | - | From the Kinase Screening Library |
| BIBF 1120 | Cayman Chemical | - | From the Kinase Screening Library |
| SMI-4a | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide XI (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10657 | Cayman Chemical | - | From the Kinase Screening Library |
| AS-703026 | Cayman Chemical | - | From the Kinase Screening Library |
| Chelerythrine chloride | Cayman Chemical | - | From the Kinase Screening Library |
| Tunicamycin | Cayman Chemical | - | From the Kinase Screening Library |
| GSK 1059615 | Cayman Chemical | - | From the Kinase Screening Library |
| Ruxolitinib | Cayman Chemical | - | From the Kinase Screening Library |
| Necrostatin-1 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 505124 | Cayman Chemical | - | From the Kinase Screening Library |
| INK128 | Cayman Chemical | - | From the Kinase Screening Library |
| Canertinib (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| SB 431542 | Cayman Chemical | - | From the Kinase Screening Library |
| PD 173074 | Cayman Chemical | - | From the Kinase Screening Library |
| Valproic Acid (sodium salt) | Cayman Chemical | - | From the Kinase Screening Library |
| PD 0325901 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 203580 | Cayman Chemical | - | From the Kinase Screening Library |
| VX-702 | Cayman Chemical | - | From the Kinase Screening Library |
| Emodin | Cayman Chemical | - | From the Kinase Screening Library |
| CHIR99021 | Cayman Chemical | - | From the Kinase Screening Library |
| BIO | Cayman Chemical | - | From the Kinase Screening Library |
| Imatinib (mesylate) | Cayman Chemical | - | From the Kinase Screening Library |
| Sunitinib Malate | Cayman Chemical | - | From the Kinase Screening Library |
| Gefitinib | Cayman Chemical | - | From the Kinase Screening Library |
| PP2 | Cayman Chemical | - | From the Kinase Screening Library |
| 3-Methyladenine | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide I | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide IV | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide V | Cayman Chemical | - | From the Kinase Screening Library |
| NSC 663284 | Cayman Chemical | - | From the Kinase Screening Library |
| D 4476 | Cayman Chemical | - | From the Kinase Screening Library |
| NU 7026 | Cayman Chemical | - | From the Kinase Screening Library |
| H-9 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Indirubin-3'-monoxime | Cayman Chemical | - | From the Kinase Screening Library |
| KN-62 | Cayman Chemical | - | From the Kinase Screening Library |
| KN-93 | Cayman Chemical | - | From the Kinase Screening Library |
| CGP 57380 | Cayman Chemical | - | From the Kinase Screening Library |
| Iso-Olomoucine | Cayman Chemical | - | From the Kinase Screening Library |
| (S)-Glycyl-H-1152 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Bisindolylmaleimide VIII (acetate) | Cayman Chemical | - | From the Kinase Screening Library |
| ST638 | Cayman Chemical | - | From the Kinase Screening Library |
| SU 6656 | Cayman Chemical | - | From the Kinase Screening Library |
| LY364947 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 203580 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10621 | Cayman Chemical | - | From the Kinase Screening Library |
| YM-201636 | Cayman Chemical | - | From the Kinase Screening Library |
| ZM 447439 | Cayman Chemical | - | From the Kinase Screening Library |
| AS-041164 | Cayman Chemical | - | From the Kinase Screening Library |
| NVP-AEW541 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| PP242 | Cayman Chemical | - | From the Kinase Screening Library |
| ABT-869 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10622 | Cayman Chemical | - | From the Kinase Screening Library |
| 17β-hydroxy Wortmannin | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10626 | Cayman Chemical | - | From the Kinase Screening Library |
| SU 6668 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10572 | Cayman Chemical | - | From the Kinase Screening Library |
| N,N-Dimethylsphingosine | Cayman Chemical | - | From the Kinase Screening Library |
| LY294002 | Cayman Chemical | - | From the Kinase Screening Library |
| U-0126 | Cayman Chemical | - | From the Kinase Screening Library |
| Staurosporine | Cayman Chemical | - | From the Kinase Screening Library |
| KN-92 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| AS-605240 (potassium salt) | Cayman Chemical | - | From the Kinase Screening Library |
| O-1918 | Cayman Chemical | - | From the Kinase Screening Library |
| Y-27632 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Leelamine | Cayman Chemical | - | From the Kinase Screening Library |
| PD 98059 | Cayman Chemical | - | From the Kinase Screening Library |
| PD 169316 | Cayman Chemical | - | From the Kinase Screening Library |
| TGX-221 | Cayman Chemical | - | From the Kinase Screening Library |
| (S)-H-1152 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| AS-605240 | Cayman Chemical | - | From the Kinase Screening Library |
| D-erythro-Sphingosine C-18 | Cayman Chemical | - | From the Kinase Screening Library |
| OSU03012 | Cayman Chemical | - | From the Kinase Screening Library |
| JNJ-10198409 | Cayman Chemical | - | From the Kinase Screening Library |
| Leelamine (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Arachidonic Acid Leelamide | Cayman Chemical | - | From the Kinase Screening Library |
| Lauric Acid Leelamide | Cayman Chemical | - | From the Kinase Screening Library |
| AS-252424 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10505 | Cayman Chemical | - | From the Kinase Screening Library |
| PI-103 | Cayman Chemical | - | From the Kinase Screening Library |
| PIK-75 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| Sphingosine Kinase Inhibitor 2 | Cayman Chemical | - | From the Kinase Screening Library |
| Piceatannol | Cayman Chemical | - | From the Kinase Screening Library |
| SC-1 | Cayman Chemical | - | From the Kinase Screening Library |
| (R)-Roscovitine | Cayman Chemical | - | From the Kinase Screening Library |
| BAY-43-9006 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10561 | Cayman Chemical | - | From the Kinase Screening Library |
| AS-604850 | Cayman Chemical | - | From the Kinase Screening Library |
| PI3-Kinase α Inhibitor 2 | Cayman Chemical | - | From the Kinase Screening Library |
| ML-9 | Cayman Chemical | - | From the Kinase Screening Library |
| Triciribine | Cayman Chemical | - | From the Kinase Screening Library |
| Erbstatin Analog | Cayman Chemical | - | From the Kinase Screening Library |
| Kenpaullone | Cayman Chemical | - | From the Kinase Screening Library |
| Olomoucine | Cayman Chemical | - | From the Kinase Screening Library |
| AG-494 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-825 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-1478 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 216763 | Cayman Chemical | - | From the Kinase Screening Library |
| SB 415286 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-17 | Cayman Chemical | - | From the Kinase Screening Library |
| H-8 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| LFM-A13 | Cayman Chemical | - | From the Kinase Screening Library |
| SC-514 | Cayman Chemical | - | From the Kinase Screening Library |
| Apigenin | Cayman Chemical | - | From the Kinase Screening Library |
| AG-18 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10554 | Cayman Chemical | - | From the Kinase Screening Library |
| DRB | Cayman Chemical | - | From the Kinase Screening Library |
| RG-13022 | Cayman Chemical | - | From the Kinase Screening Library |
| RG-14620 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-490 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-82 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-99 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-213 | Cayman Chemical | - | From the Kinase Screening Library |
| AG-183 | Cayman Chemical | - | From the Kinase Screening Library |
| Lavendustin C | Cayman Chemical | - | From the Kinase Screening Library |
| ZM 336372 | Cayman Chemical | - | From the Kinase Screening Library |
| 5-Iodotubercidin | Cayman Chemical | - | From the Kinase Screening Library |
| SB 202190 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10571 | Cayman Chemical | - | From the Kinase Screening Library |
| Nilotinib | Cayman Chemical | - | From the Kinase Screening Library |
| SP 600125 | Cayman Chemical | - | From the Kinase Screening Library |
| L-threo-Sphingosine C-18 | Cayman Chemical | - | From the Kinase Screening Library |
| H-89 | Cayman Chemical | - | From the Kinase Screening Library |
| HA-1077 (hydrochloride) | Cayman Chemical | - | From the Kinase Screening Library |
| AG-370 | Cayman Chemical | - | From the Kinase Screening Library |
| Wortmannin | Cayman Chemical | - | From the Kinase Screening Library |
| AG-1296 | Cayman Chemical | - | From the Kinase Screening Library |
| KT 5823 | Cayman Chemical | - | From the Kinase Screening Library |
| Janex 1 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10574 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10575 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10576 | Cayman Chemical | - | From the Kinase Screening Library |
| NH125 | Cayman Chemical | - | From the Kinase Screening Library |
| TWS119 | Cayman Chemical | - | From the Kinase Screening Library |
| NSC 210902 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10577 | Cayman Chemical | - | From the Kinase Screening Library |
| CAY10578 | Cayman Chemical | - | From the Kinase Screening Library |
| PD 184161 | Cayman Chemical | - | From the Kinase Screening Library |
| CCT018159 | Cayman Chemical | - | From the Kinase Screening Library |
| Myricetin | Cayman Chemical | - | From the Kinase Screening Library |
Referencias
- Gascoigne, N. R., Rybakin, V., Acuto, O., Brzostek, J. TCR Signal Strength and T Cell Development. Annual Review of Cell and Developmental Biology. 32, 327-348 (2016).
- Rothenberg, E. V., Moore, J. E., Yui, M. A. Launching the T-cell-lineage developmental programme. Nature Reviews Immunology. 8 (1), 9-21 (2008).
- Klein, L., Hinterberger, M., Wirnsberger, G., Kyewski, B. Antigen presentation in the thymus for positive selection and central tolerance induction. Nature Reviews Immunology. 9 (12), 833-844 (2009).
- Starr, T. K., Jameson, S. C., Hogquist, K. A. Positive and negative selection of T cells. Annual Review of Immunology. 21, 139-176 (2003).
- Rybakin, V., Gascoigne, N. R. Negative selection assay based on stimulation of T cell receptor transgenic thymocytes with peptide-MHC tetramers. PLoS One. 7 (8), e43191 (2012).
- Krogsgaard, M., Juang, J., Davis, M. M. A role for "self" in T-cell activation. Seminars in Immunology. 19 (4), 236-244 (2007).
- Nakayama, T., Yamashita, M. The TCR-mediated signaling pathways that control the direction of helper T cell differentiation. Seminars in Immunology. 22 (5), 303-309 (2010).
- Hoerter, J. A., et al. Coreceptor affinity for MHC defines peptide specificity requirements for TCR interaction with coagonist peptide-MHC. The Journal of Experimental Medicine. 210 (9), 1807-1821 (2013).
- Zhao, X., et al. Nonstimulatory peptide-MHC enhances human T-cell antigen-specific responses by amplifying proximal TCR signaling. Nature Communications. 9 (1), 2716 (2018).
- Fu, G., et al. Fine-tuning T cell receptor signaling to control T cell development. Trends in Immunology. 35 (7), 311-318 (2014).
- Wang, D., et al. Tespa1 is involved in late thymocyte development through the regulation of TCR-mediated signaling. Nature Immunology. 13 (6), 560-568 (2012).
- Fu, G., et al. Themis sets the signal threshold for positive and negative selection in T-cell development. Nature. 504 (7480), 441-445 (2013).
- Rosenblum, M. D., Gratz, I. K., Paw, J. S., Abbas, A. K. Treating human autoimmunity: current practice and future prospects. Science Translational Medicine. 4 (125), (2012).
- Hebeisen, M., et al. SHP-1 phosphatase activity counteracts increased T cell receptor affinity. The Journal of Clinical Investigation. 123 (3), 1044-1056 (2013).
- Wang, R. E., et al. An immunosuppressive antibody-drug conjugate. Journal of the American Chemical Society. 137 (9), 3229-3232 (2015).
- Borroto, A., et al. First-in-class inhibitor of the T cell receptor for the treatment of autoimmune diseases. Science Translational Medicine. 8 (370), (2016).
- Chen, E. W., Brzostek, J., Gascoigne, N. R. J., Rybakin, V. Development of a screening strategy for new modulators of T cell receptor signaling and T cell activation. Scientific Reports. 8 (1), 10046 (2018).
- Fouda, A., Tahsini, M., Khodayarian, F., Al-Nafisah, F., Rafei, M. A Fluorescence-based Lymphocyte Assay Suitable for High-throughput Screening of Small Molecules. Journal of Visualized Experiments. (121), e55199 (2017).
- Zhao, Z., et al. A high-throughput phenotypic screen of cytotoxic T lymphocyte lytic granule exocytosis reveals candidate immunosuppressants. Journal of Biomolecular Screening. 20 (3), 359-371 (2015).
- Florian, A. E., et al. Flow cytometry enables a high-throughput homogeneous fluorescent antibody-binding assay for cytotoxic T cell lytic granule exocytosis. Journal of Biomolecular Screening. 18 (4), 420-429 (2013).
- Krutzik, P. O., Crane, J. M., Clutter, M. R., Nolan, G. P. High-content single-cell drug screening with phosphospecific flow cytometry. Nature Chemical Biology. 4 (2), 132-142 (2008).
- Vlahos, C. J., Matter, W. F., Hui, K. Y., Brown, R. F. A specific inhibitor of phosphatidylinositol 3-kinase, 2-(4-morpholinyl)-8-phenyl-4H-1-benzopyran-4-one (LY294002). The Journal of Biological Chemistry. 269 (7), 5241-5248 (1994).
- Chen, Z., et al. Synthesis and SAR of novel 4-morpholinopyrrolopyrimidine derivatives as potent phosphatidylinositol 3-kinase inhibitors. Journal of Medicinal Chemistry. 53 (8), 3169-3182 (2010).
- Ruegg, U. T., Burgess, G. M. Staurosporine, K-252 and UCN-01: potent but nonspecific inhibitors of protein kinases. Trends in Pharmacological Sciences. 10 (6), 218-220 (1989).
- Davis, P. D., et al. Inhibitors of protein kinase C. 1. 2,3-Bisarylmaleimides. Journal of Medicinal Chemistry. 35 (1), 177-184 (1992).
- Komander, D., et al. Interactions of LY333531 and other bisindolyl maleimide inhibitors with PDK1. Structure (London, England: 1993). 12 (2), 215-226 (2004).
- Gassel, M., et al. The protein kinase C inhibitor bisindolyl maleimide 2 binds with reversed orientations to different conformations of protein kinase A. The Journal of Biological Chemistry. 279 (22), 23679-23690 (2004).
- Faull, A., Johnstone, C., Morley, A., et al. . Novel compounds. , (2003).
- Favata, M. F., et al. Identification of a novel inhibitor of mitogen-activated protein kinase kinase. The Journal of Biological Chemistry. 273 (29), 18623-18632 (1998).
- Woods, C. M., Zhu, J., McQueney, P. A., Bollag, D., Lazarides, E. Taxol-induced mitotic block triggers rapid onset of a p53-independent apoptotic pathway. Molecular Medicine (Cambridge, MA). 1 (5), 506-526 (1995).
- Teng, X., et al. Structure-activity relationship study of novel necroptosis inhibitors. Bioorganic & Medicinal Chemistry Letters. 15 (22), 5039-5044 (2005).
- Saini, M., et al. Regulation of Zap70 expression during thymocyte development enables temporal separation of CD4 and CD8 repertoire selection at different signaling thresholds. Science Signaling. 3 (114), ra23 (2010).
- Chae, H. J., et al. Molecular mechanism of staurosporine-induced apoptosis in osteoblasts. Pharmacological Research. 42 (4), 373-381 (2000).
- Varas, A., et al. Analysis of the human neonatal thymus: evidence for a transient thymic involution. Journal of Immunology (Baltimore, MD:1950). 164 (12), 6260-6267 (2000).
- Verstichel, G., et al. The checkpoint for agonist selection precedes conventional selection in human thymus. Science Immunology. 2 (8), (2017).
- Yamaguchi, E., de Vries, J., Yssel, H. Differentiation of human single-positive fetal thymocytes in vitro into IL-4- and/or IFN-gamma-producing CD4+ and CD8+ T cells. International Immunology. 11 (4), 593-603 (1999).
- Farley, A. M., et al. Dynamics of thymus organogenesis and colonization in early human development. Development (Cambridge, UK). 140 (9), 2015-2026 (2013).
- Cali, J. J., et al. Bioluminescent assays for ADMET. Expert Opinion on Drug Metabolism & Toxicology. 4 (1), 103-120 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados