需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
斑马鱼内生应激研究的行为方法
摘要
这份手稿描述了一种测量成年斑马鱼压力行为的简单方法。该方法利用了斑马鱼在压力状态下更喜欢鱼缸的下半部分的固有倾向。我们还描述了将检测与药理学结合的方法。
摘要
适当地应对有压力的刺激是生物体生存所必需的。对广泛的与压力有关的疾病和精神障碍进行了广泛的研究, 但仍需进一步研究压力的遗传和神经元调节, 以开发更好的疗法。斑马鱼提供了一个强大的遗传模型来研究神经的基础的压力, 因为有大量的突变和转基因线的集合。此外, 药理可以很容易地应用于斑马鱼, 因为大多数药物可以直接添加到水中。我们在这里描述了使用 "新的坦克试验" 作为一种方法来研究斑马鱼的先天应激反应, 并演示如何使用该分析验证潜在的抗焦虑药物。该方法可以很容易地与携带基因突变的斑马鱼系, 或使用转基因方法操作精确神经电路的斑马鱼系结合在一起。该检测方法也可用于其他鱼类模型。总之, 所描述的协议应有助于其他实验室采用这种简单的检测方法。
引言
应激反应是潜在有害或厌恶性刺激所导致的行为和生理状态的改变。压力反应在整个动物王国是保守的, 对生物体的生存至关重要.几十年的研究极大地扩大了我们对压力状态背后的一些遗传和神经元机制的了解。今天, 大脑的区域, 如杏仁核和纹状体 2, 和遗传因素,如促肾上腺皮质激素释放激素(crh), 糖皮质激素(gr) 和矿物皮质激素受体(先生) 已经被广泛研究了3,4,5,6。尽管有这些重要发现, 但关于压力的遗传和神经元调节, 仍有许多未知数。因此, 许多与压力有关的疾病缺乏治疗方法。
遗传可修正的模型生物为研究行为的遗传和神经元控制提供了一个有用的工具。特别是鱼类模型的威力非常大: 它们是生成时间短的小生物, 在实验室环境中使用它们很容易, 它们的基因组很容易改变, 作为脊椎动物, 它们不仅具有遗传特性, 而且还具有神经解剖性同源与他们的哺乳动物同行7,8。测量压力的标准检测可以与携带基因突变的斑马鱼系搭配, 也可以与那些可以操纵精确神经元子集的斑马鱼系配对, 并且可以快速有效地评估单个基因或定义神经元的影响。
在行为上, 应激反应可以描述为活动过度活跃或长时间不活动 (类似于 "冷冻")9, 减少勘探 10, 快速呼吸, 减少食物摄入11, 和对储罐12 底部的首选。例如, 当放入一个不熟悉的鱼缸时, 成年斑马鱼和其他小鱼模型显示出对鱼缸下半部分的最初偏好, 然而, 随着时间的推移, 鱼开始以接近相等的频率12探索顶部和底部的一半。成人治疗已知的减少焦虑的药物会导致鱼类立即探索上半部分10,13.相反, 增加焦虑的药物会导致鱼类对鱼缸的下半部分表现出强烈的偏好,1 2、1 4、1 5.因此, 减少对储罐下半部分的勘探和偏好是简单可靠的应力指标。
与大多数脊椎动物一样, 鱼类的应激反应是由激活下丘脑-垂体-肾间轴 (hpi; 类似于哺乳动物的下丘脑-垂体-肾上腺轴) 14,16.下丘脑神经元表达激素促肾上腺皮质激素释放激素 (CRH) 信号的垂体, 这反过来又释放肾上腺皮质激素释放激素 (促肾上腺皮质激素)。促肾上腺皮质激素然后信号到肾间腺产生和分泌皮质醇, 它有许多下游目标 16, 其中之一是产生低温神经元 3,17的负反馈, 18,19。
在这里, 我们描述了一种评估先天压力行为度量的方法。对于这种行为, 我们详细介绍了使用新的坦克潜水试验12,14的协议。然后, 我们证明, 作为一个例子, 一个已知的抗焦虑药物, 布西酮, 减少压力的行为措施。
研究方案
该协议已获得佛罗里达大西洋大学动物护理和使用机构委员会的批准。
1. 准备工作
- 指定一个用于进行行为研究的隔离室, 或关闭房间的一部分, 使其被隔离。
注: 房间应不受干扰, 交通流量较低, 以避免干扰鱼的正常行为。 - 将下列材料和设备移入行为室: (一) 相机和镜头, (二) 可连接镜头的红外滤光片, (三) 相机支架, (四) 带有相机采集软件的计算机, (五) 可靠而稳定的表格进行检测(vi) 红外灯 (红外灯; 850 纳米或940纳米), (vii) 白色丙烯酸扩散器, 其长度超过记录罐 (viii) 1.8 L 梯形塑料分析罐 (称为 "新型罐"; 此处使用的一个是 12 x 18 英寸)和 (九) 一桶鱼系统的水。
注: 对于新型储罐, 我们的实验室使用市售塑料容器, 这些塑料容器的形状是梯形的。坦克的尺寸大约是 6 x 9 中的尺寸 (详细尺寸见图 1a)。我们使用的扩散器板比新型储罐略大 (12 英寸 x 18 英寸)。对形状不同的坦克进行了新的坦克试验, 例如矩形或不同梯形尺寸为 20、21的坦克。通常情况下, 鱼的行为是类似的所有坦克, 无论其尺寸: 对于所有的容器, 鱼最初更喜欢下半部分, 但随着时间的推移开始探索上半部更频繁。 - 将红外滤光片连接到相机镜头。红外光带的波长通常从850纳米到940纳米不等。该滤波器是一种远传滤波器, 可限制波长小于 720 nm 的光通过传输到摄像机。
- 为相机采集软件选择合适的参数。对于大多数录制, 将相机采集设置为每秒30帧, 并将录制持续时间设置为10分钟。
注: 这些参数可能会有所不同, 具体取决于实验。例如, 要研究一个新的坦克22,23的习惯, 可能需要更长的录音。
2. 设置
注: 本节中的步骤描述了新的储罐检测的设置。图 1b给出了最终产品的示意图。
- 把新的坦克放在桌子中央。
- 将红外灯放置在储罐后面, 并将白色丙烯酸片或扩散器屏幕放置在储罐和 LED 光源之间。
- 放置扩散器, 使其最大限度地传播来自 Led 的光, 并且光的强度足以照亮新的坦克。板子离光源越近, 灯光就会越明亮, 但扩散的越少。相比之下, 将扩散器板放置在远离光源的地方, 会降低光强, 但更好地传播光。
- 用鱼系水填充大约四分之三的新型水箱。
注: 系统用水是使用自来水反渗透产生的, 然后加药, 电导率等于 900±100μs, ph 值是中性的 (7.2), 温度为27±1°c。 - 将相机连接到相机支架, 并将相机连接到计算机。打开视频采集软件, 调整相机, 面对坦克的前部, 确保整个新颖的坦克都能看到, 视频中没有模糊的区域。调整坦克和红外灯, 以便通过相机观察到整个油箱有足够的照明。
注: 在继续进行实验之前, 执行试运行通常会很有用, 在试运行中捕获鱼的视频并执行跟踪。这将确保设置足以进行行为实验。
3. 新型储罐测试装置
- 准备一个250毫升的烧杯, 预先填充鱼系统的水, 和至少两个持有槽。
- 在测试的当天上午, 将至少10个测试的成年斑马鱼从鱼类设施转移到一个保管箱, 转移到行为室, 并使它们至少适应1种小时。
注: 在实验之前应进行功率分析, 但在我们手中, n = 10 通常足以检测统计意义。此外, 储罐每升水不应超过5人。一个小时的适应就足够了, 因为斑马鱼的成虫已经被证明在新的坦克22号后30分钟内就习惯了。此外, 行为节律受生理过程的影响, 因此, 在不同日期进行的实验复制应在相同的时间内进行。我们通常在上午11点到下午6点之间进行所有实验。 - 给坦克贴上标签, 使实验者对动物的状况或基因型视而不见。
注: 实验可以很容易地通过标记坦克使用字母或数字系统 (即, 一个坦克被标记为 "A", 另一个 "B" 等) 的实验被蒙蔽。没有参与实验的一方用这样的系统给坦克贴上标签, 并在分析完成之前掩盖实验者的身份。 - 使用网, 轻轻地将单个成人从步骤3.1 开始放置在预先填充的烧杯中。让成年鱼在烧杯中适应10分钟。
注: 记录成人的性别, 因为它可能是重要的后分析, 以寻找性别特定的差异。 - 在烧杯中适应后, 将鱼引入新的鱼缸 (设置在第1节) 中, 轻轻地将水和成人从烧杯中倒出。
- 在将成人引入新的鱼缸后, 开始相机录制, 并离开设置, 以防止对鱼的额外困扰。
- 录音完成后, 将个人从新的储罐中取出, 放入新的储罐中。
注: 应使用与步骤3.2 中的固定罐不同的储罐, 以防止对同一个体重复测试。 - 对每个成年人重复3.4 至 3.7, 直到所有动物都经过测试。
注: 除了致盲条件或基因型外, 随机试验。使用随机数生成器或任何允许随机数生成器在试验之间进行随机化的工具。这应该在实验之前完成, 以便在实验开始之前确定每个试验。 - 在所有测试结束时, 将鱼送回鱼类设施。
4. 药物预处理
注: 以下步骤的目的是比较个人在使用药物前后的行为。这种比较是通过首先进行步骤3.4 至3.6 中的新的坦克测试, 然后是药物治疗, 然后是第二次新的坦克测试来实现的 (图 3a)。
- 准备药物的库存解决方案, 包括积极和消极的控制。
注: 如果该药物以前已在文献中使用, 请找到适当的工作剂量并使用此方法。例如, 对于有代表性的结果中的 buspirone, 我们制作了100x 库存溶液, 并使用 0.05 mg/ml 作为最终浓度, 如文献13、20 所述。如果建议的剂量未知, 则应通过检查几种浓度来执行剂量响应曲线。设置更多的烧杯与连续稀释的药物。如果该药物不能在水中溶解, 请使用二甲基亚硫酸 (DMSO) 作为溶剂。 - 用系统水稀释250毫升烧杯中的药物到工作浓度。例如, 如果制造了100x 溶液, 则在系统水中稀释 1: 100。设置一个烧杯, 只使用系统水作为控制。
注: 如果在步骤3.1 中使用 DMSO 作为溶剂, 请在控制烧杯中使用相同数量的 DMSO。 - 在另一位研究人员的帮助下, 掩盖药物和控制烧杯的身份, 以确保测试仪在分析后之前对治疗条件视而不见。
注: 可以使用数字或字母系统。 - 按照步骤3.1 到3.6 执行新的坦克测试, 以获得基线行为应激反应。
- 基线记录后, 如步骤4.2 所述, 使用网立即将新的鱼缸中的成年鱼取出, 并将其放入用药物或车辆剂量的烧杯中。允许成人在烧杯中停留10分钟。
注: 确保网不会接触烧杯中的水, 以防止药物交叉污染。根据所使用的药物, 确保适当的剂量和给药时间。10分钟的治疗时间可能不适用于所有药物。 - 处理后, 使用网子将成人从步骤4.5 中的烧杯中取出, 并将其放置在另一个仅充满新鲜系统水的烧杯中。这是在第二次新的储罐试验中最大限度地减少进一步剂量的冲洗期。允许成人在洗掉的烧杯中多呆10分钟。
注: 应使用单独的网的每个药物条件, 以防止任何不必要的交叉治疗与药物。如果实验者愿意, 可以跳过冲洗期。 - 通过在上一步将该成人从烧杯中取出, 将其放置在新的新储罐中, 并按照3.5 至3.6 步进行步骤, 进行第二次坦克潜水测试。
- 第二次新的储罐试验结束后, 将个人取出到单独的储罐中。将系统水倒在第二新颖的水箱中, 然后在下一次测试中灌满新鲜的系统水。此步骤可防止任何药物的交叉污染。
注: 根据药物的半衰期, 含有药物的新鲜烧杯应每3小时制作一次。对于布西龙, 每3小时制作一次新的解决方案。此外, 按照步骤3.8 的说明, 试验应随机分为对照和药物治疗。 - 在所有试验结束时, 将个人送回鱼类设施。
注: 根据所使用的药物类型, 这些治疗对个人的影响可能是长期的。因此, 不要在其他实验中使用这些个体。
5. 视频分析
- 经过所有试验后, 将视频文件加载到所选择的跟踪软件中。
注: 我们通常使用商业上可用的跟踪软件, 但可以使用几个免费提供的软件包。实现跟踪的步骤可能因使用的软件包而异。 - 使用视频中的静止不动框架, 定义 (i) 充满水的整个新颖的坦克竞技场周围的假想边界, 以及 (二) 前三分之一、(iii) 中第三和 (iv) 坦克倒数第三的边界。使用这些来确定鱼在新的坦克的每个部分花费的时间。
- 为步骤5.2 中定义的每个竞技场计算每个帧的 x-y 位移。
- 定义储罐的顶部、中间和底部区域。每个区域的面积都应相似。确定这些区域的一个简单方法是计算 y 方向的坦克长度, 并将其除以3。
注: 对常规协议的更改确实存在。例如, 有些实验室使用一半而不是三分之二14。 - 确定在每个竞技场上花费的时间、距离和速度。
注: 大多数跟踪包将自动为用户计算这些。但是, 如果跟踪软件不这样做, 则可以轻松地从 x-y 位移值计算这些值。例如, 可以使用以下公式确定距离: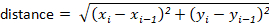
速度可以按照公式确定: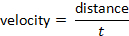
- 重复步骤5.2 至 5.4, 获取所有试验的轨道和测量值。
注: 对此常规协议的更改
6. 测试正常
- 在继续计算统计差异之前, 请先执行统计信息。检查数据是否通常使用 Shapiro-Wilk 测试进行分发。
- 如果数据通常分布的零假设被拒绝 (即数据不遵循高斯分布), 则使用非参数测试执行所有测试。相反, 如果发现数据遵循正态分布, 则继续使用参数测试。
注: 我们使用商业上可用的软件来执行统计;但是, 也可以使用 R 编程语言。可以使用 R 的变形测试功能来进行 Shapiro-Wilk 分析。
结果
研究斑马鱼的应激
为了观察野生斑马鱼在一段时间内的应激行为, 我们在新的储罐试验中测试了来自 AB 菌株24的成年鱼。AB 成年人受上述协议的影响。简单地说, 鱼在行为室的水箱里有1小时的适应期。一个人被放在烧杯里 1 0分钟, 然后轻轻地放在一个不熟悉的水箱 (新的水箱) 里, 里面装满了新鲜的系统水。记录了10分钟的昏迷活动, 并使用商业上...
讨论
斑马鱼在一个新的鱼缸中表现出强烈的应激反应
在这里, 我们描述了一种简单的行为方法来检查成年斑马鱼的应激反应, 并验证该方法作为一个简单的测量压力的药理学。
这种新型的储罐试验是一种广泛使用的试验, 用于检查斑马鱼和其他种类的 12、14、21、35、
披露声明
提交人声明, 他们没有竞争或经济利益。
致谢
这项工作得到了佛罗里达大西洋大学木星生命科学倡议向 ERD 和 ACK 提供的资金支持。这项工作还得到了国家卫生研究院 R21NS105071 (颁发给 ACK 和 ERD) 和 R15MH118625 (颁发给 ERD) 赠款的支持。
材料
| Name | Company | Catalog Number | Comments |
| Camera | We use Point Grey Grasshopper3 USB camera with lens from Edmund Optics. | ||
| Infrared filter | Edmund Optics | ||
| Video Acquisition Program | Use programs such as Virtualdub or FlyCapture because the acquisition framerate can be set. | ||
| Infrared LED lights | |||
| Assay tank | Aquaneering | Part number ZT180 | Size: M3 1.8 liter |
| Stand and clamp, or standard tripod for camera | |||
| 250mL beaker | |||
| Tracking software | We use Ethovision XT 13 from Noldus Information Technology | ||
| Buspirone chloride | Sigma-Aldrich | B7148 | |
| Randomized trial generator | We use the RANDBETWEEN function in Microsoft Excel |
参考文献
- McEwen, B. S. Stress, adaptation, and disease. Allostasis and allostatic load. Annals of the New York Academy of Sciences. 840, 33-44 (1998).
- Tovote, P., Fadok, J. P., Lüthi, A. Neuronal circuits for fear and anxiety. Nature Reviews Neuroscience. 16 (6), 317-331 (2015).
- Facchinello, N., et al. Nr3c1 null mutant zebrafish are viable and reveal DNA-binding-independent activities of the glucocorticoid receptor. Scientific Reports. 7 (4371), (2017).
- Ziv, L., et al. An affective disorder in zebrafish with mutation of the glucocorticoid receptor. Molecular Psychiatry. , (2013).
- Grone, B. P., Maruska, K. P. Divergent evolution of two corticotropin-releasing hormone (CRH) genes in teleost fishes. Frontiers in Neuroscience. , (2015).
- Fuller, P. J., Lim-Tio, S. S., Brennan, F. E. Specificity in mineralocorticoid versus glucocorticoid action. Kidney International. , (2000).
- Zhdanova, I. V. Sleep and its regulation in zebrafish. Reviews in the Neurosciences. 22 (1), 27-36 (2011).
- Patton, E. E., Zon, L. I. The art and design of genetic screens: zebrafish. Nature Reviews Genetics. , (2001).
- Duboué, E. R. E. R., Hong, E., Eldred, K. C. K. C., Halpern, M. E. M. E. Left Habenular Activity Attenuates Fear Responses in Larval Zebrafish. Current Biology. 27 (14), 2154-2162 (2017).
- Facchin, L., Duboue, E. R., Halpern, M. E. Disruption of Epithalamic Left-Right Asymmetry Increases Anxiety in Zebrafish. Journal of Neuroscience. 35 (48), 15847-15859 (2015).
- Øverli, &. #. 2. 1. 6. ;., Sørensen, C., Nilsson, G. E. Behavioral indicators of stress-coping style in rainbow trout: Do males and females react differently to novelty. Physiology and Behavior. , (2006).
- Levin, E. D., Bencan, Z., Cerutti, D. T. Anxiolytic effects of nicotine in zebrafish. Physiology & behavior. 90 (1), 54-58 (2007).
- Bencan, Z., Sledge, D., Levin, E. D. Buspirone, chlordiazepoxide and diazepam effects in a zebrafish model of anxiety. Pharmacology Biochemistry and Behavior. 94 (1), 75-80 (2009).
- Cachat, J., et al. Measuring behavioral and endocrine responses to novelty stress in adult zebrafish. Nature Protocols. 5 (11), 1786-1799 (2010).
- Mathuru, A. S., et al. Chondroitin fragments are odorants that trigger fear behavior in fish. Current Biology. , (2012).
- Alsop, D., Vijayan, M. The zebrafish stress axis: Molecular fallout from the teleost-specific genome duplication event. General and Comparative Endocrinology. , (2009).
- Evans, A. N., Liu, Y., MacGregor, R., Huang, V., Aguilera, G. Regulation of Hypothalamic Corticotropin-Releasing Hormone Transcription by Elevated Glucocorticoids. Molecular Endocrinology. , (2013).
- Fenoglio, K. A., Brunson, K. L., Avishai-Eliner, S., Chen, Y., Baram, T. Z. Region-specific onset of handling-induced changes in corticotropin- releasing factor and glucocorticoid receptor expression. Endocrinology. , (2004).
- Liposits, Z., et al. Ultrastructural localization of glucocorticoid receptor (GR) in hypothalamic paraventricular neurons synthesizing corticotropin releasing factor (CRF). Histochemistry. , (1987).
- Facchin, L., Duboué, E. R., Halpern, M. E. Disruption of epithalamic left-right asymmetry increases anxiety in Zebrafish. Journal of Neuroscience. 35 (48), (2015).
- Chin, J. S., et al. Convergence on reduced stress behavior in the Mexican blind cavefish. Developmental Biology. , (2018).
- Wong, K., et al. Analyzing habituation responses to novelty in zebrafish (Danio rerio). Behavioural Brain Research. 208 (2), 450-457 (2010).
- Matsunaga, W., Watanabe, E. Habituation of medaka (Oryzias latipes) demonstrated by open-field testing. Behavioural Processes. 85 (2), 142-150 (2010).
- Walker, C. Chapter 3 Haploid Screens and Gamma-Ray Mutagenesis. Methods in Cell Biology. , (1998).
- Rihel, J., et al. Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation. Science. 327, 348-351 (2010).
- Peal, D. S., Peterson, R. T., Milan, D. Small molecule screening in zebrafish. Journal of Cardiovascular Translational Research. , (2010).
- Murphey, R., Zon, L. Small molecule screening in the zebrafish. Methods. 39 (3), 255-261 (2006).
- Gammans, R. E., et al. Use of buspirone in patients with generalized anxiety disorder and coexisting depressive symptoms. A meta-analysis of eight randomized, controlled studies. Neuropsychobiology. 25 (4), 193-201 (1992).
- Maaswinkel, H., Zhu, L., Weng, W. The immediate and the delayed effects of buspirone on zebrafish (Danio rerio) in an open field test: A 3-D approach. Behavioural Brain Research. , (2012).
- Gebauer, D. L., et al. Effects of anxiolytics in zebrafish: Similarities and differences between benzodiazepines, buspirone and ethanol. Pharmacology Biochemistry and Behavior. , (2011).
- Maximino, C., et al. Fingerprinting of psychoactive drugs in zebrafish anxiety-like behaviors. PLoS ONE. , (2014).
- Horváth, J., Barkóczi, B., Müller, G., Szegedi, V. Anxious and nonanxious mice show similar hippocampal sensory evoked oscillations under urethane anesthesia: Difference in the effect of buspirone. Neural Plasticity. , (2015).
- Costall, B., Kelly, M. E., Naylor, R. J., Onaivi, E. S. Actions of buspirone in a putative model of anxiety in the mouse. Pharm Pharmacol. 40 (7), 494-500 (1988).
- Barros, M., Mello, E. L., Huston, J. P., Tomaz, C. Behavioral effects of buspirone in the marmoset employing a predator confrontation test of fear and anxiety. Pharmacology Biochemistry and Behavior. , (2001).
- Heinen-Kay, J. L., et al. Predicting multifarious behavioural divergence in the wild. Animal Behaviour. 121, 3-10 (2016).
- Thompson, R. R. J., Paul, E. S., Radford, A. N., Purser, J., Mendl, M. Routine handling methods affect behaviour of three-spined sticklebacks in a novel test of anxiety. Behavioural Brain Research. 306, 26-35 (2016).
- Hamilton, T. J., et al. Establishing zebrafish as a model to study the anxiolytic effects of scopolamine. Scientific Reports. , (2017).
- York, R. A., Fernald, R. D. The Repeated Evolution of Behavior. Frontiers in Ecology and Evolution. 4, 143 (2017).
- Jakka, N. M., Rao, T. G., Rao, J. V. Locomotor behavioral response of mosquitofish (Gambusia affinis) to subacute mercury stress monitored by video tracking system. Drug and Chemical Toxicology. , (2007).
- Hu, C. K., Brunet, A. The African turquoise killifish: A research organism to study vertebrate aging and diapause. Aging Cell. , (2018).
- Maximino, C., et al. Measuring anxiety in zebrafish: A critical review. Behavioural Brain Research. 214 (2), 157-171 (2010).
- Maximino, C., Marques de Brito, T., Dias, C. A. G., Gouveia, A., Morato, S. Scototaxis as anxiety-like behavior in fish. Nature protocols. 5 (2), 209-216 (2010).
- Godwin, J., Sawyer, S., Perrin, F., Oxendine, S., Kezios, Z. Adapting the Open Field Test to assess anxiety related behavior in zebrafish. Zebrafish Protocols for Neurobehavioral Research. , 181-189 (2012).
- Agetsuma, M., et al. The habenula is crucial for experience-dependent modification of fear responses in zebrafish. Nature Neuroscience. 13 (11), 1354-1356 (2010).
- Valente, A., Huang, K. H., Portugues, R., Engert, F. Ontogeny of classical and operant learning behaviors in zebrafish. Learning and Memory. , (2012).
- Baker, M. R., Goodman, A. C., Santo, J. B., Wong, R. Y. Repeatability and reliability of exploratory behavior in proactive and reactive zebrafish, Danio rerio. Scientific Reports. , (2018).
- Friedrich, R. W., Genoud, C., Wanner, A. A. Analyzing the structure and function of neuronal circuits in zebrafish. Frontiers in Neural Circuits. , 7 (2013).
- Friedrich, R. W., Jacobson, G. A., Zhu, P. Circuit Neuroscience in Zebrafish. Current Biology. 20 (8), (2010).
- Marquart, G. D., et al. A 3D Searchable Database of Transgenic Zebrafish Gal4 and Cre Lines for Functional Neuroanatomy Studies. Frontiers in Neural Circuits. , (2015).
- Randlett, O., et al. Whole-brain activity mapping onto a zebrafish brain atlas. Nature Methods. 12 (11), 1039-1046 (2015).
- Gupta, T., et al. Morphometric analysis and neuroanatomical mapping of the zebrafish brain. Methods. 1046 (18), 30011-30012 (2018).
- Marquart, G. D., et al. High-precision registration between zebrafish brain atlases using symmetric diffeomorphic normalization. GigaScience. , (2017).
- Ronneberger, O., et al. ViBE-Z: A framework for 3D virtual colocalization analysis in zebrafish larval brains. Nature Methods. , (2012).
- Subedi, A., et al. Adoption of the Q transcriptional regulatory system for zebrafish transgenesis. Methods. 66 (3), 433-440 (2014).
- Scheer, N., Campos-Ortega, J. A. Use of the Gal4-UAS technique for targeted gene expression in the zebrafish. Mechanisms of Development. 80 (2), 153-158 (1999).
- Chatterjee, D., Tran, S., Shams, S., Gerlai, R. A Simple Method for Immunohistochemical Staining of Zebrafish Brain Sections for c-fos Protein Expression. Zebrafish. , (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。