È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Approcci comportamentali allo studio dello stress innato nel zebrafish
In questo articolo
Riepilogo
Questo manoscritto descrive un metodo semplice per misurare la sollecitazione comportamentale in un pesce zebra adulto. L'approccio sfrutta la tendenza innata che il pesce zebra preferisce la metà inferiore di un serbatoio quando è in uno stato stressante. Descriviamo anche i metodi per accoppiare il saggio con la farmacologia.
Abstract
Rispondere in modo appropriato agli stimoli stressanti è essenziale per la sopravvivenza di un organismo. Una vasta ricerca è stata fatta su un ampio spettro di malattie legate allo stress e disturbi psichiatrici, eppure ulteriori studi sulla regolazione genetica e neuronale dello stress sono ancora necessari per sviluppare terapie migliori. Il pesce zebra fornisce un potente modello genetico per indagare le basi neurali dello stress, in quanto esiste una vasta collezione di linee mutanti e transgeniche. Inoltre, la farmacologia può essere facilmente applicata al pesce zebra, poiché la maggior parte dei farmaci può essere aggiunta direttamente all'acqua. Descriviamo qui l'uso del ' romanzo Tank test ' come metodo per studiare le risposte di stress innata nel pesce zebra e dimostrare come i potenziali farmaci ansiolitici possono essere convalidati utilizzando il saggio. Il metodo può essere facilmente accoppiato con linee pesce zebra che ospitano mutazioni genetiche, o quelle in cui vengono utilizzati approcci transgenici per manipolare precisi circuiti neurali. Il saggio può essere utilizzato anche in altri modelli di pesce. Insieme, il protocollo descritto dovrebbe facilitare l'adozione di questo semplice saggio ad altri laboratori.
Introduzione
Le risposte allo stress sono alterate comportamentali e gli stati fisiologici risultanti da stimoli potenzialmente dannosi o avsivi. Le risposte allo stress sono conservate in tutto il Regno animale e sono fondamentali per la sopravvivenza di un organismo1. Decenni di ricerca hanno notevolmente ampliato la nostra conoscenza di alcuni dei meccanismi genetici e neuronali alla base degli Stati di stress. Oggi, aree del cervello come l'amigdala e lo striato2, e fattori genetici come l' ormone rilasciante corticotropina (CRH), e i recettori glucocorticoidi (gr) e mineralocorticoidi ( Mr) sono stati studiati ampiamente3,4,5,6. Nonostante questi risultati critici, molto rimane sconosciuto sulla regolazione genetica e neuronale dello stress. Come tale, molti disturbi legati allo stress soffrono di una mancanza di terapie.
Organismi modello geneticamente emendabili forniscono uno strumento utile nello studio del controllo genetico e neuronale del comportamento. I modelli di pesce, in particolare, sono estremamente potenti: sono piccoli organismi con tempi di breve generazione, il loro uso in un ambiente di laboratorio è facile, i loro geniti sono facilmente modificati e, come un vertebrato, condividono non solo genetica, ma anche neuroanatomica omologia con le loro controparti di mammiferi7,8. I saggi standard per la misurazione dello stress possono essere abbinati a linee pesce zebra che ospitano mutazioni genetiche, o quelle in cui è possibile la manipolazione di precisi sottogruppi neuronali, e gli effetti di singoli geni o neuroni definiti possono essere valutati rapidamente ed efficientemente.
Comportamentoralmente, le risposte allo stress possono essere caratterizzate nel pesce come periodi di iper-attività o periodi prolungati di inattività (simile al "congelamento")9, ridotta esplorazione10, respirazione rapida, riduzione dell'assunzione di cibo11, e un posto-preferenza per il fondo di un serbatoio12. Ad esempio, se collocati in un serbatoio sconosciuto, i pesci zebra adulti e altri piccoli modelli di pesce mostrano una preferenza iniziale per la metà inferiore del serbatoio, eppure, nel corso del tempo, i pesci iniziano a esplorare le metà superiore e inferiore con una frequenza quasi uguale a12. Trattamento di adulti con farmaci noti per ridurre l'ansia causano pesci di esplorare immediatamente la metà superiore10,13. Al contrario, farmaci che aumentano l'ansia causano pesci a mostrare forte preferenza per la metà inferiore del serbatoio12,14,15. Così, ridotta esplorazione e preferenza per la metà inferiore del serbatoio sono indicatori semplici e affidabili di stress.
Come la maggior parte dei vertebrati, le risposte allo stress nei pesci sono guidate dall'attivazione dell'asse ipotalamo-ipofisi-Inter-renale (HPI; analogo all'asse ipotalamo-pituitario-surrenale [hPa] nei mammiferi)14,16. Neuroni ipotalamici che esprimono l'ormone corticotropin-releasing hormone (CRH) segnale per l'ipofisi, che a sua volta rilascia adrenocorticotropico rilascio dell'ormone (ACTH). ACTH poi segnala alla ghiandola Inter-renale per produrre e secernere cortisolo, che ha un numero di bersagli a valle16, uno dei quali è il feedback negativo dei neuroni ipotalamici che producono CRH3,17, 18,19.
Qui descriviamo un metodo per valutare le misure comportamentali dello stress innato. Per il comportamento, abbiamo dettagliato i protocolli utilizzando il romanzo Tank Diving test12,14. Abbiamo poi dimostrare, ad esempio, che un farmaco ansiolitico noto, Buspirone, riduce le misure comportamentali dello stress.
Protocollo
Il protocollo è stato approvato dal Comitato istituzionale per la cura degli animali e l'uso Committeeat Florida Atlantic University.
1. la preparazione
- Designare una stanza isolata per eseguire studi comportamentali o chiudere una sezione di una stanza in modo che sia isolata.
Nota: la stanza dovrebbe essere indisturbata e avere un basso traffico per evitare di disturbare il comportamento normale del pesce. - Spostare i seguenti materiali e attrezzature nella stanza comportamentale: (i) una fotocamera e un obiettivo, (II) un filtro a infrarossi che può essere attaccato alla lente, (III) un supporto per fotocamera, (IV) un computer con software di acquisizione della fotocamera, (v) una tabella stabile e solida per eseguire il test on, (vi) luci infrarosse (IR luci; 850 nm o 940 nm), (VII) un diffusore acrilico bianco, che è più lungo della lunghezza del serbatoio di registrazione (VIII) 1,8 L serbatoio di saggio in plastica trapezoidale (denominato "nuovo carro armato"; quello usato qui è 12 x 18 pollici) , e (IX) un secchio di acqua del sistema ittico.
Nota: per il nuovo carro armato, il nostro laboratorio utilizza recipienti di plastica disponibili in commercio, che sono di forma trapezoidale. Le dimensioni del serbatoio sono approssimativamente 6 in x 9 in (le dimensioni dettagliate sono fornite in Figura 1a). La scheda diffusore che usiamo è leggermente più grande del nuovo carro armato (12 in x 18 in). Nuovi esperimenti sui carri armati sono stati eseguiti con serbatoi aventi forme diverse, come quelle rettangolari o quelle con diverse dimensioni trapezoidali20,21. Tipicamente, il comportamento del pesce è simile in tutti i serbatoi indipendentemente dalle loro dimensioni: per tutti i contenitori, il pesce inizialmente preferisce la metà inferiore, eppure nel corso del tempo iniziano ad esplorare la metà superiore con una maggiore frequenza. - Collegare il filtro a infrarossi all'obiettivo della fotocamera. Le lunghezze d'onda delle strisce luminose infrarosse variano tipicamente da 850 a 940 nm. Il filtro è un filtro passa-lungo che limita la luce delle lunghezze d'onda inferiori a 720 Nm dalla trasmissione alla telecamera.
- Selezionare i parametri appropriati per il software di acquisizione della fotocamera. Per la maggior parte delle registrazioni, impostare l'acquisizione della fotocamera su una velocità di 30 fotogrammi al secondo e la durata di registrazione a 10 minuti.
Nota: questi parametri possono differire a seconda dell'esperimento. Ad esempio, per studiare l'abitudine in un nuovo carro armato22,23, possono essere richieste registrazioni più lunghe.
2. impostazione della configurazione
Nota: i passaggi descritti in questa sezione descrivono la configurazione del nuovo saggio del serbatoio. Un diagramma del prodotto finale è indicato nella Figura 1B.
- Posiziona il nuovo carro armato al centro del tavolo.
- Posizionare le luci infrarosse dietro il serbatoio e posizionare il foglio acrilico bianco o lo schermo diffusore tra il serbatoio e la sorgente luminosa a LED.
- Posizionare il diffusore in modo che si diffonde al massimo la luce proveniente dai LED, e l'intensità della luce è sufficiente per illuminare il nuovo serbatoio. Più la scheda è vicina alla sorgente luminosa, più luminose saranno le luci, ma meno diffonderanno. Al contrario, posizionare la scheda del diffusore lontano dalla sorgente luminosa ridurrà l'intensità della luce, ma diffonderà meglio la luce.
- Riempire circa tre quarti del nuovo carro armato con acqua del sistema di pesci.
Nota: l'acqua del sistema viene generata utilizzando l'osmosi inversa dell'acqua di rubinetto, seguita da un dosaggio tale che la conducibilità equivale a 900 ± 100 μS, che il pH è neutro (7,2) e che la temperatura è 27 ± 1 ° c. - Collegare la fotocamera al supporto della fotocamera e collegare la fotocamera al computer. Aprire il software di acquisizione video e regolare la fotocamera per affrontare la parte anteriore del serbatoio e assicurarsi che l'intero nuovo serbatoio può essere visto e che non ci sono aree oscurate nel video. Regolare il serbatoio e le luci a infrarossi in modo che vi sia sufficiente e uniforme illuminazione in tutto il serbatoio quando osservato attraverso la fotocamera.
Nota: prima di procedere agli esperimenti, spesso può essere utile eseguire un'esecuzione di prova, in cui viene catturato il video di un pesce e viene eseguito il tracciamento. Ciò garantirà che la configurazione sia sufficiente per la sperimentazione del comportamento.
3. nuova configurazione del test del serbatoio
- Preparare un becher da 250 ml pre-riempito con acqua del sistema del pesce e almeno due serbatoi di tenuta.
- Al mattino del test, trasferire almeno 10 pesce zebra adulti di prova da utilizzare per ogni condizione sperimentale (controlli e adulti sperimentali) dalla struttura di pesce in un serbatoio di detenzione, trasferirli nella stanza del comportamento e consentire loro di acclimatarsi per almeno un ora.
Nota: un'analisi di potenza deve essere eseguita prima della sperimentazione, ma nelle nostre mani, un n = 10 è di solito sufficiente per rilevare la significatività statistica. Inoltre, il serbatoio di mantenimento deve contenere non più di cinque individui per litro di acqua. Un'acclimatazione di un'ora è sufficiente in quanto gli adulti pesce zebra hanno dimostrato di abituarsi entro 30 minuti da un nuovo serbatoio22. Inoltre, i ritmi comportamentali sono influenzati dai processi circadiani, e quindi i replicati sperimentali eseguiti in giorni diversi devono essere eseguiti entro le stesse ore. In genere eseguiamo tutti gli esperimenti tra le ore di 11:00 e 6:00 PM. - Etichettare i serbatoi in modo tale che la condizione o il genotipo degli animali sia cieco allo sperimentatore.
Nota: gli esperimenti possono essere facilmente accecati allo sperimentatore etichettando i serbatoi utilizzando un sistema di lettere o numeri (ad esempio, un serbatoio è etichettato ' A ', un altro ' B ', ecc.). Una parte non coinvolta negli esperimenti etichetta i serbatoi con un sistema di questo tipo e maschera le identità dallo sperimentatore fino al completamento del post-analisi. - Utilizzando una rete, posizionare delicatamente un singolo adulto nel becher pre-riempito dal passaggio 3,1. Lasciate che i pesci adulti si acclimatano nel bicchiere per 10 minuti.
Nota: registrare il sesso dell'adulto, in quanto potrebbe essere importante post-analisi per cercare le differenze specifiche del sesso. - Dopo l'acclimatazione nel bicchiere, introdurre il pesce nel nuovo serbatoio (istituito nella sezione 1) versando delicatamente l'acqua e l'adulto dal beaker.
- Dopo aver introdotto l'adulto nel nuovo carro armato, avviare la registrazione della fotocamera e allontanarsi dalla configurazione per evitare ulteriori disagi al pesce.
- Una volta terminata la registrazione, rimuovere l'individuo dal nuovo serbatoio e posizionarlo in una nuova vasca di tenuta.
Nota: un serbatoio diverso da quello al passaggio 3,2 deve essere utilizzato per prevenire test ripetuti sugli stessi individui. - Ripetere i passaggi da 3,4 a 3,7 per ogni adulto fino a quando tutti gli animali sono stati testati.
Nota: oltre alle condizioni di accecamento o genotipi, randomizzare prove. Utilizzare un generatore di numeri casuali o qualsiasi strumento che consenta di randomizzare tra le prove. Questo dovrebbe essere fatto prima della sperimentazione in modo che ogni prova è determinata prima che gli esperimenti iniziano. - Al termine di tutte le prove, riportare il pesce alla struttura del pesce.
4. pretrattamento con farmaci
Nota: lo scopo dei seguenti passaggi è quello di confrontare il comportamento di un individuo prima e dopo l'uso di farmaci. Questo confronto è ottenuto eseguendo prima un nuovo test del serbatoio come nel passaggio 3,4 a 3,6, seguita da un trattamento farmacologico, e poi un secondo test del carro armato (Figura 3a).
- Preparare una soluzione di magazzino del farmaco, compresi i controlli positivi e negativi.
Nota: se il farmaco è stato precedentemente utilizzato in letteratura, trovare una dose di lavoro appropriata e utilizzare questo. Ad esempio, per Buspirone nei risultati rappresentativi, facciamo una soluzione di stock 100x e usiamo 0,05 mg/ml come concentrazione finale, come descritto nella letteratura13,20. Se la dose suggerita è sconosciuta, una curva di risposta alla dose deve essere eseguita esaminando diverse concentrazioni. Impostare più beaker con diluizioni seriali di droga. Se il farmaco non è dissolvibile in acqua, utilizzare dimetilsolfossido (DMSO) come solvente. - Diluire i farmaci alla concentrazione di lavoro in 250 mL di Becher con acqua di sistema. Ad esempio, se è stata effettuata una soluzione 100x, diluire 1:100 in acqua di sistema. Impostare un becher con solo acqua di sistema come un controllo.
Nota: se DMSO è stato usato come solvente nel passaggio 3,1, utilizzare un volume uguale di DMSO nel beaker di controllo. - Con l'aiuto di un altro ricercatore, mascherare le identità del farmaco e becher di controllo per garantire che il tester è cieco alle condizioni di trattamento fino a post-analisi.
Nota: è possibile utilizzare un numero o un sistema di lettere. - Eseguire un nuovo test del serbatoio seguendo i passaggi da 3,1 a 3,6 per ottenere una risposta di sollecitazione comportamentale di base.
- Dopo la registrazione di base, utilizzare una rete per rimuovere immediatamente il pesce adulto dal nuovo serbatoio e posizionarlo nel becher dosato con droga o veicolo, come descritto nel passaggio 4,2. Consenti all'adulto di rimanere nel bicchiere per 10 minuti.
Nota: assicurarsi che la rete non tocchi l'acqua nei becher per prevenire la contaminazione incrociata dei farmaci. Garantire il corretto dosaggio e il tempo di somministrazione a seconda del farmaco utilizzato. Un tempo di trattamento di 10 minuti potrebbe non funzionare per tutti i farmaci. - Dopo il trattamento, utilizzare una rete per rimuovere l'adulto dal becher al passo 4,5 e posizionarlo in un altro bicchiere riempito con acqua di sistema fresco solo. Questo è il periodo di washout per minimizzare l'ulteriore dosaggio durante il secondo nuovo test del serbatoio. Consentire all'adulto di rimanere nel becher di lavaggio per ulteriori 10 minuti.
Nota: le reti separate devono essere utilizzate per ogni condizione di farmaco per prevenire qualsiasi trattamento incrociato indesiderato con la droga. Il periodo di washout può essere saltato se lo sperimentatore desidera. - Eseguire il nuovo test di immersione serbatoio una seconda volta rimuovendo quell'adulto dal becher nel passaggio precedente, posizionarlo in un nuovo carro armato, e seguire i passaggi 3,5 a 3,6.
- Dopo il secondo nuovo test serbatoio, rimuovere l'individuo in un serbatoio di tenuta separato. Versare l'acqua del sistema nel secondo nuovo carro armato e riempirlo con acqua di sistema fresco per il prossimo test. Questo passaggio previene la contaminazione incrociata di qualsiasi farmaco.
Nota: a seconda del tempo di dimezzamento dei farmaci, Becher freschi contenenti farmaci devono essere effettuati ogni 3 ore. Per Buspirone, fare nuove soluzioni ogni 3 ore. Inoltre, seguendo la nota al passo 3,8, le sperimentazioni devono essere randomizzate tra i controlli e i trattamenti farmacologici. - Al termine di tutte le prove, riportare gli individui nella struttura di pesce.
Nota: a seconda del tipo di farmaco utilizzato, gli effetti di questi trattamenti su individui possono essere di lunga durata. Pertanto, non utilizzare questi individui in altri esperimenti.
5. analisi video
- Dopo tutte le prove, caricare i file video nel software di tracciamento di scelta.
Nota: in genere usiamo software di monitoraggio disponibili in commercio, ma possono essere utilizzati diversi pacchetti software disponibili gratuitamente. I passaggi per ottenere il tracciamento possono differire in base al pacchetto software utilizzato. - Usando un fermo fotogramma del video, Definisci i confini immaginari intorno a (i) l'intera arena del nuovo carro armato che è piena di acqua, e i confini intorno (II) il terzo superiore, (III) terzo medio, e (IV) terzo inferiore del serbatoio. Usarli per stabilire il tempo che il pesce speso in ogni porzione del nuovo carro armato.
- Calcola lo spostamento x-y per fotogramma per ogni arena definita nel passaggio 5,2.
- Definire le aree superiore, centrale e inferiore del serbatoio. Ogni regione dovrebbe essere di dimensioni simili. Un breve metodo per determinare queste regioni è quello di calcolare la lunghezza del serbatoio nella direzione y, e dividere questo per 3.
Nota: esistono variazioni al protocollo generale. Ad esempio, alcuni laboratori utilizzano metà anziché i terzi14. - Determinare il tempo trascorso in ogni Arena, la distanza e la velocità.
Nota: la maggior parte dei pacchetti di tracciamento calcolerà automaticamente questi per l'utente. Tuttavia, se il software di tracciamento non lo fa, questi possono essere calcolati facilmente dai valori di spostamento x-y. Ad esempio, la distanza può essere determinata utilizzando la formula: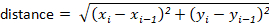
e la velocità possono essere determinate seguendo la formula: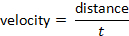
- Ripetere i passaggi da 5,2 a 5,4 per acquisire tracce e misurazioni per tutte le prove.
Nota: le variazioni di questo protocollo generale
6. test per la normalità
- Eseguire le statistiche prima di procedere al calcolo delle differenze statistiche. Verificare se i dati sono normalmente distribuiti utilizzando un test Shapiro-Wilk.
- Se l'ipotesi nulla che i dati sono normalmente distribuiti viene rifiutato (cioè, i dati non seguono una distribuzione gaussiana), eseguire tutti i test utilizzando test non parametrici. Viceversa, se i dati vengono trovati per seguire una distribuzione normale, procedere all'utilizzo di test parametrici.
Nota: usiamo software disponibili in commercio per eseguire statistiche; Tuttavia, è possibile utilizzare anche il linguaggio di programmazione R. Un'analisi di Shapiro-Wilk può essere eseguita utilizzando la funzione Shapiro. test di R.
Risultati
Esaminare lo stress nel pesce zebra
Per esaminare il comportamento dello stress nel tempo in zebra di tipo selvaggio, abbiamo testato il pesce adulto dal ceppo24 AB nel nuovo test del serbatoio. Gli adulti AB sono stati sottoposti al protocollo come descritto sopra. Brevemente, il pesce è stato dato un periodo di acclimatazione 1-h in un serbatoio nella stanza comportamento. Un individuo è stato collocato in un bicchiere per 10 minuti, e poi collocato...
Discussione
Zebrafish Mostra una solida risposta allo stress in un nuovo carro armato
Qui, descriviamo un approccio comportamentale semplice per esaminare le risposte di stress nel pesce zebra adulto, e convalidare l'approccio come una semplice misura di stress utilizzando farmacologia.
Il nuovo test del carro armato è un test ampiamente usato per esaminare lo stress innato nel pesce zebra e in altre specie di pesci12,14,
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari o concorrenti.
Riconoscimenti
Questo lavoro è stato sostenuto dai finanziamenti della Jupiter Life Science Initiative alla Florida Atlantic University fino a ERD e ACK. Quest'opera è stata sostenuta anche da sovvenzioni R21NS105071 (assegnate a ACK e ERD) e R15MH118625 (assegnate a ERD) presso gli istituti nazionali di sanità.
Materiali
| Name | Company | Catalog Number | Comments |
| Camera | We use Point Grey Grasshopper3 USB camera with lens from Edmund Optics. | ||
| Infrared filter | Edmund Optics | ||
| Video Acquisition Program | Use programs such as Virtualdub or FlyCapture because the acquisition framerate can be set. | ||
| Infrared LED lights | |||
| Assay tank | Aquaneering | Part number ZT180 | Size: M3 1.8 liter |
| Stand and clamp, or standard tripod for camera | |||
| 250mL beaker | |||
| Tracking software | We use Ethovision XT 13 from Noldus Information Technology | ||
| Buspirone chloride | Sigma-Aldrich | B7148 | |
| Randomized trial generator | We use the RANDBETWEEN function in Microsoft Excel |
Riferimenti
- McEwen, B. S. Stress, adaptation, and disease. Allostasis and allostatic load. Annals of the New York Academy of Sciences. 840, 33-44 (1998).
- Tovote, P., Fadok, J. P., Lüthi, A. Neuronal circuits for fear and anxiety. Nature Reviews Neuroscience. 16 (6), 317-331 (2015).
- Facchinello, N., et al. Nr3c1 null mutant zebrafish are viable and reveal DNA-binding-independent activities of the glucocorticoid receptor. Scientific Reports. 7 (4371), (2017).
- Ziv, L., et al. An affective disorder in zebrafish with mutation of the glucocorticoid receptor. Molecular Psychiatry. , (2013).
- Grone, B. P., Maruska, K. P. Divergent evolution of two corticotropin-releasing hormone (CRH) genes in teleost fishes. Frontiers in Neuroscience. , (2015).
- Fuller, P. J., Lim-Tio, S. S., Brennan, F. E. Specificity in mineralocorticoid versus glucocorticoid action. Kidney International. , (2000).
- Zhdanova, I. V. Sleep and its regulation in zebrafish. Reviews in the Neurosciences. 22 (1), 27-36 (2011).
- Patton, E. E., Zon, L. I. The art and design of genetic screens: zebrafish. Nature Reviews Genetics. , (2001).
- Duboué, E. R. E. R., Hong, E., Eldred, K. C. K. C., Halpern, M. E. M. E. Left Habenular Activity Attenuates Fear Responses in Larval Zebrafish. Current Biology. 27 (14), 2154-2162 (2017).
- Facchin, L., Duboue, E. R., Halpern, M. E. Disruption of Epithalamic Left-Right Asymmetry Increases Anxiety in Zebrafish. Journal of Neuroscience. 35 (48), 15847-15859 (2015).
- Øverli, &. #. 2. 1. 6. ;., Sørensen, C., Nilsson, G. E. Behavioral indicators of stress-coping style in rainbow trout: Do males and females react differently to novelty. Physiology and Behavior. , (2006).
- Levin, E. D., Bencan, Z., Cerutti, D. T. Anxiolytic effects of nicotine in zebrafish. Physiology & behavior. 90 (1), 54-58 (2007).
- Bencan, Z., Sledge, D., Levin, E. D. Buspirone, chlordiazepoxide and diazepam effects in a zebrafish model of anxiety. Pharmacology Biochemistry and Behavior. 94 (1), 75-80 (2009).
- Cachat, J., et al. Measuring behavioral and endocrine responses to novelty stress in adult zebrafish. Nature Protocols. 5 (11), 1786-1799 (2010).
- Mathuru, A. S., et al. Chondroitin fragments are odorants that trigger fear behavior in fish. Current Biology. , (2012).
- Alsop, D., Vijayan, M. The zebrafish stress axis: Molecular fallout from the teleost-specific genome duplication event. General and Comparative Endocrinology. , (2009).
- Evans, A. N., Liu, Y., MacGregor, R., Huang, V., Aguilera, G. Regulation of Hypothalamic Corticotropin-Releasing Hormone Transcription by Elevated Glucocorticoids. Molecular Endocrinology. , (2013).
- Fenoglio, K. A., Brunson, K. L., Avishai-Eliner, S., Chen, Y., Baram, T. Z. Region-specific onset of handling-induced changes in corticotropin- releasing factor and glucocorticoid receptor expression. Endocrinology. , (2004).
- Liposits, Z., et al. Ultrastructural localization of glucocorticoid receptor (GR) in hypothalamic paraventricular neurons synthesizing corticotropin releasing factor (CRF). Histochemistry. , (1987).
- Facchin, L., Duboué, E. R., Halpern, M. E. Disruption of epithalamic left-right asymmetry increases anxiety in Zebrafish. Journal of Neuroscience. 35 (48), (2015).
- Chin, J. S., et al. Convergence on reduced stress behavior in the Mexican blind cavefish. Developmental Biology. , (2018).
- Wong, K., et al. Analyzing habituation responses to novelty in zebrafish (Danio rerio). Behavioural Brain Research. 208 (2), 450-457 (2010).
- Matsunaga, W., Watanabe, E. Habituation of medaka (Oryzias latipes) demonstrated by open-field testing. Behavioural Processes. 85 (2), 142-150 (2010).
- Walker, C. Chapter 3 Haploid Screens and Gamma-Ray Mutagenesis. Methods in Cell Biology. , (1998).
- Rihel, J., et al. Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation. Science. 327, 348-351 (2010).
- Peal, D. S., Peterson, R. T., Milan, D. Small molecule screening in zebrafish. Journal of Cardiovascular Translational Research. , (2010).
- Murphey, R., Zon, L. Small molecule screening in the zebrafish. Methods. 39 (3), 255-261 (2006).
- Gammans, R. E., et al. Use of buspirone in patients with generalized anxiety disorder and coexisting depressive symptoms. A meta-analysis of eight randomized, controlled studies. Neuropsychobiology. 25 (4), 193-201 (1992).
- Maaswinkel, H., Zhu, L., Weng, W. The immediate and the delayed effects of buspirone on zebrafish (Danio rerio) in an open field test: A 3-D approach. Behavioural Brain Research. , (2012).
- Gebauer, D. L., et al. Effects of anxiolytics in zebrafish: Similarities and differences between benzodiazepines, buspirone and ethanol. Pharmacology Biochemistry and Behavior. , (2011).
- Maximino, C., et al. Fingerprinting of psychoactive drugs in zebrafish anxiety-like behaviors. PLoS ONE. , (2014).
- Horváth, J., Barkóczi, B., Müller, G., Szegedi, V. Anxious and nonanxious mice show similar hippocampal sensory evoked oscillations under urethane anesthesia: Difference in the effect of buspirone. Neural Plasticity. , (2015).
- Costall, B., Kelly, M. E., Naylor, R. J., Onaivi, E. S. Actions of buspirone in a putative model of anxiety in the mouse. Pharm Pharmacol. 40 (7), 494-500 (1988).
- Barros, M., Mello, E. L., Huston, J. P., Tomaz, C. Behavioral effects of buspirone in the marmoset employing a predator confrontation test of fear and anxiety. Pharmacology Biochemistry and Behavior. , (2001).
- Heinen-Kay, J. L., et al. Predicting multifarious behavioural divergence in the wild. Animal Behaviour. 121, 3-10 (2016).
- Thompson, R. R. J., Paul, E. S., Radford, A. N., Purser, J., Mendl, M. Routine handling methods affect behaviour of three-spined sticklebacks in a novel test of anxiety. Behavioural Brain Research. 306, 26-35 (2016).
- Hamilton, T. J., et al. Establishing zebrafish as a model to study the anxiolytic effects of scopolamine. Scientific Reports. , (2017).
- York, R. A., Fernald, R. D. The Repeated Evolution of Behavior. Frontiers in Ecology and Evolution. 4, 143 (2017).
- Jakka, N. M., Rao, T. G., Rao, J. V. Locomotor behavioral response of mosquitofish (Gambusia affinis) to subacute mercury stress monitored by video tracking system. Drug and Chemical Toxicology. , (2007).
- Hu, C. K., Brunet, A. The African turquoise killifish: A research organism to study vertebrate aging and diapause. Aging Cell. , (2018).
- Maximino, C., et al. Measuring anxiety in zebrafish: A critical review. Behavioural Brain Research. 214 (2), 157-171 (2010).
- Maximino, C., Marques de Brito, T., Dias, C. A. G., Gouveia, A., Morato, S. Scototaxis as anxiety-like behavior in fish. Nature protocols. 5 (2), 209-216 (2010).
- Godwin, J., Sawyer, S., Perrin, F., Oxendine, S., Kezios, Z. Adapting the Open Field Test to assess anxiety related behavior in zebrafish. Zebrafish Protocols for Neurobehavioral Research. , 181-189 (2012).
- Agetsuma, M., et al. The habenula is crucial for experience-dependent modification of fear responses in zebrafish. Nature Neuroscience. 13 (11), 1354-1356 (2010).
- Valente, A., Huang, K. H., Portugues, R., Engert, F. Ontogeny of classical and operant learning behaviors in zebrafish. Learning and Memory. , (2012).
- Baker, M. R., Goodman, A. C., Santo, J. B., Wong, R. Y. Repeatability and reliability of exploratory behavior in proactive and reactive zebrafish, Danio rerio. Scientific Reports. , (2018).
- Friedrich, R. W., Genoud, C., Wanner, A. A. Analyzing the structure and function of neuronal circuits in zebrafish. Frontiers in Neural Circuits. , 7 (2013).
- Friedrich, R. W., Jacobson, G. A., Zhu, P. Circuit Neuroscience in Zebrafish. Current Biology. 20 (8), (2010).
- Marquart, G. D., et al. A 3D Searchable Database of Transgenic Zebrafish Gal4 and Cre Lines for Functional Neuroanatomy Studies. Frontiers in Neural Circuits. , (2015).
- Randlett, O., et al. Whole-brain activity mapping onto a zebrafish brain atlas. Nature Methods. 12 (11), 1039-1046 (2015).
- Gupta, T., et al. Morphometric analysis and neuroanatomical mapping of the zebrafish brain. Methods. 1046 (18), 30011-30012 (2018).
- Marquart, G. D., et al. High-precision registration between zebrafish brain atlases using symmetric diffeomorphic normalization. GigaScience. , (2017).
- Ronneberger, O., et al. ViBE-Z: A framework for 3D virtual colocalization analysis in zebrafish larval brains. Nature Methods. , (2012).
- Subedi, A., et al. Adoption of the Q transcriptional regulatory system for zebrafish transgenesis. Methods. 66 (3), 433-440 (2014).
- Scheer, N., Campos-Ortega, J. A. Use of the Gal4-UAS technique for targeted gene expression in the zebrafish. Mechanisms of Development. 80 (2), 153-158 (1999).
- Chatterjee, D., Tran, S., Shams, S., Gerlai, R. A Simple Method for Immunohistochemical Staining of Zebrafish Brain Sections for c-fos Protein Expression. Zebrafish. , (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon