Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Zebrafish içinde doğuştan stres eğitimi için davranışsal yaklaşımlar
Bu Makalede
Özet
Bu yazıda yetişkin zebrafish stres davranışsal ölçmek için basit bir yöntem açıklanmaktadır. Yaklaşım, stresli bir durumda, zebra balığı bir tankın alt yarısını tercih ettiği doğuştan gelen eğilimin avantajlarından yararlanır. Biz de Farmakoloji ile tahlil bağlantı için yöntemleri tarif.
Özet
Stresli uyaranlara uygun şekilde yanıt vermek, bir organizmanın hayatta kalması için önemlidir. Kapsamlı araştırma stres ile ilgili hastalıklar ve psikiyatrik bozukluklar geniş bir spektrumunda yapılmış, henüz daha iyi terapötik geliştirmek için stres genetik ve nöronal düzenleme içine daha fazla çalışmalar hala gereklidir. Zebra balığı stres nöral temelleri araştırmak için güçlü bir genetik model sağlar, orada mutant ve transgenik hatları büyük bir koleksiyon var gibi. Ayrıca, farmakoloji kolayca zebrafish için uygulanabilir, çoğu ilaç doğrudan suya eklenebilir gibi. Biz zebrafish doğuştan stres tepkiler çalışması için bir yöntem olarak ' yeni tank testi ' kullanımı burada tarif ve nasıl potansiyel anksiyolitik ilaçlar tahlil kullanılarak doğrulanabilir gösterir. Yöntem kolayca genetik mutasyonlar içeren zebra balığı hatları ile birleşebilir, ya da hassas nöral devreleri manipüle etmek için transgenik yaklaşımlar kullanılır. Tahlil de diğer balık modellerinde kullanılabilir. Birlikte, açıklanan protokol diğer laboratuvarlara bu basit tahlil kabulü kolaylaştırmak gerekir.
Giriş
Stres tepkiler olası zararlı veya olumsuz uyaranlara kaynaklanan davranış ve fizyolojik durumları değiştirilir. Stres tepkiler Hayvan Krallığı boyunca temin edilir ve bir organizmanın hayatta kalması için önemlidir1. Yıllar süren araştırmalar, stres devletlerinin temelindeki genetik ve nöronal mekanizmalar hakkında bilgilerimizi büyük ölçüde genişletmiştir. Bugün, amigdala ve striatum2gibi beynin alanları ve kortikotropin serbest hormon (CRH) gibi genetik faktörler ve glukokortikoid (gr) ve mineralokortikoid reseptörleri ( Bay) kapsamlı3,4,5,6okudu. Bu kritik bulgulara rağmen, genetik ve nöronal stresin düzenlenmesi hakkında pek bilinmemektedir. Bu nedenle, birçok stres ile ilgili bozukluklar terapötik eksikliği muzdarip.
Genetiği değiştirilebilen model organizmalar, davranışların genetik ve nöronal kontrolünün çalışmasında yararlı bir araç sağlar. Balık modelleri, özellikle, son derece güçlüdür: onlar kısa nesil zaman ile küçük organizmalar, bir laboratuar ortamında kullanımı facile, onların genomları kolayca değiştirilebilir, ve, bir omurgası olarak, onlar sadece genetik paylaşmak, aynı zamanda nöroanatomik memeli meslektaşları ile Homoloji7,8. Stresi ölçmek için standart testler, genetik mutasyonlar içeren zebrafit hatları ile eşleştirilebilir veya hassas nöronal alt setlerin manipülasyonunun mümkün olduğu ve tek genlerin veya tanımlanmış nöronların etkileri hızla ve verimli bir şekilde değerlendirilebilir.
Davranışsal olarak, stres yanıtları, hiper-aktivite veya uzun süreli (' donma ')9, azaltılmış keşif10, hızlı nefes, azaltılmış gıda alımı11dönemleri olarak balık karakterize edilebilir ve bir yer-bir tank alt için tercih12. Örneğin, tanıdık olmayan bir tank içine yerleştirildiğinde, Yetişkin zebra balığı ve diğer küçük balık modelleri tankın alt yarısı için bir başlangıç tercihi gösterir, henüz, zamanla, Balık yakın eşit frekans12ile üst ve alt yarısı keşfetmeye başlar. Tedavi yetişkinlerin anksiyete neden balık hemen üst yarım10keşfetmek için bilinen ilaçlar ile,13. Bunun tersi olarak, endişeyi artıran ilaçlar, balık tankının alt yarısında güçlü bir tercih göstermesine neden olur12,14,15. Böylece, düşük keşif ve tank alt yarısında tercih stres basit ve güvenilir göstergeleri vardır.
Çoğu omurga gibi, balık stres tepkiler Hipotalamik-hipofiz-inter-renal eksen aktivasyonu ile tahrik edilir (HPI; memelilerde Hipotalamik-hipofiz-adrenal [hPa] eksenine benzer)14,16. Hipotalamik nöronlar hormon kortikotropin-serbest hormon ifade (CRH) hipofiz için sinyal, hangi sırayla serbest adrenokortikotropik hormon serbest (ACTH). ACTH o zaman inter-böbrek bezi üretmek ve salgıya kortizol, hangi aşağı hedefleri16, bunlardan biri CRHüreten hipotalamik nöronların negatif geribildirim olan bir dizi vardır sinyalleri3,17, 18,19.
Burada, doğuştan gelen stresin davranışsal önlemlerini değerlendirmek için bir yöntem tarif ediyoruz. Davranış için, biz detay protokolleri yeni tank dalış testi12,14kullanarak. Daha sonra, bir örnek olarak, bilinen bir anksiyolitik ilaç, Buspirone, stres davranışsal önlemleri azaltır göstermektedir.
Protokol
Protokol, kurumsal hayvan bakımı ve kullanım Komitesi Florida Atlantik Üniversitesi tarafından onaylanmıştır.
1. hazırlık
- Davranış etütler gerçekleştirmek için yalıtılmış bir oda belirleyin veya bir odanın bir bölümünü kapatmak için yalıtın.
Not: Oda bozulmamış olmalıdır ve balık normal davranışını kesintiye kaçınmak için düşük trafik var. - Aşağıdaki malzeme ve ekipman davranışsal odaya taşıyın: (i) bir kamera ve objektif, (ii) objektif bağlı olabilir bir kızılötesi filtre, (iii) bir kamera standı, (iv) kamera edinme yazılımı ile bir bilgisayar, (v) bir firma ve istikrarlı tablo tahlil gerçekleştirmek için , (vi) kızılötesi ışıklar (IR ışıkları; 850 nm veya 940 nm), (vii) kayıt tankının uzunluğundan daha uzun olan beyaz akrilik difüzör (VIII) 1,8 L trapez plastik tahlil tankı (' roman tankı ' olarak anılacaktır; burada kullanılan 12 x 18 inç) ve (IX) bir kova balık sistemi suyu.
Not: yeni tank için, laboratuvarımız, şekildeki trapez olan ticari olarak kullanılabilen plastik gemiler kullanır. Tankın boyutları yaklaşık olarak 6 x 9 ' da (ayrıntılı boyutlar Şekil 1A'da sağlanır). Kullandığınız difüzör panosu, yeni tanktan (12 ' si x 18 in) biraz daha büyüktür. Yeni tank deneyleri, dikdörtgen veya farklı trapez boyutları20,21olan olanlar gibi farklı şekillerde olan tanklarla gerçekleştirilmiştir. Genellikle, balık davranışı ne olursa olsun kendi boyutları tüm tanklarda benzer: Tüm konteynerler için, balık başlangıçta alt yarısını tercih, henüz zaman içinde daha büyük frekans ile üst yarısında keşfetmeye başlar. - Kızılötesi filtreyi kamera lensi ile bağlayın. Kızılötesi ışık şeritlerinin dalga boyları genellikle 850 nm 'den 940 nm 'ye kadar değişir. Filtre, kamera üzerinden 720 nm 'den daha az dalga boyu ışığı kısıtlayan uzun geçiş filtresine sahiptir.
- Kamera edinme yazılımı için uygun parametreleri seçin. Çoğu kayıt için, kamera edinimini saniyede 30 kare/saniye hızında ve kayıt süresini 10 dakikaya ayarlayın.
Not: Bu parametreler, denemeye bağlı olarak farklılık gösterebilir. Örneğin, bir roman tankında alışkanlık okumak için22,23, daha uzun kayıtlar gerekebilir.
2. Kurulum
Not: Bu bölümdeki adımlar yeni tank tahlil ayarlama açıklanmaktadır. Şekil 1B'de son ürünün bir diyagramı verilmiştir.
- Masanın ortasına yeni tankı yerleştirin.
- Kızılötesi ışıkları tankının arkasına konumlandırın ve beyaz akrilik levha veya difüzör ekranını tank ile LED ışık kaynağı arasına yerleştirin.
- Difüzör yerleştirin böylece LED 'Ler gelen ışık maksimum yayılır ve ışığın yoğunluğu roman tankı aydınlatmak için yeterlidir. Yakın tahta ışık kaynağına, daha parlak ışıklar olacak, henüz daha az diffuz olacaktır. Bunun tersine, difüzör kartını ışık kaynağından uzağa yerleştirmek ışık yoğunluğunu azaltır, ancak ışığı daha iyi yayacak.
- Balık sistemi suyu ile roman tankının yaklaşık dörtte üçünü doldurun.
Not: sistem suyu, musluk suyunun ters osmoz kullanılarak üretilir, böylece iletkenlik 900 ± 100 μS 'ye eşittir, pH nötr (7,2) ve sıcaklık 27 ± 1 °C ' dir. - Kamerayı kamera standında takın ve kamerayı bilgisayara bağlayın. Video edinme yazılımı açın ve tank ön yüz ve tüm roman tankı görülebilir ve video hiçbir gizlenmiş alanlar vardır sağlamak için kamerayı ayarlayın. Kamera aracılığıyla gözlenen tank boyunca yeterli ve hatta aydınlatma var gibi tank ve kızılötesi ışıkları ayarlayın.
Not: deneylere geçmeden önce, bir balık videosunu yakalanan ve izleme gerçekleştirildiği bir deneme çalışması gerçekleştirmek için genellikle yararlı olabilir. Bu, Kur 'un davranış denemesi için yeterli olmasını sağlayacaktır.
3. yeni tank testi kurulumu
- Bir 250 ml kabı balık sistemi su ile önceden dolu hazırlamak ve en az iki tutma tankları.
- Test sabahı, en az 10 test yetişkin zebra balığı her deneysel durum (kontroller ve deneysel yetişkinler) bir tutma tankı içine balık tesisinden kullanılmak üzere transfer, davranış odasına aktarmak ve en az bir için gelmesini izin Saat.
Not: bir güç analizi denenmeden önce yapılmalıdır, henüz bizim elimizde, bir n = 10 istatistiksel önemini algılamak için genellikle yeterlidir. Dahası, tutma tankı litre su başına beş kişiden fazlasını içermelidir. Zebra balığı yetişkinler yeni bir tank22dakika içinde habituate gösterilmiştir olarak bir saat bir aklimasyon yeterlidir. Ayrıca, davranışsal ritimler sirkadiyen süreçlerden etkilenir ve böylece farklı günlerde yapılan deneysel çoğaltır aynı saatler içinde yapılmalıdır. Biz genellikle 11:00 saat arasında tüm deneyler gerçekleştirmek ve 6:00 PM. - Tanklara, hayvanların durumunun veya genotipinin denemeler için kör olduğu şekilde etiketleyin.
Not: denemeler, bir mektup veya sayı sistemi kullanarak tankları etiketleme yoluyla deneylere kolayca kör edilebilir (yani, bir tank ' A ', başka bir ' B ', vb. olarak etiketlenmiştir). Deneylere dahil olmayan bir parti, tankları böyle bir sistemle etiketleyebilir ve deneme sonrası kimliklerinizi, post-analiz tamamlandıktan sonra maskeler. - Bir NET kullanarak, nazikçe adım 3,1 önceden doldurulmuş kabı tek bir yetişkin yerleştirin. Yetişkin balık 10 dakika boyunca kabı içinde gelmesini izin verin.
Not: cinsiyete özgü farklılıklar aramak için önemli post-analiz olabilir gibi, yetişkin seks kaydedin. - Beaker sonra aklimasyon, yeni tank içine balık tanıtmak (Bölüm 1) yavaşça Beaker su ve yetişkin dışarı dökme tarafından kurmak.
- Yeni tank içine yetişkin tanıttıktan sonra, kamera kaydını başlatın ve balık ek sıkıntı önlemek için kurulum uzağa taşıyın.
- Kayıt bittikten sonra, tek bir yeni tank ve bir tutma tankı içine yerden bireysel çıkarın.
Not: aynı bireylerde tekrarlanan testleri önlemek için 3,2 adımda birinden farklı bir tutma tankı kullanılmalıdır. - Tüm hayvanlar test edilinceye kadar her yetişkin için 3,7 3,4 adımları yineleyin.
Not: kör edici koşullara veya genotiplere ek olarak, denemeleri rasgele yapın. Rasgele bir sayı jeneratör veya bir denemeler arasında rastgele sağlayan herhangi bir araç kullanın. Denemeler başlamadan önce her deneme belirlenir böylece bu deneme önce yapılmalıdır. - Tüm testlerin sonunda, balıkları balık tesisine geri dönün.
4. ilaç ile ön tedavi
Not: aşağıdaki adımların amacı, ilaçların kullanımından önce ve sonra bireyin davranışını karşılaştırmak. Bu karşılaştırma ilk olarak yeni bir tank testi gerçekleştirerek elde edilir adım 3,4 olarak 3,6, ilaç tedavisi ve ardından ikinci bir roman tank testi (Şekil 3a).
- Pozitif ve negatif kontroller dahil olmak üzere ilacın stok çözümünü hazırlayın.
Not: ilaç daha önce literatürde kullanılırsa, uygun bir çalışma dozu bulun ve bunu kullanın. Örneğin, temsili sonuçlar buspiron için, biz bir 100x stok çözüm yapmak ve kullanım 0,05 mg/ml son konsantrasyon olarak, literatürde açıklandığı gibi13,20. Önerilen doz bilinmiyor ise, birkaç konsantrasyonları inceleyerek bir doz yanıt eğrisi yapılmalıdır. Uyuşturucu seri dilüsyonları ile daha fazla kadehler ayarlayın. İlaç suda çözülebilir değilse, bir solvent olarak dimetil sülventid (DMSO) kullanın. - 250 ml kadehler sistem su ile konsantrasyon çalışma ilaçlar seyreltir. Örneğin, 100x çözelti yapılırsa, sistem suyunda seyreltmeli 1:100. Kontrol olarak sadece sistem suyu ile bir kabı ayarlayın.
Not: DMSO, adım 3,1 bir çözücü olarak kullanılırsa, kontrol kabı içinde DMSO eşit bir hacim kullanın. - Başka bir araştırmacı yardımıyla, ilaç ve kontrol kadehler kimliklerini maskelemek Tester sonrası analiz kadar tedavi koşullarına kör olmasını sağlamak için.
Not: bir sayı veya mektup sistemi kullanılabilir. - 3,1, temel davranışsal stres yanıtı elde etmek için 3,6 ile ilgili adımları izleyerek yeni bir tank testi gerçekleştirin.
- Temel kayıt sonra, hemen yeni tank yetişkin balık kaldırmak ve ilaç veya araç ile dozlu kabı yerleştirmek için bir net kullanın, adım 4,2 açıklandığı gibi. Yetişkin 10 dakika boyunca kabı kalmak için izin verin.
Not: net, ilaçların çapraz kontaminasyonunu önlemek için beaklardaki suya dokunmadığından emin olun. Kullanılan ilaç bağlı olarak uygun doz ve yönetim süresi emin olun. 10 dakika tedavi süresi tüm ilaçlar için çalışamayabilir. - Tedavi sonrası, adım 4,5 içinde kabı yetişkin kaldırmak için bir net kullanın ve başka bir kabı sadece taze sistem suyu ile dolu yerleştirin. Bu, ikinci yeni tank testi sırasında dozajı en aza indirmek için yıkım dönemdir. Yetişkin bir ek 10 dakika yıkanmasına kalmak için izin verin.
Not: ilaç ile herhangi bir istenmeyen çapraz tedavi önlemek için her ilaç durumu için ayrı ağlar kullanılmalıdır. Deneylerin istekleri durumunda yıkama süresi atlanabilir. - Önceki adımda kabı Bu yetişkin kaldırarak ikinci bir kez yeni tank dalış testi gerçekleştirin, New Roman tankı yerleştirin ve 3,6 için 3,5 adımları izleyin.
- İkinci yeni tank testinden sonra, kişiyi ayrı bir tutma tankına çıkarın. İkinci roman tankı sistem suyu dökmek ve bir sonraki test için taze sistem suyu ile doldurun. Bu adım, herhangi bir ilacın çapraz kontaminasyonunu önler.
Not: ilaçların yarı ömrü bağlı olarak, her 3 saatte bir ilaç içeren taze bezeler yapılmalıdır. Buspirone için, her 3 saatte bir taze çözümler yapın. Buna ek olarak, adım 3,8 notun ardından, testler ve ilaç tedavileri arasında denemeler randomize edilmelidir. - Tüm denemelerin sonunda, kişileri balık tesisine geri dönün.
Not: kullanılan ilacın türüne bağlı olarak, bu tedavilerin bireyler üzerinde etkileri uzun ömürlü olabilir. Bu nedenle, diğer deneylerde bu kişileri kullanmayın.
5. video analizi
- Tüm denemeler sonra, seçim izleme yazılımı içine video dosyalarını yükleyin.
Not: genellikle ticari olarak kullanılabilen izleme yazılımı kullanıyoruz, ancak serbestçe kullanılabilen birçok yazılım paketi kullanılabilir. İzleme elde etme adımları kullanılan yazılım paketine göre farklılık gösterebilir. - Videodan hala bir çerçeve kullanarak, (i) çevresindeki hayali sınırları (i) su ile dolu tüm yeni tank Arenası ve çevresindeki sınırlar (ii) üst üçüncü, (iii) ikinci üçüncü, ve (iv) tankının alt üçte biri olarak tanımlayın. Balık roman tankının her bölümünde harcanan zaman kurmak için bunları kullanın.
- 5,2 adımda tanımlanan her arenada kare başına x-y yer değiştirmesi hesaplayın.
- Tankın üst, orta ve alt alanlarını tanımlayın. Her bölge boyutu benzer olmalıdır. Bu bölgelerin belirlenmesi için kısa bir yöntem, y yönünde tank uzunluğunu hesaplamak ve bu 3 ile bölmek etmektir.
Not: genel protokol varyasyonları var. Örneğin, bazı laboratuvarlar üçte biri yerine yarısını kullanır14. - Her arenada, mesafeye ve hızda harcanan süreyi belirleyin.
Not: çoğu izleme paketleri Kullanıcı için otomatik olarak hesaplar. Ancak, izleme yazılımı yoksa, bunlar x-y yer değiştirme değerlerinden kolayca hesaplanabilir. Örneğin, uzaklık formül kullanılarak belirlenebilir: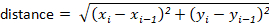
ve hız formülü takiben tespit edilebilir: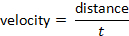
- Tüm denemeler için parça ve ölçümler almak için 5,4 5,2 adımları yineleyin.
Not: Bu genel protokol varyasyonları
6. normallik için test
- İstatistiksel farklılıkları hesaplamak için geçmeden önce istatistikleri gerçekleştirin. Verilerin normal olarak bir Shapiro-Wilk testi kullanılarak dağıtılıp dağıtılacağını kontrol edin.
- Verilerin normalde dağıtıldığı boş varsayım reddedilirse (yani, veriler bir Gauss dağıtımını izlemez), parametrik olmayan testler kullanarak tüm testleri gerçekleştirin. Bunun tersi olarak, veriler normal bir dağılımın takibinde bulunursa, parametrik testler kullanmaya devam edin.
Not: istatistik gerçekleştirmek için ticari olarak kullanılabilen yazılımları kullanırız; Ancak, R programlama dili de kullanılabilir. Bir Shapiro-Wilk analizi, R 'nin Shapiro. test işlevi kullanılarak gerçekleştirilebilir.
Sonuçlar
Zebra balığı 'te stres incelenmesi
Vahşi tip zebrafish zaman içinde stres davranışını incelemek için, biz yeni tank testinde AB gerinim24 yetişkin balık test. AB yetişkinleri, yukarıda açıklandığı gibi protokole tabi tutulmuştur. Kısaca, Balık davranış odasında bir tankta 1-h iklimlendirme dönemi verildi. Bir birey 10 dakika boyunca bir kabı yerleştirilir ve daha sonra yavaşça taze sistem suyu ile dolu bir tanıdık olmayan...
Tartışmalar
Zebrafish, yeni bir tankta sağlam bir stres tepkisi sergiler
Burada, Yetişkin zebrafish stres yanıtlarını incelemek için basit bir davranışsal yaklaşım tarif, ve farmakoloji kullanarak stres basit bir ölçü olarak yaklaşımı doğrulamak.
Yeni tank testi, zebra balığı ve diğer balık türlerinde doğuştan gelen stresin incelenmesi için yaygın olarak kullanılan bir testtir12,14,
Açıklamalar
Yazarlar, rakip veya mali çıkarları olmadığını beyan ederler.
Teşekkürler
Bu çalışma, Jüpiter yaşam bilimi girişimi 'nden Florida Atlantic University 'de ERD ve ACK 'e fon tarafından destekleniyordu. Bu çalışma Ayrıca hibe R21NS105071 (ACK ve ERD) ve R15MH118625 (ERD) Ulusal Sağlık Enstitüleri 'nden verilir tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Camera | We use Point Grey Grasshopper3 USB camera with lens from Edmund Optics. | ||
| Infrared filter | Edmund Optics | ||
| Video Acquisition Program | Use programs such as Virtualdub or FlyCapture because the acquisition framerate can be set. | ||
| Infrared LED lights | |||
| Assay tank | Aquaneering | Part number ZT180 | Size: M3 1.8 liter |
| Stand and clamp, or standard tripod for camera | |||
| 250mL beaker | |||
| Tracking software | We use Ethovision XT 13 from Noldus Information Technology | ||
| Buspirone chloride | Sigma-Aldrich | B7148 | |
| Randomized trial generator | We use the RANDBETWEEN function in Microsoft Excel |
Referanslar
- McEwen, B. S. Stress, adaptation, and disease. Allostasis and allostatic load. Annals of the New York Academy of Sciences. 840, 33-44 (1998).
- Tovote, P., Fadok, J. P., Lüthi, A. Neuronal circuits for fear and anxiety. Nature Reviews Neuroscience. 16 (6), 317-331 (2015).
- Facchinello, N., et al. Nr3c1 null mutant zebrafish are viable and reveal DNA-binding-independent activities of the glucocorticoid receptor. Scientific Reports. 7 (4371), (2017).
- Ziv, L., et al. An affective disorder in zebrafish with mutation of the glucocorticoid receptor. Molecular Psychiatry. , (2013).
- Grone, B. P., Maruska, K. P. Divergent evolution of two corticotropin-releasing hormone (CRH) genes in teleost fishes. Frontiers in Neuroscience. , (2015).
- Fuller, P. J., Lim-Tio, S. S., Brennan, F. E. Specificity in mineralocorticoid versus glucocorticoid action. Kidney International. , (2000).
- Zhdanova, I. V. Sleep and its regulation in zebrafish. Reviews in the Neurosciences. 22 (1), 27-36 (2011).
- Patton, E. E., Zon, L. I. The art and design of genetic screens: zebrafish. Nature Reviews Genetics. , (2001).
- Duboué, E. R. E. R., Hong, E., Eldred, K. C. K. C., Halpern, M. E. M. E. Left Habenular Activity Attenuates Fear Responses in Larval Zebrafish. Current Biology. 27 (14), 2154-2162 (2017).
- Facchin, L., Duboue, E. R., Halpern, M. E. Disruption of Epithalamic Left-Right Asymmetry Increases Anxiety in Zebrafish. Journal of Neuroscience. 35 (48), 15847-15859 (2015).
- Øverli, &. #. 2. 1. 6. ;., Sørensen, C., Nilsson, G. E. Behavioral indicators of stress-coping style in rainbow trout: Do males and females react differently to novelty. Physiology and Behavior. , (2006).
- Levin, E. D., Bencan, Z., Cerutti, D. T. Anxiolytic effects of nicotine in zebrafish. Physiology & behavior. 90 (1), 54-58 (2007).
- Bencan, Z., Sledge, D., Levin, E. D. Buspirone, chlordiazepoxide and diazepam effects in a zebrafish model of anxiety. Pharmacology Biochemistry and Behavior. 94 (1), 75-80 (2009).
- Cachat, J., et al. Measuring behavioral and endocrine responses to novelty stress in adult zebrafish. Nature Protocols. 5 (11), 1786-1799 (2010).
- Mathuru, A. S., et al. Chondroitin fragments are odorants that trigger fear behavior in fish. Current Biology. , (2012).
- Alsop, D., Vijayan, M. The zebrafish stress axis: Molecular fallout from the teleost-specific genome duplication event. General and Comparative Endocrinology. , (2009).
- Evans, A. N., Liu, Y., MacGregor, R., Huang, V., Aguilera, G. Regulation of Hypothalamic Corticotropin-Releasing Hormone Transcription by Elevated Glucocorticoids. Molecular Endocrinology. , (2013).
- Fenoglio, K. A., Brunson, K. L., Avishai-Eliner, S., Chen, Y., Baram, T. Z. Region-specific onset of handling-induced changes in corticotropin- releasing factor and glucocorticoid receptor expression. Endocrinology. , (2004).
- Liposits, Z., et al. Ultrastructural localization of glucocorticoid receptor (GR) in hypothalamic paraventricular neurons synthesizing corticotropin releasing factor (CRF). Histochemistry. , (1987).
- Facchin, L., Duboué, E. R., Halpern, M. E. Disruption of epithalamic left-right asymmetry increases anxiety in Zebrafish. Journal of Neuroscience. 35 (48), (2015).
- Chin, J. S., et al. Convergence on reduced stress behavior in the Mexican blind cavefish. Developmental Biology. , (2018).
- Wong, K., et al. Analyzing habituation responses to novelty in zebrafish (Danio rerio). Behavioural Brain Research. 208 (2), 450-457 (2010).
- Matsunaga, W., Watanabe, E. Habituation of medaka (Oryzias latipes) demonstrated by open-field testing. Behavioural Processes. 85 (2), 142-150 (2010).
- Walker, C. Chapter 3 Haploid Screens and Gamma-Ray Mutagenesis. Methods in Cell Biology. , (1998).
- Rihel, J., et al. Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation. Science. 327, 348-351 (2010).
- Peal, D. S., Peterson, R. T., Milan, D. Small molecule screening in zebrafish. Journal of Cardiovascular Translational Research. , (2010).
- Murphey, R., Zon, L. Small molecule screening in the zebrafish. Methods. 39 (3), 255-261 (2006).
- Gammans, R. E., et al. Use of buspirone in patients with generalized anxiety disorder and coexisting depressive symptoms. A meta-analysis of eight randomized, controlled studies. Neuropsychobiology. 25 (4), 193-201 (1992).
- Maaswinkel, H., Zhu, L., Weng, W. The immediate and the delayed effects of buspirone on zebrafish (Danio rerio) in an open field test: A 3-D approach. Behavioural Brain Research. , (2012).
- Gebauer, D. L., et al. Effects of anxiolytics in zebrafish: Similarities and differences between benzodiazepines, buspirone and ethanol. Pharmacology Biochemistry and Behavior. , (2011).
- Maximino, C., et al. Fingerprinting of psychoactive drugs in zebrafish anxiety-like behaviors. PLoS ONE. , (2014).
- Horváth, J., Barkóczi, B., Müller, G., Szegedi, V. Anxious and nonanxious mice show similar hippocampal sensory evoked oscillations under urethane anesthesia: Difference in the effect of buspirone. Neural Plasticity. , (2015).
- Costall, B., Kelly, M. E., Naylor, R. J., Onaivi, E. S. Actions of buspirone in a putative model of anxiety in the mouse. Pharm Pharmacol. 40 (7), 494-500 (1988).
- Barros, M., Mello, E. L., Huston, J. P., Tomaz, C. Behavioral effects of buspirone in the marmoset employing a predator confrontation test of fear and anxiety. Pharmacology Biochemistry and Behavior. , (2001).
- Heinen-Kay, J. L., et al. Predicting multifarious behavioural divergence in the wild. Animal Behaviour. 121, 3-10 (2016).
- Thompson, R. R. J., Paul, E. S., Radford, A. N., Purser, J., Mendl, M. Routine handling methods affect behaviour of three-spined sticklebacks in a novel test of anxiety. Behavioural Brain Research. 306, 26-35 (2016).
- Hamilton, T. J., et al. Establishing zebrafish as a model to study the anxiolytic effects of scopolamine. Scientific Reports. , (2017).
- York, R. A., Fernald, R. D. The Repeated Evolution of Behavior. Frontiers in Ecology and Evolution. 4, 143 (2017).
- Jakka, N. M., Rao, T. G., Rao, J. V. Locomotor behavioral response of mosquitofish (Gambusia affinis) to subacute mercury stress monitored by video tracking system. Drug and Chemical Toxicology. , (2007).
- Hu, C. K., Brunet, A. The African turquoise killifish: A research organism to study vertebrate aging and diapause. Aging Cell. , (2018).
- Maximino, C., et al. Measuring anxiety in zebrafish: A critical review. Behavioural Brain Research. 214 (2), 157-171 (2010).
- Maximino, C., Marques de Brito, T., Dias, C. A. G., Gouveia, A., Morato, S. Scototaxis as anxiety-like behavior in fish. Nature protocols. 5 (2), 209-216 (2010).
- Godwin, J., Sawyer, S., Perrin, F., Oxendine, S., Kezios, Z. Adapting the Open Field Test to assess anxiety related behavior in zebrafish. Zebrafish Protocols for Neurobehavioral Research. , 181-189 (2012).
- Agetsuma, M., et al. The habenula is crucial for experience-dependent modification of fear responses in zebrafish. Nature Neuroscience. 13 (11), 1354-1356 (2010).
- Valente, A., Huang, K. H., Portugues, R., Engert, F. Ontogeny of classical and operant learning behaviors in zebrafish. Learning and Memory. , (2012).
- Baker, M. R., Goodman, A. C., Santo, J. B., Wong, R. Y. Repeatability and reliability of exploratory behavior in proactive and reactive zebrafish, Danio rerio. Scientific Reports. , (2018).
- Friedrich, R. W., Genoud, C., Wanner, A. A. Analyzing the structure and function of neuronal circuits in zebrafish. Frontiers in Neural Circuits. , 7 (2013).
- Friedrich, R. W., Jacobson, G. A., Zhu, P. Circuit Neuroscience in Zebrafish. Current Biology. 20 (8), (2010).
- Marquart, G. D., et al. A 3D Searchable Database of Transgenic Zebrafish Gal4 and Cre Lines for Functional Neuroanatomy Studies. Frontiers in Neural Circuits. , (2015).
- Randlett, O., et al. Whole-brain activity mapping onto a zebrafish brain atlas. Nature Methods. 12 (11), 1039-1046 (2015).
- Gupta, T., et al. Morphometric analysis and neuroanatomical mapping of the zebrafish brain. Methods. 1046 (18), 30011-30012 (2018).
- Marquart, G. D., et al. High-precision registration between zebrafish brain atlases using symmetric diffeomorphic normalization. GigaScience. , (2017).
- Ronneberger, O., et al. ViBE-Z: A framework for 3D virtual colocalization analysis in zebrafish larval brains. Nature Methods. , (2012).
- Subedi, A., et al. Adoption of the Q transcriptional regulatory system for zebrafish transgenesis. Methods. 66 (3), 433-440 (2014).
- Scheer, N., Campos-Ortega, J. A. Use of the Gal4-UAS technique for targeted gene expression in the zebrafish. Mechanisms of Development. 80 (2), 153-158 (1999).
- Chatterjee, D., Tran, S., Shams, S., Gerlai, R. A Simple Method for Immunohistochemical Staining of Zebrafish Brain Sections for c-fos Protein Expression. Zebrafish. , (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır