Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Поведенческие подходы к изучению врожденного напряжения в рыбе данио
В этой статье
Резюме
Эта рукопись описывает простой метод измерения стресса поведенчески у взрослых рыб данио. Этот подход использует врожденную тенденцию, что данио рыбы предпочитают нижней половине танка, когда в стрессовом состоянии. Мы также описываем методы связывания анализа с фармакологией.
Аннотация
Реагирование надлежащим образом на стрессовые раздражители имеет важное значение для выживания организма. Обширные исследования было сделано по широкому спектру связанных со стрессом заболеваний и психических расстройств, но дальнейшие исследования в генетических и нейрональных регулирование стресса по-прежнему необходимы для разработки лучше терапии. Рыба данио дает мощную генетическую модель для исследования нервных основ стресса, так как существует большая коллекция мутантных и трансгенных линий. Кроме того, фармакология может легко применяться к рыбе данио, так как большинство препаратов могут быть добавлены непосредственно в воду. Мы описываем здесь использование "Роман танк испытаний" в качестве метода для изучения врожденных реакций стресса в данио рерио, и продемонстрировать, как потенциальные анксиолитические препараты могут быть проверены с помощью анализа. Этот метод легко может сочетаться с рыбными линиями данио, укрывательство генетическими мутациями, или теми, в которых используются трансгенные подходы для манипулирования точными нейросхемами. Анализ также может быть использован в других моделях рыбы. В совокупности описанный протокол должен способствовать принятию этого простого анализа в другие лаборатории.
Введение
Стресс ответы изменены поведенческих и физиологических состояний в результате потенциально вредных или отрицательной стимулы. Стресс ответы сохраняются во всем животном царстве, и имеют решающее значение для выживания организма1. Десятилетия исследований значительно расширили наши знания о некоторых генетических и нейрональных механизмов, лежащих в основе стрессовых состояний. Сегодня, области головного мозга, такие как миндалины и стриатум2, и генетические факторы, такие как кортикотропин рилизинг гормон (ЦРБ), и глюкокортикоидов (гр) и минералкортикоидных рецепторов ( Mr) были подробно изучены3,4,5,6. Несмотря на эти критические выводы, многое остается неизвестным о генетическом и нейрональных регулирование стресса. Как таковой, много вызванных напряжений разладов терпят от отсутсвия терапевтики.
Генетически наменные модели организмов обеспечивают полезный инструмент в изучении генетического и нейрональных контроля поведения. Модели рыб, в частности, чрезвычайно мощные: они являются малыми организмами с коротким поколением, их использование в лабораторных условиях является поверхностным, их геномы легко модифицированы, и, как позвоночных, они разделяют не только генетические, но и нейроанатомические Гомология с их коллегами млекопитающих7,8. Стандартные анализы для измерения напряжения могут быть в паре с линиями рыб данио укрывательство генетических мутаций, или те, в которых манипуляции точных нейронных подмножеств возможно, и эффекты отдельных генов или определенных нейронов могут быть оценены быстро и эффективно.
Поведенчески, стресс ответы могут быть охарактеризованы в рыбе как периоды гипер-активности или длительных периодов бездействия (сродни "замораживания")9, снижение разведки10, учащенное дыхание, снижение потребления пищи11, и место-предпочтение на дно танка12. Например, при помещении в незнакомый танк, рыба взрослого данио и другие мелкие рыбные модели изначально отдают предпочтение нижней половине бака, однако со временем рыба начинает исследовать верхние и нижние половинки с почти одинаковой частотой12. Лечение взрослых с наркотиками, как известно, уменьшить беспокойство вызывают рыбу сразу исследовать верхнюю половину10,13. И наоборот, препараты, которые увеличивают тревогу вызывают рыбы, чтобы показать сильное предпочтение нижней половине танка12,14,15. Таким образом, снижение разведочных работ и предпочтение нижней части бака являются простыми и надежными индикаторами стресса.
Как и большинство позвоночных, стрессовые реакции в рыбе обусловлены активацией гипоталамо-гипофизарно-межпочечной оси (ИНН; аналог гипоталамо-гипофизарно-надпочечниковой оси у млекопитающих)14,16. Гипоталамуса нейронов, выражающих гормон кортикотропин рилизинг гормон (ЦРБ) сигнал гипофиза, который в свою очередь релизы адренокортикотропиком рилизинг гормон (ACTH). ACTH затем сигналы в межпочечную железу производить и секретируют кортизола, который имеет ряд вниз по течению цели16, один из них является отрицательной обратной связи от ЦРБ-производство нейронов гипоталамуса3,17, 18,19.
Здесь мы описываем метод оценки поведенческих показателей врожденного стресса. Для поведения, мы подробно протоколы, используя новый танк Дайвинг тест12,14. Затем мы демонстрируем, как пример, что известный Анксиолитический препарат, buspirone, уменьшает поведенческие меры стресса.
протокол
Протокол был одобрен институционального ухода за животными и использовать Комитет Флорида Атлантического университета.
1. Подготовка
- Обозначьте изолированную комнату для выполнения поведенческих исследований или закройте часть комнаты так, чтобы она была изолирована.
Примечание: номер должен быть безмятежным и иметь низкий трафик, чтобы избежать нарушения нормального поведения рыбы. - Переместите следующие материалы и оборудование в поведенческую комнату: (i) фотоаппарат и объектив, (II) инфракрасный фильтр, который может быть присоединен к объективу, (III) стенд камеры, (IV) компьютер с программным обеспечением для приобретения камеры, (v) твердая и стабильная таблица для выполнения анализа на, (VI) инфракрасные огни (ИК огни; 850 нм или 940 нм), (VII) белый акриловый диффузор, который длиннее длины танка записи (VIII) 1,8 L тратраоидальная пластиковая Пробирная цистерна (именуемый "Роман танк '; один используется здесь 12 х 18 дюймов) , и (IX) ведро рыбы системы воды.
Примечание: для романа танк, наша лаборатория использует коммерчески доступных пластиковых сосудов, которые являются тратратоидная форма. Размеры танка примерно 6 в х 9 в (подробные размеры предоставляются на рисунке 1а). Диффузор борту мы используем немного больше, чем Роман танк (12 в х 18 в). Новые эксперименты танк были выполнены с цистернами, имеющих различные формы, такие как те, которые имеют прямоугольную форму или с различными тратраоидной размеры20,21. Как правило, поведение рыб аналогично во всех резервуарах независимо от их размеров: для всех контейнеров, рыба изначально предпочитают нижнюю половину, но с течением времени начинают изучать верхнюю половину с большей частотой. - Прикрепите инфракрасный фильтр к объективе камеры. Длины волн инфракрасных световых полос обычно варьируются от 850 нм до 940 нм. Фильтр длинный проход фильтр, который ограничивает свет длин волн менее 720 Нм от передачи через к камере.
- Выберите подходящие параметры для программного обеспечения для приобретения камеры. Для большинства записей, установите приобретение камеры в размере 30 кадров в секунду, и продолжительность записи до 10-мин.
Примечание: эти параметры могут отличаться в зависимости от эксперимента. Например, для изучения привыкания в романе танк22,23, более длинные записи могут потребоваться.
2. Настройка
Примечание: шаги в этом разделе описывают создание нового анализа танка. Диаграмма конечного продукта дается на рисунке 1B.
- Поместите Роман танк в середине таблицы.
- Разместите инфракрасные огни позади танка и поместите белый акриловый лист или экран диффузора между баком и СВЕТОДИОДНЫМ источником света.
- Поместите диффузор так, что он максимально распространяет свет, поступатель от светодиодов, и интенсивность света достаточно, чтобы осветить новый танк. Чем ближе доска к источнику света, тем ярче будет свет, тем меньше он будет распространяться. В отличие от этого, размещение диффузора борту от источника света снизит интенсивность света, но распространять свет лучше.
- Заполните приблизительно 3/4 из романа бака с водой системы рыб.
Примечание: система воды генерируется с помощью обратного осмоса водопроводной воды, а затем дозирования, что проводимость равна 900 ± 100 МКС, что рН нейтрально (7,2), и что температура 27 ± 1 ° c. - Прикрепите камеру к камере стенд и подключить камеру к компьютеру. Откройте программное обеспечение для приобретения видео и настроить камеру для лица передней части танка и обеспечить весь роман танк можно увидеть и что есть нет затемнены области в видео. Отрегулируйте бак и ультракрасные света такие что достаточно и даже освещение повсеместно в бак наблюдано через камеру.
Примечание: прежде чем приступать к экспериментам, это часто может быть полезно для выполнения пробный запуск, в котором видео рыбы захватили и отслеживания выполняется. Это гарантирует, что настройка является достаточным для экспериментов с поведением.
3. Новая установка испытания бака
- Приготовьте стакан 250 мл, предварительно заполненный водой из рыбы, и, по крайней мере, два резервуаров для проведения.
- На утро испытания, передача по крайней мере 10 тест взрослых рыб данио, которые будут использоваться для каждого экспериментального состояния (контроля и экспериментальных взрослых) из рыбы объекта в холдинг танк, передавать их в комнату поведения, и дать им возможность акклиматизировать, по крайней мере один Час.
Примечание: анализ мощности должен быть выполнен до экспериментов, но в наших руках, n = 10, как правило, достаточно, чтобы обнаружить статистическую значимость. Кроме того, в холдинг-баке должно содержаться не более пяти особей на литр воды. Акклиматизирование одного часа достаточно, так как взрослые рыбы данио были показаны, чтобы пристать в течение 30 минут нового танка22. Кроме того, поведенческие ритмы страдают от циркадных процессов, и, таким образом экспериментальных повторяет делать в разные дни должны выполняться в течение одного часа. Мы обычно выполняем все эксперименты между часами 11:00 утра и 6:00 вечера. - Маркировать танки таким образом, что состояние или генотипа животных слепа к экспериментатору.
Примечание: эксперименты могут быть легко ослеплены экспериментатору путем маркировки танков, используя букву или систему номера (то есть, один танк помечен как ' A ', другой ' B ' и т.д.). Участник не участвует в экспериментах этикетки танков с такой системой, и маски тождества от экспериментатора до окончания пост-анализ завершен. - Используя сеть, аккуратно поместите одного взрослого в предварительно заполненную стакан от шага 3,1. Разрешить взрослой рыбе акклиматизировать в стакане в течение 10 минут.
Примечание: запись пола взрослого, как это может быть важно после анализа, чтобы искать секс-специфических различий. - После акклиации в стакане, ввести рыбу в романе танк (создан в разделе 1), осторожно наливание воды и взрослых из стакана.
- После введения взрослого в новый танк, начать запись камеры, и отойти от установки, чтобы предотвратить дополнительные бедствия для рыб.
- После завершения записи, удалите человека из романа танк и поместите в новый холдинг танк.
Примечание: другой Холдинг бак из 1 в шаге 3,2 должны быть использованы для предотвращения повторного тестирования на тех же лиц. - Повторите шаги 3,4 до 3,7 для каждого взрослого, пока все животные были протестированы.
Примечание: в дополнение к ослепляющему условий или генотипов, рандомизации испытаний. Используйте генератор случайных чисел или любой инструмент, который позволяет случайным образом между испытаниями. Это должно быть сделано до экспериментов, так что каждое испытание определяется до начала экспериментов. - В конце всех тестов верните рыбу обратно в рыбное заведение.
4. Предварительная обработка препаратом
Примечание: целью следующих шагов является сравнение поведения индивида до и после употребления наркотиков. Это сравнение достигается путем первого выполнения испытания нового танка, как в шаге 3,4 к 3,6, а затем медикаментозного лечения, а затем второй тест танк Роман (рис. 3а).
- Подготовьте запас раствора препарата, в том числе положительный и отрицательный контроль.
Примечание: если препарат ранее использовался в литературе, найти соответствующую рабочую дозу и использовать это. Например, для буспирон в репрезентативных результатах, мы делаем 100X складе решение и использовать 0,05 мг/мл в качестве конечной концентрации, как описано в литературе13,20. Если предложена доза неизвестна, кривая реагирования на дозу должна выполняться путем изучения нескольких концентраций. Настройка больше бикеров с серийными разведениями наркотиков. Если препарат не растворяем в воде, используйте диметилсульфоксид (ДФСО) в качестве растворителя. - Разбавленные препараты для рабочей концентрации в 250 мл бикеры с системой воды. Например, если было сделано 100X раствор, разбавить 1:100 в системе воды. Настройка стакан с водой только системы в качестве элемента управления.
Примечание: Если ДДСО использовался в качестве растворителя в шаге 3,1, используйте равный объем ДДСО в контрольном стакане. - С помощью другого исследователя, маска тождества наркотиков и контроля Бикерс, чтобы убедиться, что тестер слеп к условиям лечения до пост-анализа.
Примечание: может использоваться система номер или буква. - Выполните новый тест танк, следуя шагам 3,1 к 3,6 для получения базового поведенческого стрессового ответа.
- После базовой записи, используйте сеть, чтобы немедленно удалить взрослую рыбу из романа танка и поместить его в стакан, дозированный с наркотиками или транспортным средством, как описано в шаге 4,2. Разрешить взрослым оставаться в стакане в течение 10 мин.
Примечание: Убедитесь, что чистая не прикасайтесь к воде в Бикерс для предотвращения перекрестного заражения наркотиками. Обеспечить правильную дозировку и администрирование время в зависимости от используемого препарата. 10 мин время лечения может не работать для всех препаратов. - После лечения используйте сетку, чтобы удалить взрослого из стакана в шаге 4,5 и поместите его в другой стакан, наполненный свежей системой только водой. Это период вымывания, чтобы минимизировать дальнейшие дозировки во время второго испытания танка роман. Разрешить взрослым оставаться в промыть стакан для дополнительного 10 мин.
Примечание: отдельные сетки должны использоваться для каждого состояния препарата, чтобы предотвратить любое нежелательное перекрестное лечение с наркотиками. Период вымывания может быть пропущен при желании экспериментатора. - Выполните новый танк Дайвинг тест второй раз, удалив, что взрослый из стакана в предыдущем шаге, поместите его в новый танк роман, и следуйте инструкциям 3,5 до 3,6.
- После второго испытания нового танка, удалите человека в отдельный холдинг танк. Вылейте воду системы во втором романе танк и заполнить его свежей системы воды для следующего испытания. Этот шаг предотвращает перекрестное загрязнение любого препарата.
Примечание: в зависимости от срока полураспада лекарств, свежие бикеры содержащие препараты должны быть сделаны каждые 3 часа. Для buspirone, сделать свежие решения каждые 3 часа. Кроме того, следуя примечании в шаге 3,8, испытания должны быть рандомизированными между элементами управления и медикаментозными процедурами. - В конце всех испытаний, возвращение лиц обратно в рыбе объекта.
Примечание: в зависимости от типа используемого препарата, эффекты этих методов лечения на людей могут быть долговечном. Поэтому не пользуйтесь этими индивидуумами в других экспериментах.
5. Анализ видео
- После всех испытаний Загрузите видео-файлы в программное обеспечение для отслеживания выбора.
Примечание: мы обычно используем коммерчески имеющееся отслеживая програмное обеспечение, но несколько свободно имеющихся пакетов програмного обеспечения можно использовать. Шаги для достижения отслеживания могут отличаться в зависимости от используемого программного пакета. - Использование неподвижа кадр из видео, определить мнимые границы вокруг (i) весь роман танк арене, которая заполнена водой, и границы вокруг (II) верхняя треть, (III) средней трети, и (IV) нижней трети танка. Используйте их, чтобы установить время, которое рыба провела в каждой части танка романа.
- Расчет x-y смещения за кадр для каждой арены, определенной в шаге 5,2.
- Определите верхние, средние и нижние области бака. Каждый регион должен быть схоже по размеру. Краткий метод определения этих регионов состоит в том, чтобы рассчитать длину бака в направлении y, и разделить это на 3.
Примечание: Существуют вариации общего протокола. Например, некоторые лаборатории используют половинки вместо третей14. - Определите время, проведенное на каждой арене, на расстоянии и скорости.
Примечание: большинство отслеживания пакетов будет автоматически рассчитать их для пользователя. Однако, если программное обеспечение отслеживания не делает, они могут быть рассчитаны легко от x-y значений смещения. Например, расстояние можно определить с помощью формулы: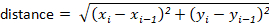
и скорость может быть определена следующим формула: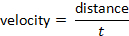
- Повторите шаги 5,2 до 5,4, чтобы приобрести треки и измерений для всех испытаний.
Примечание: вариации этого общего протокола
6. тестирование на нормальность
- Выполните статистику, прежде чем приступать к вычислениям статистических различий. Проверьте, обычно ли данные распространяются с помощью теста Шапиро-Wilk.
- Если нулевая гипотеза о том, что данные обычно распределены, отклоняется (т.е. данные не следуют за распределением Гауссово), выполните все тесты с использованием непараметрических тестов. И наоборот, если данные, как установлено, следуют обычному распределению, переходите к использованию параметрических тестов.
Примечание: мы используем коммерчески имеющееся програмное обеспечение для того чтобы выполнить статистик; Тем не менее, язык программирования R также может быть использован. Анализ Шапиро-Уилка может быть выполнен с помощью Шапиро. тестового функции.
Результаты
Изучение стресса в рыбе данио
Для изучения стресса поведение с течением времени в диком-тип рыбы данио, мы протестировали взрослых рыб из штамма AB24 в испытании нового танка. Взрослые из AB были подвергнуты протоколу, как описано выше. Коротко, рыбы по?...
Обсуждение
Рерио рыбы демонстрируют надежную реакцию на стресс в романе танк
Здесь мы описываем простой поведенческий подход к изучению стрессовых реакций у взрослых рыб данио, и проверяем подход как простую меру стресса, используя фармакологию.
Новый танк тест является шир...
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих или финансовых интересов.
Благодарности
Эта работа была поддержана финансированием из инициативы Юпитера в области науки о жизни при Флоридском Атлантическом университете до РД и АК. Эта работа была также поддержана грантами R21NS105071 (присуждены ACK и РД) и R15MH118625 (присужден Орд) от национальных институтов здравоохранения.
Материалы
| Name | Company | Catalog Number | Comments |
| Camera | We use Point Grey Grasshopper3 USB camera with lens from Edmund Optics. | ||
| Infrared filter | Edmund Optics | ||
| Video Acquisition Program | Use programs such as Virtualdub or FlyCapture because the acquisition framerate can be set. | ||
| Infrared LED lights | |||
| Assay tank | Aquaneering | Part number ZT180 | Size: M3 1.8 liter |
| Stand and clamp, or standard tripod for camera | |||
| 250mL beaker | |||
| Tracking software | We use Ethovision XT 13 from Noldus Information Technology | ||
| Buspirone chloride | Sigma-Aldrich | B7148 | |
| Randomized trial generator | We use the RANDBETWEEN function in Microsoft Excel |
Ссылки
- McEwen, B. S. Stress, adaptation, and disease. Allostasis and allostatic load. Annals of the New York Academy of Sciences. 840, 33-44 (1998).
- Tovote, P., Fadok, J. P., Lüthi, A. Neuronal circuits for fear and anxiety. Nature Reviews Neuroscience. 16 (6), 317-331 (2015).
- Facchinello, N., et al. Nr3c1 null mutant zebrafish are viable and reveal DNA-binding-independent activities of the glucocorticoid receptor. Scientific Reports. 7 (4371), (2017).
- Ziv, L., et al. An affective disorder in zebrafish with mutation of the glucocorticoid receptor. Molecular Psychiatry. , (2013).
- Grone, B. P., Maruska, K. P. Divergent evolution of two corticotropin-releasing hormone (CRH) genes in teleost fishes. Frontiers in Neuroscience. , (2015).
- Fuller, P. J., Lim-Tio, S. S., Brennan, F. E. Specificity in mineralocorticoid versus glucocorticoid action. Kidney International. , (2000).
- Zhdanova, I. V. Sleep and its regulation in zebrafish. Reviews in the Neurosciences. 22 (1), 27-36 (2011).
- Patton, E. E., Zon, L. I. The art and design of genetic screens: zebrafish. Nature Reviews Genetics. , (2001).
- Duboué, E. R. E. R., Hong, E., Eldred, K. C. K. C., Halpern, M. E. M. E. Left Habenular Activity Attenuates Fear Responses in Larval Zebrafish. Current Biology. 27 (14), 2154-2162 (2017).
- Facchin, L., Duboue, E. R., Halpern, M. E. Disruption of Epithalamic Left-Right Asymmetry Increases Anxiety in Zebrafish. Journal of Neuroscience. 35 (48), 15847-15859 (2015).
- Øverli, &. #. 2. 1. 6. ;., Sørensen, C., Nilsson, G. E. Behavioral indicators of stress-coping style in rainbow trout: Do males and females react differently to novelty. Physiology and Behavior. , (2006).
- Levin, E. D., Bencan, Z., Cerutti, D. T. Anxiolytic effects of nicotine in zebrafish. Physiology & behavior. 90 (1), 54-58 (2007).
- Bencan, Z., Sledge, D., Levin, E. D. Buspirone, chlordiazepoxide and diazepam effects in a zebrafish model of anxiety. Pharmacology Biochemistry and Behavior. 94 (1), 75-80 (2009).
- Cachat, J., et al. Measuring behavioral and endocrine responses to novelty stress in adult zebrafish. Nature Protocols. 5 (11), 1786-1799 (2010).
- Mathuru, A. S., et al. Chondroitin fragments are odorants that trigger fear behavior in fish. Current Biology. , (2012).
- Alsop, D., Vijayan, M. The zebrafish stress axis: Molecular fallout from the teleost-specific genome duplication event. General and Comparative Endocrinology. , (2009).
- Evans, A. N., Liu, Y., MacGregor, R., Huang, V., Aguilera, G. Regulation of Hypothalamic Corticotropin-Releasing Hormone Transcription by Elevated Glucocorticoids. Molecular Endocrinology. , (2013).
- Fenoglio, K. A., Brunson, K. L., Avishai-Eliner, S., Chen, Y., Baram, T. Z. Region-specific onset of handling-induced changes in corticotropin- releasing factor and glucocorticoid receptor expression. Endocrinology. , (2004).
- Liposits, Z., et al. Ultrastructural localization of glucocorticoid receptor (GR) in hypothalamic paraventricular neurons synthesizing corticotropin releasing factor (CRF). Histochemistry. , (1987).
- Facchin, L., Duboué, E. R., Halpern, M. E. Disruption of epithalamic left-right asymmetry increases anxiety in Zebrafish. Journal of Neuroscience. 35 (48), (2015).
- Chin, J. S., et al. Convergence on reduced stress behavior in the Mexican blind cavefish. Developmental Biology. , (2018).
- Wong, K., et al. Analyzing habituation responses to novelty in zebrafish (Danio rerio). Behavioural Brain Research. 208 (2), 450-457 (2010).
- Matsunaga, W., Watanabe, E. Habituation of medaka (Oryzias latipes) demonstrated by open-field testing. Behavioural Processes. 85 (2), 142-150 (2010).
- Walker, C. Chapter 3 Haploid Screens and Gamma-Ray Mutagenesis. Methods in Cell Biology. , (1998).
- Rihel, J., et al. Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation. Science. 327, 348-351 (2010).
- Peal, D. S., Peterson, R. T., Milan, D. Small molecule screening in zebrafish. Journal of Cardiovascular Translational Research. , (2010).
- Murphey, R., Zon, L. Small molecule screening in the zebrafish. Methods. 39 (3), 255-261 (2006).
- Gammans, R. E., et al. Use of buspirone in patients with generalized anxiety disorder and coexisting depressive symptoms. A meta-analysis of eight randomized, controlled studies. Neuropsychobiology. 25 (4), 193-201 (1992).
- Maaswinkel, H., Zhu, L., Weng, W. The immediate and the delayed effects of buspirone on zebrafish (Danio rerio) in an open field test: A 3-D approach. Behavioural Brain Research. , (2012).
- Gebauer, D. L., et al. Effects of anxiolytics in zebrafish: Similarities and differences between benzodiazepines, buspirone and ethanol. Pharmacology Biochemistry and Behavior. , (2011).
- Maximino, C., et al. Fingerprinting of psychoactive drugs in zebrafish anxiety-like behaviors. PLoS ONE. , (2014).
- Horváth, J., Barkóczi, B., Müller, G., Szegedi, V. Anxious and nonanxious mice show similar hippocampal sensory evoked oscillations under urethane anesthesia: Difference in the effect of buspirone. Neural Plasticity. , (2015).
- Costall, B., Kelly, M. E., Naylor, R. J., Onaivi, E. S. Actions of buspirone in a putative model of anxiety in the mouse. Pharm Pharmacol. 40 (7), 494-500 (1988).
- Barros, M., Mello, E. L., Huston, J. P., Tomaz, C. Behavioral effects of buspirone in the marmoset employing a predator confrontation test of fear and anxiety. Pharmacology Biochemistry and Behavior. , (2001).
- Heinen-Kay, J. L., et al. Predicting multifarious behavioural divergence in the wild. Animal Behaviour. 121, 3-10 (2016).
- Thompson, R. R. J., Paul, E. S., Radford, A. N., Purser, J., Mendl, M. Routine handling methods affect behaviour of three-spined sticklebacks in a novel test of anxiety. Behavioural Brain Research. 306, 26-35 (2016).
- Hamilton, T. J., et al. Establishing zebrafish as a model to study the anxiolytic effects of scopolamine. Scientific Reports. , (2017).
- York, R. A., Fernald, R. D. The Repeated Evolution of Behavior. Frontiers in Ecology and Evolution. 4, 143 (2017).
- Jakka, N. M., Rao, T. G., Rao, J. V. Locomotor behavioral response of mosquitofish (Gambusia affinis) to subacute mercury stress monitored by video tracking system. Drug and Chemical Toxicology. , (2007).
- Hu, C. K., Brunet, A. The African turquoise killifish: A research organism to study vertebrate aging and diapause. Aging Cell. , (2018).
- Maximino, C., et al. Measuring anxiety in zebrafish: A critical review. Behavioural Brain Research. 214 (2), 157-171 (2010).
- Maximino, C., Marques de Brito, T., Dias, C. A. G., Gouveia, A., Morato, S. Scototaxis as anxiety-like behavior in fish. Nature protocols. 5 (2), 209-216 (2010).
- Godwin, J., Sawyer, S., Perrin, F., Oxendine, S., Kezios, Z. Adapting the Open Field Test to assess anxiety related behavior in zebrafish. Zebrafish Protocols for Neurobehavioral Research. , 181-189 (2012).
- Agetsuma, M., et al. The habenula is crucial for experience-dependent modification of fear responses in zebrafish. Nature Neuroscience. 13 (11), 1354-1356 (2010).
- Valente, A., Huang, K. H., Portugues, R., Engert, F. Ontogeny of classical and operant learning behaviors in zebrafish. Learning and Memory. , (2012).
- Baker, M. R., Goodman, A. C., Santo, J. B., Wong, R. Y. Repeatability and reliability of exploratory behavior in proactive and reactive zebrafish, Danio rerio. Scientific Reports. , (2018).
- Friedrich, R. W., Genoud, C., Wanner, A. A. Analyzing the structure and function of neuronal circuits in zebrafish. Frontiers in Neural Circuits. , 7 (2013).
- Friedrich, R. W., Jacobson, G. A., Zhu, P. Circuit Neuroscience in Zebrafish. Current Biology. 20 (8), (2010).
- Marquart, G. D., et al. A 3D Searchable Database of Transgenic Zebrafish Gal4 and Cre Lines for Functional Neuroanatomy Studies. Frontiers in Neural Circuits. , (2015).
- Randlett, O., et al. Whole-brain activity mapping onto a zebrafish brain atlas. Nature Methods. 12 (11), 1039-1046 (2015).
- Gupta, T., et al. Morphometric analysis and neuroanatomical mapping of the zebrafish brain. Methods. 1046 (18), 30011-30012 (2018).
- Marquart, G. D., et al. High-precision registration between zebrafish brain atlases using symmetric diffeomorphic normalization. GigaScience. , (2017).
- Ronneberger, O., et al. ViBE-Z: A framework for 3D virtual colocalization analysis in zebrafish larval brains. Nature Methods. , (2012).
- Subedi, A., et al. Adoption of the Q transcriptional regulatory system for zebrafish transgenesis. Methods. 66 (3), 433-440 (2014).
- Scheer, N., Campos-Ortega, J. A. Use of the Gal4-UAS technique for targeted gene expression in the zebrafish. Mechanisms of Development. 80 (2), 153-158 (1999).
- Chatterjee, D., Tran, S., Shams, S., Gerlai, R. A Simple Method for Immunohistochemical Staining of Zebrafish Brain Sections for c-fos Protein Expression. Zebrafish. , (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены