É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Abordagens comportamentais para estudar estresse inato em zebrafish
Neste Artigo
Resumo
Este manuscrito descreve um método simples para medir o stress comportamentalmente no zebrafish adulto. A abordagem tira proveito da tendência inata que zebrafish preferem a metade inferior de um tanque quando em um estado estressante. Nós igualmente descrevemos métodos para acoplando o ensaio com farmacologia.
Resumo
Responder apropriadamente a estímulos estressores é essencial para a sobrevivência de um organismo. A pesquisa extensiva foi feita em um espectro largo de doenças stress-related e de desordens psiquiátricas, contudo uns estudos mais adicionais na regulação genética e neuronal do stress são exigidos ainda para desenvolver uma terapêutica melhor. O zebrafish fornece um modelo genético poderoso para investigar os fundamentos neural do stress, porque existe uma grande coleção de linhas mutantes e transgénicas. Além disso, a farmacologia pode ser facilmente aplicada ao zebrafish, pois a maioria das drogas pode ser adicionada diretamente à água. Nós descrevemos aqui o uso do "teste novo do tanque" como um método para estudar respostas inatas do esforço no zebrafish, e demonstramos como os fármacos ansiolíticos potenciais podem ser validados usando o ensaio. O método pode facilmente ser acoplado com as linhas do zebrafish que abrigando mutações genéticas, ou aquelas em que as aproximações transgénicas para manipular circuitos neural precisos são usadas. O ensaio também pode ser usado em outros modelos de peixes. Juntos, o protocolo descrito deve facilitar a adoção deste ensaio simples para outros laboratórios.
Introdução
As respostas ao estresse são Estados comportamentais e fisiológicos alterados resultantes de estímulos potencialmente prejudiciais ou aversivos. As respostas ao estresse são conservadas em todo o reino animal e são críticas para a sobrevivência de um organismo1. Décadas de pesquisa expandiram enormemente nosso conhecimento de alguns dos mecanismos genéticos e neuronais subjacentes aos Estados de estresse. Hoje, as áreas do cérebro, como a amígdala e o estriado2, e fatores genéticos como o hormônio liberador de corticotropina (CRH), e os receptores de glicocorticóide (gr) e Mineralocorticoide ( Mr) foram estudados extensivamente3,4,5,6. Apesar destes resultados críticos, muito permanece desconhecido sobre a regulação genética e neuronal do stress. Como tal, muitos distúrbios relacionados com o stress sofrem de uma falta de terapêutica.
Organismos modelo geneticamente modificáveis fornecem uma ferramenta útil no estudo do controle genético e neuronal do comportamento. Os modelos de peixes, em particular, são extremamente poderosos: eles são pequenos organismos com tempos de geração curtos, seu uso em um ambiente laboratorial é facile, seus genomas são facilmente modificados, e, como um vertebrado, eles compartilham não só genética, mas também neuroanatômica homologia com seus homólogos mamíferos7,8. Os ensaios padrão para o stress de medição podem ser emparelhados com as linhas do zebrafish que abrigando mutações genéticas, ou aquelas em que a manipulação de subconjuntos neuronal precisos é possível, e os efeitos de únicos genes ou de neurônios definidos podem ser avaliados ràpida e eficientemente.
Comportamentalmente, as respostas ao estresse podem ser caracterizadas em peixes como períodos de hiperatividade ou períodos prolongados de inatividade (semelhante a "congelamento")9, redução da exploração10, respiração rápida, ingestão reduzida de alimentos11, e um lugar-preferência para o fundo de um tanque12. Por exemplo, quando colocado em um tanque desconhecido, o zebrafish adulto e outros modelos pequenos do peixe mostram uma preferência inicial para a metade inferior do tanque, contudo, sobre o tempo, os peixes começam a explorar as metades superiores e inferiores com freqüência próximo-igual12. Tratamento de adultos com drogas conhecidas para reduzir a ansiedade causa peixe para explorar imediatamente a metade superior10,13. Inversamente, as drogas que aumentam a ansiedade causam o peixe a mostrar forte preferência pela metade inferior do tanque12,14,15. Assim, a exploração e a preferência reduzidas para a metade inferior do tanque são indicadores simples e de confiança do esforço.
Como a maioria dos vertebrados, as respostas ao estresse em peixes são impulsionadas pela ativação do eixo hipotálamo-hipófise-interrenal (HPI; análoga ao eixo hipotálamo-hipófise-adrenal [hPa] em mamíferos)14,15. Neurónios hipotalâmicos expressando o sinal de hormônio liberador de corticotropina (CRH) para a hipófise, que por sua vez libera hormônio liberador Adrenocorticotrópico (ACTH). ACTH então sinaliza para a glândula interrenal para produzir e secretar cortisol, que tem um número de alvos a jusante16, sendo um deles feedback negativo dos neurônios hipotalâmicos produtores de CRH3,17, 18,19.
Aqui, nós descrevemos um método para avaliar medidas comportáveis do stress inata. Para o comportamento, nós detalha protocolos usando o teste novo do mergulho do tanque12,14. Em seguida, demonstramos, como exemplo, que uma droga ansiolítica conhecida, buspirona, reduz as medidas comportamentais do estresse.
Protocolo
O protocolo foi aprovado pela instituição de cuidados institucionais de animais e uso Committeeat Florida Atlantic University.
1. preparação
- Designe um quarto isolado para executar estudos comportáveis, ou feche fora de uma seção de um quarto de modo que seja isolado.
Nota: o quarto deve ser imperturbável e ter tráfego baixo para evitar interromper o comportamento normal dos peixes. - Mova os seguintes materiais e equipamentos para a sala comportamental: (i) uma câmera e lente, (II) um filtro infravermelho que pode ser anexado à lente, (III) um suporte de câmera, (IV) um computador com software de aquisição de câmera, (v) uma mesa firme e estável para executar o ensaio em, (vi) luzes infravermelhas (luzes do IR; 850 nanômetro ou 940 nanômetro), (VII) um difusor acrílico branco, que seja mais longo do que o comprimento do tanque da gravação (VIII) 1,8 L tanque plástico trapezoidal do ensaio (referido como o "tanque novo"; o um usado aqui é 12 x 18 polegadas) , e (IX) um balde de água do sistema de peixes.
Nota: para o novo tanque, o nosso laboratório utiliza embarcações de plástico disponíveis comercialmente, que são trapezoidais em forma. As dimensões do tanque são aproximadamente 6 em x 9 em (as dimensões detalhadas são fornecidas na Figura 1A). A placa do difusor que nós nos usamos é ligeiramente maior do que o tanque novo (12 em x 18 dentro). Experimentos com tanques novos foram realizados com reservatórios com diferentes formas, como aqueles que são retangulares ou com dimensões trapezoidais distintas20,21. Tipicamente, o comportamento dos peixes é similar em todos os tanques não obstante suas dimensões: para todos os recipientes, os peixes preferem inicialmente a metade inferior, contudo sobre o tempo começam a explorar a metade superior com maior freqüência. - Fixe o filtro de infravermelhos à objectiva da câmara. Os comprimentos de onda das tiras de luz infravermelha tipicamente variam de 850 nm a 940 nm. O filtro é um filtro de passe longo que restringe a luz de comprimentos de onda inferiores a 720 Nm de transmitir através da câmera.
- Selecione os parâmetros adequados para o software de aquisição da câmera. Para a maioria das gravações, defina a aquisição da câmera para uma taxa de 30 quadros por segundo e duração de gravação para 10 min.
Observação: esses parâmetros podem diferir, dependendo do experimento. Por exemplo, para estudar a habituação em um novo tanque22,23, gravações mais longas podem ser necessárias.
2. configuração
Nota: as etapas nesta seção descrevem a configuração do novo ensaio do tanque. Um diagrama do produto final é indicado na Figura 1B.
- Coloque o novo tanque no meio da mesa.
- Posicione as luzes infravermelhas atrás do tanque e coloc a tela acrílica branca da folha ou do difusor entre o tanque e a fonte luminosa do diodo emissor de luz.
- Coloc o difusor de modo que espalhe màxima a luz que vem dos LEDs, e a intensidade da luz é bastante para iluminar o tanque novo. Quanto mais perto a placa é a fonte de luz, o mais brilhante as luzes serão, mas quanto menos ele vai difundir. Pelo contraste, coloc a placa do difusor longe da fonte luminosa reduzirá a intensidade clara, mas espalha a luz melhor.
- Encha aproximadamente três quartos do tanque novo com água do sistema de peixes.
Nota: a água do sistema é gerada usando a osmose reversa da água da torneira, seguida pela dosagem tal que a condutibilidade iguala 900 ± 100 μS, esse pH é neutro (7,2), e que a temperatura é 27 ± 1 ° c. - Fixe a câmara ao suporte da câmara e ligue a câmara ao computador. Abra o software de aquisição de vídeo e ajuste a câmera para enfrentar a frente do tanque e garantir que todo o novo tanque pode ser visto e que não há áreas obscurecidas no vídeo. Ajuste o tanque e as luzes infravermelhas de modo que haja suficiente e mesmo a iluminação durante todo o tanque quando observado através da câmera.
Nota: antes de prosseguir para experimentos, muitas vezes pode ser útil para executar uma execução de avaliação, em que o vídeo de um peixe é capturado e rastreamento é realizado. Isso garantirá que a configuração seja suficiente para a experimentação do comportamento.
3. novo tanque de configuração de teste
- Prepare uma taça de 250 mL pré-cheia com água do sistema de peixes, e pelo menos dois tanques de retenção.
- Na manhã do teste, transfira pelo menos 10 zebrafish adulto do teste para ser usado para cada condição experimental (controles e adultos experimentais) da facilidade de pesca em um tanque de exploração, transfira-os à sala do comportamento, e permita-os de aclimatar para pelo menos um Hora.
Nota: uma análise de potência deve ser realizada antes da experimentação, ainda em nossas mãos, um n = 10 é geralmente suficiente para detectar significância estatística. Além disso, o tanque de retenção não deve conter mais de cinco indivíduos por litro de água. Uma aclimatação de uma hora é suficiente, uma vez que os adultos com zebrafish demonstraram habituar-se dentro de 30 minutos de um novo tanque22. Além disso, os ritmos comportamentais são afetados por processos circadianos e, assim, repetições experimentais realizadas em dias diferentes devem ser realizadas dentro das mesmas horas. Normalmente realizamos todas as experiências entre as horas de 11:00 am e 6:00 PM. - Rotular os tanques de forma que a condição ou o genótipo dos animais é cego para o experimentador.
Nota: experimentos podem ser facilmente cegos para o experimentador, rotulando tanques usando um sistema de letras ou números (ou seja, um tanque é rotulado como ' A ', outro ' B ', etc.). Uma parte não envolvida nos experimentos rotula os tanques com tal sistema, e mascara as identidades do experimentador até que após a conclusão da pós-análise. - Usando uma rede, coloc delicadamente um único adulto no copo pre-enchido da etapa 3,1. Permita que o peixe adulto aclimatar no copo por 10 minutos.
Nota: grave o sexo do adulto, porque pôde ser borne-análise importante para procurar diferenças sexo-específicas. - Após aclimatização na taça, introduzir o peixe no tanque de novela (criado na seção 1), derramando suavemente a água e o adulto da taça.
- Após ter introduzido o adulto no tanque novo, comece a gravação da câmera, e afaste-se da instalação para impedir a aflição adicional aos peixes.
- Depois que a gravação terminar, retire o indivíduo do tanque de novela e coloque em um novo tanque de retenção.
Nota: um tanque de retenção diferente do um na etapa 3,2 deve ser usado para evitar testes repetidos nos mesmos indivíduos. - Repita as etapas 3,4 a 3,7 para cada adulto até que todos os animais tenham sido testados.
Nota: além de condições cedendo ou genótipos, Randomize ensaios. Use um gerador de números aleatórios ou qualquer ferramenta que permita randomizar entre os ensaios. Isto deve ser feito antes da experimentação de modo que cada experimentação esteja determinada antes que os experimentos comecem. - No final de todos os testes, devolver o peixe de volta para a instalação de peixes.
4. pré-tratamento com drogas
Nota: o objetivo das seguintes etapas é comparar o comportamento de um indivíduo antes e depois do uso de drogas. Esta comparação é conseguida primeiramente realizando um teste novo do tanque como em etapa 3,4 a 3,6, seguido pelo tratamento da droga, e então um segundo teste novo do tanque (Figura 3a).
- Prepare uma solução conservada em estoque da droga, incluindo controles positivos e negativos.
Nota: se o fármaco tiver sido previamente utilizado na literatura, encontre uma dose de trabalho adequada e utilize-a. Por exemplo, para buspirona nos resultados representativos, fazemos uma solução de estoque de 100x e utilizamos 0, 5 mg/ml como a concentração final, conforme descrito na literatura13,14. Se a dose sugerida for desconhecida, uma curva de resposta da dose deve ser realizada examinando várias concentrações. Configurar mais taças com diluições seriais de medicina. Se a droga não for dissolúvel em água, use dimetil sulfóxido (DMSO) como um solvente. - Diluir as drogas para a concentração de trabalho em 250 ml copos com sistema de água. Por exemplo, se uma solução 100x foi feita, diluir 1:100 na água do sistema. Configure um copo com apenas água do sistema como um controle.
Nota: se o DMSO foi usado como um solvente na etapa 3,1, use um volume igual de DMSO na taça de controle. - Com a ajuda de outro pesquisador, mascarar as identidades da droga e taças de controle para garantir que o testador é cego para as condições de tratamento até a pós-análise.
Observação: um número ou sistema de letras pode ser usado. - Realize um novo teste de tanques seguindo as etapas 3,1 a 3,6 para obter uma resposta de estresse comportamental basal.
- Após a gravação da linha de base, use uma rede para remover imediatamente o peixe adulto do tanque de novela e coloque-o na Taça dosada com droga ou veículo, como descrito na etapa 4,2. Deixe o adulto ficar na taça por 10 min.
Nota: Assegure-se de que a rede não toque a água nos copos para impedir a contaminação cruzada das drogas. Garantir a dosagem adequada e tempo de administração, dependendo da droga usada. Um tempo de tratamento de 10 minutos pode não funcionar para todas as drogas. - Após o tratamento, use uma rede para remover o adulto do béaker na etapa 4,5 e coloc o em um outro copo enchido com a água fresca do sistema somente. Este é o período de washout para minimizar mais a dose durante o segundo teste novo do tanque. Permita que o adulto permaneça na lavagem para fora o copo por uns 10 minutos adicionais.
Nota: as redes separadas devem ser usadas para cada condição da droga para impedir todo o tratamento transversal indesejável com medicina. O período de lavagem pode ser ignorado se o experimentador desejar. - Realize o novo teste de mergulho de tanque uma segunda vez, removendo esse adulto da taça no passo anterior, coloque-o em uma nova novela tanque, e siga as etapas 3,5 a 3,6.
- Após o segundo teste novo do tanque, remova o indivíduo em um tanque de terra arrendada separado. Despeje afastado a água do sistema no segundo tanque novo e encha-o com água fresca do sistema para o teste seguinte. Esta etapa impede a contaminação cruzada de qualquer droga.
Nota: dependendo da semivida das drogas, os copos frescos que contêm drogas devem ser feitos a cada 3 horas. Para Buspirone, fazer soluções frescas a cada 3 horas. Além disso, seguindo a nota na etapa 3,8, os ensaios devem ser randomizados entre controles e tratamentos medicamentoso. - No final de todas as provações, devolva os indivíduos de volta para a instalação de peixes.
Nota: dependendo do tipo de medicamento utilizado, os efeitos destes tratamentos em indivíduos podem ser duradouros. Portanto, não use esses indivíduos em outros experimentos.
5. análise de vídeo
- Depois de todos os ensaios, carregar arquivos de vídeo em software de rastreamento de escolha.
Nota: normalmente usamos software de rastreamento disponível comercialmente, mas vários pacotes de software disponíveis gratuitamente podem ser usados. As etapas para alcançar o rastreamento podem diferir de acordo com o pacote de software usado. - Usando um quadro ainda a partir do vídeo, definir limites imaginários ao redor (i) toda a novela Arena tanque que é preenchido com água, e os limites em torno (II) o terço superior, (III) terço médio, e (IV) terço inferior do tanque. Use estes para estabelecer o tempo que os peixes gastados em cada parcela do tanque novo.
- Calcule o deslocamento x-y por quadro para cada Arena definida na etapa 5,2.
- Defina as áreas superior, média e inferior do tanque. Cada região deve ser semelhante em tamanho. Um método breve para determinar essas regiões é calcular o comprimento do tanque na direção y e dividi-lo por 3.
Nota: existem variações para o protocolo geral. Por exemplo, alguns laboratórios usam metades em vez de terços14. - Determine o tempo gasto em cada Arena, a distância e a velocidade.
Observação: a maioria dos pacotes de rastreamento automaticamente calculará esses para o usuário. No entanto, se o software de rastreamento não, eles podem ser calculados facilmente a partir dos valores de deslocamento x-y. Por exemplo, a distância pode ser determinada usando a fórmula: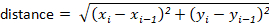
e a velocidade pode ser determinada seguindo a fórmula: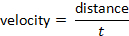
- Repita as etapas 5,2 para 5,4 para adquirir faixas e medições para todos os ensaios.
Nota: as variações deste protocolo geral
6. teste de normalidade
- Realize estatísticas antes de prosseguir para calcular as diferenças estatísticas. Verifique para ver se os dados são distribuídos normalmente usando um teste de Shapiro-Wilk.
- Se a hipótese nula de que os dados são normalmente distribuídos é rejeitada (ou seja, os dados não seguem uma distribuição gaussiana), executar todos os testes usando testes não paramétricos. Inversamente, se os dados forem encontrados para seguir uma distribuição normal, prossiga para usar testes paramétricos.
Nota: utilizamos software comercialmente disponível para realizar estatísticas; no entanto, a linguagem de programação R também pode ser usada. Uma análise de Shapiro-Wilk pode ser executada usando a função Shapiro. Test de R.
Resultados
Examinando o stress no zebrafish
Para examinar o comportamento de estresse ao longo do tempo em zebrafish tipo selvagem, testamos peixes adultos da cepa AB24 no teste de tanque novo. Os adultos do AB foram submetidos ao protocolo como descrito acima. Momentaneamente, os peixes foram dados um período da Aclimação 1-h em um tanque na sala do comportamento. Um indivíduo foi colocado em um copo para 10-min, e depois colocado suavemente em um tanque desc...
Discussão
Zebrafish exibem uma resposta de stress robusta em um novo tanque
Aqui, nós descrevemos uma aproximação comportável simples para examinar respostas do esforço no zebrafish adulto, e validamos a aproximação como uma medida simples do stress usando a farmacologia.
O novo teste do tanque é um teste amplamente utilizado para examinar o estresse inato em zebrafish e outras espécies de peixes12,14,
Divulgações
Os autores declaram que não têm interesses concorrentes ou financeiros.
Agradecimentos
Este trabalho foi apoiado pelo financiamento da iniciativa de ciência da vida de Júpiter na Universidade Atlântica da Flórida para ERD e ACK. Este trabalho também foi apoiado por subsídios R21NS105071 (concedido a ACK e ERD) e R15MH118625 (concedido ao ERD) dos institutos nacionais de saúde.
Materiais
| Name | Company | Catalog Number | Comments |
| Camera | We use Point Grey Grasshopper3 USB camera with lens from Edmund Optics. | ||
| Infrared filter | Edmund Optics | ||
| Video Acquisition Program | Use programs such as Virtualdub or FlyCapture because the acquisition framerate can be set. | ||
| Infrared LED lights | |||
| Assay tank | Aquaneering | Part number ZT180 | Size: M3 1.8 liter |
| Stand and clamp, or standard tripod for camera | |||
| 250mL beaker | |||
| Tracking software | We use Ethovision XT 13 from Noldus Information Technology | ||
| Buspirone chloride | Sigma-Aldrich | B7148 | |
| Randomized trial generator | We use the RANDBETWEEN function in Microsoft Excel |
Referências
- McEwen, B. S. Stress, adaptation, and disease. Allostasis and allostatic load. Annals of the New York Academy of Sciences. 840, 33-44 (1998).
- Tovote, P., Fadok, J. P., Lüthi, A. Neuronal circuits for fear and anxiety. Nature Reviews Neuroscience. 16 (6), 317-331 (2015).
- Facchinello, N., et al. Nr3c1 null mutant zebrafish are viable and reveal DNA-binding-independent activities of the glucocorticoid receptor. Scientific Reports. 7 (4371), (2017).
- Ziv, L., et al. An affective disorder in zebrafish with mutation of the glucocorticoid receptor. Molecular Psychiatry. , (2013).
- Grone, B. P., Maruska, K. P. Divergent evolution of two corticotropin-releasing hormone (CRH) genes in teleost fishes. Frontiers in Neuroscience. , (2015).
- Fuller, P. J., Lim-Tio, S. S., Brennan, F. E. Specificity in mineralocorticoid versus glucocorticoid action. Kidney International. , (2000).
- Zhdanova, I. V. Sleep and its regulation in zebrafish. Reviews in the Neurosciences. 22 (1), 27-36 (2011).
- Patton, E. E., Zon, L. I. The art and design of genetic screens: zebrafish. Nature Reviews Genetics. , (2001).
- Duboué, E. R. E. R., Hong, E., Eldred, K. C. K. C., Halpern, M. E. M. E. Left Habenular Activity Attenuates Fear Responses in Larval Zebrafish. Current Biology. 27 (14), 2154-2162 (2017).
- Facchin, L., Duboue, E. R., Halpern, M. E. Disruption of Epithalamic Left-Right Asymmetry Increases Anxiety in Zebrafish. Journal of Neuroscience. 35 (48), 15847-15859 (2015).
- Øverli, &. #. 2. 1. 6. ;., Sørensen, C., Nilsson, G. E. Behavioral indicators of stress-coping style in rainbow trout: Do males and females react differently to novelty. Physiology and Behavior. , (2006).
- Levin, E. D., Bencan, Z., Cerutti, D. T. Anxiolytic effects of nicotine in zebrafish. Physiology & behavior. 90 (1), 54-58 (2007).
- Bencan, Z., Sledge, D., Levin, E. D. Buspirone, chlordiazepoxide and diazepam effects in a zebrafish model of anxiety. Pharmacology Biochemistry and Behavior. 94 (1), 75-80 (2009).
- Cachat, J., et al. Measuring behavioral and endocrine responses to novelty stress in adult zebrafish. Nature Protocols. 5 (11), 1786-1799 (2010).
- Mathuru, A. S., et al. Chondroitin fragments are odorants that trigger fear behavior in fish. Current Biology. , (2012).
- Alsop, D., Vijayan, M. The zebrafish stress axis: Molecular fallout from the teleost-specific genome duplication event. General and Comparative Endocrinology. , (2009).
- Evans, A. N., Liu, Y., MacGregor, R., Huang, V., Aguilera, G. Regulation of Hypothalamic Corticotropin-Releasing Hormone Transcription by Elevated Glucocorticoids. Molecular Endocrinology. , (2013).
- Fenoglio, K. A., Brunson, K. L., Avishai-Eliner, S., Chen, Y., Baram, T. Z. Region-specific onset of handling-induced changes in corticotropin- releasing factor and glucocorticoid receptor expression. Endocrinology. , (2004).
- Liposits, Z., et al. Ultrastructural localization of glucocorticoid receptor (GR) in hypothalamic paraventricular neurons synthesizing corticotropin releasing factor (CRF). Histochemistry. , (1987).
- Facchin, L., Duboué, E. R., Halpern, M. E. Disruption of epithalamic left-right asymmetry increases anxiety in Zebrafish. Journal of Neuroscience. 35 (48), (2015).
- Chin, J. S., et al. Convergence on reduced stress behavior in the Mexican blind cavefish. Developmental Biology. , (2018).
- Wong, K., et al. Analyzing habituation responses to novelty in zebrafish (Danio rerio). Behavioural Brain Research. 208 (2), 450-457 (2010).
- Matsunaga, W., Watanabe, E. Habituation of medaka (Oryzias latipes) demonstrated by open-field testing. Behavioural Processes. 85 (2), 142-150 (2010).
- Walker, C. Chapter 3 Haploid Screens and Gamma-Ray Mutagenesis. Methods in Cell Biology. , (1998).
- Rihel, J., et al. Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation. Science. 327, 348-351 (2010).
- Peal, D. S., Peterson, R. T., Milan, D. Small molecule screening in zebrafish. Journal of Cardiovascular Translational Research. , (2010).
- Murphey, R., Zon, L. Small molecule screening in the zebrafish. Methods. 39 (3), 255-261 (2006).
- Gammans, R. E., et al. Use of buspirone in patients with generalized anxiety disorder and coexisting depressive symptoms. A meta-analysis of eight randomized, controlled studies. Neuropsychobiology. 25 (4), 193-201 (1992).
- Maaswinkel, H., Zhu, L., Weng, W. The immediate and the delayed effects of buspirone on zebrafish (Danio rerio) in an open field test: A 3-D approach. Behavioural Brain Research. , (2012).
- Gebauer, D. L., et al. Effects of anxiolytics in zebrafish: Similarities and differences between benzodiazepines, buspirone and ethanol. Pharmacology Biochemistry and Behavior. , (2011).
- Maximino, C., et al. Fingerprinting of psychoactive drugs in zebrafish anxiety-like behaviors. PLoS ONE. , (2014).
- Horváth, J., Barkóczi, B., Müller, G., Szegedi, V. Anxious and nonanxious mice show similar hippocampal sensory evoked oscillations under urethane anesthesia: Difference in the effect of buspirone. Neural Plasticity. , (2015).
- Costall, B., Kelly, M. E., Naylor, R. J., Onaivi, E. S. Actions of buspirone in a putative model of anxiety in the mouse. Pharm Pharmacol. 40 (7), 494-500 (1988).
- Barros, M., Mello, E. L., Huston, J. P., Tomaz, C. Behavioral effects of buspirone in the marmoset employing a predator confrontation test of fear and anxiety. Pharmacology Biochemistry and Behavior. , (2001).
- Heinen-Kay, J. L., et al. Predicting multifarious behavioural divergence in the wild. Animal Behaviour. 121, 3-10 (2016).
- Thompson, R. R. J., Paul, E. S., Radford, A. N., Purser, J., Mendl, M. Routine handling methods affect behaviour of three-spined sticklebacks in a novel test of anxiety. Behavioural Brain Research. 306, 26-35 (2016).
- Hamilton, T. J., et al. Establishing zebrafish as a model to study the anxiolytic effects of scopolamine. Scientific Reports. , (2017).
- York, R. A., Fernald, R. D. The Repeated Evolution of Behavior. Frontiers in Ecology and Evolution. 4, 143 (2017).
- Jakka, N. M., Rao, T. G., Rao, J. V. Locomotor behavioral response of mosquitofish (Gambusia affinis) to subacute mercury stress monitored by video tracking system. Drug and Chemical Toxicology. , (2007).
- Hu, C. K., Brunet, A. The African turquoise killifish: A research organism to study vertebrate aging and diapause. Aging Cell. , (2018).
- Maximino, C., et al. Measuring anxiety in zebrafish: A critical review. Behavioural Brain Research. 214 (2), 157-171 (2010).
- Maximino, C., Marques de Brito, T., Dias, C. A. G., Gouveia, A., Morato, S. Scototaxis as anxiety-like behavior in fish. Nature protocols. 5 (2), 209-216 (2010).
- Godwin, J., Sawyer, S., Perrin, F., Oxendine, S., Kezios, Z. Adapting the Open Field Test to assess anxiety related behavior in zebrafish. Zebrafish Protocols for Neurobehavioral Research. , 181-189 (2012).
- Agetsuma, M., et al. The habenula is crucial for experience-dependent modification of fear responses in zebrafish. Nature Neuroscience. 13 (11), 1354-1356 (2010).
- Valente, A., Huang, K. H., Portugues, R., Engert, F. Ontogeny of classical and operant learning behaviors in zebrafish. Learning and Memory. , (2012).
- Baker, M. R., Goodman, A. C., Santo, J. B., Wong, R. Y. Repeatability and reliability of exploratory behavior in proactive and reactive zebrafish, Danio rerio. Scientific Reports. , (2018).
- Friedrich, R. W., Genoud, C., Wanner, A. A. Analyzing the structure and function of neuronal circuits in zebrafish. Frontiers in Neural Circuits. , 7 (2013).
- Friedrich, R. W., Jacobson, G. A., Zhu, P. Circuit Neuroscience in Zebrafish. Current Biology. 20 (8), (2010).
- Marquart, G. D., et al. A 3D Searchable Database of Transgenic Zebrafish Gal4 and Cre Lines for Functional Neuroanatomy Studies. Frontiers in Neural Circuits. , (2015).
- Randlett, O., et al. Whole-brain activity mapping onto a zebrafish brain atlas. Nature Methods. 12 (11), 1039-1046 (2015).
- Gupta, T., et al. Morphometric analysis and neuroanatomical mapping of the zebrafish brain. Methods. 1046 (18), 30011-30012 (2018).
- Marquart, G. D., et al. High-precision registration between zebrafish brain atlases using symmetric diffeomorphic normalization. GigaScience. , (2017).
- Ronneberger, O., et al. ViBE-Z: A framework for 3D virtual colocalization analysis in zebrafish larval brains. Nature Methods. , (2012).
- Subedi, A., et al. Adoption of the Q transcriptional regulatory system for zebrafish transgenesis. Methods. 66 (3), 433-440 (2014).
- Scheer, N., Campos-Ortega, J. A. Use of the Gal4-UAS technique for targeted gene expression in the zebrafish. Mechanisms of Development. 80 (2), 153-158 (1999).
- Chatterjee, D., Tran, S., Shams, S., Gerlai, R. A Simple Method for Immunohistochemical Staining of Zebrafish Brain Sections for c-fos Protein Expression. Zebrafish. , (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados