Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Approches comportementales pour étudier le stress inné dans le Zébrafish
Dans cet article
Résumé
Ce manuscrit décrit une méthode simple pour mesurer le stress comportemental chez le zébrafish adulte. L’approche profite de la tendance innée que le zébrafish préfèrent la moitié inférieure d’un réservoir quand dans un État stressant. Nous décrivons également les méthodes de couplage du dosage avec la pharmacologie.
Résumé
La réponse appropriée aux stimuli stressants est essentielle pour la survie d’un organisme. Des recherches approfondies ont été menées sur un large éventail de maladies liées au stress et de troubles psychiatriques, mais d’autres études sur la régulation génétique et neuronale du stress sont encore nécessaires pour développer de meilleurs traitements thérapeutiques. Le zébrafish fournit un modèle génétique puissant pour enquêter sur les fondements neuronaux du stress, car il existe une grande collection de lignées mutantes et transgéniques. En outre, la pharmacologie peut facilement être appliquée à la zébrafish, car la plupart des médicaments peuvent être ajoutés directement à l’eau. Nous décrivons ici l’utilisation du «test du nouveau réservoir» comme une méthode pour étudier les réponses innées du stress chez le zébrafish, et démontrer comment les médicaments anxiolytiques potentiels peuvent être validés en utilisant le dosage. La méthode peut facilement être couplée avec des lignées de zébrafish qui constituent des mutations génétiques, ou celles dans lesquelles des approches transgéniques pour manipuler des circuits neuronaux précis sont utilisées. Le dosage peut également être utilisé dans d’autres modèles de poissons. Ensemble, le protocole décrit devrait faciliter l’adoption de ce dosage simple à d’autres laboratoires.
Introduction
Les réactions de stress sont altérées des États comportementaux et physiologiques résultant de stimuli potentiellement nocifs ou aversifs. Les réponses au stress sont conservées dans tout le règne animal et sont essentielles pour la survie d’un organisme1. Des décennies de recherche ont grandement élargi notre connaissance de certains des mécanismes génétiques et neuronaux sous-jacents aux États de stress. Aujourd’hui, les zones du cerveau telles que l’amygdale et le striatum2, et les facteurs génétiques tels que l’hormone de libération de la corticotropine (CRH), et les récepteurs glucocorticoïdes (GR) et mineralocorticoïdes ( m.) ont été étudiés intensivement3,4,5,6. Malgré ces résultats critiques, beaucoup reste inconnu au sujet de la régulation génétique et neuronale du stress. En tant que tel, de nombreux troubles liés au stress souffrent d’un manque de thérapeutique.
Les organismes modèles génétiquement amendables fournissent un outil utile dans l’étude du contrôle génétique et neuronale du comportement. Les modèles de poissons, en particulier, sont extrêmement puissants: ils sont de petits organismes avec des temps de génération courte, leur utilisation dans un cadre de laboratoire est facile, leurs génomes sont facilement modifiés, et, en tant que vertébrés, ils partagent non seulement génétique, mais aussi neuroanatomique homologie avec leurs homologues mammaliens7,8. Les dosages standard pour mesurer la contrainte peuvent être couplés avec des lignées de zébrafish qui sont des mutations génétiques, ou celles dans lesquelles la manipulation de sous-ensembles neuronaux précis est possible, et les effets de gènes isolés ou de neurones définis peuvent être évalués rapidement et efficacement.
Comportemental, les réponses au stress peuvent être caractérisées chez les poissons comme des périodes d’hyper-activité ou des périodes prolongées d’inactivité (semblable au «gel»)9, exploration réduite10, respiration rapide, réduction de l’apport alimentaire11, et a place-préférence pour le fond d’un réservoir12. Par exemple, lorsqu’ils sont placés dans un réservoir inconnu, le poisson-zèbre adulte et d’autres petits modèles de poissons montrent une préférence initiale pour la moitié inférieure du réservoir, mais, au fil du temps, les poissons commencent à explorer les moitiés supérieure et inférieure avec une fréquence presque égale à12. Traitement des adultes avec des médicaments connus pour réduire l’anxiété causer des poissons à explorer immédiatement la moitié supérieure10,13. Inversement, les médicaments qui augmentent l’anxiété causent le poisson à montrer une forte préférence pour la moitié inférieure du réservoir12,14,15. Ainsi, l’exploration et la préférence réduites pour la moitié inférieure du réservoir sont des indicateurs de stress simples et fiables.
Comme la plupart des vertébrés, les réactions de stress chez les poissons sont stimulés par l’activation de l’axe hypothalamo-hypophysaire-inter-rénal (HPI; analogue à l’axe hypothalamo-hypophysaire-surrénalien [hPa] chez les mammifères)14,16. Les neurones hypothalamiques exprimant l’hormone de libération de la corticotrophine (CRH) du signal à l’hypophyse, qui à son tour libère l’hormone de libération adrénocorticotrope (ACTH). ACTH signale ensuite à la glande inter-rénale de produire et de sécréter le cortisol, qui a un certain nombre de cibles en aval16, l’un d’eux étant la rétroaction négative des neurones hypothalamiques de production de CRH3,17, 18,19.
Ici, nous décrivons une méthode pour évaluer les mesures comportementales du stress inné. Pour le comportement, nous détaillons les protocoles en utilisant le nouvel essai de plongée de réservoir12,14. Nous démontrons ensuite, à titre d’exemple, qu’un médicament anxiolytique connu, la buspirone, réduit les mesures comportementales du stress.
Protocole
Le protocole a été approuvé par le Comité institutionnel de soins et d’utilisation des animaux Florida Atlantic University.
1. la préparation
- Désigner une pièce isolée pour effectuer des études comportementales, ou fermer une section d’une pièce afin qu’elle soit isolée.
Remarque: la pièce doit être non perturbée et avoir un faible trafic pour éviter de perturber le comportement normal du poisson. - Déplacez les matériaux et l’équipement suivants dans la salle comportementale: (i) un appareil photo et un objectif, (II) un filtre infrarouge qui peut être attaché à la lentille, (III) un support de caméra, (IV) un ordinateur avec un logiciel d’acquisition de caméra, (v) une table ferme et stable pour effectuer le test (VI) feux infrarouges (feux IR; 850 nm ou 940 nm), (VII) un diffuseur acrylique blanc, qui est plus long que la longueur de la cuve d’enregistrement (VIII) 1,8 L réservoir d’essai en plastique trapézoïdal (dénommé «nouveau réservoir»; celui utilisé ici est de 12 x 18 pouces) et (IX) un seau d’eau du système de poissons.
Remarque: pour le nouveau char, notre laboratoire utilise des récipients en plastique disponibles dans le commerce, qui sont de forme trapézoïdale. Les dimensions du réservoir sont d’environ 6 po x 9 po (les dimensions détaillées sont fournies à la figure 1A). Le panneau de diffuseur que nous utilisons est légèrement plus grand que le nouveau réservoir (12 po x 18 po). De nouvelles expériences de chars ont été réalisées avec des réservoirs ayant des formes différentes, comme ceux qui sont rectangulaires ou ceux avec des dimensions trapézoïdales différentes20,21. Typiquement, le comportement du poisson est similaire dans tous les réservoirs indépendamment de leurs dimensions: pour tous les récipients, les poissons préfèrent initialement la moitié inférieure, mais au fil du temps commencer à explorer la moitié supérieure avec une plus grande fréquence. - Fixez le filtre infrarouge à l’objectif de la caméra. Les longueurs d’onde des bandes lumineuses infrarouges varient généralement de 850 nm à 940 nm. Le filtre est un filtre passe-long qui restreint la lumière des longueurs d’onde inférieures à 720 nm de la transmission à la caméra.
- Sélectionnez les paramètres appropriés pour le logiciel d’acquisition de caméra. Pour la plupart des enregistrements, réglez l’acquisition de la caméra à un taux de 30 images par seconde, et la durée d’enregistrement à 10 minutes.
Remarque: ces paramètres peuvent différer selon l’expérience. Par exemple, pour étudier l’accouation dans un nouveau char22,23, des enregistrements plus longs peuvent être exigés.
2. Configuration de l’installation
Remarque: les étapes décrites dans cette section décrivent la mise en place du nouveau dosage du réservoir. Un diagramme du produit final est donné à la figure 1B.
- Placez le nouveau réservoir au milieu de la table.
- Positionnez les lumières infrarouges derrière le réservoir et placez la feuille d’acrylique blanche ou l’écran du diffuseur entre le réservoir et la source de lumière LED.
- Placez le diffuseur de façon à ce qu’il propage au maximum la lumière provenant des LEDs, et l’intensité de la lumière est suffisante pour éclairer le nouveau réservoir. Plus la carte est proche de la source de lumière, plus les lumières seront lumineuses, mais moins elles seront diffuses. En revanche, la mise en place de la carte de diffuseur loin de la source de lumière réduira l’intensité lumineuse, mais diffusera la lumière mieux.
- Remplissez approximativement les trois quarts du nouveau réservoir avec l’eau du système de poisson.
Remarque: l’eau du système est générée par osmose inverse de l’eau du robinet, suivie d’un dosage de telle sorte que la conductivité est égale à 900 ± 100 μS, que le pH est neutre (7,2) et que la température est de 27 ± 1 ° c. - Fixez l’appareil photo au support de la caméra et connectez l’appareil photo à l’ordinateur. Ouvrez le logiciel d’acquisition vidéo et ajustez l’appareil photo pour faire face à l’avant du réservoir et assurez-vous que le nouveau réservoir entier peut être vu et qu’il n’y a pas de zones obscurcies dans la vidéo. Ajustez le réservoir et les lumières infrarouges de telle sorte qu’il y ait suffisamment et même l’illumination dans tout le réservoir quand observé par l’appareil-photo.
Remarque: avant de procéder à des expériences, il peut souvent être utile d’effectuer une exécution d’essai, dans laquelle la vidéo d’un poisson est capturée et le suivi est effectué. Cela garantira que la configuration est suffisante pour l’expérimentation de comportement.
3. nouvelle configuration du test de réservoir
- Préparer un bécher de 250 mL prérempli avec de l’eau du système de poisson et au moins deux réservoirs de rétention.
- Le matin de l’essai, transférer au moins 10 poisson zèbre adultes d’essai à utiliser pour chaque condition expérimentale (témoins et adultes expérimentaux) de l’installation de poisson dans un réservoir de rétention, les transférer à la salle de comportement, et leur permettre d’acclimater au moins un heure.
Remarque: une analyse de puissance doit être effectuée avant l’expérimentation, mais dans nos mains, un n = 10 est généralement suffisant pour détecter la signification statistique. De plus, le réservoir de rétention ne doit pas contenir plus de cinq individus par litre d’eau. Une acclimatation d’une heure suffit pour que des adultes de zébrafish se soient habitués dans les 30 minutes d’un nouveau char22. En outre, les rythmes comportementaux sont affectés par les processus circadien, et donc les répétitions expérimentales effectuées sur des jours différents doivent être effectuées dans les mêmes heures. Nous effectuons généralement toutes les expériences entre les heures de 11:00 AM et 6:00 pm. - Étiqueter les réservoirs de telle sorte que l’État ou le génotype des animaux soit aveugle à l’expérimentat.
NOTE: les expériences peuvent facilement être aveuglées à l’expérimentat en étiquetant des réservoirs utilisant un système de lettre ou de nombre (c.-à-d., un réservoir est étiqueté «A», un autre «B», etc.). Une partie non impliquée dans les expériences étiquette les réservoirs avec un tel système, et masque les identités de l’expérimentat jusqu’à ce que la post-analyse est terminée. - À l’aide d’un filet, placer délicatement un seul adulte dans le bécher prérempli à partir de l’étape 3,1. Laisser le poisson adulte s’acclimater dans le bécher pendant 10 minutes.
NOTE: Notez le sexe de l’adulte, car il pourrait être important post-analyse pour rechercher des différences sexuelles-spécifiques. - Après acclimatation dans le bécher, introduire le poisson dans le nouveau réservoir (mis en place dans la section 1) en versant doucement l’eau et l’adulte du bécher.
- Après avoir introduit l’adulte dans le nouveau réservoir, démarrez l’enregistrement de la caméra, et éloignez-vous de la configuration pour éviter toute détresse supplémentaire pour le poisson.
- Une fois l’enregistrement terminé, retirez l’individu du nouveau réservoir et placez-le dans une nouvelle cuve de rétention.
Remarque: un réservoir de rétention différent de celui de l’étape 3,2 doit être utilisé pour éviter les essais répétés sur les mêmes individus. - Répétez les étapes 3,4 à 3,7 pour chaque adulte jusqu’à ce que tous les animaux aient été testés.
Remarque: en plus des conditions aveuglantes ou des génotypes, Randomisez les essais. Utilisez un générateur de nombres aléatoires ou tout autre outil qui permet de randomiser entre les essais. Ceci devrait être fait avant l’expérimentation afin que chaque essai soit déterminé avant que les expériences commencent. - À la fin de tous les tests, retournez le poisson à l’installation de pêche.
4. prétraitement avec le médicament
NOTE: le but des étapes suivantes est de comparer le comportement d’un individu avant et après l’utilisation de médicaments. Cette comparaison est obtenue en effectuant d’abord un nouveau test de réservoir comme à l’étape 3,4 à 3,6, suivi d’un traitement médicamenteux, puis d’un deuxième test de réservoir de nouveaux (figure 3a).
- Préparez une solution de stock du médicament, y compris les contrôles positifs et négatifs.
Remarque: si le médicament a déjà été utilisé dans la littérature, trouver une dose de travail appropriée et l’utiliser. Par exemple, pour la buspirone dans les résultats représentatifs, nous faisons une solution de stock 100X et utilisons 0,05 mg/ml comme concentration finale, comme décrit dans la littérature13,20. Si la dose suggérée est inconnue, une courbe de réponse à la dose doit être effectuée en examinant plusieurs concentrations. Mettre en place plus de Béchers avec des dilutions sérielles de drogue. Si le médicament n’est pas soluble dans l’eau, utiliser du diméthyl sulfoxyde (DMSO) comme solvant. - Diluer les médicaments à la concentration de travail dans 250 mL de Béchers avec de l’eau du système. Par exemple, si une solution 100X a été faite, diluer 1:100 dans l’eau du système. Mettre en place un bécher avec seulement l’eau du système comme un contrôle.
Remarque: si le DMSO a été utilisé comme solvant à l’étape 3,1, utiliser un volume égal de DMSO dans le bécher de contrôle. - Avec l’aide d’un autre chercheur, masquez l’identité de la drogue et contrôlez les béchers pour s’assurer que le testeur est aveugle aux conditions de traitement jusqu’à la post-analyse.
Remarque: un système de chiffres ou de lettres peut être utilisé. - Effectuez un nouveau test de réservoir en suivant les étapes 3,1 à 3,6 pour obtenir une réponse de stress comportementale de base.
- Après l’enregistrement de base, utiliser un filet pour enlever immédiatement le poisson adulte du nouveau réservoir et le placer dans le bécher dosé avec un médicament ou un véhicule, comme décrit à l’étape 4,2. Laissez l’adulte rester dans le bécher pendant 10 min.
Remarque: Assurez-vous que le filet ne touche pas l’eau des béchers pour empêcher la contamination croisée des médicaments. Assurer le bon dosage et le temps d’administration en fonction du médicament utilisé. Une durée de traitement de 10 min peut ne pas fonctionner pour tous les médicaments. - Après le traitement, utiliser un filet pour enlever l’adulte du bécher à l’étape 4,5 et le placer dans un autre bécher rempli d’eau fraîche du système seulement. Il s’agit de la période de lavage pour minimiser le dosage ultérieur pendant le deuxième test de réservoir de roman. Permettre à l’adulte de rester dans le bécher de lavage pour un supplément de 10 min.
Remarque: des filets distincts doivent être utilisés pour chaque condition médicamenteuse afin d’éviter tout traitement croisé indésirable avec la drogue. La période de lavage peut être ignorée si l’expérimenta le souhaite. - Effectuez le nouvel essai de plongée de réservoir une deuxième fois en enlevant cet adulte du bécher dans l’étape précédente, placez-le dans un nouveau réservoir de roman, et suivez les étapes 3,5 à 3,6.
- Après le deuxième essai de réservoir, retirez l’individu dans un réservoir de rétention distinct. Versez l’eau du système dans le deuxième réservoir de roman et remplissez-la d’eau fraîche pour le prochain test. Cette étape empêche la contamination croisée de tout médicament.
NOTE: selon la demi-vie des médicaments, les béchers frais contenant des médicaments doivent être faits toutes les 3 heures. Pour la buspirone, faites des solutions fraîches toutes les 3 heures. De plus, à la suite de la note de l’étape 3,8, les essais devraient être randomisés entre les contrôles et les traitements médicamenteux. - À la fin de tous les essais, retournez les individus dans l’installation de pêche.
NOTE: selon le type de médicament utilisé, les effets de ces traitements sur les individus peuvent être de longue durée. Par conséquent, ne pas utiliser ces personnes dans d’autres expériences.
5. analyse vidéo
- Après tous les essais, chargez des fichiers vidéo dans le logiciel de suivi de choix.
Remarque: nous utilisons généralement le logiciel de suivi disponible dans le commerce, mais plusieurs progiciels disponibles librement peuvent être utilisés. Les étapes pour atteindre le suivi peuvent différer selon le progiciel utilisé. - À l’aide d’une image fixe de la vidéo, définissez les limites imaginaires autour (i) de l’arène du nouveau réservoir qui est remplie d’eau, et des limites autour (II) le tiers supérieur, (III) le tiers moyen, et (IV) le tiers inférieur du réservoir. Utilisez-les pour établir le temps que les poissons ont dépensé dans chaque portion du nouveau réservoir.
- Calculez le déplacement x-y par trame pour chaque arène définie à l’étape 5,2.
- Définissez les zones supérieure, médiane et inférieure du réservoir. Chaque région doit être de taille similaire. Une brève méthode pour déterminer ces régions consiste à calculer la longueur du réservoir dans la direction y et à diviser ce nombre par 3.
Remarque: il existe des variantes du protocole général. Par exemple, certains laboratoires utilisent des moitiés au lieu des tiers14. - Déterminez le temps passé dans chaque arène, la distance et la vélocité.
Remarque: la plupart des packages de suivi calculent automatiquement ceux-ci pour l’utilisateur. Toutefois, si le logiciel de suivi ne le fait pas, ceux-ci peuvent être calculés facilement à partir des valeurs de déplacement x-y. Par exemple, la distance peut être déterminée à l’aide de la formule: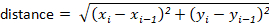
et la vélocité peuvent être déterminées à la suite de la formule: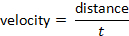
- Répétez les étapes 5,2 à 5,4 pour acquérir des pistes et des mesures pour tous les essais.
NOTE: variantes de ce protocole général
6. test de normalité
- Effectuez des statistiques avant de procéder au calcul des différences statistiques. Vérifiez si les données sont normalement distribuées à l’aide d’un test Shapiro-Wilk.
- Si l’hypothèse nulle selon laquelle les données sont normalement distribuées est rejetée (c’est-à-dire que les données ne suivent pas une distribution gaussienne), effectuez tous les tests à l’aide de tests non paramétriques. Inversement, si les données sont trouvées pour suivre une distribution normale, procédez à l’utilisation de tests paramétriques.
Remarque: nous utilisons des logiciels disponibles dans le commerce pour effectuer des statistiques; Cependant, le langage de programmation R peut également être utilisé. Une analyse Shapiro-Wilk peut être effectuée à l’aide de la fonction Shapiro. test de R.
Résultats
Examen du stress dans le zébrafish
Pour examiner le comportement du stress au fil du temps dans le zébrafish de type sauvage, nous avons testé des poissons adultes de la souche AB24 dans le test du nouveau réservoir. Les adultes AB ont été soumis au protocole tel que décrit ci-dessus. Brièvement, les poissons ont reçu une période d’acclimatation de 1 h dans un réservoir dans la salle de comportement. Une personne a été placée dans un bé...
Discussion
Le zebrafish présente une réaction de stress solide dans un nouveau char
Ici, nous décrivons une approche comportementale simple pour examiner les réponses au stress chez les adultes zebrafish, et valider l’approche comme une simple mesure du stress en utilisant la pharmacologie.
Le test du nouveau réservoir est un test largement utilisé pour examiner le stress inné chez le zébrafish et d’autres espèces de poissons12,
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts concurrentiels ou financiers.
Remerciements
Ce travail a été appuyé par le financement de la Jupiter Life Science Initiative à la Florida Atlantic University à ERD et ACK. Ces travaux ont également été soutenus par des subventions R21NS105071 (attribuées à l’ACK et à la ERD) et R15MH118625 (attribuées à la Dre) par les instituts nationaux de la santé.
matériels
| Name | Company | Catalog Number | Comments |
| Camera | We use Point Grey Grasshopper3 USB camera with lens from Edmund Optics. | ||
| Infrared filter | Edmund Optics | ||
| Video Acquisition Program | Use programs such as Virtualdub or FlyCapture because the acquisition framerate can be set. | ||
| Infrared LED lights | |||
| Assay tank | Aquaneering | Part number ZT180 | Size: M3 1.8 liter |
| Stand and clamp, or standard tripod for camera | |||
| 250mL beaker | |||
| Tracking software | We use Ethovision XT 13 from Noldus Information Technology | ||
| Buspirone chloride | Sigma-Aldrich | B7148 | |
| Randomized trial generator | We use the RANDBETWEEN function in Microsoft Excel |
Références
- McEwen, B. S. Stress, adaptation, and disease. Allostasis and allostatic load. Annals of the New York Academy of Sciences. 840, 33-44 (1998).
- Tovote, P., Fadok, J. P., Lüthi, A. Neuronal circuits for fear and anxiety. Nature Reviews Neuroscience. 16 (6), 317-331 (2015).
- Facchinello, N., et al. Nr3c1 null mutant zebrafish are viable and reveal DNA-binding-independent activities of the glucocorticoid receptor. Scientific Reports. 7 (4371), (2017).
- Ziv, L., et al. An affective disorder in zebrafish with mutation of the glucocorticoid receptor. Molecular Psychiatry. , (2013).
- Grone, B. P., Maruska, K. P. Divergent evolution of two corticotropin-releasing hormone (CRH) genes in teleost fishes. Frontiers in Neuroscience. , (2015).
- Fuller, P. J., Lim-Tio, S. S., Brennan, F. E. Specificity in mineralocorticoid versus glucocorticoid action. Kidney International. , (2000).
- Zhdanova, I. V. Sleep and its regulation in zebrafish. Reviews in the Neurosciences. 22 (1), 27-36 (2011).
- Patton, E. E., Zon, L. I. The art and design of genetic screens: zebrafish. Nature Reviews Genetics. , (2001).
- Duboué, E. R. E. R., Hong, E., Eldred, K. C. K. C., Halpern, M. E. M. E. Left Habenular Activity Attenuates Fear Responses in Larval Zebrafish. Current Biology. 27 (14), 2154-2162 (2017).
- Facchin, L., Duboue, E. R., Halpern, M. E. Disruption of Epithalamic Left-Right Asymmetry Increases Anxiety in Zebrafish. Journal of Neuroscience. 35 (48), 15847-15859 (2015).
- Øverli, &. #. 2. 1. 6. ;., Sørensen, C., Nilsson, G. E. Behavioral indicators of stress-coping style in rainbow trout: Do males and females react differently to novelty. Physiology and Behavior. , (2006).
- Levin, E. D., Bencan, Z., Cerutti, D. T. Anxiolytic effects of nicotine in zebrafish. Physiology & behavior. 90 (1), 54-58 (2007).
- Bencan, Z., Sledge, D., Levin, E. D. Buspirone, chlordiazepoxide and diazepam effects in a zebrafish model of anxiety. Pharmacology Biochemistry and Behavior. 94 (1), 75-80 (2009).
- Cachat, J., et al. Measuring behavioral and endocrine responses to novelty stress in adult zebrafish. Nature Protocols. 5 (11), 1786-1799 (2010).
- Mathuru, A. S., et al. Chondroitin fragments are odorants that trigger fear behavior in fish. Current Biology. , (2012).
- Alsop, D., Vijayan, M. The zebrafish stress axis: Molecular fallout from the teleost-specific genome duplication event. General and Comparative Endocrinology. , (2009).
- Evans, A. N., Liu, Y., MacGregor, R., Huang, V., Aguilera, G. Regulation of Hypothalamic Corticotropin-Releasing Hormone Transcription by Elevated Glucocorticoids. Molecular Endocrinology. , (2013).
- Fenoglio, K. A., Brunson, K. L., Avishai-Eliner, S., Chen, Y., Baram, T. Z. Region-specific onset of handling-induced changes in corticotropin- releasing factor and glucocorticoid receptor expression. Endocrinology. , (2004).
- Liposits, Z., et al. Ultrastructural localization of glucocorticoid receptor (GR) in hypothalamic paraventricular neurons synthesizing corticotropin releasing factor (CRF). Histochemistry. , (1987).
- Facchin, L., Duboué, E. R., Halpern, M. E. Disruption of epithalamic left-right asymmetry increases anxiety in Zebrafish. Journal of Neuroscience. 35 (48), (2015).
- Chin, J. S., et al. Convergence on reduced stress behavior in the Mexican blind cavefish. Developmental Biology. , (2018).
- Wong, K., et al. Analyzing habituation responses to novelty in zebrafish (Danio rerio). Behavioural Brain Research. 208 (2), 450-457 (2010).
- Matsunaga, W., Watanabe, E. Habituation of medaka (Oryzias latipes) demonstrated by open-field testing. Behavioural Processes. 85 (2), 142-150 (2010).
- Walker, C. Chapter 3 Haploid Screens and Gamma-Ray Mutagenesis. Methods in Cell Biology. , (1998).
- Rihel, J., et al. Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation. Science. 327, 348-351 (2010).
- Peal, D. S., Peterson, R. T., Milan, D. Small molecule screening in zebrafish. Journal of Cardiovascular Translational Research. , (2010).
- Murphey, R., Zon, L. Small molecule screening in the zebrafish. Methods. 39 (3), 255-261 (2006).
- Gammans, R. E., et al. Use of buspirone in patients with generalized anxiety disorder and coexisting depressive symptoms. A meta-analysis of eight randomized, controlled studies. Neuropsychobiology. 25 (4), 193-201 (1992).
- Maaswinkel, H., Zhu, L., Weng, W. The immediate and the delayed effects of buspirone on zebrafish (Danio rerio) in an open field test: A 3-D approach. Behavioural Brain Research. , (2012).
- Gebauer, D. L., et al. Effects of anxiolytics in zebrafish: Similarities and differences between benzodiazepines, buspirone and ethanol. Pharmacology Biochemistry and Behavior. , (2011).
- Maximino, C., et al. Fingerprinting of psychoactive drugs in zebrafish anxiety-like behaviors. PLoS ONE. , (2014).
- Horváth, J., Barkóczi, B., Müller, G., Szegedi, V. Anxious and nonanxious mice show similar hippocampal sensory evoked oscillations under urethane anesthesia: Difference in the effect of buspirone. Neural Plasticity. , (2015).
- Costall, B., Kelly, M. E., Naylor, R. J., Onaivi, E. S. Actions of buspirone in a putative model of anxiety in the mouse. Pharm Pharmacol. 40 (7), 494-500 (1988).
- Barros, M., Mello, E. L., Huston, J. P., Tomaz, C. Behavioral effects of buspirone in the marmoset employing a predator confrontation test of fear and anxiety. Pharmacology Biochemistry and Behavior. , (2001).
- Heinen-Kay, J. L., et al. Predicting multifarious behavioural divergence in the wild. Animal Behaviour. 121, 3-10 (2016).
- Thompson, R. R. J., Paul, E. S., Radford, A. N., Purser, J., Mendl, M. Routine handling methods affect behaviour of three-spined sticklebacks in a novel test of anxiety. Behavioural Brain Research. 306, 26-35 (2016).
- Hamilton, T. J., et al. Establishing zebrafish as a model to study the anxiolytic effects of scopolamine. Scientific Reports. , (2017).
- York, R. A., Fernald, R. D. The Repeated Evolution of Behavior. Frontiers in Ecology and Evolution. 4, 143 (2017).
- Jakka, N. M., Rao, T. G., Rao, J. V. Locomotor behavioral response of mosquitofish (Gambusia affinis) to subacute mercury stress monitored by video tracking system. Drug and Chemical Toxicology. , (2007).
- Hu, C. K., Brunet, A. The African turquoise killifish: A research organism to study vertebrate aging and diapause. Aging Cell. , (2018).
- Maximino, C., et al. Measuring anxiety in zebrafish: A critical review. Behavioural Brain Research. 214 (2), 157-171 (2010).
- Maximino, C., Marques de Brito, T., Dias, C. A. G., Gouveia, A., Morato, S. Scototaxis as anxiety-like behavior in fish. Nature protocols. 5 (2), 209-216 (2010).
- Godwin, J., Sawyer, S., Perrin, F., Oxendine, S., Kezios, Z. Adapting the Open Field Test to assess anxiety related behavior in zebrafish. Zebrafish Protocols for Neurobehavioral Research. , 181-189 (2012).
- Agetsuma, M., et al. The habenula is crucial for experience-dependent modification of fear responses in zebrafish. Nature Neuroscience. 13 (11), 1354-1356 (2010).
- Valente, A., Huang, K. H., Portugues, R., Engert, F. Ontogeny of classical and operant learning behaviors in zebrafish. Learning and Memory. , (2012).
- Baker, M. R., Goodman, A. C., Santo, J. B., Wong, R. Y. Repeatability and reliability of exploratory behavior in proactive and reactive zebrafish, Danio rerio. Scientific Reports. , (2018).
- Friedrich, R. W., Genoud, C., Wanner, A. A. Analyzing the structure and function of neuronal circuits in zebrafish. Frontiers in Neural Circuits. , 7 (2013).
- Friedrich, R. W., Jacobson, G. A., Zhu, P. Circuit Neuroscience in Zebrafish. Current Biology. 20 (8), (2010).
- Marquart, G. D., et al. A 3D Searchable Database of Transgenic Zebrafish Gal4 and Cre Lines for Functional Neuroanatomy Studies. Frontiers in Neural Circuits. , (2015).
- Randlett, O., et al. Whole-brain activity mapping onto a zebrafish brain atlas. Nature Methods. 12 (11), 1039-1046 (2015).
- Gupta, T., et al. Morphometric analysis and neuroanatomical mapping of the zebrafish brain. Methods. 1046 (18), 30011-30012 (2018).
- Marquart, G. D., et al. High-precision registration between zebrafish brain atlases using symmetric diffeomorphic normalization. GigaScience. , (2017).
- Ronneberger, O., et al. ViBE-Z: A framework for 3D virtual colocalization analysis in zebrafish larval brains. Nature Methods. , (2012).
- Subedi, A., et al. Adoption of the Q transcriptional regulatory system for zebrafish transgenesis. Methods. 66 (3), 433-440 (2014).
- Scheer, N., Campos-Ortega, J. A. Use of the Gal4-UAS technique for targeted gene expression in the zebrafish. Mechanisms of Development. 80 (2), 153-158 (1999).
- Chatterjee, D., Tran, S., Shams, S., Gerlai, R. A Simple Method for Immunohistochemical Staining of Zebrafish Brain Sections for c-fos Protein Expression. Zebrafish. , (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon