Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Enfoques conductuales para estudiar el estrés innato en el pez cebra
En este artículo
Resumen
Este manuscrito describe un método simple para medir el estrés de forma oral en el pez cebra adulto. El enfoque aprovecha la tendencia innata que el pez cebra prefiere la mitad inferior de un tanque cuando está en un estado estresante. También describimos métodos para acoplar el ensayo con farmacología.
Resumen
Responder apropiadamente a estímulos estresantes es esencial para la supervivencia de un organismo. Se ha realizado una extensa investigación sobre un amplio espectro de enfermedades relacionadas con el estrés y trastornos psiquiátricos, pero aún se requieren más estudios sobre la regulación genética y neuronal del estrés para desarrollar una mejor terapéutica. El pez cebra proporciona un poderoso modelo genético para investigar los fundamentos neurales del estrés, ya que existe una gran colección de líneas mutantes y transgénicas. Además, la farmacología se puede aplicar fácilmente al pez cebra, ya que la mayoría de los fármacos se pueden agregar directamente al agua. Describimos aquí el uso de la ' prueba de tanque de novela ' como un método para estudiar las respuestas de estrés innata en el pez cebra, y demostrar cómo los fármacos ansiolíticos potenciales pueden ser validados utilizando el ensayo. El método se puede acoplar fácilmente con las líneas de pez cebra que albergan mutaciones genéticas, o aquellos en los que se utilizan enfoques transgénicos para manipular circuitos neuronales precisos. El ensayo también se puede utilizar en otros modelos de peces. En conjunto, el protocolo descrito debería facilitar la adopción de este sencillo ensayo a otros laboratorios.
Introducción
Las respuestas de estrés son estados fisiológicos y conductuales alterados resultantes de estímulos potencialmente dañinos o aversivos. Las respuestas al estrés se conservan en todo el reino animal, y son fundamentales para la supervivencia de un organismo1. Décadas de investigación han ampliado en gran medida nuestro conocimiento de algunos de los mecanismos genéticos y neuronales subyacentes Estados de estrés. En la actualidad, las áreas del cerebro, como la amígdala y el estriado2, y los factores genéticos como la hormona liberadora de corticotropina (CRH) y los receptores glucocorticoides (gr) y mineralocorticoides ( Mr) se han estudiado extensamente3,4,5,6. A pesar de estos hallazgos críticos, todavía se desconoce mucho sobre la regulación genética y neuronal del estrés. Como tal, muchos trastornos relacionados con el estrés sufren de una falta de terapias.
Los organismos modelo genéticamente modificables proporcionan una herramienta útil en el estudio del control genético y neuronal del comportamiento. Los modelos de peces, en particular, son extremadamente poderosos: son pequeños organismos con tiempos de generación corta, su uso en un entorno de laboratorio es Facile, sus genomas son fácilmente modificados, y, como vertebrados, comparten no sólo genética, sino también neuroanatómico homología con sus homólogosdemamífero7,8. Los ensayos estándar para medir el estrés se pueden emparejar con las líneas de pez cebra que albergan mutaciones genéticas, o aquellas en las que es posible manipular subconjuntos neuronales precisos, y los efectos de genes individuales o neuronas definidas pueden evaluarse de forma rápida y eficiente.
El comportamiento, las respuestas de estrés se pueden caracterizar en el pescado como períodos de hiper-actividad o períodos prolongados de inactividad (similar a ' congelación ')9, reducción de la exploración10, respiración rápida, reducción de la ingesta de alimentos11, y un lugar-preferencia para el fondo de un tanque12. Por ejemplo, cuando se coloca en un tanque desconocido, pez cebra adulto y otros modelos de peces pequeños muestran una preferencia inicial para la mitad inferior del tanque, sin embargo, con el tiempo, los peces comienzan a explorar las mitades superior e inferior con la frecuencia casi igual12. El tratamiento de los adultos con fármacos conocidos para reducir la ansiedad causa que los peces exploren inmediatamente la mitad superior10,13. Por el contrario, los fármacos que aumentan la ansiedad causan que los peces muestren una fuerte preferencia por la mitad inferior del tanque12,14,15. Por lo tanto, la exploración reducida y la preferencia por la mitad inferior del tanque son indicadores simples y confiables de estrés.
Como la mayoría de los vertebrados, las respuestas de estrés en los peces son impulsadas por la activación del eje hipotalámico-pituitario-inter-renal (HPI; análogo al eje hipotalámico-pituitario-suprarrenal [hPa] en mamíferos)14,16. Las neuronas hipotalámicas que expresan la hormona liberadora de corticotropina hormonal (CRH) la señal a la hipófisis, que a su vez libera la hormona liberadora adrenocorticotropa (ACTH). ACTH entonces señala a la glándula Interrenal para producir y secretar cortisol, que tiene una serie de objetivos descendentes16, uno de ellos siendo retroalimentación negativa de las neuronas hipotalámicas que producen CRH3,17, 18,19.
Aquí describimos un método para evaluar las medidas conductuales del estrés innato. Para el comportamiento, detallamos los protocolos usando la nueva prueba de buceo de tanque12,14. A continuación, demostramos, como ejemplo, que un fármaco ansiolítico conocido, la buspirona, reduce las medidas conductuales del estrés.
Protocolo
El protocolo ha sido aprobado por el Comité institucional de cuidado de animales y uso de la Universidad atlántica de Florida Atlantic.
1. preparación
- Designe una habitación aislada para realizar estudios de comportamiento o cierre una sección de una habitación para que se aísla.
Nota: la habitación debe estar sin perturbaciones y tener poco tráfico para evitar alterar el comportamiento normal de los peces. - Mueva los siguientes materiales y equipos a la sala de comportamiento: (i) una cámara y una lente, (II) un filtro infrarrojo que se puede adjuntar a la lente, (III) un soporte de cámara, (IV) un ordenador con software de adquisición de cámara, (v) una mesa firme y estable para realizar el ensayo on, (VI) luces infrarrojas (luces IR; 850 nm o 940 nm), (VII) un difusor de acrílico blanco, que es más largo que la longitud del tanque de grabación (VIII) 1,8 L tanque de ensayo de plástico trapezoidal (conocido como el "tanque de novela"; el que se utiliza aquí es 12 x 18 pulgadas) , y (IX) un cubo de agua del sistema de peces.
Nota: para el tanque de novela, nuestro laboratorio utiliza recipientes de plástico disponibles comercialmente, que son de forma trapezoidal. Las dimensiones del tanque son aproximadamente 6 en x 9 en (las dimensiones detalladas se proporcionan en la figura 1A). La placa difusora que utilizamos es ligeramente más grande que el nuevo tanque (12 en x 18 pulg). Se han llevado a cabo experimentos con tanques que tienen diferentes formas, como las que son rectangulares o las que tienen distintas dimensiones trapezoidales20,21. Típicamente, el comportamiento de los peces es similar en todos los tanques independientemente de sus dimensiones: para todos los recipientes, los peces prefieren inicialmente la mitad inferior, pero con el tiempo comienzan a explorar la mitad superior con mayor frecuencia. - Conecte el filtro infrarrojo a la lente de la cámara. Las longitudes de onda de las tiras de luz infrarroja suelen oscilar entre 850 nm y 940 nm. El filtro es un filtro de paso largo que restringe la luz de longitudes de onda menos de 720 nm de transmitir a través de la cámara.
- Seleccione los parámetros adecuados para el software de adquisición de cámara. Para la mayoría de las grabaciones, establezca la adquisición de la cámara a una velocidad de 30 fotogramas por segundo y la duración de la grabación a 10 minutos.
Nota: estos parámetros pueden diferir, dependiendo del experimento. Por ejemplo, para estudiar la habituación en un nuevo tanque22,23, es posible que se requieran grabaciones más largas.
2. configuración
Nota: los pasos descritos en esta sección describen la configuración del ensayo del nuevo tanque. Un diagrama del producto final se da en la figura 1B.
- Coloque el tanque de novela en el centro de la mesa.
- Coloque las luces infrarrojas detrás del tanque y coloque la lámina acrílica blanca o la pantalla del difusor entre el tanque y la fuente de luz LED.
- Colocar el difusor de manera que se extienda al máximo la luz procedente de los LEDs, y la intensidad de la luz es suficiente para iluminar el nuevo tanque. Cuanto más cerca esté el tablero de la fuente de luz, más brillantes serán las luces, pero menos se difundiran. Por el contrario, colocar la placa difusora lejos de la fuente de luz reducirá la intensidad de la luz, pero esparcirá mejor la luz.
- Llene aproximadamente tres cuartas partes del tanque de novela con agua del sistema de peces.
Nota: el agua del sistema se genera utilizando ósmosis inversa de agua del grifo, seguida de dosificación tal que la conductividad equivale a 900 ± 100 μS, que el pH es neutro (7,2), y que la temperatura es de 27 ± 1 ° c. - Fije la cámara al soporte de la cámara y conecte la cámara al ordenador. Abra el software de adquisición de vídeo y ajuste la cámara para que se enfrente al frente del tanque y asegúrese de que se puede ver todo el tanque de novela y que no hay áreas ocultas en el video. Ajuste el tanque y las luces infrarrojas de tal forma que haya suficiente e incluso la iluminación en todo el tanque cuando se observa a través de la cámara.
Nota: antes de continuar con los experimentos, a menudo puede ser útil realizar una ejecución de prueba, en el que se captura el vídeo de un pez y se realiza el seguimiento. Esto garantizará que la configuración sea suficiente para la experimentación de comportamiento.
3. configuración de prueba de tanque novedoso
- Prepare un vaso de precipitados de 250 mL precargada con agua del sistema de peces y al menos dos tanques de retención.
- En la mañana de la prueba, transferir al menos 10 peces cebra adultos para ser utilizado para cada condición experimental (controles y adultos experimentales) de la instalación de pescado en un tanque de retención, transferirlos a la sala de comportamiento, y les permiten aclimatarse para al menos un Hora.
Nota: un análisis de potencia debe realizarse antes de la experimentación, sin embargo, en nuestras manos, un n = 10 es generalmente suficiente para detectar significancia estadística. Por otra parte, el tanque de retención debe contener no más de cinco individuos por litro de agua. Una aclimatación de una hora es suficiente ya que se ha demostrado que los adultos de pez cebra se acostumbran a los 30 minutos de un nuevo tanque22. También, los ritmos de comportamiento se ven afectados por los procesos circadianos, y por lo tanto las réplicas experimentales realizadas en diferentes días deben realizarse dentro de las mismas horas. Normalmente realizamos todos los experimentos entre las horas de 11:00 AM y 6:00 pm. - Etiquetar los tanques de tal forma que la condición o el genotipo de los animales sea ciego al experimentante.
Nota: los experimentos pueden ser fácilmente cegados al experimentador mediante el etiquetado de tanques utilizando un sistema de letras o números (es decir, un tanque está etiquetado como ' A ', otro ' B ', etc.). Una parte que no participe en los experimentos etiqueta a los tanques con un sistema de este tipo, y enmascara las identidades del experimentante hasta que finalice el análisis posterior. - Con una red, Coloque suavemente un solo adulto en el vaso de precipitados precargada del paso 3,1. Permitir que los peces adultos aclimatarse en el vaso de precipitados durante 10 minutos.
Nota: Registre el sexo del adulto, ya que podría ser importante después del análisis para buscar diferencias específicas de sexo. - Después de la aclimatación en el vaso de precipitados, introducir el pez en el tanque de la novela (establecido en la sección 1) derramando suavemente el agua y el adulto del vaso de precipitados.
- Después de introducir al adulto en el tanque de la novela, iniciar la grabación de la cámara, y alejarse de la configuración para evitar la angustia adicional a los peces.
- Después de que la grabación haya finalizado, retire el individuo del tanque de novela y colóquelo en un nuevo tanque de sujeción.
Nota: se debe utilizar un tanque de retención diferente al del paso 3,2 para evitar pruebas repetidas en las mismas personas. - Repita los pasos 3,4 a 3,7 para cada adulto hasta que todos los animales hayan sido probados.
Nota: además de las condiciones de ceguera o genotipos, aleatorizar los ensayos. Utilice un generador de números aleatorios o cualquier herramienta que permita aleatorizarse entre las pruebas. Esto debe hacerse antes de la experimentación para que cada ensayo se determine antes de que comiencen los experimentos. - Al final de todas las pruebas, devuelva el pez de vuelta a la instalación de pescado.
4. pretratamiento con fármacos
Nota: el objetivo de los siguientes pasos es comparar el comportamiento de un individuo antes y después del uso de drogas. Esta comparación se logra mediante la realización en primer lugar de una nueva prueba de tanque como en el paso 3,4 a 3,6, seguido por el tratamiento de drogas, y luego una segunda prueba de tanque de novela (figura 3a).
- Preparar una solución de acción de la droga, incluyendo controles positivos y negativos.
Nota: Si el fármaco se ha utilizado previamente en la literatura, encontrar una dosis de trabajo adecuada y utilizar esto. Por ejemplo, para buspirona en los resultados representativos, hacemos una solución stock 100x y utilizamos 0,05 mg/ml como la concentración final, como se describe en la literatura13,20. Si se desconoce la dosis sugerida, se debe realizar una curva de respuesta de dosis examinando varias concentraciones. Establecer más vasos con diluciones seriales de drogas. Si el fármaco no es soluble en agua, utilice sulfóxido de dimetilo (DMSO) como disolvente. - Diluir los fármacos a la concentración de trabajo en vasos de 250 mL con agua del sistema. Por ejemplo, si se hizo una solución 100x, diluir 1:100 en agua del sistema. Configure un vaso de precipitados con sólo agua del sistema como control.
Nota: si se usó DMSO como disolvente en el paso 3,1, utilice un volumen igual de DMSO en el vaso de control. - Con la ayuda de otro investigador, enmascarar las identidades de la droga y el control de vasos para asegurarse de que el probador es ciego a las condiciones de tratamiento hasta el post-análisis.
Nota: se puede utilizar un sistema de números o letras. - Realice una nueva prueba de tanque siguiendo los pasos 3,1 a 3,6 para obtener una respuesta de tensión de comportamiento basal.
- Después de la grabación de línea de base, utilice una red para retirar inmediatamente el pez adulto del tanque de novela y colocarlo en el vaso dosificador con droga o vehículo, como se describe en el paso 4,2. Deje que el adulto permanezca en el vaso durante 10 min.
Nota: Asegúrese de que la red no toque el agua de los vasos para evitar la contaminación cruzada de los fármacos. Asegurar la dosis adecuada y el tiempo de administración dependiendo de la droga utilizada. Un tiempo de tratamiento de 10 minutos podría no funcionar para todos los fármacos. - Después del tratamiento, utilice una red para retirar al adulto del vaso de precipitados en el paso 4,5 y colóquelo en otro vaso lleno con agua fresca del sistema solamente. Este es el período de lavado para minimizar la dosificación adicional durante la segunda prueba de tanque de novela. Deje que el adulto permanezca en el vaso de precipitados de lavado durante 10 minutos adicionales.
Nota: se deben utilizar redes separadas para cada condición de fármaco para prevenir cualquier tratamiento cruzado no deseado con drogas. El período de lavado puede omitirse si el experimentante lo desea. - Realice la nueva prueba de buceo del tanque por segunda vez quitando ese adulto del vaso en el paso anterior, colóquelo en un nuevo tanque de novela y siga los pasos 3,5 a 3,6.
- Después de la segunda prueba de tanque de novela, retire el individuo en un tanque de retención independiente. Vierta el agua del sistema en el segundo tanque de novela y llénelo con agua fresca del sistema para la siguiente prueba. Este paso evita la contaminación cruzada de cualquier fármaco.
Nota: dependiendo de la vida media de los fármacos, vasos frescos que contienen fármacos deben hacerse cada 3 horas. Para buspirone, hacer soluciones frescas cada 3 horas. Además, siguiendo la nota en el paso 3,8, los ensayos deben ser aleatorizados entre controles y tratamientos farmacológico. - Al final de todas las pruebas, devuelva a las personas a las instalaciones de peces.
Nota: dependiendo del tipo de fármaco utilizado, los efectos de estos tratamientos en las personas pueden ser de larga duración. Por lo tanto, no utilice estos individuos en otros experimentos.
5. Análisis de vídeo
- Después de todas las pruebas, cargue los archivos de vídeo en el software de seguimiento de elección.
Nota: normalmente utilizamos software de rastreo disponible comercialmente, pero se pueden usar varios paquetes de software disponibles de libre uso. Los pasos para lograr el seguimiento pueden diferir según el paquete de software utilizado. - Usando un marco inmóvil del video, defina los límites imaginarios alrededor de (i) la nueva arena de tanques que está llena de agua, y los límites alrededor de (II) el tercio superior, (III) el tercio medio, y (IV) tercio inferior del tanque. Utilice estos para establecer el tiempo que el pez gastado en cada porción del tanque de novela.
- Calcule el desplazamiento x-y por trama para cada arena definida en el paso 5,2.
- Defina las áreas superior, media e inferior del tanque. Cada región debe tener un tamaño similar. Un método breve para determinar estas regiones es calcular la longitud del tanque en la dirección y, y dividirlo por 3.
Nota: existen variaciones en el protocolo general. Por ejemplo, algunos laboratorios usan mitades en lugar de los tercios14. - Determine el tiempo invertido en cada arena, la distancia y la velocidad.
Nota: la mayoría de los paquetes de rastreo los calcularán automáticamente para el usuario. Sin embargo, si el software de seguimiento no lo hace, estos se pueden calcular fácilmente a partir de los valores de desplazamiento x-y. Por ejemplo, la distancia se puede determinar utilizando la fórmula: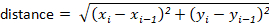
y la velocidad se pueden determinar siguiendo la fórmula: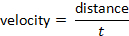
- Repita los pasos 5,2 a 5,4 para adquirir pistas y mediciones para todos los ensayos.
Nota: las variaciones de este protocolo general
6. pruebas de normalidad
- Realice las estadísticas antes de proceder a calcular las diferencias estadísticas. Compruebe si los datos se distribuyen normalmente mediante una prueba de Shapiro-Wilk.
- Si se rechaza la hipótesis nula de que los datos se distribuyen normalmente (es decir, los datos no siguen una distribución gaussiana), realice todas las pruebas mediante pruebas no paramétricas. Por el contrario, si se encuentra que los datos siguen una distribución normal, proceda a utilizar pruebas paramétricas.
Nota: Utilizamos software comercialmente disponible para realizar estadísticas; sin embargo, también se puede utilizar el lenguaje de programación R. Un análisis de Shapiro-Wilk se puede realizar utilizando la función Shapiro. test de R.
Resultados
Examinar el estrés en el pez cebra
Para examinar el comportamiento del estrés a lo largo del tiempo en el pez cebra silvestre, probamos el pescado adulto de la cepa AB24 en la prueba del tanque novel. Los adultos AB fueron sometidos al Protocolo como se describió anteriormente. Brevemente, a los peces se les dio un período de aclimatación de 1-h en un tanque en la sala de comportamiento. Un individuo fue colocado en un vaso de precipitados durante ...
Discusión
El pez cebra exhibe una respuesta de estrés robusta en un nuevo tanque
Aquí describimos un enfoque de comportamiento simple para examinar las respuestas de estrés en el pez cebra adulto, y validar el enfoque como una medida simple de estrés usando farmacología.
La prueba de tanque novel es una prueba ampliamente utilizada para examinar el estrés innato en el pez cebra y otras especies de peces12,14,
Divulgaciones
Los autores declaran que no tienen intereses competidores o financieros.
Agradecimientos
Este trabajo fue apoyado por el financiamiento de la iniciativa de ciencia de vida de Júpiter en la Universidad atlántica de Florida a ERD y ACK. Este trabajo también fue apoyado por subvenciones R21NS105071 (otorgadas a ACK y ERD) y R15MH118625 (otorgadas a ERD) de los institutos nacionales de salud.
Materiales
| Name | Company | Catalog Number | Comments |
| Camera | We use Point Grey Grasshopper3 USB camera with lens from Edmund Optics. | ||
| Infrared filter | Edmund Optics | ||
| Video Acquisition Program | Use programs such as Virtualdub or FlyCapture because the acquisition framerate can be set. | ||
| Infrared LED lights | |||
| Assay tank | Aquaneering | Part number ZT180 | Size: M3 1.8 liter |
| Stand and clamp, or standard tripod for camera | |||
| 250mL beaker | |||
| Tracking software | We use Ethovision XT 13 from Noldus Information Technology | ||
| Buspirone chloride | Sigma-Aldrich | B7148 | |
| Randomized trial generator | We use the RANDBETWEEN function in Microsoft Excel |
Referencias
- McEwen, B. S. Stress, adaptation, and disease. Allostasis and allostatic load. Annals of the New York Academy of Sciences. 840, 33-44 (1998).
- Tovote, P., Fadok, J. P., Lüthi, A. Neuronal circuits for fear and anxiety. Nature Reviews Neuroscience. 16 (6), 317-331 (2015).
- Facchinello, N., et al. Nr3c1 null mutant zebrafish are viable and reveal DNA-binding-independent activities of the glucocorticoid receptor. Scientific Reports. 7 (4371), (2017).
- Ziv, L., et al. An affective disorder in zebrafish with mutation of the glucocorticoid receptor. Molecular Psychiatry. , (2013).
- Grone, B. P., Maruska, K. P. Divergent evolution of two corticotropin-releasing hormone (CRH) genes in teleost fishes. Frontiers in Neuroscience. , (2015).
- Fuller, P. J., Lim-Tio, S. S., Brennan, F. E. Specificity in mineralocorticoid versus glucocorticoid action. Kidney International. , (2000).
- Zhdanova, I. V. Sleep and its regulation in zebrafish. Reviews in the Neurosciences. 22 (1), 27-36 (2011).
- Patton, E. E., Zon, L. I. The art and design of genetic screens: zebrafish. Nature Reviews Genetics. , (2001).
- Duboué, E. R. E. R., Hong, E., Eldred, K. C. K. C., Halpern, M. E. M. E. Left Habenular Activity Attenuates Fear Responses in Larval Zebrafish. Current Biology. 27 (14), 2154-2162 (2017).
- Facchin, L., Duboue, E. R., Halpern, M. E. Disruption of Epithalamic Left-Right Asymmetry Increases Anxiety in Zebrafish. Journal of Neuroscience. 35 (48), 15847-15859 (2015).
- Øverli, &. #. 2. 1. 6. ;., Sørensen, C., Nilsson, G. E. Behavioral indicators of stress-coping style in rainbow trout: Do males and females react differently to novelty. Physiology and Behavior. , (2006).
- Levin, E. D., Bencan, Z., Cerutti, D. T. Anxiolytic effects of nicotine in zebrafish. Physiology & behavior. 90 (1), 54-58 (2007).
- Bencan, Z., Sledge, D., Levin, E. D. Buspirone, chlordiazepoxide and diazepam effects in a zebrafish model of anxiety. Pharmacology Biochemistry and Behavior. 94 (1), 75-80 (2009).
- Cachat, J., et al. Measuring behavioral and endocrine responses to novelty stress in adult zebrafish. Nature Protocols. 5 (11), 1786-1799 (2010).
- Mathuru, A. S., et al. Chondroitin fragments are odorants that trigger fear behavior in fish. Current Biology. , (2012).
- Alsop, D., Vijayan, M. The zebrafish stress axis: Molecular fallout from the teleost-specific genome duplication event. General and Comparative Endocrinology. , (2009).
- Evans, A. N., Liu, Y., MacGregor, R., Huang, V., Aguilera, G. Regulation of Hypothalamic Corticotropin-Releasing Hormone Transcription by Elevated Glucocorticoids. Molecular Endocrinology. , (2013).
- Fenoglio, K. A., Brunson, K. L., Avishai-Eliner, S., Chen, Y., Baram, T. Z. Region-specific onset of handling-induced changes in corticotropin- releasing factor and glucocorticoid receptor expression. Endocrinology. , (2004).
- Liposits, Z., et al. Ultrastructural localization of glucocorticoid receptor (GR) in hypothalamic paraventricular neurons synthesizing corticotropin releasing factor (CRF). Histochemistry. , (1987).
- Facchin, L., Duboué, E. R., Halpern, M. E. Disruption of epithalamic left-right asymmetry increases anxiety in Zebrafish. Journal of Neuroscience. 35 (48), (2015).
- Chin, J. S., et al. Convergence on reduced stress behavior in the Mexican blind cavefish. Developmental Biology. , (2018).
- Wong, K., et al. Analyzing habituation responses to novelty in zebrafish (Danio rerio). Behavioural Brain Research. 208 (2), 450-457 (2010).
- Matsunaga, W., Watanabe, E. Habituation of medaka (Oryzias latipes) demonstrated by open-field testing. Behavioural Processes. 85 (2), 142-150 (2010).
- Walker, C. Chapter 3 Haploid Screens and Gamma-Ray Mutagenesis. Methods in Cell Biology. , (1998).
- Rihel, J., et al. Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation. Science. 327, 348-351 (2010).
- Peal, D. S., Peterson, R. T., Milan, D. Small molecule screening in zebrafish. Journal of Cardiovascular Translational Research. , (2010).
- Murphey, R., Zon, L. Small molecule screening in the zebrafish. Methods. 39 (3), 255-261 (2006).
- Gammans, R. E., et al. Use of buspirone in patients with generalized anxiety disorder and coexisting depressive symptoms. A meta-analysis of eight randomized, controlled studies. Neuropsychobiology. 25 (4), 193-201 (1992).
- Maaswinkel, H., Zhu, L., Weng, W. The immediate and the delayed effects of buspirone on zebrafish (Danio rerio) in an open field test: A 3-D approach. Behavioural Brain Research. , (2012).
- Gebauer, D. L., et al. Effects of anxiolytics in zebrafish: Similarities and differences between benzodiazepines, buspirone and ethanol. Pharmacology Biochemistry and Behavior. , (2011).
- Maximino, C., et al. Fingerprinting of psychoactive drugs in zebrafish anxiety-like behaviors. PLoS ONE. , (2014).
- Horváth, J., Barkóczi, B., Müller, G., Szegedi, V. Anxious and nonanxious mice show similar hippocampal sensory evoked oscillations under urethane anesthesia: Difference in the effect of buspirone. Neural Plasticity. , (2015).
- Costall, B., Kelly, M. E., Naylor, R. J., Onaivi, E. S. Actions of buspirone in a putative model of anxiety in the mouse. Pharm Pharmacol. 40 (7), 494-500 (1988).
- Barros, M., Mello, E. L., Huston, J. P., Tomaz, C. Behavioral effects of buspirone in the marmoset employing a predator confrontation test of fear and anxiety. Pharmacology Biochemistry and Behavior. , (2001).
- Heinen-Kay, J. L., et al. Predicting multifarious behavioural divergence in the wild. Animal Behaviour. 121, 3-10 (2016).
- Thompson, R. R. J., Paul, E. S., Radford, A. N., Purser, J., Mendl, M. Routine handling methods affect behaviour of three-spined sticklebacks in a novel test of anxiety. Behavioural Brain Research. 306, 26-35 (2016).
- Hamilton, T. J., et al. Establishing zebrafish as a model to study the anxiolytic effects of scopolamine. Scientific Reports. , (2017).
- York, R. A., Fernald, R. D. The Repeated Evolution of Behavior. Frontiers in Ecology and Evolution. 4, 143 (2017).
- Jakka, N. M., Rao, T. G., Rao, J. V. Locomotor behavioral response of mosquitofish (Gambusia affinis) to subacute mercury stress monitored by video tracking system. Drug and Chemical Toxicology. , (2007).
- Hu, C. K., Brunet, A. The African turquoise killifish: A research organism to study vertebrate aging and diapause. Aging Cell. , (2018).
- Maximino, C., et al. Measuring anxiety in zebrafish: A critical review. Behavioural Brain Research. 214 (2), 157-171 (2010).
- Maximino, C., Marques de Brito, T., Dias, C. A. G., Gouveia, A., Morato, S. Scototaxis as anxiety-like behavior in fish. Nature protocols. 5 (2), 209-216 (2010).
- Godwin, J., Sawyer, S., Perrin, F., Oxendine, S., Kezios, Z. Adapting the Open Field Test to assess anxiety related behavior in zebrafish. Zebrafish Protocols for Neurobehavioral Research. , 181-189 (2012).
- Agetsuma, M., et al. The habenula is crucial for experience-dependent modification of fear responses in zebrafish. Nature Neuroscience. 13 (11), 1354-1356 (2010).
- Valente, A., Huang, K. H., Portugues, R., Engert, F. Ontogeny of classical and operant learning behaviors in zebrafish. Learning and Memory. , (2012).
- Baker, M. R., Goodman, A. C., Santo, J. B., Wong, R. Y. Repeatability and reliability of exploratory behavior in proactive and reactive zebrafish, Danio rerio. Scientific Reports. , (2018).
- Friedrich, R. W., Genoud, C., Wanner, A. A. Analyzing the structure and function of neuronal circuits in zebrafish. Frontiers in Neural Circuits. , 7 (2013).
- Friedrich, R. W., Jacobson, G. A., Zhu, P. Circuit Neuroscience in Zebrafish. Current Biology. 20 (8), (2010).
- Marquart, G. D., et al. A 3D Searchable Database of Transgenic Zebrafish Gal4 and Cre Lines for Functional Neuroanatomy Studies. Frontiers in Neural Circuits. , (2015).
- Randlett, O., et al. Whole-brain activity mapping onto a zebrafish brain atlas. Nature Methods. 12 (11), 1039-1046 (2015).
- Gupta, T., et al. Morphometric analysis and neuroanatomical mapping of the zebrafish brain. Methods. 1046 (18), 30011-30012 (2018).
- Marquart, G. D., et al. High-precision registration between zebrafish brain atlases using symmetric diffeomorphic normalization. GigaScience. , (2017).
- Ronneberger, O., et al. ViBE-Z: A framework for 3D virtual colocalization analysis in zebrafish larval brains. Nature Methods. , (2012).
- Subedi, A., et al. Adoption of the Q transcriptional regulatory system for zebrafish transgenesis. Methods. 66 (3), 433-440 (2014).
- Scheer, N., Campos-Ortega, J. A. Use of the Gal4-UAS technique for targeted gene expression in the zebrafish. Mechanisms of Development. 80 (2), 153-158 (1999).
- Chatterjee, D., Tran, S., Shams, S., Gerlai, R. A Simple Method for Immunohistochemical Staining of Zebrafish Brain Sections for c-fos Protein Expression. Zebrafish. , (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados