需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
活体细胞毒性试验研究肿瘤特异性 CD8+ t 细胞反应中的免疫调节
摘要
我们这里描述了一种基于流式细胞仪的体内杀伤检测方法, 该方法能够检查细胞毒性 T 淋巴细胞 (CTL) 对模型肿瘤抗原的反应中的免疫调节。我们提供了如何将这种优雅的检测方法用于机械研究和药物疗效测试的示例。
摘要
羧基荧光素琥珀酰亚胺酯 (CFSE) 在体内细胞毒性检测, 使敏感和准确的定量 Cd8+细胞溶解 t 淋巴细胞 (ctl) 反应获得对肿瘤和病原源肽。与传统的杀虫检测相比, 它们具有几个优势。首先, 他们允许监测 ctl 介导的细胞毒性在建筑学完整的继发性淋巴器官, 通常在脾脏。其次, 它们允许在 CTL 响应的启动、效应和召回阶段进行机械研究。第三, 它们为在真正的体内环境中进行疫苗/药物药效检测提供了有用的平台。在这里, 我们提供了一个优化的方案, 用于检查伴随 CTL 响应的一个以上肽表位的模型肿瘤抗原 (Ag), 即 simian 病毒 40 (SV40) 编码大 T ag (T Ag)。与大多数其他与临床相关的肿瘤蛋白一样, T Ag 含有许多潜在的免疫原肽。然而, 只有四种此类肽可在 c57bl6 小鼠体内诱导可检测到的 CTL 反应。这些响应根据其大小一致地按层次顺序排列, 这构成了在这个强大的系统中 tCd8 "免疫调节" 的基础。因此, T ag 特异性 TCd8反应的大部分集中在单个免疫多瘤表位, 而其他三个表位被识别, 反应很弱。免疫调节损害了抗肿瘤 TCd8反应的广度, 因此被许多人认为是成功接种抗癌疫苗的障碍。因此, 了解决定或塑造Tcd8免疫调节的细胞和分子因素及其机制是非常重要的。我们在这里描述的协议是针对 T Ag 免疫模型中这一现象的研究量身定制的, 但可以很容易地修改和推广到其他肿瘤模型中的类似研究。我们提供了如何使用体内细胞毒性检测来衡量实验性免疫治疗干预措施的影响的例子。
引言
常规 CD8+ t 细胞 (t cd8) 在抗癌免疫监测中发挥着重要作用。它们主要在细胞分裂 t 淋巴细胞 (Ctl) 的能力, 识别肿瘤特异性或相关的肽抗原 (Ags) 显示在主要组织相容性复合体 (MHC) i 类分子的闭合裂隙中。全副武装的 Ctl 利用其细胞毒性武库来摧毁恶性细胞。抗癌 TCd8 可以检测到在循环中, 甚至在许多癌症患者和肿瘤动物的原发和转移性肿块内。然而, 它们往往是过敏或精疲力竭的, 无法根除癌症。因此, 许多免疫治疗方式旨在增加抗癌 TCd8频率, 并恢复和提高其功能。
肿瘤蛋白含有许多肽, 其中一些可以是免疫原性的, 并具有潜在的免疫保护。然而, 可量化的 TCd8 反应是以不同的大小获得的, 而只是对少数肽的反应。这在 TCd8克隆1之间创建了一个 "免疫调节层次结构"。因此, 免疫球蛋白 (ID)t Cd8 占据显著的等级等级, 这通常是由它们的丰度来判断的。相反, tCd8 细胞的 t 细胞受体 (tcr) 是特定的亚显性 (sd) 表位发生在较低的频率。我们和其他人已经确定了一些因素, 决定或塑造免疫调节在 TCd8反应。除其他外, 这些模式包括对天真的 tcd8的 ag 呈现模式 (即直接呈现、交叉呈现、变装)2、3、4、ag呈现细胞的类型 (apc)参与 tcd8活化5, 蛋白质 ags6,7的丰度和稳定性, 以及蛋白酶体 7,8,与 g 处理 (tap) 相关的转运体对9肽的相对选择性、mhc i 分子9、10的释放肽的亲和力、前体频率和 tcr 多样性。t 细胞池中的同源t cd8 11、12、13、t细胞之间在获得 apc14、15和 tcd8的骨形能力方面的交叉竞争克隆16。此外, TCd8免疫调节是由几种抑制细胞类型介导的免疫调节机制, 如自然发生的调节 t (nTreg) 细胞17, 细胞表面共抑制分子编程死亡-1 (PD-1)16, 以及某些细胞内酶, 如二氯胺酮 2, 3-二氧合酶 (ido ) 18 和雷帕霉素 (mtor)19的哺乳动物靶标。然而, 必须指出, 上述因素并不总是完全解释免疫调节。
除了 TCd8免疫调节的基本生物学外, 对这一有趣现象的检查对癌症免疫学和免疫治疗具有重要意义。首先, ID 状态不一定赋予给定的 TCd8克隆预防肿瘤开始或进展20的能力.ID 和 SDt Cd8 是否以及如何促进抗肿瘤免疫可能取决于恶性肿瘤的类型和程度以及所使用的实验系统。其次, 人们认为, idt cd8克隆可能对免疫系统 "太明显", 因此更容易出现中央和/或外周耐受机制16,21。第三, 异基因肿瘤可能含有肿瘤细胞, 避免被许多 (如果不是大多数的话) Ctl 检测, 只显示狭窄的肽谱: MHC 复合物。在这种情况下, 宽度不足的 t Cd8反应可能会给这些肿瘤细胞提供生存优势, 从而增强其生长优势22。正是出于上述原因, 许多人认为免疫调节是成功的基于 TCd8的疫苗接种和抗癌治疗的障碍。
对 c57bl6 小鼠进行接种, 为 t cd8 免疫调节提供了一个强大的临床前系统, 该小鼠具有 simian 病毒 40 (Sv40) 转化细胞, 表达大肿瘤银 (t ag)。此模型提供了几个好处。首先, 这种临床相关的癌蛋白的肽表位在这个小鼠菌株23中有很好的特征 (表 1)。第二, T Ag 表位, 称为站点 I、II/iii、IV 和 V, 触发 T Cd8 响应, 这些响应一直按以下等级排列: 站点 IV > > 站点i≥ iiieiii > ≫ 站点 iii. 站点对 t ag 进行最稳健的响应。相反, 站点 i 和 ii/iii 是次优势的, 站点 v特异性 t cd8是最少的, 通常只有在对其他表位 23、24 没有响应的情况下才能检测到。第三, 本文所述协议中使用的 t ag+肿瘤细胞系, 即 c57sv 纤维肉瘤细胞, 以及我们以前的研究中使用的细胞 16、17、18、19 25, 26,用亚基因组 sv40 片段25转化.因此, 它们无法组装和释放可能感染宿主 Apc 的 SV40 病毒。此外, C57SV 细胞缺乏典型的共刺激分子, 如 CD80 (B7-1)、CD86 (B7-1) 和 CD137 配体 (4-1BBL)16。上述属性使这些线成为通过交叉启动检测体内 TCd8激活的理想之选。交叉预防是诱导 TCd8 反应的主要途径, 特别是那些针对非造血源肿瘤细胞启动的非造血源肿瘤细胞, 不能直接提供初级天真的 t 细胞25。
抗肿瘤t Cd8频率和/或功能可以通过 mhc i 四聚体染色、细胞内染色来监测效应细胞因子 (例如, 干扰素 [ifn]-γ) 或裂解分子 (例如, 穿孔)、酶联免疫罐 (elispot) 检测和体内细胞毒性检测。自 20世纪90年代成立以来,基于体内杀灭检测的羧荧光素琥珀酰酯 (cfse) 已经能够评估抗病毒 ctl 29, 30 介导的细胞毒性反应,31、抗肿瘤 ctls16,32, 自然杀伤细胞 (nk) 33, 甘油脂反应不变的自然杀手 t (inkt) 细胞34, 以及预先存在和新的捐献者特有的同种异体抗体26。因此, 它们的应用可能会引起广大读者的兴趣, 包括但不限于在肿瘤免疫学和免疫治疗、抗病原体免疫以及预防和治疗疫苗设计等领域工作的研究人员。
为了评估细胞介导的细胞毒性在典型的情况下, 两个群体的天真的脾细胞, 显示一个不相关的 Ag 或同源 Ag (s) 标记为两种不同剂量的 CFSE, 混合在相同的数量, 并注入天真 (控制) 或杀手细胞窝藏的老鼠。然后用流式细胞仪检查每个目标种群的存在情况。
在我们对抗病毒和抗肿瘤t cd8反应 12、16、17的免疫调节作用研究中, 我们在体内进行了优化和应用。在这里, 我们提供了一个详细的协议, 用于同时评估 ID 和 SDt Cd8对 t ag 表位的响应, 这可以很容易地用于其他实验系统中的类似调查。我们还提供了具有代表性的结果, 表明 nTreg 细胞消耗和 PD-1 封锁可以有选择地增强 ID TCd8-和 Sdt cd8诱导的细胞毒性, 分别。最后, 我们将讨论体内杀灭检测的多重优势以及它们的一些固有局限性。
研究方案
这里描述的实验遵循机构实体批准的动物使用规程, 并遵守既定的国家准则。
1. c57bl6 小鼠 t ag 表达肿瘤细胞的接种
- 在 Dulbecco 的改性 eagle 培养基 (dmem) 中, 用 4.5 gl d-葡萄糖和 l-谷氨酰胺( 1x), 在 dulbecco 的改性老鹰培养基 (dmem) 中生长 sv40 转化的纤维肉瘤细胞系 c57sv (或类似的 t ag + 粘附细胞系), 并补充 1 mm 的丙酮酸钠和10% 的热失活在含有 10% CO2 的加湿大气中, 37°c 组织培养处理瓶中的胎儿牛血清 (FBS).
- 一旦细胞完全融合或稍微过度融合, 轻轻地取出并丢弃培养基, 用预热的磷酸盐缓冲盐水 (PBS) 冲洗单层。
注: 当 T Ag+细胞达到100% 融合时, 达到最大 t ag 表达。 - 在生物安全柜内, 加入预热的色氨酸 edta (0.25%)在室温下覆盖单层, 直到细胞被移出补丁。多次点击培养瓶的两侧, 释放剩余的粘附细胞。
注: 如有必要, 为了加快胰蛋白酶化过程, 请将烧瓶转移到37°c 的孵化器中。在光镜下, 被移出的细胞会迅速呈圆形。此步骤应持续约5分钟。 - 加入5毫升的 DMEM 培养基, 并分离团块, 通过上下移液每个烧瓶的内容来制备单细胞悬浮液。
- 将细胞悬浮液通过具有70μm 毛孔的细胞过滤器转移到管中。
- 在4°C 下, 以 400 x g的速度向下旋转管5分钟。
- 放弃上清液。在无菌冷 PBS 10 毫升中再移植颗粒细胞。
- 重复步骤1.6 和1.7 两次。
- 使用血细胞计计数细胞。准备含有 4 x10 7 细胞无菌 pbs 的均匀悬浮液。
- 向每个成年 (6-12) 雄性或雌性 c57bl6 小鼠注射上述悬浮液的500Μl。
2. 治疗方案
-
研究 nTreg 细胞对 TCd8免疫功能的影响
- C57BL/6 小鼠 C57SV 细胞体内启动前 4天 (步骤 1.10), 注射每只动物一次, 用0.5 毫克的低内毒素、无氮抗 CD25 单克隆抗体 (mAb) (克隆 PC-61.5.3), 它耗尽 nTreg 细胞, 或与大鼠 IgG1 同型控制 (例如, 克隆 KLHG-2-2、克隆 HRPN 或克隆 TNP6A7)。
-
Pd-1-pd-L1(2) 相互作用在形成 tCd8免疫调节中的应用意义测试方法
注: Pd-历1对 PD-1 的参与通常 (但并不总是) 调解了 ag 特异性 t Cd8的共同抑制和用尽。因此, 抗 Pd-1 治疗可以与抗 Pd-l1 和抗 Pd-l2 mAbs 的管理同时进行, 以揭示生物现象所涉及的确切细胞间相互作用。
3. 靶点肌细胞的制备
- 安乐死性别匹配天真的 c57bl6 小鼠 (6-12), 将作为脾细胞捐献者的宫颈脱位。
- 将每只老鼠的腹部朝上放置在生物安全柜内。用 70% (v/v) EtOH 喷洒皮肤。使用无菌钳和剪刀, 抬起皮肤, 使一个小的腹侧中线切口。然后, 以交叉状的方式切割皮肤, 以暴露腹膜。
- 使用钳子, 以帐篷状的方式拉起腹膜, 而不抢占任何内脏器官。切开腹膜, 露出腹腔, 轻轻切除脾脏。
- 将脾脏放入含有5毫升无菌 PBS 的15毫升弹跳组织磨床内。使用磨床的玻璃柱塞施加手动压力, 直到脾脏组织消散成红色均匀细胞悬浮液。
注: 根据每个实验组的接收动物数量, 可能需要几个供体小鼠脾脏来制备靶细胞。在15毫升磨床内, 最多可将3种脾脏同质化在一起。 - 将均质体转移到15毫升管中。在4°C 下, 以 400 x g的速度向下旋转管5分钟。
- 放弃上清液。在4毫升的氨基氯化钾 (ACK) 裂解缓冲液中再利用颗粒细胞, 时间为 4分钟, 以消除红细胞。
注: 这是一个时间敏感的步骤。过度暴露在反裂解缓冲液中会增加它们的脆弱性, 使它们容易受到非特异性细胞死亡的影响。 - 对于每个管子, 加入含有10% 热灭活 FBS、l-Alanyl-l-谷氨酰胺、0.1 mm 最低必需介质 (ML) 非必需氨基酸、1 mM 丙酮酸钠、10 mm hepes 和 1x penicilinsk 溴霉素的 rpmi 1640 培养基8毫升, 这将是以后的情况被称为完整的 RPMI 介质 (材料表)。
- 通过细胞过滤器的70μm 毛孔将其含量转移到新的 15 mL 管中。
- 在4°C 下, 以 400 x g的速度向下旋转管5分钟。
- 放弃上清液。在12毫升的完整 RPMI 中再利用颗粒细胞。
- 将脾细胞悬浮液分成3个相等的部分 (每个4毫升), 在3个单独的管中。
4. 不相关的认知肽包衣靶状脾细胞
- 根据将用于脉冲目标脾细胞的肽标记管。对照脾细胞将被脉冲与一个不相关的肽, 并且每个同源靶向脾细胞的人口将被脉冲与合成肽对应于 T ag 衍生的免疫 oo样母料表位 (站点 IV) 或一个亚显性的 T Ag 表位 (站点一或站点(表 1)。
注: 不相关肽的选择取决于每次调查中使用的实验设置和鼠标应变。作者经常使用 Gb498-505 (单纯疱疹病毒 (H-2K-限免疫分解肽肽表位) 和//GB 33-1 (H-2D b-限制性免疫分解肽肽表位淋巴细胞) c57bl6 小鼠的脉络膜炎病毒 ([LCMV]) (表 1)。这些肽是最佳选择, 因为: (i) 它们来自于此处描述的鼠标模型中以前没有遇到过的病原体;(ii) 类似于 T ag 衍生肽, gB498-505和 gB33-41受到 h-2 b 分子的限制和结合. 在体内的 "三峰" 杀灭检测中, 对应于同源靶细胞的两个峰中的每一个都可能代表用免疫调节剂或亚显性肽脉冲的脾细胞。每个肽集的选择根据每个实验的目标而有所不同。请参见图1和图2作为此类变体的示例。对于本协议的其余部分, T ag 衍生位点 i 和 IV 将分别代表亚显性和免疫调节肽。 - 在37°c 和 5% co2 下, 用相应肽的1Μm 脉冲每个标记管的含量为 1小时.
- 如有必要, 使用单独的电池过滤器 (带70微米毛孔) 来去除团块和碎屑。
- 在4°C 下, 以 400 x g的速度向下旋转管5分钟。放弃上清液。
- 在无菌冷 PBS 12 毫升中再移植颗粒细胞, 并再次重复步骤4.4。
注: 删除尽可能多的 FBS 非常重要, 因为 FBS 可以在下一步中绑定 CFSE。
5. 用 CFSE 标记靶体脾细胞
- 在无菌 PBS 4 毫升中再利用肽脉冲脾细胞。
- 在分别含有无关肽、位位 i 和位状 iv 脉冲脾细胞的管内加入0.25ΜM、0.25μm 和2μm 的 cfse。
注: 要实现均匀的 CFSE 标记, 请将每个管保持在45°角, 然后将 CFSE 添加到细胞悬浮液上方的一侧, 然后立即进行温和的涡流。这将确保在末端出现平滑的直方图。批次间和年龄在 CFSE 强度方面的差异并不少见。因此, 在决定使用最佳浓度之前, 可能需要尝试不同的 CFE 剂量。
注意: CFSE 在浓度高于5Μm 时具有毒性。 - 将管放在37°c 孵化器内 15分钟, 每5分钟倒置一次。
- 在每个管中加入3毫升的热灭活 FBS, 以阻止 CFE 反应。使用无菌 PBS 对内容进行充值。
- 在4°C 下, 以 400 x g的速度向下旋转管5分钟。放弃上清液。
- 在无菌 PBS 和重复步骤5.5 中的12毫升中再利用颗粒细胞。
6. 目标球粒细胞群体的适当/平等 CFS 标记的检测
- 在 PBS 的3毫升中再利用颗粒细胞。
- 轻轻的涡流管。将 CFSE低、cfse中间体 (INT)和 cfse高电池悬浮液各转移 10μl, 并将其转移到含有 200Μl pbs 的5毫升圆底聚苯乙烯荧光活化细胞分选 (facs) 管中。
- 使用配备488纳米激光的流式细胞仪询问细胞。在获得 FL-1 通道淋巴细胞门内的5000个事件之前, 根据细胞的正向散射 (FSC) 和侧向散射 (SSC) 特性绘制淋巴细胞门。
- 在 "父" CFSE+种群内, 绘制额外的直方图门, 以识别 cfs低、CFSint 和cfse高亚群。
- 在三个门内确认相等或接近相等的事件编号。如有必要, 调整 "源" 管中的细胞数量 (步骤 6.1), 然后在第7节将目标脾脏细胞混合并注入天真的小鼠体内。
7. 将贴有 cfse 标签的目标细胞注入 N第七届和 T-Ag-primed 接受者
- 轻轻的涡流管。将三个 cfse 标记的细胞悬浮液以相等的比例转移到一个新的管中。
- 使用无菌 PBS 对内容进行充值。
- 在4°C 下, 以 400 x g的速度向下旋转管5分钟。用无菌 PBS 重新体细胞。
- 用血细胞计对色氨酸蓝细胞进行计数, 以确保细胞活力至少达到95%。
- 调整体积, 以便通过尾静脉将 1 x 10 7 混合靶细胞/200μl pbs (i. v.) 静脉注射到每个受者 c57bl6 小鼠体内。
注: 将细胞储存在两次注射之间的冰上。每次注射前轻轻混合目标细胞。记录每只老鼠的确切注射时间, 这将决定动物何时需要安乐死。在同一实验中, 重要的是要保持所有动物体内细胞毒性的持续时间一致。
8. 数据采集
- 在注射 cfse 标记的靶细胞两、四个小时后, 用宫颈脱位对受体细胞进行安乐死。
注: 体内细胞毒性的持续时间可能因所使用的实验系统、靶标 Ags 的免疫原性、预期的脾脏肽抗原特异性 t Cd8的丰度及其溶解功能的稳健性而有所不同其他因素。 - 按照步骤 3.2-3.9 中的步骤 3.2-3.9 分别取出和处理每个脾脏。
- 丢弃上清液, 在 PBS 的3毫升中重新悬浮颗粒细胞。
注: 在细胞荧光分析之前, 请格外小心处理4°C 或冰上的脾脏组织和细胞制剂。这是为了防止体内持续的细胞毒性。 - 将每个加工脾脏的大约 1 x 107个细胞转移到一个干净的流式细胞仪管中。
- 使用配备488纳米激光的流式细胞仪立即询问细胞。根据细胞的 FSC 和 SSC 特性绘制淋巴细胞门。
- 识别 CFSE-受者的脾细胞和 CFSE+转移的目标细胞。绘制额外的大门, 以适应不同的 CFSE 低, cfsINT,和 cfse高目标细胞群。
- 在 FL-1 通道中获取总共 2000 CFS低事件。
9. 数据分析
- 使用以下公式计算每个同源靶细胞群的特定裂解:
% 特异性细胞毒性 =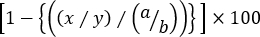
其中x = cfse在t ag 底漆鼠标中的高事件数, y = cfse低事件数在 t ag 预压鼠标, a = cfs int/high/在天真的鼠标中的高事件号,和 b = cfse低事件数数字在天真的鼠标。
注: 在评估多个同源目标群体的特定裂解的 "三峰" 细胞毒性检测中, 不宜使用目标细胞频率。这仅仅是因为同源靶细胞群的频率不仅受到不相关对照的百分比的影响, 还受到其他同源靶有脾脏细胞的百分比的影响。因此, 应在上述公式中使用每个栅极内的事件编号, 以准确计算每个同源靶细胞群 (CFSEint 或CFSE高细胞) 对 cfse 低控制的裂解。
结果
如图 1所示, 实验的目的是确定 nTreg 细胞的存在和功能是否形成或改变 t Ag-t特 cd8的免疫调节层次结构。在 c57bl6 小鼠获得 2 x 10 c57sv 肿瘤细胞 (p. p.) 前四天, 用 PBS 或0.5 毫克抗 cd25 mAb (克隆 pc-61.5.3 [PC61]) 注射了 c57bl6 小鼠.在单独的实验中, 使用了大鼠 IgG1 同型对照代替 PBS。流式细胞仪检测成功 ntreg 细胞消耗的 Pc61。
C57SV ...
讨论
与传统的杀灭检测方法 (如放射性铬 (51cr) 释放和比色乳酸脱氢酶 (ldh) 释放检测) 相比, 基于 cfse 的体内细胞毒性检测具有多种优势。首先, 他们允许监测 CTL 功能在一个建筑完整的二级淋巴器官。
其次, 在体内细胞毒性检测中对靶细胞的特异性杀伤反映了 ag特异性 t Cd8的绝对数量, 这通常是但并不总是存在于脾脏中的 tcd8频率的功能。这与51Cr/ldh...
披露声明
作者没有什么可透露的。
致谢
这项工作得到了加拿大卫生研究所的支持, 向 SMMH 提供了 MOM-130465 和 PJT-156295。JC 得到安大略省培训、学院和大学部伊丽莎白二世科学和技术研究生奖学金的部分支持。CEM 是加拿大自然科学和工程研究理事会 (NSERC) 亚历山大·格雷厄姆·贝尔加拿大研究生奖学金 (博士) 的获得者。
材料
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA (1X) | Thermo Fisher Scientific | 25200-056 | |
| ACK Lysing Buffer | Thermo Fisher Scientific | A1049201 | |
| Anti-mouse CD25 (clone PC-61.5.3) | Bio X Cell | BE0012 | |
| Anti-mouse PD-1 (clone RMP1-14) | Bio X Cell | BE0146 | |
| CFSE | Thermo Fisher Scientific | C34554 | |
| DMEM (1X) | Thermo Fisher Scientific | 11965-092 | |
| Fetal bovine serum (FBS) | Wisent Bioproducts | 080-150 | Heat-inactivate prior to use |
| GlutaMAX (100X) | Thermo Fisher Scientific | 35050-061 | |
| HEPES (1M) | Thermo Fisher Scientific | 15630080 | 10 mM final concentration |
| MEM Non-Essential Amino Acids Solution (100X) | Thermo Fisher Scientific | 11140-050 | |
| Penicillin/Streptomycin | Sigma-Aldrich | P0781 | Stock is 100X |
| Rat IgG1 (clone KLH/G1-2-2) | SouthernBiotech | 0116-01 | Isotype control |
| Rat IgG1 (clone HRPN) | Bio X Cell | BE0088 | Isotype control |
| Rat IgG1 (clone TNP6A7) | Bio X Cell | BP0290 | Isotype control |
| Rat IgG2a (clone 2A3) | Bio X Cell | BP0089 | Isotype control |
| RPMI 1640 (1X) | Thermo Fisher Scientific | 11875-093 | |
| Sodium Pyruvate (100 mM) | Thermo Fisher Scientific | 11360-070 | 1 mM final concentration |
参考文献
- Yewdell, J. W., Bennink, J. R. Immunodominance in major histocompatibility complex class I-restricted T lymphocyte responses. Annual Review of Immunology. 17, 51-88 (1999).
- Chen, W., et al. Reversal in the immunodominance hierarchy in secondary CD8+ T cell responses to influenza A virus: roles for cross-presentation and lysis-independent immunodomination. The Journal of Immunology. 173 (8), 5021-5027 (2004).
- Otahal, P., et al. Inefficient cross-presentation limits the CD8+ T cell response to a subdominant tumor antigen epitope. The Journal of Immunology. 175 (2), 700-712 (2005).
- Lauron, E. J., et al. Cross-priming induces immunodomination in the presence of viral MHC class I inhibition. PLoS Pathogens. 14 (2), e1006883 (2018).
- Crowe, S. R., et al. Differential antigen presentation regulates the changing patterns of CD8+ T cell immunodominance in primary and secondary influenza virus infections. The Journal of Experimental Medicine. 198 (3), 399-410 (2003).
- Probst, H. C., et al. Immunodominance of an antiviral cytotoxic T cell response is shaped by the kinetics of viral protein expression. The Journal of Immunology. 171 (10), 5415-5422 (2003).
- Gileadi, U., et al. Generation of an immunodominant CTL epitope is affected by proteasome subunit composition and stability of the antigenic protein. The Journal of Immunology. 163 (11), 6045-6052 (1999).
- Zanker, D., Waithman, J., Yewdell, J. W., Chen, W. Mixed proteasomes function to increase viral peptide diversity and broaden antiviral CD8+ T cell responses. The Journal of Immunology. 191 (1), 52-59 (2013).
- Deng, Y., Yewdell, J. W., Eisenlohr, L. C., Bennink, J. R. MHC affinity, peptide liberation, T cell repertoire, and immunodominance all contribute to the paucity of MHC class I-restricted peptides recognized by antiviral CTL. The Journal of Immunology. 158 (4), 1507-1515 (1997).
- Chen, W., Khilko, S., Fecondo, J., Margulies, D. H., McCluskey, J. Determinant selection of major histocompatibility complex class I-restricted antigenic peptides is explained by class I-peptide affinity and is strongly influenced by nondominant anchor residues. The Journal of Experimental Medicine. 180 (4), 1471-1483 (1994).
- Kotturi, M. F., et al. Naive precursor frequencies and MHC binding rather than the degree of epitope diversity shape CD8+ T cell immunodominance. The Journal of Immunology. 181 (3), 2124-2133 (2008).
- Haeryfar, S. M., et al. Terminal deoxynucleotidyl transferase establishes and broadens antiviral CD8+ T cell immunodominance hierarchies. The Journal of Immunology. 181 (1), 649-659 (2008).
- Leon-Ponte, M., Kasprzyski, T., Mannik, L. A., Haeryfar, S. M. Altered immunodominance hierarchies of influenza A virus-specific H-2(b)-restricted CD8+ T cells in the absence of terminal deoxynucleotidyl transferase. Immunological Investigations. 37 (7), 714-725 (2008).
- Kedl, R. M., et al. T cells compete for access to antigen-bearing antigen-presenting cells. The Journal of Experimental Medicine. 192 (8), 1105-1113 (2000).
- Kastenmuller, W., et al. Cross-competition of CD8+ T cells shapes the immunodominance hierarchy during boost vaccination. The Journal of Experimental Medicine. 204 (9), 2187-2198 (2007).
- Memarnejadian, A., et al. PD-1 Blockade Promotes Epitope Spreading in Anticancer CD8(+) T Cell Responses by Preventing Fratricidal Death of Subdominant Clones To Relieve Immunodomination. The Journal of Immunology. 199 (9), 3348-3359 (2017).
- Haeryfar, S. M., DiPaolo, R. J., Tscharke, D. C., Bennink, J. R., Yewdell, J. W. Regulatory T cells suppress CD8+ T cell responses induced by direct priming and cross-priming and moderate immunodominance disparities. The Journal of Immunology. 174 (6), 3344-3351 (2005).
- Rytelewski, M., et al. Suppression of immunodominant antitumor and antiviral CD8+ T cell responses by indoleamine 2,3-dioxygenase. PLoS One. 9 (2), e90439 (2014).
- Maleki Vareki, S., et al. Differential regulation of simultaneous antitumor and alloreactive CD8(+) T-cell responses in the same host by rapamycin. American Journal of Transplantation. 12 (1), 233-239 (2012).
- Irvine, K., Bennink, J. Factors influencing immunodominance hierarchies in TCD8+ -mediated antiviral responses. Expert Review of Clinical Immunology. 2 (1), 135-147 (2006).
- Grossmann, M. E., Davila, T., Celis, T. Avoiding tolerance against prostatic antigens with subdominant peptide epitopes. Journal of Immunotherapy. 24 (3), 237-241 (2001).
- Schreiber, H., Wu, T. H., Nachman, J., Kast, W. M. Immunodominance and tumor escape. Seminars in Cancer Biology. 12 (1), 25-31 (2002).
- Mylin, L. M., et al. Quantitation of CD8(+) T-lymphocyte responses to multiple epitopes from simian virus 40 (SV40) large T antigen in C57BL/6 mice immunized with SV40, SV40 T-antigen-transformed cells, or vaccinia virus recombinants expressing full-length T antigen or epitope minigenes. Journal of Virology. 74 (15), 6922-6934 (2000).
- Fu, T. M., et al. An endoplasmic reticulum-targeting signal sequence enhances the immunogenicity of an immunorecessive simian virus 40 large T antigen cytotoxic T-lymphocyte epitope. Journal of Virology. 72 (2), 1469-1481 (1998).
- Chen, W., et al. Cross-priming of CD8+ T cells by viral and tumor antigens is a robust phenomenon. European Journal of Immunology. 34 (1), 194-199 (2004).
- Memarnejadian, A., Meilleur, C. E., Mazzuca, D. M., Welch, I. D., Haeryfar, S. M. Quantification of Alloantibody-Mediated Cytotoxicity In Vivo. Transplantation. 100 (5), 1041-1051 (2016).
- Aichele, P., et al. Peptide antigen treatment of naive and virus-immune mice: antigen-specific tolerance versus immunopathology. Immunity. 6 (5), 519-529 (1997).
- Oehen, S., Brduscha-Riem, K. Differentiation of naive CTL to effector and memory CTL: correlation of effector function with phenotype and cell division. The Journal of Immunology. 161 (10), 5338-5346 (1998).
- Coles, R. M., Mueller, S. N., Heath, W. R., Carbone, F. R., Brooks, A. G. Progression of armed CTL from draining lymph node to spleen shortly after localized infection with herpes simplex virus 1. The Journal of Immunology. 168 (2), 834-838 (2002).
- Barber, D. L., Wherry, E. J., Ahmed, R. Cutting edge: rapid in vivo killing by memory CD8 T cells. The Journal of Immunology. 171 (1), 27-31 (2003).
- Meilleur, C. E., et al. Bacterial superantigens expand and activate, rather than delete or incapacitate, preexisting antigen-specific memory CD8+ T cells. The Journal of Infectious Diseases. , (2018).
- Goldszmid, R. S., et al. Dendritic cells charged with apoptotic tumor cells induce long-lived protective CD4+ and CD8+ T cell immunity against B16 melanoma. The Journal of Immunology. 171 (11), 5940-5947 (2003).
- Oberg, L., et al. Loss or mismatch of MHC class I is sufficient to trigger NK cell-mediated rejection of resting lymphocytes in vivo - role of KARAP/DAP12-dependent and -independent pathways. European Journal of Immunology. 34 (6), 1646-1653 (2004).
- Wingender, G., Krebs, P., Beutler, B., Kronenberg, M. Antigen-specific cytotoxicity by invariant NKT cells in vivo is CD95/CD178-dependent and is correlated with antigenic potency. The Journal of Immunology. 185 (5), 2721-2729 (2010).
- Brinster, R. L., et al. Transgenic mice harboring SV40 T-antigen genes develop characteristic brain tumors. Cell. 37 (2), 367-379 (1984).
- Tatum, A. M., et al. CD8+ T cells targeting a single immunodominant epitope are sufficient for elimination of established SV40 T antigen-induced brain tumors. The Journal of Immunology. 181 (6), 4406-4417 (2008).
- Schell, T. D., Tevethia, S. S. Control of advanced choroid plexus tumors in SV40 T antigen transgenic mice following priming of donor CD8(+) T lymphocytes by the endogenous tumor antigen. The Journal of Immunology. 167 (12), 6947-6956 (2001).
- Greenberg, N. M., et al. Prostate cancer in a transgenic mouse. Proceedings of the National Academy of Sciences of the United States of America. 92 (8), 3439-3443 (1995).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。