A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
תפירה Vivo ציטורעילות Assays ללמוד אימונומימינינס ב-CD8 התגובות הספציפיות לגידול של תאים
In This Article
Summary
אנו מתארים כאן הזרימה cyvivo try מבוסס בתוך שיטת ההרג המאפשרת לבדוק את החיסונית של האימונוטוקסיט T לימפוציטים (CTL) התגובות של הגידול מודל אנטיגן. אנו מספקים דוגמאות לאופן השימוש בבחינה אלגנטית זו למחקרים מכניסטיים ולבדיקת יעילות בסמים.
Abstract
Carboxyfluorascinimidyl אסתר (CFSE)-מבוסס vivo ציטורעילות לאפשר כימות רגיש ומדויק של CD8+ cytolytic T התגובות לימפוציטים (CTL) התגובה הנובעת מהגידול-ואת הפתוגן נגזר הפפטידים. הם מציעים מספר יתרונות. על רצח מסורתי ראשית, הם מתירים את הניטור של הרעלים בתיווך CTL בתוך איברי הלימפה שלמים מבחינה ארכיטקטונית, בדרך כלל בטחול. שנית, הם מאפשרים לימודי מכניסטיים במהלך הטרמה, התיקטור ושלבי האחזור של תגובות CTL. שלישית, הם מספקים פלטפורמות שימושיות עבור בדיקות החיסון/יעילות התרופה בהגדרה באמת vivo. כאן, אנו מספקים פרוטוקול ממוטב לבדיקה של תגובות CTL במקביל נגד יותר מאשר אפירופה פפטיד אחד של מודל הגידול אנטיגן (Ag), כלומר, וירוס קופיים 40 (SV40)-מקודד גדול T ag (t ag). כמו רוב חלבונים אחרים הגידולים קלינית הגידול, ג ' Ag הנמלים רבים פפטידים חיסוני פוטנציאלי. עם זאת, רק ארבעה פפטידים כאלה לגרום לתגובות CTL לגילוי ב C57BL/6 עכברים. תגובות אלה מסודרות בעקביות בסדר הירארכי המבוסס על גודל שלהם, אשר יוצר את הבסיס ל-TCD8 "אימונוod, במערכת רבת עוצמה זו. בהתאם לכך, רוב תגובת ה-TCD8 הספציפית לג מתמקדת נגד אפירופה בודד של החיסונית בעוד ששלושת האפיסקופים האחרים מזוהים ומגיבים רק בחולשה. אימונובודמינינס להתפשר על היקף התגובות TCD8 הגידול והוא, ככזה, נחשב על ידי רבים כמניעת חיסון מוצלח נגד סרטן. לכן, חשוב להבין את הגורמים הסלולאריים והמולקולריים והמנגנונים המכתיבים אומCD8 את הצורה T. הפרוטוקול שאנו מתארים כאן מותאם לחקירת תופעה זו במודל החיסון T Ag, אבל יכול להיות שונה בקלות המורחבת למחקרים דומים במודלים סרטניים אחרים. אנו מספקים דוגמאות של איך ההשפעה של התערבויות חיסוני ניסיוני ניתן למדוד באמצעות vivo ציטורעילות assays הספר.
Introduction
קונבנציונאלי CD8+ T תאים (TCD8) לשחק חלקים חשובים מעקב החיסונית תרופות נגד סרטן. הם בעיקר לתפקד בקיבולת של לימפוציטים T cytolytic (CTLs) המכירים אנטיגנים פפטיד או הקשורים הגידול (Ags) מוצג בתוך החריץ הסגור של מורכבת היסטוליסטית מורכבים (MHC) class אני מולקולות. באופן מלא CTLs לנצל ארסנל ציטוטוקסיים שלהם כדי להרוס תאים ממאירים. Anticancer TCD8 ניתן להבחין במחזור הדם או אפילו בתוך המוני המוני וגרורתית של חולי סרטן רבים וחיות נושאת הגידול. עם זאת, לעתים קרובות הם מותשים או מעייפים ואינם מצליחים לבער את הסרטן. לכן, שיטות חיסוני רבות נועדו להגדיל את תדריCD8 T של סרטן ולשחזר ולהגביר את התפקודים שלהם.
הגידול חלבונים הנמל פפטידים רבים, שחלקם יכולים להיות מסוג חיסוני והחיסונית פוטנציאלי. עם זאת, תגובות לכימות TCD8 מעורר עם גניטודות שונות נגד פפטידים מעטים בלבד. זה יוצר "היררכיה חיסונית" בין TCD8 המשובטים1. לפיכך, החיסונית (ID) TCD8 לכבוש את השורות ההירארכית בולטות, אשר נשפט בדרך כלל על ידי השפע שלהם. לעומת זאת, TCD8 תאים שקולטן התא t (tcr) ספציפי עבור אפידומיננטה (SD) מתרחשים בתדרים נמוכים יותר. אנו ואחרים זיהינו חלק מהגורמים המכתיבים או מרכיבים את הצורה החיסונית ב-TCD8 תגובות. אלה כוללים, בין היתר, את המצב של מצגת Ag ל-TCD8 נאיבי (כלומר, מצגת ישירה, מצגת צולבת, קרוס-חבישה)2,3,4, סוג של תאים המציגים Ag (apcs) השתתפות TCD8 הפעלה5, שפע ויציבות של החלבון Ags6,7 ואת היעילות והקינטיקה של השפלה שלהם על ידי פרוטאספמס7,8, ה סלקטיביות יחסית של טרנספורטר הקשורים לעיבוד Ag (ברז) עבור פפטידים9, האהדה של פפטידים משוחרר עבור מולקולות mhc I9,10, הנוכחות, תדרים קודמי ומגוון tcr של קנצוני TCD8 בבריכות תא t11,12,13, החוצה תחרות בין תאים t עבור גישה ל-apcs14,15, ואת הקיבולת הפרימלרצח של TCD8 שיבוטים16. בנוסף, TCD8 אימונוod הוא נתון מנגנונים אימונוגוקקים בתיווך על ידי מספר סוגי תא משתיק קול כגון הרגולציה טבעי T (nTreg) תאים17, משטח התא מעכבות שיתוף מולקולה מתוכנתים מוות -1 (PD-1)16, ו אנזימים תאיים מסוימים כגון אינפאמין 2, 3-DIחמצון (עידו)18 ואת היעד היונקים של Rapamycin (mtor)19. עם זאת, חשוב לציין, כי הגורמים שלעיל אינם תמיד מהווים משמעות מלאה לחיסוליות.
מלבד הביולוגיה הבסיסית של TCD8 אימונומימינינס, הבדיקה של תופעה זו מרתקת יש השלכות חשובות באימונולוגיה סרטן וטיפול חיסוני. ראשית, מצב מזהה אינו מעניק בהכרח על שיבוטCD8 T נתון את היכולת למנוע חניכה הגידול או התקדמות20. אם וכיצד מזהה ו-SD TCD8 לתרום חסינות antitumor עשוי להיות תלוי בסוג ואת היקף ממאירות ואת המערכת ניסיוני מועסקים. שנית, הוא חשב כי ID TCD8 שיבוטים יכול להיות ' גלוי מדי ' למערכת החיסונית וכתוצאה מכך נוטה יותר למרכז ו/או היקפי מנגנוני סיבולת16,21. שלישית, גידולים הטרובנאיים עשויים להכיל תאים נאופלסטיים הנמנעים מזיהוי ידי רבים, אם לא רוב, CTLs על ידי הצגת רק ספקטרום צר של פפטיד: MHC מתחמי. בנסיבות אלה, TCD8 התגובות של היקף מספיק צפויים להרשות לעצמם תאים סרטניים כגון יתרון הישרדות, ובכך הפוטנציאל שלהם הצמיחה22. זה בגלל הסיבות הנ ל כי הרבה לראות אימונומימינינים כמשוכה מוצלחת TCD8מבוסס חיסון וטיפולים נגד סרטן.
חיסונים של C57BL/6 עכברים עם וירוס קופיים 40 (SV40)-תאים שעברו שינוי כי לבטא גידול גדול Ag (T Ag) מספק מערכת מקדם קלינית רבת עוצמה כדי ללמוד TCD8 אימונוod ance. מודל זה מציע מספר יתרונות. ראשון, את האפיאוסקופים פפטיד של האינטרקופרוטאין זה רלוונטי קלינית מאופיינים היטב זה זן העכבר23 (שולחן 1). שנית, אפיסקופים T Ag, אשר נקראים אתרים I, II/III, IV, ו-V, ההדק תגובות TCD8 כי הם מסודרים בעקביות בסדר ההיררכי הבא: באתר IV > האתר > I ≥ באתר II/III > אתר > V. בהתאם, אתר הרביעי ספציפי TCD8 טעינת התגובה החזקה ביותר ל-T Ag. לעומת זאת, אתרים I ו-II/III הם subdominant, וCD8 האתר הספציפי T הם לפחות שופע ובדרך כלל רק לזיהוי בהעדר התגובה לאפיכסקופים אחרים23,24. שלישית, כבל T Ag+ הגידול מנוצל בפרוטוקול המתואר לעיל, כלומר תאים C57SV פיברוסרקומה, ואת אלה המשמשים בחקירות הקודמות שלנו16,17,18,19 ,25,26, משתנים עם תת גנומית SV40 שברי25. לכן, הם אינם יכולים להרכיב ולשחרר SV40 הריטונים שעלולים להדביק APCs מארח. בנוסף, תאים C57SV הם נטולי מולקולות מגירוי הקלאסי כגון CD80 (b7-1), CD86 (B7-2), CD137 ליגנד (4-1bbl)16. התכונות הנ ל להפוך את הקווים האלה אידיאלי לבדיקה של vivo TCD8 הפעלה באמצעות הטרמה. הטרמה היא מסלול מרכזי בגרימת תגובות TCD8 , במיוחד אלה השיקה נגד תאים סרטניים של מוצא לא המטבית כי לא להיכשל ישירות בתאי T מראש תמים25.
Antitumor TCD8 תדרים ו/או פונקציות ניתן לפקח על ידי mhc I כתמים הטטרמר, כתמים תאיים על ציטוקינים אפקטור (g., אינטרפרון [ifn]-γ) או מולקולות lytic (למשל, בתוספת), חיסוני מקושר אנזים (elispot) בחני ולשעבר . vivo ציטורעילות לרעלים מאז הקמתה שלהם בשנות ה-9027,28, carboxyfluorascinimidyl אסתר (cfse)-מבוסס על הvivo הריגה מאפשר הערכה של תגובות ציטוטוקסיים מתווכת על ידי ויראלית ctls29,30 , 31, antitumor הגידול16,32, טבעי הרוצח (NK) תאים33, גליקולפיד-קבוע מגיב טבעי הרוצח T (inkt) תאים34, ואת התאריך הקיימים ואת דה נובו לתורם ספציפי מיכל ה,26 לכן, היישומים שלהם יכולים להיות מעניינים לקריאה רחבה, כולל אך לא מוגבל לחוקרים העובדים בתחומים של אימונולוגיה הגידול וטיפול חיסוני, חסינות אנטי פתוגן, ועיצוב חיסון מונע וטיפולי.
כדי להעריך את הרעלת התאים בתרחישים טיפוסיים, שתי אוכלוסיות של טחול נאיבי המציגות או לא רלוונטי ag או קנצוני ag (s) מסומנים עם שתי מינונים שונים של cfse, מעורב במספרים שווים מוזרק נאיבי (שליטה) או רוצח עכברים מחסה לתאים הנוכחות/העדר של כל אוכלוסיית היעד נבדק לאחר מכן על-ידי cy, הזרימה.
יש לנו אופטימיזציה ומועסקים vivo הריגת בחני במחקרים שלנו על אימונוod, הן אנטי ויראליותCD8 התגובות לא הגידול12,16,17. כאן, אנו מספקים פרוטוקול מפורט עבור הערכה סימולטני של ID ו-SDCD8 תגובות t Ag אפיסקופים, אשר ניתן לאמץ בקלות עבור חקירות דומות במערכות ניסוי אחרות. כמו כן, אנו מספקים תוצאות מייצגות הממחיש כי המחסור תא nTreg ו-PD-1 המצור יכול באופן סלקטיבי לשפר את מזהה TCD8-ו-SD tCD8-המושרה ציטורעילות, בהתאמה. בסופו של דבר, נדון ביתרונות מרובים של vivo הריגת בחני כמו גם חלק מהמגבלות הטמונות שלהם.
Protocol
הניסויים המתוארים כאן משתמשים בפרוטוקולי השימוש בבעלי חיים שאושרו על-ידי גופים מוסדיים ומבוססים על ההנחיות הלאומיות.
1. החיסונים של C57BL/6 עכברים עם T Ag-הבעת הגידול תאים
- לגדל את SV40-שינוי התאים של קו פיברוסרקומה C57SV (או התאים הדומים T Ag+ שורה תא) ב בינונית שונה של הנשר של דולבקו (dmem) עם 4.5 g/l D-גלוקוז ו-גלוטמין (1x) ו שיושלם עם 1 מ"מ מסנן נתרן ו 10% חום-inactivated סרום של שור עוברי (FBS) בתרבית רקמות מטופלים מבחנות ב 37 ° c באווירה לחות המכיל 10% CO2.
- ברגע שהתאים נעשים מלאים באופן מלא או מעט מוגזם, בעדינות להסיר ולמחוק את המדיום ולשטוף את המונאולייר עם מלוחים מחומם מחוממים מפוספז (PBS).
הערה: ביטוי מקסימאלי T Ag מושג כאשר T Ag+ תאים להגיע 100% שליטה. - בתוך ארון בטיחות ביולוגי, להוסיף טרום מחומם טריפסין-EDTA (0.25%) לכסות את המונאולייר בטמפרטורת החדר עד שהתאים מתקטעים במדבקות. הקש על הצדדים של בקבוקון התרבות מספר פעמים כדי לשחרר את התאים החסיד הנותרים.
הערה: במקרה הצורך וכיצד לזרז את תהליך הטריסינזציה, העבירו את הבקבוקון לאינקובטור של 37 ° c. תאים שעברו במקומם יאמצו במהירות צורה מעוגלת תחת מיקרוסקופ קל. שלב זה אמור להימשך כ-5 דקות. - הוסף 5 מ ל של גושים בינוניים והשעיית הנתק כדי להכין השעיה תא יחיד על ידי ליטוף את התוכן של כל בקבוקון מעלה ומטה.
- להעביר את ההשעיה התא דרך מסננת תא עם נקבוביות 70-μm לתוך צינור.
- סובב את השפופרת ב 400 x g עבור 5 דקות ב 4 ° c.
- . מחק את הסופרנטאנט השהה תאים מחדש ב-10 מ ל.
- חזור על שלבים 1.6 ו-1.7 פעמיים.
- ספירת תאים באמצעות הומוציטומטר. הכינו השעיה אחידה המכילה 4 x 107 תאים/ML סטרילי PBS.
- להזריק 500 μL של ההשעיה לעיל intraperitoneally (כיתה) אל כל מבוגר (6-12-שבוע-בן) זכר או נקבה C57BL/6 עכבר.
2. טיפול משטרי
-
טיפול משטר לבחון את התרומה של תאי nTreg ל TCD8 אימונומימינינס
- ארבעה ימים לפני ב vivo הטרמה של C57BL/6 עכברים עם C57SV תאים (שלב 1.10), להזריק לכל חיה פעם כאלה עם 0.5 מ ג של נמוך אנדוטוקסין, azide-חינם anti-CD25 נוגדן מונבטיים (mAb) (שיבוט PC-61.5.3), אשר מרוקן תאים nTreg, או עם עכברוש IgG1 isotype שליטה (למשל, שיבוט KLH/G1-2-2, שיבוט HRPN, או שיבוט TNP6A7).
-
משטר הטיפול כדי לבדוק את המשמעות Vivo של PD-1-PD-L1 (2) אינטראקציות בעיצוב TCD8 אימונומימינינס
הערה: האירוסין של PD-1 על-ידי PD-L1 לעתים קרובות, אך לא תמיד, מדיטים את העיכוב ו/או תשישות שלCD8הספציפי Ag. לכן, טיפול עם anti-PD-1 ניתן לבצע במקביל עם המינהל של anti-PD-L1 ו-anti-PD-L2 mAbs לחשוף את האינטראקציה הבין-תאית המדויקת מעורב בתופעה ביולוגית.
3. הכנת הטחול המטרה
- המתת חסד מין בהתאמה נאיבי C57BL/6 עכברים (6-12 שבועות של גיל) זה ישמש כתורמים הטחול על ידי נקע בצוואר הרחם.
- הצב כל עכבר עם הבטן שלו כלפי מעלה בתוך ארון בטיחות ביולוגי. רסס את העור עם 70% (v/v) אטוה. באמצעות מלקחיים ומספריים סטרילי, להרים את העור ולעשות חתך קטן באמצע המסילה. לאחר מכן, חותכים את העור בצורה מרובת-פנים כדי לחשוף את הצפק.
- באמצעות מלקחיים, למשוך את הצפק בצורה כמו אוהל מבלי לקחת את כל האיברים הפנימיים. חותכים את הצפק פתוח כדי לחשוף את חלל הצפק ולהסיר בעדינות את הטחול.
- מניחים את הטחול (ים) בתוך מטחנת הרקמה של 15 מ ל המכיל 5 מ ל של הערוץ הסטרילי. הפעילו לחץ ידני באמצעות הבוכנה של המטחנה עד שרקמת הטחול מתמוסס לתוך השעיית תא הומוגנית אדום.
הערה: בהתאם למספר בעלי החיים של הנמען לכל קבוצה ניסיונית, ייתכן שיהיו צורך במספר טחולים של העכבר התורם עבור הכנת תא היעד. עד 3 מעלות יכול להיות הומוגניים יחד בתוך מטחנת 15 מ"ל. - העבירו את ההגון. לצינור של 15 מ ל סובב את השפופרת ב 400 x g עבור 5 דקות ב 4 ° c.
- . מחק את הסופרנטאנט השהה מחדש את התאים הפלתד ב-4 מ ל של אמוניום-כלוריד-אשלגן (ACK) מאגר ליסינג עבור 4 דקות כדי למנוע אריתרופוציטים.
הערה: זהו שלב רגיש לזמן. חושפים את הטחול לחיץ שלהם. ומגבירים את הרגישות למוות תאי לא ספציפי - לכל צינור, להוסיף 8 מ ל של RPMI 1640 בינוני המכיל 10% חום-inactivated-הפעלה FBS, L-alanyl-ל-גלוטמין, 0.1 מ"מ מדיה חיוניים מינימלי (לזכור) חומצות אמינו לא הכרחי, 1 מ"מ נתרן פירובט, 10 מ"מ HEPES, ו-1x פניצילין/סטרפטומיצין, אשר יהיה להלן המכונה בינונית RPMI מלאה (טבלת חומרים).
- העבר את התוכן דרך הנקבוביות 70 יקרומטר של מסננת תא לתוך צינור חדש 15 mL.
- סובב את השפופרת ב 400 x g עבור 5 דקות ב 4 ° c.
- . מחק את הסופרנטאנט השהה מחדש תאים מלאים ב-12 מ ל של RPMI.
- פיצול הטחול ההשעיה לתוך 3 חלקים שווים (4 מ ל כל אחד) ב 3 שפופרות נפרדות.
4. ציפויים בטחול מטרה עם פפטידים לא רלוונטיים
- סמן את הצינורות לפי פפטידים כי ישמש הדופק היעד הטחול. הטחול שליטה יהיה פעמו עם פפטיד לא רלוונטי, וכל האוכלוסייה של הטחול היעד קנצוני יהיה פעמו עם פפטיד סינתטי התואם את האפיפנול הנגזרות t ag (אתר IV) או אפידומינט t ag (אתר I או אתר II/III) (שולחן 1).
הערה: הבחירה של פפטידים לא רלוונטיים תלוי בהגדרה הניסיונית ואת זן העכבר המשמש בכל חקירה. המחברים לעתים קרובות להשתמש498-505 GB (h-2kb-2 מוגבל פפטיד הנגיף החיסוני של וירוס הרפס [HSV]-1) ו/או GP33-41 (H-2kb-2-מוגבל פפטיד האימונומאומייואכאפיפ של לימפוציטית וירוס כורמננודלקת ([מע) ב C57BL/6 עכברים (שולחן 1). פפטידים אלה הם בחירה אופטימלית כי: (i) הם נגזר פתוגנים לא נתקלו בעבר במודל העכבר המתואר כאן; (ii) בדומה T Ag-פפטידים נגזר, gB498-505 ו-GP33-41 מוגבלים על ידי ונקשר מולקולות H-2b . בתוך ' שלוש הפסגה ' בvivo הריגת assays כל אחת משתי הפסגות המתאימות לתאי היעד של המטרה עשויה לייצג את הטחול בעזרת פפטיד מאומינימי או מטריטן תת-דומיננטי. הבחירה של כל מערכת פפטיד משתנה בהתאם למטרות של כל ניסוי. ראה איור 1 ואיור 2 כדוגמאות לווריאציה כזו. לשארית פרוטוקול זה, האתרים הנגזרים T Ag I ו-IV מייצגים פפטידים תת-דומיננטיים ואימונומימיניניים, בהתאמה. - דופק את התוכן של כל צינור עם תווית 1 μM של פפטיד בהתאמה עבור 1 h ב 37 ° צ' ו 5% CO2.
- השתמש מסננת תא נפרד (עם נקבוביות 70-μm) עבור כל צינור כדי להסיר גושים ופסולת במידת הצורך.
- סובב את השפופרת ב 400 x g עבור 5 דקות ב 4 ° c. . מחק את הסופרנטאנט
- השהה מחדש תאים מסוימים ב-12 מ ל של PBS קר וסטרילי וחזור על שלב 4.4 פעם נוספת.
הערה: חשוב להסיר FBS רבים ככל האפשר, כי FBS יכול לאגד CFSE בשלב הבא.
5. תיוג מטרה לטחול עם CFSE
- השעיה מחדש של פפטיד-הטחול פעמו ב 4 מ ל של הPBS סטרילי.
- הוסף CFSE ב 0.025 μM, 0.25 μM, ו-2 μM לתוך הצינורות המכילים פפטיד לא רלוונטי, אתר I-ו-האתר הרביעי פעמו הטחול, בהתאמה.
הערה: כדי להשיג תיוג CFSE אחיד, להחזיק כל צינור בזווית 45 ° לפני הוספת CFSE בצד מעט מעל ההשעיה התא ואחריו מיד על ידי vortexing עדין. זה יהיה להבטיח את המראה של היסטגרמות חלקה בסוף. אצווה-to-אצווה וריאציות תלויי הגיל בעוצמות CFSE אינם נדירים. לכן, ייתכן שיהיה צורך להתנסות עם מנות CFSE דיפרנציאליות לפני שתחליט על ריכוזים אופטימליים לשימוש.
התראה: CFSE רעיל בריכוזים הגבוהים מ-5 μM. - מניחים את הצינורות בתוך החממה 37 ° c עבור 15 דקות ולהפוך אותם פעם אחת כל 5 דקות.
- הוסף 3 מ ל של FBS חום מופעל לכל צינור כדי לעצור את התגובה CFSE. למעלה את התוכן עם הערוץ ה-PBS סטרילי.
- סובב את השפופרת ב 400 x g עבור 5 דקות ב 4 ° c. . מחק את הסופרנטאנט
- השהה מחדש את התאים בתוך 12 מ ל של PBS סטרילי וחזור על שלב 5.5.
6. בחינת הסדר המתאים/שווה CFSE של אוכלוסיות היעד הטחול
- השהה תאים מחדש ב-3 מ ל של PBS.
- . וורטקס את החצוצרות בעדינות העברה 10 μL, כל אחד, של CFSEנמוך, cfseביניים (int), ו cfse תאגבוה השעיות לתוך 5 מ ל קלקר עגול-התחתון מיון תא (facs) צינור המכיל 200 μl של PBS.
- לחקור תאים באמצעות cytometer זרם מצויד בלייזר 488 ננומטר. ציירו שער לימפוציטים המבוסס על מאפייני פיזור (FSC) מקדימה ופיזור בצד (לפני השטח) של התאים לפני רכישת 5000 אירועים הנופלים בתוך שער לימפוציטים בערוץ FL-1.
- בתוך ' ההורה ' CFSE+ אוכלוסיה, לצייר שערי היסטוגרמה נוספים כדי לזהות cfseנמוך, cfseint, ו cfseגבוהה תת אוכלוסיות.
- אשר מספרי אירועים שווים או קרובים. בתוך שלושת השערים במקרה הצורך, התאימו את מספרי התאים בצינורות ' המקור ' (שלב 6.1) לפני ערבוב והזרקת הטחול של המטרה לתוך עכברים תמימים ומכוונים בסעיף 7.
7. הזרקה של תאי היעד של CFSE המוצגים לנמענים תמימים ובעלי מערכת T-Ag
- בעדינות מערבולת את צינורות המקור. העבר את שלושת השעיות התא המסומנות בתווית CFSE ביחס שווה לשפופרת חדשה.
- למעלה את התוכן עם הערוץ ה-PBS סטרילי.
- סובב את השפופרת ב 400 x g עבור 5 דקות ב 4 ° c. השהה מחדש תאים עם הערוץ התואם.
- לספור תאים בטריקון כחול על ידי הומוציטוטומטר כדי להבטיח הכדאיות התאית של לפחות 95%.
- כוונן את אמצעי האחסון כדי להזריק 1 x 107 תאי יעד מעורבים/200 ΜL PBS באופן מידי (עירוי), דרך וריד הזנב, אל כל נמען C57BL/6 עכבר.
הערה: לאחסן את התאים על הקרח בין זריקות. ערבב בעדינות את תאי היעד לפני כל זריקה. להקליט את הזמן המדויק של הזרקה עבור כל עכבר, אשר יקבע מתי החיה תצטרך להיות מורדמים. חשוב לשמור על המשך של רעילות vivo ציטוטיים עקבי בין כל החיות באותו ניסוי.
8. רכישת נתונים
- שעתיים או ארבע שעות לאחר ההזרקה של תאי יעד CFSE המסומנים, המתת החסד של עכברים הנמען על ידי פריקה צוואר הרחם.
הערה: משך הרעילות vivo ציטוזה יכול להשתנות בהתאם למערכת ניסיוני מועסק, החיסוני של היעד Ags, את השפע הצפוי של פפטיד אנטיגן ספציפי TCD8 בטחול, ואת החוסן של הפונקציה lytic שלהם בין יתר הגורמים. - להסיר ולעבד כל טחול בנפרד כמו בשלבים 3.2-3.9.
- השמט את הסופרנטאנט והשהה מחדש את תאי הפלטד ב-3 מ ל של PBS.
הערה: קחו טיפול נוסף לטיפול ברקמת הטחול וההכנות לתא ב -4 ° c או על הקרח לפני ניתוח ציטופלואורימטרי. זה כדי למנוע המשך לשעבר רעילות ציטומה vivo. - העברה כ 1 x 107 תאים מכל טחול מעובד לתוך צינור facs נקי.
- לחקור את התאים מיד באמצעות cytometer זרימה מצויד בלייזר 488 ננומטר. ציירו שער לימפוציטים המבוסס על המאפיינים של התאים FSC ו-אס. אס.
- זיהוי כדוריות הטחול של CFSE- הנמען ותאי היעד המועברים cfse+ . לצייר שערים נוספים אדיב CFSEנמוך, cfseINT, ו cfseגבוה היעד אוכלוסיות תאים.
- לרכוש סך של 2000 CFSE אירועיםנמוכים בערוץ FL-1.
9. ניתוח נתונים
- לחשב את הליזה הספציפית של כל אוכלוסיית תא היעד קנצוני באמצעות הנוסחה הבאה:
% הרעלת ציטוזה ספציפי =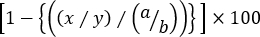
כאשר x = cfseint/ מספר אירוע גבוה ב-t ag-עכבר מוכן, y = cfse מספר אירוענמוך ב-t ag-עכבר מוכן, a = cfseint/ מספר אירוע גבוה בעכבר נאיבי, ו b = cfseנמוך אירוע ספר בעכבר נאיבי.
הערה: בתוך ' שלוש-שיא ' הרעלת ציטוזה שאומר שהעליה הספציפית של יותר מאוכלוסיית היעד האחת מוערכת, היא אינה מתאימה לשימוש בתדרי תאי היעד. זה פשוט בגלל התדירות של האוכלוסייה תא היעד קנצוני מושפע לא רק על ידי אחוז הפקדים לא רלוונטי אלא גם על ידי זה של האחר קנצוני היעד הטחול. לכן, מספרי האירועים בתוך כל שער יש להשתמש בנוסחה לעיל כדי לחשב במדויק את הליזה של כל האוכלוסייה תא היעד קנצוני (או cfseint או התאים הגבוהים cfse) נגד cfseנמוך פקדים.
תוצאות
מטרת הניסוי שתוצאותיה מתוארות באיור 1 היה לקבוע אם הנוכחות והפונקציות של התאים nTreg הצורה או לשנות את ההיררכיה האימונומימיניוליות של t Ag ספציפי tCD8. C57BL/6 עכברים הוזרקו את הכתובת עם PBS או עם 0.5 מ"ג של anti-CD25 mAb (שיבוט PC-61.5.3 [PC61]) ארבעה ימים לפני שהם קיבלו 2 x 107 C57SV הגידול תא?...
Discussion
Cfse מבוססי vivo ציטורעילות בחני מציעים מספר יתרונות על הרצח המסורתי בחני כגון כרום רדיואקטיבי (51Cr) שחרור וצביעת מטרי לקטט דהידרוגנאז (ldh) שחרור בחני. ראשית, הם מתירים את הניטור של הפונקציה CTL בתוך איבר הלימפה המשני שלמים מבחינה אדריכלית.
שנית, את ההרג הספציפי של תאי היעד ב vi...
Disclosures
. למחברים אין מה לגלות
Acknowledgements
עבודה זו נתמכת על ידי המכונים הקנדיים של מחקר הבריאות (CIHR) מענקים מגב-130465 ו PJT-156295 כדי SMMH. JC נתמך באופן חלקי על ידי המלכה אליזבת השנייה בוגרת מלגה במדע וטכנולוגיה ממשרד ההדרכה של אונטריו, מכללות ואוניברסיטאות. צ'ם היה מקבל מלגה מאוניברסיטת מדעי הטבע וההנדסה של מדינת קנדה (מחקר דוקטורט) של אלכסנדר גרהם בל קנדה.
Materials
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA (1X) | Thermo Fisher Scientific | 25200-056 | |
| ACK Lysing Buffer | Thermo Fisher Scientific | A1049201 | |
| Anti-mouse CD25 (clone PC-61.5.3) | Bio X Cell | BE0012 | |
| Anti-mouse PD-1 (clone RMP1-14) | Bio X Cell | BE0146 | |
| CFSE | Thermo Fisher Scientific | C34554 | |
| DMEM (1X) | Thermo Fisher Scientific | 11965-092 | |
| Fetal bovine serum (FBS) | Wisent Bioproducts | 080-150 | Heat-inactivate prior to use |
| GlutaMAX (100X) | Thermo Fisher Scientific | 35050-061 | |
| HEPES (1M) | Thermo Fisher Scientific | 15630080 | 10 mM final concentration |
| MEM Non-Essential Amino Acids Solution (100X) | Thermo Fisher Scientific | 11140-050 | |
| Penicillin/Streptomycin | Sigma-Aldrich | P0781 | Stock is 100X |
| Rat IgG1 (clone KLH/G1-2-2) | SouthernBiotech | 0116-01 | Isotype control |
| Rat IgG1 (clone HRPN) | Bio X Cell | BE0088 | Isotype control |
| Rat IgG1 (clone TNP6A7) | Bio X Cell | BP0290 | Isotype control |
| Rat IgG2a (clone 2A3) | Bio X Cell | BP0089 | Isotype control |
| RPMI 1640 (1X) | Thermo Fisher Scientific | 11875-093 | |
| Sodium Pyruvate (100 mM) | Thermo Fisher Scientific | 11360-070 | 1 mM final concentration |
References
- Yewdell, J. W., Bennink, J. R. Immunodominance in major histocompatibility complex class I-restricted T lymphocyte responses. Annual Review of Immunology. 17, 51-88 (1999).
- Chen, W., et al. Reversal in the immunodominance hierarchy in secondary CD8+ T cell responses to influenza A virus: roles for cross-presentation and lysis-independent immunodomination. The Journal of Immunology. 173 (8), 5021-5027 (2004).
- Otahal, P., et al. Inefficient cross-presentation limits the CD8+ T cell response to a subdominant tumor antigen epitope. The Journal of Immunology. 175 (2), 700-712 (2005).
- Lauron, E. J., et al. Cross-priming induces immunodomination in the presence of viral MHC class I inhibition. PLoS Pathogens. 14 (2), e1006883 (2018).
- Crowe, S. R., et al. Differential antigen presentation regulates the changing patterns of CD8+ T cell immunodominance in primary and secondary influenza virus infections. The Journal of Experimental Medicine. 198 (3), 399-410 (2003).
- Probst, H. C., et al. Immunodominance of an antiviral cytotoxic T cell response is shaped by the kinetics of viral protein expression. The Journal of Immunology. 171 (10), 5415-5422 (2003).
- Gileadi, U., et al. Generation of an immunodominant CTL epitope is affected by proteasome subunit composition and stability of the antigenic protein. The Journal of Immunology. 163 (11), 6045-6052 (1999).
- Zanker, D., Waithman, J., Yewdell, J. W., Chen, W. Mixed proteasomes function to increase viral peptide diversity and broaden antiviral CD8+ T cell responses. The Journal of Immunology. 191 (1), 52-59 (2013).
- Deng, Y., Yewdell, J. W., Eisenlohr, L. C., Bennink, J. R. MHC affinity, peptide liberation, T cell repertoire, and immunodominance all contribute to the paucity of MHC class I-restricted peptides recognized by antiviral CTL. The Journal of Immunology. 158 (4), 1507-1515 (1997).
- Chen, W., Khilko, S., Fecondo, J., Margulies, D. H., McCluskey, J. Determinant selection of major histocompatibility complex class I-restricted antigenic peptides is explained by class I-peptide affinity and is strongly influenced by nondominant anchor residues. The Journal of Experimental Medicine. 180 (4), 1471-1483 (1994).
- Kotturi, M. F., et al. Naive precursor frequencies and MHC binding rather than the degree of epitope diversity shape CD8+ T cell immunodominance. The Journal of Immunology. 181 (3), 2124-2133 (2008).
- Haeryfar, S. M., et al. Terminal deoxynucleotidyl transferase establishes and broadens antiviral CD8+ T cell immunodominance hierarchies. The Journal of Immunology. 181 (1), 649-659 (2008).
- Leon-Ponte, M., Kasprzyski, T., Mannik, L. A., Haeryfar, S. M. Altered immunodominance hierarchies of influenza A virus-specific H-2(b)-restricted CD8+ T cells in the absence of terminal deoxynucleotidyl transferase. Immunological Investigations. 37 (7), 714-725 (2008).
- Kedl, R. M., et al. T cells compete for access to antigen-bearing antigen-presenting cells. The Journal of Experimental Medicine. 192 (8), 1105-1113 (2000).
- Kastenmuller, W., et al. Cross-competition of CD8+ T cells shapes the immunodominance hierarchy during boost vaccination. The Journal of Experimental Medicine. 204 (9), 2187-2198 (2007).
- Memarnejadian, A., et al. PD-1 Blockade Promotes Epitope Spreading in Anticancer CD8(+) T Cell Responses by Preventing Fratricidal Death of Subdominant Clones To Relieve Immunodomination. The Journal of Immunology. 199 (9), 3348-3359 (2017).
- Haeryfar, S. M., DiPaolo, R. J., Tscharke, D. C., Bennink, J. R., Yewdell, J. W. Regulatory T cells suppress CD8+ T cell responses induced by direct priming and cross-priming and moderate immunodominance disparities. The Journal of Immunology. 174 (6), 3344-3351 (2005).
- Rytelewski, M., et al. Suppression of immunodominant antitumor and antiviral CD8+ T cell responses by indoleamine 2,3-dioxygenase. PLoS One. 9 (2), e90439 (2014).
- Maleki Vareki, S., et al. Differential regulation of simultaneous antitumor and alloreactive CD8(+) T-cell responses in the same host by rapamycin. American Journal of Transplantation. 12 (1), 233-239 (2012).
- Irvine, K., Bennink, J. Factors influencing immunodominance hierarchies in TCD8+ -mediated antiviral responses. Expert Review of Clinical Immunology. 2 (1), 135-147 (2006).
- Grossmann, M. E., Davila, T., Celis, T. Avoiding tolerance against prostatic antigens with subdominant peptide epitopes. Journal of Immunotherapy. 24 (3), 237-241 (2001).
- Schreiber, H., Wu, T. H., Nachman, J., Kast, W. M. Immunodominance and tumor escape. Seminars in Cancer Biology. 12 (1), 25-31 (2002).
- Mylin, L. M., et al. Quantitation of CD8(+) T-lymphocyte responses to multiple epitopes from simian virus 40 (SV40) large T antigen in C57BL/6 mice immunized with SV40, SV40 T-antigen-transformed cells, or vaccinia virus recombinants expressing full-length T antigen or epitope minigenes. Journal of Virology. 74 (15), 6922-6934 (2000).
- Fu, T. M., et al. An endoplasmic reticulum-targeting signal sequence enhances the immunogenicity of an immunorecessive simian virus 40 large T antigen cytotoxic T-lymphocyte epitope. Journal of Virology. 72 (2), 1469-1481 (1998).
- Chen, W., et al. Cross-priming of CD8+ T cells by viral and tumor antigens is a robust phenomenon. European Journal of Immunology. 34 (1), 194-199 (2004).
- Memarnejadian, A., Meilleur, C. E., Mazzuca, D. M., Welch, I. D., Haeryfar, S. M. Quantification of Alloantibody-Mediated Cytotoxicity In Vivo. Transplantation. 100 (5), 1041-1051 (2016).
- Aichele, P., et al. Peptide antigen treatment of naive and virus-immune mice: antigen-specific tolerance versus immunopathology. Immunity. 6 (5), 519-529 (1997).
- Oehen, S., Brduscha-Riem, K. Differentiation of naive CTL to effector and memory CTL: correlation of effector function with phenotype and cell division. The Journal of Immunology. 161 (10), 5338-5346 (1998).
- Coles, R. M., Mueller, S. N., Heath, W. R., Carbone, F. R., Brooks, A. G. Progression of armed CTL from draining lymph node to spleen shortly after localized infection with herpes simplex virus 1. The Journal of Immunology. 168 (2), 834-838 (2002).
- Barber, D. L., Wherry, E. J., Ahmed, R. Cutting edge: rapid in vivo killing by memory CD8 T cells. The Journal of Immunology. 171 (1), 27-31 (2003).
- Meilleur, C. E., et al. Bacterial superantigens expand and activate, rather than delete or incapacitate, preexisting antigen-specific memory CD8+ T cells. The Journal of Infectious Diseases. , (2018).
- Goldszmid, R. S., et al. Dendritic cells charged with apoptotic tumor cells induce long-lived protective CD4+ and CD8+ T cell immunity against B16 melanoma. The Journal of Immunology. 171 (11), 5940-5947 (2003).
- Oberg, L., et al. Loss or mismatch of MHC class I is sufficient to trigger NK cell-mediated rejection of resting lymphocytes in vivo - role of KARAP/DAP12-dependent and -independent pathways. European Journal of Immunology. 34 (6), 1646-1653 (2004).
- Wingender, G., Krebs, P., Beutler, B., Kronenberg, M. Antigen-specific cytotoxicity by invariant NKT cells in vivo is CD95/CD178-dependent and is correlated with antigenic potency. The Journal of Immunology. 185 (5), 2721-2729 (2010).
- Brinster, R. L., et al. Transgenic mice harboring SV40 T-antigen genes develop characteristic brain tumors. Cell. 37 (2), 367-379 (1984).
- Tatum, A. M., et al. CD8+ T cells targeting a single immunodominant epitope are sufficient for elimination of established SV40 T antigen-induced brain tumors. The Journal of Immunology. 181 (6), 4406-4417 (2008).
- Schell, T. D., Tevethia, S. S. Control of advanced choroid plexus tumors in SV40 T antigen transgenic mice following priming of donor CD8(+) T lymphocytes by the endogenous tumor antigen. The Journal of Immunology. 167 (12), 6947-6956 (2001).
- Greenberg, N. M., et al. Prostate cancer in a transgenic mouse. Proceedings of the National Academy of Sciences of the United States of America. 92 (8), 3439-3443 (1995).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved