Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Adaptation des dosages de cytotoxicité in vivo à l’étude de l’immunodominance dans des réponses cellulaires spécifiques à la tumeur et aux lymphocytes T
Dans cet article
Résumé
Nous décrivons ici un essai de tuerie in vivo basé sur la cytométrie en flux qui permet l’examen de l’immunodominance dans les réponses cytotoxiques des lymphocytes T (CTL) à un antigène tumoral modèle. Nous fournissons des exemples de la façon dont ce dosage élégant peut être utilisé pour les études mécanistes et pour les tests d’efficacité des médicaments.
Résumé
Les dosages de cytotoxicité in vivo à base de carboxyfluorescéine succinimidyl ester (CFSE) permettent une quantification sensible et précise des réponses de lymphocytes T cytolytiques (CTL) de la bactérie et des peptides dérivés de tumeurs et d’agents pathogènes. Ils offrent plusieurs avantages par rapport aux tests de tuerie traditionnels. Premièrement, ils permettent le suivi de la cytotoxicité médiée par la CTL au sein des organes lymphoïdes secondaires intacts architecturalement, généralement dans la rate. Deuxièmement, ils permettent des études mécanistiques pendant les phases d’amorçage, d’effecteur et de rappel des réponses CTL. Troisièmement, ils fournissent des plateformes utiles pour les tests d’efficacité des vaccins/médicaments dans un environnement véritablement in vivo. Ici, nous fournissons un protocole optimisé pour l’examen des réponses concomitantes de CTL contre plus d’un épitope de peptide d’un antigène de tumeur de modèle (AG), à savoir, le grand T AG (T AG) codé par le virus simien 40 (SV40). Comme la plupart des autres protéines tumorales cliniquement pertinentes, T AG héberge de nombreux peptides potentiellement immunogéniques. Cependant, seuls quatre de ces peptides induisent des réponses CTL détectables chez les souris C57BL/6. Ces réponses sont systématiquement disposées dans un ordre hiérarchique en fonction de leur magnitude, ce qui constitue la base de la «immunodominance» de T v dans ce système puissant. Par conséquent, la plus grande partie de la réponse T -t-t-t spécifique à t AG est centrée sur un seul épitope immunodominantes tandis que les trois autres épitopes sont reconnus et n’ont réagi que faiblement. L’immunodominance compromet l’ampleur des réponses antitumorales du T et est, en tant que telle, considérée par beaucoup comme un obstacle à la vaccination réussie contre le cancer. Par conséquent, il est important de comprendre les facteurs cellulaires et moléculaires et les mécanismes qui dictent ou forment l’immunodominance T. Le protocole que nous décrivons ici est adapté à l’étude de ce phénomène dans le modèle de vaccination de T AG, mais peut être facilement modifié et étendu à des études similaires dans d’autres modèles tumoraux. Nous fournissons des exemples de la façon dont l’impact des interventions immunothérapeutiques expérimentales peut être mesuré à l’aide de tests de cytotoxicité in vivo.
Introduction
Les cellules traditionnelles de l+ T(t) jouent des parties importantes dans la surveillance immunitaire anticancéreuse. Ils fonctionnent principalement dans la capacité des lymphocytes T cytolytiques (CTL) qui reconnaissent des antigènes peptidiques spécifiques ou associés à des tumeurs (AGS) affichés dans la fente fermée des molécules de classe I de complexe d’histocompatibilité majeure (MHC). Les CTL entièrement armés utilisent leur arsenal cytotoxique pour détruire les cellules malignes. L’anticancéreux T peut être détecté dans la circulation ou même à l’intérieur des masses primaires et métastatiques de nombreux patients cancéreux et animaux porteurs de tumeurs. Cependant, ils sont souvent anergiques ou épuisés et ne parviennent pas à éradiquer le cancer. Par conséquent, de nombreuses modalités immunothérapeutiques sont conçues pour augmenter les fréquences anticancéreuses du T et pour rétablir et renforcer leurs fonctions.
Les protéines tumorales abritent de nombreux peptides, dont certains peuvent être immunogènes et potentiellement immunoprotecteurs. Cependant, les réponses quantifiables de T-b sont obtenues avec des magnitudes variables par rapport à quelques peptides seulement. Cela crée une «hiérarchie d’immunodominance» parmi les clones T1. En conséquence, l’immunodominante (ID ) T s. v. occupent des rangs hiérarchiques importants, qui sont généralement jugés par leur abondance. En revanche, les cellules t, dont le récepteur de lymphocytes t (TCR) est spécifique pour les épitopes sous-dominants (SD), se retrouvent dans les fréquences inférieures. Nous et d’autres avons identifié certains des facteurs qui dictent ou façonnent l’immunodominance dans les réponses de T. Parmi ceux-ci figurent, entre autres, le mode de présentation AG à T (c.-à-d. présentation directe, Cross-Presentation, cross-dressing)2,3,4, le type de cellules présentatrices AG (APCS) participation à l' activation5de T, l’abondance et la stabilité des protéines AGS6,7 et l’efficacité et la cinétique de leur dégradation par les protéasomes7,8, le sélectivité relative du transporteur associé au traitement AG (TAP) pour les peptides9, l’affinité des peptides libérés pour les molécules de MHC I9,10, la présence, les fréquences précurseurs et la diversité TCR des dans les pools de lymphocytes t11,12,13, la concurrence croisée entre les lymphocytes t pour l’accès aux APCS14,15et la capacité fratricide de t clones16. De plus, l' immunodominance t-1 est soumise à des mécanismes immunologiques médiés par plusieurs types de cellules suppresseurs tels que les cellules t (ntreg) régulatrices naturelles17, la molécule co-inhibitrice de surface cellulaire programmée Death-1 (DP-1)16, et certaines enzymes intracellulaires telles que l’INDOLÉAMINE 2,3-dioxygénase (IDO)18 et l’objectif mammifère de la rapamycine (mTOR)19. Il est important de noter, cependant, que les facteurs ci-dessus ne représentent pas toujours pleinement l’immunodominance.
En dehors de la biologie de base de l’immunodominance T, l’examen de ce phénomène intrigant a des implications importantes dans l’immunologie et l’immunothérapie du cancer. Premièrement, un statut d’ID ne confère pas nécessairement à un clone T-1 donné la capacité de prévenir l’initiation ou la progression de la tumeur20. La question de savoir si et comment ID et SD T a contribuer à l’immunité antitumorale peut dépendre du type et de l’étendue de la malignité et du système expérimental utilisé. Deuxièmement, on pense que les clones ID T-1 peuvent être «trop visibles» pour le système immunitaire et par conséquent plus enclins aux mécanismes de tolérance centraux et/ou périphériques16,21. Troisièmement, les tumeurs hétérogéniques peuvent contenir des cellules néoplasiques qui évitent la détection par beaucoup, sinon la plupart, des CTL en affichant seulement un spectre étroit de peptide: complexes de MHC. Dans ces circonstances, les réponses de T. 5 de la largeur insuffisante sont susceptibles d’offrir à ces cellules tumorales un avantage de survie, potentiant ainsi leur excroissance22. C’est pour les raisons ci-dessus que de nombreux considèrent l’immunodominance comme un obstacleà la réussite de la vaccination basée sur T et des thérapies contre le cancer.
L’inoculation de souris C57BL/6 avec des cellules transformées de virus simien 40 (SV40) qui expriment une grande tumeur AG (T AG) fournit un système préclinique puissant pour étudier l’immunodominance de t. Ce modèle offre plusieurs avantages. Premièrement, les épitopes peptidiques de cette oncoprotéine cliniquement pertinente sont bien caractérisées dans cette souche de souris23 (tableau 1). Deuxièmement, les épitopes de T AG, qui sont appelés sites I, II/III, IV et V, déclenchent des réponses de T-b qui sont systématiquement disposées dans l’ordre hiérarchique suivant: site iv > > site i ≥ site II/iii > ≫ site v. en conséquence, le site IV spécifique t Montez la réponse la plus robuste à T AG. En revanche, les sites I et II/III sont sous-dominants, et le site V -specific T est moins abondant et n’est généralement détectable qu’en l’absence de réactivité à d’autres épitopes23,24. Troisièmement, la lignée de cellules tumorales T AG+ utilisée dans le protocole décrit ici, à savoir les cellules de Fibrosarcome C57SV, et celles utilisées dans nos enquêtes antérieures16,17,18,19 ,25,26, sont transformés avec des fragments de SV40 subgénomiques25. Par conséquent, ils ne peuvent pas assembler et libérer des virions SV40 qui pourraient potentiellement infecter les APCs d’hôte. En outre, les cellules C57SV sont dénuées de molécules costimulatrices classiques telles que CD80 (B7-1), CD86 (B7-2) et CD137 ligand (4-1BBL)16. Les attributs ci-dessus font de ces lignes idéales pour l’examen de l’activation in vivo T par l’amorçage croisé. L’amorçage croisé est une voie majeure pour induire des réponses de T-b, en particulier celles lancées contre des cellules tumorales d’origine non hématopoïétique qui ne parviennent pas à amorcer directement les lymphocytes t naïfs25.
Les fréquences et /ou les fonctions de l’antitumorale T sont contrôlées par la coloration du tétramère MHC I, la coloration intracellulaire pour les cytokines effectrices (p. ex. interféron [IFN]-γ) ou les molécules lytiques (p. ex. perforine), les dosages d’immunospot (ELISPOT) enzymatiques et tests de cytotoxicité vivo. Depuis leur création dans les années 199027,28, la carboxyfluorescéine succinimidyl ester (CFSE)-essais de mise à mort in vivo ont permis l’évaluation des réponses cytotoxiques médiées par les CTL antiviraux29,30 , 31, antitumeur CTLS16,32, Natural Killer (NK) cellules33, glycolipidique invariant Natural Killer T (iNKT) cellules34, et préexistant et de Novo spécifique au donneur alloanticorps26. Par conséquent, leurs applications peuvent intéresser un large lectorat, y compris, mais sans s’y limiter, les enquêteurs travaillant dans les domaines de l’immunologie tumorale et de l’immunothérapie, l’immunité anti-pathogène, et la conception préventive et thérapeutique des vaccins.
Pour évaluer la cytotoxicité véhiculée par les cellules dans des scénarios typiques, deux populations de splénocytes naïfs qui présentent soit une AG non pertinente, soit une AG (s) apparentée, sont étiquetées avec deux doses différentes de CFSE, mélangées en nombres égaux et injectées dans des naïfs (témoins) ou des tueurs souris à l’herse cellulaire. La présence/absence de chaque population cible est ensuite examinée par cytométrie en flux.
Nous avons optimisé et utilisé des essais de mise à mort in vivo dans nos études sur l’immunodominance dans les réponses antivirales et anti-tumorales de T-112,16,17. Ici, nous fournissons un protocole détaillé pour l’évaluation simultanée des réponses d’ID et de SD t de l’épitopes de t AG, qui peuvent être facilement adoptées pour des investigations semblables dans d’autres systèmes expérimentaux. Nous fournissons également des résultats représentatifs démontrant que la déplétion des cellules nTreg et le blocus de laDP-1 peuvent améliorersélectivement la cytotoxicité induite par l’ID t-t-T et le SD t-t. À la fin, nous discuterons de multiples avantages des essais de mise à mort in vivo ainsi que de certaines de leurs limitations inhérentes.
Protocole
Les expériences décrites ici suivent les protocoles d’utilisation des animaux approuvés par les entités institutionnelles et adhèrent aux lignes directrices nationales établies.
1. inoculation de souris C57BL/6 avec des cellules tumorales exprimant le T AG
- Cultiver la lignée de cellules de Fibrosarcome SV40 transformée C57SV (ou une lignée de cellules adhérentes T AG+ similaire) dans le milieu d’aigle modifié de Dulbecco (DMEM) avec 4,5 g/l de D-glucose et de l-glutamine (1x) et complétée par du pyruvate de sodium à 1 mm et 10% de la chaleur inactivée sérum bovin fœtal (FBS) dans des flacons traités à la culture tissulaire à 37 ° c dans une atmosphère humidifiée contenant 10% de CO2.
- Une fois que les cellules deviennent complètement confluentes ou légèrement surconfluentes, enlevez doucement et jetez le milieu et rincez la monocouche avec une solution saline préchauffée de phosphate-tamponné (PBS).
Remarque: l’expression T AG maximale est obtenue lorsque les cellules T AG+ atteignent 100% de confluences. - À l’intérieur d’un coffret de sécurité biologique, ajouter de la trypsine-EDTA préchauffée (0,25%) pour couvrir la monocouche à température ambiante jusqu’à ce que les cellules soient délogées dans des patchs. Appuyez plusieurs fois sur les côtés de la ou des fiole (s) de culture pour libérer les autres cellules adhérentes.
Remarque: si nécessaire et pour accélérer le processus de trypsinisation, transférer la (les) fiole (s) dans un incubateur de 37 ° c. Les cellules délogées adopteront rapidement une forme arrondie sous un microscope optique. Cette étape devrait durer environ 5 min. - Ajouter 5 mL de milieu DMEM et dissocier les amas pour préparer une suspension à une seule cellule en pipetant le contenu de chaque flacon de haut en bas.
- Transférer la suspension cellulaire à travers un tamis à cellules avec des pores de 70 μm dans un tube.
- Faire tourner le tube à 400 x g pendant 5 min à 4 ° c.
- Jetez le surnageant. Resuspendre les cellules granulées dans 10 mL de PBS froid stérile.
- Répétez les étapes 1,6 et 1,7 deux fois.
- Comptez les cellules à l’aide d’un hémocytomètre. Préparez une suspension uniforme contenant 4 x 107 cellules/ml de PBS stérile.
- Injecter 500 μL de la suspension ci-dessus intrapéritonéale (i.p.) dans chaque adulte (6-12 semaines) mâle ou femelle C57BL/6 souris.
2. schémas thérapeutiques
-
Schéma thérapeutique pour examiner la contribution des cellules nTreg à l' immunodominance de T
- Quatre jours avant l’amorçage in vivo de souris C57BL/6 avec des cellules C57SV (étape 1,10), injecter chaque animal une fois i.p. avec 0,5 mg d’un anticorps monoclonal anti-CD25 (mAb) à faible endotoxine, sans azide (clone PC-61.5.3), qui épuise les cellules nTreg, ou avec un isotype de rat contrôle (par exemple, clone KLH/G1-2-2, clone HRPN, ou clone TNP6A7).
-
Schéma thérapeutique pour tester l’importance in vivo des interactions de la DP-1-DP-L1 (2) dans la formation de l’immunodominance de T
NOTE: l’engagement de la DP-1 par la DP-L1 souvent, mais pas toujours, médite la co-inhibition et/ou l’épuisement de T-spécifique de AG. Par conséquent, le traitement par anti-DP-1 peut être effectué en parallèle avec l’administration de mAbs anti-DP-L1 et anti-DP-L2 pour révéler l’interaction intercellulaire exacte impliquée dans un phénomène biologique.
3. préparation des splénocytes cibles
- Euthanasier des souris C57BL/6 naïves de sexe (6-12 semaines d’âge) qui serviront de donneurs splénocytes par dislocation cervicale.
- Positionnez chaque souris avec son abdomen orienté vers le haut à l’intérieur d’un coffret de sécurité biologique. Vaporisez la peau avec 70% (v/v) EtOH. En utilisant des pinces et des ciseaux stériles, soulevez la peau et faites une petite incision ventrale de la ligne médiane. Ensuite, coupez la peau d’une façon croisée pour exposer le péritoine.
- À l’aide de forceps, tirez le péritoine d’une façon tente-like sans arracher les organes internes. Coupez le péritoine ouvert pour exposer la cavité péritonéale et enlevez doucement la rate.
- Placer la (les) rate (s) à l’intérieur d’un broyeur à tissu Dounce de 15 mL contenant 5 mL de PBS stérile. Appliquez une pression manuelle à l’aide du piston en verre de la meuleuse jusqu’à ce que le tissu splénique se dissite dans une suspension de cellule rouge homogène.
NOTE: selon le nombre d’animaux receveurs par groupe expérimental, plusieurs rates de souris donneuses peuvent être nécessaires pour la préparation des cellules cibles. Jusqu’à 3 rates peuvent être homogénéisées ensemble à l’intérieur d’une meuleuse de 15 mL. - Transférer l’homogénéate dans un tube de 15 mL. Faire tourner le tube à 400 x g pendant 5 min à 4 ° c.
- Jetez le surnageant. Resuspendre les cellules granulées dans 4 mL de tampon de lyse de chlorure d’ammonium et de potassium (ACK) pendant 4 min pour éliminer les érythrocytes.
Remarque: il s’agit d’une étape sensible au temps. Surexposer les splénocytes au tampon de lyse ACK augmentera leur fragilité et les rendra sensibles à la mort cellulaire non spécifique. - Pour chaque tube, ajouter 8 mL de milieu RPMI 1640 contenant 10% de FBS inactivés en chaleur, L-alanyl-L-glutamine, 0,1 mM d’acides aminés non essentiels (MEM), de 1 mM de sodium pyruvate, 10 mM d’HEPES, et 1x pénicilline/streptomycine, qui seront ci-après comme moyen complet de RPMI (table des matières).
- Transférer le contenu dans un nouveau tube de 15 mL à travers les pores de 70 μm d’un filtre à cellules.
- Faire tourner le tube à 400 x g pendant 5 min à 4 ° c.
- Jetez le surnageant. Resuspendre les cellules granulées dans 12 mL de RPMI complet.
- Diviser la suspension splénocyte en 3 portions égales (4 mL chacune) dans 3 tubes distincts.
4. enrobage des splénocytes cibles avec des peptides non pertinents et apparentés
- Étiqueter les tubes selon les peptides qui serviront à pulser les splénocytes cibles. Les splénocytes de contrôle seront pulsés avec un peptide non pertinent, et chaque population de splénocytes cibles cognées sera pulsée avec un peptide synthétique correspondant à l’épitope immunodominantes dérivé de T AG (site IV) ou un épitope de T AG sous-dominant (site I ou site II/III) (tableau 1).
Remarque: le choix des peptides non pertinents dépend de la configuration expérimentale et de la souche de souris utilisée dans chaque investigation. Les auteurs utilisent souvent gB498-505 (un épitope de peptide immunodominantes restreint h-2kbdu virus de l’herpès simplex [HSV]-1) et/ou GP33-41 (un épitope de peptide immunodominantes restreint h-2Dbde lymphocytaire le virus chorioméningite ([lcmv]) chez les souris C57BL/6 (tableau 1). Ces peptides sont des choix optimaux parce que: (i) ils sont dérivés de pathogènes qui n’ont pas été précédemment rencontrés dans le modèle de souris décrit ici; (II) similaires aux peptides dérivés de T AG, les gB498-505 et GP33-41 sont limités par et se lient aux molécules H-2b . Dans les essais de mise à mort in vivo à trois pics, chacun des deux pics qui correspondent à des cellules cibles apparentées peut représenter des splénocytes pulsés avec un peptide immunodominantes ou sous-dominant. Le choix de chaque ensemble de peptides varie en fonction des objectifs de chaque expérience. Voir la figure 1 et la figure 2 comme exemples de cette variation. Pour le reste de ce protocole, les sites I et IV dérivés de T AG représenteront respectivement des peptides sous-dominants et immunodominants. - Pulser le contenu de chaque tube étiqueté avec 1 μM du peptide respectif pendant 1 h à 37 ° c et 5% CO2.
- Utilisez un filtre à cellules distinct (avec pores de 70 μm) pour chaque tube pour enlever les touffats et les débris si nécessaire.
- Faire tourner le tube à 400 x g pendant 5 min à 4 ° c. Jetez le surnageant.
- Resuspendre les cellules granulées dans 12 mL de PBS froid stérile et répéter l’étape 4,4 une fois de plus.
Remarque: il est important de supprimer autant de FBS que possible car FBS peut lier CFSE à l’étape suivante.
5. étiquetage des splénocytes cibles avec CFSE
- Resuspendre les splénocytes à impulsions peptidiques dans 4 mL de PBS stérile.
- Ajouter CFSE à 0,025 μM, 0,25 μM, et 2 μM dans les tubes contenant des splénocytes pulsés de peptide, de site I et de site IV, respectivement.
Remarque: pour obtenir un étiquetage uniforme de CFSE, tenez chaque tube à un angle de 45 ° avant d’ajouter le CFSE sur le côté légèrement au-dessus de la suspension de la cellule suivie immédiatement par un vortexing doux. Cela garantira l’apparition d’histogrammes lisses à la fin. Les variations par lot et par âge des intensités de CFSE ne sont pas rares. Par conséquent, on peut avoir besoin d’expérimenter avec des doses différentielles de CFSE avant de décider sur les concentrations optimales à utiliser.
ATTENTION: le CFSE est toxique à des concentrations supérieures à 5 μM. - Placez les tubes à l’intérieur d’un incubateur de 37 ° c pendant 15 min et inversez-les une fois toutes les 5 min.
- Ajouter 3 mL de FBS inactivés à la chaleur à chaque tube pour arrêter la réaction du CFSE. En haut du contenu avec PBS stérile.
- Faire tourner le tube à 400 x g pendant 5 min à 4 ° c. Jetez le surnageant.
- Resuspendre les cellules granulées dans 12 mL de PBS stérile et répéter l’étape 5,5.
6. examen de l’étiquetage adéquat/égal du CFSE des populations de Splocytes cibles
- Resuspendre les cellules granulées dans 3 mL de PBS.
- Agiter doucement les tubes. Transférer 10 μL, chacun, des suspensions à cellulesélevées CFSELow, CFSEintermédiaire (int)et CFSE dans un tube de tri de cellules activées par fluorescence de polystyrène (FACS) de 5 ml contenant 200 μl de PBS.
- Interrogez les cellules à l’aide d’un cytomètre à flux équipé d’un laser 488 nm. Dessinez une barrière lymphocytaire basée sur les propriétés de dispersion en avant (FSC) et de dispersion latérale (SSC) des cellules avant d’acquérir 5000 événements tombant dans la barrière lymphocytaire du canal FL-1.
- Au sein de la population CFSE+ de «parent», dessinez des grilles d’histogramme additionnelles pour identifier les sous-populations de CFSELow, CFSEintet CFSE.
- Confirmez les numéros d’événement égaux ou quasi égaux dans les trois portes. Si nécessaire, ajustez les nombres de cellules dans les tubes «source» (étape 6,1) avant de mélanger et d’injecter des splénocytes cibles dans des souris naïves et apprêtés dans la section 7.
7. injection de cellules cibles marquées par le CFSE dans des receveurs naïfs et de T-AG
- Agiter doucement les tubes sources. Transférer les trois suspensions de cellules marquées par CFSE dans des proportions égales dans un nouveau tube.
- En haut du contenu avec PBS stérile.
- Faire tourner le tube à 400 x g pendant 5 min à 4 ° c. Resuspendre les cellules granulées avec du PBS stérile.
- Compter les cellules en bleu trypan par un hemocytomètre pour assurer la viabilité cellulaire d’au moins 95%.
- Réglez le volume afin d’injecter 1 x 107 cellules cibles mixtes/200 ΜL de PBS par voie intraveineuse (i.v.), par veine de queue, dans chaque souris C57BL/6 du receveur.
Remarque: stockez les cellules sur la glace entre les injections. Mélanger délicatement les cellules cibles avant chaque injection. Notez l’heure exacte d’injection pour chaque souris, qui déterminera quand l’animal devra être euthanasié. Il est important de maintenir la durée de la cytotoxicité in vivo cohérente entre tous les animaux de la même expérience.
8. acquisition de données
- Deux ou quatre heures après l’injection de cellules cibles marquées par le CFSE, l’euthanasie des souris receveurs par la dislocation cervicale.
NOTE: la durée de la cytotoxicité in vivo peut varier en fonction du système expérimental utilisé, de l’immunogénicité de l’AGS cible, de l’abondance attendue de T e-T dans la rate par l’antigène peptidique spécifique et de la robustesse de leur fonction lytique entre autres facteurs. - Retirer et traiter chaque rate séparément comme dans les étapes 3.2 − 3.9.
- Jetez le surnageant et resuspendez les cellules granulées dans 3 mL de PBS.
Remarque: prenez soin de manipuler le tissu splénique et les préparations cellulaires à 4 ° c ou sur la glace avant les analyses cytofluorimétriques. Il s’agit d’empêcher la cytotoxicité continue ex vivo. - Transférer approximativement 1 x 107 cellules de chaque rate traitée dans un tube FACS propre.
- Interrogez immédiatement les cellules à l’aide d’un cytomètre à flux équipé d’un laser 488-nm. Dessinez une barrière lymphocytaire basée sur les propriétés FSC et SSC des cellules.
- Identifiez les splénocytes et les cellules cibles transférées du CFSE- receveur. Dessinez des barrières additionnelles qui accueillent des populations de cellules ciblesélevées de CFSELow, CFSEintet CFSE.
- Obtenez un total de 2000 événements defaible CFSE dans le canal FL-1.
9. analyse des données
- Calculez la lyse spécifique de chaque population de cellules cibles apparentées à l’aide de la formule suivante:
% Cytotoxicité spécifique =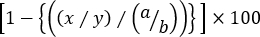
où x = CFSEint/High numéro d’événement en t AG-souris amorcée, y = CFSELow numéro d’événement en t AG-souris primées, a = CFSEint/High numéro d’événement dans la souris naïve, et b = CFSELow événement nombre dans la souris naïve.
Note: dans les essais de cytotoxicité à trois pics dans lesquels la lyse spécifique de plus d’une population cible de apparenté est évaluée, il n’est pas approprié d’utiliser les fréquences des cellules cibles. C’est simplement parce que la fréquence d’une population de cellules cibles apparentées est influencée non seulement par le pourcentage des témoins non pertinents, mais aussi par celui des autres splénocytes cibles apparentés. Par conséquent, les numéros d’événement au sein de chaque porte doivent être utilisés dans la formule ci-dessus pour calculer avec précision la lyse de chaque population de cellules cibles apparentées (soit CFSEint , soit CFSEHigh Cells) contre les contrôlesLow de CFSE.
Résultats
L’objectif de l’expérience dont les résultats sont décrits dans la figure 1 était de déterminer si la présence et les fonctions des cellules nTreg formaient ou modifiaient la hiérarchie de l’immunodominance de t s t AG spécifique. Des souris C57BL/6 ont été injectées i.p. avec PBS ou avec 0,5 mg d’un mAb anti-CD25 (clone PC-61.5.3 [PC61]) quatre jours avant de recevoir 2 x 107 C57SV cellules tumorales i.p. Dans des expériences distinctes, un contrôl...
Discussion
Les dosages de cytotoxicité in vivo basés sur le CFSE offrent plusieurs avantages par rapport aux essais de mise à mort traditionnels, tels que le chrome radioactif (51CR) et les essais de libération de la lactate déshydrogénase (LDH) colorimétrique. Premièrement, ils permettent le contrôle de la fonction CTL au sein d’un organe lymphoïde secondaire intact sur le plan architectural.
Deuxièmement, la mise à mort spécifique des cellules cibles dans les essais de cytotox...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ces travaux ont été soutenus par les subventions MOP-130465 et PJT-156295 de la SMMH par les instituts de recherche en santé du Canada (IRSC). JC est partiellement appuyé par une bourse d’études supérieures de la Reine Elizabeth II en sciences et technologie du ministère de la formation, des collèges et des universités de l’Ontario. CEM a été récipiendaire d’une bourse d’études supérieures Alexander Graham Bell Canada (doctorat) du Conseil de recherches en sciences naturelles et en génie du Canada (CRSNG).
matériels
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA (1X) | Thermo Fisher Scientific | 25200-056 | |
| ACK Lysing Buffer | Thermo Fisher Scientific | A1049201 | |
| Anti-mouse CD25 (clone PC-61.5.3) | Bio X Cell | BE0012 | |
| Anti-mouse PD-1 (clone RMP1-14) | Bio X Cell | BE0146 | |
| CFSE | Thermo Fisher Scientific | C34554 | |
| DMEM (1X) | Thermo Fisher Scientific | 11965-092 | |
| Fetal bovine serum (FBS) | Wisent Bioproducts | 080-150 | Heat-inactivate prior to use |
| GlutaMAX (100X) | Thermo Fisher Scientific | 35050-061 | |
| HEPES (1M) | Thermo Fisher Scientific | 15630080 | 10 mM final concentration |
| MEM Non-Essential Amino Acids Solution (100X) | Thermo Fisher Scientific | 11140-050 | |
| Penicillin/Streptomycin | Sigma-Aldrich | P0781 | Stock is 100X |
| Rat IgG1 (clone KLH/G1-2-2) | SouthernBiotech | 0116-01 | Isotype control |
| Rat IgG1 (clone HRPN) | Bio X Cell | BE0088 | Isotype control |
| Rat IgG1 (clone TNP6A7) | Bio X Cell | BP0290 | Isotype control |
| Rat IgG2a (clone 2A3) | Bio X Cell | BP0089 | Isotype control |
| RPMI 1640 (1X) | Thermo Fisher Scientific | 11875-093 | |
| Sodium Pyruvate (100 mM) | Thermo Fisher Scientific | 11360-070 | 1 mM final concentration |
Références
- Yewdell, J. W., Bennink, J. R. Immunodominance in major histocompatibility complex class I-restricted T lymphocyte responses. Annual Review of Immunology. 17, 51-88 (1999).
- Chen, W., et al. Reversal in the immunodominance hierarchy in secondary CD8+ T cell responses to influenza A virus: roles for cross-presentation and lysis-independent immunodomination. The Journal of Immunology. 173 (8), 5021-5027 (2004).
- Otahal, P., et al. Inefficient cross-presentation limits the CD8+ T cell response to a subdominant tumor antigen epitope. The Journal of Immunology. 175 (2), 700-712 (2005).
- Lauron, E. J., et al. Cross-priming induces immunodomination in the presence of viral MHC class I inhibition. PLoS Pathogens. 14 (2), e1006883 (2018).
- Crowe, S. R., et al. Differential antigen presentation regulates the changing patterns of CD8+ T cell immunodominance in primary and secondary influenza virus infections. The Journal of Experimental Medicine. 198 (3), 399-410 (2003).
- Probst, H. C., et al. Immunodominance of an antiviral cytotoxic T cell response is shaped by the kinetics of viral protein expression. The Journal of Immunology. 171 (10), 5415-5422 (2003).
- Gileadi, U., et al. Generation of an immunodominant CTL epitope is affected by proteasome subunit composition and stability of the antigenic protein. The Journal of Immunology. 163 (11), 6045-6052 (1999).
- Zanker, D., Waithman, J., Yewdell, J. W., Chen, W. Mixed proteasomes function to increase viral peptide diversity and broaden antiviral CD8+ T cell responses. The Journal of Immunology. 191 (1), 52-59 (2013).
- Deng, Y., Yewdell, J. W., Eisenlohr, L. C., Bennink, J. R. MHC affinity, peptide liberation, T cell repertoire, and immunodominance all contribute to the paucity of MHC class I-restricted peptides recognized by antiviral CTL. The Journal of Immunology. 158 (4), 1507-1515 (1997).
- Chen, W., Khilko, S., Fecondo, J., Margulies, D. H., McCluskey, J. Determinant selection of major histocompatibility complex class I-restricted antigenic peptides is explained by class I-peptide affinity and is strongly influenced by nondominant anchor residues. The Journal of Experimental Medicine. 180 (4), 1471-1483 (1994).
- Kotturi, M. F., et al. Naive precursor frequencies and MHC binding rather than the degree of epitope diversity shape CD8+ T cell immunodominance. The Journal of Immunology. 181 (3), 2124-2133 (2008).
- Haeryfar, S. M., et al. Terminal deoxynucleotidyl transferase establishes and broadens antiviral CD8+ T cell immunodominance hierarchies. The Journal of Immunology. 181 (1), 649-659 (2008).
- Leon-Ponte, M., Kasprzyski, T., Mannik, L. A., Haeryfar, S. M. Altered immunodominance hierarchies of influenza A virus-specific H-2(b)-restricted CD8+ T cells in the absence of terminal deoxynucleotidyl transferase. Immunological Investigations. 37 (7), 714-725 (2008).
- Kedl, R. M., et al. T cells compete for access to antigen-bearing antigen-presenting cells. The Journal of Experimental Medicine. 192 (8), 1105-1113 (2000).
- Kastenmuller, W., et al. Cross-competition of CD8+ T cells shapes the immunodominance hierarchy during boost vaccination. The Journal of Experimental Medicine. 204 (9), 2187-2198 (2007).
- Memarnejadian, A., et al. PD-1 Blockade Promotes Epitope Spreading in Anticancer CD8(+) T Cell Responses by Preventing Fratricidal Death of Subdominant Clones To Relieve Immunodomination. The Journal of Immunology. 199 (9), 3348-3359 (2017).
- Haeryfar, S. M., DiPaolo, R. J., Tscharke, D. C., Bennink, J. R., Yewdell, J. W. Regulatory T cells suppress CD8+ T cell responses induced by direct priming and cross-priming and moderate immunodominance disparities. The Journal of Immunology. 174 (6), 3344-3351 (2005).
- Rytelewski, M., et al. Suppression of immunodominant antitumor and antiviral CD8+ T cell responses by indoleamine 2,3-dioxygenase. PLoS One. 9 (2), e90439 (2014).
- Maleki Vareki, S., et al. Differential regulation of simultaneous antitumor and alloreactive CD8(+) T-cell responses in the same host by rapamycin. American Journal of Transplantation. 12 (1), 233-239 (2012).
- Irvine, K., Bennink, J. Factors influencing immunodominance hierarchies in TCD8+ -mediated antiviral responses. Expert Review of Clinical Immunology. 2 (1), 135-147 (2006).
- Grossmann, M. E., Davila, T., Celis, T. Avoiding tolerance against prostatic antigens with subdominant peptide epitopes. Journal of Immunotherapy. 24 (3), 237-241 (2001).
- Schreiber, H., Wu, T. H., Nachman, J., Kast, W. M. Immunodominance and tumor escape. Seminars in Cancer Biology. 12 (1), 25-31 (2002).
- Mylin, L. M., et al. Quantitation of CD8(+) T-lymphocyte responses to multiple epitopes from simian virus 40 (SV40) large T antigen in C57BL/6 mice immunized with SV40, SV40 T-antigen-transformed cells, or vaccinia virus recombinants expressing full-length T antigen or epitope minigenes. Journal of Virology. 74 (15), 6922-6934 (2000).
- Fu, T. M., et al. An endoplasmic reticulum-targeting signal sequence enhances the immunogenicity of an immunorecessive simian virus 40 large T antigen cytotoxic T-lymphocyte epitope. Journal of Virology. 72 (2), 1469-1481 (1998).
- Chen, W., et al. Cross-priming of CD8+ T cells by viral and tumor antigens is a robust phenomenon. European Journal of Immunology. 34 (1), 194-199 (2004).
- Memarnejadian, A., Meilleur, C. E., Mazzuca, D. M., Welch, I. D., Haeryfar, S. M. Quantification of Alloantibody-Mediated Cytotoxicity In Vivo. Transplantation. 100 (5), 1041-1051 (2016).
- Aichele, P., et al. Peptide antigen treatment of naive and virus-immune mice: antigen-specific tolerance versus immunopathology. Immunity. 6 (5), 519-529 (1997).
- Oehen, S., Brduscha-Riem, K. Differentiation of naive CTL to effector and memory CTL: correlation of effector function with phenotype and cell division. The Journal of Immunology. 161 (10), 5338-5346 (1998).
- Coles, R. M., Mueller, S. N., Heath, W. R., Carbone, F. R., Brooks, A. G. Progression of armed CTL from draining lymph node to spleen shortly after localized infection with herpes simplex virus 1. The Journal of Immunology. 168 (2), 834-838 (2002).
- Barber, D. L., Wherry, E. J., Ahmed, R. Cutting edge: rapid in vivo killing by memory CD8 T cells. The Journal of Immunology. 171 (1), 27-31 (2003).
- Meilleur, C. E., et al. Bacterial superantigens expand and activate, rather than delete or incapacitate, preexisting antigen-specific memory CD8+ T cells. The Journal of Infectious Diseases. , (2018).
- Goldszmid, R. S., et al. Dendritic cells charged with apoptotic tumor cells induce long-lived protective CD4+ and CD8+ T cell immunity against B16 melanoma. The Journal of Immunology. 171 (11), 5940-5947 (2003).
- Oberg, L., et al. Loss or mismatch of MHC class I is sufficient to trigger NK cell-mediated rejection of resting lymphocytes in vivo - role of KARAP/DAP12-dependent and -independent pathways. European Journal of Immunology. 34 (6), 1646-1653 (2004).
- Wingender, G., Krebs, P., Beutler, B., Kronenberg, M. Antigen-specific cytotoxicity by invariant NKT cells in vivo is CD95/CD178-dependent and is correlated with antigenic potency. The Journal of Immunology. 185 (5), 2721-2729 (2010).
- Brinster, R. L., et al. Transgenic mice harboring SV40 T-antigen genes develop characteristic brain tumors. Cell. 37 (2), 367-379 (1984).
- Tatum, A. M., et al. CD8+ T cells targeting a single immunodominant epitope are sufficient for elimination of established SV40 T antigen-induced brain tumors. The Journal of Immunology. 181 (6), 4406-4417 (2008).
- Schell, T. D., Tevethia, S. S. Control of advanced choroid plexus tumors in SV40 T antigen transgenic mice following priming of donor CD8(+) T lymphocytes by the endogenous tumor antigen. The Journal of Immunology. 167 (12), 6947-6956 (2001).
- Greenberg, N. M., et al. Prostate cancer in a transgenic mouse. Proceedings of the National Academy of Sciences of the United States of America. 92 (8), 3439-3443 (1995).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon