このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
腫瘍特異的 CD8+ T 細胞応答における Immunodominance を研究するためのインビボ細胞毒性アッセイ
要約
ここでは、モデル腫瘍抗原に対する細胞傷害性 T リンパ球 (CTL) 応答における immunodominance の検査を可能にする、フローサイトメトリーベースのインビボ殺傷アッセイについて述べる。このエレガントなアッセイが、機械的な研究や薬効試験にどのように使用されるかの例を示します。
要約
Carboxyfluorescein succinimidyl エステル (CFSE)-インビボ細胞傷害性アッセイは、腫瘍および病原体由来ペプチドに対して惹起される CD8+細胞溶解 T リンパ球 (CTL) 応答の高感度かつ正確な定量を可能にする。従来の殺滅アッセイよりもいくつかの利点があります。第1に、それらは、構造的に無傷の二次的なリンパ系器官内の CTL 媒介性細胞毒性のモニタリングを可能にし、典型的には脾臓にある。第2に、それらは CTL 応答のプライミング、エフェクターおよびリコール段階における機械的な研究を可能にする。第三に、彼らは真の in vivo の設定でワクチン/薬効試験のための有用なプラットフォームを提供します。ここで、我々は、モデル腫瘍抗原 (Ag) の複数のペプチドエピトープに対する付随する CTL 応答の検査のために最適化されたプロトコルを提供し、即ち、シミアンウイルス 40 (SV40) −大 T Ag (T Ag) をコードした。他のほとんどの臨床的に関連した腫瘍蛋白質のように、T Ag は多くの潜在的に免疫原性ペプチドを港湾する。しかし、このようなペプチドは、C57BL/6 マウスにおいて検出できる CTL 応答を誘導するものは4つだけである。これらの応答は、その大きさに基づいて一貫して階層的に配列されており、この強力なシステムにおいて TCD8 「immunodominance」の基礎をなす。したがって、T Ag 特異的 TCD8応答の大部分は、単一の immunodominant エピトープに対して集束され、他方の3つのエピトープは認識され、弱くしか応答しない。Immunodominance は、抗腫瘍性 TCD8応答の幅を妥協し、癌に対する予防接種を成功させるための障害として多くの人に考えられています。したがって、TCD8 immunodominance を規定または形状する細胞および分子因子および機構を理解することが重要である。ここで述べるプロトコールは、T Ag 免疫モデルにおけるこの現象の調査に合わせたものであるが、他の腫瘍モデルにおいても同様の研究に容易に改変および拡張することができる。我々は、実験的免疫療法介入の影響が in vivo の細胞傷害性アッセイを使用して測定できる方法の例を提供する。
概要
従来の CD8+ T 細胞 (TCD8) は抗癌免疫監視において重要な部分を再生する。それらは主として、主要な組織適合性複合体 (MHC) クラス I 分子の閉鎖間隙内に表示される腫瘍特異的または関連するペプチド抗原 (Ags) を認識する細胞溶解 T リンパ球 (CTLs) の能力において機能する。完全に武装した CTLs は、細胞傷害性兵器庫を利用して悪性セルを破壊する。抗癌性 TCD8は、循環中に、あるいは多くの癌患者および腫瘍担持する動物の原発性および転移性の塊の中で検出することができる。しかし、彼らはしばしば anergic または枯渇し、癌の根絶に失敗します。したがって、多くの免疫療法モダリティは、抗癌 TCD8周波数を増加させ、それらの機能を回復し、後押しするように設計されています。
腫瘍タンパク質は多くのペプチドを immunoprotective し、そのうちのいくつかは免疫原性および潜在的に可能性がある。しかし、定量化可能な TCD8応答は、少数のペプチドに対してのみ様々な大きさで惹起される。これは、TCD8クローン1の間で「immunodominance 階層」を作成する。したがって、immunodominant (ID) TCD8は、顕著な階層ランクを占め、これは一般的にその豊かさによって判断される。対照的に、t 細胞受容体 (TCR) が音 (SD) エピトープに特異的である TCD8細胞は、より低い周波数で起こる。我々および他の人々は、TCD8応答において immunodominance を指示または形成するいくつかの因子を同定した。これらには、とりわけ、ナイーブ TCD8に対する Ag 提示のモード (すなわち、直接提示、クロスプレゼンテーション、クロスドレッシング)2、3、4、ag 提示細胞の種類 (apc)TCD8活性化5に参加して、タンパク質 Ags6,7の豊かさと安定性と、プロテアソーム7,8によるそれらの分解の効率および動態とを、ペプチド9の Ag 処理 (TAP) に関連するトランスポーターの相対選択性は、MHC I 分子9、10に対する遊離ペプチドの親和性、存在、前駆体頻度および TCR 多様性のt 細胞プール11、12、13における同族 tcd8 、apc14、15、および tCD8の fratricidal 能力にアクセスするための t 細胞間の交差競合クローン16加えて、TCD8 immunodominance は、天然に存在する調節性 t (nTreg) 細胞17などのいくつかのサプレッサー細胞型によって媒介される免疫調節機構を受け、細胞表面共阻害分子プログラム死− 1 (PD − 1)16、及び indoleamine 2、3−ジオキシゲナーゼ (イド)18及び哺乳動物用ラパマイシンの哺乳類標的 (mTOR) などの特定の細胞内酵素が19である。ただし、上記の要因が常に immunodominance を考慮しているわけではないことに注意することが重要です。
TCD8 immunodominance の基礎生物学とは別に、この興味深い現象の検査は、がん免疫学と免疫療法において重要な意味を持っています。第1に、ID ステータスは、必ずしも所与の TCD8クローンが腫瘍開始または進行20を予防する能力を与えるとは限らない。どのように、どのように ID と SD TCD8が抗腫瘍免疫に寄与するかは、悪性腫瘍の種類と程度、および使用される実験系に依存する可能性があります。第2に、ID TCD8クローンが免疫系に対して「あまりにも見えない」可能性があり、結果的に中枢および/または末梢寛容機構16,21になりやすいと考えられる。第3に、heterogeneic 腫瘍は、多くの場合には検出を回避する新生細胞を含んでいてもよく、ほとんどではないにしても、CTLs はペプチドの狭いスペクトルのみを表示することによって、MHC 複合体。これらの状況下では、不十分な幅の TCD8応答は、このような腫瘍細胞を生存の利点とする余裕があり、従ってそれらの伸長22を増強する。それは、多くの見方が、TCD8ベースのワクチン接種と癌に対する治療を成功させるためのハードルとして immunodominance ことである。
C57BL/6 マウスをサルウイルス 40 (SV40) で接種すると、大規模な腫瘍 Ag (T Ag) を発現する形質転換細胞は、TCD8 immunodominance を研究する強力な前臨床システムを提供する。このモデルは、いくつかの利点を提供します。第1に、この臨床的に関連するあるのペプチドエピトープは、このマウス株23においてよく特徴付けられる (表 1)。第二に、サイト I、II/III、IV、および V と呼ばれる T Ag エピトープは、以下の階層順序で一貫して配列されている TCD8応答をトリガします: サイト iv > > サイト I ≥サイト II/III > ≫ サイト V。したがって、サイト Iv 特異的 TCD8T Ag に最も堅牢な応答をマウントします。対照的に、部位 I および II/III は音であり、そして部位 V 特異的な TCD8は、少なくとも豊富であり、通常、他のエピトープ23、24に対する応答性がない場合にのみ検出可能である。第3に、本明細書に記載のプロトコールにおいて利用される T Ag+腫瘍細胞株、すなわち C57SV 線維肉腫細胞、およびこれまでの調査で用いられたものは16、17、18、19 、25、26、サブゲノミック SV40 フラグメント25で形質転換される。したがって、それらは、宿主 Apc に感染する可能性のある SV40 ビリオンをアセンブルおよび放出することができない。さらに、C57SV 細胞は、CD80 (B7-1)、CD86 (B7-2)、および CD137 リガンド (4-1BBL)16などの古典的な増強分子を欠いている。上記の属性は、これらの線を交差プライミングによるインビボ TCD8活性化の検査に理想的にする。交差プライミングは、TCD8応答を誘導することにおける主要な経路であり、特に、直接素数 t 細胞25に失敗する非造血起源の腫瘍細胞に対して発射されるものである。
抗腫瘍性 TCD8の頻度および/または機能は、MHC I 四量体染色によってモニタリングすることができ、エフェクターサイトカインに対する細胞内染色 (例えば、インターフェロン [IFN]-γ) または溶菌分子 (例えば、パーフォリン)、酵素結合 Immunospot (ELISpot) アッセイおよび exインビボ細胞傷害性アッセイ。1990年代に開始されて以来、27,28, carboxyfluorescein succinimidyl エステル (CFSE)-インビボで殺害アッセイは、抗ウイルスによって媒介される細胞傷害性応答の評価を可能にした CTLs29,30,31、抗腫瘍性 CTLs16、32、ナチュラルキラー (NK) 細胞33、糖脂質反応性不変のナチュラルキラー T (iNKT) 細胞34、および、既存および de novo ドナー特異的同種抗体26。したがって、それらのアプリケーションは、腫瘍免疫学および免疫療法、抗病原体免疫、および予防および治療ワクチン設計の分野で働く研究者を含むが、これらに限定されない幅広い読者にとって興味深いものとなり得る。
典型的なシナリオにおける細胞媒介性細胞毒性を評価するために、無関係な Ag または同族 Ag のいずれかを表示するナイーブ脾細胞の2つの集団は、CFSE の2つの異なる用量で標識され、等しい数で混合し、ナイーブ (コントロール) またはキラーに注入する細胞を宿すマウス。次に、各ターゲット母集団の有無がフローサイトメトリーによって検査されます。
我々は、抗ウイルスおよび抗腫瘍性 TCD8応答の両方における immunodominance に関する研究において、最適化されており、インビボ殺害アッセイを行った12、16、17。ここでは、ID および SD TCD8応答の同時評価のための詳細なプロトコールを、他の実験系における同様の調査のために容易に採用することができる t Ag エピトープに提供する。我々はまた、nTreg 細胞枯渇および PD-1 遮断が、それぞれ ID Tcd8-および SD Tcd8誘発性細胞毒性を選択的に増強できることを示す代表的な結果を提供する。最後に、in vivo での殺滅アッセイとその固有の制限について、複数の利点について説明します。
プロトコル
ここに記載された実験は、機関団体が承認し、確立された国家ガイドラインに従う動物使用プロトコルに従っています。
1. T Ag 発現腫瘍細胞を用いた C57BL/6 マウスの接種
- 4.5 g/L D-グルコースおよび L-グルタミン (1x) でダルベッコ改変の修飾イーグル培地 (DMEM) で SV40 形質転換線維肉腫細胞株 C57SV (または類似の T Ag+接着細胞株) を増殖させ、1 mM のピルビン酸ナトリウムと 10% の熱不活性化を添加したウシ胎児血清 (FBS) を 10% CO2 を含有する加湿雰囲気下で37° c の組織培養処理フラスコ中。
- 細胞が完全にコンフルエントまたはわずかに overconfluent になったら、培地を静かに除去して廃棄し、あらかじめ温めた滅菌リン緩衝生理食塩水 (PBS) で単層をすすいでください。
注: T Ag+細胞が 100% コンフルエントに達すると、最大 t ag 発現が達成されます。 - 生物学的安全キャビネットの中で、予加温したトリプシン-EDTA (0.25%)パッチ内で細胞が外れてしまうまで室温で単層を覆うこと。培養フラスコの側面を数回タップして、残りの付着細胞を放出する。
注: 必要に応じて、トリプシン処理プロセスを迅速に行うには、フラスコを37° c のインキュベーターに移します。外れた細胞は、すぐに光学顕微鏡下で丸い形状を採用します。このステップは、約5分を持続する必要があります。 - 5 mL の DMEM 培地を追加し、塊を解離させることにより、各フラスコの内容物を上下にピペッティングして単一細胞懸濁液を調製します。
- 70μ m の細孔を持つ細胞の懸濁液をチューブに移します。
- 4° c で5分間 400 x gでチューブをスピンダウンします。
- 上清を破棄します。再懸濁は、10 mL の滅菌冷 PBS 中の細胞をペレット化した。
- 手順1.6 と1.7 を2回繰り返します。
- 血球計数器を使用してセルをカウントします。4 x 107細胞/ml の無菌 PBS を含む均一な懸濁液を調製します。
- 上記の懸濁液の500μ l を各成人 (6-12 週齢) オスまたはメス型 C57BL/6 マウスに注入する。
2. 治療レジメン
-
NTreg 細胞の TCD8 Immunodominance への寄与を調べる治療レジメン
- C57SV 細胞を用いた C57BL/6 マウスのインビボプライミングの4日前 (ステップ 1.10)、0.5 の低エンドトキシンを CD25 として一度に1つずつ、nTreg 細胞を枯渇させるアジドフリー抗モノクローナル抗体 (mAb) (クローン PC-61.5.3)、またはラット IgG1 アイソタイプを注入する。コントロール (例: クローン KLH/G1-2-2、クローン HRPN、クローン TNP6A7)
-
Immunodominance の整形における PD −1− PD − L1 (2) 相互作用の生体内意義を試験する治療レジメン
注: pd − L1 による PD-1 の関与は、しばしば、常にではないが、Ag 特異的 TCD8の共阻害および/または枯渇を媒介する。したがって、抗 pd −1による治療は、抗 pd − L1 および抗 PD − L2 mAbs の投与と並行して行うことができ、生物学的現象に関与する正確な細胞間相互作用を明らかにする。
3. 標的脾細胞の調製
- Euthanize は子宮頸脱臼によって splenocyte ドナーとして機能する、性的にマッチしたナイーブ C57BL/6 マウス (6-12 週齢) を使用します。
- 生物学的安全キャビネットの中に、腹部を上に向けて配置します。70% (v/v) Etoh 中で皮膚をスプレーします。生殖不能の鉗子およびはさみを使用して、皮を持ち上げ、そして小さい腹の正中線の切り傷を作る。その後、皮膚をクロスのような方法で切断し、腹膜を露出させる。
- 鉗子を使用して、内臓のいずれかをひったくりことなく、テントのような方法で腹膜を引き上げます。腹膜を開いて腹腔を露出させ、穏やかに脾臓を除去します。
- 5 mL の滅菌 PBS を含む 15 mL Dounce 組織グラインダーの中に脾臓 (s) を配置します。脾組織が赤く均質な細胞懸濁液に放散するまで、グラインダーのガラスプランジャーを使用して手動圧力を適用します。
注: 実験群あたりのレシピエント動物の数に応じて、標的細胞調製のためにいくつかのドナーマウス脾臓が必要とされ得る。15の mL の粉砕機の中で3つまでの脾臓は一緒に均質にすることができる。 - ホモジネートを 15 mL チューブに移します。4° c で5分間 400 x gでチューブをスピンダウンします。
- 上清を破棄します。再懸濁は、赤血球を除去するために4分間のアンモニウム-塩化カリウム (ACK) 溶解するバッファー4ミリリットルの細胞をペレット化しました。
注: これは時間に敏感なステップです。Overexposing 脾細胞を ACK 溶解するバッファーにすると、脆弱性が増加し、非特異的細胞死の影響を受けやすくなる。 - 各チューブに、10% の熱不活性化 FBS、L-アラニル-L-グルタミン、0.1 mM 最小必須培地 (MEM) 非必須アミノ酸、1 mM ピルビン酸ナトリウム、10 mM HEPES、および1x ペニシリン/ストレプトマイシンを含有する 8 mL の RPMI 1640 媒体を加え、これは今後完全 RPMI 培地 (材料表) と称される。
- セルストレーナーの70μ m の細孔を介して新しい 15 mL チューブにコンテンツを移します。
- 4° c で5分間 400 x gでチューブをスピンダウンします。
- 上清を破棄します。再懸濁は、12 mL の完全な RPMI 中で細胞をペレット化した。
- Splenocyte 懸濁液を3つの等しい部分 (それぞれ4つの mL) に分けます。
4. 無関係で同族ペプチドを用いたコーティング標的脾細胞
- 標的脾細胞をパルスするために使用されるペプチドに従ってチューブにラベルを付けます。コントロール脾細胞は無関係なペプチドでパルスされ、同一の標的脾細胞の各集団は、T Ag 由来 immunodominant エピトープ (部位 IV) または音 T Ag エピトープに対応する合成ペプチドでパルスされる (サイト I またはサイトII/III) (表 1)。
注: 無関係なペプチドの選択は、各調査で使用される実験のセットアップとマウスのひずみに依存します。著者らはしばしば、gB498-505を使用しています (h-2kb-単純ヘルペスウイルスの IMMUNODOMINANT ペプチドエピトープ [HSV]-1) および/または GP33-41 (a h-2db-リンパ性の immunodominant ペプチドエピトープを制限choriomeningitis ウイルス ([LCMV]) を C57BL/6 マウスにおける (表 1)。これらのペプチドは、以下の理由から最適な選択肢です:(i) ここに記載されているマウスモデルで以前に遭遇していない病原体に由来しています。(ii) T Ag 由来ペプチドと同様に、gB498-505および GP33-41は、h2b分子によって制限され、結合する。インビボ殺害アッセイにおける「3ピーク」において、同族標的細胞に対応する2つのピークの各々は、immunodominant または音ペプチドでパルスされた脾細胞を表すことができる。各ペプチドセットの選択は、各実験の目的に応じて変化する。このような変動の例として図1および図2を参照のこと。このプロトコルの残りの部分については、T Ag 由来部位 I および IV は、それぞれ音および immunodominant ペプチドを表すであろう。 - 各標識チューブの含有量を1μ m でそれぞれのペプチドを37° c で1時間、5%co2 でパルスする。
- 必要に応じて、それぞれのチューブについて別の細胞ストレーナー (70 μ m の細孔) を使用して凝集体と破片を除去してください。
- 4° c で5分間 400 x gでチューブをスピンダウンします。上清を破棄します。
- 再懸濁は、12 mL の無菌冷 PBS 中の細胞をペレット化し、もう一度ステップ4.4 を繰り返す。
注: FBS は次のステップで CFSE をバインドできるため、できるだけ多くの FBS を削除することが重要です。
5. 標的脾細胞を CFSE で標識する
- 再懸濁は、無菌 PBS の 4 mL にペプチドパルス脾細胞を加えた。
- 0.025 μ m、0.25 μ m、および2μ m の CFSE を、無関係なペプチド-、部位 I-、および部位 IV-パルス脾細胞を含むチューブに添加する。
注: 均一な CFSE ラベリングを達成するには、各チューブを45°の角度で保持してから、細胞懸濁液の少し上側に CFSE を加え、すぐに穏やかなボルテックスが続くようにします。これは、最後に滑らかなヒストグラムの外観を確保します.CFSE 強度におけるバッチ間および年齢依存の変動は珍しくない。したがって、使用する最適な濃度を決定する前に、差動 CFSE 用量で実験する必要があるかもしれません。
注意: CFSE は5μ m より高い濃度で有毒です。 - チューブを37° c のインキュベーター内に15分間置き、5分ごとに1回反転させます。
- 3 mL の熱不活性化 FBS を各チューブに加え、CFSE 反応を停止させる。無菌 PBS でコンテンツをトップアップ。
- 4° c で5分間 400 x gでチューブをスピンダウンします。上清を破棄します。
- 再懸濁は、12 mL の無菌 PBS 中の細胞をペレット化し、ステップ5.5 を繰り返す。
6. 標的 Splenocyte 集団の適切な/等しい CFSE の標識の検討
- 再懸濁は、PBS の3ミリリットル中の細胞をペレット化した。
- 優しくチューブを渦。転写10μ l は、それぞれ、CFSE の低、CFSE中間体 (int)、及び CFSE の高細胞懸濁液を 5 mL の丸底ポリスチレン蛍光活性化細胞選別 (FACS) チューブに200μ l の PBS を含有する。
- 488 nm レーザーを搭載したフローサイトメーターを用いて細胞を尋問する。FL −1チャネルにおけるリンパ球ゲート内にある5000イベントを取得する前に、細胞の前方散乱 (FSC) および側散乱 (SSC) 特性に基づいてリンパ球ゲートを描く。
- 「親」 CFSE+母集団内で、CFSE低、CFSEint、および CFSE高亜集団を識別するために、追加のヒストグラム・ゲートを描画します。
- 3つのゲート内で等しいまたはほぼ等しいイベント番号を確認します。必要であれば、「ソース」チューブ (ステップ 6.1) で細胞数を調整してから、標的脾細胞を混合して、セクション7のナイーブマウスとプライミングされたネズミに注入する。
7. CFSE に分類された標的細胞をナイーブおよび T-Ag-プライミング受信者に注入する
- ソースチューブをゆっくりと渦をかけます。3つの CFSE 標識された細胞懸濁液を等しい比率で新しいチューブに移します。
- 無菌 PBS でコンテンツをトップアップ。
- 4° c で5分間 400 x gでチューブをスピンダウンします。再懸濁は、無菌 PBS で細胞をペレット化した。
- 少なくとも 95% の細胞の生存率を確保するために血球計数器によってトリパンブルーの細胞を数えます。
- 1 x 107混合標的細胞/200 μ l PBS を静脈内 (点滴静脈内) に注入するために、各レシピエント C57BL/6 マウスに体積を調整する。
注: 注射の間に氷の上に細胞を保存します。各注射の前に、ターゲット細胞を優しく混ぜます。各マウスの射出の正確な時間を記録し、動物を安楽死させる必要がある時期を決定します。同じ実験において全ての動物の間で生体内の細胞傷害の持続時間を維持することが重要である。
8. データ取得
- CFSE 標識標的細胞の注入の2または4時間後に、頸椎脱臼によってレシピエントマウスを euthanize する。
注: インビボ細胞傷害性の持続時間は、用いられる実験系、標的 Ags の免疫原性、脾臓におけるペプチド抗原特異的 TCD8の予想される存在量、およびそれらの溶解機能の頑健性によって変化し得る他の要因の中で. - ステップ3.2 −3.9 のように各脾臓を別々に取り外し、処理する。
- 上清を捨て、ペレット化した細胞を 3 mL の PBS に再懸濁。
注: cytofluorimetric 分析の前に、4° c または氷上で脾組織と細胞製剤を処理するために細心の注意を取ってください。これは、生体内における細胞毒性の継続を防止するためである。 - 処理した脾臓から約 1 x 107個の細胞を清潔な FACS チューブに移します。
- 488 nm レーザーを搭載したフローサイトメーターを用いて細胞に直ちに尋問する。細胞の FSC および SSC の特性に基づいてリンパ球ゲートを描きます。
- CFSE-レシピエントの脾細胞と CFSE+転移した標的を同定する。明確な CFSE低、CFSEINT、および CFSE の高い標的細胞集団を収容する追加のゲートを描画します。
- FL-1 チャネルで合計 2000 CFSE の低いイベントを取得します。
9. データ分析
- 次の式を使用して、各同族ターゲットセル母集団の特定の溶解を計算します。
比特異的細胞傷害性 =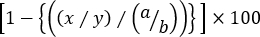
ここでは、t ag 先読みマウスのx = CFSEint/highイベント番号、 y = CFSE の低いイベント番号 t ag-プライミングされるマウス、 a = CFSEint/highイベント番号 (ナイーブマウス)、 b = CFSE低イベントナイーブマウスの番号。
注: 複数の同族ターゲット集団の特定の溶解が評価される「3ピーク」細胞毒性アッセイでは、ターゲット細胞の頻度を使用することは適切ではありません。これは、単に同族の標的細胞集団の頻度が、無関係な対照のパーセンテージによってだけでなく、他の同族対象脾細胞の割合によっても影響を受けるからである。したがって、各ゲート内のイベント番号は、CFSE の低制御に対して各同族ターゲット細胞集団 (CFSEINTまたは CFSE高セルのいずれか) の溶解を正確に計算するために、上記の式で使用する必要があります。
結果
その結果が図 1に示された実験の目的は、nTreg 細胞の存在および機能が t Ag 特異的 tCD8の immunodominance 階層を形成または変化させるかどうかを決定することであった。C57BL/6 マウスを PBS または 0.5 mg の抗 CD25 mAb (クローン PC-61.5.3 [PC61]) で4日目に 2 x 106 C57SV 腫瘍細胞を受信した。別々の実験において、ラット IgG1 アイソタイプコントロールが PBS の代わりに...
ディスカッション
CFSE ベースの細胞傷害アッセイは、放射性クロム (51Cr) 放出および比色乳酸脱水素酵素 (LDH) 放出アッセイなどの従来の殺滅アッセイに比べていくつかの利点を提供する。第1に、構造的に無傷な二次リンパ器官内での CTL 機能のモニタリングを可能にする。
第2に、インビボ細胞傷害性アッセイにおける標的細胞の特異的殺傷は、Ag 特異的 Tcd8の絶対数を反?...
開示事項
作者は何も開示することはありません。
謝辞
この作業は、カナダ医療研究機関 (CIHR) 助成金130465と PJT-156295 によってサポートされました SMMH。JC さんは、オンタリオ州の研修、大学、大学から科学技術分野の研究者であるクイーン・エリザベス二世によって部分的に支持されています。CEM は、カナダの自然科学および工学研究評議会 (NSERC) からアレクサンダー・グラハム・ベル・カナダ奨学生 (博士) の受賞者でした。
資料
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA (1X) | Thermo Fisher Scientific | 25200-056 | |
| ACK Lysing Buffer | Thermo Fisher Scientific | A1049201 | |
| Anti-mouse CD25 (clone PC-61.5.3) | Bio X Cell | BE0012 | |
| Anti-mouse PD-1 (clone RMP1-14) | Bio X Cell | BE0146 | |
| CFSE | Thermo Fisher Scientific | C34554 | |
| DMEM (1X) | Thermo Fisher Scientific | 11965-092 | |
| Fetal bovine serum (FBS) | Wisent Bioproducts | 080-150 | Heat-inactivate prior to use |
| GlutaMAX (100X) | Thermo Fisher Scientific | 35050-061 | |
| HEPES (1M) | Thermo Fisher Scientific | 15630080 | 10 mM final concentration |
| MEM Non-Essential Amino Acids Solution (100X) | Thermo Fisher Scientific | 11140-050 | |
| Penicillin/Streptomycin | Sigma-Aldrich | P0781 | Stock is 100X |
| Rat IgG1 (clone KLH/G1-2-2) | SouthernBiotech | 0116-01 | Isotype control |
| Rat IgG1 (clone HRPN) | Bio X Cell | BE0088 | Isotype control |
| Rat IgG1 (clone TNP6A7) | Bio X Cell | BP0290 | Isotype control |
| Rat IgG2a (clone 2A3) | Bio X Cell | BP0089 | Isotype control |
| RPMI 1640 (1X) | Thermo Fisher Scientific | 11875-093 | |
| Sodium Pyruvate (100 mM) | Thermo Fisher Scientific | 11360-070 | 1 mM final concentration |
参考文献
- Yewdell, J. W., Bennink, J. R. Immunodominance in major histocompatibility complex class I-restricted T lymphocyte responses. Annual Review of Immunology. 17, 51-88 (1999).
- Chen, W., et al. Reversal in the immunodominance hierarchy in secondary CD8+ T cell responses to influenza A virus: roles for cross-presentation and lysis-independent immunodomination. The Journal of Immunology. 173 (8), 5021-5027 (2004).
- Otahal, P., et al. Inefficient cross-presentation limits the CD8+ T cell response to a subdominant tumor antigen epitope. The Journal of Immunology. 175 (2), 700-712 (2005).
- Lauron, E. J., et al. Cross-priming induces immunodomination in the presence of viral MHC class I inhibition. PLoS Pathogens. 14 (2), e1006883 (2018).
- Crowe, S. R., et al. Differential antigen presentation regulates the changing patterns of CD8+ T cell immunodominance in primary and secondary influenza virus infections. The Journal of Experimental Medicine. 198 (3), 399-410 (2003).
- Probst, H. C., et al. Immunodominance of an antiviral cytotoxic T cell response is shaped by the kinetics of viral protein expression. The Journal of Immunology. 171 (10), 5415-5422 (2003).
- Gileadi, U., et al. Generation of an immunodominant CTL epitope is affected by proteasome subunit composition and stability of the antigenic protein. The Journal of Immunology. 163 (11), 6045-6052 (1999).
- Zanker, D., Waithman, J., Yewdell, J. W., Chen, W. Mixed proteasomes function to increase viral peptide diversity and broaden antiviral CD8+ T cell responses. The Journal of Immunology. 191 (1), 52-59 (2013).
- Deng, Y., Yewdell, J. W., Eisenlohr, L. C., Bennink, J. R. MHC affinity, peptide liberation, T cell repertoire, and immunodominance all contribute to the paucity of MHC class I-restricted peptides recognized by antiviral CTL. The Journal of Immunology. 158 (4), 1507-1515 (1997).
- Chen, W., Khilko, S., Fecondo, J., Margulies, D. H., McCluskey, J. Determinant selection of major histocompatibility complex class I-restricted antigenic peptides is explained by class I-peptide affinity and is strongly influenced by nondominant anchor residues. The Journal of Experimental Medicine. 180 (4), 1471-1483 (1994).
- Kotturi, M. F., et al. Naive precursor frequencies and MHC binding rather than the degree of epitope diversity shape CD8+ T cell immunodominance. The Journal of Immunology. 181 (3), 2124-2133 (2008).
- Haeryfar, S. M., et al. Terminal deoxynucleotidyl transferase establishes and broadens antiviral CD8+ T cell immunodominance hierarchies. The Journal of Immunology. 181 (1), 649-659 (2008).
- Leon-Ponte, M., Kasprzyski, T., Mannik, L. A., Haeryfar, S. M. Altered immunodominance hierarchies of influenza A virus-specific H-2(b)-restricted CD8+ T cells in the absence of terminal deoxynucleotidyl transferase. Immunological Investigations. 37 (7), 714-725 (2008).
- Kedl, R. M., et al. T cells compete for access to antigen-bearing antigen-presenting cells. The Journal of Experimental Medicine. 192 (8), 1105-1113 (2000).
- Kastenmuller, W., et al. Cross-competition of CD8+ T cells shapes the immunodominance hierarchy during boost vaccination. The Journal of Experimental Medicine. 204 (9), 2187-2198 (2007).
- Memarnejadian, A., et al. PD-1 Blockade Promotes Epitope Spreading in Anticancer CD8(+) T Cell Responses by Preventing Fratricidal Death of Subdominant Clones To Relieve Immunodomination. The Journal of Immunology. 199 (9), 3348-3359 (2017).
- Haeryfar, S. M., DiPaolo, R. J., Tscharke, D. C., Bennink, J. R., Yewdell, J. W. Regulatory T cells suppress CD8+ T cell responses induced by direct priming and cross-priming and moderate immunodominance disparities. The Journal of Immunology. 174 (6), 3344-3351 (2005).
- Rytelewski, M., et al. Suppression of immunodominant antitumor and antiviral CD8+ T cell responses by indoleamine 2,3-dioxygenase. PLoS One. 9 (2), e90439 (2014).
- Maleki Vareki, S., et al. Differential regulation of simultaneous antitumor and alloreactive CD8(+) T-cell responses in the same host by rapamycin. American Journal of Transplantation. 12 (1), 233-239 (2012).
- Irvine, K., Bennink, J. Factors influencing immunodominance hierarchies in TCD8+ -mediated antiviral responses. Expert Review of Clinical Immunology. 2 (1), 135-147 (2006).
- Grossmann, M. E., Davila, T., Celis, T. Avoiding tolerance against prostatic antigens with subdominant peptide epitopes. Journal of Immunotherapy. 24 (3), 237-241 (2001).
- Schreiber, H., Wu, T. H., Nachman, J., Kast, W. M. Immunodominance and tumor escape. Seminars in Cancer Biology. 12 (1), 25-31 (2002).
- Mylin, L. M., et al. Quantitation of CD8(+) T-lymphocyte responses to multiple epitopes from simian virus 40 (SV40) large T antigen in C57BL/6 mice immunized with SV40, SV40 T-antigen-transformed cells, or vaccinia virus recombinants expressing full-length T antigen or epitope minigenes. Journal of Virology. 74 (15), 6922-6934 (2000).
- Fu, T. M., et al. An endoplasmic reticulum-targeting signal sequence enhances the immunogenicity of an immunorecessive simian virus 40 large T antigen cytotoxic T-lymphocyte epitope. Journal of Virology. 72 (2), 1469-1481 (1998).
- Chen, W., et al. Cross-priming of CD8+ T cells by viral and tumor antigens is a robust phenomenon. European Journal of Immunology. 34 (1), 194-199 (2004).
- Memarnejadian, A., Meilleur, C. E., Mazzuca, D. M., Welch, I. D., Haeryfar, S. M. Quantification of Alloantibody-Mediated Cytotoxicity In Vivo. Transplantation. 100 (5), 1041-1051 (2016).
- Aichele, P., et al. Peptide antigen treatment of naive and virus-immune mice: antigen-specific tolerance versus immunopathology. Immunity. 6 (5), 519-529 (1997).
- Oehen, S., Brduscha-Riem, K. Differentiation of naive CTL to effector and memory CTL: correlation of effector function with phenotype and cell division. The Journal of Immunology. 161 (10), 5338-5346 (1998).
- Coles, R. M., Mueller, S. N., Heath, W. R., Carbone, F. R., Brooks, A. G. Progression of armed CTL from draining lymph node to spleen shortly after localized infection with herpes simplex virus 1. The Journal of Immunology. 168 (2), 834-838 (2002).
- Barber, D. L., Wherry, E. J., Ahmed, R. Cutting edge: rapid in vivo killing by memory CD8 T cells. The Journal of Immunology. 171 (1), 27-31 (2003).
- Meilleur, C. E., et al. Bacterial superantigens expand and activate, rather than delete or incapacitate, preexisting antigen-specific memory CD8+ T cells. The Journal of Infectious Diseases. , (2018).
- Goldszmid, R. S., et al. Dendritic cells charged with apoptotic tumor cells induce long-lived protective CD4+ and CD8+ T cell immunity against B16 melanoma. The Journal of Immunology. 171 (11), 5940-5947 (2003).
- Oberg, L., et al. Loss or mismatch of MHC class I is sufficient to trigger NK cell-mediated rejection of resting lymphocytes in vivo - role of KARAP/DAP12-dependent and -independent pathways. European Journal of Immunology. 34 (6), 1646-1653 (2004).
- Wingender, G., Krebs, P., Beutler, B., Kronenberg, M. Antigen-specific cytotoxicity by invariant NKT cells in vivo is CD95/CD178-dependent and is correlated with antigenic potency. The Journal of Immunology. 185 (5), 2721-2729 (2010).
- Brinster, R. L., et al. Transgenic mice harboring SV40 T-antigen genes develop characteristic brain tumors. Cell. 37 (2), 367-379 (1984).
- Tatum, A. M., et al. CD8+ T cells targeting a single immunodominant epitope are sufficient for elimination of established SV40 T antigen-induced brain tumors. The Journal of Immunology. 181 (6), 4406-4417 (2008).
- Schell, T. D., Tevethia, S. S. Control of advanced choroid plexus tumors in SV40 T antigen transgenic mice following priming of donor CD8(+) T lymphocytes by the endogenous tumor antigen. The Journal of Immunology. 167 (12), 6947-6956 (2001).
- Greenberg, N. M., et al. Prostate cancer in a transgenic mouse. Proceedings of the National Academy of Sciences of the United States of America. 92 (8), 3439-3443 (1995).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved