É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Adaptando os ensaios de citotoxicidade in vivo para estudar Imunodominância em respostas de células T CD8+ específicas do tumor
Neste Artigo
Resumo
Nós descrevemos aqui um ensaio in vivo cytometry-baseado do fluxo da matança que permita a examinação do immunodominance em respostas citotóxicas do linfócito de T (CTL) a um antígeno modelo do tumor. Nós fornecemos exemplos de como este ensaio elegante pode ser empregado para estudos mecanistic e para o teste da eficácia da droga.
Resumo
Carboxyfluoresceína éster succinimidílico (CFSE)-com base in vivo ensaios de citotoxicidade permitem a quantificação sensível e precisa de CD8+ citolítico T linfócitos (CTL) respostas eliciadas contra tumor e peptídeos derivados de patógenos. Oferecem diversas vantagens sobre ensaios tradicionais da matança. Primeiramente, permitem a monitoração do citotoxicidade CTL-negociado dentro dos órgãos lymphoid secundários arquitetonicamente intactos, tipicamente no spleen. Segundo, eles permitem estudos mecanísticos durante as fases de priming, efetor e recall de respostas CTL. Em terceiro lugar, eles fornecem plataformas úteis para testes de eficácia de vacina/drogas em um ambiente verdadeiramente in vivo. Aqui, nós fornecemos um protocolo aperfeiçoado para a examinação de respostas concomitantes do CTL de encontro a mais de um epítopo do peptide de um antígeno modelo do tumor (AG), a saber, o vírus do Simian 40 (SV40)-codificado grande T AG (T AG). Como a maioria das outras proteínas tumorais clinicamente relevantes, o T AG abriga muitos peptídeos potencialmente imunogênicos. Entretanto, somente quatro tais peptídeos induzem respostas detectáveis de CTL em camundongos C57BL/6. Estas respostas são organizadas consistentemente em uma ordem hierárquica baseada em sua magnitude, que forma a base para o "immunodominance TCD8 " neste sistema poderoso. Conformemente, a maioria da resposta t AG-específicaCD8 de t é focalizada de encontro a um único epítopo mapeado immunodominante quando os outros três epítopos forem reconhecidos e respondidos a somente fraca. A imunodominância compromete a amplitude das respostas antitumorais TCD8 e é, como tal, considerada por muitos como um impedimento para a vacinação bem-sucedida contra o cancro. Portanto, é importante compreender os fatores e mecanismos celulares e moleculares que ditam ou formam a imunodominância TCD8 . O protocolo que nós descrevemos aqui é costurado à investigação deste fenômeno no modelo da imunização de T AG, mas pode prontamente ser modificado e estendido aos estudos similares em outros modelos do tumor. Fornecemos exemplos de como o impacto das intervenções imunoterapêuticas experimentais pode ser medido usando ensaios de citotoxicidade in vivo.
Introdução
Células t CD8+ convencionais (tCD8) desempenham partes importantes na vigilância imune anticâncer. Eles funcionam principalmente na capacidade de linfócitos T citolíticos (CTLs) que reconhecem antígenos de peptídeos específicos do tumor ou associados (AGS) exibidos dentro da fenda fechada das moléculas de classe I do complexo de histocompatibilidade principal (MHC). CTLs totalmente armados utilizam seu arsenal citotóxico para destruir células malignas. O anticâncer TCD8 pode ser detectado na circulação ou mesmo dentro de massas primárias e metastáticas de muitos pacientes com câncer e animais portadores de tumor. No entanto, muitas vezes são anérgicos ou esgotados e não conseguem erradicar o cancro. Portanto, muitas modalidades imunoterapêuticas são projetadas para aumentar as frequências TCD8 anticâncer e para restaurar e impulsionar suas funções.
As proteínas tumorais abrigam muitos peptídeos, alguns dos quais podem ser imunogênicos e potencialmente imunoprotetores. Entretanto, as respostas TCD8 quantificáveis são eliciadas com magnitudes variáveis contra poucos peptídeos. Isso cria uma "hierarquia de imunodominância" entre os clones TCD8 1. Consequentemente, o imunodominante (ID) TCD8 ocupa fileiras hierárquicas proeminentes, que é julgada geralmente por sua abundância. Em contraste, células TCD8 cujo receptor de célula t (TCR) é específico para epítopos SUBDOMINANTES (DP) ocorrem em freqüências mais baixas. Nós e outros identificamos alguns dos fatores que ditam ou formam a imunodominância em respostas TCD8 . Estes incluem, entre outros, a modalidade da apresentação do AG ao TCD8 ingênuo (isto é, apresentação direta, Cruz-apresentação, cross-dressing)2,3,4, o tipo de pilhas AG-apresentando (APCs) participando da ativação TCD8 5, a abundância e estabilidade de proteínas AGS 6,7 e a eficiência e cinética de sua degradação por proteasomas7,8, o seletividade relativa do transportador associada ao processamento de AG (TAP) parapeptídeos9, a afinidade de peptídeos liberados para moléculas de MHC I9,10, a presença, as frequências precursoras e a diversidade de TCR de cognato tCD8 em pools de células t11,12,13, Cross-Competition entre as células t para acesso a APCs14,15, e a capacidade fratricida de TCD8 dos clones16. Além disso, a imunodominância TCD8 é submetida a mecanismos imunoregulatórios mediados por vários tipos de células supressoras, tais como células t regulatórias de ocorrência natural (ntreg)17, a molécula de superfície celular co-inibitória programada óbito-1 (PD-1)16, e certas enzimas intracelulares como a indolamina 2,3-dioxigenase (ido)18 e o alvo de mamíferos de rapamicina (mTOR)19. É importante notar, no entanto, que os fatores acima nem sempre respondem totalmente à imunodominância.
Aparte da biologia básica do immunodominance de TCD8 , a examinação deste fenômeno intrigante tem implicações importantes na imunologia e na imunoterapia do cancro. Primeiramente, um status da identificação não confere necessariamente em cima de um clone dado de TCD8 a habilidade de impedir a iniciação ou a progressão do tumor20. Se e como a identificação e o SD TCD8 contribuem à imunidade antitumoral podem depender do tipo e da extensão da malignidade e do sistema experimental empregado. Em segundo lugar, acredita-se que os clones de ID TCD8 podem ser "muito visíveis" para o sistema imunológico e, consequentemente,mais propensos a mecanismos de tolerância central e/ou periférica,16,21. Em terceiro lugar, os tumores heterogênicos podem conter as pilhas neoplásticas que evitam a deteção por muitos, se não a maioria, CTLs indicando somente um espectro estreito dos complexos do peptide: MHC. estas circunstâncias, as respostas de TCD8 da amplitude insuficiente são prováveis ter recursos para tais pilhas do tumor uma vantagem da sobrevivência, assim potenciando seu conseqüência22. É pelas razões acima que muitos a imunodominância da vista como um obstáculo ao sucesso TCD8-baseou a vacinação e as terapias de encontro ao cancro.
A inoculação de camundongos C57BL/6 com vírus Simian 40 (SV40)-células transformadas que expressam grande tumor AG (T AG) fornece um poderoso sistema pré-clínico para estudar imunodominância TCD8 . Este modelo oferece vários benefícios. Primeiramente, os epítopos peptídicos desta oncoproteína clinicamente relevante são bem caracterizados nesta cepa do camundongo23 (tabela 1). Segundo, os epítopos de T AG, que são chamados de sites I, II/III, IV e V, ativam as respostas TCD8 que são consistentemente organizadas na seguinte ordem hierárquica: site iv > > site i ≥ site II/iii > ≫ site V. consequentemente, o local IV específico tCD8 montar a resposta mais robusta para T AG. Em contrapartida, os sítios I e II/III são subdominantes, e o TCD8 específico do sítio V é menos abundante e geralmente apenas detectável na ausência de responsividade a outros epítopos23,24. Em terceiro lugar, a linha celular T AG+ tumoral utilizada no protocolo aqui descrito, ou seja, células fibrosarcoma C57SV, e aquelas utilizadas em nossas investigações prévias16, 17,18,19 ,25,26, são transformados com fragmentos de SV40 subgenômica25. Conseqüentemente, são incapazes de montar e liberar os virions SV40 que poderiam potencialmente infectar APCs do anfitrião. Além disso, as células C57SV são desprovidas de moléculas coestimulatórias clássicas como CD80 (B7-1), CD86 (B7-2) e CD137 ligantes (4-1BBL)16. Os atributos acima tornam estas linhas ideais para o exame de in vivo TCD8 ativação via Cross-priming. O priming cruzado é um caminho importante na indução de respostas TCD8 , especialmente aquelas lançadas contra células tumorais de origem não hematopoiética que falham diretamente em Prime as células t ingênuas25.
As frequências e/ou funções antitumorais TCD8 podem ser monitoradas pela coloração de tetrâmero de MHC I, coloração intracelular para citocinas efetoras (por exemplo, interferão [IFN]-γ) ou moléculas líticas (por exemplo, perforina), ensaios imunoenzimáticos (ELISPOT) e ex ensaios de citotoxicidade vivo. Desde a sua criação nos anos 199027,28, carboxyfluoresceína éster succinimidil (CFSE)-com base em ensaios de matança in vivo permitiram a avaliação de respostas citotóxicas mediadas por CTLs antiviral29,30 , 31, CTLs antitumoral16,32, pilhas naturais do assassino (NK)33, pilhas naturais invariantes de glycolipid-reactivas do assassino T (iNKT)34, e preexistente e de novo doador-específico dos aloanticorpos26. Conseqüentemente, suas aplicações podem ser do interesse a um Readership largo, incluindo mas não limitado aos investigadores que trabalham nas áreas da imunologia do tumor e da imunoterapia, da imunidade do antipatógeno, e do projeto preventivo e terapêutico da vacina.
Para avaliar a citotoxicidade mediada por células em cenários típicos, duas populações de esplenócitos ingênuos que exibem um AG irrelevante ou um cognato AG (s) são rotulados com duas doses diferentes de CFSE, misturadas em números iguais e injetadas em ingênuo (controle) ou assassino ratos abrigando células. A presença/ausência de cada população-alvo é então examinada por citometria de fluxo.
Temos otimizado e empregado in vivo ensaios de matança em nossos estudos sobre imunodominância em ambas as respostas antiviral e antitumoral TCD8 12,16,17. Aqui, nós fornecemos um protocolo detalhado para a avaliação simultânea de respostas do ID e do SD TCD8 aos Epitopes de t AG, que podem prontamente ser adotados para investigações similares em outros sistemas experimentais. Nós igualmente fornecemos os resultados representativos que demonstram que o esgotamento da pilha de nTreg e o bloqueio PD-1 podem seletivamente realçar a citotoxicidadeCD8-induzida da identificação tCD8-e do SD t, respectivamente. No final, discutiremos várias vantagens de ensaios de matança in vivo, bem como algumas de suas limitações inerentes.
Protocolo
Os experimentos aqui descritos seguem protocolos de uso animal aprovados por entidades institucionais e aderentes às diretrizes nacionais estabelecidas.
1. inoculação de C57BL/6 camundongos com T AG-expressando células tumorais
- Cresça a linha celular SV40 do fibrosarcoma C57SV (ou uma linha celular similar de T AG+ aderente) no meio modificado da águia de Dulbecco (DMEM) com 4,5 g/l D-glucose e l-Glutamine (1x) e suplementado com 1 milímetro piruvato de sódio e 10% calor-inactivated soro bovino fetal (FBS) em frascos tratados com cultura tecidual a 37 ° c em atmosfera umidificada contendo 10% de CO2.
- Uma vez que as pilhas se tornam inteiramente confluentes ou ligeiramente overconfluent, remova delicadamente e rejeite o meio e enxague o monocamada com o soro fisiológico fosfato-tamponado pré-aquecido (PBS).
Nota: a expressão máxima de T AG é alcançada quando as células T AG+ atingem 100% de confluência. - Dentro de um armário biológico da segurança, adicione o Trypsin-EDTA pre-aquecido (0,25%) para cobrir a monocamada à temperatura ambiente até que as células sejam desalojadas em manchas. Toque os lados do balão (s) de cultura várias vezes para liberar as células aderentes restantes.
Nota: se necessário e para agilizar o processo de tripsinização, transfira o (s) balão (es) para uma incubadora de 37 ° c. As células desalojadas adoptarão rapidamente uma forma arredondada um microscópio de luz. Esta etapa deve durar aproximadamente 5 min. - Adicionar 5 mL de meio DMEM e dissociar os aglomerados para preparar uma suspensão de célula única, introduzindo a pipetagem do conteúdo de cada balão para cima e para baixo.
- Transfira a suspensão celular através de um filtro de células com poros de 70 μm em um tubo.
- Girar para baixo o tubo em 400 x g por 5 min a 4 ° c.
- Descarte o sobrenadante. Resuspend pilhas peletizadas em 10 mL de PBS frio estéril.
- Repita as etapas 1,6 e 1,7 duas vezes.
- Contagem de células usando um Hemocytometer. Prepare uma suspensão uniforme contendo 4 x 107 células/ml de PBS estéril.
- Injetar 500 μL da suspensão acima intraperitonealmente (i.p.) em cada adulto (6-12-semana-velho) do sexo masculino ou feminino C57BL/6 mouse.
2. regimes de tratamento
-
Regime de tratamento para examinar a contribuição das células nTreg para a imunodominância TCD8
- Quatro dias antes do condicionamento in vivo de C57BL/6 camundongos com células C57SV (passo 1,10), injetar cada animal uma vez i.p. com 0,5 mg de um anticorpo monoclonal de baixa endotoxina, azida-livre CD25 (mAb) (clone PC-61.5.3), que esgota as células nTreg, ou com um isotipo IgG1 de rato controle (por exemplo, clone KLH/G1-2-2, clone HRPN, ou clone TNP6A7).
-
Regime de tratamento para testar o significado in vivo de PD-1-PD-L1 (2) interações em moldar TCD8 immunodominance
Nota: o acoplamento de PD-1 por PD-L1 frequentemente, mas não sempre, Media a coinibição e/ou a exaustão de TCD8AG-específico. Portanto, o tratamento com anti-PD-1 pode ser realizado em paralelo com a administração de mAbs anti-PD-L1 e anti-PD-L2 para revelar a interação intercelular exata envolvida em um fenômeno biológico.
3. preparação de esplenócitos alvo
- Euthanize o sexo-combinou C57BL/6 ratos (6-12 semanas da idade) que servirão como doadores do splenocyte pela deslocação cervical.
- Posicione cada rato com o seu abdômen virado para cima dentro de um armário de segurança biológico. Pulverize a pele com 70% (v/v) EtOH. Usando fórceps e tesouras estéreis, levante a pele e faça uma pequena incisão na linha média ventral. Em seguida, corte a pele em uma forma de cruz-like para expor o peritônio.
- Usando fórceps, puxe o peritônio de uma forma tenda-like sem arrebatar qualquer um dos órgãos internos. Corte o peritônio aberto para expor a cavidade peritoneal e retire suavemente o baço.
- Coloque o baço (s) dentro de um moedor de tecido dounce de 15 mL contendo 5 mL de PBS estéril. Aplique a pressão manual usando o êmbolo de vidro do moedor até que o tecido esplênico se dissipa em uma suspensão de células homogênea vermelha.
Nota: dependendo do número de animais receptores por grupo experimental, vários baços de rato doadores podem ser necessários para a preparação da célula alvo. Até 3 baços podem ser homogeneizados juntos dentro de um moedor de 15 mL. - Transfira o homogeneado para um tubo de 15 mL. Girar para baixo o tubo em 400 x g por 5 min a 4 ° c.
- Descarte o sobrenadante. Ressuspender as células peletizadas em 4 mL de tampão de lisagem de cloreto de amônio-potássio (ACK) por 4 min para eliminar os eritrócitos.
Nota: esta é uma etapa sensível ao tempo. A superexposição de esplenócitos ao tampão de lisagem ACK aumentará sua fragilidade e as tornará suscetíveis à morte celular não específica. - Para cada tubo, adicionar 8 mL de RPMI 1640 médio contendo 10% FBS calor-inactivated, L-alanyl-L-glutamina, 0,1 mM mínimo Essential Media (MEM) aminoácidos não essenciais, 1 mM piruvato de sódio, 10 mM HEPES, e 1x penicilina/estreptomicina, que será doravante refere-se ao meio RPMI completo (tabela de materiais).
- Transfira o conteúdo através de 70 μm de poros de um filtro de células para um novo tubo de 15 mL.
- Girar para baixo o tubo em 400 x g por 5 min a 4 ° c.
- Descarte o sobrenadante. Resuspend pilhas peletizadas em 12 mL de RPMI completo.
- Divida a suspensão do splenocyte em 3 porções iguais (4 mL cada) em 3 tubos separados.
4. revestimento splenocytes alvo com irrelevantes e Cognate peptídeos
- Rotule os tubos de acordo com os peptídeos que serão usados para pulsar os esplenócitos alvo. Os esplenócitos do controle serão pulsados com um peptide irrelevante, e cada população de esplenócitos cientes do alvo será pulsada com um peptide sintético que corresponde ao epítopo mapeado immunodominante t AG-derivado (local IV) ou a um epítopo mapeado subdominante de t AG (local mim ou local II/III) (tabela 1).
Nota: a escolha de peptídeos irrelevantes depende da configuração experimental e da estirpe do rato utilizada em cada investigação. Os autores usam frequentemente GB498-505 (um epítopo mapeado immunodominante do peptide de h-2Kb-restrito do vírus de palavra simples de herpes [HSV]-1) e/ou GP33-41 (um epítopo immunodominante do peptide de h-2Db-restrito de Lymphocytic vírus coriomeningitis ([LCMV]) em camundongos C57BL/6 (tabela 1). Estes peptídeos são escolhas ideais porque: (i) eles são derivados de patógenos não encontrados anteriormente no modelo de mouse descrito aqui; (II) semelhantes aos peptídeos derivados de T AG, gB498-505 e GP33-41 são restritos e se ligam a moléculas H-2b . Em ensaios de matança "Three-Peak" in vivo, cada um dos dois picos que correspondem às células-alvo cognato pode representar os esplenócitos pulsados com um peptide immunodominante ou subdominante. A escolha de cada conjunto de peptídeos varia de acordo com os objetivos de cada experimento. Veja a Figura 1 e a Figura 2 como exemplos dessa variação. Para o restante deste protocolo, os sítios I e IV derivados de T AG representarão peptídeos subdominantes e imunodominantes, respectivamente. - Pulse o conteúdo de cada tubo rotulado com 1 μM do respectivo peptídeo durante 1 h a 37 ° c e 5% CO2.
- Use um filtro de célula separado (com poros de 70 μm) para cada tubo para remover aglomerantes e detritos, se necessário.
- Girar para baixo o tubo em 400 x g por 5 min a 4 ° c. Descarte o sobrenadante.
- Resuspend células peletizadas em 12 mL de PBS frio estéril e repita o passo 4,4 mais uma vez.
Nota: é importante remover o máximo de FBS possível porque FBS pode ligar CFSE na próxima etapa.
5. etiquetando os esplenócitos do alvo com CFSE
- Resuspend o esplenócitos peptídeo-pulsado em 4 ml do PBS estéril.
- Adicionar CFSE em 0, 25 μM, 0,25 μM, e 2 μM nos tubos contendo peptídeos irrelevantes-, local I-e local IV-esplenócitos pulsado, respectivamente.
Nota: para conseguir uma rotulagem CFSE uniforme, segure cada tubo em um ângulo de 45 ° antes de adicionar o CFSE ao lado ligeiramente acima da suspensão da célula seguida imediatamente por vortexing suave. Isso garantirá o aparecimento de histogramas suaves no final. As variações batch-to-batch e dependentes da idade nas intensidades do CFSE não são incomuns. Conseqüentemente, um pode precisar de experimentar com doses diferenciais de CFSE antes de decidir em concentrações óptimas a ser usadas.
PRECAUÇÃO: o CFSE é tóxico em concentrações superiores a 5 μM. - Coloque os tubos dentro de uma incubadora de 37 ° c por 15 min e inverta-os uma vez a cada 5 min.
- Adicione 3 mL de FBS calor-inactivated a cada tubo para parar a reação de CFSE. Cubra o conteúdo com PBS estéril.
- Girar para baixo o tubo em 400 x g por 5 min a 4 ° c. Descarte o sobrenadante.
- Resuspend células peletizadas em 12 mL de PBS estéril e repita o passo 5,5.
6. exame da rotulagem de CFSE adequada/igual de populações de Esplócito alvo
- Resuspend pilhas peletizadas em 3 mL de PBS.
- Vórtice os tubos suavemente. Transferir 10 μL, cada um, de CFSEbaixo, CFSEintermediário (int), e suspensõeselevadas da pilha de CFSE em um tubo da separação da pilha da fluorescência-Activated do poliestireno da redondo-parte inferior de 5 ml que contem 200 μL de PBS.
- Interrogue células usando um citometro de fluxo equipado com um laser de 488 nm. Desenhe uma porta de linfócitos com base nas propriedades de dispersão para a frente (FSC) e dispersão lateral (SSC) das células antes de adquirir 5000 eventos caindo dentro do portão de linfócitos no canal FL-1.
- Dentro da população ' Parent ' CFSE+ , desenhe portas adicionais do histograma para identificar subpopulações de CFSELow, CFSEinte CFSEHigh .
- Confirme números de eventos iguais ou quase iguais dentro dos três portões. Se necessário, ajuste os números das células nos tubos ' fonte ' (passo 6,1) antes de misturar e injetar esplenócitos alvo em camundongos ingênuos e aprontado na seção 7.
7. injeção de células-alvo com rótulo CFSE em recipientes ingênuos e T-AG-primed
- Agite suavemente os tubos de origem. Transfira as três suspensões de células marcadas com CFSE em proporções iguais em um novo tubo.
- Cubra o conteúdo com PBS estéril.
- Girar para baixo o tubo em 400 x g por 5 min a 4 ° c. Resuspend células peletizadas com PBS estéril.
- Contagem de células em Tripan azul por um hemocitômetro para garantir a viabilidade celular de pelo menos 95%.
- Ajuste o volume para injetar 1 x 107 células alvo misturadas/200 μl PBS intravenosamente (i.v.), através da veia da cauda, em cada rato C57Bl/6 receptor.
Nota: Guarde as células no gelo entre as injeções. Misture suavemente as células-alvo antes de cada injeção. Registre a hora exata da injeção para cada rato, que determinará quando o animal precisará de ser eutanasiado. É importante manter a duração da citotoxicidade in vivo consistente entre todos os animais no mesmo experimento.
8. aquisição de dados
- Duas ou quatro horas após a injeção de células alvo CFSE-rotuladas, eutanizar os camundongos receptores por luxação cervical.
Nota: a duração da citotoxicidade in vivo pode variar dependendo do sistema experimental empregado, a imunogenicidade do alvo AGS, a abundância antecipada de TCD8 antígeno-específico do peptídeo no baço, e a robustez de sua função lítica entre outros fatores. - Remova e processe cada baço separadamente como nos passos 3.2 − 3.9.
- Descartar o sobrenadante e suspender as células peletizadas em 3 mL de PBS.
Nota: Tome o cuidado extra para segurar o tecido splenic e as preparações da pilha em 4 ° c ou no gelo antes das análises se. Isto é para prevenir a continuação da citotoxicidade ex vivo. - Transfira aproximadamente 1 x 107 pilhas de cada Spleen processado em um tubo limpo de FACS.
- Interrogue as células imediatamente usando um citometro de fluxo equipado com um laser de 488 nm. Desenhe um portão de linfócitos com base nas propriedades do FSC e SSC das células.
- Identifique os esplenócitos do CFSE- receptor e o CFSE+ pilhas de alvo transferidas. Desenhe portões adicionais que acomodam distintas CFSEbaixo, CFSEint, e CFSEalta populações de células-alvo.
- Adquira um total de 2000 CFSE eventosbaixos no canal FL-1.
9. análise de dados
- Calcule a Lise específica de cada população de células alvo cognato usando a seguinte fórmula:
% Citotoxicidade específica =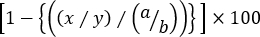
onde x = CFSEint/alto número de evento em t AG-primed mouse, y = CFSE número de eventobaixo em t AG-primed mouse, a = CFSEint/ número de evento alto em mouse ingênuo, e b = CFSEbaixo evento número no rato ingênuo.
Nota: em ensaios de citotoxicidade "Three-Peak" em que a Lise específica de mais de uma população-alvo cognato é avaliada, não é apropriado usar freqüências da pilha do alvo. Isso é simplesmente porque a frequência de uma população de células-alvo cognato é influenciada não só pela percentagem dos controles irrelevantes, mas também pelo dos outros splenocytes alvo cognato. Portanto, os números de evento dentro de cada portão devem ser usados na fórmula acima para calcular com precisão a lise de cada população de células-alvo cognato (ou CFSEint ou CFSE célulasaltas ) contra controles CFSEbaixa .
Resultados
O objetivo do experimento cujos resultados estão representados na Figura 1 foi determinar se a presença e as funções das células nTreg formam ou alteram a hierarquia de imunodominância de tCD8específico t AG. C57BL/6 camundongos foram injetados i.p. com PBS ou com 0,5 mgs de um CD25 mAb (clone PC-61.5.3 [PC61]) quatro dias antes de receberem 2 x 107 C57SV células tumorais i.p. Em experimentos separados, um controle de isotipo de rato IgG1 foi usado em vez de PBS...
Discussão
Os ensaios de citotoxicidade in vivo baseados em CFSE oferecem várias vantagens em relação aos ensaios de matança tradicionais, como o cromo radioativo (51CR) e os ensaios de liberação de lactato desidrogenase colorimétrica (LDH). Primeiramente, permitem a monitoração da função de CTL dentro de um órgão lymphoid secundário arquitetonicamente intacto.
Em segundo lugar, o assassinato específico de células-alvo em ensaios de citotoxicidade in vivo reflete o número abso...
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este trabalho foi apoiado pelo canadense institutos de pesquisa em saúde (CIHR) concede MOP-130465 e PJT-156295 para SMMH. JC é parcialmente apoiado por uma rainha Elizabeth II bolsa de pós-graduação em ciência e tecnologia do Ministério de formação, faculdades e universidades de Ontário. CEM foi um receptor de uma bolsa de pós-graduação Alexander Graham Bell Canada (doutorado) do Conselho de ciências naturais e engenharia de pesquisa do Canadá (NSERC).
Materiais
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA (1X) | Thermo Fisher Scientific | 25200-056 | |
| ACK Lysing Buffer | Thermo Fisher Scientific | A1049201 | |
| Anti-mouse CD25 (clone PC-61.5.3) | Bio X Cell | BE0012 | |
| Anti-mouse PD-1 (clone RMP1-14) | Bio X Cell | BE0146 | |
| CFSE | Thermo Fisher Scientific | C34554 | |
| DMEM (1X) | Thermo Fisher Scientific | 11965-092 | |
| Fetal bovine serum (FBS) | Wisent Bioproducts | 080-150 | Heat-inactivate prior to use |
| GlutaMAX (100X) | Thermo Fisher Scientific | 35050-061 | |
| HEPES (1M) | Thermo Fisher Scientific | 15630080 | 10 mM final concentration |
| MEM Non-Essential Amino Acids Solution (100X) | Thermo Fisher Scientific | 11140-050 | |
| Penicillin/Streptomycin | Sigma-Aldrich | P0781 | Stock is 100X |
| Rat IgG1 (clone KLH/G1-2-2) | SouthernBiotech | 0116-01 | Isotype control |
| Rat IgG1 (clone HRPN) | Bio X Cell | BE0088 | Isotype control |
| Rat IgG1 (clone TNP6A7) | Bio X Cell | BP0290 | Isotype control |
| Rat IgG2a (clone 2A3) | Bio X Cell | BP0089 | Isotype control |
| RPMI 1640 (1X) | Thermo Fisher Scientific | 11875-093 | |
| Sodium Pyruvate (100 mM) | Thermo Fisher Scientific | 11360-070 | 1 mM final concentration |
Referências
- Yewdell, J. W., Bennink, J. R. Immunodominance in major histocompatibility complex class I-restricted T lymphocyte responses. Annual Review of Immunology. 17, 51-88 (1999).
- Chen, W., et al. Reversal in the immunodominance hierarchy in secondary CD8+ T cell responses to influenza A virus: roles for cross-presentation and lysis-independent immunodomination. The Journal of Immunology. 173 (8), 5021-5027 (2004).
- Otahal, P., et al. Inefficient cross-presentation limits the CD8+ T cell response to a subdominant tumor antigen epitope. The Journal of Immunology. 175 (2), 700-712 (2005).
- Lauron, E. J., et al. Cross-priming induces immunodomination in the presence of viral MHC class I inhibition. PLoS Pathogens. 14 (2), e1006883 (2018).
- Crowe, S. R., et al. Differential antigen presentation regulates the changing patterns of CD8+ T cell immunodominance in primary and secondary influenza virus infections. The Journal of Experimental Medicine. 198 (3), 399-410 (2003).
- Probst, H. C., et al. Immunodominance of an antiviral cytotoxic T cell response is shaped by the kinetics of viral protein expression. The Journal of Immunology. 171 (10), 5415-5422 (2003).
- Gileadi, U., et al. Generation of an immunodominant CTL epitope is affected by proteasome subunit composition and stability of the antigenic protein. The Journal of Immunology. 163 (11), 6045-6052 (1999).
- Zanker, D., Waithman, J., Yewdell, J. W., Chen, W. Mixed proteasomes function to increase viral peptide diversity and broaden antiviral CD8+ T cell responses. The Journal of Immunology. 191 (1), 52-59 (2013).
- Deng, Y., Yewdell, J. W., Eisenlohr, L. C., Bennink, J. R. MHC affinity, peptide liberation, T cell repertoire, and immunodominance all contribute to the paucity of MHC class I-restricted peptides recognized by antiviral CTL. The Journal of Immunology. 158 (4), 1507-1515 (1997).
- Chen, W., Khilko, S., Fecondo, J., Margulies, D. H., McCluskey, J. Determinant selection of major histocompatibility complex class I-restricted antigenic peptides is explained by class I-peptide affinity and is strongly influenced by nondominant anchor residues. The Journal of Experimental Medicine. 180 (4), 1471-1483 (1994).
- Kotturi, M. F., et al. Naive precursor frequencies and MHC binding rather than the degree of epitope diversity shape CD8+ T cell immunodominance. The Journal of Immunology. 181 (3), 2124-2133 (2008).
- Haeryfar, S. M., et al. Terminal deoxynucleotidyl transferase establishes and broadens antiviral CD8+ T cell immunodominance hierarchies. The Journal of Immunology. 181 (1), 649-659 (2008).
- Leon-Ponte, M., Kasprzyski, T., Mannik, L. A., Haeryfar, S. M. Altered immunodominance hierarchies of influenza A virus-specific H-2(b)-restricted CD8+ T cells in the absence of terminal deoxynucleotidyl transferase. Immunological Investigations. 37 (7), 714-725 (2008).
- Kedl, R. M., et al. T cells compete for access to antigen-bearing antigen-presenting cells. The Journal of Experimental Medicine. 192 (8), 1105-1113 (2000).
- Kastenmuller, W., et al. Cross-competition of CD8+ T cells shapes the immunodominance hierarchy during boost vaccination. The Journal of Experimental Medicine. 204 (9), 2187-2198 (2007).
- Memarnejadian, A., et al. PD-1 Blockade Promotes Epitope Spreading in Anticancer CD8(+) T Cell Responses by Preventing Fratricidal Death of Subdominant Clones To Relieve Immunodomination. The Journal of Immunology. 199 (9), 3348-3359 (2017).
- Haeryfar, S. M., DiPaolo, R. J., Tscharke, D. C., Bennink, J. R., Yewdell, J. W. Regulatory T cells suppress CD8+ T cell responses induced by direct priming and cross-priming and moderate immunodominance disparities. The Journal of Immunology. 174 (6), 3344-3351 (2005).
- Rytelewski, M., et al. Suppression of immunodominant antitumor and antiviral CD8+ T cell responses by indoleamine 2,3-dioxygenase. PLoS One. 9 (2), e90439 (2014).
- Maleki Vareki, S., et al. Differential regulation of simultaneous antitumor and alloreactive CD8(+) T-cell responses in the same host by rapamycin. American Journal of Transplantation. 12 (1), 233-239 (2012).
- Irvine, K., Bennink, J. Factors influencing immunodominance hierarchies in TCD8+ -mediated antiviral responses. Expert Review of Clinical Immunology. 2 (1), 135-147 (2006).
- Grossmann, M. E., Davila, T., Celis, T. Avoiding tolerance against prostatic antigens with subdominant peptide epitopes. Journal of Immunotherapy. 24 (3), 237-241 (2001).
- Schreiber, H., Wu, T. H., Nachman, J., Kast, W. M. Immunodominance and tumor escape. Seminars in Cancer Biology. 12 (1), 25-31 (2002).
- Mylin, L. M., et al. Quantitation of CD8(+) T-lymphocyte responses to multiple epitopes from simian virus 40 (SV40) large T antigen in C57BL/6 mice immunized with SV40, SV40 T-antigen-transformed cells, or vaccinia virus recombinants expressing full-length T antigen or epitope minigenes. Journal of Virology. 74 (15), 6922-6934 (2000).
- Fu, T. M., et al. An endoplasmic reticulum-targeting signal sequence enhances the immunogenicity of an immunorecessive simian virus 40 large T antigen cytotoxic T-lymphocyte epitope. Journal of Virology. 72 (2), 1469-1481 (1998).
- Chen, W., et al. Cross-priming of CD8+ T cells by viral and tumor antigens is a robust phenomenon. European Journal of Immunology. 34 (1), 194-199 (2004).
- Memarnejadian, A., Meilleur, C. E., Mazzuca, D. M., Welch, I. D., Haeryfar, S. M. Quantification of Alloantibody-Mediated Cytotoxicity In Vivo. Transplantation. 100 (5), 1041-1051 (2016).
- Aichele, P., et al. Peptide antigen treatment of naive and virus-immune mice: antigen-specific tolerance versus immunopathology. Immunity. 6 (5), 519-529 (1997).
- Oehen, S., Brduscha-Riem, K. Differentiation of naive CTL to effector and memory CTL: correlation of effector function with phenotype and cell division. The Journal of Immunology. 161 (10), 5338-5346 (1998).
- Coles, R. M., Mueller, S. N., Heath, W. R., Carbone, F. R., Brooks, A. G. Progression of armed CTL from draining lymph node to spleen shortly after localized infection with herpes simplex virus 1. The Journal of Immunology. 168 (2), 834-838 (2002).
- Barber, D. L., Wherry, E. J., Ahmed, R. Cutting edge: rapid in vivo killing by memory CD8 T cells. The Journal of Immunology. 171 (1), 27-31 (2003).
- Meilleur, C. E., et al. Bacterial superantigens expand and activate, rather than delete or incapacitate, preexisting antigen-specific memory CD8+ T cells. The Journal of Infectious Diseases. , (2018).
- Goldszmid, R. S., et al. Dendritic cells charged with apoptotic tumor cells induce long-lived protective CD4+ and CD8+ T cell immunity against B16 melanoma. The Journal of Immunology. 171 (11), 5940-5947 (2003).
- Oberg, L., et al. Loss or mismatch of MHC class I is sufficient to trigger NK cell-mediated rejection of resting lymphocytes in vivo - role of KARAP/DAP12-dependent and -independent pathways. European Journal of Immunology. 34 (6), 1646-1653 (2004).
- Wingender, G., Krebs, P., Beutler, B., Kronenberg, M. Antigen-specific cytotoxicity by invariant NKT cells in vivo is CD95/CD178-dependent and is correlated with antigenic potency. The Journal of Immunology. 185 (5), 2721-2729 (2010).
- Brinster, R. L., et al. Transgenic mice harboring SV40 T-antigen genes develop characteristic brain tumors. Cell. 37 (2), 367-379 (1984).
- Tatum, A. M., et al. CD8+ T cells targeting a single immunodominant epitope are sufficient for elimination of established SV40 T antigen-induced brain tumors. The Journal of Immunology. 181 (6), 4406-4417 (2008).
- Schell, T. D., Tevethia, S. S. Control of advanced choroid plexus tumors in SV40 T antigen transgenic mice following priming of donor CD8(+) T lymphocytes by the endogenous tumor antigen. The Journal of Immunology. 167 (12), 6947-6956 (2001).
- Greenberg, N. M., et al. Prostate cancer in a transgenic mouse. Proceedings of the National Academy of Sciences of the United States of America. 92 (8), 3439-3443 (1995).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados