Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Tümör-spesifik CD8+ T hücre tepkiler Immunodominance çalışması Için In vivo sitotoksisite assays terzilik
Bu Makalede
Özet
Burada, sitotoksisik T lenfosit (CTL) yanıt olarak bir model tümör antijeni için immundominance muayene sağlayan bir akış sitometri tabanlı in vivo öldürme tahlil tarif. Biz bu zarif tahlil mekanik çalışmalar için ve ilaç etkinliği test için istihdam olabilir nasıl örnekler sunuyoruz.
Özet
Carboxyflorcein succinimidil Ester (cfse)-based In vivo sitotoksisite, tümör-ve patojen türevi peptidler karşı elde edilen CD8+ sitolitik T lenfosit (CTL) yanıtlarının hassas ve doğru kantitasyon sağlar. Onlar geleneksel öldürme assays üzerinde çeşitli avantajlar sunuyoruz. İlk olarak, genellikle dalak içinde, mimari olarak bozulmamış ikincil lenfoid organlar içinde CTL aracılı sitotoksisitenin izlenmesi için izin verir. İkinci olarak, CTL yanıtlarının priming, efektör ve Recall aşamalarında mekanik çalışmalar yapılmasına izin verir. Üçüncü olarak, onlar gerçekten in vivo ayarı aşı/ilaç etkinliği test için yararlı platformlar sağlar. Burada, bir model tümör antijen (AG), yani, Simian virüs 40 (bazılarında SV40) kodlanmış büyük t AG (t AG) birden fazla peptit epitopu karşı eşlik eden CTL yanıtlarını incelenmesi için optimize edilmiş bir protokol sağlar. Diğer çoğu klinik olarak ilgili tümör proteinleri gibi, T AG birçok potansiyel immünojenik peptidler barındırmaz. Ancak, sadece dört böyle peptitler C57BL/6 fareler algılanabilir CTL tepkiler neden. Bu tepkiler tutarlı bir hiyerarşik sırada kendi büyüklüğü dayalı olarak düzenlenmiş, bu güçlü sistemde TCD8 "immundominance" için temel oluşturur. Buna göre, t AG 'ye özgü tCD8 yanıt toplu tek bir immundominant epitopu karşı odaklanmıştır, diğer üç epitopları tanınır ve sadece zayıf yanıt. İmmundominance antitümör TCD8 yanıt genişliği ödün ve olduğu gibi, kansere karşı başarılı aşılama için bir engel olarak birçok tarafından kabul edilir. Bu nedenle, TCD8 immundominance dikte veya şekillendiren hücresel ve moleküler faktörler ve mekanizmalar anlamak önemlidir. Biz burada tarif protokol T AG immünizasyon modelinde bu fenomen soruşturma için uyarlanmış, ancak kolayca değiştirilebilir ve diğer tümör modellerinde benzer çalışmalara uzatılabilir. Deneysel immünoterapötik müdahalelerin, in vivo sitotoksisite ile ölçülmesi hakkında örnekler sunmaktayız.
Giriş
Konvansiyonel CD8+ t hücreler (tCD8) antikanser bağışıklık gözetim önemli parçaları oynayın. Onlar öncelikle sitolitik T lenfosit kapasitesinde işlev (CTL) Bu tümör özgü veya ilişkili peptit antijenleri tanımak (AGS) büyük histokompatibilite kompleksi kapalı yarık içinde görüntülenen (MHC) sınıf ı molekülleri. Tam silahlı CTL 'Ler malign hücreleri yok etmek için sitotoksisik cephaneliği kullanır. Anticancer TCD8 dolaşımda veya birçok kanser hastalarının ve tümör taşıyan hayvanların primer ve metastatik kitlelerinde bile tespit edilebilir. Ancak, genellikle Anerjik veya yorgun ve kanser ortadan kaldırmak için başarısız. Bu nedenle, birçok immünoterapötik modaliteler antikanser TCD8 frekansları artırmak ve geri yüklemek ve işlevlerini artırmak için tasarlanmıştır.
Tümör proteinlerini birçok peptit liman, bazıları immünojenik ve potansiyel immünokoruyucu olabilir. Ancak, ölçülebilir TCD8 tepkiler sadece birkaç peptidler karşı değişen büyüklükleri ile elicited edilir. Bu TCD8 klonlar1arasında bir "immundominance hiyerarşi" oluşturur. Buna göre, immundominant (ID) TCD8 yaygın onların bolluk tarafından değerlendirilir belirgin hiyerarşik rütbe, işgal. Buna karşılık, tCD8 Cells olan t hücre reseptörü (TCR) baskın (SD) epitopları için özeldir alt frekanslarda oluşur. Biz ve diğerleri TCD8 yanıtlarında immundominance dikte veya şekil faktörleri bazı tespit ettik. Bunlar arasında, diğerleri arasında, naif TCD8 için AG sunum modu (yani, doğrudan sunum, çapraz sunum, Cross-pansuman)2,3,4, AG türü-hücre sunma (APCs) TCD8 aktivasyon5, bolluk ve protein AGS,6,7 ve verimliliği ve proteinazon7,8tarafından onların bozulması kinetiği istikrar katılan , peptitler için AG işleme (TAP) ile ilişkili ışınlayıcı göreli seçiciliği9, MHC ı molekülleri için özgürlü peptidler yakınlık9,10, varlığı, habercisi frekanslar ve TCR çeşitliliği bilat tCD8 t hücre havuzları11,12,13, APCs erişim için t hücreleri arasında çapraz rekabet14,15, ve tCD8 kardeşine karşı kapasitesi klonlar16. Buna ek olarak, TCD8 immunodominance doğal düzenleyici T (nTreg) hücreleri17, hücre yüzeyi Co-inhibitör molekül programlanmış gibi çeşitli bastırıcı hücre türleri tarafından aracılık immünoregulatory mekanizmalar tabi tutulur ölüm-1 (PD-1)16ve indoleamin 2, 3-dioxygenase (IDO)18 ve rapamyisin memeliler hedefi (mTOR)19gibi bazı hücre içi enzimler. Ancak, yukarıdaki faktörlerin her zaman tamamen immundominance için hesap olmadığını unutmayın önemlidir.
TCD8 'in temel biyolojisinin dışında, bu ilginç fenomen muayenesi kanser immünolojisinde ve immünoterapi açısından önemli etkileri vardır. İlk olarak, bir kimlik durumu mutlaka belirli bir TCD8 Clone tümör başlatma veya ilerleme20önlemek için yeteneği üzerinde görüşmek değildir. Olup olmadığını ve nasıl kimlik ve SD TCD8 antitümör bağışıklık için katkı türü ve malignite ve deneysel sistemin ölçüde bağlı olabilir. İkincisi, bu kimlik TCD8 klonlar ' çok bağışıklık sistemi ve sonuç olarak daha eğilimli merkezi ve/veya periferik tolerans mekanizmaları16,21için görünür olabilir düşünülmektedir. Üçüncü olarak, heterojenik tümörlerin çoğu değil, çoğu tarafından algılama önlemek Neoplastik hücreler içerebilir, peptid sadece dar bir spektrum görüntüleyerek CTL 'Ler: MHC kompleksleri. Bu şartlar altında, yetersiz genişlikte TCD8 tepkiler bu tür tümör hücreleri bir hayatta kalma avantajı göze muhtemeldir, böylece onların büyüme potansiyelini22. Bu yukarıdaki nedenlerden dolayı başarılı TCD8-bazlı aşılama ve kansere karşı tedaviler için bir engel olarak birçok görünüm immundominance.
Simian virüsü 40 ile C57BL/6 fareler inoculation (BAZıLARıNDA SV40)-büyük tümör AG (T AG) ifade dönüştürülmüş hücreler TCD8 immünhakimiyet çalışması için güçlü bir preklinik sistem sağlar. Bu model çeşitli avantajlar sunar. İlk olarak, bu klinik olarak alakalı ondeproteinin peptid epitopları bu fare gerinim23 ' te (Tablo 1) iyi karakterize edilir. Ikinci, T AG epitopes, hangi siteler ı, II/III, IV, ve V denir, sürekli olarak aşağıdaki hiyerarşik sırada düzenlenmiş olan TCD8 tepkiler tetik: site ıv > > site ı ≥ site II/ııı > ≫ site V. buna göre, site IV özgü TCD8 T AG 'ye en sağlam yanıtı bağlayın. Buna karşılık, siteler ı ve II/III baskın ve site V-özgül TCD8 en az bol ve genellikle sadece diğer epitopları için yanıt yokluğunda algılanabilir23,24. Üçüncü olarak, burada açıklanan protokolde kullanılan T AG+ tümör hücresi hattı, yani C57SV Fibrosarkom hücreleri, ve önceki soruşturmalarımızda kullanılan16,17,18,19 ,25,26, subgenomic bazılarında SV40 parçaları25ile dönüştürülür. Bu nedenle, onlar montaj ve potansiyel olarak ana APU 'lar enfekte BAZıLARıNDA SV40 virions serbest edemiyor. Buna ek olarak, C57SV hücreler, CD80 (B7-1), CD86 (B7-2) ve CD137 ligand (4-1BBL)16gibi klasik costimulatory moleküllerden yoksun. Yukarıdaki nitelikler, çapraz astar yoluyla in vivo TCD8 aktivasyonunun incelenmesi için bu satırları ideal hale getirmek. Cross-astar TCD8 tepkiler inducing önemli bir yoldur, doğrudan Prime naif T hücreleri başarısız olmayan hematopoetik Orijin tümör hücrelere karşı başlatılan özellikle25.
Antitumor TCD8 frekanslar ve/veya fonksiyonlar MHC I tetramer boyama tarafından izlenebilir, efektör sitokinler için hücre içi boyama (örn., interferon [IFN]-γ) veya litik molekülleri (örneğin, perforin), enzim bağlantılı immunospot (elispot) asder ve eski Vivo sitotoksisite gösteriyor. 1990 ' larda kuruluşundan bu yana27,28, karboksflorcein succinimidyl Ester (cfse)-tabanlı in vivo öldürme deneyleri sitotoksisik yanıt değerlendirilmesi sağladı antiviral CTLS tarafından aracılı29,30 , 31, antitümör CTLS16,32, doğal katil (NK) hücreleri33, glycolipid-reaktif sabit doğal katil T (iNKT) hücreleri34, ve önceden varolan ve de Novo donör özgü alloantikorlar26. Bu nedenle, onların uygulamaları da dahil olmak üzere geniş bir okuyucuların ilgi olabilir, ancak tümör İmmunoloji ve immünoterapi, Anti-patojen bağışıklık ve önleyici ve terapötik aşı tasarımı alanlarında çalışan müfettişlere sınırlı değildir.
Tipik senaryolarda hücre aracılı sitotoksisite değerlendirmek için, ya ilgisiz bir AG veya bir bilat AG (s) görüntülemek naif splenanosit iki nüfus CFSE iki farklı doz ile etiketlenmiş, eşit sayıda karışık ve saf içine enjekte (kontrol) veya katil hücre-harsıkıcı fareler. Her hedef nüfusun varlığı/yokluğunda akış sitometri tarafından incelenir.
Hem antiviral hem de antitümör TCD8 yanıtlarında immundominance üzerinde çalışmalarımız içinde vivo öldürme testlerinde optimize edilmiş ve istihdam ettik12,16,17. Burada, diğer deneysel sistemlerde benzer araştırmalar için kolayca kabul edilebilir T AG epitopes, ID ve SD TCD8 yanıt eşzamanlı değerlendirme için ayrıntılı bir protokol sunuyoruz. Ayrıca, nTreg hücre tükenmesi ve PD-1 blokajı seçici KIMLIK TCD8-ve SD tCD8-indüklenen sitotoksisite, sırasıyla artırabilir gösteren temsili sonuçlar sağlar. Sonunda, in vivo öldürme deneyleri yanı sıra bazı içsel sınırlamaları birden fazla avantajı tartışacağız.
Protokol
Burada açıklanan deneyler, kurumsal varlıklar tarafından onaylanan hayvan kullanım protokollerini takip eder ve kurulan Ulusal yönergelere uyulmalıdır.
1. C57BL/6 fareler T AG-ifade tümör hücreleri ile inoculation
- 4,5 g/l D-glikoz ve L-glutamin (1x) ile Dulbecco 'nun modifiye kartal Orta (dmem) ve 1 mm sodyum piruvat ve% 10 ısı-inaktive ile tamamlayıcı bazılarında SV40-dönüştürülmüş Fibrosarkom hücre hattı C57SV (veya benzer bir T AG+ yapışkan hücre hattı) büyümek % 10 CO2içeren nemlendirilmiş atmosferde 37 °c ' de doku kültüründe tedavi edilen flsorlarda fetal sığır serumu (FBS).
- Hücreler tamamen confluent veya biraz overconfluent hale sonra, yavaşça kaldırın ve orta atın ve ön ısıtılmış steril fosfat-tamponlu tuz (PBS) ile Tek tabakalı durulayın.
Not: maksimum T AG ifadesi, T AG+ hücrelerinin% 100 konflukans ulaşırken elde edilir. - Biyolojik Güvenlik kabininin içinde, önceden ısıtılmış tripsin-EDTA (% 0,25) ekleyin hücreler yamalar dışına kadar oda sıcaklığında Tek tabakalı kapsayacak şekilde. Kalan yapışma hücrelerini serbest bırakmak için birkaç kez kültür Flask (ler) tarafına dokunun.
Not: gerektiğinde ve tripsinizasyon sürecini hızlandırmak için, Flask (lar) ı 37 °C ' lik bir kuluçta aktarın. Dislodged hücreler hızlı bir şekilde hafif mikroskop altında yuvarlak bir şekil benimseyecek. Bu adım yaklaşık 5 dakika sürecek. - 5 ml dmem orta ekleyin ve her bir Flask içeriği pipetleme tarafından tek hücreli bir süspansiyon hazırlamak için kümeleri ayırmak yukarı ve aşağı.
- 70-μm gözenekleri olan bir hücre süzgeci ile hücre süspansiyonunu bir tüpün içine aktarın.
- 4 °C ' de 5 dakika için 400 x g 'de tüpü aşağı döndürün.
- Süpernatant atın. 10 mL steril soğuk PBS içinde resuspend pelleted hücreler.
- 1,6 ve 1,7 iki kez adımları yineleyin.
- Bir hemokytometer kullanarak hücreleri saymak. 4 x 107 hücre/ml steril PBS içeren tek kullanımlık bir süspansiyon hazırlayın.
- Yukarıdaki süspansiyon 500 μL intraperitoneal (IP) her yetişkin içine enjekte (6-12-hafta-eski) erkek veya kadın C57BL/6 fare.
2. tedavi rejimleri
-
Tedavi rejimi TCD8 immunodominance nTreg hücrelerinin katkısı incelemek için
- C57SV hücreler (adım 1,10) ile C57BL/6 fareler, 4 gün önce her hayvan enjekte bir kez IP 0,5 düşük endotoksin mg, Azide-ücretsiz anti-CD25 monoklonal antikor (MAB) (klon PC-61.5.3), hangi ntreg hücreleri tüketir, ya da bir sıçan IgG1 izotip ile kontrol (örneğin, klon KLH/G1-2-2, klon HRPN, veya klon TNP6A7).
-
PH-1-PD-L1 (2) In vivo önemini test etmek için tedavi rejimi TCD8 immunodominance şekillendirme etkileşimleri
Not: PD-1 ile PD-L1 çoğu zaman, ancak her zaman değil, Co-inhibisyonu ve/veya AG özgü TCD8yorgunluktan arabulucuları. Bu nedenle, Anti-PD-1 ile tedavi, Anti-PD-L1 ve anti-PD-L2 mAbs yönetimi ile paralel olarak, biyolojik bir fenomen içinde bulunan tam hücresel etkileşimi ortaya çıkarmak için gerçekleştirilebilir.
3. hedef Splenanositlerin hazırlanması
- Ötenize seks eşleşen naif C57BL/6 fareler (6-12 yaş) bu servikal dislocation tarafından splenocyte bağış olarak hizmet verecektir.
- Her fareyi karın ile bir biyolojik güvenlik kabininin içine bakacak şekilde konumlandırın. % 70 (v/v) EtOH ile cildi sprey. Steril forseps ve makas kullanarak, cildi kaldırın ve küçük bir ventral orta çizgi kesi yapmak. Sonra, periton açığa çıkarmak için çapraz benzeri bir moda cilt kesti.
- Forseps kullanarak, iç organlardan herhangi birini kaçırmadan peroneumu çadır benzeri bir moda çekin. Periton boşluğu açığa çıkarmak ve dalağı nazikçe çıkarmak için peritonumu açın.
- Dalağı (ler), 5 mL steril PBS içeren 15 mL 'Lik Dons doku değirmeni içine yerleştirin. Splenik doku kırmızı homojen hücre süspansiyon içine dağılıncaya kadar değirmeni cam pistonlu kullanarak manuel basınç uygulayın.
Not: deneysel grup başına alıcı hayvanların sayısına bağlı olarak, hedef hücre hazırlama için birkaç donör fare dalağı gerekebilir. En fazla 3 dalağı, 15 ml değirmeni içinde birlikte homojenize edilebilir. - Homojenini 15 mL 'Lik bir tüpün içine aktarın. 4 °C ' de 5 dakika için 400 x g 'de tüpü aşağı döndürün.
- Süpernatant atın. Eritrositleri ortadan kaldırmak için 4 dk amonyum klorür-potasyum (ACK) parçalanması tampon 4 ml resuspend pelleted hücreler.
Not: Bu zaman duyarlı bir adımdır. ACK parçalanması arabelleğine splenanosit aşırı açığa onların kırılganlık artacak ve non-spesifik hücre ölümü için duyarlı hale. - Her tüp için, 8 mL RPMI 1640 orta içeren 10% ısı-inaktive FBS, L-alanil-L-glutamin, 0,1 mM asgari temel medya (MEM) esansiyel olmayan amino asitler, 1 mM sodyum pyruvate, 10 mM HEPLERI, ve 1x penisilin/streptomicin, hangi olacak bundan sonra tam RPMı Orta (malzeme tablosu) olarak adlandırılır.
- 70 μm gözenekli bir hücre süzgeci ile içeriği yeni 15 mL tüpüne aktarın.
- 4 °C ' de 5 dakika için 400 x g 'de tüpü aşağı döndürün.
- Süpernatant atın. Tam RPMı 12 mL resuspend pelleted hücreler.
- Splenocayt süspansiyonunu 3 ayrı tüpte 3 eşit kısım (4 mL) içine bölün.
4. Ilgisiz ve bilat peptitler ile kaplama hedef Splenanosit
- Pullu hedef splenanositler için kullanılacak peptidler göre tüpler etiket. Kontrol splenocytes ilgisiz bir peptid ile darbeli olacak, ve bilat hedef splenanositlerin her nüfusu t AG-türevi immundominant epitopu (site IV) veya bir baskın t AG epitopu (site ı veya site karşılık gelen sentetik peptit ile darbeli olacak II/III) (Tablo 1).
Not: ilgisiz peptidler seçimi deneysel ayarlama ve her soruşturmada kullanılan fare gerinim bağlıdır. Yazarlar sıklıkla gB498-505 (herpes simpleks virüsü [HSV]-1) ve/veya GP33-41 (bir h-2kb-kısıtlanmış immundominant peptid epitopu) kullanın (bir h-2Db-kısıtlanmış immundominant peptid epitopu lenfositik choriomenenjit virüsü ([LCMV]) C57BL/6 fareler (Tablo 1). Bu peptitler en uygun seçeneklerdir, çünkü: (i) daha önce burada açıklanan fare modelinde karşılaşılan patojenlerden türetilir; (ii) T AG türevi peptidler benzer, gB498-505 ve GP33-41 ile sınırlıdır ve H-2b molekülleri bağlar. ' Üç-Peak ' in vivo öldürme assays, her iki zirvede bilek hedef hücrelere karşılık gelen splenocytes bir bağışıklık baskın veya baskın peptit ile darbeli temsil edebilir. Her peptit kümesinin seçimi her denemenin hedeflerine göre değişir. Bkz. Şekil 1 ve Şekil 2 gibi varyasyon örnekleri. Bu protokol geri kalanı için, T AG-türetilmiş siteler ı ve IV sırasıyla baskın ve immünozit peptidler temsil edecektir. - 37 °C ve% 5 CO2' de 1 h için ilgili peptid 1 μM ile etiketlenmiş her tüpün içeriğini Pulse.
- Gerekirse kümeleri ve enkaz kaldırmak için her tüp için ayrı bir hücre süzgeci (70-μm gözenekleri ile) kullanın.
- 4 °C ' de 5 dakika için 400 x g 'de tüpü aşağı döndürün. Süpernatant atın.
- 12 mL steril soğuk PBS ve tekrar adım 4,4 bir kez daha resuspend pelleted hücreler.
Not: FBS sonraki adımda CFSE bağlayabilirsiniz çünkü mümkün olduğunca çok FBS kaldırmak önemlidir.
5. CFSE ile hedef splenanosit etiketleme
- 4 mL steril PBS olarak resuspend peptid-pulsed splenanosit.
- 0,025 μM, 0,25 μM ve 2 μM ' de CFSE ekleyin, sırasıyla ilgisiz peptid, site ı ve site IV-pulsed splenanosit içeren tüplere yerleştirin.
Not: uniform CFSE etiketleme elde etmek Için, her tüp bir 45 ° açı üzerinde biraz hücre süspansiyonu hemen ardından yumuşak vormentleme tarafından takip yan CFSE eklemeden önce tutun. Bu, sonunda pürüzsüz histogramlar görünümünü sağlayacaktır. Toplu iş ve CFSE yoğunlukları yaş bağımlı varyasyonları nadir değildir. Bu nedenle, kullanılacak optimum konsantrasyonlara karar vermeden önce Diferansiyel CFSE dozları ile deney yapmanız gerekebilir.
DIKKAT: CFSE 5 μM ' den yüksek konsantrasyonlarda zehirlidir. - Tüpleri 37 °C ' lik bir kuluçside 15 dakika içinde yerleştirin ve her 5 dakikada bir ters çevirin.
- CFSE reaksiyonu durdurmak için her tüp için ısı-inaktive FBS 3 mL ekleyin. Steril PBS ile içeriği üst yukarı.
- 4 °C ' de 5 dakika için 400 x g 'de tüpü aşağı döndürün. Süpernatant atın.
- 12 mL steril PBS içinde resuspend pelleted hücreler ve tekrar adım 5,5.
6. hedef Splenocayt nüfusunun yeterli/eşit CFSE etiketinin incelenmesi
- 3 mL PBS içinde resuspend pelleted hücreler.
- Tüpler yavaşça Vortex. 10 μL, her, CFSEdüşük, cfseAra (INT)ve cfseyüksek hücre süspansiyonları 5 ml Yuvarlak alt polistiren floresans-aktive hücre sıralama (FACS) 200 μL PBS içeren tüp içine aktarın.
- 488 nm lazer ile donatılmış bir akış sitometresi kullanarak hücreleri sorgulayın. FL-1 kanalındaki lenfosit kapısı içinde düşen 5000 olayları almadan önce, hücrelerin ileri dağılım (FSC) ve yan dağılım (SSC) özelliklerine dayalı bir lenfosit kapısı çizin.
- ' Parent ' CFSE+ nüfus içinde cfsedüşük, CFSEintve cfseyüksek alt tanımlamak için ek histogram kapıları çizin.
- Üç kapı içinde eşit veya yakın eşit olay numaralarını onaylayın. Gerekirse, ' kaynak ' tüpler (adım 6,1) hücre numaralarını karıştırma ve Bölüm 7 ' de saf ve astar fareler içine hedef splenanosit enjekte etmeden önce ayarlayın.
7. CFSE etiketli hedef hücrelerin naif ve T-AG-astar alıcılarına enjekte edilmesi
- Hafifçe kaynak tüpleri girdap. Üç CFSE etiketli hücre süspansiyonları yeni bir tüpün içine eşit oranlarda aktarın.
- Steril PBS ile içeriği üst yukarı.
- 4 °C ' de 5 dakika için 400 x g 'de tüpü aşağı döndürün. Steril PBS ile pelleted hücreler resuspend.
- En az% 95 hücresel canlılığı sağlamak için bir hemasitometre tarafından tripan mavi hücreler saymak.
- 1 x 107 karışık hedef hücre/200 ΜL PBS (serum), kuyruk ven yoluyla, her alıcı C57BL/6 fareye enjekte etmek için ses seviyesini ayarlayın.
Not: enjeksiyon arasında buz üzerinde hücreleri saklayın. Her enjeksiyondan önce hedef hücreleri nazikçe karıştırın. Her fare için enjeksiyon tam süresini kaydedin, hangi hayvan ötenize gerekir ne zaman belirleyecektir. Aynı denemede tüm hayvanlar arasında tutarlı in vivo sitotoksisite süresini tutmak önemlidir.
8. veri edinme
- CFSE etiketli hedef hücrelerin enjekte edildikten iki veya dört saat sonra, alıcı fareler servikal dislocation tarafından ötenize.
Not: in vivo sitotoksisite süresi, istihdam deneysel sisteme bağlı olarak değişebilir, hedef AGS immünojenisite, dalak peptit antijeni özgü TCD8 beklenen bolluk, ve onların litik fonksiyonunun sağlamlık diğer faktörler arasında. - Her dalağı 3.2 − 3.9 adımlarında olduğu gibi ayrı olarak çıkarın ve işle.
- Süpernatant atın ve PBS 3 ml pelleted hücreleri pelletini.
Not: 4 °C ' de veya sitofluorimetrik analizden önce buz üzerinde splenik doku ve hücre preparatlarının üstesinden gitmek için ekstra özen yapın. Bu sürekli sitotoksisite ex vivo önlemek için. - Her işlenmiş daldan yaklaşık 1 x 107 hücreyi temız bır FACS tüpüne aktarın.
- Bir 488-nm lazer ile donatılmış bir akış sitometresi kullanarak hemen hücreleri sorgulama. Hücrelerin FSC ve SSC özelliklerine dayalı bir lenfosit kapısı çizin.
- CFSE- alıcının splenocytes ve cfse+ aktarılan hedef hücreleri belirleyin. Farklı CFSEdüşük, cfseIntve cfseyüksek hedef hücre nüfus accomodating ek kapılar çizin.
- FL-1 kanalında toplam 2000 CFSEdüşük etkinlik kazanın.
9. veri analizi
- Aşağıdaki formülü kullanarak her bilat hedef hücre popülasyonunun belirli Liz hesaplamak:
% Spesifik sitotoksisite =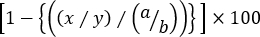
Burada x = cfseint/High olay numarası t AG-astar fare, y = cfsedüşük olay numarası t AG-astar fare, a = cfseInt/yüksek olay numarası naif fare ve b = cfseLow olay saf fare numarası.
Not: ' üç-Peak ' sitotoksisite içinde birden fazla bilat hedef nüfus belirli lizis değerlendirilir, hedef hücre frekansları kullanmak uygun değildir. Bu basitçe çünkü bir bilat hedef hücre nüfus sıklığı ilgisiz kontrolleri yüzdesi değil, aynı zamanda diğer bilat hedef splenocytes tarafından etkilenir. Bu nedenle, her kapı içinde olay numaraları doğru CFSEdüşük denetimlere karşı her bilat hedef hücre popülasyonunun (cfseInt veya cfseyüksek hücreler) liziz hesaplamak için yukarıdaki formülde kullanılmalıdır.
Sonuçlar
Sonuçları Şekil 1 ' de tasvir edilen denemenin amacı, nTreg hücrelerinin varlığı ve fonksiyonları, t AG 'ye özgü tCD8'nin immundominance hiyerarşisini şekillendirip değiştirmeyeceğini belirlemektir. C57BL/6 fareler PBS ile ya da 0,5 mg bir anti-CD25 MAB (klon PC-61.5.3 [PC61]) dört gün önce 2 x 107 C57SV tümör hücreleri ı.x Ayrı deneylerde PBS yerine bir sıçan IgG1 izotype kontrolü kullanılmıştır. PC61 tarafından başarılı nTreg hücre ...
Tartışmalar
CFSE tabanlı in vivo sitotoksisite, radyoaktif krom (51CR) serbest bırakma ve kolorimetrik lakdamak dehidrojenaz (LDH) serbest bırakma gibi geleneksel öldürme konusunda çeşitli avantajlar sunar. İlk olarak, bir mimari olarak bozulmamış ikincil lenfoid organ içinde CTL işlevinin izlenmesi izin verir.
İkinci olarak, In vivo sitotoksisite alanında hedef hücrelerin spesifik öldürme, genellikle, ama her zaman değil, TCD8 Frekanslar dalak mevcut bir fonksiyon ...
Açıklamalar
Yazarların ifşa etmesi gereken hiçbir şey yok.
Teşekkürler
Bu çalışma Kanada Sağlık Araştırmaları Enstitüleri (CIR) tarafından desteklenmektedir MOP-130465 ve PJT-156295 SMMH için verir. JC kısmen Ontario eğitim, kolejler ve üniversiteler Bakanlığı Bilim ve teknoloji bir Queen Elizabeth II lisansüstü bursu tarafından desteklenmektedir. CEM bir Alexander Graham Bell Kanada Yüksek Lisans Bursu (Doktora) Doğal Bilimler ve Kanada Mühendislik Araştırma Konseyi (NSERC) bir alıcı oldu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA (1X) | Thermo Fisher Scientific | 25200-056 | |
| ACK Lysing Buffer | Thermo Fisher Scientific | A1049201 | |
| Anti-mouse CD25 (clone PC-61.5.3) | Bio X Cell | BE0012 | |
| Anti-mouse PD-1 (clone RMP1-14) | Bio X Cell | BE0146 | |
| CFSE | Thermo Fisher Scientific | C34554 | |
| DMEM (1X) | Thermo Fisher Scientific | 11965-092 | |
| Fetal bovine serum (FBS) | Wisent Bioproducts | 080-150 | Heat-inactivate prior to use |
| GlutaMAX (100X) | Thermo Fisher Scientific | 35050-061 | |
| HEPES (1M) | Thermo Fisher Scientific | 15630080 | 10 mM final concentration |
| MEM Non-Essential Amino Acids Solution (100X) | Thermo Fisher Scientific | 11140-050 | |
| Penicillin/Streptomycin | Sigma-Aldrich | P0781 | Stock is 100X |
| Rat IgG1 (clone KLH/G1-2-2) | SouthernBiotech | 0116-01 | Isotype control |
| Rat IgG1 (clone HRPN) | Bio X Cell | BE0088 | Isotype control |
| Rat IgG1 (clone TNP6A7) | Bio X Cell | BP0290 | Isotype control |
| Rat IgG2a (clone 2A3) | Bio X Cell | BP0089 | Isotype control |
| RPMI 1640 (1X) | Thermo Fisher Scientific | 11875-093 | |
| Sodium Pyruvate (100 mM) | Thermo Fisher Scientific | 11360-070 | 1 mM final concentration |
Referanslar
- Yewdell, J. W., Bennink, J. R. Immunodominance in major histocompatibility complex class I-restricted T lymphocyte responses. Annual Review of Immunology. 17, 51-88 (1999).
- Chen, W., et al. Reversal in the immunodominance hierarchy in secondary CD8+ T cell responses to influenza A virus: roles for cross-presentation and lysis-independent immunodomination. The Journal of Immunology. 173 (8), 5021-5027 (2004).
- Otahal, P., et al. Inefficient cross-presentation limits the CD8+ T cell response to a subdominant tumor antigen epitope. The Journal of Immunology. 175 (2), 700-712 (2005).
- Lauron, E. J., et al. Cross-priming induces immunodomination in the presence of viral MHC class I inhibition. PLoS Pathogens. 14 (2), e1006883 (2018).
- Crowe, S. R., et al. Differential antigen presentation regulates the changing patterns of CD8+ T cell immunodominance in primary and secondary influenza virus infections. The Journal of Experimental Medicine. 198 (3), 399-410 (2003).
- Probst, H. C., et al. Immunodominance of an antiviral cytotoxic T cell response is shaped by the kinetics of viral protein expression. The Journal of Immunology. 171 (10), 5415-5422 (2003).
- Gileadi, U., et al. Generation of an immunodominant CTL epitope is affected by proteasome subunit composition and stability of the antigenic protein. The Journal of Immunology. 163 (11), 6045-6052 (1999).
- Zanker, D., Waithman, J., Yewdell, J. W., Chen, W. Mixed proteasomes function to increase viral peptide diversity and broaden antiviral CD8+ T cell responses. The Journal of Immunology. 191 (1), 52-59 (2013).
- Deng, Y., Yewdell, J. W., Eisenlohr, L. C., Bennink, J. R. MHC affinity, peptide liberation, T cell repertoire, and immunodominance all contribute to the paucity of MHC class I-restricted peptides recognized by antiviral CTL. The Journal of Immunology. 158 (4), 1507-1515 (1997).
- Chen, W., Khilko, S., Fecondo, J., Margulies, D. H., McCluskey, J. Determinant selection of major histocompatibility complex class I-restricted antigenic peptides is explained by class I-peptide affinity and is strongly influenced by nondominant anchor residues. The Journal of Experimental Medicine. 180 (4), 1471-1483 (1994).
- Kotturi, M. F., et al. Naive precursor frequencies and MHC binding rather than the degree of epitope diversity shape CD8+ T cell immunodominance. The Journal of Immunology. 181 (3), 2124-2133 (2008).
- Haeryfar, S. M., et al. Terminal deoxynucleotidyl transferase establishes and broadens antiviral CD8+ T cell immunodominance hierarchies. The Journal of Immunology. 181 (1), 649-659 (2008).
- Leon-Ponte, M., Kasprzyski, T., Mannik, L. A., Haeryfar, S. M. Altered immunodominance hierarchies of influenza A virus-specific H-2(b)-restricted CD8+ T cells in the absence of terminal deoxynucleotidyl transferase. Immunological Investigations. 37 (7), 714-725 (2008).
- Kedl, R. M., et al. T cells compete for access to antigen-bearing antigen-presenting cells. The Journal of Experimental Medicine. 192 (8), 1105-1113 (2000).
- Kastenmuller, W., et al. Cross-competition of CD8+ T cells shapes the immunodominance hierarchy during boost vaccination. The Journal of Experimental Medicine. 204 (9), 2187-2198 (2007).
- Memarnejadian, A., et al. PD-1 Blockade Promotes Epitope Spreading in Anticancer CD8(+) T Cell Responses by Preventing Fratricidal Death of Subdominant Clones To Relieve Immunodomination. The Journal of Immunology. 199 (9), 3348-3359 (2017).
- Haeryfar, S. M., DiPaolo, R. J., Tscharke, D. C., Bennink, J. R., Yewdell, J. W. Regulatory T cells suppress CD8+ T cell responses induced by direct priming and cross-priming and moderate immunodominance disparities. The Journal of Immunology. 174 (6), 3344-3351 (2005).
- Rytelewski, M., et al. Suppression of immunodominant antitumor and antiviral CD8+ T cell responses by indoleamine 2,3-dioxygenase. PLoS One. 9 (2), e90439 (2014).
- Maleki Vareki, S., et al. Differential regulation of simultaneous antitumor and alloreactive CD8(+) T-cell responses in the same host by rapamycin. American Journal of Transplantation. 12 (1), 233-239 (2012).
- Irvine, K., Bennink, J. Factors influencing immunodominance hierarchies in TCD8+ -mediated antiviral responses. Expert Review of Clinical Immunology. 2 (1), 135-147 (2006).
- Grossmann, M. E., Davila, T., Celis, T. Avoiding tolerance against prostatic antigens with subdominant peptide epitopes. Journal of Immunotherapy. 24 (3), 237-241 (2001).
- Schreiber, H., Wu, T. H., Nachman, J., Kast, W. M. Immunodominance and tumor escape. Seminars in Cancer Biology. 12 (1), 25-31 (2002).
- Mylin, L. M., et al. Quantitation of CD8(+) T-lymphocyte responses to multiple epitopes from simian virus 40 (SV40) large T antigen in C57BL/6 mice immunized with SV40, SV40 T-antigen-transformed cells, or vaccinia virus recombinants expressing full-length T antigen or epitope minigenes. Journal of Virology. 74 (15), 6922-6934 (2000).
- Fu, T. M., et al. An endoplasmic reticulum-targeting signal sequence enhances the immunogenicity of an immunorecessive simian virus 40 large T antigen cytotoxic T-lymphocyte epitope. Journal of Virology. 72 (2), 1469-1481 (1998).
- Chen, W., et al. Cross-priming of CD8+ T cells by viral and tumor antigens is a robust phenomenon. European Journal of Immunology. 34 (1), 194-199 (2004).
- Memarnejadian, A., Meilleur, C. E., Mazzuca, D. M., Welch, I. D., Haeryfar, S. M. Quantification of Alloantibody-Mediated Cytotoxicity In Vivo. Transplantation. 100 (5), 1041-1051 (2016).
- Aichele, P., et al. Peptide antigen treatment of naive and virus-immune mice: antigen-specific tolerance versus immunopathology. Immunity. 6 (5), 519-529 (1997).
- Oehen, S., Brduscha-Riem, K. Differentiation of naive CTL to effector and memory CTL: correlation of effector function with phenotype and cell division. The Journal of Immunology. 161 (10), 5338-5346 (1998).
- Coles, R. M., Mueller, S. N., Heath, W. R., Carbone, F. R., Brooks, A. G. Progression of armed CTL from draining lymph node to spleen shortly after localized infection with herpes simplex virus 1. The Journal of Immunology. 168 (2), 834-838 (2002).
- Barber, D. L., Wherry, E. J., Ahmed, R. Cutting edge: rapid in vivo killing by memory CD8 T cells. The Journal of Immunology. 171 (1), 27-31 (2003).
- Meilleur, C. E., et al. Bacterial superantigens expand and activate, rather than delete or incapacitate, preexisting antigen-specific memory CD8+ T cells. The Journal of Infectious Diseases. , (2018).
- Goldszmid, R. S., et al. Dendritic cells charged with apoptotic tumor cells induce long-lived protective CD4+ and CD8+ T cell immunity against B16 melanoma. The Journal of Immunology. 171 (11), 5940-5947 (2003).
- Oberg, L., et al. Loss or mismatch of MHC class I is sufficient to trigger NK cell-mediated rejection of resting lymphocytes in vivo - role of KARAP/DAP12-dependent and -independent pathways. European Journal of Immunology. 34 (6), 1646-1653 (2004).
- Wingender, G., Krebs, P., Beutler, B., Kronenberg, M. Antigen-specific cytotoxicity by invariant NKT cells in vivo is CD95/CD178-dependent and is correlated with antigenic potency. The Journal of Immunology. 185 (5), 2721-2729 (2010).
- Brinster, R. L., et al. Transgenic mice harboring SV40 T-antigen genes develop characteristic brain tumors. Cell. 37 (2), 367-379 (1984).
- Tatum, A. M., et al. CD8+ T cells targeting a single immunodominant epitope are sufficient for elimination of established SV40 T antigen-induced brain tumors. The Journal of Immunology. 181 (6), 4406-4417 (2008).
- Schell, T. D., Tevethia, S. S. Control of advanced choroid plexus tumors in SV40 T antigen transgenic mice following priming of donor CD8(+) T lymphocytes by the endogenous tumor antigen. The Journal of Immunology. 167 (12), 6947-6956 (2001).
- Greenberg, N. M., et al. Prostate cancer in a transgenic mouse. Proceedings of the National Academy of Sciences of the United States of America. 92 (8), 3439-3443 (1995).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır