Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Портняжное в естественных условиях цитотоксичности исследования для изучения Иммунодоминирования в опухоль конкретных CD8+ т ячейки ответы
В этой статье
Резюме
Мы описываем здесь поток цитометрия основе в естественных условиях убийства анализ, который позволяет изучение иммунодоминирования в цитотоксических т-лимфоцитов (CTL) ответы на модели опухолевого антигена. Мы предоставляем примеры того, как этот элегантный анализ может быть использован для механистических исследований и для тестирования эффективности лекарственных препаратов.
Аннотация
Carboxyфлуоресьин Эстер (CFSE)-основанная в естественных условиях цитотоксичности исследования позволяют чувствительной и точной квантации CD8+ цитолитических т-лимфоцитов (CTL) ответы вызвали против опухоли и патогена производные пептиды. Они предлагают несколько преимуществ по сравнению с традиционными убийства анализов. Во-первых, они позволяют мониторинг CTL-опосредованной цитотоксичности в архитектурно нетронутыми вторичных лимфоидных органов, как правило, в селезенке. Во-вторых, они позволяют механистические исследования во время грунтовки, эффекторных и вспомнить фазы ответов CTL. В-третьих, они обеспечивают полезные платформы для вакцины/тестирования эффективности лекарственных средств в истинно в естественных условиях. Здесь мы предоставляем оптимизированный протокол для изучения сопутствующих CTL ответов против более чем одного пептидного эпитопа модели опухолевого антигена (AG), а именно, вируса обезьян 40 (SV40)-закодированного большого T AG (T AG). Как и большинство других клинически значимых опухолевых белков, T AG таит много потенциально иммуногенных пептидов. Однако, только 4 таких пептидов вызывают обнаруживаемые реакции CTL в мышах C57BL/6. Эти ответы последовательно расположены в иерархическом порядке, основанном на их величине, которая является основой для TCD8 "иммунодоминирования" в этой мощной системе. Соответственно, основная часть T AG-специфическая реакция TCD8 сосредоточена против одного иммунодоминантного эпитопа, в то время как остальные три эпитопов признаются и реагируют только слабо. Иммунодоминирование ставит под угрозу широту антиопухолевого TCD8 ответы и, как таковой, по мнению многих, как препятствие для успешной вакцинации против рака. Таким образом, важно понимать клеточные и молекулярные факторы и механизмы, которые диктуют или формируют TCD8 иммунодоминирование. Протокол, который мы описываем здесь, адаптирован к исследованию этого феномена в модели иммунизации T AG, но может быть легко модифицирован и распространен на аналогичные исследования в других моделях опухолей. Мы предлагаем примеры того, как воздействие экспериментальных иммунотерапевтических вмешательств может быть измерено с использованием в естественных условиях цитотоксичности анализов.
Введение
Обычные CD8+ t-клетки (tCD8) играют важную роль в противоопухолевой иммунной слежке. Они в первую очередь функции в качестве цитолитических т-лимфоцитов (Ктлс), которые признают опухоль конкретных или связанных пептидных антигенов (АГС) отображается в закрытой расщелины основных комплекса гистосовместимости (MHC) класса я молекул. Полностью вооруженные КСТ использовать их цитотоксический арсенал для уничтожения злокачественных клеток. Противоопухолевые TCD8 могут быть обнаружены в обращении или даже внутри первичных и метастатических масс многих онкологических больных и опухолевых подшипников животных. Однако, они часто нергические или исчерпаны, и не в состоянии искоренить рак. Таким образом, многие иммунотерапевтические методы призваны увеличить противораковые TCD8 частоты и восстановить и повысить их функции.
Опухолевые белки питают многие пептиды, некоторые из которых могут быть иммуногенными и потенциально иммунопротекторными. Тем не менее, количественные ответы TCD8 выявляют с различной магнитудой против немногих пептидов только. Это создает «иерархию иммунодоминирования» среди TCD8 клонов1. Соответственно, иммунодоминант (ID) TCD8 занимают видные иерархические ряды, о которых часто судят по их обилию. В противоположность этому, TCD8 клетки, чьи т-клеточный рецептор (TCR) специфическая для субдоминантных (SD) эпитопов встречаются в нижних частотах. Мы и другие определили некоторые из факторов, которые диктуют или формируют иммунодоминирование в ответах TCD8 . К ним относятся, среди прочего, режим AG презентации наивно TCD8 (например, прямая презентация, кросс-презентация, кросс-одевания)2,3,4, тип AG-представляя клетки (БТР) участие в TCD8 активации5, обилие и устойчивость белка АГС6,7 и эффективность и кинетика их деградации протеасом7,8, Относительная избирательность транспортера, связанного с обработкой AG (TAP) для пептидов9, близость освобожденных пептидов для молекул MHC I9,10, наличие, частоты прекурсоров и TCR разнообразие родственный tCD8 в бассейнах t Cell11,12,13, кросс-конкурс среди т-клеток для доступа к БТР14,15, и братоубийственной емкость tCD8 клонов16. Кроме того, TCD8 иммунодоминирование подвергается иммунорегуляторные механизмы опосредовано несколько типов клеток супрессоров, таких как естественные нормативные т (ntreg) клетки17, клеточной поверхности Co-тормозящий молекулы запрограммированы смерть-1 (PD-1)16, и некоторые внутриклеточные ферменты, такие как индолеамин 2, 3-диоксигеназы (Идо)18 и млекопитающих, цель рапамицина (mTOR)19. Важно отметить, однако, что вышеуказанные факторы не всегда в полной мере учитывают иммунодоминирование.
Помимо базовой биологии TCD8 иммунодоминирования, изучение этого интригующего явления имеет важные последствия в иммунологии и иммунотерапии рака. Во-первых, статус ID не обязательно наделяют данный клон TCD8 способностью предотвращать начало опухоли или прогрессирование20. Ли и как ID и SD TCD8 способствовать противоопухолевого иммунитета может зависеть от типа и степени злокачественности и экспериментальной системы, используемой. Во-вторых, считается, что ID TCD8 клоны могут быть "слишком заметны" для иммунной системы и, следовательно, более склонны к Центральной и/или периферийные механизмы толерантности16,21. В-третьих, гетерогенетические опухоли могут содержать неопластические клетки, которые избегают обнаружения многими, если не большинством, кцл, показывая только узкий спектр пептидов: комплексы MHC. В этих условиях, TCD8 ответы недостаточной ширины, вероятно, позволить такие опухолевые клетки выживания преимущество, тем самым потенцируя их рост22. Именно по вышеуказанным причинам многие рассматривают иммунодоминирование как препятствие для успешной вакцинации на основе TCD8и терапии против рака.
Прививка C57BL/6 мышей с симианом вирусом 40 (SV40)-преобразованные клетки, которые выражают большую опухоль AG (T AG) обеспечивает мощную доклинические системы для изучения TCD8 иммунодоминирование. Эта модель предлагает несколько преимуществ. Во-первых, пептидные эпитопы этого клинически соответствующего онкопротеина хорошо характеризуются в этом штаммом мыши23 (Таблица 1). Во-вторых, T AG эпитопов, которые называются сайты I, II/III, IV, и V, вызвать TCD8 ответы, которые последовательно расположены в следующем иерархическом порядке: сайт IV > > сайте я II/iii > ≫ сайт V. соответственно, сайт IV-специфическая TCD8 установите наиболее надежный ответ на T AG. В отличие от, сайты I и II/III являются субдоминантными, и сайт V-специфических TCD8 являются наименее обильными и, как правило, только обнаруживаемые в отсутствие реагирования на другие эпитопы23,24. В-третьих, т AG+ клетка опухолевых клеток, используемых в протоколе описано здесь, а именно C57SV клетки фибросаркома, и те, которые используются в наших предыдущих исследованиях16,17,18,19 ,25,26, преобразуются с субгеномной SV40 фрагментами25. Таким образом, они не в состоянии собрать и выпустить SV40 вирионов, которые потенциально могут заразить хост БТР. Кроме того, C57SV клетки лишены классических кокосмитирующих молекул, таких как CD80 (B7-1), CD86 (B7-2) и CD137 лиганда (4-1bbl.)16. Приведенные выше атрибуты делают эти линии идеально подходит для изучения в естественных условиях TCD8 активации через кросс грунтовки. Кросс-грунтовка является одним из основных путей в вызывая TCD8 ответы, особенно те, запущен против опухолевых клеток, не гемопоэтических происхождения, которые не могут непосредственно премьер-наивные т-клетки25.
Противоопухолевые TCD8 частоты и/или функции могут контролироваться MHC я теттрамер окрашивания, внутриклеточного окрашивания для эффекторных цитокинов (например, интерферон [IFN]-γ) или литические молекул (например, перфорин), фермент связанных иммуносопот (ELISpot) анализы и ex естественных цитотоксичности анализов. С момента своего создания в 1990-е годы27,28, carboxyфлуорессеин Эстер (CFSE)-основанный в естественных условиях убийства анализы позволили оценки цитотоксических реакций, опосредованных противовирусные кцл29,30 , 31, противоопухолевые ЦС16,32, естественных киллеров (НК) клетки33, гликолипид-реактивный ининт естественных убийца т (inkt) клетки34, и ранее и де Ново доноров конкретных аллоантител26. Таким образом, их приложения могут быть интересны широкому кругу читателей, в том числе, но не ограничиваясь исследователями, работающими в области иммунологии и иммунотерапии опухолей, анти-патогенного иммунитета, а так же превентивной и терапевтической разработки вакцин.
Для оценки клеточного опосредованного цитотоксичности в типичных сценариях, две популяции наивных сселезоцитов, которые отображают либо несущественный AG или родственный AG (s), помечены двумя различными дозами CFSE, смешанные в равных количествах и впрыснуты в наивные (контроль) или убийца клеток-укрывательство мышей. Присутствие/отсутствие каждой целевой популяции затем рассматривается потоком цитометрии.
Мы оптимизированы и использованы в естественных условиях убийства анализов в наших исследованиях на иммунодоминирование в обоих противовирусных и противоопухолевые TCD8 ответы12,16,17. Здесь мы предоставляем подробный протокол для одновременной оценки ID и SD TCD8 ответы на t AG эпитопов, которые могут быть легко приняты для аналогичных исследований в других экспериментальных систем. Мы также предоставляем репрезентативные результаты, доказывая, что истощение ячейки nTreg и блокада PD-1 могут выборочно усилить ID TCD8-и SD tCD8-индуцированной цитотоксичности, соответственно. В конце концов, мы обсудим несколько преимуществ в естественных условиях убийства анализов, а также некоторые из их неотъемлемых ограничений.
протокол
Описанные здесь эксперименты следуют протоколам использования животных, утвержденным институциональными образованиями, и придерживаются установленных национальных руководящих принципов.
1. прививка C57BL/6 мышей с T AG-выражая опухолевые клетки
- Вырастите SV40-преобразованный фибросаркома клеточной линии C57SV (или аналогичный T AG+ прилипающего клеточного линии) в средне-модифицированной Eagle (дмэм) с 4,5 g/L D-глюкозы и l-глютамина (1x) и дополнено 1 мм натрия пируват и 10% тепло-инактивированных Эмбриональная бычья сыворотка (ФПС) в тканевой культуре-обработанные колбы при температуре 37 ° с в увлажненный атмосфере, содержащей 10% CO2.
- Как только клетки становятся полностью свободно или слегка сверхсвободно, аккуратно удалите и выбросите носитель и промойте монослой с предварительно разогретой стерильным фосфором-буфером физиологического раствора (PBS).
Примечание: максимальное выражение T AG достигается, когда T AG+ клетки достигают 100% беглость. - Внутри биологической безопасности кабинета, добавить предварительно прогревается трипсина-ЭДТА (0,25%) для покрытия монослоя при комнатной температуре, пока клетки не выбили в патчей. Нажмите стороны культуры колбу (ы) несколько раз, чтобы освободить оставшихся адепт клеток.
Примечание: при необходимости и ускорить процесс тринонизации, перенесите колбу (ы) в инкубатор 37 °C. Выбили клетки быстро принять округлые формы под легким микроскопом. Этот шаг должен длиться приблизительно 5 минут. - Добавить 5 мл средней ДМЕ и отделить сгустки, чтобы подготовить одноклеточную суспензию, пипетки содержание каждой колбы вверх и вниз.
- Перенесение клеточной суспензии через сетчатый фильтр с 70-мкм поры в трубку.
- Спин вниз по трубе на 400 x g в течение 5 минут при температуре 4 °c.
- Выбросьте супернатант. Ресуспензируем гранулированных клеток в 10 мл стерильных холодных PBS.
- Повторите шаги 1,6 и 1,7 дважды.
- Считайте ячейки, используя хемоцитометер. Подготовьте равномерную подвеску, содержащую 4 х 107 клеток/мл СТЕРИЛЬНЫХ PBS.
- Впрыснуть 500 мкл вышеуказанной суспензии интраперитально (IP) в каждого взрослого (6-12-недельного) мужского или женского C57BL/6 мыши.
2. схемы лечения
-
Режим лечения, чтобы изучить вклад клеток nTreg к TCD8 иммунодоминирование
- За четыре дня до в естественных условиях грунтовки C57BL/6 мышей с C57SV клеток (шаг 1,10), придать каждому животному один раз IP с 0,5 мг низко-эндотоксина, азид-бесплатно анти-CD25 моноклональных антител (mAb) (клон PC-61.5.3), который истощает клетки nTreg, или с крысы IgG1 изотип (например, клон KLH/G1-2-2, клон HRPN или клон TNP6A7).
-
Режим лечения, чтобы проверить в естественных условиях значение PD-1-PD-(2) взаимодействия в формировании TCD8 иммунодоминирование
Примечание: участие PD-1 по PD-CD8 часто, но не всегда, выступает посредником в совместном ингибирование и/или истощение AG конкретных T. Таким образом, лечение анти-PD-1 может быть выполнено параллельно с управлением анти-PD-Л1 и анти-PD-Л2 МБС, чтобы выявить точное межклеточного взаимодействия, участвующих в биологическом явлении.
3. Подготовка целевых Сселезоцитов
- Эвтаназии секс-соответствует наивный C57BL/6 мышей (6-12 недель), которые будут служить в качестве доноров сцитарной от шейки дислокации.
- Позиция каждой мыши с ее живот лицом вверх внутри биологической безопасности кабинета. Спрей кожи с 70% (v/v) этох. Использование стерильных щипцов и ножниц, поднимите кожу и сделать небольшой брюшной разрез средней линии. Затем, вырезать кожу в кросс-как мода подвергать брюшины.
- Используя щипцы, потяните брюшину в палатке, подобной моде, не вырывая ни одного из внутренних органов. Cut брюшины открыты подвергать брюшной полости и осторожно удалить селезенку.
- Поместите селезенку (ы) в 15 мл ткани Dounce, содержащую 5 мл стерильного PBS. Нанесите ручное давление с помощью стеклянного поршень точильщика, пока ткань селезенки рассеивается в красный однородный клеточную суспензию.
Примечание: в зависимости от количества получателей животных в экспериментальной группе, несколько доноров мыши селезенки могут быть необходимы для подготовки целевых клеток. До 3 селезенки могут быть однородно вместе внутри 15 мл точильщика. - Перенос гогоната в трубку 15 мл. Спин вниз по трубе на 400 x g в течение 5 минут при температуре 4 °c.
- Выбросьте супернатант. Ресуспензируем клеток в 4 мл аммония-хлорида-калия (ACK) lysing буфер для устранения эритроцитов в 4 мин.
Примечание: это чувствительный к времени шаг. Чрезмерная разоблачение срисоцитов к ACK lysing буфер увеличит их хрупкость и сделать их восприимчивыми к неспецифическая гибель клеток. - Для каждой трубки, добавить 8 мл RPMI 1640 средний, содержащий 10% тепло-инактивированных ФПС, L-аланил-L-глютамина, 0,1 mM минимальные основные средства массовой информации (мем) несуществных аминокислот, 1 мм натрия pyruvate, 10 мм HEPES, и 1x пенициллин/стрептомицин, который в дальнейшем будет называется полным средним RPMI (таблица материалов).
- Передача содержимого через 70 мкм поры ячейки стрейнер в новую 15 мл трубки.
- Спин вниз по трубе на 400 x g в течение 5 минут при температуре 4 °c.
- Выбросьте супернатант. Ресуспензируем клетки в 12 мл полного RPMI.
- Разделите суспензию селезенки на 3 равные порции (по 4 мл каждая) в 3 отдельных трубках.
4. покрытие целевые Сселезоциты с неуместным и коньячного пептидов
- Маркировать трубы в соответствии с пептидами, которые будут использоваться для импульса сселезоцитов. Контроль сселезоцитов будет пульсировать с несоответствующим пептида, и каждая популяция родственного целевой сселезоцитов будет пульсировать с синтетическим пептидом, соответствующий T AG производные иммунодоминантного эпитопа (сайт IV) или субдоминантный T AG эпитопе (сайт I или сайт II/III) (Таблица 1).
Примечание: выбор несоответствных пептидов зависит от экспериментальной настройки и деформации мыши, используемой в каждом расследовании. Авторы часто используют gB498-505 (h-2kb-ограниченный Иммунодоминантный пептид эпитопа вируса простого герпеса [ВПГ]-1) и/или GP33-41 (H-2kb-ограниченный Иммунодоминантный пептидный эпитопе лимфоцитов вируса хориоменингита ([ЛЦМВ]) в C57BL/6 мышах (Таблица 1). Эти пептиды являются оптимальным выбором, потому что: (i) они получены из патогенов, ранее не встречаемый в модели мыши, описанной здесь; (II) похожие на пептиды T AG, gB498-505 и GP33-41 ограничены и связывается с H-2b молекул. В "три-пик" в естественных условиях убийства анализов, каждый из двух пиков, которые соответствуют родственные клетки-мишени могут представлять сселезоцитов импульсных с иммунодоминантным или субдоминантный пептид. Выбор каждого набора пептидов варьируется в зависимости от целей каждого эксперимента. См. рисунок 1 и рисунок 2 в качестве примера таких вариаций. На оставшуюся часть этого протокола, T AG-производные сайты I и IV будет представлять субдоминантных и иммунодоминантных пептидов, соответственно. - Пульс содержание каждого помечены трубки с 1 мкм соответствующего пептида для 1 ч на 37 ° c и 5% CO2.
- Использование отдельной ячейки стрейнер (с 70-мкм поры) для каждой трубки для удаления сгустки и мусора, если это необходимо.
- Спин вниз по трубе на 400 x g в течение 5 минут при температуре 4 °c. Выбросьте супернатант.
- Ресуспензируем гранулированных клеток в 12 мл стерильных холодных PBS и повторите шаг 4,4 еще раз.
Примечание: важно удалить как можно больше ФПС, поскольку ФПС может связать CFSE в следующем шаге.
5. Маркировка целевых сселезоцитов с CFSE
- Ресуспензируем пептид-импульсных сселезоцитов в 4 мл стерильных PBS.
- Добавьте CFSE в 0,025 мкм, 0,25 мкм и 2 мкм в трубы, содержащие несоответствный пептид-, сайт I-, и сайт IV-импульсный сцоциты, соответственно.
Примечание: для достижения равномерной маркировки CFSE, удерживайте каждую трубку под углом 45 °, прежде чем добавлять CFSE в сторону немного выше клеточную суспензию следуют сразу же нежной вихрей. Это обеспечит появление гладких гистограмм в конце. Не редки случаи пакетной и возрастной зависимости от интенсивности CFSE. Поэтому, возможно, потребуется поэкспериментировать с дифференциальными дозами CFSE, прежде чем принимать решение о оптимальных концентрациях, которые будут использоваться.
Осторожно: CFSE является токсичным в концентрациях, которые выше, чем 5 мкм. - Поместите трубы внутри инкубатора 37 ° c в течение 15 минут и инвертировать их один раз каждые 5 мин.
- Добавить 3 мл тепла инактивированных ФПС для каждой трубки, чтобы остановить реакцию CFSE. Топ содержание стерильных PBS.
- Спин вниз по трубе на 400 x g в течение 5 минут при температуре 4 °c. Выбросьте супернатант.
- Ресуспензируем гранулированных клеток в 12 мл стерильных PBS и повторить шаг 5,5.
6. Экспертиза адекватного/равного CFSE маркировки целевых Сцсцитарных популяций
- Ресуспензируем лейкоциты в 3 мл PBS.
- Вихревые трубы осторожно. Передача 10 мкл, каждый, из CFSEнизким, CFSEпромежуточные (int), и CFSEвысокой ячейки суспензий в 5 мл круглый-дно полистирола флуоресценции клеток сортировки (facs) трубка, содержащая 200 мкл PBS.
- Опрашивайте клетки с помощью потока, cytometer оснащен лазером 488 нм. Нарисуйте лимфоциты ворот, основанных на форвард разброс (ЛПС) и боковой разброс (ССК) свойства клеток до приобретения 5000 событий, входящих в лимфоцитов ворот в канале FL-1.
- В рамках «родителя» CFSE+ населения, нарисуйте дополнительные ворота гистограммы, чтобы определитьнизкий уровеньCFSE, CFSEint, и CFSEвысокой субпопуляций.
- Подтвердите равное или почти равное число событий в пределах трех ворот. При необходимости, корректировать номера клеток в "источник" трубы (шаг 6,1), прежде чем смешивать и инъекционных целевых сселезоцитов в наивных и загрунтовать мышей в разделе 7.
7. впрыска маркированных ячеек целевых клеток в наивные и T-AG-загрунтовать получатели
- Осторожно вихря исходные трубы. Перенесите три ячейки с маркированы CFSE в равных пропорциях в новую трубку.
- Топ содержание стерильных PBS.
- Спин вниз по трубе на 400 x g в течение 5 минут при температуре 4 °c. Ресуспензируем гранулированных клеток стерильных PBS.
- Отсчет клеток в трипоне синего хемоцитометер для обеспечения клеточной жизнеспособности, по крайней мере 95%.
- Отрегулируйте громкость, чтобы придать 1 х 107 смешанных клеток-мишеней/200 мкл PBS внутривенно (внутривенно), через хвостовую Вену, в каждый получатель C57Bl/6 мыши.
Примечание: Храните клетки на льду между инъекциями. Аккуратно Смешайте клетки-мишени перед каждой инъекцией. Запишите точное время инъекции для каждой мыши, которая определит, когда животное нужно будет усыпить. Важно держать продолжительность в естественных условиях цитотоксичность последовательной среди всех животных в том же эксперименте.
8. приобретение данных
- Два или четыре часа после инъекции CFSE-помечены целевые клетки, усыпить получателя мышей от шейки дислокации.
Примечание: продолжительность в естественных условиях цитотоксичность может варьироваться в зависимости от экспериментальной системы, используемой, иммуногенность целевых АГС, ожидаемое обилие пептидный антиген-специфический TCD8 в селезенке, и надежность их литические функции среди прочих факторов. - Удалить и обработать каждую селезенку отдельно, как в шагах 3.2 − 3,9.
- Выбросьте супернатант и ресуспензируем ячейки в 3 мл PBS.
Примечание: Возьмите дополнительную заботу для обработки селезенки ткани и клеточной подготовки при температуре 4 ° c или на льду перед цитофлюметрическим анализом. Это необходимо для предотвращения продолжения цитотоксичности ex естественных условиях. - Перенесите приблизительно 1 x 107 клеток от каждой обработанной селезенки в чистую трубку FACS.
- Опрашивайте клетки сразу же с помощью потока, cytometer оснащен лазером 488 нм. Нарисуйте ворота лимфоцитов на основе свойств КФС и ССК клеток.
- Определите сцоцитов получателя и CFSE+ переданы клетки- мишени. Нарисуйте дополнительные ворота размещения различных CFSEнизким, CFSEint, и CFSEвысокой целевой популяции клеток.
- Получите в общей сложности 2000низких событий CFSE в канале FL-1.
9. анализ данных
- Расчет конкретного лизиза каждой родственно популяции целевых клеток, используя следующую формулу:
% Специфическая цитотоксичность =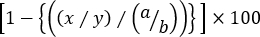
где x = CFSEint/высокий номер события в t AG-загрунтовать мышь, y = CFSEнизкий номер события в t AG-загрунтовать мышь, a = CFSEint/высокий номер события в наивной мыши, и b = CFSEнизкое событие номер в наивной мыши.
Примечание: в «трехпиковом» цитотоксичности, в котором оценивается конкретное лизиз более чем одного родственного целевого населения, не целесообразно использовать частоты целевых клеток. Это просто потому, что частота родственного популяции целевых клеток зависит не только от процента от неуместные элементы управления, но и от других родственный целевой сселезоцитов. Таким образом, числа событий в каждом стробе должны использоваться в вышеуказанной формуле для точного расчета лизиса каждой родственно-целевой популяции клеток (иливысоких ячеек CFSEint или CFSE) противнизких элементов управления CFSE.
Результаты
Цель эксперимента, результаты которого изображены на рисунке 1 , заключалась в определении того, является ли наличие и функции клеток nTreg формировать или изменять иерархию Иммунодоминирования t AG-специфическая тCD8. C57BL/6 мышей вводили IP с PBS или с 0,5 mg Anti-CD25 mAb (клон PC-61.5...
Обсуждение
CFSE основе в естественных условиях цитотоксичности анализы предлагают несколько преимуществ по сравнению с традиционными убийства анализов, таких как радиоактивный хром (51CR) релиз и цветаметрическое лактата дегидрогеназы (LDH) релиз-тестов. Во-первых, они позволяют мониторинг фун?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана канадскими институтами медицинских исследований (CIHR) гранты СС-130465 и PJT-156295 в СММХ. Джей Си частично поддерживается стипендиатом королевы Елизаветы II по науке и технике из министерства образования, колледжей и университетов провинции Онтарио. Джем был получателем стипендии Александра Грэхема Белла (докторантура) в научно-исследовательском совете естественных наук и инженерных исследований Канады (NSERC).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA (1X) | Thermo Fisher Scientific | 25200-056 | |
| ACK Lysing Buffer | Thermo Fisher Scientific | A1049201 | |
| Anti-mouse CD25 (clone PC-61.5.3) | Bio X Cell | BE0012 | |
| Anti-mouse PD-1 (clone RMP1-14) | Bio X Cell | BE0146 | |
| CFSE | Thermo Fisher Scientific | C34554 | |
| DMEM (1X) | Thermo Fisher Scientific | 11965-092 | |
| Fetal bovine serum (FBS) | Wisent Bioproducts | 080-150 | Heat-inactivate prior to use |
| GlutaMAX (100X) | Thermo Fisher Scientific | 35050-061 | |
| HEPES (1M) | Thermo Fisher Scientific | 15630080 | 10 mM final concentration |
| MEM Non-Essential Amino Acids Solution (100X) | Thermo Fisher Scientific | 11140-050 | |
| Penicillin/Streptomycin | Sigma-Aldrich | P0781 | Stock is 100X |
| Rat IgG1 (clone KLH/G1-2-2) | SouthernBiotech | 0116-01 | Isotype control |
| Rat IgG1 (clone HRPN) | Bio X Cell | BE0088 | Isotype control |
| Rat IgG1 (clone TNP6A7) | Bio X Cell | BP0290 | Isotype control |
| Rat IgG2a (clone 2A3) | Bio X Cell | BP0089 | Isotype control |
| RPMI 1640 (1X) | Thermo Fisher Scientific | 11875-093 | |
| Sodium Pyruvate (100 mM) | Thermo Fisher Scientific | 11360-070 | 1 mM final concentration |
Ссылки
- Yewdell, J. W., Bennink, J. R. Immunodominance in major histocompatibility complex class I-restricted T lymphocyte responses. Annual Review of Immunology. 17, 51-88 (1999).
- Chen, W., et al. Reversal in the immunodominance hierarchy in secondary CD8+ T cell responses to influenza A virus: roles for cross-presentation and lysis-independent immunodomination. The Journal of Immunology. 173 (8), 5021-5027 (2004).
- Otahal, P., et al. Inefficient cross-presentation limits the CD8+ T cell response to a subdominant tumor antigen epitope. The Journal of Immunology. 175 (2), 700-712 (2005).
- Lauron, E. J., et al. Cross-priming induces immunodomination in the presence of viral MHC class I inhibition. PLoS Pathogens. 14 (2), e1006883 (2018).
- Crowe, S. R., et al. Differential antigen presentation regulates the changing patterns of CD8+ T cell immunodominance in primary and secondary influenza virus infections. The Journal of Experimental Medicine. 198 (3), 399-410 (2003).
- Probst, H. C., et al. Immunodominance of an antiviral cytotoxic T cell response is shaped by the kinetics of viral protein expression. The Journal of Immunology. 171 (10), 5415-5422 (2003).
- Gileadi, U., et al. Generation of an immunodominant CTL epitope is affected by proteasome subunit composition and stability of the antigenic protein. The Journal of Immunology. 163 (11), 6045-6052 (1999).
- Zanker, D., Waithman, J., Yewdell, J. W., Chen, W. Mixed proteasomes function to increase viral peptide diversity and broaden antiviral CD8+ T cell responses. The Journal of Immunology. 191 (1), 52-59 (2013).
- Deng, Y., Yewdell, J. W., Eisenlohr, L. C., Bennink, J. R. MHC affinity, peptide liberation, T cell repertoire, and immunodominance all contribute to the paucity of MHC class I-restricted peptides recognized by antiviral CTL. The Journal of Immunology. 158 (4), 1507-1515 (1997).
- Chen, W., Khilko, S., Fecondo, J., Margulies, D. H., McCluskey, J. Determinant selection of major histocompatibility complex class I-restricted antigenic peptides is explained by class I-peptide affinity and is strongly influenced by nondominant anchor residues. The Journal of Experimental Medicine. 180 (4), 1471-1483 (1994).
- Kotturi, M. F., et al. Naive precursor frequencies and MHC binding rather than the degree of epitope diversity shape CD8+ T cell immunodominance. The Journal of Immunology. 181 (3), 2124-2133 (2008).
- Haeryfar, S. M., et al. Terminal deoxynucleotidyl transferase establishes and broadens antiviral CD8+ T cell immunodominance hierarchies. The Journal of Immunology. 181 (1), 649-659 (2008).
- Leon-Ponte, M., Kasprzyski, T., Mannik, L. A., Haeryfar, S. M. Altered immunodominance hierarchies of influenza A virus-specific H-2(b)-restricted CD8+ T cells in the absence of terminal deoxynucleotidyl transferase. Immunological Investigations. 37 (7), 714-725 (2008).
- Kedl, R. M., et al. T cells compete for access to antigen-bearing antigen-presenting cells. The Journal of Experimental Medicine. 192 (8), 1105-1113 (2000).
- Kastenmuller, W., et al. Cross-competition of CD8+ T cells shapes the immunodominance hierarchy during boost vaccination. The Journal of Experimental Medicine. 204 (9), 2187-2198 (2007).
- Memarnejadian, A., et al. PD-1 Blockade Promotes Epitope Spreading in Anticancer CD8(+) T Cell Responses by Preventing Fratricidal Death of Subdominant Clones To Relieve Immunodomination. The Journal of Immunology. 199 (9), 3348-3359 (2017).
- Haeryfar, S. M., DiPaolo, R. J., Tscharke, D. C., Bennink, J. R., Yewdell, J. W. Regulatory T cells suppress CD8+ T cell responses induced by direct priming and cross-priming and moderate immunodominance disparities. The Journal of Immunology. 174 (6), 3344-3351 (2005).
- Rytelewski, M., et al. Suppression of immunodominant antitumor and antiviral CD8+ T cell responses by indoleamine 2,3-dioxygenase. PLoS One. 9 (2), e90439 (2014).
- Maleki Vareki, S., et al. Differential regulation of simultaneous antitumor and alloreactive CD8(+) T-cell responses in the same host by rapamycin. American Journal of Transplantation. 12 (1), 233-239 (2012).
- Irvine, K., Bennink, J. Factors influencing immunodominance hierarchies in TCD8+ -mediated antiviral responses. Expert Review of Clinical Immunology. 2 (1), 135-147 (2006).
- Grossmann, M. E., Davila, T., Celis, T. Avoiding tolerance against prostatic antigens with subdominant peptide epitopes. Journal of Immunotherapy. 24 (3), 237-241 (2001).
- Schreiber, H., Wu, T. H., Nachman, J., Kast, W. M. Immunodominance and tumor escape. Seminars in Cancer Biology. 12 (1), 25-31 (2002).
- Mylin, L. M., et al. Quantitation of CD8(+) T-lymphocyte responses to multiple epitopes from simian virus 40 (SV40) large T antigen in C57BL/6 mice immunized with SV40, SV40 T-antigen-transformed cells, or vaccinia virus recombinants expressing full-length T antigen or epitope minigenes. Journal of Virology. 74 (15), 6922-6934 (2000).
- Fu, T. M., et al. An endoplasmic reticulum-targeting signal sequence enhances the immunogenicity of an immunorecessive simian virus 40 large T antigen cytotoxic T-lymphocyte epitope. Journal of Virology. 72 (2), 1469-1481 (1998).
- Chen, W., et al. Cross-priming of CD8+ T cells by viral and tumor antigens is a robust phenomenon. European Journal of Immunology. 34 (1), 194-199 (2004).
- Memarnejadian, A., Meilleur, C. E., Mazzuca, D. M., Welch, I. D., Haeryfar, S. M. Quantification of Alloantibody-Mediated Cytotoxicity In Vivo. Transplantation. 100 (5), 1041-1051 (2016).
- Aichele, P., et al. Peptide antigen treatment of naive and virus-immune mice: antigen-specific tolerance versus immunopathology. Immunity. 6 (5), 519-529 (1997).
- Oehen, S., Brduscha-Riem, K. Differentiation of naive CTL to effector and memory CTL: correlation of effector function with phenotype and cell division. The Journal of Immunology. 161 (10), 5338-5346 (1998).
- Coles, R. M., Mueller, S. N., Heath, W. R., Carbone, F. R., Brooks, A. G. Progression of armed CTL from draining lymph node to spleen shortly after localized infection with herpes simplex virus 1. The Journal of Immunology. 168 (2), 834-838 (2002).
- Barber, D. L., Wherry, E. J., Ahmed, R. Cutting edge: rapid in vivo killing by memory CD8 T cells. The Journal of Immunology. 171 (1), 27-31 (2003).
- Meilleur, C. E., et al. Bacterial superantigens expand and activate, rather than delete or incapacitate, preexisting antigen-specific memory CD8+ T cells. The Journal of Infectious Diseases. , (2018).
- Goldszmid, R. S., et al. Dendritic cells charged with apoptotic tumor cells induce long-lived protective CD4+ and CD8+ T cell immunity against B16 melanoma. The Journal of Immunology. 171 (11), 5940-5947 (2003).
- Oberg, L., et al. Loss or mismatch of MHC class I is sufficient to trigger NK cell-mediated rejection of resting lymphocytes in vivo - role of KARAP/DAP12-dependent and -independent pathways. European Journal of Immunology. 34 (6), 1646-1653 (2004).
- Wingender, G., Krebs, P., Beutler, B., Kronenberg, M. Antigen-specific cytotoxicity by invariant NKT cells in vivo is CD95/CD178-dependent and is correlated with antigenic potency. The Journal of Immunology. 185 (5), 2721-2729 (2010).
- Brinster, R. L., et al. Transgenic mice harboring SV40 T-antigen genes develop characteristic brain tumors. Cell. 37 (2), 367-379 (1984).
- Tatum, A. M., et al. CD8+ T cells targeting a single immunodominant epitope are sufficient for elimination of established SV40 T antigen-induced brain tumors. The Journal of Immunology. 181 (6), 4406-4417 (2008).
- Schell, T. D., Tevethia, S. S. Control of advanced choroid plexus tumors in SV40 T antigen transgenic mice following priming of donor CD8(+) T lymphocytes by the endogenous tumor antigen. The Journal of Immunology. 167 (12), 6947-6956 (2001).
- Greenberg, N. M., et al. Prostate cancer in a transgenic mouse. Proceedings of the National Academy of Sciences of the United States of America. 92 (8), 3439-3443 (1995).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены