Method Article
siRNA 电穿孔以在单纯疱疹病毒类型 1-感染单细胞衍生的丹突细胞中调制自噬
摘要
在这项研究中,我们提出了基于抑制剂和siRNA的策略,以干扰单纯疱疹病毒类型-1(HSV-1)感染的单细胞衍生树突状细胞中的自噬性通量。
摘要
单纯疱疹病毒类型-1(HSV-1)在未成熟的树突状细胞(iDC)和成熟的树突状细胞(mDC)中诱导自噬,而自噬通量仅在iDC中观察到。为了获得机械学的洞察力,我们开发了有效的策略来干扰HSV-1引起的自噬性周转。调节HSV-1诱导自噬的抑制剂策略是首选,因为它是一种简单快捷的方法。为了规避此类化合物的潜在非特异性脱靶效应,我们开发了一种基于siRNA的替代策略,在HSV-1感染后调节iDC的自噬性周转率。事实上,在HSV-1感染之前,用FIP200特异性siRNA对iDC进行电穿孔是一种非常具体和成功的方法,可以抑制FIP200蛋白表达,从而抑制自噬性通量。两种方法均能有效抑制IDC中HSV-1诱导的自噬性周转,从而对基于siRNA的技术更具针对性。开发了一种基于siRNA的另一种方法,选择性地抑制KIF1B和KIF2A的蛋白质表达,促进在MDC中HSV-1感染时的自噬性周转。总之,siRNA电穿孔技术是一种有前途的策略,可以选择性地消减不同蛋白质的表达,并分析其对HSV-1感染的影响。
引言
人类单细胞衍生树突状细胞(DC)的产生构成了研究这一重要免疫细胞类型的功能和生物学的适当体外模型。近年,单核细胞与单核细胞的隔离及分化已确立为DC。DC感染β-疱疹单纯疱疹病毒-1型(HSV-1)作为研究HSV-1介导的DC生物学调制的模型系统2,3,4,5,6.这一点尤其重要,阐明疱疹病毒如何抑制或抑制强效抗病毒免疫反应,在宿主7、8内部建立免疫特权利基的延迟。在这方面,疱疹病毒是非常成功的病原体,在人群中广泛传播,根据地理区域9,血清患病率高达90%。为了理解并可能防止这种情况,需要对宿主免疫系统的HSV-1介导调制,特别是免疫细胞(如DC)的见解。
Turan等人最近发表了一份关于DC与HSV-1相互作用的一个全新的观察。作者证明,HSV-1复制的完成完全取决于DC的成熟状态。在 iDC 中,HSV-1 的完全复制通过自噬依赖机制得到促进。虽然HSV1在iDC和mDC中诱导自噬,但自噬通量仅在iDC中观察到。这反过来又通过iDC中核层状的自噬性降解,促进病毒辣椒的核出口。为了获得对 iDC 与 mDC 中这种 HSV-1 诱导降解途径的机械见解,新的高效策略对于研究自噬通量至关重要。
巨细胞(自噬)是一种保存良好的多步骤过程,针对细胞内蛋白质或整个细胞器的细胞内消化11。简单化,自噬可分为(i)启动,(ii)膜成核,(iii)囊泡扩张,和(iv)自噬体-裂液体融合阶段12。在启动 (i) 期间,含有 200 kD (FIP200) 的焦点粘附激酶家族相互作用蛋白的活性 ULK1/2 激酶复合物等成分对于激活 beclin-1-Vps34-AMBRA1 复合物至关重要。随后,膜核(ii)启动吞噬形成13,吞噬细胞质货物,这些细胞质货物被p6214等分子标记。在囊泡扩张和自噬性成熟(iii)微管相关蛋白光链3(LC3)-I被转换成其脂质形式LC3-II,插入到自噬细胞膜中。因此,LC3-I到-II的转换率是自噬诱导的指标,通过镜像成熟自噬体15,16的形成。在自噬细胞体-裂解体融合(iv)时,不仅自噬性货物,而且相关的p62和LC3-II蛋白发生降解(例如,水解)。因此,p62和LC3-II的损耗作为自噬通量17的标记。自噬体与液化体的融合,从而遵循自噬性流动,高度依赖于细胞内裂液体定位。除其他外,这是由亲子体成员KIF1B和KIF2A调节,它们被证明对自噬体-流合体融合18产生负面影响。有趣的是,KIF1B和KIF2A的蛋白质表达在直流成熟时诱导,从而导致HSV-1感染mDC中低效的自噬通量,从而阻碍HSV-1完全复制10。
调节自噬的实验尝试包括使用已知诱导或抑制这种特定途径的化合物19,20,21。在这项研究中,我们描述了两种基于抑制剂的策略来阻止HSV-1感染iDC的自噬性周转。在我们的实验中使用的第一个化合物是特定和强效的自噬抑制剂-1(斯帕他丁-1),它被描述为在自噬22的起始阶段促进贝克林-1-Vps34-AMBRA1复合降解。本研究使用的第二种化合物是巴菲洛霉素-A1(BA1),一种V-ATPase抑制剂,可阻断晚期自噬事件(即自噬体-裂解体融合以及自体体酸化)23、24。在iDC感染HSV-1之前,这两种抑制剂中的任何一种的使用能有效抑制自噬,但不会干扰有效的病毒基因表达。因此,在HSV-1感染之前,这种基于抑制剂的策略提供了一个强大的工具来抑制HSV-1诱发的自噬通量,这种通量很容易扩展到大量不同的细胞类型和病毒,这也可能导致自噬。
为了克服基于抑制剂的方法(即非特异性脱靶效应)的主要缺点,我们开发了一种基于siRNA的方法来阻止(HSV-1感染)iDC中的自噬性通量。siRNA电穿孔技术代表一种强大的替代策略,通过选择性消融不同蛋白质的表达(即自噬成分)。在我们的实验中,iDC使用电穿孔装置I(见材料表)和Gerer等人(2017年)和Prechtel等人(2007年)描述的改性协议对FIP200特异性siRNA进行电穿孔,以抑制在启动阶段25,26。这种技术使我们能够在iDC中具体敲除FIP200表达,而不会干扰细胞活力及其电穿孔后两天的不成熟表型。值得注意的是,HSV-1感染是在这些电化iDC中建立的,这些电化iDC由有效的病毒蛋白表达所镜像。这种基于siRNA的技术提供了独特的好处(即,各种不同的自噬成分,即使组合在一起),可以专门针对其表达的消融。
在这项研究中,我们进一步描述了一种基于siRNA的方法,在HSV-1感染的mDC中也诱导自噬性通量。在这种情况下,使用电穿孔装置II(参见材料表),在直流成熟前,对KIF1B和KIF2A进行针对的siRNA电镀。由于这两种蛋白质在DC成熟过程中被调节,并且已知对自噬体与裂游体10、18的融合产生负面调节,因此在HSV-1感染后,它们在mDC中具有很强的自噬通量。因此,基于siRNA的技术使我们能够通过干扰mDC中的KIF蛋白表达来专门诱导自噬性周转,从而可以模拟iDC中的表达水平。
总之,我们提出了两种独特的方法来抑制HSV-1感染iDC的自噬性通量。虽然第一种基于抑制剂的方法构成了一种简单、廉价和快速的方式来干扰自噬性降解,但第二种基于siRNA的技术更为具体,是支持和验证基于抑制剂的结果的非常合适的方法。实验。此外,我们描述了一种通过siRNA介导的两种KIF蛋白的敲除,在HSV-1感染的mDC中也诱导自噬性通量的方法。
研究方案
单细胞衍生的DC是由健康捐赠者的白细胞生成产物。为此,得到了当地道德委员会的肯定投票(参考号4556)。本研究的实验是根据"弗里德里希-亚历山大-埃尔兰根-纽伦堡大学"道德委员会的建议进行的(参考文献编号4556)。所有捐助者都批准了书面知情同意,包括根据《赫尔辛基宣言》。
1. 未成熟的树突状细胞(iDC)和成熟树突状细胞(mDC)的生成和处理
- 如前所述,从白细胞减少系统室(LRCs)分离出人类外周血单核细胞(PBMC)。避免对多溴联苯醚进行低温保存,并在隔离时直接使用它们以获得更高的直流产量。
- 在T175细胞培养瓶中从不同健康捐赠者的PBMC中生成人类DC,如前所述10,27。简单地说,在30 mL的直流介质(不含L-谷氨酰胺的RPMI 1640,1%(v/v)AB-血清、100 U/mL青霉素、100毫克/mL链霉素、0.4 mM L-谷氨酰胺、10mM HEPES)中,每细胞培养液中使用350-400万PBMC,用于分离单细胞。1小时后,使用 RPMI 1640 洗去非粘附分数。加入新鲜的直流介质,辅以800 U/mL GM-CSF和250 U/mL IL-4,孵育3天。
- 在第3天粘附后,加入5 mL的新鲜直流介质,含有GM-CSF和IL-4,最终浓度分别为400U/mL和250 U/mL,每个细胞培养瓶,用于直流分化。
- 要收获 iDC,请在第 4 天粘附后从细胞培养瓶底部轻轻冲洗松粘的 iDC。重复此步骤 2 次。对于 mDC 的生成,添加由以下组成的成熟鸡尾酒:GM-CSF(最终浓度:40 U/mL)、IL-4(最终浓度:250 U/mL)、IL-6(最终浓度:1000 U/mL)、IL-1+(最终浓度:200 U/mL)、TNF-α(最终浓度:10纳克/升mL),前列腺素E2(PGE2;最终浓度:1微克/升)。
- 坚持后六天(使用细胞因子鸡尾酒诱导成熟后两天),从细胞培养瓶底部冲洗mDC。重复此步骤两次。
注:不成熟和成熟的DC可以依次从1个细胞培养瓶中的相同捐赠者产生。为此,(i) 使用步骤 1.2.2 中列出的细胞因子鸡尾酒分离适当数量的 iDC 和 (ii) 诱导烧瓶中剩余细胞的成熟。
- 将相应细胞培养基中的 iDC 或 mDC 转移到 50 mL 管中。通过300 x g离心收获细胞5分钟。
- 每细胞培养瓶轻轻重新悬浮(洗涤)在 RPMI 1640 的 5-10 mL 中。将各自的直流悬架组合在一个管中。
- 使用计数室或替代方法定义单元格编号。在处理 iDC 时避免温度变化,以降低型型变化的风险。
2. 流式细胞分析,以监测型型成熟状态
- 将 iDC 或 mDC (0.5 x 106) 从步骤 1.3.1 转移到 1.5 mL 管中。在3390 x g下离心收获细胞1.5分钟。用FACS缓冲液清洗细胞一次(PBS补充2%胎儿小牛血清(FCS)。P为2%。
- 在100μL的抗体染色溶液(FACS缓冲液)中重新悬浮细胞,含有特定的含氟铬标记抗体,针对定义的表面分子。
- 使用以下抗体验证纯度(CD3-FITC、CD14-PE)以及DC的成熟状态(CD80-PacBlue/-PE-Cy5、CD11c-PE-Cy5、CCR7-PE-Cy7、CD83-APC、CD86-PE、MHCII-APC-Cy7)。
- 在 100 μL 的 FACS 缓冲液中制备一个未染色的样品作为对照。
- 在黑暗中将细胞在冰上染色30分钟。
- 随后,在1mL的FACS缓冲液中清洗细胞两次,在3390 x g下用离心机清洗1.5分钟。
- 最后,在200μL的FACS缓冲液中重新悬浮细胞,辅以2%PFA,并通过流式细胞测定分析细胞。固定细胞可在黑暗中储存在4°C下,最多2天。
3. 使用单纯疱疹病毒类型1(HSV-1)的DC的感染程序,以及通过spautin-1或巴菲洛霉素-A1干扰HSV-1诱发的自噬通量
注:本研究中使用的HSV-1/17+/CMV-EGFP/UL43(HSV-1 EGFP)菌株来自实验室菌株HSV-1菌株17+。HSV-1 EGFP菌株表示增强的绿色荧光蛋白(EGFP),该蛋白已插入CMV启动子控制的UL43基因位点。EGFP是HSV-1感染的标记。此外,HSV1-RFPVP26菌株用于DC感染研究(以前在Turan等人中描述,2019年)。这种病毒表达帽状表面蛋白VP26融合到单体红色荧光蛋白(mRFP)。
- 将 iDC 或 mDC (2 x 106) 从步骤 1.3 转移到 2 mL 管中。随后,在3390 x g下将细胞离心1.5分钟,并丢弃上清液。
- 轻轻重新悬浮感染培养基中的细胞(RPMI 1640 补充20 mM HEPES)。
- 为了抑制自噬菌体-脂质层降解途径,在感染前1小时用spautin-1或巴菲洛霉素-A11进行预处理DC。将10μM spautin-1或1μM BA1或DMSO作为未经治疗的对照添加到感染培养基。在300rpm转速下在37°C下孵育电池,在37°C下孵育1小时。
- 对于感染研究,在感染(MOI)为2倍的感染(MOI)中用HSV-1病毒给细胞接种。将相应的MNT缓冲液(30 mM 2-(N-变形)甲酸(MES),100 mM NaCl,20 mM Tris)的相应体积添加为模拟控制。在300rpm转速下在37°C下孵育电池,在37°C下孵育1小时。
- 感染后1小时(hpi),在3390 x g下收集细胞1.5分钟。吸气接种,并轻轻地将含有40 U/mL的转基因CSF、250 U/mL的IL-4和10μM spautin-1、1 μM BA1或DMSO作为对照的DC培养基中的细胞重新悬浮。种子模拟处理和HSV-1感染细胞,最终浓度为1 x 106/mL到6孔板。
- 在16-24 hpi,通过毛利(mDC)或使用细胞刮刀(iDC)收获细胞。将细胞转移到1.5 mL安全锁管中。
- 通过3390 x g离心收集细胞1.5分钟,通过加入1mL的PBS洗涤颗粒一次。
- 在含有29μL 2x Roti-Load、1μL 100 mM MgCl2和12.5 U/mL苯酶的赖酶混合物中大力悬浮细胞。
- 对于使用苯甲酶进行细胞解说和DNA消化,在37°C下孵育样品10分钟。随后,在95°C下变性蛋白质10分钟。
- 执行 SDS-PAGE 和西印子分析,以验证 LC3BI/II、p62、ICP0/5 和 GAPDH 的蛋白质水平。
4. 使用FIP200-siRNA对iDC进行电穿孔,对HSV-1诱导自噬通量的干扰
注:本siRNA电穿孔协议由Prechtel等人(2007年)和Gerer等人(2017年)修改。
- 转移 iDC (12 x 106) 在第 3.5 天后粘附到 50 mL 管中。随后,在300 x g下将细胞离心5分钟,并丢弃上清液。同时,执行流式细胞分析以监控步骤 2 中描述的成熟状态(使用生命/死紫罗兰而不是 CD80-PacBlue)。
- 在不带苯酚红的情况下,在5 mL的OptiMEM中轻轻清洗iDC,在300 x g下将细胞离心5分钟。在200 μL的OptiMEM中,在无苯酚红的情况下,将上清液轻轻重新悬浮,调整6 x 10 6/100 μL的细胞浓度。请勿将细胞放在冰上,避免温度变化。快速移动,避免在OptiMEM中避免长时间潜伏,没有苯酚红。
- 将FIP200特异性siRNA的75pmol或75pmol的炒siRNA作为对照,转移到4毫米电比色皿中,并加入100μL(6x106细胞)的细胞悬浮液。使用电穿孔装置 I 直接脉冲 iDC,应用以下设置:500 V 表示 1 毫秒。
- 在实验程序之前,根据制造商的指示制备siRNA悬浮液,等分并储存在-20°C。使用这些 siRNA 进行电穿孔时,将其解冻并保持在冰上。在电镀样品之前,执行测试脉冲。
- 电穿孔后,直接将 iDC 转移到 6 孔板中,使用新鲜的预加热直流介质(辅以 40 U/mL 的 GM-CSF 和 250 U/mL 的 IL-4)。以1 x 106/mL的最终浓度将细胞播种,并将其放入培养箱中。请勿将电池冲洗出电比色皿。
- 48小时后,首先从微观上检查电镀iDC的形态。然后,使用细胞刮刀收获细胞,并将其转移到15 mL管中。用1mL的PBS冲洗水井,辅以0.01%EDTA,并在相应的管中转移溶液。
- 随后,按后续步骤所述,每 siRNA 条件拆分 6 x 106 iDC。
- 使用 0.5 x 106细胞评估步骤 2 中描述的成熟状态和细胞活力。使用以下抗体:CD11c-PE-Cy5、CCR7-PE-Cy7、CD83-APC、MHCII-APC-Cy7和生命/死紫罗兰。
- 使用 1 x 106细胞进行西印子分析,以验证 FIP200 特定的击倒效率。在3390 x g下离心,将细胞转移到1.5 mL安全锁管中,进行1.5分钟。如步骤3.4所述制备细胞分糖,并进行西印法分析。
- 使用剩余的细胞 (4.5 x 106) 进行 HSV-1 感染实验。对于每个实验条件,将 2.25 x 106 iDC 转移到 2 mL 管中,并在 MOI 为 2 时将其感染 HSV1,或添加 MNT 缓冲区作为模拟控制。执行步骤 3.3 中所述的感染。
- 在 20 hpi 时,使用细胞刮刀收获细胞,并准备细胞液化液,用于步骤 3.4 中所述的西方斑点分析。
5. 使用KIF1B/2A-siRNA电穿孔对HSV-1感染的mDC中自噬菌体-液化菌通路进行调制
- 转移 iDC (24 x 106) 在第 4 天粘接到 50 mL 管中。随后,在300 x g下将细胞离心5分钟,并丢弃上清液。
- 在 8 mL 的 PBS 中轻轻重新悬浮(+ 洗涤)iDC,以调整 3 x 106/mL 的最终细胞浓度。将3 x 106细胞转移到1.5 mL管中,以3390 x g收获细胞1.5分钟。
- 在含有补充混合物的100 μL缓冲液P3中重新悬浮iDC(根据制造商的说明;电穿孔试剂盒装置II)和(i)KIF1B特异性siRNA的75pmol,(ii)KIF2A特异性siRNA的75pmol,或(iii)两者。使用 (iv) 各自数量的炒 siRNA 作为对照。为每个 siRNA 条件准备两个管(6 x 106细胞),并将悬浮液转移到单独的电比色皿中。使用电穿孔装置II直接脉冲iDC应用脉冲"EH-100"。
- 在实验程序之前,根据制造商的指示制备siRNA悬浮液,等分并储存在-20°C。使用这些 siRNA 进行电穿孔时,将其解冻并保持在冰上。请勿将 iDC 放在冰上,避免温度变化。快速前进,避免在 PBS 或缓冲 P3 中长时间孵化 iDC。
- 电穿孔后,将 500 μL 的预加热 RPMI 1640 添加到电比质器中。在孵化器中孵育细胞5-10分钟。将iDC转移到6孔板中,使用新鲜的预加热直流培养基(辅以40U/mL的GM-CSF和250 U/mL的IL-4)。将各自的条件合并成一口井中,在1⁄106/mL的最终浓度下粒细胞,并将其放入培养箱中。
- 孵育后4小时,加入含有步骤1.2.2中所列细胞因子的成熟鸡尾酒。
注:从非电镀DC(1 x 106)制备一个样品,作为电穿孔后2天流式细胞测定分析的控制。处理与电镀样品类似的控制电池。 - 电穿孔后两天,收获电池通过重新悬浮和转移到15 mL管。用 1 mL 的 PBS 冲洗水井,并将悬浮液转移到相应的管中。按以下步骤所述,每 siRNA 条件拆分 6~106个 DC:
- 使用 0.25 x 106 DC(电镀和非电镀)检查成熟状态和细胞活力,如步骤 2 所述。使用以下抗体:CD80-PE-Cy5、CD83-APC、CD86-PE、MHCII-APC-Cy7和生命/死紫罗兰。
- 使用 0.75 x 106细胞进行西式斑点分析,以评估 KIF1B/2A 特定的敲除效率。在3390 x g下离心,将细胞收集到1.5 mL安全锁管中,1.5分钟。
- 使用每个siRNA条件的剩余细胞(5 x 106),并进行HSV-1感染实验。对于每个实验条件,将 2.5 x 106 iDC 转移到 2 mL 管中,并在 MOI 为 2 时用 HSV-1 感染它们,或添加 MNT 缓冲区作为模拟控制。执行步骤 3.3 中所述的感染。
- 在感染后20小时,通过重新悬浮收获细胞,并准备细胞裂解物,用于西方印菌分析,以验证HSV-1诱导自噬周转的诱导,如步骤3.4所述。
结果
在本手稿中,我们描述了干扰树突状细胞中HSV-1诱导自噬的方法。这包括人类单核细胞衍生iDC和mDC的生成,它们通过流动细胞学进行表型分析(图1)。在第4天粘附后,DC表现出一个不成熟的表型,其特点是CD80、CCR7和CD83的表达较弱,以及高CD11c和中间MHCII表达。由于缺少CD3和CD14信号,可以排除T细胞和单核细胞污染。在第6天后依从性(即,第2天诱导成熟)时,DC显示一种成熟的表型,表现为CD80、CCR7、CD83和MHC-II表面表达的显著增加。感染eGFP表达的HSV-1菌株(图2)导致iDC(图2A上面板)或mDC(图2下面板,图2B)几乎完全感染。通过荧光显微镜和流式细胞学分析强 GFP 信号。
正如我们最近的报告所证明的,HSV-1在iDC和mDC中都会引起自噬,然而,自噬的营业额在iDC中只有10个。在第一种方法中,我们用斯巴他丁-1(图3A)治疗iDC和mDC-阻止自噬启动-或巴菲洛霉素-A1(BA1;图3B) - 抑制最终自噬体-结体融合。在无斯普他丁-1和BA1的情况下iDC感染HSV-1时,自噬通量分别由p62和LC3B表达的下降反映出来。相比之下,在无斯普他丁-1的情况下,mDC的HSV-1感染不会影响p62的表达,而斯帕丁-1和BA1治疗则诱导LC3B-II的积累。这反映了自噬的诱导,但mDC中自噬周转的失败。在iDC中,由于在启动阶段抑制自噬,spautin-1预处理在HSV-1感染时强烈恢复p62的自噬性退化。在BA1的预处理中,模拟和HSV-1感染的iDC显示LC3B-II蛋白水平有很强的积累,表明通过阻断晚期自噬体-裂质体融合成功地抑制了自噬性流动。与此一致,对mDC的spautin-1和BA1预处理也分别导致稳定的p62和LC3B-II蛋白水平增加。
在第二种损害自噬性通量的方法中,对针对FIP200的siRNA电穿孔进行了检查,以探讨其阻断HSV-1感染iDC中自噬性通量的能力。如图4A所示,与对照siRNA相比,在iDC48h电穿孔后检测到的FIP200蛋白水平明显降低。此时,iDC没有任何细胞死亡的迹象(图4B),并保持其不成熟的表型(图4C)。FIP200沉默iDC感染HSV-1表明,与对照siRNA治疗的同行相比,自噬通量明显下降(图4D)。当FIP200在HSV-1感染的iDC中静音时,LC3B和p62的蛋白质水平也随之增加。
相反,我们研究了SiRNA介导的KIF1B和KIF2A蛋白表达的消融是否也能在HSV-1感染的mDC中实现自噬菌体-结体体周转。因此,iDC使用特定的siRNA进行电化,针对其中一种或两种蛋白质,细胞随后成熟(图5)。电穿孔后2天,当使用特定的siRNA时,mDC显示KIF1B和/或KIF2A蛋白表达有强烈减少(图5A)。这种方法也既不会导致突出的细胞死亡(图5B),也没有改变其型型成熟状态(图5C)。支持KIF1B和KIF2A在自噬菌体-裂地体降解期间的重要性,在HSV-1感染之前它们的耗竭有助于mDC中自噬通量的增加。这反映在残余p62蛋白质水平下降,与各自的控制条件相反(图5D)。
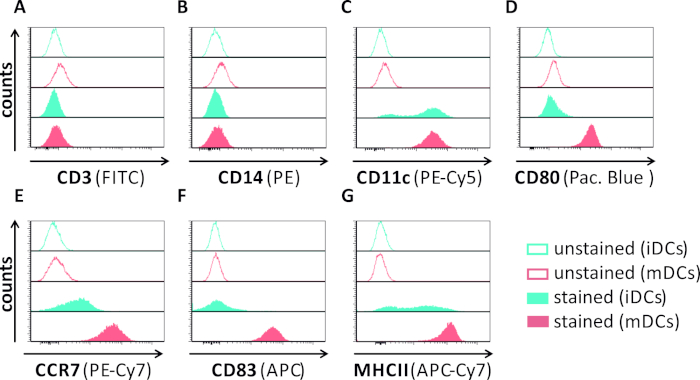
图1:使用流式细胞测定仪对人单核衍生iDC和mDC进行表型表征。产生和染色的DC与特定的抗体,以验证其纯度:(A)CD3排除T细胞污染,(B)CD14排除单核细胞污染,和(C)CD11c作为DC的标记。为了评估其型型成熟状态,使用了以下抗体: (D) CD80, (E) CCR7, (F) CD83 和 (G) MHCII.这些分子在mDC上高度表达,从而允许不成熟和成熟的直流表型之间的区分。使用 FCS 快线 5.0 对数据进行分析。请点击此处查看此图的较大版本。
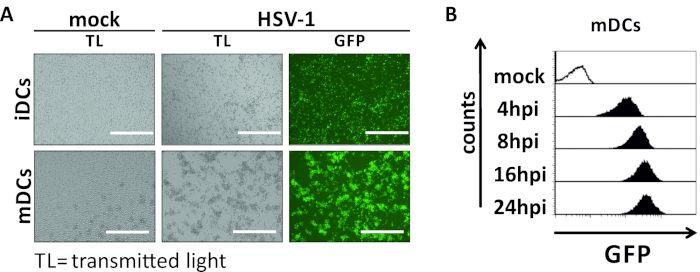
图2:HSV-1感染iDC和mDC的微观和流式细胞学分析。iDC 和 mDC 感染了表达 EGFP (HSV-1 EGFP) 的 HSV-1 菌株,以便根据 GFP 信号对感染率进行量化。(A) 对GFP阳性HSV-1感染的iDC和mDC的微观分析,在MOI为2,与未感染的同行相比,在24 hpi。为了可视化受感染的细胞,对GFP荧光进行了监测。刻度条表示 400 μm (B) 在感染动力学期间对模拟或 HSV-1 感染 mDC 的流量细胞测量。上面板(黑色衬里直方图)显示模拟条件,下面板(黑色填充直方图)显示 HSV-1 感染的细胞后指示的时间点感染后感染。使用 FCS 快线 5.0 对数据进行分析。请点击此处查看此图的较大版本。
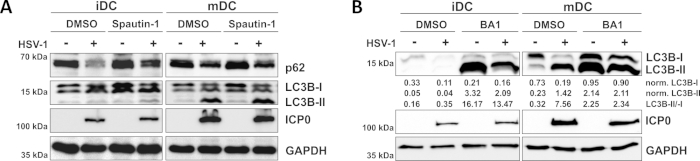
图3:Spautin-1和b阿菲洛霉素-A1调节HSV-1感染iDC的自噬性通量。iDC和mDC在感染前1小时用(A)斯普丁-1或(B)巴菲洛霉素-A1(BA1)治疗。细胞随后被模拟或HSV-1感染(HSV1-RFPVP26),使用MOI为2。16-18小时后,收集DC,对蛋白质裂干物进行西方印迹,以确定p62或LC3B-I/-II作为自噬标记物的表达,ICP0作为感染控制,GAPDH作为载荷控制。使用Bio1D(光学密度)对LC3B-I和LC3B-II蛋白质水平进行量化并归化为参考蛋白GAPDH。显示了标准化LC3B-II与规范化LC3B-I信号的比例。这个数字已经修改和改编自©2019 Turan等人最初发表在JCB。https://doi.org/10.1083/jcb.20180115110.请点击此处查看此图的较大版本。
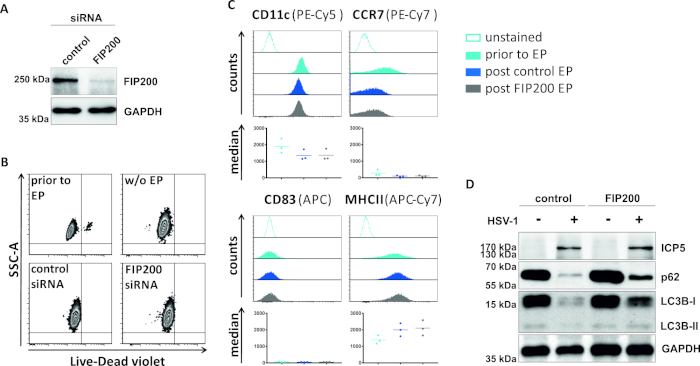
图4:FIP200-siRNA电穿孔时HSV-1感染iDC的自噬通量分析。iDC使用控制siRNA或FIP200特异性siRNA进行电穿孔,通过执行西方污点分析,对FIP200敲除48h后电穿孔的效率进行了电穿孔分析。(B) 在电穿孔(浅蓝色直方图)和48小时柱(深蓝色和灰色直方图)电穿孔之前,通过流式细胞测量分析细胞活力和(C)成熟状态。显示了三个不同捐助者的中值。在确认FIP200和不成熟表型的有效击倒后,使用MOI为2的细胞HSV-1感染(HSV-1EGFP)。使用 FCS 快线 5.0 对数据进行分析。(D) 在感染后20小时,细胞接受西方斑点分析,以确定LC3B-I/-II和p62作为自噬标记物的表达。ICP5 被检测为感染控制,GAPDH 被检测为负载控制。A 和 D 面板已由最初在 JCB © 2019 Turan 等人中进行了修改和改编。https://doi.org/10.1083/jcb.20180115110.请点击此处查看此图的较大版本。
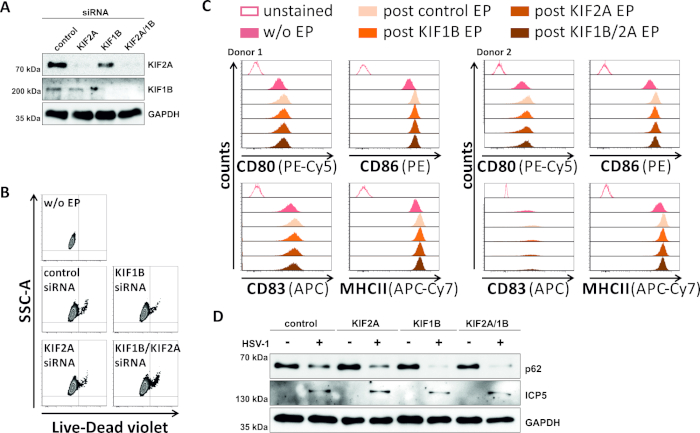
图5:在HSV-1感染的mDC中,siRNA介导的KIF1B和/或KIF2A调节自噬的周转率。iDC使用KIF1B特异性和/或KIF2A特异性siRNA电镀,以及使用电穿孔装置II控制siRNA。在电穿孔后4小时,通过添加成熟鸡尾酒诱导成熟。在电穿孔后48小时,使用流细胞测定分析(A)分析通过西印的KIF敲除效率,(B)细胞的生存能力以及它们的(C)型型成熟状态(两种不同的分析)显示捐赠者)。"w/o EP"是指没有电穿孔,但后诱导成熟;"后控制EP"是指使用控制siRNA进行电穿孔后;"后 KIF1B、KIF2A、KIF1B/2A EP"是指使用KIF1B-和/或KIF2A特异性siRNA进行电穿孔后。在确认有效击倒KIF1B和/或KIF2A和成熟表型后,使用MOI为2的HSV-1感染(HSV-1EGFP)。使用 FCS 快线 5.0 对数据进行分析。(D) 细胞在感染后20小时接受西方斑点分析,以评估p62作为自噬标记物的表达。ICP5用作感染控制,GAPDH用作载荷控制。图A和D已由最初发表在JCB©图兰等人修改和改编。https://doi.org/10.1083/jcb.20180115110.请点击此处查看此图的较大版本。
讨论
本议定书的范围包括:(i) 处理人类单核衍生iDC以及mDC,(ii)他们感染了HSV-1,(iii)使用已知能抑制自噬的化合物进行治疗,以及(iv)使用两种不同的技术设置。使用本协议,自噬通量可以在HSV-1感染的iDC中阻断,也可以在HSV-1感染的mDC中诱导。
由于DC,特别是iDC,是非常脆弱的细胞,处理这些细胞涉及相当微妙的步骤。对于直流发电,我们建议使用新鲜分离的PBMC,并避免其冷冻保存,以获得更高的细胞产量。此外,在实验期间处理 iDC 时,包括其后续培养时,可防止剧烈或长时间的温度变化。否则,iDC 可能会经历表型变化,因此有必要通过流动细胞学来验证其不成熟的表型。请注意,与成熟的同行相比,iDC 缺乏明显的标记,如 CD80、CD83 和 CD8628、29。iDC和mDC感染HSV-1是一个公认的方法2,3,4,5,6,10。我们和其他人表明,当使用 1 或 2 的 MOI 时,DC 极易感染 HSV-1(图 2)。在我们手中,将感染介质的体积保持在低水平(250-350 μL中的1-3 x 106个细胞)将能提高感染效率。
干扰给定独特细胞通路的一种经典方法是使用特定化合物。各种不同的自噬调节剂,即活化剂和抑制剂,目前有30种。关于HSV-1诱导的自噬在DC,图兰等人,(2019年)最近显示了斯普他辛-1和巴菲洛霉素-A1(BA1)对iDC10自噬周转的抑制作用。这种自噬抑制技术适用于与后续HSV-1感染的组合,因为DC(特别是iDC)的感染率和成熟状态均不受影响。在未来的应用中,这种基于抑制剂的方法也可以与其他传染性因子、压力条件(如饥饿)以及不同细胞类型结合使用。然而,当使用抑制剂时,在确定有效自噬抑制的适当浓度时会产生限制,而不会严重影响细胞的生存能力。然而,使用抑制剂时的主要限制是发生潜在的偏离目标或不利影响,这可能导致误导性的结果31,32。
干扰自噬的第二种方法,在本协议中涵盖,是使用siRNA33,34,35进行特定的击倒。一方面,我们使用电穿孔装置I专门抑制FIP200的表达,从而抑制HSV-1在iDC中引起的自噬性周转。另一方面,我们使用电穿孔装置II,使两种不同的KIF蛋白(即KIF1B和KIF2A)静音,以促进HSV-1感染的mDC中的自噬通量。两种电穿孔协议都导致iDC中的FIP200和mDC中的KIF1B/KIF2A几乎完全消融,通过西方印版分析验证(图4A,图5A)。与不影响DC生存能力的电穿孔装置I相比,使用电穿孔装置II的mDC电穿孔会导致死电池的速率略高(图4B,图5B)).因此,在未来的应用中,电穿孔装置I应优先用于iDC和mDC。值得注意的是,这两种基于siRNA的技术,调节自噬性通量,都与随后的HSV-1感染iDC或mDC相容。此外,iDC的不成熟表型和mDC的成熟表型在电穿孔后都没有改变。
使用FIP200特异性siRNA对iDC进行电穿孔是一种高效且高度特异性的解毒方法,在HSV-1感染时抑制自噬通量。除了FIP200的特定沉默,该协议可以适应沉默其他自噬成分,参与在自噬级联期间的不同步骤。然而,确定有效siRNA介导抑制自噬的适当目标包括几个令人关切的问题。首先,自噬相关基因(ATG)的敲除效率不一定与有效抑制自噬有正相关,并且高度依赖于沉默36的特异性ATG蛋白。其次,不同的ATG蛋白还参与不同于自噬的通路,因此它们的消融也可能导致副作用37,38,39。第三,不同的ATG可能具有冗余功能,因此一个组件的敲除可能不足以抑制自噬(例如,贝克林-1和贝林-2)40。
此外,DC的电穿孔装置I基电穿孔协议也适用于mRNA,并可用于各种额外的初级细胞类型,如PBMC25。因此,该系统提供了一个一般策略,将不同的RNA物种输送到不同的原细胞类型。最后,我们提出了两种抑制自噬性通量的规程,要么使用抑制剂或siRNA的方法,结合随后的HSV-1感染iDC。此外,我们描述了一种siRNA电穿孔方法,在HSV-1感染后诱导mDC的自噬通量。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了德国研究理事会(DFG)的支持,该项目授予AS的STE 432/11-1项目,以及医学院的ELAN项目(弗里德里希-亚历山大-埃尔兰根-纽伦堡大学)通过授予LG的项目18-12-21-1。
材料
| Name | Company | Catalog Number | Comments |
| 4D-Nucleofector Core Unit (electroporation apparatus II) | Lonza (Basel, Switzerland) | AAF-1002B | |
| AB-Serum | Sigma Aldrich Chemie GmbH (Steinheim, Germany) | H4522 | Dendritic cell cultivation |
| ACD-A | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | 9007281 | |
| Amaxa P3 Primary Cell 4D-Nucleofector X Kit L (electroporation kit apparatus II) | Lonza (Basel, Switzerland) | V4XP-3024 | |
| Amersham ECL Prime Western Blotting Detection Reagent | GE Healthcare (Solingen, Germany) | RPN2232 | Western Blot Detection |
| Ammonium persulfate (APS) | Sigma Aldrich Chemie GmbH (Steinheim, Germany) | A3678 | |
| anti-mouse-IgG (mouse, polyclonal, HRP) | Cell Signaling (Leiden, Netherlands) | 7076 | Western Blot detection |
| anti-rabbit-IgG (goat, polyclonal, HRP) | Cell Signaling (Leiden, Netherlands) | 7074 | Western Blot detection |
| Bafilomycin A1 | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | tlrl-baf1 | inhibition of autophagy and lysosomal degradation |
| BD FACS Canto II Flow Cytometer | BD Biosciences (Heidelberg, Germany) | 338962 | |
| Benzonase | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | E1014 | |
| Blotting Chamber Fastblot B44 | Biometra (Göttingen, Germany) | 846-015-100 | |
| CCR7 (mouse, Pe-Cy7) | BioLegend (Fell, Germany) | 557648 | Flow cytometry Dilution: 1:100 Clone: G043H7 |
| CD11c (mouse, Pe-Cy5) | BD Biosciences (Heidelberg, Germany) | 561692 | Flow cytometry Dilution: 1:100 Clone: B-ly6 |
| CD14 (mouse, PE) | BD Biosciences (Heidelberg, Germany) | 555398 | Flow cytometry Dilution: 1:100 Clone: M5E2 |
| CD3 (mouse, FITC) | BD Biosciences (Heidelberg, Germany) | 555332 | Flow cytometry Dilution: 1:100 Clone: UCHT1 |
| CD80 (mouse, V450) | BD Biosciences (Heidelberg, Germany) | 560442 | Flow cytometry Dilution: 1:100 Clone: L307.4 |
| CD83 (mouse, APC) | eBioscience Thermo Fisher Scientific (Langenselbold, Germany) | 17-0839-41 | Flow cytometry Dilution: 1:200 Clone: HB15e |
| CD86 (mouse, PE) | BD Biosciences (Heidelberg, Germany) | 553692 | Flow cytometry Dilution: 1:100 |
| EVOS FL Cell Imaging | System AMG/Life Technologies (Carlsbad, USA) | AMF4300 | |
| FIP200 (rabbit) | Cell Signaling (Leiden, Netherlands) | 12436 | Western Blot detection Dilution: 1:1000 Clone: D10D11 |
| GAPDH (mouse) | Merck Millipore (Massachusetts, USA) | AB2302 | Western Blot detection Dilution: 1:5000 Clone: MAB374 |
| Gene Pulser II apparatus (electroporation apparatus I) | BioRad Laboratories GmbH (München, Germany) | 165-2112 | |
| GM-CSF (4x104 U/mL) | Miltenyi Biotec (Bergisch Gladbach, Germany) | 130-093-868 | |
| HLA?DR (mouse, APC-Cy7) | BioLegend (Fell, Germany) | 307618 | Flow cytometry Dilution: 1:200 Clone: L243 |
| HSV-1/17+/CMV-EGFP/UL43 | BioVex | DC infection | |
| ICP0 (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-53070 | Western Blot detection Dilution: 1:1000 Clone: 11060 |
| ICP5 (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-56989 | Western Blot detection Dilution: 1:1000 Clone: 3B6 |
| IL-1β (0.1x106 U/mL) | Cell Genix GmbH (Freiburg, Germany) | 1411-050 | |
| IL-4 (1x106 U/mL) | Miltenyi Biotec (Bergisch Gladbach, Germany) | 130-093-924 | |
| IL-6 (1x106 U/mL) | Cell Genix GmbH (Freiburg, Germany) | 1404-050 | |
| ImageQuant LAS 4000 | GE Healthcare (Solingen, Germany) | 28955810 | |
| KIF1B (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-376246 | Western Blot detection Dilution: 1:1000 Clone: E-12 |
| KIF2A (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-271471 | Western Blot detection Dilution: 1:1000 Clone: D-7 |
| LC3B (rabbit) | Cell Signaling (Leiden, Netherlands) | 3868 | Western Blot detection Dilution: 1:1000 Clone: D11 |
| L-glutamine | Lonza (Basel, Switzerland) | 17-605E | |
| LIVE/DEAD Fixable Violet dead cell stain kit | Life Technologies (Carlsbad, CA, USA) | L34964 | L/D staining in Flow cytometry |
| Lymphoprep | Alere Technologies AS (Oslo, Norway) | 04-03-9391/01 | |
| Magnesiumchloride | Carl Roth GmbH (Karlsruhe, Germany) | A537.1 | |
| Megafuge 2.0 RS | Heraeus (Hanau, Germany) | 75015505 | |
| N, N, N', N'-Tetramethylethylendiamine (TEMED) | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | T9281 | |
| Neubauer counting chamber | Brand (Wertheim, Germany) | 717805 | |
| Nunc Cell culture flasks (175.0 cm2) | Thermo Scientific (Rockford, USA) | 159910 | |
| p62 (rabbit) | Cell Signaling (Leiden, Netherlands) | 88588 | Western Blot detection Dilution: 1:1000 Clone: D5L7G |
| PageRuler prestained protein ladder | Thermo Fisher Scientific (Langenselbold, Germany) | 26616 | |
| Paraformaldehyde, 16 % | Alfa Aesar, Haverhill, USA | 43368.9M | |
| PerfectSpin 24 Plus | Peqlab (Erlangen, Germany) | C2500-R-PL | |
| PGE2 (1 mg/mL) | Pfizer (Berlin, Germany) | BE130681 | |
| Phosphate buffered saline (PBS) | Lonza (Basel, Switzerland) | 17-512F | |
| Protein gel system MiniProtean II | Bio-Rad Laboratories GmbH (München, Germany) | 1652960 | |
| RestoreTM Western Blot Stripping Buffer | Thermo Scientific, Rockford, USA | 21059 | |
| Rocking Platform wt 15 | Biometra (Göttingen, Germany) | 042-590 | |
| RotiBlock | Carl Roth GmbH (Karlsruhe, Germany) | A151.4 | |
| Roti-Load 1 (4x) | Carl Roth GmbH (Karlsruhe, Germany) | K929.3 | |
| Rotiphorese Gel 30 (37.5:1) | Carl Roth GmbH (Karlsruhe, Germany) | 3029.1 | |
| RPMI 1640 | Lonza (Basel, Switzerland) | 12-167F | |
| Sodium dodecyl Sulfate (SDS) | Carl Roth GmbH (Karlsruhe, Germany) | 2326.2 | |
| Thermomixer comfort | Eppendorf (Hamburg, Germany) | 5355 000.011 | |
| TNF-α (10 μg/mL) | Peprotech (Hamburg, Germany) | 300-01A | |
| Tris | Carl Roth GmbH (Karlsruhe, Germany) | 4855.3 | |
| Trypan blue solution (0.4 %) | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | T8154 | |
| Tween 20 | Carl Roth GmbH (Karlsruhe, Germany) | 9127.1 | |
| Whatman 0.2 μm nitrocellulose membrane | GE Healthcare (Solingen, Germany) | 10600001 | |
| WhatmanTM Chromatography Paper 3 mm Chr | Fisher Scientific GmbH (Schwerte, Germany) | 3030917 |
参考文献
- Chapuis, F., Rosenzwajg, M., Yagello, M., Ekman, M., Biberfeld, P., Gluckman, J. C. Differentiation of human dendritic cells from monocytes in vitro. European Journal of Immunology. 27 (2), 431-441 (1997).
- Kummer, M., et al. Herpes simplex virus type 1 induces CD83 degradation in mature dendritic cells with immediate-early kinetics via the cellular proteasome. Journal of Virology. 81 (12), 6326-6338 (2007).
- Kruse, M., et al. Mature dendritic cells infected with herpes simplex virus type 1 exhibit inhibited T-cell stimulatory capacity. Journal of Virology. 74 (15), 7127-7136 (2000).
- Salio, M., Cella, M., Suter, M., Lanzavecchia, A. Inhibition of dendritic cell maturation by herpes simplex virus. European Journal of Immunology. 29 (10), 3245-3253 (1999).
- Prechtel, A. T., et al. Infection of mature dendritic cells with herpes simplex virus type 1 dramatically reduces lymphoid chemokine-mediated migration. Journal of General Virology. 86, 1645-1657 (2005).
- Theodoridis, A. A., Eich, C., Figdor, C. G., Steinkasserer, A. Infection of dendritic cells with herpes simplex virus type 1 induces rapid degradation of CYTIP, thereby modulating adhesion and migration. Blood. 118 (1), 107-115 (2011).
- Cohrs, R. J., Gilden, D. H. Human herpesvirus latency. Brain Pathology. 11 (4), 465-474 (2001).
- Grinde, B. Herpesviruses: latency and reactivation - viral strategies and host response. Journal of Oral Microbiology. 5, (2013).
- Whitley, R. J., Roizman, B. Herpes simplex virus infections. The Lancet. 357 (9267), 1513-1518 (2001).
- Turan, A., et al. Autophagic degradation of lamins facilitates the nuclear egress of herpes simplex virus type 1. The Journal of Cell Biology. 218 (2), 508-523 (2019).
- Takeshige, K., Baba, M., Tsuboi, S., Noda, T., Ohsumi, Y. Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction. The Journal of Cell Biology. 119 (2), 301-311 (1992).
- Yin, Z., Pascual, C., Klionsky, D. J. Autophagy: machinery and regulation. Microbial Cell. 3 (12), 588-596 (2016).
- Bodemann, B. O., et al. RalB and the exocyst mediate the cellular starvation response by direct activation of autophagosome assembly. Cell. 144 (2), 253-267 (2011).
- Bjorkoy, G., et al. p62/SQSTM1 forms protein aggregates degraded by autophagy and has a protective effect on huntingtin-induced cell death. The Journal of Cell Biology. 171 (4), 603-614 (2005).
- Kabeya, Y., et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing. The EMBO Journal. 19 (21), 5720-5728 (2000).
- Kabeya, Y., Mizushima, N., Yamamoto, A., Oshitani-Okamoto, S., Ohsumi, Y., Yoshimori, T. LC3, GABARAP and GATE16 localize to autophagosomal membrane depending on form-II formation. Journal of Cell Science. 117, 2805-2812 (2004).
- Pankiv, S., et al. p62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy. The Journal of Biological Chemistry. 282 (33), 24131-24145 (2007).
- Korolchuk, V. I., Rubinsztein, D. C. Regulation of autophagy by lysosomal positioning. Autophagy. 7 (8), 927-928 (2011).
- Li, Y., et al. A cell-based quantitative high-throughput image screening identified novel autophagy modulators. Pharmacological Research. 110, 35-49 (2016).
- Pampaloni, F., et al. A Novel Cellular Spheroid-Based Autophagy Screen Applying Live Fluorescence Microscopy Identifies Nonactin as a Strong Inducer of Autophagosomal Turnover. SLAS Discovery. 22 (5), 558-570 (2017).
- Deng, Y., Zhu, L., Cai, H., Wang, G., Liu, B. Autophagic compound database: A resource connecting autophagy-modulating compounds, their potential targets and relevant diseases. Cell Proliferation. 51 (3), 12403 (2018).
- Liu, J., et al. Beclin1 controls the levels of p53 by regulating the deubiquitination activity of USP10 and USP13. Cell. 147 (1), 223-234 (2011).
- Mauvezin, C., Neufeld, T. P. Bafilomycin A1 disrupts autophagic flux by inhibiting both V-ATPase-dependent acidification and Ca-P60A/SERCA-dependent autophagosome-lysosome fusion. Autophagy. 11 (8), 1437-1438 (2015).
- Yoshimori, T., Yamamoto, A., Moriyama, Y., Futai, M., Tashiro, Y. Bafilomycin A1, a specific inhibitor of vacuolar-type H(+)-ATPase, inhibits acidification and protein degradation in lysosomes of cultured cells. Journal of Biological Chemistry. 266 (26), 17707-17712 (1991).
- Gerer, K. F., Hoyer, S., Dorrie, J., Schaft, N. Electroporation of mRNA as Universal Technology Platform to Transfect a Variety of Primary Cells with Antigens and Functional Proteins. Methods in Molecular Biology. 1499, 165-178 (2017).
- Prechtel, A. T., Turza, N. M., Theodoridis, A. A., Steinkasserer, A. CD83 knockdown in monocyte-derived dendritic cells by small interfering RNA leads to a diminished T cell stimulation. The Journal of Immunology. 178 (9), 5454-5464 (2007).
- Pfeiffer, I. A., et al. Leukoreduction system chambers are an efficient, valid, and economic source of functional monocyte-derived dendritic cells and lymphocytes. Immunobiology. 218 (11), 1392-1401 (2013).
- Villadangos, J. A., Heath, W. R. Life cycle, migration and antigen presenting functions of spleen and lymph node dendritic cells: limitations of the Langerhans cells paradigm. Seminars in Immunology. 17 (4), 262-272 (2005).
- Lechmann, M., Berchtold, S., Hauber, J., Steinkasserer, A. CD83 on dendritic cells: more than just a marker for maturation. Trends in Immunology. 23 (6), 273-275 (2002).
- Yang, Y. P., et al. Application and interpretation of current autophagy inhibitors and activators. Acta Pharmacologica Sinica. 34 (5), 625-635 (2013).
- Redmann, M., et al. Inhibition of autophagy with bafilomycin and chloroquine decreases mitochondrial quality and bioenergetic function in primary neurons. Redox Biology. 11, 73-81 (2017).
- Yan, Y., et al. Bafilomycin A1 induces caspase-independent cell death in hepatocellular carcinoma cells via targeting of autophagy and MAPK pathways. Scientific Reports. 6, 37052 (2016).
- Hale, C. M., et al. Identification of modulators of autophagic flux in an image-based high content siRNA screen. Autophagy. 12 (4), 713-726 (2016).
- Lipinski, M. M., et al. A genome-wide siRNA screen reveals multiple mTORC1 independent signaling pathways regulating autophagy under normal nutritional conditions. Developmental Cell. 18 (6), 1041-1052 (2010).
- Orvedahl, A., et al. Image-based genome-wide siRNA screen identifies selective autophagy factors. Nature. 480 (7375), 113-117 (2011).
- Staskiewicz, L., Thorburn, J., Morgan, M. J., Thorburn, A. Inhibiting autophagy by shRNA knockdown: cautions and recommendations. Autophagy. 9 (10), 1449-1450 (2013).
- Lee, I. H., et al. Atg7 modulates p53 activity to regulate cell cycle and survival during metabolic stress. Science. 336 (6078), 225-228 (2012).
- Fremont, S., Gerard, A., Galloux, M., Janvier, K., Karess, R. E., Berlioz-Torrent, C. Beclin-1 is required for chromosome congression and proper outer kinetochore assembly. EMBO Reports. 14 (4), 364-372 (2013).
- Bestebroer, J., V'kovski, P., Mauthe, M., Reggiori, F. Hidden behind autophagy: the unconventional roles of ATG proteins. Traffic. 14 (10), 1029-1041 (2013).
- Galluzzi, L., Kroemer, G. Common and divergent functions of Beclin 1 and Beclin 2. Cell Research. 23 (12), 1341-1342 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。