Method Article
L'elettroporazione di siRNA alla modulazione dell'autofagia nell'herpes Simplex Virus Tipo 1-Infected Monocyte-Derived Dendritic Cells
In questo articolo
Riepilogo
In questo studio, presentiamo strategie basate su inibitori e siRNA per interferire con il flusso autofagico nel virus Herpes simplex di tipo 1 (HSV-1) -infettato monocite-derivato cellule.
Abstract
Il virus herpes simplex di tipo 1 (HSV-1) induce l'autofagia in entrambe le cellule dendritiche immature (iDC) e le cellule dendritiche mature (mDC), mentre il flusso autofagico è osservato solo negli iDC. Per ottenere informazioni meccanicistiche, abbiamo sviluppato strategie efficienti per interferire con il turnover autofagico indotto da HSV-1. Una strategia basata sugli inibitori, per modulare l'autofagia indotta da HSV-1, costituisce la prima scelta, poiché è un metodo facile e veloce. Per aggirare potenziali effetti fuori bersaglio non specifici di tali composti, abbiamo sviluppato una strategia alternativa basata sul siRNA, per modulare il turnover autofagico negli iDC in caso di infezione da HSV-1. Infatti, l'elettroporazione degli iDC con siRNA FIP200-specifico prima dell'infezione da HSV-1 è un metodo molto specifico e efficace per ablate l'espressione della proteina FIP200 e quindi per inibire il flusso autofagico. Entrambi i metodi presentati si traducono nell'efficiente inibizione del turnover autofagico indotto da HSV-1 negli iDC, per cui la tecnica basata sul siRNA è più specifica del target. È stato sviluppato un ulteriore approccio basato sul siRNA per silenziare selettivamente l'espressione proteica di KIF1B e KIF2A, facilitando il turnover autofagico in caso di infezione da HSV-1 negli mDC. In conclusione, la tecnica dell'elettroporazione del siRNA rappresenta una strategia promettente, per ablate selettivamente l'espressione di proteine distinte e per analizzare la loro influenza su un'infezione da HSV-1.
Introduzione
La generazione di cellule dendritiche derivate da monciti umani costituisce un modello in vitro appropriato per studiare le funzioni e la biologia di questo importante tipo di cellule immunitarie. L'isolamento e la differenziazione dei monociti nei controller di dominio sono stati ben consolidati negli ultimi anni1,2. L'infezione di DCs con il virus dell'herpes simplex di tipo 1 (HSV-1) funge da sistema modello per studiare modulazioni mediate da HSV-1 della biologia DC2,3,4,5,6 . Ciò è particolarmente importante per chiarire come l'herpesvirus smorzare o inibire le potenti risposte immunitarie antivirali, per stabilire la latenza nelle nicchie immuno-privilegiate all'interno dell'ospite7,8. A questo proposito, gli herpesvirus sono patogeni di grande successo che si diffondono in tutta la popolazione raggiungendo una sieroprevalenza fino al 90 % secondo la regione geografica9. Per comprendere ed eventualmente prevenire questo, sono necessarie ulteriori informazioni sulle modulazioni mediate da HSV-1 del sistema immunitario dell'ospite, e in particolare delle cellule immunitarie come i DC.
Un'osservazione completamente nuova per quanto riguarda l'interazione di DC con HSV-1 è stata recentemente pubblicata da Turan et al.10. Gli autori hanno dimostrato che la realizzazione della replica HSV-1 dipende strettamente dallo stato di maturazione dei controller di dominio. Negli iDC, la replica completa dell'HSV-1 è facilitata da meccanismi dipendenti dall'autofagia. Mentre HSV1 induce l'autofagia in entrambi, iDC e mDC, il flusso autofagico è osservato solo negli iDC. Questo a sua volta facilita l'uscita nucleare di capsidi virali attraverso la degradazione autofagica delle lamins nucleari negli iDC. Per ottenere informazioni meccanicistiche su questo percorso di degradazione indotta da HSV-1 negli iDC rispetto agli MDC, nuove ed efficienti strategie sono fondamentali per studiare il flusso autofagico.
La macroautofagia (autofagia) è un processo multifase ben conservato che si rivolge a proteine intracellulari o organelli interi per la digestione lsosomica11. In modo semplicistico, l'autofagia può essere divisa nella (i) iniziazione, nella nucleazione della membrana (ii), nell'espansione (iii) della vescica e nella (iv) fase di fusione autofagosomi-lisonia-lisonzo-lisonia12. Durante l'iniziazione (i), componenti come il complesso di chinasi ULK1/2 attivato, contenente la proteina della famiglia di annessione focale di 200 kD (FIP200), sono fondamentali per attivare il complesso beclin-1-Vps34-AMBRA1. Successivamente, la nucleazione della membrana (ii) avvia la formazione dei fagofori13, che avvolge carichi citoplasmici che sono contrassegnati da molecole come p6214. Durante l'espansione del vescicolo e la maturazione dell'autofagoforo (iii) la catena di luce proteica associata ai microtubuli 3 (LC3)-I viene convertita nella sua forma lipidata LC3-II che viene inserita nella membrana autophagosomica. Così, i tassi di conversione da LC3-I a -II sono un indicatore per l'induzione dell'autofagia rispecchiando la formazione di autofagosomi maturi15,16. Al momento della fusione autofagosomia-lisosoma (iv), non solo il carico autofagico, ma anche le proteine p62 e LC3-II associate subiscono una degradazione (ad esempio, per idrolisi). Così, la perdita di p62 e LC3-II servono come marcatori per il flusso autofagico17. La fusione degli autofagosomi con i lisosomi, e quindi dopo il turnover autofagico, è fortemente dipendente dalla localizzazione lisosomica intracellulare. Questo è, tra gli altri, regolato dai membri della famiglia kinesin KIF1B e KIF2A, che hanno dimostrato di influenzare negativamente autofasome-lysososome fusion18. È interessante notare che l'espressione proteica di KIF1B e KIF2A è indotta dalla maturazione DC ed è quindi responsabile dell'inefficiente flusso autofagico negli mDC infettati da HSV-1, che ostacola la replica HSV-11.
I tentativi sperimentali di modulare l'autofagia includono l'uso di composti noti per indurre o inibire questo particolare percorso19,20,21. In questo studio, descriviamo due strategie basate sugli inibitori per bloccare il turnover autofagico negli iDC infettati da HSV-1. Il primo composto utilizzato nei nostri esperimenti è specifico e potente autofagia inibitore-1 (spautin-1), che è stato descritto per promuovere beclin-1-Vps34-AMBRA1 complesso degradazione durante la fase di avvio di autofagia22. Il secondo composto utilizzato nel presente studio è la bafilomicina-A1 (BA1), un inibitore di V-ATPase che blocca gli eventi tardi autofagici (cioè, la fusione autofagososo-lysososoo così come l'acidificazione autolimposo)23, 24. L'uso di uno di questi due inibitori prima dell'infezione da iDC con HSV-1 inibisce potentemente l'autofagia, ma non disturba l'espressione genica virale efficiente. Così, questa strategia basata su inibitori prima dell'infezione da HSV-1 offre un potente strumento per inibire il flusso autofagico indotto da HSV-1 che può essere facilmente ampliato per una pletora di diversi tipi di cellule e virus, che potenzialmente inducono anche l'autofagia.
Per superare un importante svantaggio di un approccio basato sugli inibitori (cioè effetti non specifici fuori bersaglio), abbiamo sviluppato un metodo basato sul siRNA per bloccare gli iDC autofagici (infettati da HSV-1). La tecnica dell'elettroporazione del siRNA rappresenta una potente strategia alternativa, attraverso l'ablazione selettiva dell'espressione di proteine distinte (cioè componenti autofagici). Nei nostri esperimenti gli iDC sono stati elettroporate con siRNA specifico FIP200 utilizzando l'apparato di elettroporazione I (vedi Tabella dei materiali)e un protocollo modificato descritto da Gerer et al. (2017) e Prechtel et al. (2007), per inibire l'autofagia fase di avvio25,26. Questa tecnica ci ha permesso di abbattere specificamente l'espressione FIP200 negli iDC, senza interferire con la vitalità cellulare e il loro fenotipo immaturo due giorni dopo l'elettroporazione. Degno di nota, l'infezione da HSV-1 è stata stabilita in questi iDC elettroporate rispecchiati da un'efficiente espressione proteica virale. Questa tecnica basata sul siRNA offre un vantaggio unico (cioè, che una varietà di diversi componenti autofagici, anche in combinazione), può essere specificamente mirata per l'ablazione della loro espressione.
In questo studio, descriviamo ulteriormente un metodo basato su siRNA per indurre il flusso autofagico anche negli mDC infettati da HSV-1. In questo caso, gli IDC sono stati elettroporati con siRNA mirati contro KIF1B e KIF2A prima della maturazione DC utilizzando l'apparato di elettroporazione II (vedi Tabella dei materiali). Poiché entrambe le proteine sono regolate durante la maturazione DC e sono note per regolare negativamente la fusione degli autofagosomi con linfonosi10,18, il loro abbattimento del flusso autofagico fortemente indotto in mDC su infezione da HSV-1. Pertanto, la tecnica basata sul siRNA ci ha permesso di indurre specificamente il turnover autofagico interferendo con l'espressione della proteina KIF nei mDC, e potrebbe quindi imitare i loro livelli di espressione negli iDC.
In sintesi, presentiamo due metodi distinti per inibire il flusso autofagico negli iDC infettati da HSV-1. Mentre il primo approccio basato sugli inibitori costituisce un modo semplice, economico e veloce per interferire con la degradazione autofagica, la seconda tecnica basata su siRNA è più specifica e un metodo molto adatto per sostenere e verificare i risultati della Esperimenti. Inoltre, descriviamo un metodo per indurre il flusso autofagico anche negli MDC infettati da HSV-1, attraverso il knockdown mediato dal siRNA di due proteine KIF.
Protocollo
I DC derivati da monociti sono stati generati da prodotti di leukaferesi di donatori sani. Per questo è stato ottenuto un voto positivo da parte del comitato etico locale (numero di riferimento 4556). Gli esperimenti del presente studio sono stati eseguiti in conformità con le raccomandazioni del comitato etico del "Friedrich-Alexander-Universitat Erlangen-Norimberga" (numero di riferimento 4556). Tutti i donatori hanno approvato un consenso informato scritto, compreso il conforme alla Dichiarazione di Helsinki.
1. Generazione e gestione di cellule dendritiche immature (iDC) e cellule dendritiche mature (mDC)
- Isolare le cellule mononucleari del sangue periferico umano (PBMC) dalle camere di sistema di leucoriduzione (LRS) come descritto in precedenza27. Evitare la crioconservazione dei PBMC e utilizzarli direttamente in isolamento per ottenere rendimenti DC più elevati.
- Generare controller di dominio umano da PBMC di diversi donatori sani in flaconi di coltura cellulare T175 come descritto in precedenza10,27. In breve, utilizzare 350-400 milioni di PBMC in 30 mL di mezzo DC (RPMI 1640 senza L-glutamine, 1% (v/v) AB-siero, 100 U/mL penicillina, 100 mg/mL streptomicina, 0,4 mM L-glutamine, 10 m HEPES) per fiaschecoltura cellulare per l'isolamento dei monociti per aderenza. Dopo 1 h, lavare la frazione non aderente utilizzando RPMI 1640. Aggiungere il nuovo mezzo DC integrato con 800 U/mL GM-CSF e 250 U/mL IL-4 e incubare per 3 giorni.
- Il giorno 3 post aderenza, aggiungere 5 mL di fresco mezzo DC contenente GM-CSF e IL-4 con una concentrazione finale di 400 U/mL e 250 U/mL per fiaschetta di coltura cellulare, rispettivamente, per la differenziazione DC.
- Per raccogliere gli IDC, risciacquare delicatamente gli IDC liberamente aderenti dal fondo del flacone di coltura cellulare, il giorno 4 dopo l'aderenza. Ripetere questo passaggio 2 volte. Per la generazione di mDC, aggiungere cocktail di maturazione composto come segue: GM-CSF (concentrazione finale: 40 U/mL), IL-4 (concentrazione finale: 250 U/mL), IL-6 (concentrazione finale: 1000 U/mL), IL-1 (concentrazione finale: 200 U/mL), TNF-z (concentrazione finale: 10 ng/ mL), prostaglandin E2 (PGE2; concentrazione finale: 1 g/mL).
- Sei giorni dopo l'aderenza (due giorni dopo l'induzione della maturazione utilizzando un cocktail di citochine), risciacquare gli mDC dal fondo del flacone della coltura cellulare. Ripetere questo passaggio due volte.
NOTA: i controller di dominio immaturi e maturi possono essere generati in sequenza da donatori identici in una fiaschetta di coltura cellulare. Per farlo, (i) separare il numero appropriato di iDC e (ii) indurre la maturazione delle cellule rimanenti nei flaconi utilizzando il cocktail di citochina elencato al punto 1.2.2.
- Trasferire iDC o mDC nel rispettivo mezzo di coltura cellulare in tubi da 50 mL. Raccogliere le cellule tramite centrifugazione a 300 x g per 5 min.
- Resospendere delicatamente i controller di dominio in 5-10 mL di RPMI 1640 per fiaschetta di coltura cellulare. Combinare le rispettive sospensioni DC in un unico tubo.
- Definire il numero di cella utilizzando una camera di conteggio o un metodo alternativo. Evitare alterazioni della temperatura durante la manipolazione degli iDC, per ridurre il rischio di cambiamenti fenotipici.
2. Analisi citometriche di flusso per monitorare lo stato di maturazione fenotipica
- Trasferire iDC o mDC (0,5 x 106) dal passaggio 1.3.1 a un tubo da 1,5 mL. Raccogliere le cellule tramite centrifugazione a 3390 x g per 1,5 min. Lavare le cellule una volta con TAC buffer (PBS integrato con 2% siero di vitello fetale (FCS)).
- Risospendere le cellule in 100 . . . l di soluzione di colorazione degli anticorpi (FACS buffer) contenente anticorpi specifici con etichetta fluorocromo contro molecole di superficie definite.
- Utilizzare i seguenti anticorpi per verificare la purezza (CD3-FITC, CD14-PE) e lo stato di maturazione dei VAN (CD80-PacBlue/-PE-Cy5, CD11c-PE-Cy5, CCR7-PE-Cy7, CD83-APC, CD86-PE, MHCII-APC-Cy7).
- Preparare un campione non colorato in 100 l di TAC buffer come controllo.
- Macchiare le cellule sul ghiaccio al buio per 30 min.
- Successivamente lavare le cellule due volte in 1 mL di tampone FACS e centrifugare a 3390 x g per 1,5 min.
- Infine, risospendere le cellule in 200 : L di TAC buffer integrato con 2% PFA e analizzare le cellule per citometria di flusso. Le celle fisse possono essere conservate al buio fino a 2 giorni.
3. Procedura di infezione di DC con virus Herpes simplex tipo-1 (HSV-1) e interferenza del flusso autofagico indotto da HSV-1 tramite spautin-1 o bafilomycin-A1
NOTA: il ceppo HSV-1/17/CMV-EGFP/UL43 (HSV-1 EGFP) utilizzato in questo studio è stato ottenuto dal ceppo di laboratorio HSV-1 ceppo 17. Il ceppo HSV-1 EGFP esprime la proteina fluorescente verde potenziata (EGFP) che è stata inserita nel locus genico UL43 sotto il controllo del promotore CMV. EGFP serve come marcatore per l'infezione da HSV-1. Inoltre, il ceppo HSV1-RFPVP26 è stato utilizzato per gli studi sulle infezioni dc (precedentemente descritto in Turan et al., 2019). Questo virus esprime la proteina superficiale del capside VP26 fusa alla proteina fluorescente rossa monomero (mRFP).
- Trasferire iDC o mDC (2 x 106) dal passaggio 1,3 in un tubo da 2 mL. Successivamente, centrifugare le cellule a 3390 x g per 1,5 min e scartare il supernatante.
- Respendere delicatamente le cellule nel mezzo di infezione (RPMI 1640 integrato con 20 m HEPES).
- Per inibire il percorso di degradazione autofrosomico-lisosomiale, pre-trattare DC con spautin-1 o bafilomicina-A1 1 h prima dell'infezione. Aggiungete al mezzo di infezione 10 spautin-1 o 1 BA1, o DMSO, come controllo non trattato. Incubare le cellule in un blocco di riscaldamento a 300 giri/min trem a 37 gradi centigradi per 1 h.
- Per gli studi sulle infezioni, inoculare le cellule con virioni HSV-1 ad una molteplicità di infezione (MOI) di 2. Aggiungere il rispettivo volume di mNT buffer (30 mM 2-(N-morpholino)ethanesulfonic acid (MES), 100 mM NaCl, 20 mM Tris) come controllo fittizio. Incubare le cellule in un blocco di riscaldamento a 300 giri/min trem a 37 gradi centigradi per 1 h.
- 1 h dopo l'infezione (hpi), raccogliere le cellule a 3390 x g per 1,5 min. Aspirate inoculum e risospendere delicatamente le cellule nel mezzo DC contenente 40 U/mL di GM-CSF, 250 U/mL di IL-4 e 10 spautin-1, 1 . Cellule infette e cellule infette da semi trattati in modo fittizio e HSV-1-infettati ad una concentrazione finale di 1 x 106/mL in una piastra a 6 pozze.
- A 16-24 hpi, raccogliere le cellule risciacquando (MDC) o utilizzando un raschietto cellulare (iDC). Trasferire le celle in un tubo di sicurezza da 1,5 ml.
- Raccogliere le cellule con centrifugazione a 3390 x g per 1,5 min e lavare il pellet una volta aggiungendo 1 mL di PBS.
- Risospendere vigorosamente le cellule nella collezione di lisi contenenti 29 , l'l di 2x Roti-Load, 1 .L 100 mM MgCl2 e 12.5 U/mL benzonase.
- Per la lisi cellulare e la digestione del DNA usando il benzonasi, incubare i campioni a 37 gradi centigradi per 10 min. Successivamente, denaturare le proteine a 95 gradi centigradi per 10 min.
- Eseguire analisi delle macchie SDS-PAGE e Western per verificare i livelli proteici di LC3BI/II, p62, ICP0/5 e GAPDH.
4. Interferenza del flusso autofagico indotto da HSV-1 tramite elettroporazione di iDC utilizzando FIP200-siRNA
NOTA: L'attuale protocollo per l'elettroporazione del siRNA è stato modificato da Prechtel et al. (2007) e Gerer et al. (2017).
- Trasferire iDC (12 x 106) al giorno 3.5 post aderenza in un tubo da 50 mL. Successivamente, centrifugare le cellule a 300 x g per 5 min e scartare il supernatante. Parallelamente, eseguire l'analisi citometrica del flusso per monitorare lo stato di maturazione come descritto nel passaggio 2 (Utilizzare Violet vita/morto invece di CD80-PacBlue).
- Lavare delicatamente gli iDC in 5 mL di OptiMEM senza fenolo rosso e centrificare le cellule a 300 x g per 5 min. Scartare gli iDC sovralimentati erattivare delicatamente gli IDC in 200 . Non posizionare le cellule sul ghiaccio ed evitare alterazioni della temperatura. Andare avanti rapidamente ed evitare lunghi periodi di incubazione di iDC in OptiMEM senza rosso fenolo.
- Trasferire 75 pmol di siRNA specifico FIP200 o 75 pmol di siRNA strapazzato, sotto il controllo, in elettrocuvette da 4 mm e aggiungere 100 l (6x106 cellule) della sospensione cellulare. Gli iDI a impulsi diretto utilizzando l'apparato di elettroporazione I, applicando le seguenti impostazioni: 500 V per 1 ms.
- Prima della procedura sperimentale, preparare le sospensioni siRNA secondo le istruzioni del produttore e conservarle a -20 gradi centigradi. Scongelare e tenerli sul ghiaccio quando si utilizzano questi siRNA per l'elettroporazione. Prima di elettroporare i campioni, eseguire un impulso di prova.
- Dopo l'elettroporazione, trasferire direttamente iDC in piastre a 6 pozze con mezzo DC preriscaldato fresco (integrato con 40 U/mL di GM-CSF e 250 U/mL di IL-4). Semina le cellule ad una concentrazione finale di 1 x 106/mL e le metti in un'incubatrice. Non sciacquare le cellule dall'elettrocuvette.
- Dopo 48 h, esaminare prima la morfologia degli iDC elettroporate microscopicamente. Quindi, raccogliere le cellule utilizzando uno scrapper cellulare e trasferirle in tubi da 15 mL. Sciacquare i pozzi con 1 mL di PBS integrati con 0.01% EDTA e trasferire la soluzione nei rispettivi tubi.
- Successivamente, dividere 6 x 106 iDC per condizione di siRNA come descritto nei passaggi successivi.
- Utilizzare 0,5 x 106 celle per valutare lo stato di maturazione e la fattibilità delle cellule come descritto nel passaggio 2. Usa i seguenti anticorpi: CD11c-PE-Cy5, CCR7-PE-Cy7, CD83-APC, MHCII-APC-Cy7 e Life/Dead violet.
- Utilizzare 1 x 106 celle per le analisi delle macchie occidentali per verificare l'efficienza del knockdown specifico di FIP200. Trasferire e raccogliere le cellule in un tubo di sicurezza da 1,5 ml mediante centrifugazione a 3390 x g per 1,5 min. Preparare le lingue cellulari come descritto al punto 3.4 ed eseguire analisi delle macchie occidentali.
- Utilizzare le cellule rimanenti (4,5 x 106) per gli esperimenti di infezione da HSV-1. Per ogni condizione sperimentale, trasferire 2,25 x 106 iDC in tubi da 2 mL e infettarli con HSV1 a un MOI di 2 o aggiungere il buffer MNT come controllo fittizio. Eseguire l'infezione come descritto al punto 3.3.
- A 20 hpi, raccogliere le cellule utilizzando un raschietto cellulare e preparare le persone a lesicella per le analisi occidentali delle macchie, come descritto al punto 3.4.
5. Modulazione della via autofagoso-lisoniano nei mDC infettati da HSV-1 utilizzando l'elettroporazione KIF1B/2A-siRNA
- Trasferire iDC (24 x 106) al giorno 4 post aderenza in un tubo da 50 mL. Successivamente, centrifugare le cellule a 300 x g per 5 min e scartare il supernatante.
- Resospendere delicatamente gli iDC in 8 mL di PBS, per regolare una concentrazione finale delle celle di 3 x 106 /mL. Trasferire 3 x 106 cellule in tubi da 1,5 mL e raccogliere le cellule a 3390 x g per 1,5 min.
- Risospendere gli iDC in 100 o L di tampone P3 contenente il mix di supplemento (secondo le istruzioni del produttore; apparato iI del kit di elettroporazione elettronica) e (i) 75 pmol di siRNA specifico di KIF1B, (ii) 75 pmol di siRNA specifico di KIF2A, o (iii) entrambi. Utilizzare (iv) la rispettiva quantità di siRNA strapazzato come controllo. Preparare due tubi per ogni condizione di siRNA (6 x 106 cellule) e trasferire le sospensioni in elettrocuvette separate. Gli iDC a impulsi diretti applicando l'impulso "EH-100" utilizzando l'apparato di elettroporazione II.
- Prima della procedura sperimentale, preparare le sospensioni siRNA secondo le istruzioni del produttore e conservarle a -20 gradi centigradi. Scongelare e tenerli sul ghiaccio quando si utilizzano questi siRNA per l'elettroporazione. Non posizionare gli iDC sul ghiaccio ed evitare alterazioni della temperatura. Passare rapidamente ed evitare lunghe incubazioni di iDC in PBS o buffer P3.
- Subito dopo l'elettroporazione, aggiungere 500 l di RPMI 1640 preriscaldato alle elettrocuvette. Incubare le cellule in un'incubatrice per 5-10 min. Trasferire iDC in piastre a 6 pozze con mezzo DC preriscaldato fresco (completato con 40 U/mL di GM-CSF e 250 U/mL di IL-4). Combinare le rispettive condizioni in un unico pozzo, semina le cellule ad una concentrazione finale di 1/106/ mL e metterle in un'incubatrice.
- 4 h dopo l'incubazione, aggiungere il cocktail di maturazione contenente le citochine elencate al punto 1.2.2.
NOTA: Preparare un campione da DC non elettropotorati (1 x 106) come controllo per le analisi citometriche di flusso 2 giorni dopo l'elettroporazione. Trattare le cellule di controllo analogamente a campioni elettropotati. - Due giorni dopo l'elettroporazione, raccogliere le cellule per sospensione e trasferimento in tubi da 15 mL. Sciacquare i pozze con 1 mL di PBS e trasferire le sospensioni nei rispettivi tubi. Dividere 6-106 CONTROLLER per condizione di siRNA come descritto nei seguenti passaggi:
- Utilizzare 0,25 x 106 DC (elettroporate e non elettroporate) per verificare lo stato di maturazione e la fattibilità cellulare come descritto al punto 2. Usa i seguenti anticorpi: CD80-PE-Cy5, CD83-APC, CD86-PE, MHCII-APC-Cy7 e Life/Dead violet.
- Utilizzare 0,75 x 106 celle per le analisi delle macchie occidentali per valutare l'efficienza del knockdown specifico di KIF1B/2A. Raccogliere le cellule in un tubo di sicurezza da 1,5 ml mediante centrifugazione a 3390 x g per 1,5 min. Preparare i listi cellulari come descritto nel passaggio 3.4 ed eseguire analisi delle macchie occidentali.
- Utilizzare le cellule rimanenti (5 x 106) da ogni condizione di siRNA ed eseguire esperimenti di infezione da HSV-1. Per ogni condizione sperimentale, trasferire 2,5 x 106 iDC in tubi da 2 mL e infettarli con HSV-1 a un MOI di 2 o aggiungere il buffer MNT come controllo fittizio. Eseguire l'infezione come descritto al punto 3.3.
- A 20 h dopo l'infezione, raccogliere le cellule con sospensione e preparare listi cellulari per le analisi occidentali delle macchie per verificare l'induzione del turnover autofagico indotto da HSV-1, come descritto in precedenza nel passaggio 3.4.
Risultati
In questo manoscritto, descriviamo i metodi per interferire con l'autofagia indotta da HSV-1 nelle cellule dendritiche. Ciò include la generazione di iDC e MC derivati da monciti umani, che sono stati analizzati fenotipicamente dalla citometria di flusso (Figura 1). Il giorno 4 dopo l'aderenza, i controller di dominio mostrano un fenotipo immaturo caratterizzato da un'espressione debole di CD80, CCR7 e CD83, nonché da un'alta espressione CD11c e MHCII intermedia. Poiché mancano i segnali CD3 e CD14, le contaminazioni delle cellule T e dei monociti possono essere escluse. Il giorno 6 post aderenza (cioè, giorno 2 post induzione della maturazione), i DC mostrano un fenotipo maturo riflesso da un aumento significativo dell'espressione di superficie CD80, CCR7, CD83 e MHC-II. L'infezione con un ceppo HSV-1 espresso da eGFP (Figura 2) comporta un'infezione quasi completa di iDC(Figura 2A pannello superiore) o mDC(Figura 2A pannello inferiore, Figura 2B), basata su forti segnali GFP analizzati dalla microscopia a fluorescenza e dalla citometria di flusso.
Come dimostrato nel nostro recente rapporto, HSV-1 induce l'autofagia sia in iDC e mDC, tuttavia, fatturato autofagico si verifica in iDC solo10. In un primo approccio, abbiamo trattato iDC e mDC con spautin-1 (Figura 3A) - per bloccare l'inizio dell'autofagia - o bafilomycin-A1 (BA1; Figura 3B) - per inibire la fusione autofagosomica-lisonia finale. Dopo l'infezione da HSV-1 di iDC in assenza di spautin-1 e BA1, il flusso autofagico è rispecchiato dal declino dell'espressione p62 e LC3B, rispettivamente. Al contrario, l'infezione da HSV-1 di mDC in assenza di spautin-1 non influisce sull'espressione p62, mentre il trattamento con spautin-1 e BA1 induce un accumulo di LC3B-II. Ciò riflette l'induzione dell'autofagia, ma un fallimento del turnover autofagico nei mDC. Negli iDC, il pretrattamento spautin-1 ripristina fortemente la degradazione autofagica di p62 in base all'infezione da HSV-1, a causa dell'inibizione dell'autofagia durante la fase di avvio. Dopo il pre-trattamento con BA1, gli iDC infettati finto e HSV-1 mostrano un forte accumulo di livelli di proteine LC3B-II, indicando un'inibizione di successo del turnover autofagico tramite il blocco della fusione tarda autofamasomica. Coerentemente con questo, il pretrattamento di spautin-1 e BA1 degli MDC si traduce anche in p62 stabili e livelli di proteine LC3B-II, rispettivamente.
In un secondo metodo per compromettere il flusso autofagico, viene esaminata l'elettroporazione di siRNA mirata a FIP200 per quanto riguarda la sua capacità di bloccare il flusso autofagico negli iDC infettati da HSV-1. Come mostrato nella Figura 4A, sono stati rilevati livelli di proteine FIP200 fortemente ridotti negli iDC 48 h dopo l'elettroporazione, rispetto al siRNA di controllo. A questo punto, gli IDC non mostrano alcun segno di morte cellulare (Figura 4B) e mantengono il loro fenotipo immaturo (Figura 4C). L'infezione degli IDC silenziati FIP200 con HSV-1 rivela una forte diminuzione del flusso autofagico rispetto alle loro controparti di controllo trattate con siRNA (Figura 4D). Questo è accompagnato da un aumento dei livelli proteici di LC3B e p62 quando FIP200 viene silenziato negli iDC infettati da HSV-1.
In un tentativo inverso, abbiamo studiato se l'ablazione mediata da siRNA dell'espressione proteica KIF1B e KIF2A consente il turnover autofromal-lisomico-lisomico anche negli MDC infettati da HSV-1. Pertanto, gli iDC sono stati elettroporate utilizzando siRNA specifici mirati a una o entrambe queste proteine, e le cellule sono state successivamente maturate (Figura 5). 2 giorni dopo l'elettroporazione, gli mDC mostrano una forte riduzione dell'espressione proteica KIF1B e/o KIF2A, quando sono stati utilizzati siRNA specifici (Figura 5A). Questo metodo non ha anche portato a morte prominente delle cellule (Figura 5B) né a cambiamenti nel loro stato di maturazione fenotipica (Figura 5C). Sostenendo l'importanza del KIF1B e del KIF2A durante la degradazione autophagosomal-lysosomica, il loro esaurimento prima dell'infezione da HSV-1 facilita un aumento del flusso autofagico negli mDC. Ciò si riflette nella diminuzione dei livelli di proteine residue p62, a differenza delle rispettive condizioni di controllo (Figura 5D).
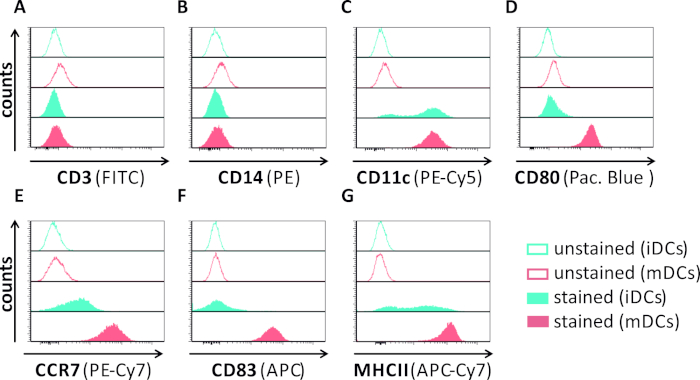
Figura 1: caratterizzazione fenotipica di iDC e mDC derivati da monociti umani utilizzando la citometria di flusso. I controller di dominio sono stati generati e macchiati con anticorpi specifici per verificarne la purezza: (A) CD3 per escludere le contaminazioni delle cellule T,(B) CD14 per escludere la contaminazione da monociti e(C)CD11c come marcatore per i controller di dominio. Per valutare il loro stato di maturazione fenotipica sono stati utilizzati i seguenti anticorpi: (D) CD80, (E) CCR7, (F) CD83 e (G) MHCII. Queste molecole sono altamente espresse sugli mDC e consentono così la discriminazione tra il fenotipo DC immaturo e maturo. I dati sono stati analizzati utilizzando FCS express 5.0. Fare clic qui per visualizzare una versione più grande di questa figura.
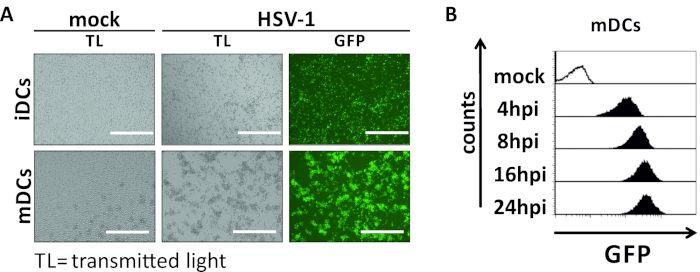
Figura 2: Analisi citometriche microscopiche e di flusso di iDC e mDC infettati da HSV-1. IDC e mDC sono stati infettati da un ceppo HSV-1 che esprime EGFP (HSV-1 EGFP), per consentire la quantificazione del tasso di infezione in base al segnale GFP. (A) Analisi microscopiche degli IDC e degli IDC infettati da HSV-1 positivi alla GFP infettarsi in un MOI di 2, rispetto alle loro controparti non infette, a 24 hpi. Per visualizzare le cellule infette, è stata monitorata la fluorescenza GFP. La barra della scala rappresentala misurazione citometrica del flusso di mCratici simulati o infetti da HSV-1 durante la cinetica dell'infezione. I pannelli superiori (istogrammi foderati di nero) mostrano una condizione fittizia, i pannelli inferiori (istogrammi riempiti di nero) mostrano le cellule infettate da HSV-1 dopo i punti temporali indicati dopo l'infezione. I dati sono stati analizzati utilizzando FCS express 5.0. Fare clic qui per visualizzare una versione più grande di questa figura.
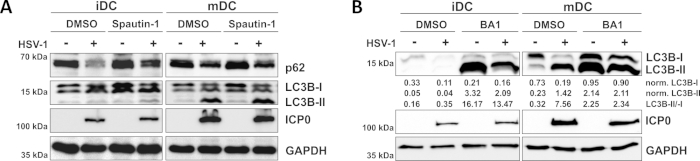
Figura 3: Spautin-1 e b afilocina-A1 modulano il flusso autofagico negli iDC infettati da HSV-1. iDC e mDC sono stati trattati con (A) spautin-1 o (B) bafilomycinA-A1 (BA1) per 1 h prima dell'infezione. Le cellule sono state successivamente infettate in modo fittizio o HSV-1 (HSV1-RFPVP26) utilizzando un MOI di 2. Dopo 16-18 h, i DC sono stati raccolti e le lislate proteiche sono state sottoposte a gonfiore occidentale per determinare l'espressione di p62 o LC3B-I/II come marcatori autofagici, ICP0 come controllo delle infezioni e GAPDH come controllo del carico. I livelli di proteine LC3B-I e LC3B-II sono stati quantificati e normalizzati alla proteina di riferimento GAPDH utilizzando Bio1D (densità ottica). Viene visualizzato il rapporto tra segnali LC3B-II normalizzati e segnali LC3B-I normalizzati. Questa cifra è stata modificata e adattata da ©2019 Turan et al. originariamente pubblicato in JCB. https://doi.org/10.1083/jcb.20180115110. Fare clic qui per visualizzare una versione più grande di questa figura.
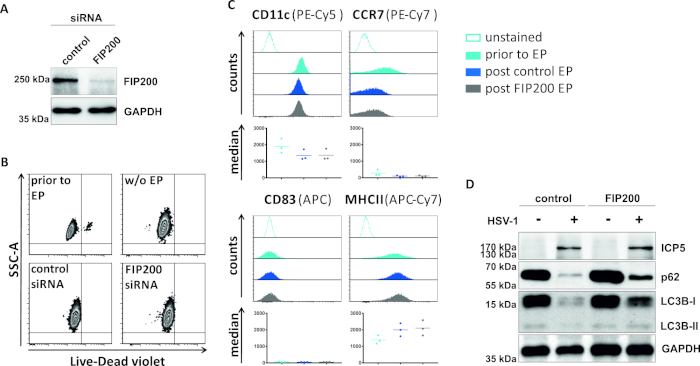
Figura 4: Analisi del flusso autofagico negli iDC infettati da HSV-1 sull'elettroporazione FIP200-siRNA. Gli iDC sono stati elettroporate con siRNA di controllo o siRNA specifico FIP200 utilizzando l'apparato di elettroporazione I. (A) sono stati analizzati per quanto riguarda l'efficienza del FIP200 knockdown 48 h dopo l'elettroporazione, eseguendo analisi western blot. (B) Lo stato di maturazione delle cellule e (C)è stato analizzato prima dell'elettroporazione (istogrammi azzurri) e l'elettroporazione di 48 ore (istogrammi blu scuro) per citometria di flusso. Vengono visualizzati i valori mediani per tre donatori diversi. Dopo aver confermato un'efficace eliminazione del FIP200 e del fenotipo immaturo, le cellule sono state infettate da HSV-1 (HSV-1 EGFP) utilizzando un MOI di 2. I dati sono stati analizzati utilizzando FCS express 5.0. (D) A 20 h dopo l'infezione, le cellule sono state sottoposte ad analisi occidentali delle macchie per determinare l'espressione di LC3B-I/II e p62 come marcatori autofagici. ICP5 è stato rilevato come controllo delle infezioni e GAPDH come controllo del carico. I pannelli A e D sono stati modificati e adattati da ©2019 Turan et al. originariamente pubblicati in JCB. https://doi.org/10.1083/jcb.20180115110. Fare clic qui per visualizzare una versione più grande di questa figura.
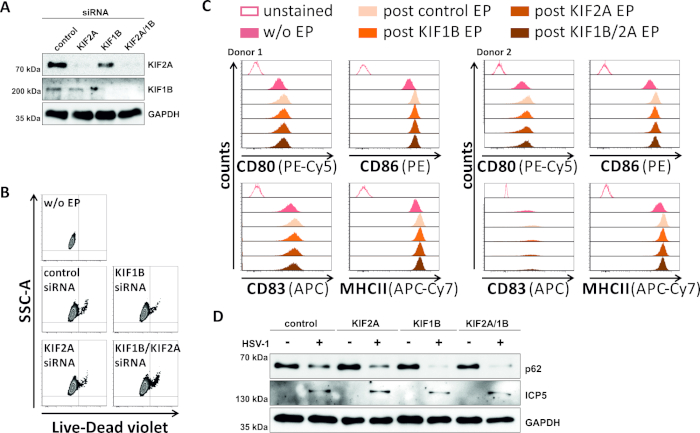
Figura 5: l'ablazione mediata da siRNA di KIF1B e/o KIF2A modula il turnover autofagico nei mDC infettati da HSV-1. Gli iDC sono stati elettroporate con siRNA specifico e/o specifico di KIF2A, nonché con siRNA di controllo, utilizzando l'apparato di elettroporazione II. A 4 h dopo l'elettroporazione, la maturazione è stata indotta tramite l'aggiunta di un cocktail di maturazione. A 48 h dopo l'elettroporazione, i DC sono stati analizzati per quanto riguarda (A) l'efficienza del knockdown KIF attraverso il gonfiore occidentale,(B)la vitalità delle cellule e il loro stato di maturazione fenotipica (C)utilizzando analisi citometriche di flusso (due diverse donatori). "w/o EP" significa senza elettroporazione, ma post induzione della maturazione; "Post control EP" significa post elettroporazione utilizzando siRNA di controllo; "post KIF1B, KIF2A, KIF1B/2A EP" significa post elettroporazione utilizzando siRNA specifico KIF1B e/o specifico di KIF2A. Dopo aver confermato un'efficace eliminazione di KIF1B e/o KIF2A e il fenotipo maturo, le cellule sono state infettate da HSV-1 (HSV-1 EGFP) utilizzando un MOI di 2. I dati sono stati analizzati utilizzando FCS express 5.0. (D) Le cellule sono state sottoposte ad analisi occidentali della macchia 20 h dopo l'infezione, al fine di valutare l'espressione di p62 come marcatore autofagico. ICP5 è stato utilizzato come controllo delle infezioni e GAPDH come controllo del carico. Le figure A e D sono state modificate e adattate da ©2019 Turan et al. originariamente pubblicate in JCB. https://doi.org/10.1083/jcb.20180115110. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
L'ambito del presente protocollo comprende (i) la gestione degli iDC derivati dai monociti umani e degli mDC, (ii) la loro infezione da HSV-1, (iii) il loro trattamento con composti noti per inibire l'autofaginismo e (iv) la loro elettroporazione con siRNA utilizzando due diverse configurazioni tecniche. Utilizzando il protocollo attuale, il flusso autofagico può essere bloccato negli iDC infettati da HSV-1 o indotto negli mDC infettati da HSV-1.
Poiché i DC, e in particolare gli IDC, sono cellule molto vulnerabili, lavorare con queste cellule comporta passaggi piuttosto delicati. Per la generazione di DC, si consiglia di utilizzare PBC appena isolati e di evitare la loro crioconservazione, al fine di ottenere rendimenti cellulari più elevati. Inoltre, quando si tratta di iDC durante gli esperimenti, compresa la loro successiva coltivazione, prevenire alterazioni di temperatura dure o prolungate. In caso contrario, gli iDC potrebbero subire cambiamenti fenotipici e quindi è necessario verificare il loro fenotipo immaturo per citometria di flusso. Si noti che, a differenza delle loro controparti mature, gli iDC non dispongono di marcatori distinti, ad esempio CD80, CD83 e CD8628,29. L'infezione di iDC e mDC con HSV-1 è un metodo consolidato2,3,4,5,6,10. Noi e altri hanno dimostrato che i controller di dominio sono altamente suscettibili per l'infezione da HSV-1, quando è stato utilizzato un MOI pari a 1 o 2 (Figura 2). Nelle nostre mani, mantenere il volume del mezzo di infezione a bassi livelli (1-3 x 106 cellule in 250-350 l) porterà a migliori efficienze di infezione.
Un approccio classico per interferire con un determinato percorso cellulare distinto è l'uso di composti specifici. Una varietà di diversi modulatori di autofagia, cioè attivatori e inibitori, sono attualmente disponibili30. Per quanto riguarda l'autofagia indotta da HSV-1 nei DC, Turan et al., (2019) ha recentemente mostrato gli effetti inibitori di spautin-1 e bafilomycin-A1 (BA1) sul fatturato autofagico negli iDC10. Questa tecnica per l'inibizione dell'autofagia è adatta per la combinazione con una successiva infezione da HSV-1, poiché né il tasso di infezione né lo stato di maturazione dei DC (in particolare gli IDC) sono compromessi. Nelle applicazioni future, questo approccio basato sugli inibitori potrebbe essere applicato anche in combinazione con altri agenti infettivi, condizioni di stress, come la fame, nonché per diversi tipi di cellule. Tuttavia, quando si utilizzano inibitori, sorgono limitazioni nel determinare la concentrazione adatta per un'efficiente inibizione dell'autofagia, senza compromettere gravemente la vitalità cellulare. La principale limitazione quando si utilizzano inibitori è, tuttavia, il verificarsi di potenziali effetti negativi o off-target, che potrebbero portare a risultati fuorvianti31,32.
Il secondo approccio per interferire con l'autofagia, coperto nel presente protocollo, è il knockdown specifico utilizzando siRNA33,34,35. Da un lato, abbiamo usato l'apparato di elettroporazione I per ablate specificamente l'espressione di FIP200, inibendo così il turnover autofagico indotto da HSV-1 negli iDC. D'altra parte, abbiamo messo a tacere due diverse proteine KIF (ad esempio, KIF1B e KIF2A), utilizzando l'apparato di elettroporazione II, per facilitare il flusso autofagico negli MDC infettati da HSV-1. Entrambi i protocolli di elettroporazione hanno portato ad un'ablazione quasi completa di FIP200 negli iDC e KIF1B/KIF2A nelle mDC, che è stata verificata tramite analisi delle macchie occidentali (Figura 4A, Figura 5A). A differenza dell'apparato di elettroporazione I, che non influisce sulla fattibilità dei DC, l'elettroporazione degli mDC che utilizzano l'apparato di elettroporazione II determina tassi leggermente più elevati di cellule morte(Figura 4B, Figura 5B ). Quindi, nelle applicazioni future, l'apparato di elettroporazione I dovrebbe essere preferibilmente utilizzato per entrambi, iDC e mDC. Sorprendentemente, entrambe le tecniche basate su siRNA, per modulare il flusso autofagico, sono compatibili con la successiva infezione Da HSV-1 di iDC o mDC. Inoltre, né il fenotipo immaturo degli iDC né il fenotipo maturo degli mDC vengono alterati dopo l'elettroporazione.
L'elettroporazione degli iDC che utilizzano il siRNA specifico di FIP200 è un metodo efficiente e altamente specifico per il knockdown genico e l'inibizione del flusso autofagico sull'infezione da HSV-1. Oltre al silenziamento specifico di FIP200, questo protocollo può essere adattato per silenziare altri componenti autofagici, partecipando a diversi passaggi durante la cascata autofagica. Tuttavia, l'identificazione dell'obiettivo appropriato per un'efficace inibizione mediata da siRNA dell'autofagia include diversi aspetti di preoccupazione. In primo luogo, l'efficienza knockdown dei geni correlati all'autofagia (ATG) non è necessariamente correlata positivamente all'inibizione efficiente dell'autofagia ed è altamente dipendente dalla proteina ATG specifica che viene silenziata36. In secondo luogo, proteine ATG distinte sono inoltre coinvolte in percorsi distinti dall'autofagia, quindi la loro ablazione potrebbe anche portare a effetti collaterali negativi37,38,39. In terzo luogo, diversi ATG possono avere funzioni ridondanti, quindi il knockdown di un componente potrebbe non essere sufficiente a inibire l'autofagia (adesempio,, beclin-1 e beclin-2)40.
Inoltre, l'apparato di elettroporazione I-based protocollo di DC è adatto anche per mRNA, e potrebbe essere utilizzato per una varietà di tipi di cellule primarie aggiuntive, come PBMC25. Questo sistema fornisce quindi una strategia generale per fornire specie di RNA distinte in diversi tipi di cellule primarie. In conclusione, presentiamo due protocolli per inibire il flusso autofagico, utilizzando un approccio basato su inibitori o siRNA combinato con la successiva infezione da HSV-1 degli iDC. Inoltre, descriviamo un approccio di elettroporazione di siRNA per indurre il flusso autofagico nelle mDC in seguito all'infezione da HSV-1.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dal Consiglio tedesco delle ricerche (DFG) attraverso il progetto STE 432/11-1 assegnato all'AS e dal programma ELAN della Facoltà di Medicina (Friedrich-Alexander-Universitat Erlangen-Norimberga) attraverso il progetto 18-12-21-1, concesso a LG.
Materiali
| Name | Company | Catalog Number | Comments |
| 4D-Nucleofector Core Unit (electroporation apparatus II) | Lonza (Basel, Switzerland) | AAF-1002B | |
| AB-Serum | Sigma Aldrich Chemie GmbH (Steinheim, Germany) | H4522 | Dendritic cell cultivation |
| ACD-A | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | 9007281 | |
| Amaxa P3 Primary Cell 4D-Nucleofector X Kit L (electroporation kit apparatus II) | Lonza (Basel, Switzerland) | V4XP-3024 | |
| Amersham ECL Prime Western Blotting Detection Reagent | GE Healthcare (Solingen, Germany) | RPN2232 | Western Blot Detection |
| Ammonium persulfate (APS) | Sigma Aldrich Chemie GmbH (Steinheim, Germany) | A3678 | |
| anti-mouse-IgG (mouse, polyclonal, HRP) | Cell Signaling (Leiden, Netherlands) | 7076 | Western Blot detection |
| anti-rabbit-IgG (goat, polyclonal, HRP) | Cell Signaling (Leiden, Netherlands) | 7074 | Western Blot detection |
| Bafilomycin A1 | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | tlrl-baf1 | inhibition of autophagy and lysosomal degradation |
| BD FACS Canto II Flow Cytometer | BD Biosciences (Heidelberg, Germany) | 338962 | |
| Benzonase | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | E1014 | |
| Blotting Chamber Fastblot B44 | Biometra (Göttingen, Germany) | 846-015-100 | |
| CCR7 (mouse, Pe-Cy7) | BioLegend (Fell, Germany) | 557648 | Flow cytometry Dilution: 1:100 Clone: G043H7 |
| CD11c (mouse, Pe-Cy5) | BD Biosciences (Heidelberg, Germany) | 561692 | Flow cytometry Dilution: 1:100 Clone: B-ly6 |
| CD14 (mouse, PE) | BD Biosciences (Heidelberg, Germany) | 555398 | Flow cytometry Dilution: 1:100 Clone: M5E2 |
| CD3 (mouse, FITC) | BD Biosciences (Heidelberg, Germany) | 555332 | Flow cytometry Dilution: 1:100 Clone: UCHT1 |
| CD80 (mouse, V450) | BD Biosciences (Heidelberg, Germany) | 560442 | Flow cytometry Dilution: 1:100 Clone: L307.4 |
| CD83 (mouse, APC) | eBioscience Thermo Fisher Scientific (Langenselbold, Germany) | 17-0839-41 | Flow cytometry Dilution: 1:200 Clone: HB15e |
| CD86 (mouse, PE) | BD Biosciences (Heidelberg, Germany) | 553692 | Flow cytometry Dilution: 1:100 |
| EVOS FL Cell Imaging | System AMG/Life Technologies (Carlsbad, USA) | AMF4300 | |
| FIP200 (rabbit) | Cell Signaling (Leiden, Netherlands) | 12436 | Western Blot detection Dilution: 1:1000 Clone: D10D11 |
| GAPDH (mouse) | Merck Millipore (Massachusetts, USA) | AB2302 | Western Blot detection Dilution: 1:5000 Clone: MAB374 |
| Gene Pulser II apparatus (electroporation apparatus I) | BioRad Laboratories GmbH (München, Germany) | 165-2112 | |
| GM-CSF (4x104 U/mL) | Miltenyi Biotec (Bergisch Gladbach, Germany) | 130-093-868 | |
| HLA?DR (mouse, APC-Cy7) | BioLegend (Fell, Germany) | 307618 | Flow cytometry Dilution: 1:200 Clone: L243 |
| HSV-1/17+/CMV-EGFP/UL43 | BioVex | DC infection | |
| ICP0 (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-53070 | Western Blot detection Dilution: 1:1000 Clone: 11060 |
| ICP5 (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-56989 | Western Blot detection Dilution: 1:1000 Clone: 3B6 |
| IL-1β (0.1x106 U/mL) | Cell Genix GmbH (Freiburg, Germany) | 1411-050 | |
| IL-4 (1x106 U/mL) | Miltenyi Biotec (Bergisch Gladbach, Germany) | 130-093-924 | |
| IL-6 (1x106 U/mL) | Cell Genix GmbH (Freiburg, Germany) | 1404-050 | |
| ImageQuant LAS 4000 | GE Healthcare (Solingen, Germany) | 28955810 | |
| KIF1B (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-376246 | Western Blot detection Dilution: 1:1000 Clone: E-12 |
| KIF2A (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-271471 | Western Blot detection Dilution: 1:1000 Clone: D-7 |
| LC3B (rabbit) | Cell Signaling (Leiden, Netherlands) | 3868 | Western Blot detection Dilution: 1:1000 Clone: D11 |
| L-glutamine | Lonza (Basel, Switzerland) | 17-605E | |
| LIVE/DEAD Fixable Violet dead cell stain kit | Life Technologies (Carlsbad, CA, USA) | L34964 | L/D staining in Flow cytometry |
| Lymphoprep | Alere Technologies AS (Oslo, Norway) | 04-03-9391/01 | |
| Magnesiumchloride | Carl Roth GmbH (Karlsruhe, Germany) | A537.1 | |
| Megafuge 2.0 RS | Heraeus (Hanau, Germany) | 75015505 | |
| N, N, N', N'-Tetramethylethylendiamine (TEMED) | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | T9281 | |
| Neubauer counting chamber | Brand (Wertheim, Germany) | 717805 | |
| Nunc Cell culture flasks (175.0 cm2) | Thermo Scientific (Rockford, USA) | 159910 | |
| p62 (rabbit) | Cell Signaling (Leiden, Netherlands) | 88588 | Western Blot detection Dilution: 1:1000 Clone: D5L7G |
| PageRuler prestained protein ladder | Thermo Fisher Scientific (Langenselbold, Germany) | 26616 | |
| Paraformaldehyde, 16 % | Alfa Aesar, Haverhill, USA | 43368.9M | |
| PerfectSpin 24 Plus | Peqlab (Erlangen, Germany) | C2500-R-PL | |
| PGE2 (1 mg/mL) | Pfizer (Berlin, Germany) | BE130681 | |
| Phosphate buffered saline (PBS) | Lonza (Basel, Switzerland) | 17-512F | |
| Protein gel system MiniProtean II | Bio-Rad Laboratories GmbH (München, Germany) | 1652960 | |
| RestoreTM Western Blot Stripping Buffer | Thermo Scientific, Rockford, USA | 21059 | |
| Rocking Platform wt 15 | Biometra (Göttingen, Germany) | 042-590 | |
| RotiBlock | Carl Roth GmbH (Karlsruhe, Germany) | A151.4 | |
| Roti-Load 1 (4x) | Carl Roth GmbH (Karlsruhe, Germany) | K929.3 | |
| Rotiphorese Gel 30 (37.5:1) | Carl Roth GmbH (Karlsruhe, Germany) | 3029.1 | |
| RPMI 1640 | Lonza (Basel, Switzerland) | 12-167F | |
| Sodium dodecyl Sulfate (SDS) | Carl Roth GmbH (Karlsruhe, Germany) | 2326.2 | |
| Thermomixer comfort | Eppendorf (Hamburg, Germany) | 5355 000.011 | |
| TNF-α (10 μg/mL) | Peprotech (Hamburg, Germany) | 300-01A | |
| Tris | Carl Roth GmbH (Karlsruhe, Germany) | 4855.3 | |
| Trypan blue solution (0.4 %) | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | T8154 | |
| Tween 20 | Carl Roth GmbH (Karlsruhe, Germany) | 9127.1 | |
| Whatman 0.2 μm nitrocellulose membrane | GE Healthcare (Solingen, Germany) | 10600001 | |
| WhatmanTM Chromatography Paper 3 mm Chr | Fisher Scientific GmbH (Schwerte, Germany) | 3030917 |
Riferimenti
- Chapuis, F., Rosenzwajg, M., Yagello, M., Ekman, M., Biberfeld, P., Gluckman, J. C. Differentiation of human dendritic cells from monocytes in vitro. European Journal of Immunology. 27 (2), 431-441 (1997).
- Kummer, M., et al. Herpes simplex virus type 1 induces CD83 degradation in mature dendritic cells with immediate-early kinetics via the cellular proteasome. Journal of Virology. 81 (12), 6326-6338 (2007).
- Kruse, M., et al. Mature dendritic cells infected with herpes simplex virus type 1 exhibit inhibited T-cell stimulatory capacity. Journal of Virology. 74 (15), 7127-7136 (2000).
- Salio, M., Cella, M., Suter, M., Lanzavecchia, A. Inhibition of dendritic cell maturation by herpes simplex virus. European Journal of Immunology. 29 (10), 3245-3253 (1999).
- Prechtel, A. T., et al. Infection of mature dendritic cells with herpes simplex virus type 1 dramatically reduces lymphoid chemokine-mediated migration. Journal of General Virology. 86, 1645-1657 (2005).
- Theodoridis, A. A., Eich, C., Figdor, C. G., Steinkasserer, A. Infection of dendritic cells with herpes simplex virus type 1 induces rapid degradation of CYTIP, thereby modulating adhesion and migration. Blood. 118 (1), 107-115 (2011).
- Cohrs, R. J., Gilden, D. H. Human herpesvirus latency. Brain Pathology. 11 (4), 465-474 (2001).
- Grinde, B. Herpesviruses: latency and reactivation - viral strategies and host response. Journal of Oral Microbiology. 5, (2013).
- Whitley, R. J., Roizman, B. Herpes simplex virus infections. The Lancet. 357 (9267), 1513-1518 (2001).
- Turan, A., et al. Autophagic degradation of lamins facilitates the nuclear egress of herpes simplex virus type 1. The Journal of Cell Biology. 218 (2), 508-523 (2019).
- Takeshige, K., Baba, M., Tsuboi, S., Noda, T., Ohsumi, Y. Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction. The Journal of Cell Biology. 119 (2), 301-311 (1992).
- Yin, Z., Pascual, C., Klionsky, D. J. Autophagy: machinery and regulation. Microbial Cell. 3 (12), 588-596 (2016).
- Bodemann, B. O., et al. RalB and the exocyst mediate the cellular starvation response by direct activation of autophagosome assembly. Cell. 144 (2), 253-267 (2011).
- Bjorkoy, G., et al. p62/SQSTM1 forms protein aggregates degraded by autophagy and has a protective effect on huntingtin-induced cell death. The Journal of Cell Biology. 171 (4), 603-614 (2005).
- Kabeya, Y., et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing. The EMBO Journal. 19 (21), 5720-5728 (2000).
- Kabeya, Y., Mizushima, N., Yamamoto, A., Oshitani-Okamoto, S., Ohsumi, Y., Yoshimori, T. LC3, GABARAP and GATE16 localize to autophagosomal membrane depending on form-II formation. Journal of Cell Science. 117, 2805-2812 (2004).
- Pankiv, S., et al. p62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy. The Journal of Biological Chemistry. 282 (33), 24131-24145 (2007).
- Korolchuk, V. I., Rubinsztein, D. C. Regulation of autophagy by lysosomal positioning. Autophagy. 7 (8), 927-928 (2011).
- Li, Y., et al. A cell-based quantitative high-throughput image screening identified novel autophagy modulators. Pharmacological Research. 110, 35-49 (2016).
- Pampaloni, F., et al. A Novel Cellular Spheroid-Based Autophagy Screen Applying Live Fluorescence Microscopy Identifies Nonactin as a Strong Inducer of Autophagosomal Turnover. SLAS Discovery. 22 (5), 558-570 (2017).
- Deng, Y., Zhu, L., Cai, H., Wang, G., Liu, B. Autophagic compound database: A resource connecting autophagy-modulating compounds, their potential targets and relevant diseases. Cell Proliferation. 51 (3), 12403 (2018).
- Liu, J., et al. Beclin1 controls the levels of p53 by regulating the deubiquitination activity of USP10 and USP13. Cell. 147 (1), 223-234 (2011).
- Mauvezin, C., Neufeld, T. P. Bafilomycin A1 disrupts autophagic flux by inhibiting both V-ATPase-dependent acidification and Ca-P60A/SERCA-dependent autophagosome-lysosome fusion. Autophagy. 11 (8), 1437-1438 (2015).
- Yoshimori, T., Yamamoto, A., Moriyama, Y., Futai, M., Tashiro, Y. Bafilomycin A1, a specific inhibitor of vacuolar-type H(+)-ATPase, inhibits acidification and protein degradation in lysosomes of cultured cells. Journal of Biological Chemistry. 266 (26), 17707-17712 (1991).
- Gerer, K. F., Hoyer, S., Dorrie, J., Schaft, N. Electroporation of mRNA as Universal Technology Platform to Transfect a Variety of Primary Cells with Antigens and Functional Proteins. Methods in Molecular Biology. 1499, 165-178 (2017).
- Prechtel, A. T., Turza, N. M., Theodoridis, A. A., Steinkasserer, A. CD83 knockdown in monocyte-derived dendritic cells by small interfering RNA leads to a diminished T cell stimulation. The Journal of Immunology. 178 (9), 5454-5464 (2007).
- Pfeiffer, I. A., et al. Leukoreduction system chambers are an efficient, valid, and economic source of functional monocyte-derived dendritic cells and lymphocytes. Immunobiology. 218 (11), 1392-1401 (2013).
- Villadangos, J. A., Heath, W. R. Life cycle, migration and antigen presenting functions of spleen and lymph node dendritic cells: limitations of the Langerhans cells paradigm. Seminars in Immunology. 17 (4), 262-272 (2005).
- Lechmann, M., Berchtold, S., Hauber, J., Steinkasserer, A. CD83 on dendritic cells: more than just a marker for maturation. Trends in Immunology. 23 (6), 273-275 (2002).
- Yang, Y. P., et al. Application and interpretation of current autophagy inhibitors and activators. Acta Pharmacologica Sinica. 34 (5), 625-635 (2013).
- Redmann, M., et al. Inhibition of autophagy with bafilomycin and chloroquine decreases mitochondrial quality and bioenergetic function in primary neurons. Redox Biology. 11, 73-81 (2017).
- Yan, Y., et al. Bafilomycin A1 induces caspase-independent cell death in hepatocellular carcinoma cells via targeting of autophagy and MAPK pathways. Scientific Reports. 6, 37052 (2016).
- Hale, C. M., et al. Identification of modulators of autophagic flux in an image-based high content siRNA screen. Autophagy. 12 (4), 713-726 (2016).
- Lipinski, M. M., et al. A genome-wide siRNA screen reveals multiple mTORC1 independent signaling pathways regulating autophagy under normal nutritional conditions. Developmental Cell. 18 (6), 1041-1052 (2010).
- Orvedahl, A., et al. Image-based genome-wide siRNA screen identifies selective autophagy factors. Nature. 480 (7375), 113-117 (2011).
- Staskiewicz, L., Thorburn, J., Morgan, M. J., Thorburn, A. Inhibiting autophagy by shRNA knockdown: cautions and recommendations. Autophagy. 9 (10), 1449-1450 (2013).
- Lee, I. H., et al. Atg7 modulates p53 activity to regulate cell cycle and survival during metabolic stress. Science. 336 (6078), 225-228 (2012).
- Fremont, S., Gerard, A., Galloux, M., Janvier, K., Karess, R. E., Berlioz-Torrent, C. Beclin-1 is required for chromosome congression and proper outer kinetochore assembly. EMBO Reports. 14 (4), 364-372 (2013).
- Bestebroer, J., V'kovski, P., Mauthe, M., Reggiori, F. Hidden behind autophagy: the unconventional roles of ATG proteins. Traffic. 14 (10), 1029-1041 (2013).
- Galluzzi, L., Kroemer, G. Common and divergent functions of Beclin 1 and Beclin 2. Cell Research. 23 (12), 1341-1342 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon