Method Article
siRNA Elektroporation zur Modulation der Autophagie bei Herpes Simplex Virus Typ 1-Infected Monocyte-Derived Dendritic Cells
In diesem Artikel
Zusammenfassung
In dieser Studie präsentieren wir inhibitor- und siRNA-basierte Strategien, um den autophagischen Fluss in Herpes simplex Virus Typ-1 (HSV-1)-infizierten monozyten-abgeleiteten dendritischen Zellen zu stören.
Zusammenfassung
Herpes simplex Virus Typ-1 (HSV-1) induziert Autophagie in beiden, unreifen dendritischen Zellen (iDCs) sowie reifen dendritischen Zellen (mDCs), während autophagischer Fluss nur in iDCs beobachtet wird. Um mechanistische Erkenntnisse zu gewinnen, entwickelten wir effiziente Strategien, um den HSV-1-induzierten autophagischen Umsatz zu stören. Eine Inhibitor-basierte Strategie, die HSV-1-induzierte Autophagie zu modulieren, stellt die erste Wahl dar, da es sich um eine einfache und schnelle Methode handelt. Um mögliche unspezifische Off-Target-Effekte solcher Verbindungen zu umgehen, haben wir eine alternative siRNA-basierte Strategie entwickelt, um den autophagischen Umsatz in iDCs bei HSV-1-Infektion zu modulieren. Tatsächlich ist die Elektroporation von iDCs mit FIP200-spezifischer siRNA vor der HSV-1-Infektion eine sehr spezifische und erfolgreiche Methode, um die FIP200-Proteinexpression abzuvernichten und damit den autophagischen Fluss zu hemmen. Beide vorgestellten Methoden führen zur effizienten Hemmung des HSV-1-induzierten autophagischen Umsatzes in iDCs, wobei die siRNA-basierte Technik zielorientierter ist. Ein zusätzlicher siRNA-basierter Ansatz wurde entwickelt, um die Proteinexpression von KIF1B und KIF2A selektiv zum Schweigen zu bringen und so den autophagischen Umsatz bei HSV-1-Infektionen bei mDCs zu erleichtern. Zusammenfassend lässt sich sagen, dass die Technik der siRNA-Elektroporation eine vielversprechende Strategie darstellt, die Expression von verschiedenen Proteinen selektiv abzumildern und ihren Einfluss auf eine HSV-1-Infektion zu analysieren.
Einleitung
Die Erzeugung menschlicher monozytenabgeleiteter dendritischer Zellen (DCs) stellt ein geeignetes In-vitro-Modell dar, um die Funktionen und die Biologie dieses wichtigen Immunzelltyps zu untersuchen. Die Isolation sowie die Differenzierung von Monozyten in DCs haben sich in den letzten Jahren gut etabliert1,2. Die Infektion von DCs mit dem Herpesvirus Herpes simplex Virus Typ-1 (HSV-1) dient als Modellsystem zur Untersuchung hsv-1-vermittelter Modulationen der DC-Biologie2,3,4,5,6 . Dies ist besonders wichtig, um aufzuklären, wie Herpesviren starke antivirale Immunantworten dämpfen oder hemmen, um Latenz in immunprivilegierten Nischen innerhalb des Wirts zu etablieren7,8. In dieser Hinsicht sind Herpesviren sehr erfolgreiche Krankheitserreger, die in der Population weit verbreitet sind und eine Seroprävalenz von bis zu 90 % nach der geografischen Region9erreichen. Um dies zu verstehen und möglicherweise zu verhindern, sind weitere Einblicke in die HSV-1-vermittelten Modulationen des Immunsystems des Wirts und insbesondere von Immunzellen wie DCs erforderlich.
Eine völlig neue Beobachtung zum Zusammenspiel von DCs mit HSV-1 wurde kürzlich von Turan et al.10veröffentlicht. Die Autoren zeigten, dass die Durchführung der HSV-1-Replikation streng vom Reifestatus von DCs abhängt. In iDCs wird die vollständige Replikation von HSV-1 durch autophagieabhängige Mechanismen erleichtert. Während HSV1 Autophagie in beiden iDCs und mDCs induziert, wird der autophagische Fluss nur in iDCs beobachtet. Dies wiederum erleichtert den nuklearen Ausgang viraler Kapsiden durch autophagische Degradierung von Kernlaminen in iDCs. Um mechanistische Einblicke in diesen HSV-1-induzierten Abbaupfad in iDCs im Vergleich zu mDCs zu gewinnen, sind neue und effiziente Strategien entscheidend, um den autophagischen Fluss zu untersuchen.
Makroautophagie (Autophagie) ist ein gut konservierter mehrstufiger Prozess, der auf intrazelluläre Proteine oder ganze Organellen zur lysosomalen Verdauung abzielt11. Vereinfacht kann die Autophagie in die (i) Initiation, (ii) Membrankernbildung, (iii) Vesikelausdehnung und (iv) autophagosome-lysosome Fusionsphase12unterteilt werden. Während der Initiierung (i) sind Komponenten wie der aktivierte ULK1/2-Kinase-Komplex, der das fokale Adhäsionskinase-Protein der 200 kD (FIP200) enthält, entscheidend, um den Beclin-1-Vps34-AMBRA1-Komplex zu aktivieren. Anschließend initiiert die Membrankernbildung (ii) die Phagophorebildung13, die zytoplasmatische Ladungen verschlingt, die durch Moleküle wie p6214gekennzeichnet sind. Während der Vesikelexpansion und Autophagophorereifung (iii) mikrotubule-assoziierte Protein-Lichtkette 3 (LC3)-I wird in seine lipidierte Form LC3-II umgewandelt, die in die autophagosomale Membran eingeführt wird. Somit sind die Umwandlungsraten von LC3-I bis -II ein Indikator für die autophagie Induktion durch Spiegelung der Bildung von reifen Autophagosomen15,16. Bei der autophagosomem-lysosom-Fusion (iv) werden nicht nur die autophagische Ladung, sondern auch die damit verbundenen p62- und LC3-II-Proteine abgebaut (z.B. durch Hydrolyse). Somit dient der Verlust von p62 und LC3-II als Marker für den autophagischen Fluss17. Die Verschmelzung von Autophagosomen mit Lysosomen und damit nach dem autophagischen Umsatz ist in hohem Maße von der intrazellulären lysosomalen Lokalisation abhängig. Dies wird unter anderem von den Kinesin-Familienmitgliedern KIF1B und KIF2A reguliert, die nachweislich die Autophagosomen-Lysosome-Fusion negativ beeinflussen18. Interessanterweise wird die Proteinexpression von KIF1B und KIF2A bei der DC-Reifung induziert und ist damit verantwortlich für den ineffizienten autophagischen Fluss in HSV-1-infizierten mDCs, der die vollständige HSV-1-Replikation10behindert.
Experimentelle Versuche, Autophagie zu modulieren gehören die Verwendung von Verbindungen bekannt, um diesen bestimmten Weg zu induzieren oder zu hemmen19,20,21. In dieser Studie beschreiben wir zwei inhibitorbasierte Strategien zur Blockierung des autophagischen Umsatzes in HSV-1-infizierten iDCs. Die erste In unseren Experimenten verwendete Verbindung ist ein spezifischer und potenter Autophagie-Inhibitor-1 (Spautin-1), der beschrieben wurde, um den komplexen Abbau von Beclin-1-Vps34-AMBRA1 während der Initiationsphase der Autophagie22zu fördern. Die zweite In dieser Studie verwendete Verbindung ist Bafilomycin-A1 (BA1), ein V-ATPase-Hemmer, der die späten autophagischen Ereignisse (d.h. autophagosome-lysosome fusion sowie autolysosome acidification)blockiert 23,24. Die Verwendung eines dieser beiden Inhibitoren vor der iDC-Infektion mit HSV-1 hemmt die Autophagie stark, stört aber nicht die effiziente virale Genexpression. Somit bietet diese inhibitorbasierte Strategie vor der HSV-1-Infektion ein leistungsfähiges Werkzeug, um HSV-1-induzierten autophagischen Fluss zu hemmen, der leicht für eine Vielzahl von verschiedenen Zelltypen und Viren erweitert werden kann, die möglicherweise auch Autophagie induzieren.
Um einen großen Nachteil eines inhibitorbasierten Ansatzes (d. h. unspezifische Off-Target-Effekte) zu überwinden, haben wir eine siRNA-basierte Methodeentwickelt, um den autophagischen Fluss in (HSV-1-infizierten) iDCs zu blockieren. Die Technik der siRNA-Elektroporation stellt eine leistungsstarke Alternativstrategie dar, durch selektive Ablation der Expression von verschiedenen Proteinen (d.h. autophagischen Komponenten). In unseren Experimenten wurden iDCs mit FIP200-spezifischer siRNA mit dem Elektroporationsapparat I (siehe Materialtabelle)und einem modifizierten Protokoll, das von Gerer et al. (2017) und Prechtel et al. (2007) beschrieben wurde, elektropoiert, um die Autophagie während der Initiationsphase25,26. Diese Technik ermöglichte es uns, die FIP200-Expression in iDCs gezielt abzusenken, ohne die Zelllebensfähigkeit und ihren unreifen Phänotyp zwei Tage nach der Elektroporation zu stören. Bemerkenswert ist, dass in diesen elektroporated iDCs, die durch eine effiziente virale Proteinexpression gespiegelt werden, eine HSV-1-Infektion festgestellt wurde. Diese siRNA-basierte Technik bietet einen einzigartigen Vorteil (d.h. dass eine Vielzahl unterschiedlicher autophagischer Komponenten, auch in Kombination), gezielt auf die Ablation ihrer Expression ausgerichtet werden können.
In dieser Studie beschreiben wir weiter eine siRNA-basierte Methode, um autophagischen Fluss auch in HSV-1-infizierten mDCs zu induzieren. In diesem Fall wurden iDCs mit siRNA gegen KIF1B und KIF2A vor der DC-Reifung mit dem Elektroporationsgerät II elektropoiert (siehe Materialtabelle). Da beide Proteine während der DC-Reifung hochreguliert sind und bekanntermaßen die Fusion von Autophagosomen mit Lysosomen10,18negativ regulieren, induziert ihr Knockdown stark induzierten autophagischen Fluss in mDCs bei HSV-1-Infektion. So ermöglichte uns die siRNA-basierte Technik, durch Eingriffe in die KIF-Proteinexpression in mDCs gezielt autophagischen Umsatz zu induzieren und dadurch ihre Expressionsniveaus in iDCs nachzuahmen.
Zusammenfassend stellen wir zwei verschiedene Methoden zur Hemmung des autophagischen Flusses in HSV-1-infizierten iDCs vor. Während der erste inhibitorbasierte Ansatz eine einfache, billige und schnelle Möglichkeit darstellt, den autophagischen Abbau zu stören, ist die zweite siRNA-basierte Technik spezifischer und eine sehr geeignete Methode, um die Ergebnisse von Inhibitoren zu unterstützen und zu verifizieren. Experimente. Darüber hinaus beschreiben wir eine Methode, um autophagischen Fluss auch in HSV-1-infizierten mDCs zu induzieren, über den siRNA-vermittelten Knockdown von zwei KIF-Proteinen.
Protokoll
Monozyten-abgeleitete DCs wurden aus Leukapherese-Produkten gesunder Spender erzeugt. Dafür wurde ein positives Votum der lokalen Ethikkommission (Referenznummer 4556) eingeholt. Die Experimente der vorliegenden Studie wurden nach den Empfehlungen der Ethikkommission der Friedrich-Alexander-Universität Erlangen-Nürnberg (Referenznummer 4556) durchgeführt. Alle Geber stimmten einer schriftlichen Zustimmung in Kenntnis der Sachlage zu, einschließlich der Übereinstimmung mit der Erklärung von Helsinki.
1. Erzeugung und Handhabung unreifer dendritischer Zellen (iDCs) und reifer dendritischer Zellen (mDCs)
- Isolieren Sie menschliche periphere Mononuklezellen (PBMCs) aus Leukoreduction Systemkammern (LRSCs), wie zuvor beschrieben27. Vermeiden Sie die Kryokonservierung von PBMCs und verwenden Sie sie direkt nach Isolation, um höhere DC-Ausbeute zu erzielen.
- Generieren Sie menschliche DCs aus PBMCs verschiedener gesunder Spender in T175-Zellkulturkolben, wie zuvor beschrieben10,27. Verwenden Sie 350-400 Millionen PBMCs in 30 ml DC-Medium (RPMI 1640 ohne L-Glutamin, 1% (v/v) AB-Serum, 100 U/ml Penicillin, 100 mg/ml Streptomycin, 0,4 mM L-Glutamin, 10 mM HEPES) pro Zellkulturkolben zur Isolierung von Monozyten durch Adhärenz. Nach 1 h die nicht haftende Fraktion mit RPMI 1640 abwaschen. Fügen Sie frischeDC Medium mit 800 U/mL GM-CSF und 250 U/ml IL-4 ergänzt, und inkubieren für 3 Tage.
- Am Tag 3 nach der Einhaltung 5 ml frisches DC-Medium mit GM-CSF und IL-4 mit einer Endkonzentration von 400 U/ml bzw. 250 U/ml pro Zellkulturkolben zur DC-Differenzierung hinzufügen.
- Um iDCs zu ernten, spülen Sie lose anhaftende iDCs am 4. Tag nach der Einhaltung sanft aus dem Boden des Zellkulturkolbens. Wiederholen Sie diesen Schritt 2 Mal. Für die Erzeugung von mDCs fügen Sie den Reifungscocktail wie folgt hinzu: GM-CSF (Endkonzentration: 40 U/ml), IL-4 (Endkonzentration: 250 U/ml), IL-6 (Endkonzentration: 1000 U/ml), IL-1 (Endkonzentration: 200 U/ml), TNF-A (Endkonzentration: 10 ng/ mL), Prostaglandin E2 (PGE2; Endkonzentration: 1 g/ml).
- Sechs Tage nach der Reifung (zwei Tage nach der Reifung mit einem Zytokin-Cocktail), mDCs vom Boden des Zellkulturkolbens abspülen. Wiederholen Sie diesen Schritt zweimal.
HINWEIS: Unreife und ausgereifte DCs können sequenziell von identischen Spendern in einem Zellkulturkolben erzeugt werden. Trennen Sie dazu (i) die entsprechende Anzahl von iDCs und (ii) die Reifung der verbleibenden Zellen in den Kolben mit dem in Schritt 1.2.2 aufgeführten Zytokincocktail induzieren.
- Übertragen Sie iDCs oder mDCs im jeweiligen Zellkulturmedium in 50 ml-Röhren. Ernte der Zellen über Zentrifugation bei 300 x g für 5 min.
- Resuspend (=wash) DCs in 5-10 ml RPMI 1640 pro Zellkulturkolben. Kombinieren Sie die jeweiligen DC-Aufhängungen in einem Rohr.
- Definieren Sie die Zellennummer mit einer Zählkammer oder einer alternativen Methode. Vermeiden Sie Temperaturänderungen beim Umgang mit iDCs, um das Risiko von phänotychen Veränderungen zu reduzieren.
2. Zytometrische Durchflussanalysen zur Überwachung des phäotypischen Reifungsstatus
- IDCs oder mDCs (0,5 x 106) von Schritt 1.3.1 in ein 1,5 ml Rohr übertragen. Ernte der Zellen durch Zentrifugation bei 3390 x g für 1,5 min. Waschen Sie die Zellen einmal mit FACS Puffer (PBS ergänzt mit 2% fetalem Kalbsserum (FCS)).
- Setzen Sie die Zellen in 100 l Antikörper-Färbelösung (FACS-Puffer) aus, die spezifische fluorchrome-markierte Antikörper gegen definierte Oberflächenmoleküle enthalten.
- Verwenden Sie die folgenden Antikörper, um die Reinheit (CD3-FITC, CD14-PE) sowie den Reifestatus von DCs (CD80-PacBlue/-PE-Cy5, CD11c-PE-Cy5, CCR7-PE-Cy7, CD83-APC, CD86-PE, MHCII-APC-Cy7) zu überprüfen.
- Bereiten Sie eine ungefärbte Probe in 100 L FACS-Puffer als Steuerung vor.
- Färben Sie die Zellen auf Eis im Dunkeln für 30 min.
- Anschließend die Zellen zweimal in 1 ml FACS-Puffer und Zentrifuge bei 3390 x g für 1,5 min waschen.
- Schließlich setzen Sie die Zellen in 200 L FACS-Puffer, ergänzt mit 2% PFA, wieder aus und analysieren die Zellen durch Durchflusszytometrie. Feste Zellen können bei 4° C im Dunkeln bis zu 2 Tage gelagert werden.
3. Infektionsverfahren von DCs mit Herpes simplex Virus Typ-1 (HSV-1) und Interferenz des HSV-1-induzierten autophagischen Flusses über Spautin-1 oder Bafilomycin-A1
HINWEIS: Der in dieser Studie verwendete Stamm HSV-1/17+/CMV-EGFP/UL43 (HSV-1 EGFP) wurde aus dem Laborstamm HSV-1 Stamm 17+ gewonnen. Der HSV-1 EGFP-Stamm drückt das verbesserte grüne Fluoreszenzprotein (EGFP) aus, das unter Kontrolle des CMV-Promotors in den UL43-Genort eingeführt wurde. EGFP dient als Marker für HSV-1-Infektion. Darüber hinaus wurde der Stamm HSV1-RFPVP26 für DC-Infektionsstudien verwendet (zuvor beschrieben in Turan et al., 2019). Dieses Virus drückt das Kapsidoberflächenprotein VP26 aus, das zu monomerrotem fluoreszierendem Protein (mRFP) verschmolzen wird.
- IDCs oder mDCs (2 x 106) von Schritt 1,3 in ein 2 ml-Rohr übertragen. Anschließend zentrifugieren Sie die Zellen bei 3390 x g für 1,5 min und entsorgen Sie den Überstand.
- Die Zellen im Infektionsmedium vorsichtig wieder aussetzen (RPMI 1640 ergänzt durch 20 mM HEPES).
- Um den autophagosomal-lysosomalen Abbauweg zu hemmen, vorbehandeln DCs mit Spautin-1 oder Bafilomycin-A1 1 h vor der Infektion. Fügen Sie dem Infektionsmedium entweder 10 M Spautin-1 oder 1 M BA1 oder DMSO als unbehandelte Kontrolle hinzu. Inkubieren Sie die Zellen in einem Heizblock bei 300 Umdrehungen pro Minute schütteln bei 37 °C für 1 h.
- Für Infektionsstudien impfen Sie die Zellen mit HSV-1-Virionen bei einer Vielzahl von Infektionen (MOI) von 2. Fügen Sie das jeweilige Volumen des MNT-Puffers (30 mM 2-(N-morpholino)ethanesulfonsäure (MES), 100 mM NaCl, 20 mM Tris) als Mock-Steuerung hinzu. Inkubieren Sie die Zellen in einem Heizblock bei 300 Umdrehungen pro Minute schütteln bei 37 °C für 1 h.
- 1 h nach der Infektion (hpi), sammeln Sie die Zellen bei 3390 x g für 1,5 min. Aspirieren Sie inoculum und setzen Sie die Zellen in DC-Medium, das 40 U/ml GM-CSF, 250 U/ml IL-4 und entweder 10 'M Spautin-1, 1 'M BA1 oder DMSO als Kontrolle enthält, sanft wieder auf. Saat-Mock-behandelte und HSV-1-infizierte Zellen in einer Endkonzentration von 1 x 106/ml in eine 6-Well-Platte.
- Bei 16-24 PSi ernten Sie die Zellen durch Spülen (mDCs) oder mit einem Zellschaber (iDCs). Übertragen Sie die Zellen in ein 1,5 ml Safelock-Rohr.
- Sammeln Sie die Zellen über Zentrifugation bei 3390 x g für 1,5 min und waschen Sie das Pellet einmal durch Zugabe von 1 ml PBS.
- Die Zellen in Lysemischung, die 29 l 2x Roti-Load, 1 l 100 mM MgCl2 und 12,5 U/ml Benzonase enthält, kräftig wieder aussetzen.
- Zur Zelllyse und DNA-Verdauung mit Benzonase, inkubieren Sie die Proben bei 37 °C für 10 min. Anschließend denaturieren Sie die Proteine bei 95 °C für 10 min.
- Führen Sie SDS-PAGE- und Western-Blot-Analysen durch, um den Proteingehalt von LC3BI/II, p62, ICP0/5 und GAPDH zu überprüfen.
4. Interferenz des HSV-1-induzierten autophagischen Flusses durch Elektroporation von iDCs mit FIP200-siRNA
HINWEIS: Das vorliegende Protokoll für siRNA-Elektroporation wurde von Prechtel et al. (2007) und Gerer et al. (2017) modifiziert.
- Übertragen Sie iDCs (12 x 106) an Tag 3,5 Post-Haftung in ein 50 ml Rohr. Anschließend zentrifugieren Sie die Zellen bei 300 x g für 5 min und entsorgen Sie den Überstand. Führen Sie parallel eine zytometrische Flussanalyse durch, um den in Schritt 2 beschriebenen Reifestatus zu überwachen (Verwenden Sie Life/Dead violett anstelle von CD80-PacBlue).
- Waschen Sie iDCs in 5 ml OptiMEM ohne Phenolrot vorsichtig und zentrifugieren Sie die Zellen bei 300 x g für 5 min. Entsorgen Sie den Überstand und setzen Sie iDCs in 200 l OptiMEM ohne Phenolrot sanft wieder auf, wodurch eine Zellkonzentration von 6 x 106/100 l eingestellt wird. Stellen Sie die Zellen nicht auf Eis und vermeiden Sie Temperaturänderungen. Gehen Sie schnell weiter und vermeiden Sie lange Inkubationszeiten von iDCs in OptiMEM ohne Phenolrot.
- Übertragen Sie entweder 75 pmol FIP200-spezifische siRNA oder 75 pmol RührsiRNA als Steuerung in 4 mm Elektroküvetten und fügen Sie 100 l (6x106 Zellen) der Zellsuspension hinzu. Direkt pulsieren iDCs mit dem Elektroporationsgerät I unter Anwendung der folgenden Einstellungen: 500 V für 1 ms.
- Bereiten Sie vor dem experimentellen Verfahren siRNA Suspensionen gemäß der Anweisung des Herstellers vor, aliquotieren und lagern Sie sie bei -20 °C. Tauen und halten Sie sie auf Eis, wenn Sie diese siRNAs für die Elektroporation verwenden. Führen Sie vor dem Elektropolieren der Proben einen Testimpuls durch.
- Nach der Elektroporation iDC direkt in 6-Well-Platten mit frischem vorgewärmten DC-Medium (ergänzt mit 40 U/ml GM-CSF und 250 U/ml IL-4). Säen Sie die Zellen in einer Endkonzentration von 1 x 106/ml und legen Sie sie in einen Inkubator. Spülen Sie die Zellen nicht aus der Elektroküvette.
- Nach 48 h zunächst die Morphologie von elektroporated iDCs mikroskopisch untersuchen. Dann ernten Sie die Zellen mit einem Zell-Schrotter und übertragen Sie sie in 15 ml Rohre. Spülen Sie die Brunnen mit 1 ml PBS, ergänzt mit 0,01% EDTA, und übertragen Sie die Lösung in die jeweiligen Rohre.
- Anschließend teilen Sie 6 x 106 iDCs pro siRNA Zustand, wie in den nächsten Schritten beschrieben.
- Verwenden Sie 0,5 x 106 Zellen, um den Reifezustand und die Zelllebensfähigkeit zu bewerten, wie in Schritt 2 beschrieben. Verwenden Sie die folgenden Antikörper: CD11c-PE-Cy5, CCR7-PE-Cy7, CD83-APC, MHCII-APC-Cy7 und Life/Dead violett.
- Verwenden Sie 1 x 106 Zellen für Western Blot-Analysen, um die FIP200-spezifische Knockdown-Effizienz zu überprüfen. Übertragen und ernten Sie die Zellen in ein 1,5 ml Safelock-Rohr durch Zentrifugation bei 3390 x g für 1,5 min. Bereiten Sie Zelllysate wie in Schritt 3.4 beschrieben vor und führen Sie Western-Blot-Analysen durch.
- Verwenden Sie die verbleibenden Zellen (4,5 x 106) für HSV-1-Infektionsexperimente. Übertragen Sie für jeden Versuchszustand 2,25 x 106 iDCs in 2 ml-Röhren und infizieren Sie sie entweder mit HSV1 bei einem MOI von 2 oder fügen Sie MNT-Puffer als Mock-Steuerung hinzu. Führen Sie die Infektion wie in Schritt 3.3 beschrieben.
- Mit 20 PSi ernten Sie die Zellen mit einem Zellschaber und bereiten Zelllysate für Western-Blot-Analysen vor, wie in Schritt 3.4 beschrieben.
5. Modulation des autophagosom-lysosomalen Weges in HSV-1-infizierten mDCs mit KIF1B/2A-siRNA-Elektroporation
- Übertragen Sie iDCs (24 x 106) an Tag 4 nach der Haftung in ein 50 ml Rohr. Anschließend zentrifugieren Sie die Zellen bei 300 x g für 5 min und entsorgen Sie den Überstand.
- Resuspend (= waschen) iDCs in 8 ml PBS, um eine endgültige Zellkonzentration von 3 x 106/ml einzustellen. 3 x 106 Zellen in 1,5 ml-Rohre übertragen und die Zellen bei 3390 x g 1,5 min ernten.
- Resuspend iDCs in 100 l Puffer P3, der den Zusatzmix enthält (gemäß den Anweisungen des Herstellers; Elektroporationskit-Gerät II) und entweder (i) 75 pmol KIF1B-spezifischer siRNA, (ii) 75 pmol KIF2A-spezifischer siRNA oder (iii) beides. Verwenden Sie (iv) die jeweilige Menge an gerührter siRNA als Steuerung. Bereiten Sie zwei Röhren für jede siRNA-Bedingung (6 x 106 Zellen) vor und übertragen Sie die Suspensionen in separate Elektroküvetten. Direkt pulsieren iDCs, die den Puls "EH-100" mit dem Elektroporationsgerät II anwenden.
- Bereiten Sie vor dem experimentellen Verfahren siRNA Suspensionen gemäß der Anweisung des Herstellers vor, aliquotieren und lagern Sie sie bei -20 °C. Tauen und halten Sie sie auf Eis, wenn Sie diese siRNAs für die Elektroporation verwenden. IDCs nicht auf Eis legen und Temperaturänderungen vermeiden. Fahren Sie schnell fort und vermeiden Sie eine lange Inkubation von iDCs in PBS oder Puffer P3.
- Direkt nach der Elektroporation 500 l vorgewärmten RPMI 1640 zu Elektroküvetten hinzufügen. Inkubieren Sie die Zellen in einem Inkubator für 5-10 min. Übertragen Sie iDCs in 6-Well-Platten mit frischem vorgewärmten DC-Medium (ergänzt mit 40 U/ml GM-CSF und 250 U/ml IL-4). Kombinieren Sie die jeweiligen Bedingungen in einem Brunnen, säen Sie die Zellen in einer Endkonzentration von 1x106/ml und legen Sie sie in einen Inkubator.
- 4 h nach der Inkubation den Reifungscocktail mit den in Schritt 1.2.2 aufgeführten Zytokinen hinzufügen.
HINWEIS: Bereiten Sie eine Probe aus nicht-elektroporated DCs (1 x 106) als Steuerung für durchflusszytometrische Analysen 2 Tage nach der Elektroporation vor. Behandeln Sie Steuerzellen analog zu elektropoierten Proben. - Zwei Tage nach der Elektroporation, Erntezellen durch Resuspension und Übertragung in 15 ml Rohre. Spülen Sie die Brunnen mit 1 ml PBS und übertragen Sie die Aufhängungen in die jeweiligen Rohre. Split 6-106 DCs pro siRNA-Bedingung, wie in den folgenden Schritten beschrieben:
- Verwenden Sie 0,25 x 106 DCs (elektroporated und non-electroporated), um den Reifezustand und die Zelllebensfähigkeit zu überprüfen, wie in Schritt 2 beschrieben. Verwenden Sie die folgenden Antikörper: CD80-PE-Cy5, CD83-APC, CD86-PE, MHCII-APC-Cy7 und Life/Dead violett.
- Verwenden Sie 0,75 x 106 Zellen für Western Blot-Analysen, um die KIF1B/2A-spezifische Knockdown-Effizienz zu bewerten. Sammeln Sie die Zellen in einem 1,5 ml Safelock-Rohr durch Zentrifugation bei 3390 x g für 1,5 min. Bereiten Sie Zelllysate wie in Schritt 3.4 beschrieben vor und führen Sie Western-Blot-Analysen durch.
- Verwenden Sie die verbleibenden Zellen (5 x 106) aus jeder siRNA-Bedingung und führen Sie HSV-1-Infektionsexperimente durch. Übertragen Sie für jeden Versuchszustand 2,5 x 106 iDCs in 2 ml-Röhren und infizieren Sie sie entweder mit HSV-1 bei einem MOI von 2 oder fügen Sie MNT-Puffer als Mock-Steuerung hinzu. Führen Sie die Infektion wie in Schritt 3.3 beschrieben.
- Bei 20 h nach der Infektion, ernten Sie die Zellen durch Resuspension und bereiten Zelllysate für Western Blot Analysen, um die Induktion von HSV-1-induzierten autophagischen Umsatz zu überprüfen, wie oben in Schritt 3.4 beschrieben.
Ergebnisse
In diesem Manuskript beschreiben wir Methoden, um die HSV-1-induzierte Autophagie in dendritischen Zellen zu stören. Dazu gehört die Erzeugung von humanen Monozyten-abgeleiteten iDCs und mDCs, die phänotypisch durch Durchflusszytometrie analysiert wurden (Abbildung 1). Am Tag 4 nach der Einhaltung zeigen DCs einen unreifen Phänotyp, der durch eine schwache Expression von CD80, CCR7 und CD83 sowie einen hohen CD11c- und MHCII-Zwischenausdruck gekennzeichnet ist. Da CD3- und CD14-Signale fehlen, können T-Zell- und Monozytenkontaminationen ausgeschlossen werden. Am Tag 6 nach der Einhaltung (d. h. Tag 2 nach der Induktion der Reifung) zeigen DCs einen reifen Phänotyp, der durch eine signifikante Zunahme der CD80-, CCR7-, CD83- und MHC-II-Oberflächenexpression widergespiegelt wird. Die Infektion mit einem eGFP-exezierenden HSV-1-Stamm (Abbildung 2) führt zu einer nahezu vollständigen Infektion entweder von iDCs (Abbildung 2A Oberpanel) oder mDCs (Abbildung 2Ein unteres Panel, Abbildung 2B), basierend auf starke GFP-Signale, die durch Fluoreszenzmikroskopie sowie Durchflusszytometrie analysiert werden.
Wie in unserem jüngsten Bericht gezeigt, HSV-1 induziert Autophagie sowohl in iDCs und mDCs, jedoch autophagischen Umsatz tritt in iDCs nur10. In einem ersten Ansatz behandelten wir iDCs und mDCs mit Spautin-1 (Abbildung 3A) - um die Autophagie-Initiierung zu blockieren - oder Bafilomycin-A1 (BA1; Abbildung 3B) - zur Hemmung der endgültigen Autophagosomen-Lysosom-Fusion. Bei einer HSV-1-Infektion von iDCs ohne Spautin-1 und BA1 wird der autophagische Fluss durch den Rückgang der p62- bzw. LC3B-Expression gespiegelt. Im Gegensatz dazu wirkt sich die HSV-1-Infektion von mDCs ohne Spautin-1 nicht auf die p62-Expression aus, während Spautin-1- und BA1-Behandlung eine Anhäufung von LC3B-II induzieren. Dies spiegelt die Induktion der Autophagie wider, aber ein Versagen des autophagischen Umsatzes in mDCs. Bei iDCs stellt die Spautin-1-Vorbehandlung den autophagischen Abbau von p62 bei HSV-1-Infektion aufgrund der Hemmung der Autophagie während der Initiationsphase stark wieder her. Nach der Vorbehandlung mit BA1 zeigen Mock- und HSV-1-infizierte iDCs eine starke Ansammlung von LC3B-II-Proteinspiegeln, was auf eine erfolgreiche Hemmung des autophagischen Umsatzes durch Blockierung der späten autophagosomen-lysosomen Fusion hindeutet. In Diesem Einklang führen Spautin-1 und BA1-Vorbehandlungen von mDCs ebenfalls zu stabilen p62- bzw. erhöhten LC3B-II-Proteinspiegeln.
In einer zweiten Methode zur Verdronierung des autophagischen Flusses wird die siRNA-Elektroporation, die auf FIP200 abzielt, auf ihre Fähigkeit untersucht, den autophagischen Fluss in HSV-1-infizierten iDCs zu blockieren. Wie in Abbildung 4Adargestellt, wurden in iDCs 48 h nach der Elektroporation im Vergleich zur Kontroll-siRNA stark reduzierte FIP200-Proteinspiegel nachgewiesen. Zu diesem Zeitpunkt zeigen iDCs keine Anzeichen eines Zelltodes (Abbildung 4B) und behalten ihren unreifen Phänotyp bei (Abbildung 4C). Die Infektion von FIP200-stummen iDCs mit HSV-1 zeigt eine starke Abnahme des autophagischen Flusses im Vergleich zu ihren kontrollsiRNA-behandelten Gegenstücken (Abbildung 4D). Dies geht einher mit einem erhöhten Proteingehalt von LC3B sowie p62, wenn FIP200 in HSV-1-infizierten iDCs zum Schweigen gebracht wird.
In einem umgekehrten Versuch untersuchten wir, ob die siRNA-vermittelte Ablation der KIF1B- und KIF2A-Proteinexpression auch in HSV-1-infizierten mDCs autophagosomal-lysosomalen Fluktuation ermöglicht. So wurden iDCs mit spezifischen siRNAs elektropoiert, die entweder auf eines oder beide dieser Proteine abzielten, und die Zellen wurden anschließend gereift (Abbildung 5). 2 Tage nach der Elektroporation zeigen mDCs eine starke Reduktion der KIF1B- und/oder KIF2A-Proteinexpression, wenn spezifische siRNAs verwendet wurden (Abbildung 5A). Diese Methode führte auch weder zum prominenten Zelltod (Abbildung 5B) noch zu Veränderungen ihres phäotypischen Reifungsstatus (Abbildung 5C). Durch die Unterstützung der Bedeutung von KIF1B und KIF2A während des autophagosomal-lysosomalen Abbaus erleichtert ihre Erschöpfung vor der HSV-1-Infektion einen erhöhten autophagischen Fluss in mDCs. Dies spiegelt sich in den verringerten Rest-p62-Proteinspiegeln wider, im Gegensatz zur jeweiligen Kontrollbedingung (Abbildung 5D).
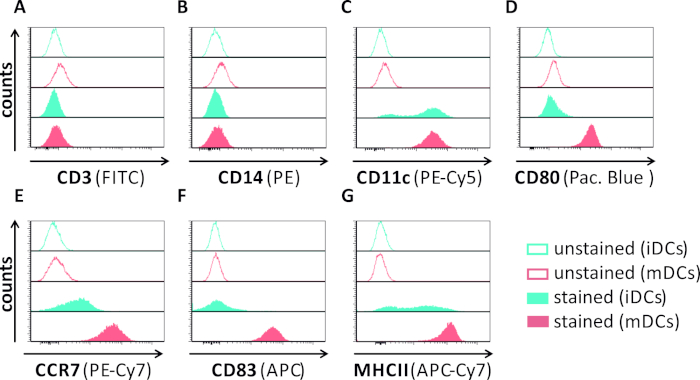
Abbildung 1: Phänotypische Charakterisierung von menschlichen Monozyten-abgeleiteten iDCs und mDCs mittels Durchflusszytometrie. DCs wurden erzeugt und mit spezifischen Antikörpern gefärbt, um ihre Reinheit zu überprüfen: (A) CD3, um T-Zellkontaminationen auszuschließen, (B) CD14, um eine Kontamination mit Monozyten auszuschließen, und (C) CD11c als Marker für DCs. Zur Beurteilung ihres phänotikischen Reifungsstatus wurden folgende Antikörper verwendet: (D) CD80, (E) CCR7, (F) CD83 und (G) MHCII. Diese Moleküle sind stark auf mDCs exprimiert und ermöglichen somit die Diskriminierung zwischen dem unreifen und reifen DC-Phänotyp. Die Daten wurden mit FCS express 5.0 analysiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
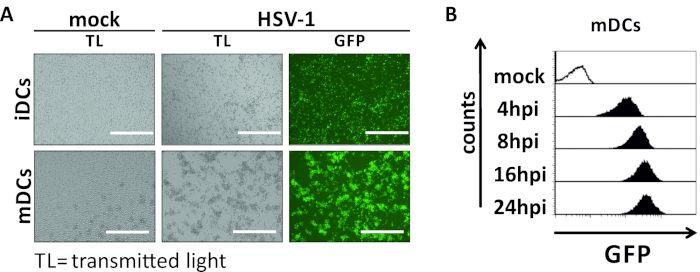
Abbildung 2: Mikroskopische sowie durchflusszytometrische Analysen von HSV-1-infizierten iDCs und mDCs. iDCs und mDCs wurden mit einem HSV-1-Stamm infiziert, der EGFP (HSV-1 EGFP) exzeichnet, um eine Quantifizierung der Infektionsrate auf basis des GFP-Signals zu ermöglichen. (A) Mikroskopische Analysen von GFP-positiven HSV-1-infizierten iDCs und mDCs, die mit einem MOI von 2 infiziert wurden, im Vergleich zu ihren nicht infizierten Gegenstücken, mit 24 PSi. Um infizierte Zellen zu visualisieren, wurde die GFP-Fluoreszenz überwacht. Der Maßstabsbalken stellt 400 m (B) Die zytometrische Messung von Mock- oder HSV-1-infizierten mDCs während der Infektionskinetik dar. Obere Paneele (schwarz gefütterte Histogramme) zeigen Mock-Zustand, untere Platten (schwarz gefüllte Histogramme) zeigen HSV-1-infizierte Zellen nach den angegebenen Zeitpunkten nach der Infektion. Die Daten wurden mit FCS express 5.0 analysiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
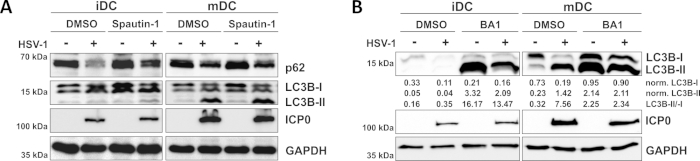
Abbildung 3: Spautin-1 und b Afilomycin-A1 modulieren den autophagischen Fluss in HSV-1-infizierten iDCs. iDCs und mDCs wurden vor der Infektion mit (A) Spautin-1 oder (B) Bafilomycin-A1 (BA1) behandelt. Zellen wurden anschließend verspottet oder HSV-1-infiziert (HSV1-RFPVP26) mit einem MOI von 2. Nach 16-18 h wurden DCs geerntet und Proteinlysate wurden dem westlichen Blotting unterzogen, um die Expression von p62 oder LC3B-I/-II als autophagische Marker, ICP0 als Infektionskontrolle und GAPDH als Ladekontrolle zu bestimmen. Der Proteingehalt von LC3B-I und LC3B-II wurde mit Bio1D (optische Dichte) quantifiziert und auf das Referenzprotein GAPDH normalisiert. Das Verhältnis von normalisierten LC3B-II zu normalisierten LC3B-I-Signalen wird angezeigt. Diese Zahl wurde modifiziert und angepasst von ©2019 Turan et al. ursprünglich in JCB veröffentlicht. https://doi.org/10.1083/jcb.20180115110. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
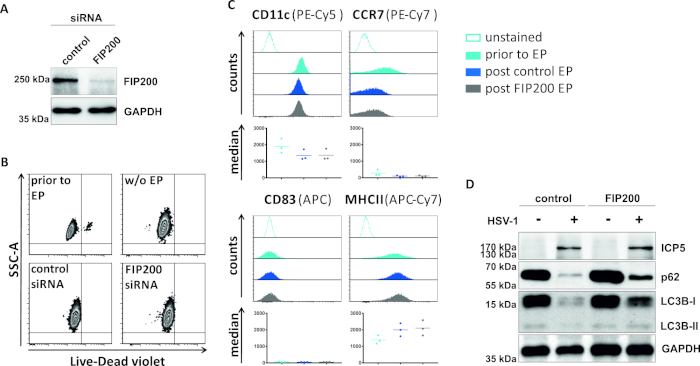
Abbildung 4: Analyse des autophagischen Flusses bei HSV-1-infizierten iDCs bei FIP200-siRNA-Elektroporation. iDCs wurden mit SteuersiRNA oder FIP200-spezifischer siRNA mit dem Elektroporationsgerät I. (A) DCs hinsichtlich der Effizienz von FIP200 Knockdown 48 h post electroporation analysiert, indem Western Blot Analysen durchgeführt wurden. (B) Die Zelllebensfähigkeit sowie der Reifestatus (C) wurden vor der Elektroporation (hellblaue Histogramme) und 48 h Post (dunkelblaue und graue Histogramme) Elektroporation durch Durchflusszytometrie analysiert. Medianwerte für drei verschiedene Spender werden angezeigt. Nach der Bestätigung des effizienten Knockdowns von FIP200 und des unreifen Phänotyps wurden die Zellen HSV-1-infiziert (HSV-1 EGFP) mit einem MOI von 2. Die Daten wurden mit FCS express 5.0 analysiert. (D) Bei 20 h nach der Infektion wurden Zellen westlichen Blot-Analysen unterzogen, um die Expression von LC3B-I/-II und p62 als autophagische Marker zu bestimmen. ICP5 wurde als Infektionskontrolle und GAPDH als Ladekontrolle erkannt. Die Panels A und D wurden von ©2019 Turan et al. modifiziert und angepasst, die ursprünglich in JCB veröffentlicht wurden. https://doi.org/10.1083/jcb.20180115110. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
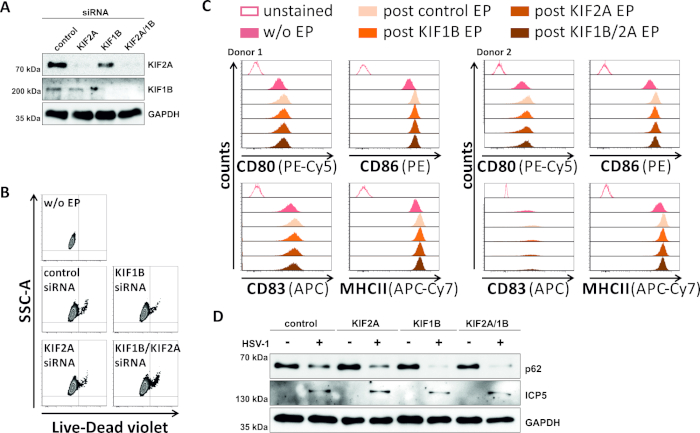
Abbildung 5: siRNA-vermittelte Ablation von KIF1B und/oder KIF2A moduliert den autophagischen Umsatz in HSV-1-infizierten mDCs. iDCs wurden mit KIF1B-spezifischem und/oder KIF2A-spezifischem siRNA sowie SteuersiRNA mit dem Elektroporationsgerät II elektropoiert. Bei 4 h nach der Elektroporation wurde die Reifung durch Zugabe eines Reifungscocktails induziert. Bei 48 h nach der Elektroporation wurden DCs hinsichtlich (A) der Effizienz des KIF-Knockdowns über Western Blotting, (B) Zelllebensfähigkeit sowie deren (C) phäkopicreifereifereifen Status mittels flow cytometrischer Analysen (zwei verschiedene Spender angezeigt werden). "w/o EP" bedeutet ohne Elektroporation, aber nach der Induktion der Reifung; "Post control EP" bezeichnet die Postelektroporation mit Derinanik; "post KIF1B, KIF2A, KIF1B/2A EP" bezeichnet die Nachelektroporation mit KIF1B- und/oder KIF2A-spezifischer siRNA. Nach der Bestätigung des effizienten Knockdowns von KIF1B und/oder KIF2A und des reifen Phänotyps wurden die Zellen HSV-1-infiziert (HSV-1 EGFP) mit einem MOI von 2. Die Daten wurden mit FCS express 5.0 analysiert. (D) Zellen wurden Western-Blot-Analysen 20 h nach der Infektion unterzogen, um die Expression von p62 als autophagischen Marker zu bewerten. ICP5 wurde als Infektionskontrolle und GAPDH als Ladekontrolle verwendet. Die Abbildungen A und D wurden von ©2019 Turan et al. geändert und angepasst, die ursprünglich in JCB veröffentlicht wurden. https://doi.org/10.1083/jcb.20180115110. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Der Anwendungsbereich dieses Protokolls umfasst (i) den Umgang mit humanen Monozyten-abgeleiteten iDCs sowie mDCs, (ii) ihre Infektion mit HSV-1, (iii) ihre Behandlung mit Verbindungen, von der bekannt ist, dass sie die Autophagie hemmt, und (iv) ihre Elektroporation mit siRNA unter Verwendung von zwei verschiedenen technischen Setups. Mit dem vorliegenden Protokoll kann der autophagische Fluss entweder in HSV-1-infizierten iDCs blockiert oder in HSV-1-infizierten mDCs induziert werden.
Da DCs, insbesondere iDCs, sehr anfällige Zellen sind, erfordert die Arbeit mit diesen Zellen ziemlich empfindliche Schritte. Für die DC-Erzeugung empfehlen wir, frisch isolierte PBMCs zu verwenden und deren Kryokonservierung zu vermeiden, um höhere Zellerträge zu erzielen. Darüber hinaus verhindern beim Umgang mit iDCs während von Experimenten, einschließlich ihrer anschließenden Kultivierung, harte oder längere Temperaturänderungen. Andernfalls können iDCs phänotypischen Veränderungen unterzogen werden und daher ist es notwendig, ihren unreifen Phänotyp durch Durchflusszytometrie zu überprüfen. Beachten Sie, dass iDCs im Gegensatz zu ihren ausgereiften Gegenstücken unterschiedliche Marker wie CD80, CD83 und CD8628,29fehlen. Die Infektion von iDCs und mDCs mit HSV-1 ist eine etablierte Methode2,3,4,5,6,10. Wir und andere zeigten, dass DCs sehr anfällig für HSV-1-Infektion sind, wenn ein MOI von 1 oder 2 verwendet wurde (Abbildung 2). In unseren Händen führt die Beibehaltung des Infektionsmediums auf niedrigem Niveau (1-3 x 106 Zellen in 250-350 l) zu einer besseren Infektionseffizienz.
Ein klassischer Ansatz, um mit einem bestimmten unterschiedlichen zellulären Weg zu stören ist die Verwendung von spezifischen Verbindungen. Eine Vielzahl von verschiedenen Modulatoren der Autophagie, d.h. Aktivatoren sowie Inhibitoren, sind derzeitverfügbar 30. In Bezug auf HSV-1-induzierte Autophagie in DCs, Turan et al., (2019) zeigte vor kurzem die hemmende Wirkung von Spautin-1 und Bafilomycin-A1 (BA1) auf den autophagischen Umsatz in iDCs10. Diese Technik zur Autophagie-Hemmung eignet sich für die Kombination mit einer nachfolgenden HSV-1-Infektion, da weder die Infektionsrate noch der Reifestatus von DCs (insbesondere iDCs) beeinträchtigt sind. In zukünftigen Anwendungen könnte dieser inhibitorbasierte Ansatz auch in Kombination mit anderen Infektionserregern, Stresszuständen wie Hunger, sowie für verschiedene Zelltypen angewendet werden. Bei der Verwendung von Inhibitoren ergeben sich jedoch Einschränkungen bei der Bestimmung der geeigneten Konzentration für eine effiziente Autophagie-Hemmung, ohne die Zelllebensfähigkeit ernsthaft zu beeinträchtigen. Die Hauptbeschränkung bei der Verwendung von Inhibitoren ist jedoch das Auftreten potenzieller Off-Target- oder Nebenwirkungen, die zu irreführenden Ergebnissen führen könnten31,32.
Der zweite Ansatz, um die Autophagie zu stören, die im vorliegenden Protokoll behandelt wird, ist der spezifische Knockdown mit siRNA33,34,35. Einerseits haben wir mit dem Elektroporationsapparat I den Ausdruck von FIP200 gezielt ablateliert und damit den HSV-1-induzierten autophagischen Umsatz in iDCs hemmt. Andererseits haben wir zwei verschiedene KIF-Proteine (z.B. KIF1B und KIF2A) mit dem Elektroporationsapparat II zum Schweigen gebracht, um den autophagischen Fluss in HSV-1-infizierten mDCs zu erleichtern. Beide Elektroporationsprotokolle führten zu einer nahezu vollständigen Ablation von FIP200 in iDCs und KIF1B/KIF2A in mDCs, die durch Western Blot-Analysen überprüft wurde (Abbildung 4A, Abbildung 5A). Im Gegensatz zum Elektroporationsgerät I, das die Lebensfähigkeit von DCs nicht beeinträchtigt, führt die Elektroporation von mDCs mit dem Elektroporationsgerät II zu etwas höheren Raten abgestorbener Zellen(Abbildung 4B, Abbildung 5B ). Daher sollte in zukünftigen Anwendungen das Elektroporationsgerät I bevorzugt sowohl für iDCs als auch für mDCs verwendet werden. Bemerkenswerterweise sind beide siRNA-basierten Techniken zur Modulation des autophagischen Flusses mit einer nachfolgenden HSV-1-Infektion von iDCs oder mDCs kompatibel. Darüber hinaus wird weder der unreife Phänotyp von iDCs noch der ausgereifte Phänotyp von mDCs nach der Elektroporation verändert.
Die Elektroporation von iDCs mit FIP200-spezifischer siRNA ist eine effiziente und hochspezifische Methode zur Genknockdown sowie hemmung des autophagischen Flusses bei HSV-1-Infektion. Zusätzlich zum spezifischen Silencing von FIP200 kann dieses Protokoll angepasst werden, um andere autophagische Komponenten zum Schweigen zu bringen, die in verschiedenen Schritten während der autophagischen Kaskade teilnehmen. Die Identifizierung des geeigneten Ziels für eine effiziente siRNA-vermittelte Hemmung der Autophagie umfasst jedoch mehrere Aspekte, die Anlass zur Sorge geben. Erstens korreliert die Knockdown-Effizienz von autophagy-bezogenen Genen (ATG) nicht unbedingt positiv mit der effizienten Hemmung der Autophagie und ist in hohem Maße abhängig von dem spezifischen ATG-Protein, das36zum Schweigen gebracht wird. Zweitens sind verschiedene ATG-Proteine zusätzlich an von der Autophagie getrennten Bahnen beteiligt, so dass ihre Ablation auch zu Nebenwirkungen führen könnte37,38,39. Drittens können verschiedene ATGs redundante Funktionen haben, so dass der Knockdown einer Komponente möglicherweise nicht ausreicht, um die Autophagie zu hemmen (z.B. beclin-1 und beclin-2)40.
Darüber hinaus eignet sich das Elektroporationsgerät I-basiertes Elektroporationsprotokoll von DCs auch für mRNAs und könnte für eine Vielzahl zusätzlicher Primärzelltypen wie PBMCs25verwendet werden. Dieses System bietet somit eine allgemeine Strategie, um verschiedene RNA-Arten in verschiedene primäre Zelltypen zu liefern. Zusammenfassend stellen wir zwei Protokolle zur Hemmung des autophagischen Flusses vor, indem wir entweder einen inhibitor- oder siRNA-basierten Ansatz in Kombination mit einer anschließenden HSV-1-Infektion von iDCs verwenden. Darüber hinaus beschreiben wir einen siRNA-Elektroporationsansatz, um einen autophagischen Fluss in mDCs bei HSV-1-Infektion zu induzieren.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde von der Deutschen Forschungsgemeinschaft (DFG) durch das Projekt STE 432/11-1 an AS und das ELAN-Programm der Medizinischen Fakultät (Friedrich-Alexander-Universität Erlangen-Nürnberg) über das Projekt 18-12-21-1, das LG vergeben wurde, unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 4D-Nucleofector Core Unit (electroporation apparatus II) | Lonza (Basel, Switzerland) | AAF-1002B | |
| AB-Serum | Sigma Aldrich Chemie GmbH (Steinheim, Germany) | H4522 | Dendritic cell cultivation |
| ACD-A | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | 9007281 | |
| Amaxa P3 Primary Cell 4D-Nucleofector X Kit L (electroporation kit apparatus II) | Lonza (Basel, Switzerland) | V4XP-3024 | |
| Amersham ECL Prime Western Blotting Detection Reagent | GE Healthcare (Solingen, Germany) | RPN2232 | Western Blot Detection |
| Ammonium persulfate (APS) | Sigma Aldrich Chemie GmbH (Steinheim, Germany) | A3678 | |
| anti-mouse-IgG (mouse, polyclonal, HRP) | Cell Signaling (Leiden, Netherlands) | 7076 | Western Blot detection |
| anti-rabbit-IgG (goat, polyclonal, HRP) | Cell Signaling (Leiden, Netherlands) | 7074 | Western Blot detection |
| Bafilomycin A1 | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | tlrl-baf1 | inhibition of autophagy and lysosomal degradation |
| BD FACS Canto II Flow Cytometer | BD Biosciences (Heidelberg, Germany) | 338962 | |
| Benzonase | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | E1014 | |
| Blotting Chamber Fastblot B44 | Biometra (Göttingen, Germany) | 846-015-100 | |
| CCR7 (mouse, Pe-Cy7) | BioLegend (Fell, Germany) | 557648 | Flow cytometry Dilution: 1:100 Clone: G043H7 |
| CD11c (mouse, Pe-Cy5) | BD Biosciences (Heidelberg, Germany) | 561692 | Flow cytometry Dilution: 1:100 Clone: B-ly6 |
| CD14 (mouse, PE) | BD Biosciences (Heidelberg, Germany) | 555398 | Flow cytometry Dilution: 1:100 Clone: M5E2 |
| CD3 (mouse, FITC) | BD Biosciences (Heidelberg, Germany) | 555332 | Flow cytometry Dilution: 1:100 Clone: UCHT1 |
| CD80 (mouse, V450) | BD Biosciences (Heidelberg, Germany) | 560442 | Flow cytometry Dilution: 1:100 Clone: L307.4 |
| CD83 (mouse, APC) | eBioscience Thermo Fisher Scientific (Langenselbold, Germany) | 17-0839-41 | Flow cytometry Dilution: 1:200 Clone: HB15e |
| CD86 (mouse, PE) | BD Biosciences (Heidelberg, Germany) | 553692 | Flow cytometry Dilution: 1:100 |
| EVOS FL Cell Imaging | System AMG/Life Technologies (Carlsbad, USA) | AMF4300 | |
| FIP200 (rabbit) | Cell Signaling (Leiden, Netherlands) | 12436 | Western Blot detection Dilution: 1:1000 Clone: D10D11 |
| GAPDH (mouse) | Merck Millipore (Massachusetts, USA) | AB2302 | Western Blot detection Dilution: 1:5000 Clone: MAB374 |
| Gene Pulser II apparatus (electroporation apparatus I) | BioRad Laboratories GmbH (München, Germany) | 165-2112 | |
| GM-CSF (4x104 U/mL) | Miltenyi Biotec (Bergisch Gladbach, Germany) | 130-093-868 | |
| HLA?DR (mouse, APC-Cy7) | BioLegend (Fell, Germany) | 307618 | Flow cytometry Dilution: 1:200 Clone: L243 |
| HSV-1/17+/CMV-EGFP/UL43 | BioVex | DC infection | |
| ICP0 (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-53070 | Western Blot detection Dilution: 1:1000 Clone: 11060 |
| ICP5 (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-56989 | Western Blot detection Dilution: 1:1000 Clone: 3B6 |
| IL-1β (0.1x106 U/mL) | Cell Genix GmbH (Freiburg, Germany) | 1411-050 | |
| IL-4 (1x106 U/mL) | Miltenyi Biotec (Bergisch Gladbach, Germany) | 130-093-924 | |
| IL-6 (1x106 U/mL) | Cell Genix GmbH (Freiburg, Germany) | 1404-050 | |
| ImageQuant LAS 4000 | GE Healthcare (Solingen, Germany) | 28955810 | |
| KIF1B (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-376246 | Western Blot detection Dilution: 1:1000 Clone: E-12 |
| KIF2A (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-271471 | Western Blot detection Dilution: 1:1000 Clone: D-7 |
| LC3B (rabbit) | Cell Signaling (Leiden, Netherlands) | 3868 | Western Blot detection Dilution: 1:1000 Clone: D11 |
| L-glutamine | Lonza (Basel, Switzerland) | 17-605E | |
| LIVE/DEAD Fixable Violet dead cell stain kit | Life Technologies (Carlsbad, CA, USA) | L34964 | L/D staining in Flow cytometry |
| Lymphoprep | Alere Technologies AS (Oslo, Norway) | 04-03-9391/01 | |
| Magnesiumchloride | Carl Roth GmbH (Karlsruhe, Germany) | A537.1 | |
| Megafuge 2.0 RS | Heraeus (Hanau, Germany) | 75015505 | |
| N, N, N', N'-Tetramethylethylendiamine (TEMED) | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | T9281 | |
| Neubauer counting chamber | Brand (Wertheim, Germany) | 717805 | |
| Nunc Cell culture flasks (175.0 cm2) | Thermo Scientific (Rockford, USA) | 159910 | |
| p62 (rabbit) | Cell Signaling (Leiden, Netherlands) | 88588 | Western Blot detection Dilution: 1:1000 Clone: D5L7G |
| PageRuler prestained protein ladder | Thermo Fisher Scientific (Langenselbold, Germany) | 26616 | |
| Paraformaldehyde, 16 % | Alfa Aesar, Haverhill, USA | 43368.9M | |
| PerfectSpin 24 Plus | Peqlab (Erlangen, Germany) | C2500-R-PL | |
| PGE2 (1 mg/mL) | Pfizer (Berlin, Germany) | BE130681 | |
| Phosphate buffered saline (PBS) | Lonza (Basel, Switzerland) | 17-512F | |
| Protein gel system MiniProtean II | Bio-Rad Laboratories GmbH (München, Germany) | 1652960 | |
| RestoreTM Western Blot Stripping Buffer | Thermo Scientific, Rockford, USA | 21059 | |
| Rocking Platform wt 15 | Biometra (Göttingen, Germany) | 042-590 | |
| RotiBlock | Carl Roth GmbH (Karlsruhe, Germany) | A151.4 | |
| Roti-Load 1 (4x) | Carl Roth GmbH (Karlsruhe, Germany) | K929.3 | |
| Rotiphorese Gel 30 (37.5:1) | Carl Roth GmbH (Karlsruhe, Germany) | 3029.1 | |
| RPMI 1640 | Lonza (Basel, Switzerland) | 12-167F | |
| Sodium dodecyl Sulfate (SDS) | Carl Roth GmbH (Karlsruhe, Germany) | 2326.2 | |
| Thermomixer comfort | Eppendorf (Hamburg, Germany) | 5355 000.011 | |
| TNF-α (10 μg/mL) | Peprotech (Hamburg, Germany) | 300-01A | |
| Tris | Carl Roth GmbH (Karlsruhe, Germany) | 4855.3 | |
| Trypan blue solution (0.4 %) | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | T8154 | |
| Tween 20 | Carl Roth GmbH (Karlsruhe, Germany) | 9127.1 | |
| Whatman 0.2 μm nitrocellulose membrane | GE Healthcare (Solingen, Germany) | 10600001 | |
| WhatmanTM Chromatography Paper 3 mm Chr | Fisher Scientific GmbH (Schwerte, Germany) | 3030917 |
Referenzen
- Chapuis, F., Rosenzwajg, M., Yagello, M., Ekman, M., Biberfeld, P., Gluckman, J. C. Differentiation of human dendritic cells from monocytes in vitro. European Journal of Immunology. 27 (2), 431-441 (1997).
- Kummer, M., et al. Herpes simplex virus type 1 induces CD83 degradation in mature dendritic cells with immediate-early kinetics via the cellular proteasome. Journal of Virology. 81 (12), 6326-6338 (2007).
- Kruse, M., et al. Mature dendritic cells infected with herpes simplex virus type 1 exhibit inhibited T-cell stimulatory capacity. Journal of Virology. 74 (15), 7127-7136 (2000).
- Salio, M., Cella, M., Suter, M., Lanzavecchia, A. Inhibition of dendritic cell maturation by herpes simplex virus. European Journal of Immunology. 29 (10), 3245-3253 (1999).
- Prechtel, A. T., et al. Infection of mature dendritic cells with herpes simplex virus type 1 dramatically reduces lymphoid chemokine-mediated migration. Journal of General Virology. 86, 1645-1657 (2005).
- Theodoridis, A. A., Eich, C., Figdor, C. G., Steinkasserer, A. Infection of dendritic cells with herpes simplex virus type 1 induces rapid degradation of CYTIP, thereby modulating adhesion and migration. Blood. 118 (1), 107-115 (2011).
- Cohrs, R. J., Gilden, D. H. Human herpesvirus latency. Brain Pathology. 11 (4), 465-474 (2001).
- Grinde, B. Herpesviruses: latency and reactivation - viral strategies and host response. Journal of Oral Microbiology. 5, (2013).
- Whitley, R. J., Roizman, B. Herpes simplex virus infections. The Lancet. 357 (9267), 1513-1518 (2001).
- Turan, A., et al. Autophagic degradation of lamins facilitates the nuclear egress of herpes simplex virus type 1. The Journal of Cell Biology. 218 (2), 508-523 (2019).
- Takeshige, K., Baba, M., Tsuboi, S., Noda, T., Ohsumi, Y. Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction. The Journal of Cell Biology. 119 (2), 301-311 (1992).
- Yin, Z., Pascual, C., Klionsky, D. J. Autophagy: machinery and regulation. Microbial Cell. 3 (12), 588-596 (2016).
- Bodemann, B. O., et al. RalB and the exocyst mediate the cellular starvation response by direct activation of autophagosome assembly. Cell. 144 (2), 253-267 (2011).
- Bjorkoy, G., et al. p62/SQSTM1 forms protein aggregates degraded by autophagy and has a protective effect on huntingtin-induced cell death. The Journal of Cell Biology. 171 (4), 603-614 (2005).
- Kabeya, Y., et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing. The EMBO Journal. 19 (21), 5720-5728 (2000).
- Kabeya, Y., Mizushima, N., Yamamoto, A., Oshitani-Okamoto, S., Ohsumi, Y., Yoshimori, T. LC3, GABARAP and GATE16 localize to autophagosomal membrane depending on form-II formation. Journal of Cell Science. 117, 2805-2812 (2004).
- Pankiv, S., et al. p62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy. The Journal of Biological Chemistry. 282 (33), 24131-24145 (2007).
- Korolchuk, V. I., Rubinsztein, D. C. Regulation of autophagy by lysosomal positioning. Autophagy. 7 (8), 927-928 (2011).
- Li, Y., et al. A cell-based quantitative high-throughput image screening identified novel autophagy modulators. Pharmacological Research. 110, 35-49 (2016).
- Pampaloni, F., et al. A Novel Cellular Spheroid-Based Autophagy Screen Applying Live Fluorescence Microscopy Identifies Nonactin as a Strong Inducer of Autophagosomal Turnover. SLAS Discovery. 22 (5), 558-570 (2017).
- Deng, Y., Zhu, L., Cai, H., Wang, G., Liu, B. Autophagic compound database: A resource connecting autophagy-modulating compounds, their potential targets and relevant diseases. Cell Proliferation. 51 (3), 12403 (2018).
- Liu, J., et al. Beclin1 controls the levels of p53 by regulating the deubiquitination activity of USP10 and USP13. Cell. 147 (1), 223-234 (2011).
- Mauvezin, C., Neufeld, T. P. Bafilomycin A1 disrupts autophagic flux by inhibiting both V-ATPase-dependent acidification and Ca-P60A/SERCA-dependent autophagosome-lysosome fusion. Autophagy. 11 (8), 1437-1438 (2015).
- Yoshimori, T., Yamamoto, A., Moriyama, Y., Futai, M., Tashiro, Y. Bafilomycin A1, a specific inhibitor of vacuolar-type H(+)-ATPase, inhibits acidification and protein degradation in lysosomes of cultured cells. Journal of Biological Chemistry. 266 (26), 17707-17712 (1991).
- Gerer, K. F., Hoyer, S., Dorrie, J., Schaft, N. Electroporation of mRNA as Universal Technology Platform to Transfect a Variety of Primary Cells with Antigens and Functional Proteins. Methods in Molecular Biology. 1499, 165-178 (2017).
- Prechtel, A. T., Turza, N. M., Theodoridis, A. A., Steinkasserer, A. CD83 knockdown in monocyte-derived dendritic cells by small interfering RNA leads to a diminished T cell stimulation. The Journal of Immunology. 178 (9), 5454-5464 (2007).
- Pfeiffer, I. A., et al. Leukoreduction system chambers are an efficient, valid, and economic source of functional monocyte-derived dendritic cells and lymphocytes. Immunobiology. 218 (11), 1392-1401 (2013).
- Villadangos, J. A., Heath, W. R. Life cycle, migration and antigen presenting functions of spleen and lymph node dendritic cells: limitations of the Langerhans cells paradigm. Seminars in Immunology. 17 (4), 262-272 (2005).
- Lechmann, M., Berchtold, S., Hauber, J., Steinkasserer, A. CD83 on dendritic cells: more than just a marker for maturation. Trends in Immunology. 23 (6), 273-275 (2002).
- Yang, Y. P., et al. Application and interpretation of current autophagy inhibitors and activators. Acta Pharmacologica Sinica. 34 (5), 625-635 (2013).
- Redmann, M., et al. Inhibition of autophagy with bafilomycin and chloroquine decreases mitochondrial quality and bioenergetic function in primary neurons. Redox Biology. 11, 73-81 (2017).
- Yan, Y., et al. Bafilomycin A1 induces caspase-independent cell death in hepatocellular carcinoma cells via targeting of autophagy and MAPK pathways. Scientific Reports. 6, 37052 (2016).
- Hale, C. M., et al. Identification of modulators of autophagic flux in an image-based high content siRNA screen. Autophagy. 12 (4), 713-726 (2016).
- Lipinski, M. M., et al. A genome-wide siRNA screen reveals multiple mTORC1 independent signaling pathways regulating autophagy under normal nutritional conditions. Developmental Cell. 18 (6), 1041-1052 (2010).
- Orvedahl, A., et al. Image-based genome-wide siRNA screen identifies selective autophagy factors. Nature. 480 (7375), 113-117 (2011).
- Staskiewicz, L., Thorburn, J., Morgan, M. J., Thorburn, A. Inhibiting autophagy by shRNA knockdown: cautions and recommendations. Autophagy. 9 (10), 1449-1450 (2013).
- Lee, I. H., et al. Atg7 modulates p53 activity to regulate cell cycle and survival during metabolic stress. Science. 336 (6078), 225-228 (2012).
- Fremont, S., Gerard, A., Galloux, M., Janvier, K., Karess, R. E., Berlioz-Torrent, C. Beclin-1 is required for chromosome congression and proper outer kinetochore assembly. EMBO Reports. 14 (4), 364-372 (2013).
- Bestebroer, J., V'kovski, P., Mauthe, M., Reggiori, F. Hidden behind autophagy: the unconventional roles of ATG proteins. Traffic. 14 (10), 1029-1041 (2013).
- Galluzzi, L., Kroemer, G. Common and divergent functions of Beclin 1 and Beclin 2. Cell Research. 23 (12), 1341-1342 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten