Method Article
eletroporação siRNA para modular a autofagia em herpes simplex vírus tipo 1 infectado monocyte derivados células dendríticas
Neste Artigo
Resumo
Neste estudo, apresentamos estratégias baseadas em inibidor e siRNA para interferir com o fluxo autofárgico no vírus Herpes simplex tipo 1 (HSV-1) células dendríticas derivadas de monocyte infectadas.
Resumo
Herpes simplex vírus tipo 1 (HSV-1) induz a autofagia em ambas, células dendríticas imaturas (iDCs), bem como células dendríticas maduras (MDCs), enquanto o fluxo autofárgico só é observado em iDCs. Para obter insights mecanicistas, desenvolvemos estratégias eficientes para interferir com o volume de negócios autofágico induzido pelo HSV-1. Uma estratégia baseada em inibidor, para modular a autofagia induzida pelo HSV-1, constitui a primeira escolha, uma vez que é um método fácil e rápido. Para contornar potenciais efeitos inespecíficos fora do alvo de tais compostos, desenvolvemos uma estratégia alternativa baseada em siRNA, para modular o volume de negócios autofágico em iDCs após a infecção pelo HSV-1. De fato, a eletroporação de iDCs com siRNA específico da FIP200 antes da infecção pelo HSV-1 é um método muito específico e bem-sucedido para alovar a expressão de proteína FIP200 e, assim, inibir o fluxo autofárgico. Ambos os métodos apresentados resultam na inibição eficiente do volume de negócios autofágico induzido por HSV-1 em iDCs, pelo qual a técnica baseada em siRNA é mais específica do alvo. Uma abordagem adicional baseada em siRNA foi desenvolvida para silenciar seletivamente a expressão proteica de KIF1B e KIF2A, facilitando o volume de negócios autofágico sobre a infecção por HSV-1 em MDCs. Em conclusão, a técnica de eletroporação de siRNA representa uma estratégia promissora, para ablatina seletivamente da expressão de proteínas distintas e analisar sua influência sobre uma infecção por HSV-1.
Introdução
A geração de células dendríticas deolador sumido santem (DCs) constitui um modelo in vitro apropriado para estudar as funções e biologia deste importante tipo de célulaimune. O isolamento, bem como a diferenciação de monócitos em DCs tem sido bem estabelecida nos últimos anos1,2. A infecção de DCs com o vírus do herpes vírus α-herpes vírus simplex tipo 1 (HSV-1) serve como um sistema modelo para estudar modulações mediadas pelo HSV-1 da biologia dc2,3,4,5, 6 . Isto é particularmente importante para elucidar como herpesvírus umedecer ou inibir potentes respostas imunes antivirais, para estabelecer latência em nichos imunes privilegiados dentro do host7,8. A este respeito, os herpesvírus são patógenos muito bem sucedidos que são amplamente espalhados por toda a população atingindo uma prevalência de soro de até 90% de acordo com a região geográfica9. Para entender e possivelmente prevenir isso, mais insights sobre as modulações mediadas pelo HSV-1 do sistema imunológico do hospedeiro, e especialmente de células imunes, como DCs, são necessários.
Uma observação completamente nova sobre a interação de DCs com HSV-1 foi recentemente publicada pela Turan et al.10. Os autores demonstraram que a realização da replicação do HSV-1 é estritamente dependente do status de maturação das DCs. Nos iDCs, a replicação completa do HSV-1 é facilitada por mecanismos dependentes da autofagia. Enquanto hsv1 induz autofagia em ambos, iDCs e mDCs, fluxo autofágico é observado apenas em iDCs. Isso, por sua vez, facilita a saída nuclear de capsídeos virais através da degradação autofágica de laminados nucleares em iDCs. Para obter insights mecanicistas sobre essa via de degradação induzida pelo HSV-1 em iDCs versus mDCs, estratégias novas e eficientes são fundamentais para investigar o fluxo autofágico.
A macroautofagia (autofagia) é um processo multipasso bem conservado que visa proteínas intracelulares ou organelas inteiras para digestão lysossômica11. Simplistamente, a autofagia pode ser dividida na iniciação (i), (ii) nucleação de membrana, (iii) expansão vesícula e (iv) fase de fusão autofagossoma-lysossoma12. Durante a iniciação (i), componentes como o complexo ativado de kinase ULK1/2, contendo a proteína de interação da família de adesão focal kinase de 200 kD (FIP200), são fundamentais para ativar o complexo beclin-1-Vps34-AMBRA1. Posteriormente, a nucleação da membrana (ii) inicia a formação do fagoforre13,que envolve cargas citoplasmasma que são marcadas por moléculas como p6214. Durante a expansão da vesícula e maturação autofagosa (iii) cadeia de luz de proteína associada ao microtúbulo 3 (LC3)-I é convertida em sua forma lipirosa LC3-II que é inserida na membrana autofagossômica. Assim, as taxas de conversão LC3-I a -II são um indicador de indução de autofagia, espelhando a formação de autofagossomos maduros15,16. Após a fusão autofagossoma-lisôsomesoma (iv), não só a carga autofágica, mas também as proteínas p62 e LC3-II associadas sofrem degradação (por exemplo, por hidrólise). Assim, a perda de p62 e LC3-II serve como marcadores para o fluxo autofágico17. A fusão de autofagossomos com lisósomos e, portanto, após o volume de negócios autofárgico, é altamente dependente da localização lisossômica intracelular. Isto é, entre outros, regulado pelos membros da família kinesin KIF1B e KIF2A, que foram mostrados para afetar negativamente a fusão autophagosome-lysosome18. Curiosamente, a expressão proteica de KIF1B e KIF2A é induzida após a maturação dc e é, assim, responsável pelo fluxo autofágico ineficiente em MDCs infectados pelo HSV-1, o que dificulta a replicação completa do HSV-110.
Tentativas experimentais de modular a autofagia incluem o uso de compostos conhecidos por induzir ou inibir esta via particular19,20,21. Neste estudo, descrevemos duas estratégias baseadas em inibidores para bloquear o volume de negócios autofágico em IDCs infectados por HSV-1. O primeiro composto utilizado em nossos experimentos é o inibidor específico e potente da autofagia-1 (spautina-1), que foi descrito para promover a degradação complexa de beclin-1-Vps34-AMBRA1 durante a fase de iniciação da autofagia22. O segundo composto utilizado no presente estudo é bafilomicina-A1 (BA1), um inibidor v-ATPase que bloqueia os eventos autofágicos tardios (ouseja, fusão autofagossoma-lisôsoma, bem como acidificação autolísosoma)23,24. O uso de qualquer um desses dois inibidores antes da infecção pelo IDC com HSV-1 potentemente inibe a autofagia, mas não perturba a expressão genética viral eficiente. Assim, essa estratégia baseada em inibidor antes da infecção pelo HSV-1 oferece uma ferramenta poderosa para inibir o fluxo autofágico induzido pelo VSV-1 que pode ser facilmente expandido para uma infinidade de diferentes tipos de células e vírus, que também potencialmente induzem a autofagia.
Para superar uma grande desvantagem de uma abordagem baseada em inibidor (ouseja, efeitos não específicos fora do alvo), desenvolvemos um método baseado em siRNA para bloquear o fluxo autofárgico em iDCs (infectados pelo HSV-1). A técnica de eletroporação siRNA representa uma poderosa estratégia alternativa, via ablação seletiva da expressão de proteínas distintas (ou seja, componentes autofágicos). Em nossos experimentos os iDCs foram eletroporados com siRNA específico da FIP200 usando o aparelho de eletroporação I (ver Tabela de Materiais)e um protocolo modificado descrito por Gerer et al. (2017) e Prechtel et al. (2007), para inibir a autofagia durante a autofagia durante a autofagia durante a autofagia durante a autofagia durante a autofagia durante a autofagia durante a autofagia durante a autofagia durante a autofagia durante a autofagia durante a autofagia durante a autofagia durante a autofagia durante a autofagia durante a autofagia durante a autofagia durante a autofagia durante a autofagia durante a autofagia durante a autofagia durante a autofagia durante a autofagia fase de iniciação25,26. Esta técnica nos permitiu especificamente knockdown fip200 expressão em iDCs, sem interferir com a viabilidade celular e seu fenótipo imaturo dois dias após eletroporação. Notável, a infecção por HSV-1 foi estabelecida nesses iDCs eletroporados espelhados pela expressão de proteína viral eficiente. Esta técnica baseada em siRNA oferece um benefício único (ou seja, que uma variedade de diferentes componentes autofágicos, mesmo em combinação), pode ser especificamente orientada para a ablação de sua expressão.
Neste estudo, descrevemos ainda um método baseado em siRNA para induzir o fluxo autofágico também em MDCs infectados por HSV-1. Neste caso, os iDCs foram eletroporados com siRNA direcionado contra KIF1B e KIF2A antes da maturação dc usando o aparelho de eletroporação II (ver Tabela de Materiais). Uma vez que ambas as proteínas são upregulated durante a maturação DC e conhecido por regular negativamente a fusão de autofagossomos com lisossomos10,18, seu knockdown fortemente induzida fluxo autofágico em MDCs sobre hsv-1 infecção. Assim, a técnica baseada em siRNA nos permitiu induzir especificamente o volume de negócios autofágico através de interferir com a expressão de proteína KIF em MDCs, e poderia, assim, imitar seus níveis de expressão em iDCs.
Em resumo, apresentamos dois métodos distintos para inibir o fluxo autofágico em IDCs infectados por HSV-1. Embora a primeira abordagem baseada em inibidor constitua uma maneira fácil, barata e rápida de interferir na degradação autofágica, a segunda técnica baseada em siRNA é mais específica e um método muito adequado para suportar e verificar os resultados da degradação baseada em inibidores Experiências. Além disso, descrevemos um método para induzir o fluxo autofágico também em MDCs infectados pelo HSV-1, através do knockdown mediado pelo siRNA de duas proteínas KIF.
Protocolo
DCs derivados de monocyte foram gerados a partir de produtos leukapheresis de doadores saudáveis. Para isso, um voto positivo do comitê de ética local foi obtido (referência número 4556). Os experimentos do presente estudo foram realizados de acordo com as recomendações do comitê de ética do "Friedrich-Alexander-Universität Erlangen-Nürnberg" (referência número 4556). Todos os doadores aprovaram um consentimento informado por escrito, incluindo o acordo com a Declaração de Helsínquia.
1. Geração e manuseio de células dendríticas imaturas (IDCs) e células dendríticas maduras (MDCs)
- Isolar as células mononucleares do sangue periférico humano (PBMCs) das câmaras do sistema de leukoreduction (LRSCs), conforme descrito anteriormente27. Evite a criopreservação de PBMCs e use-os diretamente após o isolamento para obter maiores rendimentos de DC.
- Gerar DCs humanos de PBMCs de diferentes doadores saudáveis em frascos de cultura celular T175, como descrito anteriormente10,27. Resumidamente, use 350-400 milhões de PBMCs em 30 mL de DC médio (RPMI 1640 sem L-glutamina, 1% (v/v) AB-soro, 100 U/mL penicilina, 100 mg/mL estreptomicina, 0,4 mM L-glutamina, 10 mM HEPES) por frasco de cultura celular para isolamento de monócitos pela adesão. Após 1 h, lave a fração não aderente usando RPMI 1640. Adicione o meio fresco dc complementado com 800 U/mL GM-CSF e 250 U/mL IL-4, e incubar por 3 dias.
- No dia 3 após a adesão, adicione 5 mL de dc fresco médio contendo GM-CSF e IL-4 com uma concentração final de 400 U/mL e 250 U/mL por frasco de cultura celular, respectivamente, para diferenciação DC.
- Para colher iDCs, enxaguar suavemente iDCs vagamente aderentes do fundo do frasco de cultura celular, no dia 4 após a adesão. Repita este passo 2 vezes. Para geração de mDCs, adicione coquetel de maturação composto da seguinte forma: GM-CSF (concentração final: 40 U/mL), IL-4 (concentração final: 250 U/mL), IL-6 (concentração final: 1000 U/mL), IL-1β (concentração final: 200 U/mL), TNF-α (concentração final: 10 ng/ mL), prostaglandina E2 (PGE2; concentração final: 1 μg/mL).
- Seis dias após a adesão (dois dias após a indução da maturação usando um coquetel de citocina), enxaguar mDCs da parte inferior do frasco de cultura celular. Repita este passo duas vezes.
NOTA: DCs imaturos e maduros podem ser gerados sequencialmente a partir de doadores idênticos em 1 frasco de cultura celular. Para fazer isso, (i) separar o número adequado de iDCs e (ii) induzir a maturação das células restantes nos frascos usando o coquetel de citocina listados na etapa 1.2.2.
- Transfira iDCs ou mDCs no respectivo meio de cultura celular em tubos de 50 mL. Colher as células através de centrífuga a 300 x g por 5 min.
- Resuspende delicadamente (=wash) DCs em 5-10 mL de RPMI 1640 por frasco da cultura da pilha. Combine as respectivas suspensões dc em um tubo.
- Defina o número celular usando uma câmara de contagem ou um método alternativo. Evite alterações de temperatura ao manusear iDCs, para reduzir o risco de alterações phenotípicas.
2. Análises citométricas de fluxo para monitorar o estado de maturação phenotípica
- Transfira iDCs ou mDCs (0,5 x 106)do passo 1.3.1 para um tubo de 1,5 mL. Colher as células via centrífuga a 3390 x g por 1,5 min. Lave as células uma vez com tampão FACS (PBS complementado com 2% de soro de vitela fetal (FCS)).
- Resuspenda as células em 100 μL de solução de coloração de anticorpos (tampão FACS) contendo anticorpos específicos com rótulo fluorocromático contra moléculas de superfície definidas.
- Use os seguintes anticorpos para verificar a pureza (CD3-FITC, CD14-PE), bem como o status de maturação das DCs (CD80-PacBlue/-PE-Cy5, CD11c-PE-Cy5, CCR7-PE-Cy7, CD83-APC, CD86-PE, MHCII-APC-Cy7).
- Prepare uma amostra não manchada em 100 μL de buffer FACS como um controle.
- Manchar as células no gelo no escuro por 30 min.
- Posteriormente lavar as células duas vezes em 1 mL de buffer FACS e centrífuga em 3390 x g para 1,5 min.
- Finalmente, resuspender as células em 200 μL de tampão FACS complementado com 2% PFA e analisar as células por citometria de fluxo. As células fixas podem ser armazenadas a 4°C no escuro até 2 dias.
3. Procedimento de infecção de DCs com herpes simplex vírus tipo 1 (HSV-1) e interferência de HSV-1 induzida fluxo autofágico via spautina-1 ou bafilomicina-A1
NOTA: A cepa HSV-1/17+/CMV-EGFP/UL43 (HSV-1 EGFP) utilizada neste estudo foi obtida a partir da cepa laboratorial Cepa HSV-1 cepa 17+. A estirpe HSV-1 EGFP expressa a proteína fluorescente verde melhorada (EGFP) que foi inserida no locus genético UL43 controlo do promotor cmv. O EGFP serve como marcador para a infecção pelo HSV-1. Além disso, a cepa HSV1-RFPVP26 foi usada para estudos de infecção por DC (anteriormente descrita em Turan et al., 2019). Este vírus expressa a proteína de superfície capsid VP26 fundida à proteína fluorescente vermelha monomer (mRFP).
- Transfira iDCs ou mDCs (2 x 106)do passo 1.3 para um tubo de 2 mL. Posteriormente, centrífugas as células em 3390 x g para 1,5 min e descartar o supernatant.
- Resuspende delicadamente as pilhas no meio da infecção (RPMI 1640 suplementado com 20 mM HEPES).
- Para inibir a via de degradação autofagossômica-lysossômica, pré-tratar DCs com spautina-1 ou bafilomicina-A1 1 h antes da infecção. Adicione 10 μM spautin-1 ou 1 μM BA1, ou DMSO como controle não tratado, ao meio de infecção. Incubar as células em um bloco de aquecimento a 300 rpm tremendo a 37 °C para 1 h.
- Para estudos de infecção, inocular as células com virions HSV-1 em uma multiplicidade de infecção (MOI) de 2. Adicione o respectivo volume de mnt buffer (30 mm 2-(N-morpholino) ácido ethanesulfonic (MES), 100 mM NaCl, 20 mM Tris) como controle simulado. Incubar as células em um bloco de aquecimento a 300 rpm tremendo a 37 °C para 1 h.
- 1 h após infecção (hpi), coletar as células em 3390 x g para 1,5 min. Aspirar inóculo e resuspender suavemente as células em DC médio contendo 40 U/mL de GM-CSF, 250 U/mL de IL-4 e 10 μM spautin-1, 1 μM BA11, ou DMSO como controle. Células tratadas com sementes e infectadas por HSV-1, emuma concentração final de 1 x 10 6/mL em uma placa de 6 poços.
- Em 16-24 hpi, colher as células por enxaguar (mDCs) ou usando um raspador de células (iDCs). Transfira as células para um tubo de segurança de 1,5 mL.
- Colete as células via centrífuga a 3390 x g por 1,5 min e lave a pelota uma vez adicionando 1 mL de PBS.
- Resuspende vigorosamente as células em mistura de lyse contendo 29 μL de 2x Roti-Load, 1 μL 100 mM MgCl2 e 12,5 U/mL benzonase.
- Para a disse celular e digestão de DNA usando benzonase, incubar as amostras em 37 °C para 10 min. Posteriormente, desnaturar as proteínas em 95 °C por 10 min.
- Realize análises de sds-page e borrão ocidental para verificar os níveis de proteína de LC3BI/II, p62, ICP0/5 e GAPDH.
4. Interferência do fluxo autofágico induzido por HSV-1 por meio de eletroporação de iDCs usando FIP200-siRNA
NOTA: O protocolo atual para eletroporação de siRNA foi modificado de Prechtel et al. (2007) e Gerer et al. (2017).
- Transfira iDCs (12 x 106)no dia 3.5 após a adesão em um tubo de 50 mL. Posteriormente, centrífugas as células a 300 x g por 5 min e descartar o supernatant. Em paralelo, realize análise citométrica de fluxo para monitorar o status de maturação descrito no passo 2 (Use Life/Dead violeta em vez de CD80-PacBlue).
- Lave suavemente os iDCs em 5 mL de OptiMEM sem fenol vermelho e centrífuga as células a 300 x g por 5 min. Descarte os iDCs supernatantes e resuspendem suavemente em 200 μL de OptiMEM sem fenol vermelho, ajustando uma concentração celular de 6 x 106/100 μL. Não coloque as células no gelo e evitar alterações de temperatura. Siga em frente rapidamente e evite longos períodos de incubação de iDCs em OptiMEM sem fenol vermelho.
- Transfira 75 pmol de siRNA específico da FIP200 ou 75 pmol de siRNA mexido, como controle, para 4 mm de eletro cuvettes e adicione 100 μL (6x106 células) da suspensão celular. Diretamente pulso iDCs usando o aparelho de eletroporação I, aplicando as seguintes configurações: 500 V para 1 ms.
- Antes do procedimento experimental, prepare suspensões de siRNA de acordo com a instrução do fabricante, alíquota e armazená-las a -20 °C. Descongele e mantê-los no gelo ao usar estes siRNAs para eletroporação. Antes de eletroporating as amostras, execute um pulso do teste.
- Após a eletroporação, transferir diretamente o iDC para placas de 6 poços com fresco meio DC pré-aquecido (complementado com 40 U/mL de GM-CSF e 250 U/mL de IL-4). Semeie as células em uma concentração final de 1 x 106/mLe coloque-as em uma incubadora. Não lave as células para fora do electro cuvette.
- Após 48 h, primeiro examine a morfologia de iDCs eletroporados microscópico. Em seguida, colher as células usando um raspador de células e transferi-los em tubos de 15 mL. Lave os poços com 1 mL de PBS complementado com 0,01% EDTA e transferir a solução nos respectivos tubos.
- Posteriormente, dividir 6 x 106 iDCs por condição siRNA, conforme descrito nos próximos passos.
- Use 0,5 x 106 células para avaliar o estado de maturação e viabilidade celular, conforme descrito na etapa 2. Use os seguintes anticorpos: CD11c-PE-Cy5, CCR7-PE-Cy7, CD83-APC, MHCII-APC-Cy7 e VioletLife/Dead.
- Use 1 x 106 células para análises de borrões ocidentais para verificar a eficiência específica do knockdown da FIP200. Transfira e colha as células para um tubo de bloqueio seguro de 1,5 mL por centrífuga a 3390 x g por 1,5 min. Prepare as lysates celulares descritas no passo 3.4 e realize análises de borrões ocidentais.
- Use as células restantes (4,5 x 106)para experimentos de infecção por HSV-1. Para cada condição experimental, transfira 2,25 x 106 iDCs em tubos de 2 mL e infecte-os com HSV1 em um MOI de 2 ou adicionar buffer MNT como um controle simulado. Realize a infecção conforme descrito no passo 3.3.
- Em 20 hpi, colha as pilhas usando um raspador da pilha e prepare lysates da pilha para análises ocidentais do borrão como descrito na etapa 3.4.
5. Modulação da via autofagossômica em MDCs infectados por HSV-1 usando eletroporação KIF1B/2A-siRNA
- Transfira iDCs (24 x 106)no dia 4 após a adesão a um tubo de 50 mL. Posteriormente, centrífugas as células a 300 x g por 5 min e descartar o supernatant.
- Resuspende suavemente (= lavagem) iDCs em 8 mL de PBS, para ajustar uma concentração de células final de 3 x 106/mL. Transfira 3 x 106 células para tubos de 1,5 mL e colha as células a 3390 x g por 1,5 min.
- Resuspender os iDCs em 100 μL de buffer P3 contendo a mistura de suplemento (de acordo com as instruções do fabricante; aparelho de kit de eletroporação II) e (i) 75 pmol de SiRNA específico da KIF1B, (ii) 75 pmol de siRNA específico da KIF2A, ou (iii) ambos. Use (iv) a respectiva quantidade de siRNA mexidos como um controle. Prepare dois tubos para cada condição de siRNA (6 x 106 células) e transfira as suspensões para eletro cuvettes separadas. Diretamente pulso iDCs aplicando o pulso "EH-100" usando o aparelho de eletroporação II.
- Antes do procedimento experimental, prepare suspensões de siRNA de acordo com a instrução do fabricante, alíquota e armazená-las a -20 °C. Descongele e mantê-los no gelo ao usar estes siRNAs para eletroporação. Não coloque iDCs no gelo e evite alterações de temperatura. Siga em frente rapidamente e evitar uma longa incubação de iDCs em PBS ou Buffer P3.
- Diretamente após a eletroporação, adicione 500 μL de RPMI pré-aquecido 1640 a electro cuvettes. Incubar as células em uma incubadora de 5-10 min. Transfer iDCs em placas de 6 poços com fresco pré-aquecido DC médio (complementado com 40 U/mL de GM-CSF e 250 U/mL de IL-4). Combine as respectivas condições em um poço, semeieas células em uma concentração final de 1·10 6/mL e coloque-as em uma incubadora.
- 4 h após a incubação, adicione o coquetel de maturação contendo as citocinas listadas na etapa 1.2.2.
NOTA: Prepare uma amostra de DCs não eletroporados (1 x 106)como controle para análises citométricas de fluxo 2 dias após eletroporação. Trate as células de controle análogamente às amostras eletroporatadas. - Dois dias após a eletroporação, colhem células por resuspensão e transferência para 15 tubos mL. Lave os poços com 1 mL de PBS e transfira as suspensões nos respectivos tubos. Dividido 6·106 DCs por condição de siRNA, conforme descrito nas seguintes etapas:
- Use 0,25 x 106 DCs (eletroporados e não eletroporados) para verificar se há status de maturação e viabilidade celular, conforme descrito na etapa 2. Use os seguintes anticorpos: CD80-PE-Cy5, CD83-APC, CD86-PE, MHCII-APC-Cy7 e Violeta Life/Dead.
- Use 0,75 x 106 células para análises de borrões ocidentais para avaliar a eficiência específica do knockdown do KIF1B/2A. Colete as células em um tubo de bloqueio de segurança de 1,5 mL por centrífugação a 3390 x g por 1,5 min. Prepare lysates celulares como descrito no passo 3.4 e realize análises de borrões ocidentais.
- Use as células restantes (5 x 106)de cada condição de siRNA e realize experimentos de infecção por HSV-1. Para cada condição experimental, transfira 2,5 x 106 iDCs em tubos de 2 mL e infecte-os com HSV-1 em um MOI de 2 ou adicionar buffer MNT como um controle simulado. Realize a infecção conforme descrito no passo 3.3.
- Em 20 h após a infecção, colher as pilhas pela resuspensão e preparar lysates da pilha para análises ocidentais do borrão para verificar a indução do retorno autophagic HSV-1-induzido, como descrito acima na etapa 3.4.
Resultados
Neste manuscrito, descrevemos métodos para interferir com a autofagia induzida pelo HSV-1 em células dendríticas. Isso inclui a geração de iDCs e MDCs derivados de monócito soro, que foram analisados fenotipicamente por citometria de fluxo(Figura 1). No dia 4 após a adesão, dcs mostram um fenótipo imaturo caracterizado pela expressão fraca de CD80, CCR7, e CD83, bem como alta expressão de CD11c e MHCII intermediário. Como os sinais CD3 e CD14 estão faltando, as contaminações de células T e monócitos podem ser excluídas. No dia 6 após a adesão (ou seja, dia 2 após a indução da maturação), dcs mostram um fenótipo maduro refletido por um aumento significativo na CD80, CCR7, CD83, e MHC-II expressão superficial. A infecção por uma cepa hsv-1 expressora por eGFP (Figura 2)resulta em uma infecção quase completa de iDCs(Figura 2Um painel superior) ou mDCs (Figura 2Um painel inferior, Figura 2B), com base em fortes sinais gfp analisados por microscopia de fluorescência, bem como citometria de fluxo.
Como demonstrado em nosso relatório recente, o HSV-1 induz a autofagia tanto em iDCs quanto em mDCs, no entanto, o volume de negócios autofágico ocorre em iDCs apenas10. Em uma primeira abordagem, tratamos iDCs e mDCs com spautina-1 (Figura 3A) - para bloquear a iniciação da autofagia - ou bafilomicina-A1 (BA1; Figura 3B) - para inibir a fusão final autophagosome-lysosome. Após a infecção por HSV-1 de iDCs na ausência de spautina-1 e BA1, o fluxo autofágico é espelhado pelo declínio da expressão p62 e LC3B, respectivamente. Em contraste, a infecção por HSV-1 de MDCs na ausência de spautina-1 não afeta a expressão p62, enquanto o tratamento com espautina-1 e BA1 induz um acúmulo de LC3B-II. Isso reflete a indução da autofagia, mas uma falha do volume de negócios autofágico em MDCs. Em iDCs, a spautina-1 pré-tratamento restaura fortemente a degradação autofágica do p62 sobre a infecção pelo HSV-1, devido à inibição da autofagia durante a fase de iniciação. Após o pré-tratamento com IDCs infectados por BA1, mock- e HSV-1 mostram um forte acúmulo de níveis de proteína LC3B-II, indicando inibição bem-sucedida do volume de negócios autofágico através do bloqueio da fusão do ciclossoma autôagoano tardio. Consistente com isso, o pré-tratamento de MDCs de spautina-1 e BA1 também resulta em p62 estáveis e aumento dos níveis de proteína LC3B-II, respectivamente.
Em um segundo método para prejudicar o fluxo autofárgico, a eletroporação de siRNA visando FIP200 é examinada em relação à sua capacidade de bloquear o fluxo autofágico em iDCs infectados por HSV-1. Como mostrado na Figura 4A,os níveis de proteína FIP200 fortemente reduzidos foram detectados em iDCs 48 h após eletroporação pós, em comparação com o controle siRNA. Neste momento, os iDCs não mostram sinais de morte celular(Figura 4B)e mantêm seu fenótipo imaturo(Figura 4C). A infecção de iDCs silenciados pela FIP200 com HSV-1 revela uma forte diminuição no fluxo autofágico em comparação com suas contrapartes tratadas com siRNA de controle (Figura 4D). Isto é acompanhado por níveis aumentados da proteína de LC3B assim como o p62 quando FIP200 é silenciado em iDCs HSV-1-contaminados.
Em uma tentativa inversa, estudamos se a ablação mediada por siRNA de kif1b e kif2a expressão de proteína permite autofagomal-lysosomal volume de negócios também em HSV-1 infectados mDCs. Assim, os iDCs foram eletroporados usando siRNAs específicos visando uma ou ambas as proteínas, e as células foram posteriormente amadurecidas(Figura 5). 2 dias após eletroporação, os mDCs mostram uma forte redução na expressão de proteína KIF1B e/ou KIF2A, quando foram utilizados siRNAs específicos(Figura 5A). Este método também não levou à morte celular proeminente(Figura 5B)nem a mudanças em seu status de maturação phenotípica (Figura 5C). Apoiando a importância do KIF1B e kif2a durante a degradação autofagossômica-lysossômica, seu esgotamento antes da infecção pelo HSV-1 facilita um aumento do fluxo autofágico em MDCs. Isso se reflete pela diminuição dos níveis residuais de proteína p62, em contraste com a respectiva condição de controle(Figura 5D).
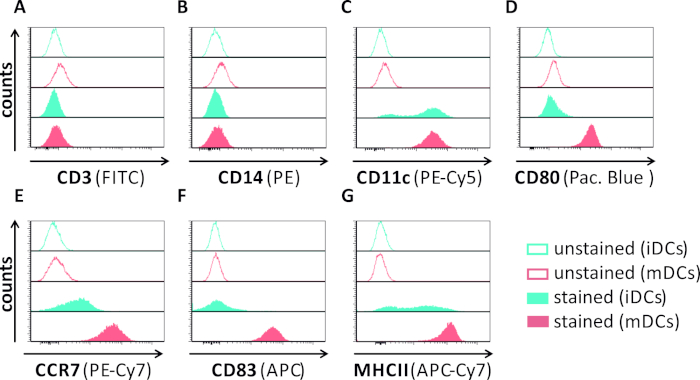
Figura 1: Caracterização phenotypic de iDCs e de mDCs monocyte-derivados humanos usando a citometria do fluxo. DCs foram gerados e manchados com anticorpos específicos para verificar sua pureza: (A)CD3 para excluir contaminações de células T, (B) CD14 para excluir a contaminação com monócitos, e (C)CD11c como um marcador para DCs. Para avaliar seu status de maturação phenotípica foram utilizados os seguintes anticorpos: (D)CD80, (E)CCR7, (F)CD83, e (G)MHCII. Estas moléculas são altamente expressas em mDCs e, assim, permitir a discriminação entre o fenótipo DC imaturo e maduro. Os dados foram analisados por meio do FCS express o 5.0. Clique aqui para ver uma versão maior deste número.
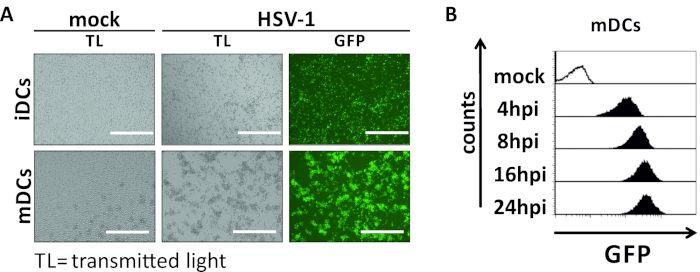
Figura 2: Análises citométricas microscópicas e de fluxo de IDCs e MDCs infectados por HSV-1. Os iDCs e os MDCs foram infectados com uma cepa HSV-1 expressando EGFP (HSV-1 EGFP), para permitir a quantificação da taxa de infecção com base no sinal GFP. (A) Análises microscópicas de iDCs e MDCs infectados por HSV-1 infectados por GFP infectados por HDCs infectados em um MOI de 2, em comparação com suas contrapartes não infectadas, a 24 hpi. Para visualizar as células infectadas, a fluorescência da GFP foi monitorada. A barra de escala representa 400 μm. (B)Medida citométrica de mDCs simulados ou infectados pelo HSV-1 durante a cinética de infecção. Painéis superiores (histogramas alinhados pretos) mostram condição simulada, painéis inferiores (histogramas pretos preenchidos) mostram células infectadas pelo VSV-1 após os pontos de tempo indicados após a infecção. Os dados foram analisados por meio do FCS express o 5.0. Clique aqui para ver uma versão maior deste número.
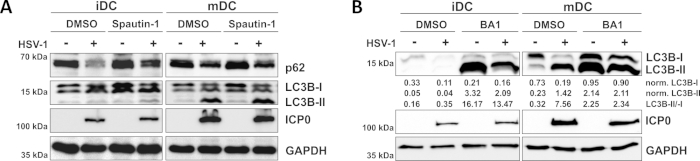
Figura 3: Spautin-1 e b afilomicina-A1 modulam o fluxo autofágico em iDCs infectados pelo HSV-1. IDCs e mDCs foram tratados com (A)spautina-1 ou (B) bafilomicina-A1 (BA1) por 1 h antes da infecção. As células foram posteriormente infectadas por mock- ou HSV-1 (HSV1-RFPVP26) usando um MOI de 2. Após 16-18 h, dcs foram colhidos e lisates de proteína foram submetidos a borrão ocidental para determinar a expressão de p62 ou LC3B-I/-II como marcadores autofágicos, ICP0 como controle de infecção, e GAPDH como controle de carga. Os níveis de proteína LC3B-I e LC3B-II foram quantificados e normalizados para a proteína de referência GAPDH usando Bio1D (densidade óptica). A proporção de sinais LC3B-II-II normalizados aos sinais normalizados de LC3B-I é mostrada. Este número foi modificado e adaptado de ©2019 Turan et al. publicado originalmente na JCB. https://doi.org/10.1083/jcb.20180115110. Clique aqui para ver uma versão maior deste número.
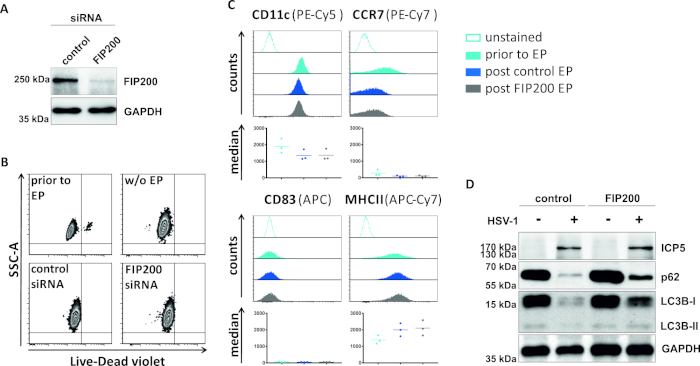
Figura 4: Análise do fluxo autofágico em iDCs infectados por HSV-1 após eletroporação FIP200-siRNA. Os iDCs foram eletroporated com siRNA do controle ou fip200-específico siRNA usando o instrumento i. (A)DCs do eldopta foram analisados a respeito da eficiência do knockdown FIP200 48 h após a eletroporação, executando análises ocidentais do borrão. (B) A viabilidade celular, bem como (C)estado de maturação foi analisado antes da eletroporação (histogramas azul claro) e 48 h post (histogramas azul escuro e cinza) eletroporata por citometria de fluxo. Os valores medianos para três doadores diferentes são mostrados. Depois de confirmar o knockdown eficiente do FIP200 e o fenótipo imaturo, as células foram infectadas pelo HSV-1 (HSV-1 EGFP) usando um MOI de 2. Os dados foram analisados por meio do FCS express o 5.0. (D)Em 20 h após a infecção, as pilhas foram sujeitadas às análises ocidentais do borrão para determinar a expressão de LC3B-I/-II e p62 como marcadores autofágicos. ICP5 foi detectado como controle de infecção, e GAPDH como controle de carga. Os painéis A e D foram modificados e adaptados de ©2019 Turan et al. publicado originalmente no JCB. https://doi.org/10.1083/jcb.20180115110. Clique aqui para ver uma versão maior deste número.
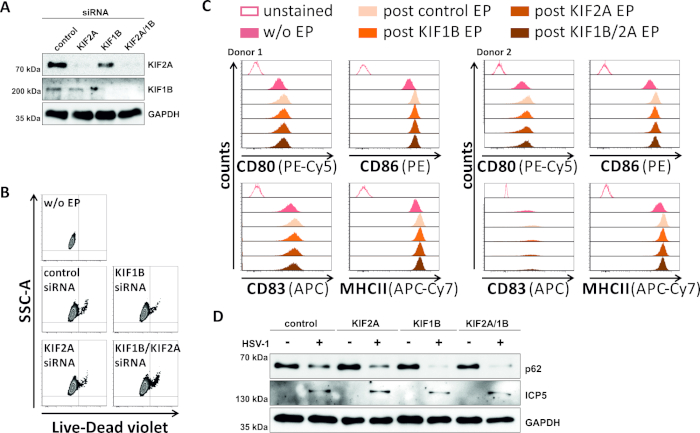
Figura 5: ablação mediada por siRNA de KIF1B e/ou KIF2A modula o volume de negócios autofágico em MDCs infectados por HSV-1. Os iDCs foram eletroporados com siRNA específico e/ou kif2a específico da KIF1B, bem como siRNA de controle, usando o aparelho de eletroporação II. Em 4 h após a eletroporação, a maturação foi induzida através da adição de um cocktail da maturação. Em 48 h pós eletroporação, DCs foram analisados em relação (A)a eficiência do knockdown KIF via borrão ocidental, (B) viabilidade celular, bem como o seu (C) status de maturação phenotípica usando análises citométricas de fluxo (dois diferentes os doadores são mostrados). "w/o EP" significa sem eletroporação, mas pós indução de maturação; "EP pós-controle" significa eletroporação pós-controle usando controle siRNA; "post KIF1B, KIF2A, KIF1B/2A EP" significa pós-eletroporação usando SiRNA específico da KIF1B e/ou KIF2A. Depois de confirmar o knockdown eficiente do KIF1B e/ou KIF2A e do fenótipo maduro, as células foram infectadas pelo HSV-1 (HSV-1 EGFP) usando um MOI de 2. Os dados foram analisados por meio do FCS express o 5.0. (D)As células foram submetidas a análises de borrões ocidentais 20 h após a infecção, a fim de avaliar a expressão de p62 como um marcador autofágico. O ICP5 foi usado como controle de infecção, e gapdh como controle de carga. Os números A e D foram modificados e adaptados de ©2019 Turan et al. originalmente publicados no JCB. https://doi.org/10.1083/jcb.20180115110. Clique aqui para ver uma versão maior deste número.
Discussão
O escopo do protocolo atual inclui (i) o manuseio de iDCs de omonlícitos humanos, bem como mDCs, (ii) sua infecção com HSV-1, (iii) seu tratamento com compostos conhecidos por inibir a autofagia, e (iv) sua eletroporação com siRNA usando dois diferentes configurações técnicas. Usando o protocolo atual, o fluxo autofágico pode ser bloqueado em iDCs infectados por HSV-1 ou induzido em MDCs infectados por HSV-1.
Uma vez que os DCs, e especialmente os iDCs, são células muito vulneráveis, trabalhar com essas células envolve passos bastante delicados. Para a geração DC, recomendamos o uso de PBMCs recém-isolados e evitar sua criopreservação, a fim de obter maiores rendimentos celulares. Além disso, ao manusear iDCs durante experimentos, incluindo seu cultivo subseqüente, evite alterações de temperatura severas ou prolongadas. Caso contrário, os iDCs podem sofrer alterações fenotípicas e, portanto, é necessário verificar seu fenótipo imaturo por citometria de fluxo. Note-se, em contraste com os seus homólogos maduros, os iDCs carecem de marcadores distintos, como CD80, CD83 e CD8628,29. A infecção de iDCs e mDCs com HSV-1 é um método bem estabelecido2,3,4,5,6,10. Nós e outros mostramos que os DCs são altamente suscetíveis à infecção por HSV-1, quando um MOI de 1 ou 2 foi usado (Figura 2). Em nossas mãos, manter o volume do meio de infecção em níveis baixos (1-3 x 106 células em 250-350 μL) levará a uma melhor eficiência de infecção.
Uma abordagem clássica para interferir com uma determinada via celular distinta é o uso de compostos específicos. Uma variedade de diferentes moduladores de autofagia, ou seja, ativadores, bem como inibidores, estão atualmente disponíveis30. Em relação à autofagia induzida pelo HSV-1 em DCs, Turan et al., (2019) mostraram recentemente os efeitos inibitórios da spautina-1 e bafilomicina-A1 (BA1) no volume de negócios autofágico em iDCs10. Esta técnica de inibição da autofagia é adequada para a combinação com uma infecção subsequente pelo HSV-1, uma vez que nem a taxa de infecção nem o estado de maturação dos DCs (especialmente iDCs) são prejudicados. Em aplicações futuras, essa abordagem baseada em inibidor pode ser aplicada também em combinação com outros agentes infecciosos, condições de estresse, como a fome, bem como para diferentes tipos de células. No entanto, ao usar inibidores, surgem limitações na determinação da concentração adequada para inibição eficiente da autofagia, sem afetar gravemente a viabilidade celular. A principal limitação ao usar inibidores é, no entanto, a ocorrência de potenciais efeitos fora do alvo ou adversos, o que pode levar a resultados enganosos31,32.
A segunda abordagem para interferir com a autofagia, abrangida no protocolo atual, é o knockdown específico usando siRNA33,34,35. Por um lado, usamos o aparelho de eletroporação I especificamente para ablatina da expressão do FIP200, inibindo assim o volume de negócios autofágico induzido pelo HSV-1 em iDCs. Por outro lado, silenciamos duas proteínas KIF diferentes (ou seja, KIF1B e KIF2A), usando o aparelho de eletroporação II, para facilitar o fluxo autofágico em MDCs infectados pelo HSV-1. Ambos os protocolos de eletroporação resultaram em uma ablação quase completa de FIP200 em iDCs, e KIF1B/KIF2A em mDCs, que foi verificado através de análises de borrões ocidentais (Figura 4A, Figura 5A). Em contraste com o aparelho de eletroporação I, que não afeta a viabilidade das DCs, a eletroporação de MDCs utilizando o aparelho de eletroporação II resulta em taxas ligeiramente mais elevadas de células mortas (Figura 4B, Figura 5B ). Assim, em aplicações futuras, o aparelho de eletroporação eu deveria ser usado preferencialmente para ambos, iDCs e mDCs. Notavelmente, ambas as técnicas baseadas em siRNA, para modular o fluxo autofágico, são compatíveis com a infecção subsequente por HSV-1 de iDCs ou mDCs. Além disso, nem o fenótipo imaturo dos iDCs nem o fenótipo maduro de MDCs são alternados após a eletroporação.
A eletroporação de iDCs usando siRNA específico do FIP200 é um método eficiente e altamente específico para knockdown genético, bem como inibição do fluxo autofágico sobre a infecção pelo HSV-1. Além do silenciamento específico do FIP200, este protocolo pode ser adaptado para silenciar outros componentes autofágicos, participando de diferentes etapas durante a cascata autofágica. No entanto, identificar o alvo adequado para a inibição eficiente mediada por siRNA da autofagia inclui vários aspectos de preocupação. Em primeiro lugar, a eficiência de knockdown de genes relacionados à autofagia (ATG) não necessariamente se correlaciona positivamente com a inibição eficiente da autofagia e é altamente dependente da proteína ATG específica que é silenciada36. Em segundo lugar, as proteínas ATG distintas estão adicionalmente envolvidas em vias distintas da autofagia, portanto, sua ablação também pode levar a efeitos colaterais adversos37,38,39. Em terceiro lugar, atgs diferentes podem ter funções redundantes, assim knockdown de um componente pode não ser suficiente para inibir a autofagia (porexemplo, beclin-1 e beclin-2)40.
Além disso, o protocolo de eletroporação i-based eletroporação de DCs também é adequado para mRNAs, e poderia ser usado para uma variedade de tipos adicionais de células primárias, como PBMCs25. Este sistema fornece assim uma estratégia geral para entregar espécies distintas do RNA em tipos diferentes da pilha preliminar. Em conclusão, apresentamos dois protocolos para inibir o fluxo autofágico, usando uma abordagem baseada em inibidor ou siRNA combinada com a subsequente infecção por HSV-1 de iDCs. Além disso, descrevemos uma abordagem de eletroporação de siRNA para induzir o fluxo autofágico em MDCs após a infecção pelo HSV-1.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este trabalho foi apoiado pelo Conselho Alemão de Pesquisa (DFG) através do projeto STE 432/11-1 concedido à AS e pelo Programa ELAN da Faculdade de Medicina (Friedrich-Alexander-Universität Erlangen-Nürnberg) através do projeto 18-12-21-1, concedido à LG.
Materiais
| Name | Company | Catalog Number | Comments |
| 4D-Nucleofector Core Unit (electroporation apparatus II) | Lonza (Basel, Switzerland) | AAF-1002B | |
| AB-Serum | Sigma Aldrich Chemie GmbH (Steinheim, Germany) | H4522 | Dendritic cell cultivation |
| ACD-A | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | 9007281 | |
| Amaxa P3 Primary Cell 4D-Nucleofector X Kit L (electroporation kit apparatus II) | Lonza (Basel, Switzerland) | V4XP-3024 | |
| Amersham ECL Prime Western Blotting Detection Reagent | GE Healthcare (Solingen, Germany) | RPN2232 | Western Blot Detection |
| Ammonium persulfate (APS) | Sigma Aldrich Chemie GmbH (Steinheim, Germany) | A3678 | |
| anti-mouse-IgG (mouse, polyclonal, HRP) | Cell Signaling (Leiden, Netherlands) | 7076 | Western Blot detection |
| anti-rabbit-IgG (goat, polyclonal, HRP) | Cell Signaling (Leiden, Netherlands) | 7074 | Western Blot detection |
| Bafilomycin A1 | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | tlrl-baf1 | inhibition of autophagy and lysosomal degradation |
| BD FACS Canto II Flow Cytometer | BD Biosciences (Heidelberg, Germany) | 338962 | |
| Benzonase | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | E1014 | |
| Blotting Chamber Fastblot B44 | Biometra (Göttingen, Germany) | 846-015-100 | |
| CCR7 (mouse, Pe-Cy7) | BioLegend (Fell, Germany) | 557648 | Flow cytometry Dilution: 1:100 Clone: G043H7 |
| CD11c (mouse, Pe-Cy5) | BD Biosciences (Heidelberg, Germany) | 561692 | Flow cytometry Dilution: 1:100 Clone: B-ly6 |
| CD14 (mouse, PE) | BD Biosciences (Heidelberg, Germany) | 555398 | Flow cytometry Dilution: 1:100 Clone: M5E2 |
| CD3 (mouse, FITC) | BD Biosciences (Heidelberg, Germany) | 555332 | Flow cytometry Dilution: 1:100 Clone: UCHT1 |
| CD80 (mouse, V450) | BD Biosciences (Heidelberg, Germany) | 560442 | Flow cytometry Dilution: 1:100 Clone: L307.4 |
| CD83 (mouse, APC) | eBioscience Thermo Fisher Scientific (Langenselbold, Germany) | 17-0839-41 | Flow cytometry Dilution: 1:200 Clone: HB15e |
| CD86 (mouse, PE) | BD Biosciences (Heidelberg, Germany) | 553692 | Flow cytometry Dilution: 1:100 |
| EVOS FL Cell Imaging | System AMG/Life Technologies (Carlsbad, USA) | AMF4300 | |
| FIP200 (rabbit) | Cell Signaling (Leiden, Netherlands) | 12436 | Western Blot detection Dilution: 1:1000 Clone: D10D11 |
| GAPDH (mouse) | Merck Millipore (Massachusetts, USA) | AB2302 | Western Blot detection Dilution: 1:5000 Clone: MAB374 |
| Gene Pulser II apparatus (electroporation apparatus I) | BioRad Laboratories GmbH (München, Germany) | 165-2112 | |
| GM-CSF (4x104 U/mL) | Miltenyi Biotec (Bergisch Gladbach, Germany) | 130-093-868 | |
| HLA?DR (mouse, APC-Cy7) | BioLegend (Fell, Germany) | 307618 | Flow cytometry Dilution: 1:200 Clone: L243 |
| HSV-1/17+/CMV-EGFP/UL43 | BioVex | DC infection | |
| ICP0 (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-53070 | Western Blot detection Dilution: 1:1000 Clone: 11060 |
| ICP5 (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-56989 | Western Blot detection Dilution: 1:1000 Clone: 3B6 |
| IL-1β (0.1x106 U/mL) | Cell Genix GmbH (Freiburg, Germany) | 1411-050 | |
| IL-4 (1x106 U/mL) | Miltenyi Biotec (Bergisch Gladbach, Germany) | 130-093-924 | |
| IL-6 (1x106 U/mL) | Cell Genix GmbH (Freiburg, Germany) | 1404-050 | |
| ImageQuant LAS 4000 | GE Healthcare (Solingen, Germany) | 28955810 | |
| KIF1B (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-376246 | Western Blot detection Dilution: 1:1000 Clone: E-12 |
| KIF2A (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-271471 | Western Blot detection Dilution: 1:1000 Clone: D-7 |
| LC3B (rabbit) | Cell Signaling (Leiden, Netherlands) | 3868 | Western Blot detection Dilution: 1:1000 Clone: D11 |
| L-glutamine | Lonza (Basel, Switzerland) | 17-605E | |
| LIVE/DEAD Fixable Violet dead cell stain kit | Life Technologies (Carlsbad, CA, USA) | L34964 | L/D staining in Flow cytometry |
| Lymphoprep | Alere Technologies AS (Oslo, Norway) | 04-03-9391/01 | |
| Magnesiumchloride | Carl Roth GmbH (Karlsruhe, Germany) | A537.1 | |
| Megafuge 2.0 RS | Heraeus (Hanau, Germany) | 75015505 | |
| N, N, N', N'-Tetramethylethylendiamine (TEMED) | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | T9281 | |
| Neubauer counting chamber | Brand (Wertheim, Germany) | 717805 | |
| Nunc Cell culture flasks (175.0 cm2) | Thermo Scientific (Rockford, USA) | 159910 | |
| p62 (rabbit) | Cell Signaling (Leiden, Netherlands) | 88588 | Western Blot detection Dilution: 1:1000 Clone: D5L7G |
| PageRuler prestained protein ladder | Thermo Fisher Scientific (Langenselbold, Germany) | 26616 | |
| Paraformaldehyde, 16 % | Alfa Aesar, Haverhill, USA | 43368.9M | |
| PerfectSpin 24 Plus | Peqlab (Erlangen, Germany) | C2500-R-PL | |
| PGE2 (1 mg/mL) | Pfizer (Berlin, Germany) | BE130681 | |
| Phosphate buffered saline (PBS) | Lonza (Basel, Switzerland) | 17-512F | |
| Protein gel system MiniProtean II | Bio-Rad Laboratories GmbH (München, Germany) | 1652960 | |
| RestoreTM Western Blot Stripping Buffer | Thermo Scientific, Rockford, USA | 21059 | |
| Rocking Platform wt 15 | Biometra (Göttingen, Germany) | 042-590 | |
| RotiBlock | Carl Roth GmbH (Karlsruhe, Germany) | A151.4 | |
| Roti-Load 1 (4x) | Carl Roth GmbH (Karlsruhe, Germany) | K929.3 | |
| Rotiphorese Gel 30 (37.5:1) | Carl Roth GmbH (Karlsruhe, Germany) | 3029.1 | |
| RPMI 1640 | Lonza (Basel, Switzerland) | 12-167F | |
| Sodium dodecyl Sulfate (SDS) | Carl Roth GmbH (Karlsruhe, Germany) | 2326.2 | |
| Thermomixer comfort | Eppendorf (Hamburg, Germany) | 5355 000.011 | |
| TNF-α (10 μg/mL) | Peprotech (Hamburg, Germany) | 300-01A | |
| Tris | Carl Roth GmbH (Karlsruhe, Germany) | 4855.3 | |
| Trypan blue solution (0.4 %) | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | T8154 | |
| Tween 20 | Carl Roth GmbH (Karlsruhe, Germany) | 9127.1 | |
| Whatman 0.2 μm nitrocellulose membrane | GE Healthcare (Solingen, Germany) | 10600001 | |
| WhatmanTM Chromatography Paper 3 mm Chr | Fisher Scientific GmbH (Schwerte, Germany) | 3030917 |
Referências
- Chapuis, F., Rosenzwajg, M., Yagello, M., Ekman, M., Biberfeld, P., Gluckman, J. C. Differentiation of human dendritic cells from monocytes in vitro. European Journal of Immunology. 27 (2), 431-441 (1997).
- Kummer, M., et al. Herpes simplex virus type 1 induces CD83 degradation in mature dendritic cells with immediate-early kinetics via the cellular proteasome. Journal of Virology. 81 (12), 6326-6338 (2007).
- Kruse, M., et al. Mature dendritic cells infected with herpes simplex virus type 1 exhibit inhibited T-cell stimulatory capacity. Journal of Virology. 74 (15), 7127-7136 (2000).
- Salio, M., Cella, M., Suter, M., Lanzavecchia, A. Inhibition of dendritic cell maturation by herpes simplex virus. European Journal of Immunology. 29 (10), 3245-3253 (1999).
- Prechtel, A. T., et al. Infection of mature dendritic cells with herpes simplex virus type 1 dramatically reduces lymphoid chemokine-mediated migration. Journal of General Virology. 86, 1645-1657 (2005).
- Theodoridis, A. A., Eich, C., Figdor, C. G., Steinkasserer, A. Infection of dendritic cells with herpes simplex virus type 1 induces rapid degradation of CYTIP, thereby modulating adhesion and migration. Blood. 118 (1), 107-115 (2011).
- Cohrs, R. J., Gilden, D. H. Human herpesvirus latency. Brain Pathology. 11 (4), 465-474 (2001).
- Grinde, B. Herpesviruses: latency and reactivation - viral strategies and host response. Journal of Oral Microbiology. 5, (2013).
- Whitley, R. J., Roizman, B. Herpes simplex virus infections. The Lancet. 357 (9267), 1513-1518 (2001).
- Turan, A., et al. Autophagic degradation of lamins facilitates the nuclear egress of herpes simplex virus type 1. The Journal of Cell Biology. 218 (2), 508-523 (2019).
- Takeshige, K., Baba, M., Tsuboi, S., Noda, T., Ohsumi, Y. Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction. The Journal of Cell Biology. 119 (2), 301-311 (1992).
- Yin, Z., Pascual, C., Klionsky, D. J. Autophagy: machinery and regulation. Microbial Cell. 3 (12), 588-596 (2016).
- Bodemann, B. O., et al. RalB and the exocyst mediate the cellular starvation response by direct activation of autophagosome assembly. Cell. 144 (2), 253-267 (2011).
- Bjorkoy, G., et al. p62/SQSTM1 forms protein aggregates degraded by autophagy and has a protective effect on huntingtin-induced cell death. The Journal of Cell Biology. 171 (4), 603-614 (2005).
- Kabeya, Y., et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing. The EMBO Journal. 19 (21), 5720-5728 (2000).
- Kabeya, Y., Mizushima, N., Yamamoto, A., Oshitani-Okamoto, S., Ohsumi, Y., Yoshimori, T. LC3, GABARAP and GATE16 localize to autophagosomal membrane depending on form-II formation. Journal of Cell Science. 117, 2805-2812 (2004).
- Pankiv, S., et al. p62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy. The Journal of Biological Chemistry. 282 (33), 24131-24145 (2007).
- Korolchuk, V. I., Rubinsztein, D. C. Regulation of autophagy by lysosomal positioning. Autophagy. 7 (8), 927-928 (2011).
- Li, Y., et al. A cell-based quantitative high-throughput image screening identified novel autophagy modulators. Pharmacological Research. 110, 35-49 (2016).
- Pampaloni, F., et al. A Novel Cellular Spheroid-Based Autophagy Screen Applying Live Fluorescence Microscopy Identifies Nonactin as a Strong Inducer of Autophagosomal Turnover. SLAS Discovery. 22 (5), 558-570 (2017).
- Deng, Y., Zhu, L., Cai, H., Wang, G., Liu, B. Autophagic compound database: A resource connecting autophagy-modulating compounds, their potential targets and relevant diseases. Cell Proliferation. 51 (3), 12403 (2018).
- Liu, J., et al. Beclin1 controls the levels of p53 by regulating the deubiquitination activity of USP10 and USP13. Cell. 147 (1), 223-234 (2011).
- Mauvezin, C., Neufeld, T. P. Bafilomycin A1 disrupts autophagic flux by inhibiting both V-ATPase-dependent acidification and Ca-P60A/SERCA-dependent autophagosome-lysosome fusion. Autophagy. 11 (8), 1437-1438 (2015).
- Yoshimori, T., Yamamoto, A., Moriyama, Y., Futai, M., Tashiro, Y. Bafilomycin A1, a specific inhibitor of vacuolar-type H(+)-ATPase, inhibits acidification and protein degradation in lysosomes of cultured cells. Journal of Biological Chemistry. 266 (26), 17707-17712 (1991).
- Gerer, K. F., Hoyer, S., Dorrie, J., Schaft, N. Electroporation of mRNA as Universal Technology Platform to Transfect a Variety of Primary Cells with Antigens and Functional Proteins. Methods in Molecular Biology. 1499, 165-178 (2017).
- Prechtel, A. T., Turza, N. M., Theodoridis, A. A., Steinkasserer, A. CD83 knockdown in monocyte-derived dendritic cells by small interfering RNA leads to a diminished T cell stimulation. The Journal of Immunology. 178 (9), 5454-5464 (2007).
- Pfeiffer, I. A., et al. Leukoreduction system chambers are an efficient, valid, and economic source of functional monocyte-derived dendritic cells and lymphocytes. Immunobiology. 218 (11), 1392-1401 (2013).
- Villadangos, J. A., Heath, W. R. Life cycle, migration and antigen presenting functions of spleen and lymph node dendritic cells: limitations of the Langerhans cells paradigm. Seminars in Immunology. 17 (4), 262-272 (2005).
- Lechmann, M., Berchtold, S., Hauber, J., Steinkasserer, A. CD83 on dendritic cells: more than just a marker for maturation. Trends in Immunology. 23 (6), 273-275 (2002).
- Yang, Y. P., et al. Application and interpretation of current autophagy inhibitors and activators. Acta Pharmacologica Sinica. 34 (5), 625-635 (2013).
- Redmann, M., et al. Inhibition of autophagy with bafilomycin and chloroquine decreases mitochondrial quality and bioenergetic function in primary neurons. Redox Biology. 11, 73-81 (2017).
- Yan, Y., et al. Bafilomycin A1 induces caspase-independent cell death in hepatocellular carcinoma cells via targeting of autophagy and MAPK pathways. Scientific Reports. 6, 37052 (2016).
- Hale, C. M., et al. Identification of modulators of autophagic flux in an image-based high content siRNA screen. Autophagy. 12 (4), 713-726 (2016).
- Lipinski, M. M., et al. A genome-wide siRNA screen reveals multiple mTORC1 independent signaling pathways regulating autophagy under normal nutritional conditions. Developmental Cell. 18 (6), 1041-1052 (2010).
- Orvedahl, A., et al. Image-based genome-wide siRNA screen identifies selective autophagy factors. Nature. 480 (7375), 113-117 (2011).
- Staskiewicz, L., Thorburn, J., Morgan, M. J., Thorburn, A. Inhibiting autophagy by shRNA knockdown: cautions and recommendations. Autophagy. 9 (10), 1449-1450 (2013).
- Lee, I. H., et al. Atg7 modulates p53 activity to regulate cell cycle and survival during metabolic stress. Science. 336 (6078), 225-228 (2012).
- Fremont, S., Gerard, A., Galloux, M., Janvier, K., Karess, R. E., Berlioz-Torrent, C. Beclin-1 is required for chromosome congression and proper outer kinetochore assembly. EMBO Reports. 14 (4), 364-372 (2013).
- Bestebroer, J., V'kovski, P., Mauthe, M., Reggiori, F. Hidden behind autophagy: the unconventional roles of ATG proteins. Traffic. 14 (10), 1029-1041 (2013).
- Galluzzi, L., Kroemer, G. Common and divergent functions of Beclin 1 and Beclin 2. Cell Research. 23 (12), 1341-1342 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados