Method Article
siRNA 전기 포진 포진 심플렉스 바이러스 유형 1-감염 단핵구 파생 수지상 세포에서 자가 포식을 조절
요약
본 연구에서, 우리는 헤르페스 심플렉스 바이러스 타입-1(HSV-1)-감염된 단핵구 유래 수지상 세포에서 자가파전 유속을 방해하는 억제제 및 siRNA 기반 전략을 제시한다.
초록
포진 심플렉스 바이러스 유형-1 (HSV-1)은 성숙 한 수지상 세포 (iDC)뿐만 아니라 성숙한 수지상 세포 (mDC)에서 자가 포식을 유도하는 반면, 자가 파동은 iDC에서만 관찰됩니다. 기계적 통찰력을 얻기 위해, 우리는 HSV-1 유도 자가 전환에 방해하기 위해 효율적인 전략을 개발했다. 억제제 기반 전략, HSV-1 유도 자가 포식을 조절하는 것은 쉽고 빠른 방법이기 때문에 첫 번째 선택을 구성한다. 이러한 화합물의 잠재적비특이적 오프 타겟 효과를 우회하기 위해, 우리는 HSV-1 감염시 iDC의 자가 파기 회전율을 조절하는 대체 siRNA 기반 전략을 개발했습니다. 실제로, HSV-1 감염 이전에 FIP200 특이적 siRNA를 이용한 iDC의 전기천공은 FIP200 단백질 발현을 제거하여 자가파장 증류를 억제하는 매우 구체적이고 성공적인 방법이다. 제시된 두 방법 모두 iDC에서 HSV-1 유도 자가관회전의 효율적인 억제를 초래하며, 이에 의해 siRNA 기반 기술은 보다 표적 특이적이다. 추가 siRNA 기지를 둔 접근은 MDC에 있는 HSV-1 감염에 자동 파기 회전율을 촉진하는 KIF1B와 KIF2A의 단백질 발현을 선택적으로 침묵하기 위하여 개발되었습니다. 결론적으로, siRNA 전기 천공의 기술은 선택적으로 명백한 단백질의 표현을 포기하고 HSV-1 감염에 그들의 영향을 분석하기 위하여 유망한 전략을 나타냅니다.
서문
인간 단핵구 유래 수지상 세포(DC)의 생성은 이 중요한 면역 세포 유형의 기능 및 생물학을 연구하는 적절한 시험관 내 모델을 구성한다. 단핵구를 DC로의 분리뿐만 아니라 최근 몇 년 동안 잘 확립되어 있다1,2. α-헤르페스 바이러스 포진 포진 을 가진 DC의 감염심플렉스 바이러스 타입-1 (HSV-1)은 DC 생물학2,3,4,5,6의 HSV-1 매개 변조를 연구하는 모델 시스템역할을 합니다. . 이는 헤르페스바이러스가 강력한 항바이러스 면역 반응을 약화 또는 억제하는 방법을 해명하고, 숙주7,8내부의 면역 특권 틈새시장에서 대기 시간을 확립하는 데 특히 중요하다. 이와 관련하여 헤르페스바이러스는 지역9에따라 최대 90%의 혈청 유병률에 이르는 인구 전체에 걸쳐 광범위하게 퍼지는 매우 성공적인 병원체이다. 이해하고 가능하게 이것을 방지하기 위하여는, 호스트의 면역 계통의 HSV-1 중재한 변조, 특히 DC와 같은 면역 세포의 더 많은 통찰력이 요구됩니다.
HSV-1과 DC의 상호 작용에 관한 완전히 새로운 관찰은 최근 투란 등10에의해 출판되었다 . 저자는 HSV-1 복제의 성취가 DC의 성숙 상태에 엄격하게 의존한다는 것을 보여주었습니다. iDC에서 HSV-1의 완전한 복제는 자가 포식 의존적 메커니즘에 의해 촉진됩니다. HSV1은 iDC와 mDC 모두에서 자가 포식을 유도하는 반면, 자동 파기 플럭스는 iDC에서만 관찰됩니다. 이것은 차례로 iDC에 있는 핵 적층의 autophagic 분해를 통해 바이러스성 capsids의 핵 출구를 용이하게 합니다. iDC와 mDC의 HSV-1 유도 열화 경로에 대한 기계적 통찰력을 얻으려면 자율 유속을 조사하는 새롭고 효율적인 전략이 중요합니다.
대식세포증(autophagy)은 리소좀 소화를 위한 세포내 단백질 또는 전체 세포기관을 표적으로 하는 잘 보존된 다단계과정(11)이다. 단순하게, 자가포식은 (i) 개시, (ii) 막 핵형성, (iii) 소포 팽창 및 (iv) 자가식포성-리소좀 융합상12단계로나눌 수 있다. 개시 시(i), 활성화된 ULK1/2 키나아제 복합체와 같은 성분, 200 kD(FIP200)의 국소 접착 키나아제 계열 상호작용 단백질을 함유하는 성분은 베클린-1-Vps34-AMBRA1 복합체를 활성화시키는 데 매우 중요하다. 이어서, 막 핵형성(ii)은 p6214와같은 분자에 의해 표시되는 세포질 화물을 삼키는 식서포형성(13)을개시한다. 소포 팽창 및 자가포종 성숙(iii) 미세관 관련 단백질 라이트 체인 3(LC3)-I는 자가포식 막 내로 삽입되는 그의 지질 형태 LC3-II로 전환된다. 따라서, LC3-I to -II 전환율은 성숙한 자가포식의 형성을 미러링함으로써 자가포식 유도에 대한지표(15,16)이다. 자가식-리소좀 융합(iv)에 따라, 자가포식 화물뿐만 아니라 관련 p62 및 LC3-II 단백질도 분해(예를 들어, 가수분해에 의해)를 겪습니다. 따라서, p62 및 LC3-II의 손실은 자가파색플럭스(17)에대한 마커로서 역할을 한다. 자가 식기와 리소좀의 융합, 따라서 autophagic 회전율을 따르는, 세포 내 리소좀 국소화에 크게 의존한다. 이는, 다른 사람의 사이에서, 키네신 가족 구성원 KIF1B 및 KIF2A에 의해 조절되며, 이는 자가식포성-리소좀융합18에부정적인 영향을 미치는 것으로 나타났다. 흥미롭게도, KIF1B 및 KIF2A의 단백질 발현은 DC 성숙시 유도되고, 이로인 하여 완전한 HSV-1 복제10을방해하는 HSV-1 감염mDC에서 비효율적인 자가파전 플럭스를 담당한다.
자가포식을 조절하려는 실험적 시도는 이러한 특정 경로를 유도또는 억제하는 것으로 알려진 화합물의 사용을 포함한다19,20,21. 이 연구에서는, 우리는 HSV-1 감염한 iDC에 있는 자동 파기 회전율을 막기 위하여 2개의 억제제 기지를 둔 전략을 기술합니다. 실험에 사용된 제1 화합물은 특이적이고 강력한 자가포식 억제제-1(spautin-1)이며, 이는 자가포식22의개시 단계 동안 베클린-1-Vps34-AMBRA1 복합 분해를 촉진하도록 기술되었다. 본 연구에서 사용되는 두 번째 화합물은 바필로마이신-A1(BA1), 후기 자가파전 성사건(즉, 자가포아고솜-리소좀 융합뿐만 아니라 자가리소좀 산성화)을 차단하는 V-ATPase 억제제(23,24)이다. HSV-1을 가진 iDC 감염의 앞에 이 2개의 억제제의 사용은 강력하게 autophagy를 억제합니다, 그러나 능률적인 바이러스성 유전자 발현을 방해하지 않습니다. 따라서, HSV-1 감염 이전에 이러한 억제제 기반 전략은 HSV-1 유도자가증 플럭스를 억제하는 강력한 도구를 제공하며, 이는 또한 잠재적으로 자가포식을 유도할 수 있는 다양한 세포 유형 및 바이러스에 대해 쉽게 확장될 수 있다.
억제제 기반 접근법(즉, 비특이적 오프 타겟 효과)의 주요 단점을 극복하기 위해, 우리는 (HSV-1-감염된) iDC에서 자가파전 플럭스를 차단하는 siRNA 기반 방법을 개발했습니다. siRNA 전기 천공의 기술은 뚜렷한 단백질 (즉, 자가 파기 성분)의 발현의 선택적 절제를 통해 강력한 대체 전략을 나타냅니다. 본 실험에서 iDC는 전기개질 장치 I(재료 표참조)을 사용하여 FIP200 특이적 siRNA로 전기포판화되었고, Gerer et al.(2017) 및 Prechtel et al.(2007)에 의해 기술된 변형된 프로토콜을 사용하여, 동안자가포를 억제하였다. 개시 단계25,26. 이 기술을 통해 우리는 세포 생존 가능성과 미성숙한 표현형을 이틀 후 전기 천공 을 방해하지 않고 iDC에서 FIP200 발현을 구체적으로 무너뜨릴 수 있었습니다. 주목할 만한, HSV-1 감염 효율적인 바이러스 성 단백질 발현에 의해 미러링 이러한 전기 iDC에서 설립 되었다. 이러한 siRNA 기반 기술은 독특한 이점(즉, 다양한 상이한 자가관성 성분이 조합되어 있음)을 제공하며, 특히 그들의 발현의 절제에 대해 표적화될 수 있다.
본 연구에서, 우리는 HSV-1 감염 mDC에서도 자가파전 플럭스를 유도하는 siRNA 기반 방법을 더 설명한다. 이 경우, iDC는 전기천공 장치 II를 사용하여 DC 성숙 전에 KIF1B 및 KIF2A를 대상으로 하는 siRNA로 전기포질하였다(재료 표참조). 두 단백질은 DC 성숙 동안 upregulated 및 리소좀과 autophagosomes의 융합을 부정적으로 조절하는 것으로 알려져 있기 때문에10,18,그들의 녹다운은 HSV-1 감염시 mDC에서 강하게 유도된 autophagic 플럭스를 유도했습니다. 따라서, siRNA 기반 기술은 mDC에서 KIF 단백질 발현을 방해함으로써 자가전율을 구체적으로 유도할 수 있게 되었고, 이에 따라 iDC에서의 발현 수준을 모방할 수 있었다.
요약하면, 우리는 HSV-1 감염된 iDC에서 자가파전 유속을 억제하는 두 가지 뚜렷한 방법을 제시한다. 첫 번째 억제제 기반 접근법은 자가 파기 성 분해를 방해하는 쉽고 저렴하고 빠른 방법을 구성하지만, 두 번째 siRNA 기반 기술은 억제제 기반의 결과를 지원하고 확인하는 데 보다 구체적이고 매우 적합한 방법입니다. 실험. 또한, 우리는 두 KIF 단백질의 siRNA 매개 녹다운을 통해 HSV-1 감염 mDC에서도 자가파전 플럭스를 유도하는 방법을 설명한다.
프로토콜
단핵구 유래 DC는 건강한 기증자의 백반페레시스 제품으로부터 생성되었다. 이를 위해 지역윤리위원회(참고인 번호 4556)에서 긍정적인 표를 얻었다. 본 연구의 실험은 "프리드리히 - 알렉산더 - Universität 에를랑겐 - 뉘른베르크"(참조 번호 4556)의 윤리위원회의 권고에 따라 수행되었다. 모든 기부자는 헬싱키 선언에 따라 서면 으로 동의를 승인했습니다.
1. 미성숙 수지상 세포 (iDC) 및 성숙한 수지상 세포 (mDC)의 생성 및 처리
- 앞서 설명한 바와 같이 인간 말초 혈액 단핵 세포(PBMC)를 백혈구 감소 시스템 챔버(LRSCs)로부터분리하는 27. PBMC의 동결 보존을 피하고 격리 시 직접 사용하여 더 높은 DC 수율을 얻습니다.
- 앞서 설명한바와같이 T175 세포 배양 플라스크에서 상이한 건강한 공여자들의 PBMC로부터 인간 DC를생성한다. 간단히 말해서, 30 mL의 DC 매체 (L-글루타민없이 RPMI 1640)에서 350-400 백만 개의 PBMC를 사용, 1% (v/v) AB-세럼, 100 U/mL 페니실린, 100 mg/mL 스트렙토마이신, 0.4 mM L-글루타민, 10 mM HEPES) 세포 배양 당 배양 플라스크는 순응에 의한 단핵구의 분리를 위해. 1시간 후, RPMI 1640을 사용하여 비부착 분획을 씻어낸다. 800 U/mL GM-CSF와 250 U/mL IL-4로 보충된 신선한 DC 매체를 추가하고 3일 동안 배양합니다.
- 3일차 포스트 준수에 대해 DC 분화를 위해 GM-CSF 및 IL-4를 함유한 신선한 DC 배지 5mL를 최종 농도400 U/mL 및 세포 배양 플라스크당 250 U/mL의 최종 농도로 추가합니다.
- iDC를 수확하려면 4일째에 세포 배양 플라스크 바닥에서 느슨하게 부착된 iDC를 부드럽게 헹구십시오. 이 단계를 2번 반복합니다. MDC 생성을 위해, GM-CSF (최종 농도: 40 U/mL), IL-4 (최종 농도: 250 U/mL), IL-6 (최종 농도: 1000 U/mL), IL-1β (최종 농도: 200 U/mL), TNF-α (최종 농도: 10 ng/ng/ mL), 프로스타글란딘 E2 (PGE2; 최종 농도: 1 μg/mL).
- 6 일 후 준수 (사이토 카인 칵테일을 사용하여 성숙의 이틀 후 유도), 세포 배양 플라스크의 바닥에서 mDC를 헹구는다. 이 단계를 두 번 반복합니다.
참고: 미성숙 및 성숙한 DC는 1세포 배양 플라스크에서 동일한 공여자로부터 순차적으로 생성될 수 있다. 이렇게 하기 위해, (i) iDC의 적절한 수를 분리하고 (ii) 단계 1.2.2에 열거된 사이토카인 칵테일을 사용하여 플라스크 내의 나머지 세포의 성숙을 유도한다.
- 각각의 세포 배양 배지에서 iDC 또는 mDC를 50 mL 튜브로 전달한다. 5 분 동안 300 x g에서 원심 분리를 통해 세포를 수확하십시오.
- 세포 배양 플라스크 당 RPMI 1640의 5-10 mL에서 부드럽게 재일시 (= 세척) DC. 각 DC 현탁액을 하나의 튜브에 결합합니다.
- 계수 챔버 또는 대체 방법을 사용하여 셀 번호를 정의합니다. iDC를 취급할 때 온도 변경을 피하여 표현형 변화의 위험을 줄이십시오.
2. 유동 세포 측정 분석으로 표현형 성숙 상태 모니터링
- 단계 1.3.1에서 iDC 또는 mDC(0.5 x 106)를1.5mL 튜브로 전송합니다. 3390 x g에서 1.5 분 동안 원심 분리를 통해 세포를 수확하십시오. FACS 버퍼로 세포를 한 번 씻으하십시오 (PBS는 2 % 태아 송아지 혈청 (FCS)로 보충되었습니다).
- 정의된 표면 분자에 대하여 특정 형광크롬 표지된 항체를 포함하는 항체 염색 용액 (FACS 완충액)의 100 μL에 있는 세포를 다시 중단하십시오.
- 다음 항체를 사용하여 순도(CD3-FITC, CD14-PE)뿐만 아니라 DC(CD80-PacBlue/-PE-Cy5, CD11c-PE-Cy5, CCR7-PE-Cy7, CD83-APC, CD86-PE, MHCII-APC-Cy7)의 성숙 상태를 확인합니다.
- 100 μL의 FACS 버퍼에 얼룩지지 않은 샘플을 대조군으로 준비한다.
- 30 분 동안 어둠 속에서 얼음에 세포를 얼룩.
- 이어서 1mL의 FACS 버퍼 및 원심분리기에서 세포를 1.5분 동안 3390 x g에서 2회 세척하였다.
- 마지막으로, 2% PFA로 보충된 FACS 완충액의 200 μL에서 세포를 재중단하고 유세포 측정에 의해 세포를 분석하였다. 고정 세포는 최대 2 일까지 어둠 속에서 4 ° C에서 저장할 수 있습니다.
3. 헤르페스 심플렉스 바이러스 타입-1 (HSV-1)을 가진 DC의 감염 절차 및 SPAUTin-1 또는 바필로마이신-A1를 통해 HSV-1 유도 된 autophagic 플럭스의 간섭
참고: 본 연구에 사용된 HSV-1/17+/CMV-EGFP(HSV-1 EGFP)균주는 실험실 균주 HSV-1 균주 17+로부터 수득되었다. HSV-1 EGFP 균주는 CMV 프로모터의 통제 하에 UL43 유전자 궤적에 삽입된 향상된 녹색 형광 단백질(EGFP)을 발현한다. EGFP는 HSV-1 감염에 대한 마커 역할을 한다. 더욱이, 균주 HSV1-RFPVP26은 DC 감염 연구에 사용되었다(투란 외, 2019). 이 바이러스는 단량체 적색 형광 단백질 (mRFP)에 융합된 캡시드 표면 단백질 VP26을 발현한다.
- 단계 1.3에서 iDC 또는 mDC(2 x 106)를2mL 튜브로 전송합니다. 이어서, 세포를 3390 x g에서 1.5 분 동안 원심분리하고 상한체를 버린다.
- 감염 배지에서 세포를 부드럽게 다시 일시 중단 (RPMI 1640 20 mM HEPES로 보충).
- 자가phagosomal-리소좀 분해 경로를 억제하기 위해, 감염 전에 스패틴-1 또는 바필로마이신-A1 1 h로 DC를 미리 치료하십시오. 10 μM 스패우틴-1 또는 1 μM BA1 또는 DMSO를 치료되지 않은 대조군으로 감염 배지에 추가합니다. 300 rpm에서 가열 블록에서 세포를 37°C에서 1시간 동안 흔들어 인큐베이션한다.
- 감염 연구를 위해, 감염의 복합성에서 HSV-1 virions로 세포를 접종 (MOI) 2. MNT 버퍼(30 mM 2-(N-morpholino)에탄설포닉산(MES), 100 mM NaCl, 20 mM Tris)의 각각부량을 모의 대조군으로 추가합니다. 300 rpm에서 가열 블록에서 세포를 37°C에서 1시간 동안 흔들어 인큐베이션한다.
- 1 시간 사후 감염 (hpi), 1.5 분 동안 3390 x g에서 세포를 수집하고 흡인 접종을 하고 GM-CSF의 40 U / mL, IL-4의 250 U / mL 및 10 μM 스패우틴-1, 1 μM BA1 또는 DMSO를 포함하는 DC 배지에서 세포를 부드럽게 재중단시냅니다. 종자 모의 처리 및 HSV-1-감염된 세포를 6웰플레이트 내로 1 x 10 6/mL의 최종 농도에서.
- 16-24 hpi에서 헹구거나 세포 스크레이퍼 (iDC)를 사용하여 세포를 수확하십시오. 세포를 1.5 mL 안전 잠금 튜브로 옮김.
- 3390 x g에서 1.5 분 동안 원심 분리를 통해 세포를 수집하고 PBS 1 mL을 추가하여 펠릿을 한 번 씻습니다.
- 2x 로티 로드, 1 μL 100 mM MgCl2 및 12.5 U/mL 벤조나아제 29 μL을 함유한 용해 혼합물에서 세포를 격렬하게 재중단시스터.
- 벤조나아제에 의한 세포 용해 및 DNA 소화의 경우, 샘플을 37°C에서 10분 동안 배양합니다. 이어서, 단백질을 95°C에서 10분 동안 변성시.
- SDS-PAGE 및 웨스턴 블롯 분석을 수행하여 LC3BI/II, p62, ICP0/5 및 GAPDH의 단백질 수준을 확인합니다.
4. FIP200-siRNA를 사용하는 iDC의 전기 천공을 통한 HSV-1 유도 자가 파동 간섭
참고: siRNA 전기천공화에 대한 본 프로토콜은 Prechtel 외(2007) 및 Gerer et al. (2017)으로부터 수정되었다.
- iDC(12 x 106)를3.5일 후 50mL 튜브로 전송합니다. 이어서, 세포를 300 x g에서 5 분 동안 원심 분리하고 상한체를 버린다. 병렬로 흐름 세포 측정 분석을 수행하여 2단계에서 설명한 대로 성숙 상태를 모니터링합니다(CD80-PacBlue 대신 수명/죽은 바이올렛 사용).
- 페놀 적색없이 OptiMEM의 5 mL에서 iDC를 부드럽게 세척하고 5 분 동안 300 x g의 세포를 원심 분리합니다. 얼음 위에 세포를 놓고 온도 변화를 피하십시오. 빠르게 이동하고 페놀 레드없이 OptiMEM에서 iDC의 긴 잠복기를 피하십시오.
- FIP200 특이적 siRNA의 75 pmol 또는 스크램블된 siRNA의 75pmol을 대조군으로 4 mm 전기 큐벳으로 옮기고 세포 현탁액의 100 μL(6x106 셀)을 추가합니다. 직접 펄스 iDC 는 전기 천공 장치 I을 사용하여 다음과 같은 설정을 적용합니다 : 1 ms에 500 V.
- 실험 절차에 앞서 제조업체의 지시에 따라 siRNA 현탁액을 준비하고 -20 °C에 보관하십시오. 해동 하고 전기 포공에 대 한 이러한 siRNAs를 사용 하는 경우 얼음에 그들을 유지 합니다. 샘플을 전기화하기 전에 테스트 펄스를 수행합니다.
- 전기 를 채운 후, iDC를 신선한 미리 데운 DC 매체로 6 웰 플레이트로 직접 옮김 (GM-CSF 의 40 U / mL 및 IL-4의 250 U / mL로 보충). 세포를 1 x 106/mL의 최종 농도로 시드하고 인큐베이터에 넣습니다. 전기 큐벳에서 세포를 헹구지 마십시오.
- 48 시간 후, 먼저 현미경으로 전기 기화 iDC의 형태를 검사합니다. 그런 다음 셀 스크레이퍼를 사용하여 세포를 수확하고 15 mL 튜브로 옮김을 옮김을 넣습니다. 0.01% EDTA로 보충된 PBS 1 mL로 우물을 헹구고 각 튜브에 용액을 옮김을 옮김을 옮김을 합니다.
- 이어서, 다음 단계에서 설명된 바와 같이 siRNA 조건당 6 x 106 iDC를 분할한다.
- 2단계에서 설명한 바와 같이 성숙 상태 및 세포 생존 가능성을 평가하기 위해 0.5 x 106 세포를 사용한다. CD11c-PE-Cy5, CCR7-PE-Cy7, CD83-APC, MHCII-APC-Cy7 및 생명/죽은 바이올렛을 사용하십시오.
- 웨스턴 블롯 해석에 1 x 106 셀을 사용하여 FIP200 전용 녹다운 효율을 확인합니다. 세포를 1.5분 동안 3390 x g에서 원심분리하여 1.5 mL 세이프록 튜브로 옮기고 수확합니다.
- HSV-1 감염 실험에 나머지 세포(4.5 x 106)를사용하십시오. 각 실험 조건에 대해 2.25 x 106 iDC를 2 mL 튜브로 전송하고 MOI 2에서 HSV1로 감염시키거나 모의 제어로 MNT 버퍼를 추가하십시오. 단계 3.3에 설명된 대로 감염을 수행합니다.
- 20 hpi에서, 세포 스크레이퍼를 사용하여 세포를 수확하고 3.4 단계에서 설명한 대로 서쪽 얼룩 분석을 위한 세포 용해를 준비합니다.
5. KIF1B/2A-siRNA 전기천공을 사용하여 HSV-1 감염 mDC에서 자가 식임-리소좀 통로의 변조
- 50 mL 튜브에 4 포스트 준수에 iDC (24 x 106)를전송합니다. 이어서, 세포를 300 x g에서 5 분 동안 원심 분리하고 상한체를 버린다.
- PBS의 8 mL에서 iDC를 부드럽게 다시 일시 중단하고 최종 세포 농도를 3 x 106/mL로 조정합니다. 3 x 106 세포를 1.5 mL 튜브로 옮기고 1.5 분 동안 3390 x g에서 세포를 수확하십시오.
- 보충 혼합물을 포함하는 완충P3의 100 μL에서 iDC를 다시 일시 중단 (제조업체의 지침에 따라; 전기 화 키트 장치 II) 및 (i) KIF1B 특이적 siRNA의 75 pmol, (ii) KIF2A 특이적 siRNA의 75 pmol, 또는 (iii) 둘 다. (iv) 스크램블된 siRNA의 각각의 양을 대조군으로 사용한다. 각 siRNA 조건(6 x 106 셀)에 대해 두 개의 튜브를 준비하고 현탁액을 별도의 전기 큐벳으로 옮니다. 직접 펄스 iDC는 전기 화 장치 II를 사용하여 펄스 "EH-100"을 적용한다.
- 실험 절차에 앞서 제조업체의 지시에 따라 siRNA 현탁액을 준비하고 -20 °C에 보관하십시오. 해동 하고 전기 포공에 대 한 이러한 siRNAs를 사용 하는 경우 얼음에 그들을 유지 합니다. 얼음 위에 iDC를 놓고 온도 변화를 피하십시오. 빠르게 이동하고 PBS 또는 버퍼 P3에서 iDC의 긴 배양을 피하십시오.
- 전기 천공 직후, 전기 큐벳에 미리 온난RPMI 1640 500 μL을 추가합니다. 5-10 분 동안 인큐베이터에서 세포를 인큐베이터에 배양. 신선한 미리 데운 DC 매체와 6 웰 플레이트에 iDC를 전송 (GM-CSF의 40 U / mL 및 IL-4의 250 U / mL로 보충). 각각의 조건을 하나의 우물로 결합하고, 세포를 1/10 6/mL의 최종 농도로 시드하고 인큐베이터에 넣습니다.
- 배양 후 4시간, 1.2.2단계에 열거된 사이토카인을 함유하는 성숙 칵테일을 첨가한다.
참고 : 유세포 측정 분석 2 일 후 전기 포공 에 대한 제어로 비 전기 DC (1 x 106)에서하나의 샘플을 준비합니다. 제어 셀을 전기 포어 샘플과 유사하게 처리합니다. - 이틀 후 전기 천공, 재서스펜션에 의해 세포를 수확하고 15 mL 튜브로 옮김. 1 mL의 PBS로 우물을 헹구고 각 튜브에 현탁액을 옮김을 옮김을 옮김을 옮김을 옮김을 옮김을 옮김을 합니다. 다음 단계에 설명된 대로 siRNA 조건당6개 6개의 DC를 분할합니다.
- 0.25 x 106 DC(전기 포기 및 비전기 화)를 사용하여 2단계에서 설명한 대로 성숙 상태와 세포 생존 가능성을 확인합니다. CD80-PE-Cy5, CD83-APC, CD86-PE, MHCII-APC-Cy7 및 생명/죽은 바이올렛을 사용하십시오.
- 서양 블롯 해석에 0.75 x 106 셀을 사용하여 KIF1B/2A 별 녹다운 효율을 평가합니다. 1.5 분 동안 3390 x g에서 원심분리에 의해 1.5 mL safelock 튜브로 세포를 수집합니다.
- 각 siRNA 조건에서 나머지 세포 (5 x 106)를사용하고 HSV-1 감염 실험을 수행합니다. 각 실험 조건에 대해 2.5 x 106 iDC를 2 mL 튜브로 전송하고 MOI 2에서 HSV-1로 감염시키거나 모의 제어로 MNT 버퍼를 추가하십시오. 단계 3.3에 설명된 대로 감염을 수행합니다.
- 20 시간 후 감염에서, 재서스펜션에 의해 세포를 수확하고 3.4 단계에서 전술한 바와 같이 HSV-1 유도 자가 전환의 유도를 확인하기 위해 서양 얼룩 분석을 위해 세포 용해를 준비한다.
결과
이 원고에서, 우리는 수지상 세포에서 HSV-1 유도 자가 포식을 방해하는 방법을 설명합니다. 이는 유세포세포측정에 의해 현상적으로 분석된 인간 단핵구 유래 iDC 및 mDC의 생성을포함한다(도 1). 4일째에, DC는 CD80, CCR7 및 CD83의 약한 발현뿐만 아니라 높은 CD11c 및 중간 MHCII 발현을 특징으로 하는 미성숙 한 표현형을 보여준다. CD3 및 CD14 신호가 누락되었기 때문에 T 셀 및 단핵구 오염을 배제할 수 있습니다. 6일째에 부착후(즉, 2일째 성숙의 유도 후) DC는 CD80, CCR7, CD83 및 MHC-II 표면 발현의 현저한 증가에 의해 반영된 성숙한 표현형을 보여준다. eGFP 발현 HSV-1 균주를 가진 감염(그림 2)iDC(그림 2상부 패널) 또는 mDC(그림 2하부 패널, 그림 2B)의거의 완전한 감염을 초래한다. 형광 현미경 검사법뿐만 아니라 유세포 측정에 의해 분석 된 강한 GFP 신호.
우리의 최근 보고서에서 입증 된 바와 같이, HSV-1은 iDC와 mDC 모두에서 자가 포식을 유도, 그러나, 자동 회전율은iDC에서 발생 10. 첫 번째 접근법에서, 우리는 iDC 및 mDC를 스패틴-1(그림3A)으로처리하여 자가포식 개시-또는 바필로마이신-A1(BA1; 도 3B)-최종 자가포식-리소좀 융합을 억제한다. 스패우틴-1 및 BA1이 없는 경우 iDC의 HSV-1 감염 시, 자가파전 유속은 각각 p62 및 LC3B 발현의 감소에 의해 미러된다. 대조적으로, 스패우틴-1의 부재시 mDC의 HSV-1 감염은 p62 발현에 영향을 미치지 않는 반면, 스패우틴-1 및 BA1 치료는 LC3B-II의 축적을 유도한다. 이것은 autophagy의 유도 그러나 mDC에 있는 autophagic 회전율의 실패를 반영합니다. iDC에서, spautin-1 전처리는 강하게 개시 단계 도중 autophagy의 금지 때문에 HSV-1 감염에 p62의 autophagic 저하를 복원합니다. BA1로 전처리할 때, 모의 및 HSV-1-감염된 iDC는 LC3B-II 단백질 수준의 강력한 축적을 보여주며, 이는 후기 자가포미온-리소좀 융합을 차단함으로써 자가파전이 성공적으로 억제되었음을 나타냅니다. 이와 일치, mDC의 spautin-1 및 BA1 전처리는 또한 안정한 p62 및 증가LC3B-II 단백질 수준, 각각 결과.
자동 파동을 손상시키는 두 번째 방법에서, FIP200을 표적으로 하는 siRNA 전기천공은 HSV-1 감염된 iDC에서 자가파색 플럭스를 차단하는 능력에 관하여 검토된다. 도 4A에도시된 바와 같이, 대조군 siRNA에 비해 iDC 48h 포스트 전기천공에서 강하게 감소된 FIP200 단백질 수치가 검출되었다. 이 시점에서, iDC는 세포 사멸의 어떠한 징후도 나타내지않는다(도 4B)그들의 미성숙 표현형을 유지한다(도4C). HSV-1을 가진 FIP200 침묵iDC의 감염은 그들의 대조군 siRNA 처리 된 대응에 비해 자가 파기 유속의 강한 감소를 보여준다(그림 4D). 이것은 FIP200이 HSV-1 감염한 iDC에서 침묵할 때 LC3B의 증가된 단백질 수준 및 p62를 동반합니다.
역시도에서, 우리는 SiRNA 중재된 KIF1B 및 KIF2A 단백질 발현이 HSV-1 감염mDCs에서 또한 자가포곤-리소좀 회전율을 가능하게 하는지 여부를 연구했습니다. 따라서, iDC는 이들 단백질 중 하나 또는 둘 모두를 표적화하는 특정 siRNAs를 사용하여 전기포상화되었고, 세포는 이후에 성숙되었다(도5). 2일 후 전기천공, mDC는 KIF1B 및/또는 KIF2A 단백질 발현의 강한 감소를 나타내며, 특정 siRNAs를 사용했을때(도 5A). 이 방법은 또한 눈에 띄는 세포 사멸(그림 5B)도그들의 표현형 성숙 상태의 변화(그림 5C)로이어지지 않았다. 자가 포종-리소좀 분해 시 KIF1B 및 KIF2A의 중요성을 뒷받침하며, HSV-1 감염 이전에 고갈되어 mDC의 자가파전 유속이 증가합니다. 이는 각각의 대조군 조건과 는 대조적으로, 감소된 잔류 p62 단백질 수준에 의해 반영된다(도5D).
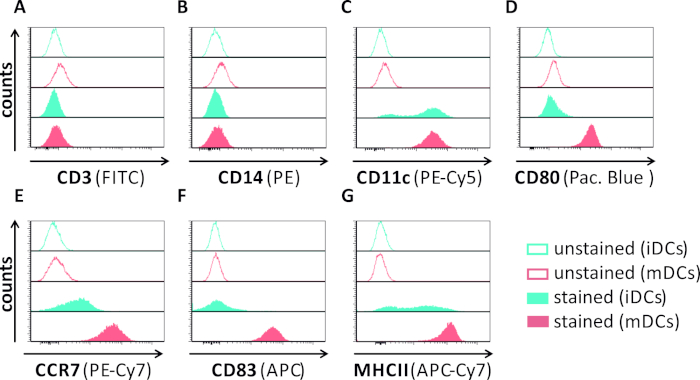
그림 1: 유세포 측정을 이용한 인간 단핵구 유래 iDC 및 mDC의 현상학적 특성 분석. DC는 그들의 순도를 확인하기 위해 특이적 항체로 염색하였다:(A)CD3는 T 세포 오염을 배제하고,(B)CD14는 단핵구로 오염을 배제하고,(C)CD11c는 DC용 마커로서. 그들의 표현형 성숙 상태를 평가하기 위해 다음 항체를 사용하였다:(D)CD80,(E)CCR7,(F)CD83, 및(G)MHCII. 이 분자는 mDC에 높게 표현되고, 그러므로 미성숙하고 성숙한 DC 표현형 사이 차별을 허용합니다. 데이터는 FCS 익스프레스 5.0을 사용하여 분석되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
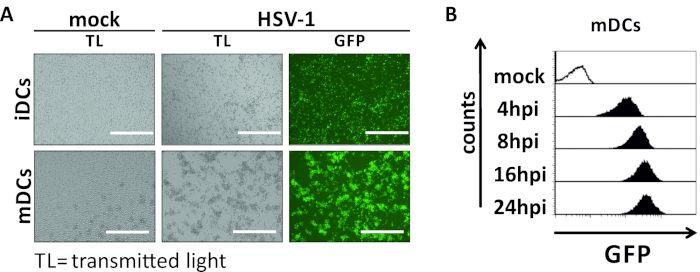
그림 2: HSV-1 감염 iDC 및 mDC의 현미경 및 유동 세포 측정 분석. iDC 및 mDC는 GFP 신호에 기초하여 감염률의 정량화를 허용하기 위해 EGFP(HSV-1 EGFP)를 발현하는 HSV-1 균주에 감염되었다. (A)GFP 양성 HSV-1 감염 iDC 및 mDC의 현미경 분석은 24 hpi에서 감염되지 않은 대응에 비해 MOI에서 2에 감염되었습니다. 감염된 세포를 시각화하기 위해 GFP 형광을 모니터링하였다. 스케일 바는 감염 역학 동안 모의 또는 HSV-1 감염 mDC의 400 μm.(B)유동 세포 측정을 나타낸다. 상부 패널 (검은 줄 지어 히스토그램) 모의 상태를 표시, 낮은 패널 (검은 채워진 히스토그램) 표시 된 시간 포인트 후 감염 후 HSV-1 감염 된 세포를 보여줍니다. 데이터는 FCS 익스프레스 5.0을 사용하여 분석되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
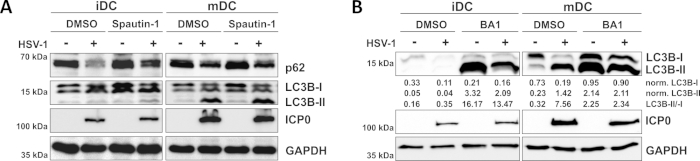
그림 3: 스패틴-1 및 b 아필로마이신-A1은 HSV-1 감염 iDC에서 자가 파기 플럭스를 조절한다. iDC 및 mDC는 감염 전 1시간 동안(A)스패우틴-1 또는(B)바필로마이신-A1(BA1)으로 치료하였다. 세포는 2의 MOI를 사용하여 이후에 모의-또는 HSV-1 감염(HSV1-RFPVP26)을 하였다. 16-18시간 후, DC를 수확하고 단백질 용해액을 서양 블로팅을 실시하여 p62 또는 LC3B-I/-II를 자가포제 마커로, ICP0을 감염 대조군으로, GAPDH를 하중 제어로 결정하였다. LC3B-I 및 LC3B-II 단백질 수준은 Bio1D(광학 밀도)를 사용하여 기준 단백질 GAPDH로 정량화 및 정규화되었다. 정규화된 LC3B-II 신호와 정규화된 LC3B-I 신호의 비율이 표시됩니다. 이 수치는 원래 JCB에 게시 된 © 2019 Turan 등에서 수정및 조정되었습니다. https://doi.org/10.1083/jcb.20180115110. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
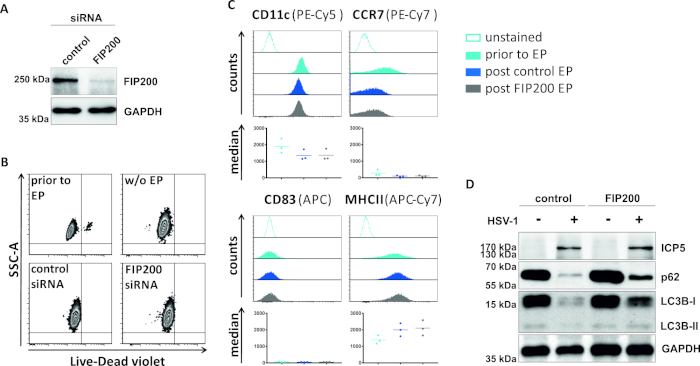
그림 4: FIP200-siRNA 전기천공시 HSV-1 감염 iDC에서의 자가파동 플럭스 분석. iDC는 전기화 장치I(A)를이용하여 제어 siRNA 또는 FIP200 특이적 siRNA로 전기포를 박았다. (B)세포 생존력뿐만 아니라(C)성숙 상태는 유세포측정에 의한 전기천공(연한 파랑 히스토그램) 및 48시간 포스트(다크 블루 및 그레이 히스토그램) 전기천공 에 앞서 분석하였다. 세 개의 다른 기증자에 대한 중앙값이 표시됩니다. FIP200및 미성숙 표현형의 효율적인 녹다운을 확인한 후, 세포는 2의 MOI를 사용하여 HSV-1 감염(HSV-1 EGFP)을 하였다. 데이터는 FCS 익스프레스 5.0을 사용하여 분석되었다. (D)20시간 후 감염에서, 세포는 LC3B-I/-II 및 p62의 발현을 자가포식 마커로 결정하기 위해 서양 얼룩 분석을 실시하였다. ICP5는 감염 제어로 검출되었고, GAPDH는 로딩 제어로서 검출되었다. 패널 A와 D는 원래 JCB에 게시 된 ©2019 투란 등에서 수정 및 적응되었습니다. https://doi.org/10.1083/jcb.20180115110. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
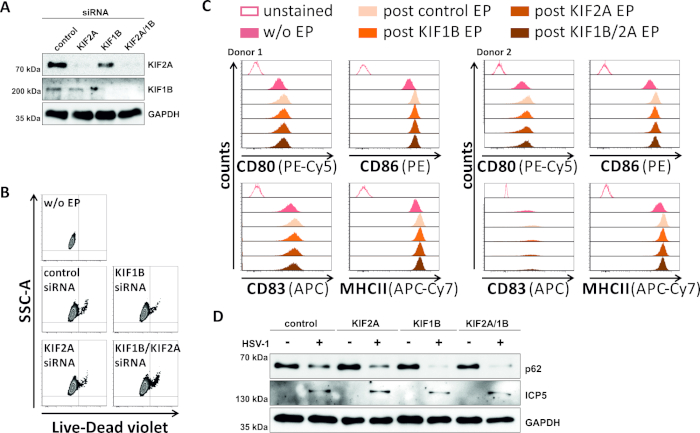
그림 5: kIF1B 및/또는 KIF2A의 siRNA 매개 절제는 HSV-1 감염 mDC에서 자가 파기 회전율을 조절합니다. iDC는 KIF1B 특이적 및/또는 KIF2A 특이적 siRNA뿐만 아니라 제어 siRNA로 전기화 장치 II를 사용하여 전기포상화하였다. 4 시간 후 전기 천공에서, 성숙 칵테일의 첨가를 통해 성숙이 유도되었다. 48시간 후 전기천공에서, DC는(A)서양 블로팅을 통한 KIF 녹다운의 효율,(B)세포 생존력뿐만 아니라유동세포측정 분석(2개의 다른)을 이용한 표현형 성숙 상태(2가지 상이한)를 분석하였다. 기부자가 표시됩니다). "w/o EP"는 전기 천공없이 의미하지만, 성숙의 사후 유도; "포스트 제어 EP"는 제어 siRNA를 사용하여 포스트 전기포공을 의미; "포스트 KIF1B, KIF2A, KIF1B/2A EP"는 KIF1B- 및/또는 KIF2A 특이적 siRNA를 사용하여 포스트 전기천공을 의미한다. KIF1B 및/또는 KIF2A 및 성숙한 표현형의 효율적인 녹다운을 확인한 후, 세포는 2의 MOI를 사용하여 HSV-1 감염(HSV-1 EGFP)을 하였다. 데이터는 FCS 익스프레스 5.0을 사용하여 분석되었다. (D)세포는 자가포식 마커로서 p62의 발현을 평가하기 위해 20시간 후 감염을 분석하여 서양 얼룩을 실시하였다. ICP5는 감염 대조군으로 사용되었고, GAPDH는 로딩 제어로서 사용하였다. 그림 A와 D는 원래 JCB에 게시 된 ©2019 투란 등에서 수정 및 적응되었습니다. https://doi.org/10.1083/jcb.20180115110. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
본 프로토콜의 범위는 (i) 인간 단핵구 유래 iDC의 처리뿐만 아니라 mDC, (ii) HSV-1에 대한 감염, (iii) 자가포식을 억제하는 것으로 알려진 화합물로의 그들의 치료, 및 (iv) 두 가지를 사용하여 siRNA를 이용한 그들의 전기개전을 포함한다. 다른 기술 적 설정. 본 프로토콜을 사용하여, 자가파전 플럭스는 HSV-1 감염 iDC에서 차단되거나 HSV-1 감염 mDC에서 유도될 수 있다.
DC, 특히 iDC는 매우 취약한 세포이기 때문에 이러한 세포로 작업하는 것은 다소 섬세한 단계를 수반합니다. DC 생성의 경우, 우리는 더 높은 세포 수율을 얻기 위해, 갓 고립 된 PBMC를 사용하고, 그들의 동결 보존을 방지하는 것이 좋습니다. 또한 후속 재배를 포함하여 실험 중에 iDC를 취급할 때 가혹하거나 장시간 온도 변화를 방지합니다. 그렇지 않으면 iDC는 표현형 변화를 겪을 수 있으므로 유세포 측정에 의한 미성숙 표현형을 검증할 필요가 있습니다. iDC는 성숙한 것과 달리 CD80, CD83 및 CD8628,29와같은 고유한 마커가 없습니다. HSV-1을 가진 iDC 및 mDC의 감염은 잘 확립 된 방법2,3,4,5,6,10. 우리와 다른 사람들은 DC가 1 또는 2의 MOI가 사용되었을 때 HSV-1 감염에 매우 취약하다는 것을 보여주었습니다(그림 2). 우리의 손에, 낮은 수준에서 감염 매체의 부피를 유지 (1-3 x 106 세포 250-350 μL) 더 나은 감염 효율성으로 이어질 것입니다.
주어진 된 별개의 세포 통로 방해 하는 고전적인 접근은 특정 화합물의 사용. autophagy의 다른 변조기의 다양한, 즉 활성제뿐만 아니라 억제제, 현재 사용할 수30. DC에서 의 HSV-1 유도 자가포식에 관해서는, 투란 등(2019)은 최근 iDC10에서자가파마이펙트에 대한 스패틴-1 및 바필로마이신-A1(BA1)의 억제 효과를 보였다. 자가 포식 억제를위한이 기술은 감염율이나 DC (특히 iDC)의 성숙 상태가 손상되지 않기 때문에 후속 HSV-1 감염과의 조합에 적합합니다. 향후 적용에서, 이러한 억제제 기반 접근법은 다른 감염제, 기아와 같은 스트레스 조건뿐만 아니라 상이한 세포 유형에 대해서도 적용될 수 있다. 그러나, 억제제사용시, 세포 생존능력에 심각한 영향을 미치지 않으면서 효율적인 자가포식 억제를 위한 적절한 농도를 결정하는 데 한계가 발생한다. 그러나 억제제 사용 시 주요 제한사항은 잠재적인 오프 타겟 또는 부작용의 발생으로 오해의 소지가 있는 결과31,32로이어질 수 있습니다.
본 프로토콜에서 다루는 자가 포식을 방해하는 두 번째 접근법은 siRNA33,34,35를사용하여 특정 한 녹다운이다. 한편으로는, 우리는 FIP200의 발현을 구체적으로 제거하기 위해 전기 개화 장치를 사용하여, IDC에서 HSV-1 유도 자가파전 회전율을 억제하였다. 한편, 우리는 HSV-1 감염 mDC에서 자가파전 플럭스를 용이하게 하기 위해 전기 천공 장치 II를 사용하여 두 가지 다른 KIF 단백질(즉, KIF1B 및 KIF2A)을 침묵시켰습니다. 두 전기 개화 프로토콜 은 iDC에서 FIP200의 거의 완전한 절제 결과, MDC에서 KIF1B / KIF2A, 이는 서양 블롯 분석을 통해 검증되었다(그림 4A, 그림 5A). DC의 생존력에 영향을 미치지 않는 전기 천공 장치 I과 는 달리, 전기 천공 장치 II를 사용하여 mDC의 전기 천공은 죽은 세포의 약간 더 높은 비율을 초래합니다(그림 4B, 그림 5B ). 따라서, 향후 응용 분야에서, 전기 개화 장치는 iDC 및 mDC 모두에 우선적으로 사용되어야 한다. 놀랍게도, 두 siRNA 기반 기술, 자가 파기 플럭스를 조절하는, iDC 또는 mDC 중 하나의 후속 HSV-1 감염과 호환됩니다. 더욱이, iDC의 미성숙한 표현형도 mDC의 성숙한 표현형도 전기천공 후 변경되지 않습니다.
FIP200 특이적 siRNA를 사용하는 iDC의 전기 포공은 HSV-1 감염 시 자가 파마 플럭스의 억제뿐만 아니라 유전자 녹다운에 대한 효율적이고 매우 구체적인 방법입니다. FIP200의 특정 침묵 이외에, 이 프로토콜은 다른 자동 관성 성분을 침묵하도록 적응될 수 있으며, 자가포식 캐스케이드 동안 다른 단계에 참여한다. 그러나, 자가포식의 효율적인 siRNA 매개 억제에 대한 적절한 표적을 식별하는 것은 우려의 몇몇 양상을 포함한다. 첫째, 자가포식 관련 유전자(ATG)의 녹다운 효율은 반드시 자가포식의 효율적인 억제와 반드시 긍정적으로 상관관계가 있는 것은아니며, 침묵되는특이적 ATG 단백질에 크게 의존한다( 36). 둘째, 뚜렷한 ATG 단백질은 자가 포식과 구별되는 경로에 추가로 관여하므로 절제는 또한 불리한 부작용37,38,39로이어질 수 있습니다. 셋째, 상이한 ATG는 중복 기능을 가질 수 있으며, 따라서 하나의 성분의 녹다운은 자가포식(예를들어, beclin-1 및 beclin-2)40을억제하기에 충분하지 않을 수 있다.
또한, DC의 전기천공 장치 I-기반 전기 천공 프로토콜은 mRNA에도 적합하며, PBMC25와같은 다양한 추가적인 1차 전지 유형에 사용될 수 있다. 이 시스템은 이렇게 다른 1 차적인 세포 모형으로 명백한 RNA 종을 전달하기 위하여 일반적인 전략을 제공합니다. 결론적으로, 우리는 iDC의 후속 HSV-1 감염과 결합된 억제제 또는 siRNA 기반 접근법을 사용하여 자가파기 플럭스를 억제하는 2개의 프로토콜을 제시한다. 더욱이, 우리는 HSV-1 감염에 mDC에 있는 자동 파기 유속을 유도하는 siRNA 전기 천공 접근을 기술합니다.
공개
저자는 공개 할 것이 없다.
감사의 말
이 작품은 프로젝트 STE를 통해 독일 연구위원회 (DFG) 432/11-1 AS에 수여 및 의학 학부에서 ELAN 프로그램에 의해 지원되었다 (프리드리히 - 알렉산더 - Universität 에를랑겐 - 뉘른베르크) 프로젝트를 통해 18-12-21-1, LG에 부여.
자료
| Name | Company | Catalog Number | Comments |
| 4D-Nucleofector Core Unit (electroporation apparatus II) | Lonza (Basel, Switzerland) | AAF-1002B | |
| AB-Serum | Sigma Aldrich Chemie GmbH (Steinheim, Germany) | H4522 | Dendritic cell cultivation |
| ACD-A | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | 9007281 | |
| Amaxa P3 Primary Cell 4D-Nucleofector X Kit L (electroporation kit apparatus II) | Lonza (Basel, Switzerland) | V4XP-3024 | |
| Amersham ECL Prime Western Blotting Detection Reagent | GE Healthcare (Solingen, Germany) | RPN2232 | Western Blot Detection |
| Ammonium persulfate (APS) | Sigma Aldrich Chemie GmbH (Steinheim, Germany) | A3678 | |
| anti-mouse-IgG (mouse, polyclonal, HRP) | Cell Signaling (Leiden, Netherlands) | 7076 | Western Blot detection |
| anti-rabbit-IgG (goat, polyclonal, HRP) | Cell Signaling (Leiden, Netherlands) | 7074 | Western Blot detection |
| Bafilomycin A1 | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | tlrl-baf1 | inhibition of autophagy and lysosomal degradation |
| BD FACS Canto II Flow Cytometer | BD Biosciences (Heidelberg, Germany) | 338962 | |
| Benzonase | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | E1014 | |
| Blotting Chamber Fastblot B44 | Biometra (Göttingen, Germany) | 846-015-100 | |
| CCR7 (mouse, Pe-Cy7) | BioLegend (Fell, Germany) | 557648 | Flow cytometry Dilution: 1:100 Clone: G043H7 |
| CD11c (mouse, Pe-Cy5) | BD Biosciences (Heidelberg, Germany) | 561692 | Flow cytometry Dilution: 1:100 Clone: B-ly6 |
| CD14 (mouse, PE) | BD Biosciences (Heidelberg, Germany) | 555398 | Flow cytometry Dilution: 1:100 Clone: M5E2 |
| CD3 (mouse, FITC) | BD Biosciences (Heidelberg, Germany) | 555332 | Flow cytometry Dilution: 1:100 Clone: UCHT1 |
| CD80 (mouse, V450) | BD Biosciences (Heidelberg, Germany) | 560442 | Flow cytometry Dilution: 1:100 Clone: L307.4 |
| CD83 (mouse, APC) | eBioscience Thermo Fisher Scientific (Langenselbold, Germany) | 17-0839-41 | Flow cytometry Dilution: 1:200 Clone: HB15e |
| CD86 (mouse, PE) | BD Biosciences (Heidelberg, Germany) | 553692 | Flow cytometry Dilution: 1:100 |
| EVOS FL Cell Imaging | System AMG/Life Technologies (Carlsbad, USA) | AMF4300 | |
| FIP200 (rabbit) | Cell Signaling (Leiden, Netherlands) | 12436 | Western Blot detection Dilution: 1:1000 Clone: D10D11 |
| GAPDH (mouse) | Merck Millipore (Massachusetts, USA) | AB2302 | Western Blot detection Dilution: 1:5000 Clone: MAB374 |
| Gene Pulser II apparatus (electroporation apparatus I) | BioRad Laboratories GmbH (München, Germany) | 165-2112 | |
| GM-CSF (4x104 U/mL) | Miltenyi Biotec (Bergisch Gladbach, Germany) | 130-093-868 | |
| HLA?DR (mouse, APC-Cy7) | BioLegend (Fell, Germany) | 307618 | Flow cytometry Dilution: 1:200 Clone: L243 |
| HSV-1/17+/CMV-EGFP/UL43 | BioVex | DC infection | |
| ICP0 (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-53070 | Western Blot detection Dilution: 1:1000 Clone: 11060 |
| ICP5 (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-56989 | Western Blot detection Dilution: 1:1000 Clone: 3B6 |
| IL-1β (0.1x106 U/mL) | Cell Genix GmbH (Freiburg, Germany) | 1411-050 | |
| IL-4 (1x106 U/mL) | Miltenyi Biotec (Bergisch Gladbach, Germany) | 130-093-924 | |
| IL-6 (1x106 U/mL) | Cell Genix GmbH (Freiburg, Germany) | 1404-050 | |
| ImageQuant LAS 4000 | GE Healthcare (Solingen, Germany) | 28955810 | |
| KIF1B (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-376246 | Western Blot detection Dilution: 1:1000 Clone: E-12 |
| KIF2A (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-271471 | Western Blot detection Dilution: 1:1000 Clone: D-7 |
| LC3B (rabbit) | Cell Signaling (Leiden, Netherlands) | 3868 | Western Blot detection Dilution: 1:1000 Clone: D11 |
| L-glutamine | Lonza (Basel, Switzerland) | 17-605E | |
| LIVE/DEAD Fixable Violet dead cell stain kit | Life Technologies (Carlsbad, CA, USA) | L34964 | L/D staining in Flow cytometry |
| Lymphoprep | Alere Technologies AS (Oslo, Norway) | 04-03-9391/01 | |
| Magnesiumchloride | Carl Roth GmbH (Karlsruhe, Germany) | A537.1 | |
| Megafuge 2.0 RS | Heraeus (Hanau, Germany) | 75015505 | |
| N, N, N', N'-Tetramethylethylendiamine (TEMED) | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | T9281 | |
| Neubauer counting chamber | Brand (Wertheim, Germany) | 717805 | |
| Nunc Cell culture flasks (175.0 cm2) | Thermo Scientific (Rockford, USA) | 159910 | |
| p62 (rabbit) | Cell Signaling (Leiden, Netherlands) | 88588 | Western Blot detection Dilution: 1:1000 Clone: D5L7G |
| PageRuler prestained protein ladder | Thermo Fisher Scientific (Langenselbold, Germany) | 26616 | |
| Paraformaldehyde, 16 % | Alfa Aesar, Haverhill, USA | 43368.9M | |
| PerfectSpin 24 Plus | Peqlab (Erlangen, Germany) | C2500-R-PL | |
| PGE2 (1 mg/mL) | Pfizer (Berlin, Germany) | BE130681 | |
| Phosphate buffered saline (PBS) | Lonza (Basel, Switzerland) | 17-512F | |
| Protein gel system MiniProtean II | Bio-Rad Laboratories GmbH (München, Germany) | 1652960 | |
| RestoreTM Western Blot Stripping Buffer | Thermo Scientific, Rockford, USA | 21059 | |
| Rocking Platform wt 15 | Biometra (Göttingen, Germany) | 042-590 | |
| RotiBlock | Carl Roth GmbH (Karlsruhe, Germany) | A151.4 | |
| Roti-Load 1 (4x) | Carl Roth GmbH (Karlsruhe, Germany) | K929.3 | |
| Rotiphorese Gel 30 (37.5:1) | Carl Roth GmbH (Karlsruhe, Germany) | 3029.1 | |
| RPMI 1640 | Lonza (Basel, Switzerland) | 12-167F | |
| Sodium dodecyl Sulfate (SDS) | Carl Roth GmbH (Karlsruhe, Germany) | 2326.2 | |
| Thermomixer comfort | Eppendorf (Hamburg, Germany) | 5355 000.011 | |
| TNF-α (10 μg/mL) | Peprotech (Hamburg, Germany) | 300-01A | |
| Tris | Carl Roth GmbH (Karlsruhe, Germany) | 4855.3 | |
| Trypan blue solution (0.4 %) | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | T8154 | |
| Tween 20 | Carl Roth GmbH (Karlsruhe, Germany) | 9127.1 | |
| Whatman 0.2 μm nitrocellulose membrane | GE Healthcare (Solingen, Germany) | 10600001 | |
| WhatmanTM Chromatography Paper 3 mm Chr | Fisher Scientific GmbH (Schwerte, Germany) | 3030917 |
참고문헌
- Chapuis, F., Rosenzwajg, M., Yagello, M., Ekman, M., Biberfeld, P., Gluckman, J. C. Differentiation of human dendritic cells from monocytes in vitro. European Journal of Immunology. 27 (2), 431-441 (1997).
- Kummer, M., et al. Herpes simplex virus type 1 induces CD83 degradation in mature dendritic cells with immediate-early kinetics via the cellular proteasome. Journal of Virology. 81 (12), 6326-6338 (2007).
- Kruse, M., et al. Mature dendritic cells infected with herpes simplex virus type 1 exhibit inhibited T-cell stimulatory capacity. Journal of Virology. 74 (15), 7127-7136 (2000).
- Salio, M., Cella, M., Suter, M., Lanzavecchia, A. Inhibition of dendritic cell maturation by herpes simplex virus. European Journal of Immunology. 29 (10), 3245-3253 (1999).
- Prechtel, A. T., et al. Infection of mature dendritic cells with herpes simplex virus type 1 dramatically reduces lymphoid chemokine-mediated migration. Journal of General Virology. 86, 1645-1657 (2005).
- Theodoridis, A. A., Eich, C., Figdor, C. G., Steinkasserer, A. Infection of dendritic cells with herpes simplex virus type 1 induces rapid degradation of CYTIP, thereby modulating adhesion and migration. Blood. 118 (1), 107-115 (2011).
- Cohrs, R. J., Gilden, D. H. Human herpesvirus latency. Brain Pathology. 11 (4), 465-474 (2001).
- Grinde, B. Herpesviruses: latency and reactivation - viral strategies and host response. Journal of Oral Microbiology. 5, (2013).
- Whitley, R. J., Roizman, B. Herpes simplex virus infections. The Lancet. 357 (9267), 1513-1518 (2001).
- Turan, A., et al. Autophagic degradation of lamins facilitates the nuclear egress of herpes simplex virus type 1. The Journal of Cell Biology. 218 (2), 508-523 (2019).
- Takeshige, K., Baba, M., Tsuboi, S., Noda, T., Ohsumi, Y. Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction. The Journal of Cell Biology. 119 (2), 301-311 (1992).
- Yin, Z., Pascual, C., Klionsky, D. J. Autophagy: machinery and regulation. Microbial Cell. 3 (12), 588-596 (2016).
- Bodemann, B. O., et al. RalB and the exocyst mediate the cellular starvation response by direct activation of autophagosome assembly. Cell. 144 (2), 253-267 (2011).
- Bjorkoy, G., et al. p62/SQSTM1 forms protein aggregates degraded by autophagy and has a protective effect on huntingtin-induced cell death. The Journal of Cell Biology. 171 (4), 603-614 (2005).
- Kabeya, Y., et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing. The EMBO Journal. 19 (21), 5720-5728 (2000).
- Kabeya, Y., Mizushima, N., Yamamoto, A., Oshitani-Okamoto, S., Ohsumi, Y., Yoshimori, T. LC3, GABARAP and GATE16 localize to autophagosomal membrane depending on form-II formation. Journal of Cell Science. 117, 2805-2812 (2004).
- Pankiv, S., et al. p62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy. The Journal of Biological Chemistry. 282 (33), 24131-24145 (2007).
- Korolchuk, V. I., Rubinsztein, D. C. Regulation of autophagy by lysosomal positioning. Autophagy. 7 (8), 927-928 (2011).
- Li, Y., et al. A cell-based quantitative high-throughput image screening identified novel autophagy modulators. Pharmacological Research. 110, 35-49 (2016).
- Pampaloni, F., et al. A Novel Cellular Spheroid-Based Autophagy Screen Applying Live Fluorescence Microscopy Identifies Nonactin as a Strong Inducer of Autophagosomal Turnover. SLAS Discovery. 22 (5), 558-570 (2017).
- Deng, Y., Zhu, L., Cai, H., Wang, G., Liu, B. Autophagic compound database: A resource connecting autophagy-modulating compounds, their potential targets and relevant diseases. Cell Proliferation. 51 (3), 12403 (2018).
- Liu, J., et al. Beclin1 controls the levels of p53 by regulating the deubiquitination activity of USP10 and USP13. Cell. 147 (1), 223-234 (2011).
- Mauvezin, C., Neufeld, T. P. Bafilomycin A1 disrupts autophagic flux by inhibiting both V-ATPase-dependent acidification and Ca-P60A/SERCA-dependent autophagosome-lysosome fusion. Autophagy. 11 (8), 1437-1438 (2015).
- Yoshimori, T., Yamamoto, A., Moriyama, Y., Futai, M., Tashiro, Y. Bafilomycin A1, a specific inhibitor of vacuolar-type H(+)-ATPase, inhibits acidification and protein degradation in lysosomes of cultured cells. Journal of Biological Chemistry. 266 (26), 17707-17712 (1991).
- Gerer, K. F., Hoyer, S., Dorrie, J., Schaft, N. Electroporation of mRNA as Universal Technology Platform to Transfect a Variety of Primary Cells with Antigens and Functional Proteins. Methods in Molecular Biology. 1499, 165-178 (2017).
- Prechtel, A. T., Turza, N. M., Theodoridis, A. A., Steinkasserer, A. CD83 knockdown in monocyte-derived dendritic cells by small interfering RNA leads to a diminished T cell stimulation. The Journal of Immunology. 178 (9), 5454-5464 (2007).
- Pfeiffer, I. A., et al. Leukoreduction system chambers are an efficient, valid, and economic source of functional monocyte-derived dendritic cells and lymphocytes. Immunobiology. 218 (11), 1392-1401 (2013).
- Villadangos, J. A., Heath, W. R. Life cycle, migration and antigen presenting functions of spleen and lymph node dendritic cells: limitations of the Langerhans cells paradigm. Seminars in Immunology. 17 (4), 262-272 (2005).
- Lechmann, M., Berchtold, S., Hauber, J., Steinkasserer, A. CD83 on dendritic cells: more than just a marker for maturation. Trends in Immunology. 23 (6), 273-275 (2002).
- Yang, Y. P., et al. Application and interpretation of current autophagy inhibitors and activators. Acta Pharmacologica Sinica. 34 (5), 625-635 (2013).
- Redmann, M., et al. Inhibition of autophagy with bafilomycin and chloroquine decreases mitochondrial quality and bioenergetic function in primary neurons. Redox Biology. 11, 73-81 (2017).
- Yan, Y., et al. Bafilomycin A1 induces caspase-independent cell death in hepatocellular carcinoma cells via targeting of autophagy and MAPK pathways. Scientific Reports. 6, 37052 (2016).
- Hale, C. M., et al. Identification of modulators of autophagic flux in an image-based high content siRNA screen. Autophagy. 12 (4), 713-726 (2016).
- Lipinski, M. M., et al. A genome-wide siRNA screen reveals multiple mTORC1 independent signaling pathways regulating autophagy under normal nutritional conditions. Developmental Cell. 18 (6), 1041-1052 (2010).
- Orvedahl, A., et al. Image-based genome-wide siRNA screen identifies selective autophagy factors. Nature. 480 (7375), 113-117 (2011).
- Staskiewicz, L., Thorburn, J., Morgan, M. J., Thorburn, A. Inhibiting autophagy by shRNA knockdown: cautions and recommendations. Autophagy. 9 (10), 1449-1450 (2013).
- Lee, I. H., et al. Atg7 modulates p53 activity to regulate cell cycle and survival during metabolic stress. Science. 336 (6078), 225-228 (2012).
- Fremont, S., Gerard, A., Galloux, M., Janvier, K., Karess, R. E., Berlioz-Torrent, C. Beclin-1 is required for chromosome congression and proper outer kinetochore assembly. EMBO Reports. 14 (4), 364-372 (2013).
- Bestebroer, J., V'kovski, P., Mauthe, M., Reggiori, F. Hidden behind autophagy: the unconventional roles of ATG proteins. Traffic. 14 (10), 1029-1041 (2013).
- Galluzzi, L., Kroemer, G. Common and divergent functions of Beclin 1 and Beclin 2. Cell Research. 23 (12), 1341-1342 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유