Method Article
siRNA Электропорация модулировать аутофагии в вирусе простого герпеса типа 1-инфицированных моноцитов производные дендритные клетки
В этой статье
Резюме
В этом исследовании, мы представляем ингибитор- и siRNA основе стратегий вмешиваться в аутофагический поток в вирусе простого герпеса типа-1 (HSV-1) инфицированных моноцитов полученных дендритных клеток.
Аннотация
Вирус простого герпеса типа-1 (HSV-1) индуцирует аутофагию в обоих, незрелых дендритных клетках (иДК), а также зрелых дендритных клетках (МДК), в то время как аутофагический поток наблюдается только в iDCs. Чтобы получить механистическую информацию, мы разработали эффективные стратегии, чтобы помешать HSV-1-индуцированного автофагического оборота. Стратегия на основе ингибитора, чтобы модулировать HSV-1-индуцированной аутофагии, представляет собой первый выбор, так как это простой и быстрый метод. Чтобы обойти потенциальные неспецифические внецелевые эффекты таких соединений, мы разработали альтернативную стратегию на основе siRNA, чтобы модулировать аутофагический оборот в IDCs при инфекции ВПГ-1. Действительно, электропорация iDCs с FIP200-специфической siRNA до инфекции ВПГ-1 является очень специфическим и успешным методом, чтобы абляции экспрессии белка FIP200 и тем самым ингибировать аутофагический поток. Оба представленных метода приводят к эффективному ингибированию впг-1-индуцированного аутофагического оборота в IDCs, в результате чего метод на основе siRNA является более целевым. Был разработан дополнительный подход на основе siRNA для избирательного замалчивания белкового экспрессии KIF1B и KIF2A, способствуя аутофагному обороту при инфекции ВПГ-1 в МДК. В заключение, метод электропорации siRNA представляет собой перспективную стратегию, чтобы избирательно абляции выражение различных белков и анализировать их влияние на инфекцию ВПГ-1.
Введение
Поколение человеческих моноцитов, полученных дендритных клеток (DCs) представляет собой соответствующую модель in vitro для изучения функций и биологии этого важного типа иммунных клеток. Изоляция, а также дифференциация моноцитов в ЦОС была хорошо установлена в последние годы1,2. Инфекция ДК с вирусом простого герпеса герпеса типа-1 (HSV-1) служит модельной системой для изучения ВПГ-1-опосредованного модуляции биологии DC2,3,4,5,6 . Это особенно важно, чтобы выяснить, как герпесвирусы ослабить или ингибировать мощные противовирусные иммунные реакции, чтобы установить задержку в иммунной привилегированных нишах внутри хозяина7,8. В этом отношении, герпесвирусы являются очень успешными патогенами, которые широко распространены по всей популяции, достигающей серораспространенности до 90% в зависимости от географического региона9. Чтобы понять и, возможно, предотвратить это, требуется больше информации о ВПГ-1-опосредованного модуляции иммунной системы хозяина, и особенно иммунных клеток, таких как DC, не требуется.
Совершенно новое наблюдение в отношении взаимодействия DCs с HSV-1 был недавно опубликован Turan et al.10. Авторы продемонстрировали, что выполнение репликации ВПГ-1 строго зависит от статуса созревания ДК. В iDCs полная репликация ВПГ-1 облегчается аутофагий-зависимыми механизмами. В то время как HSV1 индуцирует аутофагию в обоих, iDCs и mDCs, аутофагический поток наблюдается только в iDCs. Это, в свою очередь, облегчает ядерный выход вирусных капсидов через аутофагическую деградацию ядерных ламинов в иДК. Чтобы получить механистическое понимание этого HSV-1-индуцированного пути деградации в iDCs по сравнению с MDCs, новые и эффективные стратегии имеют решающее значение для изучения аутофагического потока.
Макроавтофагия (аутофагия) является хорошо сохранимым многоступенчатым процессом, ориентированным на внутриклеточные белки или целые органеллы для лизосомального пищеварения11. Просто, аутофагия может быть разделена на (i) инициации, (ii) мембраны нуклеации, (iii) везикул расширения, и (iv) аутофагосомо-лизосомы фазы синтеза12. Во время начала (i), такие компоненты, как активированный комплекс киназы ULK1'2, содержащий фокусное семейство киназы, взаимодействующий белок 200 кД (FIP200), имеют решающее значение для активации комплекса beclin-1-Vps34-AMBRA1. Впоследствии, мембранное нуклеация (ii) инициирует образование фагофора13, который охватывает цитоплазматные грузы, которые отмечены молекулами, такими как p6214. Во время расширения везикулы и аутофагофора созревания (iii) микротрубо-ассоциированных белковой световой цепи 3 (LC3)-I преобразуется в его липидной форме LC3-II, которая вставляется в аутофагосомальной мембраны. Таким образом, коэффициенты конверсии LC3-I к-II являются индикатором аутофагии индукции путем зеркального отражения формирования зрелых аутофагосм15,16. При аутофагосомо-лизосомного синтезе (iv) не только аутофагический груз, но и связанные с ним белки p62 и LC3-II подвергаются деградации (например, гидролизу). Таким образом, потеря p62 и LC3-II служит маркерами для аутофагического потока17. Слияние аутофагосом с лизосомами, и, таким образом, после аутофагического оборота, сильно зависит от внутриклеточной лизосомальной локализации. Это, в частности, регулируется kinesin членов семьи KIF1B и KIF2A, которые были показаны негативно повлиять на аутофагосомо-лисосомного слияния18. Интересно, что выражение белка KIF1B и KIF2A индуцируется после созревания постоянного тока и тем самым несет ответственность за неэффективный аутофагный поток в HSV-1-инфицированных МДК, что затрудняет полную репликацию ВПГ-110.
Экспериментальные попытки модулировать аутофагии включают использование соединений, как известно, вызывают или подавляют этот конкретный путь19,20,21. В этом исследовании мы описываем две стратегии на основе ингибитора для блокирования аутофагического оборота в HSV-1-инфицированных iDCs. Первое соединение, используемое в наших экспериментах является специфическим и мощным ингибитором аутофагии-1 (spautin-1), который был описан для содействия beclin-1-Vps34-AMBRA1 комплекс деградации во время фазы начала аутофагии22. Вторым соединением, используемым в настоящем исследовании, является бафиломицин-А1 (BA1), ингибитор V-ATPase, который блокирует поздние аутофагические события (т.е. аутофагососомного синтеза, а также аутолибососомомного подкисления)23, 24. Использование любого из этих двух ингибиторов до инфекции IDC с ВПГ-1 сильно подавляет аутофагию, но не нарушает эффективное экспрессию вирусных генов. Таким образом, эта стратегия на основе ингибитора до инфекции ВПГ-1 предлагает мощный инструмент для ингибирования ВПГ-1-индуцированного аутофагического потока, который может быть легко расширен для множества различных типов клеток и вирусов, которые также потенциально вызывают аутофагию.
Для преодоления серьезного недостатка ингибиторного подхода (т.е. неспецифических эффектов вне цели) мы разработали метод на основе siRNA для блокирования аутофагического потока в (HSV-1-инфицированных) iDCs. Техника электропорации siRNA представляет собой мощную альтернативную стратегию, через селективную абляцию экспрессии различных белков (т.е. аутофагических компонентов). В наших экспериментах iDCs были электропораированы с FIP200-специфической siRNA с помощью электропоронного аппарата I (см. Таблица материалов)и измененного протокола, описанного Gerer et al. (2017) и Prechtel et al. (2007), для ингибирования аутофагии во время инициацияфазы 25,26. Этот метод позволил нам специально нокдаун FIP200 выражение в iDCs, не мешая жизнеспособности клеток и их незрелый фенотип два дня после электропорации. Примечательно, что инфекция ВПГ-1 была установлена в этих электропорированных иДК, отраженных эффективным экспрессией вирусного белка. Этот метод на основе siRNA предлагает уникальное преимущество (т.е., что различные аутофагические компоненты, даже в сочетании), могут быть специально ориентированы на абляцию их выражения.
В этом исследовании, мы далее описать siRNA основе метода, чтобы вызвать аутофагический поток также в HSV-1-инфицированных MDCs. В этом случае, iDCs были электропонасысы с siRNA целевых против KIF1B и KIF2A до созревания DC с помощью электропорации аппарата II (см. Таблица материалов). Так как оба белка upregulated во время созревания DC и, как известно, негативно регулировать слияние аутофагосом с изосомы10,18, их нокдаун сильно индуцированных аутофагических потока в MDCs на ВПГ-1 инфекции. Таким образом, метод на основе siRNA позволил нам специально индуцировать аутофагический оборот, вмешиваясь в экспрессию белка KIF в MDCs, и тем самым мог имитировать их уровень экспрессии в iDCs.
Таким образом, мы представляем два различных метода для ингибирования аутофагического потока в HSV-1-инфицированных iDCs. В то время как первый ингибитор-основанный подход представляет собой простой, дешевый и быстрый способ вмешательства в аутофагическую деградацию, второй метод на основе siRNA является более конкретным и очень подходящим методом для поддержки и проверки результатов ингибитора на основе Эксперименты. Кроме того, мы описываем метод, чтобы вызвать аутофагический поток также в HSV-1-инфицированных mDCs, через siRNA-опосредованный нокдаун двух белков KIF.
протокол
Моноцитов полученных DC были созданы из лейкаперез продуктов здоровых доноров. Для этого было получено положительное голосование от местного комитета по этике (справочный номер 4556). Эксперименты настоящего исследования проводились в соответствии с рекомендациями комитета по этике «Фридрих-Александр-Университет Эрланген-Нюрнберг» (справочный номер 4556). Все доноры одобрили письменное информированное согласие, включая соответствие с Хельсинкской декларацией.
1. Поколение и обработка незрелых дендритных клеток (иДК) и зрелых дендритных клеток (mDCs)
- Изолировать человеческие периферийные клетки крови (PBMCs) от лейкосекторных системных камер (LRSCs), как ранее описано27. Избегайте криоконсервации ПБМК и используйте их непосредственно при изоляции, чтобы получить более высокие урожаи постоянного тока.
- Создание человека DCs от PBMCs различных здоровых доноров в T175 клеточной культуры колбы, как ранее описано10,27. Кратко, используйте 350-400 миллионов PBMCs в 30 mL среды DC (RPMI 1640 без L-глютамина, 1% (v/v) AB-сыворотка, 100 U/mL пенициллин, 100 мг/мЛ стрептомицин, 0,4 мМ L-глютамин, 10 мМ HEPES) на колбу клеточной культуры для изоляции моноцитов при соблюдении. После 1 ч смойте непридерживающиеся фракции с помощью RPMI 1640. Добавьте свежий DC средний дополнен 800 U/mL GM-CSF и 250 U/mL IL-4, и инкубировать в течение 3 дней.
- На 3-й день после присоединения, добавить 5 мл свежего DC среды, содержащей GM-CSF и IL-4 с окончательной концентрацией 400 U/mL и 250 U/mL на колбу клеточной культуры, соответственно, для ДИфференциации DC.
- Чтобы собрать iDCs, аккуратно промыть свободно придерживающихся iDCs от нижней части колбы клеточной культуры, на 4-й день после присоединения. Повторите этот шаг 2 раза. Для генерации МДК добавьте созревационный коктейль, составленный следующим образом: GM-CSF (окончательная концентрация: 40 U/mL), IL-4 (окончательная концентрация: 250 U/mL), IL-6 (окончательная концентрация: 200 U/mL), TNF-з (окончательная концентрация: 10 нг/ мЛ), простагландин E2 (PGE2; конечная концентрация: 1 мкг/мл).
- Шесть дней после присоединения (два дня после индукции созревания с помощью цитокинов коктейль), промыть mDCs от нижней части колбы клеточной культуры. Повторите этот шаг два раза.
ПРИМЕЧАНИЕ: Незрелые и зрелые DCs могут быть последовательно генерируемых из идентичных доноров в 1 колбе культуры клеток. Для этого i) отделить соответствующее количество иДК и (ii) вызвать созревание оставшихся клеток в колбах с помощью цитокинового коктейля, перечисленного в шаге 1.2.2.
- Передача iDCs или mDCs в соответствующей среде культуры клетки в трубы 50 mL. Урожай клетки через центрифугацию на 300 х г в течение 5 мин.
- Аккуратно переприостановите (мыть) DCs в 5-10 мл RPMI 1640 на колбу клеточной культуры. Объедините соответствующие суспензии постоянного тока в одной трубке.
- Определите номер ячейки с помощью счетной камеры или альтернативного метода. Избегайте изменения температуры при обработке iDCs, чтобы уменьшить риск фенотипических изменений.
2. Поток цитометрические анализы для мониторинга фенотипического состояния созревания
- Перенесите iDCs или mDCs (0.5 x 106)от шага 1.3.1 в трубку 1.5 mL. Урожай клеток с помощью центрифугации на 3390 х г в течение 1,5 мин. Вымойте клетки один раз с faCS буфера (PBS дополнен 2% плода икроножной сыворотки (FCS)).
- Повторное увеличение количества клеток в 100 л антител, содержащего специфические флюорохромные антитела против определенных молекул поверхности.
- Используйте следующие антитела для проверки чистоты (CD3-FITC, CD14-PE), а также статуса созревания DCs (CD80-PacBlue/-PE-Cy5, CD11c-PE-Cy5, CCR7-PE-Cy7, CD83-APC, CD86-PE, MHCII-APC-Cy7).
- Подготовьте один неокрашенный образец в 100 кЛ буфера FACS в качестве элемента управления.
- Попятнать клетки на льду в темноте в течение 30 мин.
- Затем мыть клетки два раза в 1 мл буфера FACS и центрифуги на 3390 х г в течение 1,5 мин.
- Наконец, повторное приостановление клеток в 200 л буфера FACS дополнено 2% PFA и анализировать клетки по цитометрии потока. Фиксированные ячейки могут храниться при 4 градусах Цельсия в темноте до 2 дней.
3. Инфекция процедуры DCs с вирусом простого герпеса типа-1 (HSV-1) и вмешательства ВПГ-1-индуцированного аутофагического потока через spautin-1 или bafilomycin-A1
ПРИМЕЧАНИЕ: Штамм ВПГ-1/17/CMV-EGFP/UL43 (HSV-1 EGFP), используемый в данном исследовании, был получен из лабораторного штамма ВПГ-1 штамма 17 ". Штамм HSV-1 EGFP выражает улучшенный зеленый флуоресцентный белок (EGFP), который был вставлен в локус гена UL43 под контролем промотора CMV. EGFP служит маркером инфекции ВПГ-1. Кроме того, штамм ВПГ1-RFPVP26 был использован для исследований инфекции ДК (ранее описанная в Turan et al., 2019). Этот вирус выражает капсид поверхностный белок VP26, слитый с мономерным красным флуоресцентным белком (mRFP).
- Передача iDCs или mDCs (2 х 106) от шага 1.3 в трубку 2 мл. Впоследствии центрифуги клетки на 3390 х г в течение 1,5 мин и отбросить супернатанта.
- Аккуратно повторно приостанавливайте работу клеток в инфекционной среде (RPMI 1640, дополненная 20 мМ HEPES).
- Чтобы ингибировать аутофагосомально-лисосомальный путь деградации, предварительно лечить DCs со спаутин-1 или бафиломицин-A1 1 ч до инфекции. Добавьте к инфекционной среде либо 10 мкм спаутин-1 или 1 мКМ БА1, либо DMSO в качестве необработанного контроля. Инкубировать клетки в нагревательном блоке при 300 об/мин, встряхивая при 37 градусах по Цельсию в течение 1 ч.
- Для инфекции исследования, привить клетки с ВПГ-1 virions на множественность инфекции (МВД) 2. В качестве макета добавьте соответствующий объем буфера MNT (30 мМ 2-(N-морфолино)этансульфоновая кислота (MES), 100 мМ NaCl, 20 мМ Tris. Инкубировать клетки в нагревательном блоке при 300 об/мин, встряхивая при 37 градусах по Цельсию в течение 1 ч.
- 1 ч пост инфекции (hpi), собирать клетки на 3390 х г в течение 1,5 мин. Аспир инокулум и осторожно resuspend клетки в СРЕДе DC, содержащий 40 U/mL ГМ-CSF, 250 U/mL ИЛ-4 и либо 10 мкм spautin-1, 1 мкм BA1, или DMSO в качестве контроля. Семена макет лечения и ВПГ-1-инфицированных клеток при окончательной концентрации 1 х 106/ мл в 6-хорошую пластину.
- На 16-24 hpi, урожай клетки путем промывки (mDCs) или с помощью скребка ячейки (iDCs). Перенесите клетки в трубку безопасности 1,5 мл.
- Соберите клетки с помощью центрифугации при 3390 х г в течение 1,5 мин и мыть гранулы один раз, добавив 1 мл PBS.
- Энергично resuspend клетки в миксе lysis содержащ 29 l 2x Roti-Load, 1 ЗЛ 100 mM MgCl2 и 12.5 U/mL бензоназа.
- Для клеточного лиза и пищеварения ДНК с помощью бензоназа, инкубировать образцы при 37 градусов по Цельсию в течение 10 минут. Впоследствии, денатурации белков при 95 градусах по Цельсию в течение 10 мин.
- Выполните Анализы SDS-PAGE и Western blot для проверки уровней белка LC3BI/II, p62, ICP0/5 и GAPDH.
4. Вмешательство HSV-1-индуцированного аутофагического потока через электропорацию iDCs с использованием FIP200-siRNA
ПРИМЕЧАНИЕ: Настоящий протокол для электропорации siRNA был изменен от Prechtel et al. (2007) и Gerer et al. (2017).
- Передача iDCs (12 х 106) в день 3,5 пост присоединения в 50 мл трубки. Впоследствии центрифуги клетки на 300 х г в течение 5 минут и отбросить супернатант. Параллельно выполняется цитометрический анализ потока для мониторинга состояния созревания, описанного в шаге 2 (Использовать life/Dead violet вместо CD80-PacBlue).
- Аккуратно промыть iDCs в 5 мл OptiMEM без фенола красного и центрифуги клеток на 300 х г в течение 5 мин. Отбросьте супернатант и осторожно resuspend iDCs в 200 л OptiMEM без фенола красный, регулируя концентрацию клеток 6 х 106/100 л. Не помещайте клетки на лед и избегайте перепадов температуры. Двигайтесь дальше быстро и избегайте длительных инкубационных периодов iDCs в OptiMEM без фенола красного цвета.
- Передача либо 75 pmol FIP200-специфических siRNA или 75 pmol скремал, в качестве контроля, в 4 мм электро кюветы и добавить 100 кЛ (6x106 клеток) клеточной подвески. Непосредственно импульсные iDCs с помощью электропорационного аппарата I, применяя следующие настройки: 500 В на 1 мс.
- Перед экспериментальной процедурой, подготовить siRNA суспензии в соответствии с инструкцией производителя, aliquot и хранить их на -20 градусов по Цельсию. Оттепель и держать их на льду при использовании этих siRNAs для электропорации. Перед электропорабилите образцы, выполните тестовый импульс.
- После электропорации, непосредственно передать iDC в 6-колодные пластины со свежим предварительно подогретый DC среды (дополнены 40 U/mL ГМ-CSF и 250 U/mL Ил-4). Семя клетки на окончательной концентрации 1 х 106/мл и поместить их в инкубатор. Не промыть клетки из электро-кювета.
- После 48 ч сначала изучите морфологию электропорированных иДК микроскопически. Затем собираем клетки с помощью клеточного скребока и перевешаем их в трубки 15 мл. Промыть скважины с 1 мл PBS дополнены 0,01% EDTA и передать раствор в соответствующих труб.
- Впоследствии, разделить 6 х 106 iDCs на состояние siRNA, как описано в следующих шагах.
- Используйте 0,5 х 106 клеток для оценки состояния созревания и жизнеспособности клеток, как описано в шаге 2. Используйте следующие антитела: CD11c-PE-Cy5, CCR7-PE-Cy7, CD83-APC, MHCII-APC-Cy7 и Life/Dead violet.
- Используйте 1 х 106 ячеек для анализа западных помок для проверки эффективности нокдауна FIP200. Перенос и сбор клеток в трубку безопасности 1,5 мл путем центрифугирования при 3390 х г в течение 1,5 мин. Подготовьте клеточные лисаты, как описано в шаге 3.4, и выполняйте западные анализы пятен.
- Используйте оставшиеся клетки (4,5 х 106)для экспериментов на инфекции ВПГ-1. Для каждого экспериментального состояния, передача 2,25 х 106 iDCs в 2 мл труб и либо заразить их HSV1 на МВД 2 или добавить буфер MNT в качестве макета управления. Выполните инфекцию, как описано в шаге 3.3.
- На 20 hpi, урожай клеток с помощью клеточного скребок и подготовить клеточные lysates для западных анализов поблучники, как описано в шаге 3.4.
5. Модуляция аутофагосомного-лизосомального пути в HSV-1-инфицированных МДК с использованием электропорации KIF1B/2A-siRNA
- Передача iDCs (24 х 106) в день 4 пост присоединения в 50 мл трубки. Впоследствии центрифуги клетки на 300 х г в течение 5 минут и отбросить супернатант.
- Аккуратно приостановите (я мыть) iDCs в 8 мл PBS, чтобы настроить конечную концентрацию клеток 3 х 106/мл. Перенесите 3 х 106 ячеек в трубки 1,5 мл и собираем клетки при 3390 х г в течение 1,5 мин.
- Resuspend iDCs в 100 зЛ буфера P3, содержащего смесь дополнения (в соответствии с инструкциями производителя; электропорации комплект аппарата II) и либо (i) 75 pmol KIF1B-специфических siRNA, (ii) 75 pmol KIF2A-специфического siRNA, или (iii) оба. Используйте (iv) соответствующее количество скремна в качестве элемента контроля. Подготовьте две трубки для каждого состояния siRNA (6 х 106 ячеек) и перенесите подвески в отдельные электро-кюветы. Непосредственно импульсные иДК, применяющие пульс "EH-100" с помощью электропорационного аппарата II.
- Перед экспериментальной процедурой, подготовить siRNA суспензии в соответствии с инструкцией производителя, aliquot и хранить их на -20 градусов по Цельсию. Оттепель и держать их на льду при использовании этих siRNAs для электропорации. Не размещайте iDCs на льду и избегайте перепадов температуры. Двигайтесь быстро и избегайте длительной инкубации iDCs в PBS или буфере P3.
- Непосредственно после электропорации добавьте 500 qL предварительно разогретого RPMI 1640 к электро-кюветам. Инкубировать клетки в инкубаторе в течение 5-10 мин. Передача iDCs в 6-колодные пластины со свежим предварительно подогретым цОД (дополнено 40 U/mL GM-CSF и 250 U/mL ИЛ-4). Объедините соответствующие условия в одну скважину, семя клетки на окончательной концентрации 1'106/mL и поместите их в инкубатор.
- 4 ч после инкубации добавьте созревание коктейль, содержащий цитокины, перечисленные в шаге 1.2.2.
ПРИМЕЧАНИЕ: Подготовьте один образец из неэлектропонных DCs (1 х 106)в качестве контроля для потока цитометрический анализ 2 дней после электропорации. Лечить контрольные элементы аналогично электропообразуемым образцам. - Два дня после электропорации, сбор клеток путем повторного suspension и передачи в 15 мл труб. Промыть скважины с 1 мл PBS и передать подвески в соответствующих труб. Сплит 6'106 DCs на состояние siRNA, как описано в следующих шагах:
- Используйте 0,25 x 106 DCs (электропозавемые и неэлектропоранные) для проверки состояния созревания и жизнеспособности клеток, как описано в шаге 2. Используйте следующие антитела: CD80-PE-Cy5, CD83-APC, CD86-PE, MHCII-APC-Cy7 и Life/Dead violet.
- Используйте 0,75 x 106 ячеек для анализа западных пятнизмов для оценки эффективности нокдауна KIF1B/2A. Соберите клетки в трубку безопасности 1,5 мл путем центрифугирования при 3390 х г в течение 1,5 мин. Подготовьте клеточные лисаты, описанные в шаге 3.4, и выполняйте западные анализы пятен.
- Используйте оставшиеся клетки (5 х 106) от каждого состояния siRNA и выполнять эксперименты инфекции ВПГ-1. Для каждого экспериментального состояния, передача 2,5 х 106 iDCs в 2 мл труб и либо заразить их HSV-1 на МВД 2 или добавить буфер MNT в качестве макета управления. Выполните инфекцию, как описано в шаге 3.3.
- На 20 ч после инфекции, урожай клеток путем повторного приостановления и подготовить клеточные лисаты для западных анализов помот для проверки индукции ВПГ-1 индуцированной аутофагическом обороте, как описано выше в шаге 3.4.
Результаты
В этой рукописи мы описываем методы вмешательства в аутофагию ВПГ-1 в дендритных клетках. Это включает в себя генерацию человека моноцитов полученных iDCs и mDCs, которые были фенотипически проанализированы поток цитометрии(Рисунок 1). На 4-й день после присоединения, DCs показать незрелый фенотип характеризуется слабым выражением CD80, CCR7, и CD83, а также высокой CD11c и промежуточного выражения MHCII. Поскольку сигналы CD3 и CD14 отсутствуют, Т-клеточные и моноцитные загрязнения могут быть исключены. На 6-й день после присоединения (т.е. день 2 после индукции созревания), DCs показать зрелый фенотип отражает значительное увеличение CD80, CCR7, CD83, и MHC-II поверхности выражения. Инфекция с eGFP-выражение штамма ВПГ-1(Рисунок 2) приводит к почти полной инфекции либо iDCs(Рисунок 2Верхняя панель) или mDCs(Рисунок 2Нижняя панель, Рисунок 2B), на основе сильные сигналы GFP, анализируемые флуоресценцией, а также цитометрией потока.
Как показано в нашем недавнем докладе, HSV-1 вызывает аутофагию как в iDCs и mDCs, однако, аутофагический оборот происходит в iDCs только10. При первом подходе мы лечили iDCs и mDCs со спаутином-1(рисунок 3A) - для блокирования инициации аутофагии - или бафиломицина-А1 (BA1; Рисунок 3B) - ингибировать окончательный аутофагосомо-лисосососомного синтеза. При ВПГ-1 инфекции иДК при отсутствии спаутина-1 и BA1, аутофагический поток отражается снижением экспрессии p62 и LC3B соответственно. В отличие от этого, инфекция ВПГ-1 МДК при отсутствии спаутина-1 не влияет на экспрессию p62, в то время как лечение спаутин-1 и БА1 вызывает накопление LC3B-II. Это отражает индукцию аутофагии, но сбой аутофагического оборота в МДК. В iDCs, spautin-1 предварительной обработки сильно восстанавливает аутофагической деградации p62 на ВПГ-1 инфекции, в связи с ингибированием аутофагии во время фазы начала. При предварительном лечении с BA1, макет- и ВПГ-1-инфицированных iDCs показывают сильное накопление lc3B-II уровень белка, что свидетельствует об успешном ингибировании аутофагического оборота через блокирование позднего аутофагосомного-лисосомного синтеза. В соответствии с этим, spautin-1 и BA1 предварительной обработки MDCs также приводит к стабильной p62 и повышение уровня белка LC3B-II, соответственно.
Во втором методе, чтобы нарушить аутофагический поток, siRNA электропорации ориентации FIP200 рассматривается относительно его способности блокировать аутофагический поток в HSV-1-инфицированных iDCs. Как показано на рисунке 4A, сильно сниженные уровни белка FIP200 были обнаружены в iDCs 48 h после электропорации, по сравнению с контролем siRNA. На данный момент, iDCs не показывают каких-либо признаков клеточной смерти (Рисунок 4B) и поддерживать их незрелый фенотип(Рисунок 4C). Инфекция FIP200-молчание iDCs с ВПГ-1 показывает сильное снижение аутофагического потока по сравнению с их контроля siRNA обработанных аналогов (Рисунок 4D). Это сопровождается повышением уровня белка LC3B, а также p62, когда FIP200 заглушается в HSV-1-инфицированных iDCs.
В обратном попытке мы изучили, обеспечивает ли экспрессия белка KIF1B и KIF2A опосредование siRNA и KIF2A атоульсома-лисосомальный оборот также в ВПГ-1-инфицированных МДК. Таким образом, iDCs были электропоранированы с помощью конкретных siRNAs ориентации одного или обоих из этих белков, и клетки впоследствии созрели(Рисунок 5). 2 дня после электропорации, mDCs показывают сильное снижение экспрессии белка KIF1B и/или KIF2A, когда использовались специфические siRNA(рисунок 5A). Этот метод также не привел ни к заметной смерти клеток(рисунок 5B),ни к изменениям в их фенотипическом статусе созревания(рисунок 5C). Поддерживая важность KIF1B и KIF2A во время аутофагосомально-лисосомальной деградации, их истощение до инфекции ВПГ-1 способствует увеличению аутофагического потока в МДК. Это отражается на снижении остаточного уровня белка p62, в отличие от соответствующего условия контроля(рисунок 5D).
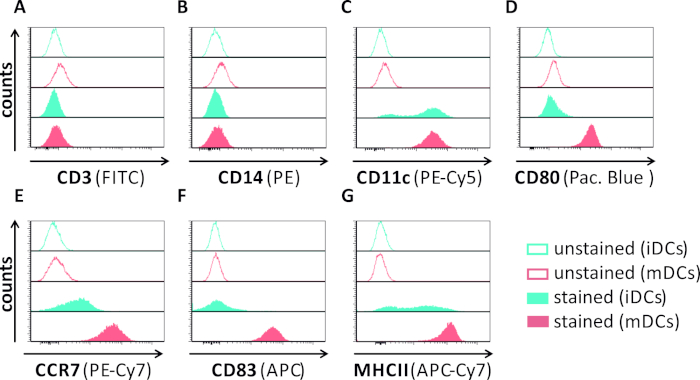
Рисунок 1: Фенотипическая характеристика iDC, полученных из моноцитов человека, и МДК с использованием цитометрии потока. DCs были созданы и окрашены специфическими антителами, чтобы проверить их чистоту: (A) CD3, чтобы исключить Т-клеточные загрязнения, (B) CD14, чтобы исключить загрязнение моноцитами, и (C) CD11c в качестве маркера для DCs. Для оценки состояния фенотипического созревания были использованы следующие антитела: (D) CD80, (E) CCR7, (F) CD83, и (G) MHCII. Эти молекулы высоко выражены на mDCs и таким образом позволяют различение между незрелым и возмужалым фенотипом DC. Данные были проанализированы с помощью FCS Express 5.0. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
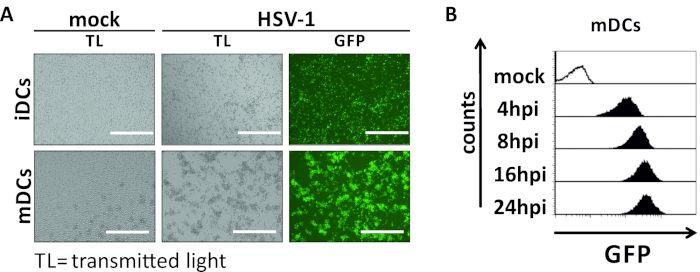
Рисунок 2: Микроскопический, а также цитометрический анализ впихно-1-инфицированных иДК и МДК. IDCs и mDCs были заражены штаммом ВПГ-1, выражающим EGFP (HSV-1 EGFP), чтобы позволить количественно определить уровень инфицирования на основе сигнала GFP. ()Микроскопические анализы GFP-положительных HSV-1-инфицированных iDCs и mDCs инфицированных в МВД 2, по сравнению с их неинфицированных аналогов, на 24 hpi. Для визуализации инфицированных клеток, GFP флуоресценции был мониторинг. Шкала бар представляет 400 мкм. (B) Поток цитометрического измерения макет- или ВПГ-1-инфицированных MDCs во время инфекции кинетики. Верхние панели (черные облицованные гистограммы) показывают макет состояние, нижние панели (черные заполненные гистограммы) показывают ВПГ-1-инфицированных клеток после указанных точек времени после инфекции. Данные были проанализированы с помощью FCS Express 5.0. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
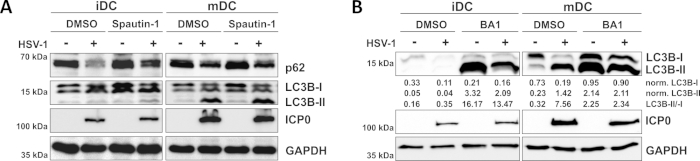
Рисунок 3: Спаутин-1 и b afilomycin-A1 модулируют аутофагический поток в ВПГ-1-инфицированных iDCs. iDCs и mDCs были обработаны с(A)spautin-1 или (B) bafilomycin-A1 (BA1) для 1 h до инфекции. Клетки были впоследствии макет- или ВПГ-1-инфицированных (HSV1-RFPVP26) с помощью МВД 2. После 16-18 ч, DCs были собраны и белка lysates были подвергнуты западной blotting определить выражение p62 или LC3B-I/-II как аутофагические маркеры, ICP0 как контроль инфекции, и GAPDH как контроль нагрузки. Уровни белка LC3B-I и LC3B-II были количественно оценены и нормализованы к эталонному белку GAPDH с использованием Bio1D (оптическая плотность). Показано соотношение нормализованных сигналов LC3B-II к нормализованным сигналам LC3B-I. Эта цифра была изменена и адаптирована с ©2019 Turan et al., первоначально опубликованной в JCB. https://doi.org/10.1083/jcb.20180115110. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
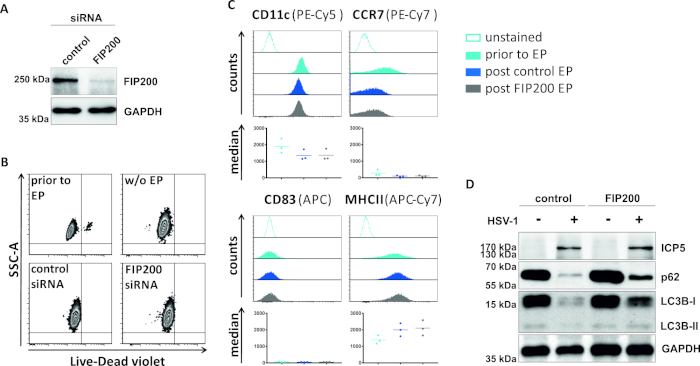
Рисунок 4: Анализ аутофагического потока в HSV-1-инфицированных iDCs на электропорации FIP200-siRNA. iDCs были электропоранированы с контролем siRNA или FIP200-специфических siRNA с помощью электропорации аппарата I. (A) DCs были проанализированы относительно эффективности FIP200 нокдаун 48 ч после электропорации, путем выполнения западных анализов помок. (B) Жизнеспособность клетки также, как ( (C) состояние созревания было проанализировано до электропорации (светло-голубой гистограмм) и 48 h столб (темно-синий и серый гистограммы) электропорация цитометрией потока. Отображаются средние значения для трех различных доноров. После подтверждения эффективного нокдауна FIP200 и незрелого фенотипа, клетки были инфицированы ВПГ-1 (HSV-1 EGFP) с помощью MOI 2. Данные были проанализированы с помощью FCS Express 5.0. (D) На 20 ч после инфекции, клетки были подвергнуты западной помарка анализы для определения экспрессии LC3B-I/-II и p62 в качестве аутофагических маркеров. ICP5 был обнаружен как инфекционный контроль, а GAPDH как контроль нагрузки. Панели A и D были изменены и адаптированы с ©2019 Turan et al., первоначально опубликованные в JCB. https://doi.org/10.1083/jcb.20180115110. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
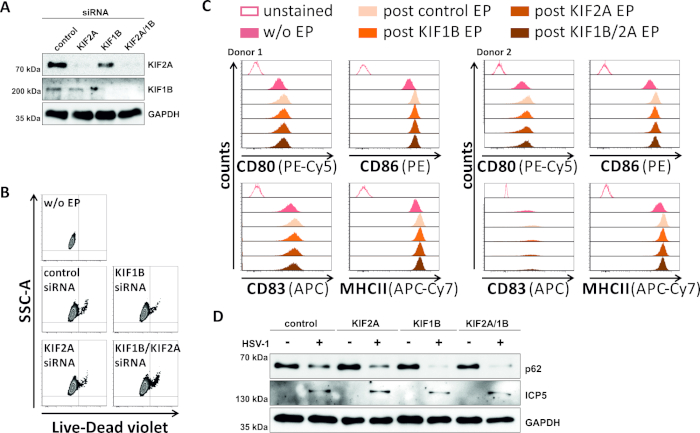
Рисунок 5: siRNA-опосредованного абляции KIF1B и / или KIF2A модулирует аутофагический оборот в HSV-1-инфицированных MDCs. iDCs были электропорежно с KIF1B-специфическими и/или KIF2A-специфическими siRNA, также, как управление siRNA, используя аппарат электропорации II. В 4 ч после электропорации, созревание было индуцировано путем добавления созревания коктейль. На 48 ч после электропорации, DCs были проанализированы в отношении (A) эффективность KIF нокдаун через западные промотирования, (B) жизнеспособность клеток, а также их (C) фенотипический статус созревания с использованием потока цитометрические анализы (два различных доноров показаны). "w/o EP" означает без электропорации, но после индукции созревания; "постконтрольНЫЙ EP" означает постэлектропорацию с использованием контрольной siRNA; "Пост KIF1B, KIF2A, KIF1B/2A EP" означает постэлектропорацию с использованием KIF1B- и/или KIF2A-специфической siRNA. После подтверждения эффективного нокдауна KIF1B и/или KIF2A и зрелого фенотипа, клетки были инфицированы ВПГ-1 (HSV-1 EGFP) с помощью МВД 2. Данные были проанализированы с помощью FCS Express 5.0. (D) Клетки были подвергнуты западной помарка анализы 20 h после инфекции, для того, чтобы оценить выражение p62 как аутофагический маркер. ICP5 использовался в качестве инфекционного контроля, а GAPDH - как контроль нагрузки. Цифры A и D были изменены и адаптированы с ©2019 Turan et al., первоначально опубликованные в JCB. https://doi.org/10.1083/jcb.20180115110. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Сфера действия настоящего протокола включает в себя i) обработку iDC, полученных из моноцитов человека, а также МДК, ii) их заражение ВПГ-1, (iii) их лечение соединениями, которые, как известно, подавляют аутофагию, и (iv) их электропорацию с использованием двух различные технические установки. Используя настоящий протокол, аутофагический поток может быть заблокирован в HSV-1-инфицированных iDCs или индуцированных в HSV-1-инфицированных MDCs.
Поскольку DC, и особенно iDCs, являются очень уязвимыми клетками, работа с этими клетками включает в себя довольно деликатные шаги. Для генерации постоянного тока, мы рекомендуем использовать свежеиспозоливенные ПБМК, и, чтобы избежать их криоконсервации, для того, чтобы получить более высокие урожаи клеток. Кроме того, при обработке iDCs во время экспериментов, в ключая их последующее культивирование, предотвращают резкие или длительные изменения температуры. В противном случае, iDCs может претерпеть фенотипические изменения и, таким образом, необходимо проверить их незрелый фенотип по цитометрии потока. Обратите внимание, что в отличие от зрелых аналогов, iDCs не имеют различных маркеров, таких как CD80, CD83 и CD8628,29. Инфекция iDCs и mDCs с HSV-1 является устоявшимся методом2,3,4,5,6,10. Мы и другие показали, что DCs очень восприимчивы к инфекции ВПГ-1, когда МВД 1 или 2 был использован(Рисунок 2). В наших руках, сохраняя объем инфекции среды на низких уровнях (1-3 х 106 клеток в 250-350 Л) приведет к лучшей эффективности инфекции.
Классический подход, чтобы вмешиваться в данный отдельный клеточный путь является использование конкретных соединений. Разнообразие различных модуляторов аутофагии, т.е. активаторов, а также ингибиторов, в настоящее время доступны30. Что касается HSV-1 индуцированной аутофагии в ДК, Turan и др., (2019) недавно показали ингибирующее действие спаутин-1 и bafilomycin-A1 (BA1) на аутофагический оборот в iDCs10. Этот метод ингибирования аутофагии подходит для сочетания с последующей инфекцией ВПГ-1, так как ни уровень инфекции, ни статус созревания ДК (особенно iDCs) не нарушается. В будущих приложениях этот ингибиторный подход может применяться также в сочетании с другими инфекционными агентами, стрессовыми состояниями, такими как голод, а также для различных типов клеток. Однако при использовании ингибиторов возникают ограничения при определении подходящей концентрации для эффективного ингибирования аутофагии, без серьезного влияния на жизнеспособность клеток. Основным ограничением при использовании ингибиторов, однако, появление потенциальных вне цели или неблагоприятные последствия, которые могут привести к вводящим в заблуждение результаты31,32.
Второй подход к вмешательству в аутофагию, охватываемый настоящим протоколом, является конкретный нокдаун с использованием siRNA33,34,35. С одной стороны, мы использовали электропорационный аппарат I специально абляции экспрессии FIP200, тем самым препятствуя ВПГ-1-индуцированного аутофагического оборота в IDCs. С другой стороны, мы замолчали два различных белка KIF (нат., KIF1B и KIF2A), используя электропорационный аппарат II, чтобы облегчить аутофагический поток в HSV-1-инфицированных МДК. Оба протокола электропорации привели к почти полной абляции FIP200 в iDCs, и KIF1B/KIF2A в MDCs, который был проверен с помощью анализа западных пятен(Рисунок 4A, Рисунок 5A). В отличие от электропорационного аппарата I, который не влияет на жизнеспособность ЦС, электропорация МДК с помощью электропорационного аппарата II приводит к несколько более высоким показателям мертвых клеток(рисунок 4В, Рисунок 5В ). Следовательно, в будущих приложениях электропорационный аппарат, который я должен преимущественно использовать как для iDCs, так и для МДК. Примечательно, что обе методы на основе siRNA, чтобы модулировать аутофагический поток, совместимы с последующей инфекцией ВПГ-1 либо iDCs или mDCs. Кроме того, ни незрелый фенотип иДК, ни зрелый фенотип МДК не изменяются после электропорации.
Электропорация iDCs с использованием FIP200-специфической siRNA является эффективным и высокоспецифическим методом для подделки генов, а также ингибирование аутофагического потока на инфекции ВПГ-1. В дополнение к конкретному замалчиванию FIP200, этот протокол может быть адаптирован, чтобы заставить замолчать другие автофагические компоненты, участвующие на различных шагах во время автофагического каскада. Однако определение подходящей цели для эффективного ингибирования аутофагии при посредничестве siRNA включает в себя несколько аспектов, вызывающих озабоченность. Во-первых, нокдаун эффективность аутофагии связанных генов (ATG) не обязательно положительно коррелирует с эффективным ингибированием аутофагии и в значительной степени зависит от конкретного белка ATG, который замолчать36. Во-вторых, различные белки ATG дополнительно участвуют в путях, отличных от аутофагии, таким образом, их абляция может также привести к неблагоприятным побочным эффектам37,38,39. В-третьих, различные АТГ могут иметь избыточные функции, поэтому нокдаун одного компонента может быть недостаточно для ингибирования аутофагии(например, beclin-1 и beclin-2)40.
Кроме того, электропорационный аппарат I на основе протокола электропорации DCs также подходит для мРНК, и может быть использован для различных дополнительных типов первичных клеток, таких как PBMCs25. Таким образом, эта система обеспечивает общую стратегию доставки различных видов РНК в различные типы первичных клеток. В заключение, мы представляем два протокола для ингибирования аутофагического потока, либо с помощью ингибитора- или siRNA основе подхода в сочетании с последующей инфекции ВПГ-1 iDCs. Кроме того, мы описываем подход к электропорации siRNA, чтобы вызвать аутофагический поток в МДК при инфекции ВПГ-1.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана Германским научно-исследовательским советом (DFG) в рамках проекта STE 432/11-1, присужденного AS, и программой ELAN с медицинского факультета (Friedrich-Alexander-Universit't Erlangen-N'rnberg) в рамках проекта 18-12-21-1, предоставленного LG.
Материалы
| Name | Company | Catalog Number | Comments |
| 4D-Nucleofector Core Unit (electroporation apparatus II) | Lonza (Basel, Switzerland) | AAF-1002B | |
| AB-Serum | Sigma Aldrich Chemie GmbH (Steinheim, Germany) | H4522 | Dendritic cell cultivation |
| ACD-A | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | 9007281 | |
| Amaxa P3 Primary Cell 4D-Nucleofector X Kit L (electroporation kit apparatus II) | Lonza (Basel, Switzerland) | V4XP-3024 | |
| Amersham ECL Prime Western Blotting Detection Reagent | GE Healthcare (Solingen, Germany) | RPN2232 | Western Blot Detection |
| Ammonium persulfate (APS) | Sigma Aldrich Chemie GmbH (Steinheim, Germany) | A3678 | |
| anti-mouse-IgG (mouse, polyclonal, HRP) | Cell Signaling (Leiden, Netherlands) | 7076 | Western Blot detection |
| anti-rabbit-IgG (goat, polyclonal, HRP) | Cell Signaling (Leiden, Netherlands) | 7074 | Western Blot detection |
| Bafilomycin A1 | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | tlrl-baf1 | inhibition of autophagy and lysosomal degradation |
| BD FACS Canto II Flow Cytometer | BD Biosciences (Heidelberg, Germany) | 338962 | |
| Benzonase | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | E1014 | |
| Blotting Chamber Fastblot B44 | Biometra (Göttingen, Germany) | 846-015-100 | |
| CCR7 (mouse, Pe-Cy7) | BioLegend (Fell, Germany) | 557648 | Flow cytometry Dilution: 1:100 Clone: G043H7 |
| CD11c (mouse, Pe-Cy5) | BD Biosciences (Heidelberg, Germany) | 561692 | Flow cytometry Dilution: 1:100 Clone: B-ly6 |
| CD14 (mouse, PE) | BD Biosciences (Heidelberg, Germany) | 555398 | Flow cytometry Dilution: 1:100 Clone: M5E2 |
| CD3 (mouse, FITC) | BD Biosciences (Heidelberg, Germany) | 555332 | Flow cytometry Dilution: 1:100 Clone: UCHT1 |
| CD80 (mouse, V450) | BD Biosciences (Heidelberg, Germany) | 560442 | Flow cytometry Dilution: 1:100 Clone: L307.4 |
| CD83 (mouse, APC) | eBioscience Thermo Fisher Scientific (Langenselbold, Germany) | 17-0839-41 | Flow cytometry Dilution: 1:200 Clone: HB15e |
| CD86 (mouse, PE) | BD Biosciences (Heidelberg, Germany) | 553692 | Flow cytometry Dilution: 1:100 |
| EVOS FL Cell Imaging | System AMG/Life Technologies (Carlsbad, USA) | AMF4300 | |
| FIP200 (rabbit) | Cell Signaling (Leiden, Netherlands) | 12436 | Western Blot detection Dilution: 1:1000 Clone: D10D11 |
| GAPDH (mouse) | Merck Millipore (Massachusetts, USA) | AB2302 | Western Blot detection Dilution: 1:5000 Clone: MAB374 |
| Gene Pulser II apparatus (electroporation apparatus I) | BioRad Laboratories GmbH (München, Germany) | 165-2112 | |
| GM-CSF (4x104 U/mL) | Miltenyi Biotec (Bergisch Gladbach, Germany) | 130-093-868 | |
| HLA?DR (mouse, APC-Cy7) | BioLegend (Fell, Germany) | 307618 | Flow cytometry Dilution: 1:200 Clone: L243 |
| HSV-1/17+/CMV-EGFP/UL43 | BioVex | DC infection | |
| ICP0 (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-53070 | Western Blot detection Dilution: 1:1000 Clone: 11060 |
| ICP5 (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-56989 | Western Blot detection Dilution: 1:1000 Clone: 3B6 |
| IL-1β (0.1x106 U/mL) | Cell Genix GmbH (Freiburg, Germany) | 1411-050 | |
| IL-4 (1x106 U/mL) | Miltenyi Biotec (Bergisch Gladbach, Germany) | 130-093-924 | |
| IL-6 (1x106 U/mL) | Cell Genix GmbH (Freiburg, Germany) | 1404-050 | |
| ImageQuant LAS 4000 | GE Healthcare (Solingen, Germany) | 28955810 | |
| KIF1B (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-376246 | Western Blot detection Dilution: 1:1000 Clone: E-12 |
| KIF2A (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-271471 | Western Blot detection Dilution: 1:1000 Clone: D-7 |
| LC3B (rabbit) | Cell Signaling (Leiden, Netherlands) | 3868 | Western Blot detection Dilution: 1:1000 Clone: D11 |
| L-glutamine | Lonza (Basel, Switzerland) | 17-605E | |
| LIVE/DEAD Fixable Violet dead cell stain kit | Life Technologies (Carlsbad, CA, USA) | L34964 | L/D staining in Flow cytometry |
| Lymphoprep | Alere Technologies AS (Oslo, Norway) | 04-03-9391/01 | |
| Magnesiumchloride | Carl Roth GmbH (Karlsruhe, Germany) | A537.1 | |
| Megafuge 2.0 RS | Heraeus (Hanau, Germany) | 75015505 | |
| N, N, N', N'-Tetramethylethylendiamine (TEMED) | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | T9281 | |
| Neubauer counting chamber | Brand (Wertheim, Germany) | 717805 | |
| Nunc Cell culture flasks (175.0 cm2) | Thermo Scientific (Rockford, USA) | 159910 | |
| p62 (rabbit) | Cell Signaling (Leiden, Netherlands) | 88588 | Western Blot detection Dilution: 1:1000 Clone: D5L7G |
| PageRuler prestained protein ladder | Thermo Fisher Scientific (Langenselbold, Germany) | 26616 | |
| Paraformaldehyde, 16 % | Alfa Aesar, Haverhill, USA | 43368.9M | |
| PerfectSpin 24 Plus | Peqlab (Erlangen, Germany) | C2500-R-PL | |
| PGE2 (1 mg/mL) | Pfizer (Berlin, Germany) | BE130681 | |
| Phosphate buffered saline (PBS) | Lonza (Basel, Switzerland) | 17-512F | |
| Protein gel system MiniProtean II | Bio-Rad Laboratories GmbH (München, Germany) | 1652960 | |
| RestoreTM Western Blot Stripping Buffer | Thermo Scientific, Rockford, USA | 21059 | |
| Rocking Platform wt 15 | Biometra (Göttingen, Germany) | 042-590 | |
| RotiBlock | Carl Roth GmbH (Karlsruhe, Germany) | A151.4 | |
| Roti-Load 1 (4x) | Carl Roth GmbH (Karlsruhe, Germany) | K929.3 | |
| Rotiphorese Gel 30 (37.5:1) | Carl Roth GmbH (Karlsruhe, Germany) | 3029.1 | |
| RPMI 1640 | Lonza (Basel, Switzerland) | 12-167F | |
| Sodium dodecyl Sulfate (SDS) | Carl Roth GmbH (Karlsruhe, Germany) | 2326.2 | |
| Thermomixer comfort | Eppendorf (Hamburg, Germany) | 5355 000.011 | |
| TNF-α (10 μg/mL) | Peprotech (Hamburg, Germany) | 300-01A | |
| Tris | Carl Roth GmbH (Karlsruhe, Germany) | 4855.3 | |
| Trypan blue solution (0.4 %) | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | T8154 | |
| Tween 20 | Carl Roth GmbH (Karlsruhe, Germany) | 9127.1 | |
| Whatman 0.2 μm nitrocellulose membrane | GE Healthcare (Solingen, Germany) | 10600001 | |
| WhatmanTM Chromatography Paper 3 mm Chr | Fisher Scientific GmbH (Schwerte, Germany) | 3030917 |
Ссылки
- Chapuis, F., Rosenzwajg, M., Yagello, M., Ekman, M., Biberfeld, P., Gluckman, J. C. Differentiation of human dendritic cells from monocytes in vitro. European Journal of Immunology. 27 (2), 431-441 (1997).
- Kummer, M., et al. Herpes simplex virus type 1 induces CD83 degradation in mature dendritic cells with immediate-early kinetics via the cellular proteasome. Journal of Virology. 81 (12), 6326-6338 (2007).
- Kruse, M., et al. Mature dendritic cells infected with herpes simplex virus type 1 exhibit inhibited T-cell stimulatory capacity. Journal of Virology. 74 (15), 7127-7136 (2000).
- Salio, M., Cella, M., Suter, M., Lanzavecchia, A. Inhibition of dendritic cell maturation by herpes simplex virus. European Journal of Immunology. 29 (10), 3245-3253 (1999).
- Prechtel, A. T., et al. Infection of mature dendritic cells with herpes simplex virus type 1 dramatically reduces lymphoid chemokine-mediated migration. Journal of General Virology. 86, 1645-1657 (2005).
- Theodoridis, A. A., Eich, C., Figdor, C. G., Steinkasserer, A. Infection of dendritic cells with herpes simplex virus type 1 induces rapid degradation of CYTIP, thereby modulating adhesion and migration. Blood. 118 (1), 107-115 (2011).
- Cohrs, R. J., Gilden, D. H. Human herpesvirus latency. Brain Pathology. 11 (4), 465-474 (2001).
- Grinde, B. Herpesviruses: latency and reactivation - viral strategies and host response. Journal of Oral Microbiology. 5, (2013).
- Whitley, R. J., Roizman, B. Herpes simplex virus infections. The Lancet. 357 (9267), 1513-1518 (2001).
- Turan, A., et al. Autophagic degradation of lamins facilitates the nuclear egress of herpes simplex virus type 1. The Journal of Cell Biology. 218 (2), 508-523 (2019).
- Takeshige, K., Baba, M., Tsuboi, S., Noda, T., Ohsumi, Y. Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction. The Journal of Cell Biology. 119 (2), 301-311 (1992).
- Yin, Z., Pascual, C., Klionsky, D. J. Autophagy: machinery and regulation. Microbial Cell. 3 (12), 588-596 (2016).
- Bodemann, B. O., et al. RalB and the exocyst mediate the cellular starvation response by direct activation of autophagosome assembly. Cell. 144 (2), 253-267 (2011).
- Bjorkoy, G., et al. p62/SQSTM1 forms protein aggregates degraded by autophagy and has a protective effect on huntingtin-induced cell death. The Journal of Cell Biology. 171 (4), 603-614 (2005).
- Kabeya, Y., et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing. The EMBO Journal. 19 (21), 5720-5728 (2000).
- Kabeya, Y., Mizushima, N., Yamamoto, A., Oshitani-Okamoto, S., Ohsumi, Y., Yoshimori, T. LC3, GABARAP and GATE16 localize to autophagosomal membrane depending on form-II formation. Journal of Cell Science. 117, 2805-2812 (2004).
- Pankiv, S., et al. p62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy. The Journal of Biological Chemistry. 282 (33), 24131-24145 (2007).
- Korolchuk, V. I., Rubinsztein, D. C. Regulation of autophagy by lysosomal positioning. Autophagy. 7 (8), 927-928 (2011).
- Li, Y., et al. A cell-based quantitative high-throughput image screening identified novel autophagy modulators. Pharmacological Research. 110, 35-49 (2016).
- Pampaloni, F., et al. A Novel Cellular Spheroid-Based Autophagy Screen Applying Live Fluorescence Microscopy Identifies Nonactin as a Strong Inducer of Autophagosomal Turnover. SLAS Discovery. 22 (5), 558-570 (2017).
- Deng, Y., Zhu, L., Cai, H., Wang, G., Liu, B. Autophagic compound database: A resource connecting autophagy-modulating compounds, their potential targets and relevant diseases. Cell Proliferation. 51 (3), 12403 (2018).
- Liu, J., et al. Beclin1 controls the levels of p53 by regulating the deubiquitination activity of USP10 and USP13. Cell. 147 (1), 223-234 (2011).
- Mauvezin, C., Neufeld, T. P. Bafilomycin A1 disrupts autophagic flux by inhibiting both V-ATPase-dependent acidification and Ca-P60A/SERCA-dependent autophagosome-lysosome fusion. Autophagy. 11 (8), 1437-1438 (2015).
- Yoshimori, T., Yamamoto, A., Moriyama, Y., Futai, M., Tashiro, Y. Bafilomycin A1, a specific inhibitor of vacuolar-type H(+)-ATPase, inhibits acidification and protein degradation in lysosomes of cultured cells. Journal of Biological Chemistry. 266 (26), 17707-17712 (1991).
- Gerer, K. F., Hoyer, S., Dorrie, J., Schaft, N. Electroporation of mRNA as Universal Technology Platform to Transfect a Variety of Primary Cells with Antigens and Functional Proteins. Methods in Molecular Biology. 1499, 165-178 (2017).
- Prechtel, A. T., Turza, N. M., Theodoridis, A. A., Steinkasserer, A. CD83 knockdown in monocyte-derived dendritic cells by small interfering RNA leads to a diminished T cell stimulation. The Journal of Immunology. 178 (9), 5454-5464 (2007).
- Pfeiffer, I. A., et al. Leukoreduction system chambers are an efficient, valid, and economic source of functional monocyte-derived dendritic cells and lymphocytes. Immunobiology. 218 (11), 1392-1401 (2013).
- Villadangos, J. A., Heath, W. R. Life cycle, migration and antigen presenting functions of spleen and lymph node dendritic cells: limitations of the Langerhans cells paradigm. Seminars in Immunology. 17 (4), 262-272 (2005).
- Lechmann, M., Berchtold, S., Hauber, J., Steinkasserer, A. CD83 on dendritic cells: more than just a marker for maturation. Trends in Immunology. 23 (6), 273-275 (2002).
- Yang, Y. P., et al. Application and interpretation of current autophagy inhibitors and activators. Acta Pharmacologica Sinica. 34 (5), 625-635 (2013).
- Redmann, M., et al. Inhibition of autophagy with bafilomycin and chloroquine decreases mitochondrial quality and bioenergetic function in primary neurons. Redox Biology. 11, 73-81 (2017).
- Yan, Y., et al. Bafilomycin A1 induces caspase-independent cell death in hepatocellular carcinoma cells via targeting of autophagy and MAPK pathways. Scientific Reports. 6, 37052 (2016).
- Hale, C. M., et al. Identification of modulators of autophagic flux in an image-based high content siRNA screen. Autophagy. 12 (4), 713-726 (2016).
- Lipinski, M. M., et al. A genome-wide siRNA screen reveals multiple mTORC1 independent signaling pathways regulating autophagy under normal nutritional conditions. Developmental Cell. 18 (6), 1041-1052 (2010).
- Orvedahl, A., et al. Image-based genome-wide siRNA screen identifies selective autophagy factors. Nature. 480 (7375), 113-117 (2011).
- Staskiewicz, L., Thorburn, J., Morgan, M. J., Thorburn, A. Inhibiting autophagy by shRNA knockdown: cautions and recommendations. Autophagy. 9 (10), 1449-1450 (2013).
- Lee, I. H., et al. Atg7 modulates p53 activity to regulate cell cycle and survival during metabolic stress. Science. 336 (6078), 225-228 (2012).
- Fremont, S., Gerard, A., Galloux, M., Janvier, K., Karess, R. E., Berlioz-Torrent, C. Beclin-1 is required for chromosome congression and proper outer kinetochore assembly. EMBO Reports. 14 (4), 364-372 (2013).
- Bestebroer, J., V'kovski, P., Mauthe, M., Reggiori, F. Hidden behind autophagy: the unconventional roles of ATG proteins. Traffic. 14 (10), 1029-1041 (2013).
- Galluzzi, L., Kroemer, G. Common and divergent functions of Beclin 1 and Beclin 2. Cell Research. 23 (12), 1341-1342 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены