Method Article
electroporación de siRNA para modular la autofagia en el virus del herpes simple tipo 1-Células dendríticas derivadas de monocitos infectados
En este artículo
Resumen
En este estudio, presentamos estrategias basadas en inhibidores y siRNA para interferir con el flujo autofágico en las células dendríticas infectadas por el virus del herpes simple tipo-1 (HSV-1) basadas en monocitos.
Resumen
El virus del herpes simple tipo-1 (HSV-1) induce la autofagia tanto en células dendríticas inmaduras (iCD) como en células dendríticas maduras (mCD), mientras que el flujo autofágico solo se observa en los iCD. Para obtener conocimientos mecánicos, desarrollamos estrategias eficientes para interferir con la rotación autofágica inducida por vhs-1. Una estrategia basada en inhibidores, para modular la autofagia inducida por VHS-1, constituye la primera opción, ya que es un método fácil y rápido. Para eludir los posibles efectos inespecíficos fuera del objetivo de estos compuestos, desarrollamos una estrategia alternativa basada en siRNA, para modular la rotación autofágica en iDCs tras la infección por VHS-1. De hecho, la electroporación de iDCs con siRNA específica FIP200 antes de la infección por VHS-1 es un método muy específico y exitoso para ablar la expresión de proteína FIP200 y así inhibir el flujo autofágico. Ambos métodos presentados dan como resultado la inhibición eficiente de la rotación autofágica inducida por VHS-1 en iDCs, por lo que la técnica basada en siRNA es más específica del objetivo. Se desarrolló un enfoque adicional basado en siRNA para silenciar selectivamente la expresión proteica de KIF1B y KIF2A, facilitando la rotación autofágica sobre la infección por VHS-1 en los mDC. En conclusión, la técnica de electroporación de siRNA representa una estrategia prometedora, para ablar selectivamente la expresión de proteínas distintas y para analizar su influencia en una infección por VHS-1.
Introducción
La generación de células dendríticas derivadas de monocitos humanos (DC) constituye un modelo in vitro adecuado para estudiar las funciones y la biología de este importante tipo de células inmunitarias. El aislamiento, así como la diferenciación de monocitos en csuocitos, ha sido bien establecido en los últimos años1,2. La infección de los DC con el virus del herpes simple tipo-1 (HSV-1) del herpeszó es un sistema modelo para estudiar las modulaciones mediadas por VHS-1 de la biología de CC2,3,4,5,6 . Esto es particularmente importante para dilucidar cómo los herpesvirus amortiguan o inhiben las potentes respuestas inmunitarias antivirales, para establecer latencia en nichos inmunes privilegiados dentro del huésped7,8. En este sentido, los herpesvirus son patógenos muy exitosos que se propagan ampliamente por toda la población alcanzando una seroprevalencia de hasta el 90 % según la región geográfica9. Para entender y posiblemente prevenir esto, se requieren más información sobre las modulaciones mediadas por VHS-1 del sistema inmunitario del huésped, y especialmente de las células inmunitarias como los controladores de dominio.
Una observación completamente nueva sobre la interacción de los dCs con HSV-1 fue publicada recientemente por Turan et al.10. Los autores demostraron que la realización de la replicación del VHS-1 depende estrictamente del estado de maduración de los controladores de datos. En los iDC, la replicación completa del VhS-1 se facilita mediante mecanismos dependientes de la autofagia. Mientras que el HSV1 induce la autofagia en ambos, iDCs y mDCs, el flujo autofágico se observa sólo en iDCs. Esto a su vez facilita la salida nuclear de cápsides virales a través de la degradación autofágica de las laminas nucleares en los iDCs. Para obtener información mecanicista sobre esta vía de degradación inducida por el VHS-1 en los iDC s frente a los mDC, las estrategias nuevas y eficientes son fundamentales para investigar el flujo autofágico.
La macroautofagia (autofagia) es un proceso multipaso bien conservado dirigido a proteínas intracelulares u orgánulos enteros para la digestión lisosomal11. Simpísticamente, la autofagia se puede dividir en el (i) inicio, (ii) nucleación de membrana, (iii) expansión de la vesícula y (iv) fase de fusión autofagosoma-lisosoma12. Durante el inicio (i), componentes como el complejo de quinasa ULK1/2 activado, que contiene la proteína de interacción de la familia de quinasas de adhesión focal de 200 kD (FIP200), son fundamentales para activar el complejo beclin-1-Vps34-AMBRA1. Posteriormente, la nucleación de membranas (ii) inicia la formación de fagoforos13,que envuelve cargas citoplasmáticas marcadas por moléculas como p6214. Durante la expansión de la vesícula y la maduración autofagofórica (iii) cadena de luz proteica asociada a microtúbulos 3 (LC3)-I se convierte en su forma lipicada LC3-II que se inserta en la membrana autofagosomal. Por lo tanto, las tasas de conversión DE LC3-I a -II son un indicador de la inducción de la autofagia al reflejar la formación de autofagosomas maduros15,16. Tras la fusión autofagossomeo-lisosoma (iv), no sólo la carga autofágica, sino también las proteínas p62 y LC3-II asociadas sufren degradación (por ejemplo, por hidrólisis). Por lo tanto, la pérdida de p62 y LC3-II sirven como marcadores para el flujo autofágico17. La fusión de autofagosomas con lisosomas, y por lo tanto después de la rotación autofágica, depende en gran medida de la localización islososómica intracelular. Esto está, entre otros, regulado por los miembros de la familia kinesin a KIF1B y KIF2A, que se demostró que afectan negativamente a la fusión autofagoso-lisosoma18. Curiosamente, la expresión proteica de KIF1B y KIF2A se induce sobre la maduración de CC y, por lo que, por lo general, es responsable del flujo autofágico ineficiente en los mDC infectados por vhs,1, lo que dificulta la replicación completa del VHS-110.
Los intentos experimentales de modular la autofagia incluyen el uso de compuestos conocidos por inducir o inhibir esta vía particular19,20,21. En este estudio, describimos dos estrategias basadas en inhibidores para bloquear la rotación autofágica en iDCinfectados infectados por VHS-1. El primer compuesto utilizado en nuestros experimentos es específico y potente inhibidor de la autofagia-1 (spautina-1), que fue descrito para promover la degradación compleja beclin-1-Vps34-AMBRA1 durante la fase de iniciación de la autofagia22. El segundo compuesto utilizado en el presente estudio es la bafilomicina-A1 (BA1), un inhibidor de V-ATPase que bloquea los eventos autofágicos tardíos (esdecir, fusión autofagosoma-lisosoma, así como acidificación autolisósoma)23,24. El uso de cualquiera de estos dos inhibidores antes de la infección iDC con VHS-1 inhibe poderosamente la autofagia, pero no perturba la expresión génica viral eficiente. Por lo tanto, esta estrategia basada en inhibidores antes de la infección por VHS-1 ofrece una poderosa herramienta para inhibir el flujo autofágico inducido por VHS-1 que se puede expandir fácilmente para una plétora de diferentes tipos de células y virus, que también potencialmente inducen la autofagia.
Para superar una desventaja importante de un enfoque basado en inhibidores (esdecir, efectos fuera del objetivo inespecíficos), desarrollamos un método basado en siRNA para bloquear el flujo autofágico en iDCs (infectados por VHS-1). La técnica de la electroporación de siRNA representa una poderosa estrategia alternativa, a través de la ablación selectiva de la expresión de proteínas distintas (es decir, componentes autofágicos). En nuestros experimentos, los iCC fueron electroporados con siRNA específica de FIP200 utilizando el aparato de electroporación I (ver Tabla de Materiales)y un protocolo modificado descrito por Gerer et al. (2017) y Prechtel et al. (2007), para inhibir la autofagia durante el fase de iniciación25,26. Esta técnica nos permitió derribar específicamente la expresión FIP200 en iDCs, sin interferir con la viabilidad celular y su fenotipo inmaduro dos días después de la electroporación. Cabe destacar que la infección por VHS-1 se estableció en estos iDCs electroportados reflejados por una expresión eficaz de proteínas virales. Esta técnica basada en siRNA ofrece un beneficio único (es decir, que una variedad de diferentes componentes autofágicos, incluso en combinación), pueden ser específicamente dirigidos a la ablación de su expresión.
En este estudio, describimos además un método basado en siRNA para inducir el flujo autofágico también en los mDC infectados por VHS-1. En este caso, los iDC fueron electroporados con siRNA dirigido contra KIF1B y KIF2A antes de la maduración de CC utilizando el aparato de electroporación II (ver Tabla de Materiales). Dado que ambas proteínas están reguladas durante la maduración de CC y se sabe que regulan negativamente la fusión de autofagosomas con lisosomas10,18, su derribo indujo fuertemente el flujo autofágico en los mDC sobre la infección por VHS-1. Por lo tanto, la técnica basada en siRNA nos permitió inducir específicamente la rotación autofágica a través de interferir con la expresión de proteína KIF en los mDC, y así podría imitar sus niveles de expresión en iDCs.
En resumen, presentamos dos métodos distintos para inhibir el flujo autofágico en los iDC infectados por VHS-1. Si bien el primer enfoque basado en inhibidores constituye una forma fácil, barata y rápida de interferir con la degradación autofágica, la segunda técnica basada en siRNA es más específica y un método muy adecuado para apoyar y verificar los resultados de la Experimentos. Además, describimos un método para inducir el flujo autofágico también en los mDC infectados por VHS-1, a través del derribo mediado por siRNA de dos proteínas KIF.
Protocolo
Los circuitos de estumecdes derivados de monocitos se generaron a partir de productos de leucoféresis de donantes sanos. Para ello, se ha obtenido un voto positivo del comité de ética local (número de referencia 4556). Los experimentos del presente estudio se realizaron de acuerdo con las recomendaciones del comité de ética de la "Friedrich-Alexander-Universitat Erlangen-Núremberg" (número de referencia 4556). Todos los donantes aprobaron un consentimiento informado por escrito, incluida la conformidad con la Declaración de Helsinki.
1. Generación y manipulación de células dendríticas inmaduras (iCD) y células dendríticas maduras (mCD)
- Aísle las células mononucleares de sangre periférica humana (PPBCM) de las cámaras del sistema de leucoreducción (LSCC) como se describió anteriormente27. Evite la criopreservación de los PBMC y utilícelos directamente sobre el aislamiento para obtener mayores rendimientos de CC.
- Generar dCs humanos a partir de PbMCs de diferentes donantes saludables en matraces de cultivo celular T175 como se describió anteriormente10,27. Brevemente, utilizar 350-400 millones de PBML en 30 ml de medio DC (RPMI 1640 sin L-glutamina, 1% (v/v) AB-suero, 100 U/ml de penicilina, 100 mg/ml de estreptomicina, 0,4 mM de L-glutamina, 10 mM DE HEPES) por matraz de cultivo celular para el aislamiento de la adherencia de los monocitos. Después de 1 h, lave la fracción no adherente usando RPMI 1640. Agregue el medio fresco de CC complementado con 800 U/mL GM-CSF y 250 U/mL IL-4, e incubar durante 3 días.
- En el día 3 después de la adherencia, añadir 5 ml de medio de CC fresco que contenga GM-CSF e IL-4 con una concentración final de 400 U/ml y 250 U/ml por matraz de cultivo celular, respectivamente, para la diferenciación de CC.
- Para cosechar iDCs, enjuague suavemente los iDCs que se adhieran holgadamente desde la parte inferior del matraz de cultivo celular, el día 4 después de la adherencia. Repita este paso 2 veces. Para la generación de mDCs, añadir cóctel de maduración compuesto de la siguiente manera: GM-CSF (concentración final: 40 U/mL), IL-4 (concentración final: 250 U/mL), IL-6 (concentración final: 1000 U/mL), IL-1 ( concentración final: 200 U/mL), TNF-o (concentración final: 10 ng/ mL), prostaglandina E2 (PGE2; concentración final: 1 g/ml).
- Seis días después de la adherencia (dos días después de la inducción de la maduración utilizando un cóctel de citoquinas), enjuague los mCC desde la parte inferior del matraz de cultivo celular. Repita este paso dos veces.
NOTA: Los circuitos de trabajo inmaduros y maduros se pueden generar secuencialmente a partir de donantes idénticos en matraz de cultivo de 1 célula. Para ello, (i) separar el número adecuado de iDCs y (ii) inducir la maduración de las células restantes en los matraces utilizando el cóctel de citoquinas enumerados en el paso 1.2.2.
- Transfiera iDCs o mDCs en el medio de cultivo celular respectivo a tubos de 50 ml. Cosecha las células a través de centrifugación a 300 x g durante 5 min.
- Resuspenda suavemente los DC en 5-10 ml de RPMI 1640 por matraz de cultivo celular. Combine las respectivas suspensiones de CC en un tubo.
- Defina el número de celda utilizando una cámara de conteo o un método alternativo. Evite las alteraciones de temperatura al manipular iDCs, para reducir el riesgo de cambios fenotípicos.
2. Análisis citométricos de flujo para controlar el estado de maduración fenotípica
- Transfiera iDCs o mDCs (0,5 x 106) desde el paso 1.3.1 a un tubo de 1,5 ml. Cosechar las células a través de centrifugación a 3390 x g durante 1,5 min. Lavar las células una vez con tampón FACS (PBS complementado con 2% de suero de ternera fetal (FCS)).
- Resuspenda las células en 100 sl de solución de tinción de anticuerpos (buffer FACS) que contengan anticuerpos específicos etiquetados con fluorocromo contra moléculas de superficie definidas.
- Utilice los siguientes anticuerpos para verificar la pureza (CD3-FITC, CD14-PE) así como el estado de maduración de los DC (CD80-PacBlue/-PE-Cy5, CD11c-PE-Cy5, CCR7-PE-Cy7, CD83-APC, CD86-PE, MHCII-APC-Cy7).
- Prepare una muestra sin mancha en 100 l de búfer FACS como control.
- Mancha las células sobre hielo en la oscuridad durante 30 min.
- Posteriormente lave las células dos veces en 1 ml de tampón FACS y centrífuga a 3390 x g durante 1,5 min.
- Por último, resuspenda las células en 200 l de tampón FACS complementado con 2% de PFA y analice las células por citometría de flujo. Las celdas fijas se pueden almacenar a 4oC en la oscuridad hasta 2 días.
3. Procedimiento de infección de LOS CC con el virus del herpes simple tipo-1 (HSV-1) y la interferencia del flujo autofálgico inducido por VHS-1 a través de la espantina-1 o la bafilomicina-A1
NOTA: La cepa HSV-1/17+/CMV-EGFP/UL43 (HSV-1 EGFP) utilizada en este estudio se obtuvo de la cepa de laboratorio HSV-1 17+. La cepa HSV-1 EGFP expresa la proteína fluorescente verde mejorada (EGFP) que se ha insertado en el locus del gen UL43 bajo control del promotor del CMV. EGFP sirve como un marcador para la infección por VHS-1. Además, la cepa HSV1-RFPVP26 se utilizó para estudios de infección de CC (descrito anteriormente en Turan et al., 2019). Este virus expresa la proteína de superficie cápside VP26 fusionada a la proteína fluorescente roja monómero (mRFP).
- Transfiera iDCs o mDCs (2 x 106) desde el paso 1.3 a un tubo de 2 ml. Posteriormente, centrifugar las células a 3390 x g durante 1,5 min y desechar el sobrenadante.
- Resuspender suavemente las células en el medio de infección (RPMI 1640 complementado con 20 mM HEPES).
- Para inhibir la vía de degradación autofagosomal-lisosomal, pre-tratar los cSu con espantina-1 o bafilomicina-A1 1 h antes de la infección. Añadir al medio de infección 10 m de espacina-1 o 1 M BA1, o DMSO como control no tratado. Incubar las células en un bloque de calentamiento a 300 rpm agitando a 37oC durante 1 h.
- Para estudios de infección, inocular las células con viriones HSV-1 a una multiplicidad de infección (MOI) de 2. Añadir el volumen respectivo de tampón MNT (30 mM 2-(N-morpholino)ácido etanosulfónico (MES), 100 mM NaCl, 20 mM Tris) como control simulado. Incubar las células en un bloque de calentamiento a 300 rpm agitando a 37oC durante 1 h.
- 1 h después de la infección (hpi), recoger las células a 3390 x g durante 1,5 min. Aspirar el inóculo y resuspender suavemente las células en medio de CC que contengan 40 U/ml de GM-CSF, 250 U/ml de IL-4 y 10 oM de esbala-1, 1 OM BA1 o DMSO como control. Semillas de células tratadas simuladas e infectadas por VHS-1 a una concentración final de 1 x 106/ml en una placa de 6 pocillos.
- A 16-24 hpi, cosecha las células enjuagándose (mCD) o usando un rascador de células (iCd). Transfiera las células a un tubo de bloqueo de 1,5 ml.
- Recoger las células a través de la centrifugación a 3390 x g durante 1,5 min y lavar el pellet una vez añadiendo 1 ml de PBS.
- Resuspender vigorosamente las células en la mezcla de lisis que contienen 29 s de 2x Roti-Load, 1 L 100 mM MgCl2 y 12.5 U/mL benzonase.
- Para la lisis celular y la digestión del ADN utilizando benzonasa, incubar las muestras a 37 oC durante 10 min. Posteriormente, desnaturalizar las proteínas a 95oC durante 10 min.
- Realice análisis de SDS-PAGE y Western blot para verificar los niveles de proteínas de LC3BI/II, p62, ICP0/5 y GAPDH.
4. Interferencia del flujo autofágico inducido por VhS-1 a través de la electroporación de iDCs utilizando FIP200-siRNA
NOTA: El presente protocolo para la electroporación de siRNA fue modificado de Prechtel et al. (2007) y Gerer et al. (2017).
- Transfiera iDCs (12 x 106) en el día 3.5 después de la adherencia en un tubo de 50 ml. Posteriormente, centrifugar las células a 300 x g durante 5 min y desechar el sobrenadante. Paralelamente, realice análisis citométricos de flujo para supervisar el estado de maduración como se describe en el paso 2 (Usar violeta de vida/muerta en lugar de CD80-PacBlue).
- Lave suavemente los iCD en 5 ml de OptiMEM sin rojo fenol y centrifugar las células a 300 x g durante 5 min. Deseche el sobrenadante y resuspenda suavemente los iCD en 200 ml de OptiMEM sin rojo fenol, ajustando una concentración celular de 6 x 106/100 l. No coloque las células sobre hielo y evite alteraciones de temperatura. Muévete rápidamente y evita largos períodos de incubación de iDCs en OptiMEM sin rojo fenol.
- Transfiera 75 pmol de SIRNA específico de FIP200 o 75 pmol de siRNA revuelto, como control, a las pechugas electro de 4 mm y agregue 100 l (6x106 células) de la suspensión celular. Pulse directamente iDCs utilizando el aparato de electroporación I, aplicando los siguientes ajustes: 500 V durante 1 ms.
- Antes del procedimiento experimental, preparar las suspensiones de siRNA de acuerdo con las instrucciones del fabricante, alícuota y almacenarlas a -20 oC. Descongelarlos y mantenerlos en hielo cuando utiliceestos siRNAs para electroporación. Antes de electroportar las muestras, realice un pulso de prueba.
- Después de la electroporación, transfiera directamente iDC en placas de 6 pocillos con medio de CC precalentado fresco (complementado con 40 U/ml de GM-CSF y 250 U/ml de IL-4). Sembrar las células a una concentración final de 1 x 106/ml y colocarlas en una incubadora. No enjuague las células de la electro cubeta.
- Después de 48 h, primero examine la morfología de los iDCelectroados microscópicamente. Luego, cosecha las células usando un raspador celular y transfiéralas en tubos de 15 ml. Enjuagar los pozos con 1 ml de PBS complementado con 0.01% EDTA y transferir la solución en los respectivos tubos.
- Posteriormente, divida 6 x 106 iDCs por condición de siRNA como se describe en los pasos siguientes.
- Utilice 0.5 x 106 celdas para evaluar el estado de maduración y la viabilidad celular como se describe en el paso 2. Utilice los siguientes anticuerpos: CD11c-PE-Cy5, CCR7-PE-Cy7, CD83-APC, MHCII-APC-Cy7 y Life/Dead violet.
- Utilice 1 x 106 celdas para los análisis de western blot para verificar la eficiencia de derribo específica de FIP200. Transfiera y cosecha las células en un tubo de bloqueo de 1,5 ml por centrifugación a 3390 x g durante 1,5 min. Prepare los lysates celulares como se describe en el paso 3.4 y realice análisis de manchas occidentales.
- Utilice las células restantes (4,5 x 106) para experimentos de infección por VHS-1. Para cada condición experimental, transfiera 2.25 x 106 iDCs a tubos de 2 ml y infecte con HSV1 en un MOI de 2 o agregue el búfer MNT como un control simulado. Realice la infección como se describe en el paso 3.3.
- A 20 cvi, cosecha las células usando un rascador celular y prepara los lysates celulares para los análisis de manchas occidentales como se describe en el paso 3.4.
5. Modulación de la vía autofago-lisosomal en los mCD infectados por el VHS-1 utilizando la electroporación KIF1B/2A-siRNA
- Transfiera iDCs (24 x 106) en el día 4 después de la adherencia en un tubo de 50 ml. Posteriormente, centrifugar las células a 300 x g durante 5 min y desechar el sobrenadante.
- Resuspenda suavemente los iDC en 8 ml de PBS para ajustar una concentración celular final de 3 x 106/mL. Transfiera 3 x 106 células en tubos de 1,5 ml y cosecha las células a 3390 x g durante 1,5 min.
- Resuspender iDCs en 100 l de tampón P3 que contenga la mezcla de suplemento (de acuerdo con las instrucciones del fabricante; aparato del kit de electroporación II) y (i) 75 pmol de siRNA específico de KIF1B, (ii) 75 pmol de siRNA específico de KIF2A, o (iii) ambos. Utilice (iv) la cantidad respectiva de siRNA revuelto como control. Prepare dos tubos para cada condición de siRNA (6 x 106 células) y transfiera las suspensiones a electro cubetas separadas. Pulse directamente iDCs aplicando el pulso "EH-100" utilizando el aparato de electroporación II.
- Antes del procedimiento experimental, preparar las suspensiones de siRNA de acuerdo con las instrucciones del fabricante, alícuota y almacenarlas a -20 oC. Descongelarlos y mantenerlos en hielo cuando utiliceestos siRNAs para electroporación. No coloque iDCs sobre hielo y evite alteraciones de temperatura. Muévase rápidamente y evite la incubación prolongada de iDCs en PBS o buffer P3.
- Inmediatamente después de la electroporación, añadir 500 l de RPMI 1640 precalentado a las peluqueras electro. Incubar las células en una incubadora durante 5-10 min. Transfiera iDC en placas de 6 pocillos con medio de CC precalentado fresco (complementado con 40 U/ml de GM-CSF y 250 U/ml de IL-4). Combinar las condiciones respectivas en un solo pozo, sembrar las células a una concentración final de 1-106/ml y colocarlas en una incubadora.
- 4 h después de la incubación, añadir el cóctel de maduración que contiene las citoquinas enumeradas en el paso 1.2.2.
NOTA: Preparar una muestra de DCs no electroporados (1 x 106) como control para análisis citométricos de flujo 2 días después de la electroporación. Tratar las células de control de forma análoga a las muestras electroporadas. - Dos días después de la electroporación, cosecha las células por resuspensión y se transfiere a tubos de 15 ml. Enjuague los pozos con 1 ml de PBS y transfiera las suspensiones en los tubos respectivos. Divida entre 6 y 106 dCs por condición de siRNA como se describe en los pasos siguientes:
- Utilice 0,25 x 106 CC (electroporados y no electroportados) para comprobar el estado de maduración y la viabilidad celular como se describe en el paso 2. Utilice los siguientes anticuerpos: CD80-PE-Cy5, CD83-APC, CD86-PE, MHCII-APC-Cy7 y Life/Dead violeta.
- Utilice 0,75 x 106 celdas para los análisis de western blot para evaluar la eficiencia de derribo específica de KIF1B/2A. Recoja las células en un tubo de bloqueo de 1,5 ml por centrifugación a 3390 x g durante 1,5 min. Prepare los lysaatos celulares como se describe en el paso 3.4 y realice análisis de manchas occidentales.
- Utilice las células restantes (5 x 106) de cada condición de siRNA y realice experimentos de infección por VHS-1. Para cada condición experimental, transfiera 2.5 x 106 iDCs en tubos de 2 ml y infecte con HSV-1 en un MOI de 2 o agregue el búfer MNT como un control simulado. Realice la infección como se describe en el paso 3.3.
- A las 20 h después de la infección, cosechar las células por resuspensión y preparar los lysates celulares para los análisis de manchas occidentales para verificar la inducción de la rotación autofágica inducida por VHS-1, como se describe anteriormente en el paso 3.4.
Resultados
En este manuscrito, describimos métodos para interferir con la autofagia inducida por VHS-1 en células dendríticas. Esto incluye la generación de iDCs y mDCs derivados de monocitos humanos, que fueron analizados fenotípicamente por citometría de flujo (Figura 1). En el día 4 después de la adherencia, los DC muestran un fenotipo inmaduro caracterizado por una expresión débil de CD80, CCR7 y CD83, así como alta expresión CD11c y MHCII intermedia. Dado que faltan señales CD3 y CD14, se pueden excluir las contaminaciones de células T y monocitos. En el día 6 después de la adherencia (es decir, día 2 después de la inducción de la maduración), los DC muestran un fenotipo maduro reflejado por un aumento significativo en la expresión superficial CD80, CCR7, CD83 y MHC-II. La infección por una cepa hSV-1 que expresa eGFP(Figura 2) da como resultado una infección casi completa de iDCs(Figura 2A panel superior) o mDCs(Figura 2A panel inferior, Figura 2B), basado en señales GFP fuertes analizadas por microscopía de fluorescencia, así como citometría de flujo.
Como se demuestra en nuestro reciente informe, el HSV-1 induce la autofagia tanto en iDCs como en mDCs, sin embargo, el volumen de negocios autofágico se produce en iDCs sólo10. En un primer enfoque, tratamos iDCs y mDCs con spautin-1(Figura 3A) - para bloquear la iniciación de la autofagia - o bafilomicina-A1 (BA1; Figura 3B) - para inhibir la fusión autofagsomeo-lisosoma final. Tras la infección por VHS-1 de iDCs en ausencia de spautina-1 y BA1, el flujo autofágico se refleja en la disminución de la expresión p62 y LC3B, respectivamente. Por el contrario, la infección por VHS-1 de los MCC en ausencia de espaguetina-1 no afecta a la expresión p62, mientras que el tratamiento con spautina-1 y BA1 induce una acumulación de LC3B-II. Esto refleja la inducción de la autofagia, pero un fracaso de la rotación autofágica en los mDC. En los iDC, el pretratamiento de la espaguetina-1 restaura fuertemente la degradación autofágica de p62 sobre la infección por VHS-1, debido a la inhibición de la autofagia durante la fase de iniciación. Tras el pretratamiento con BA1, los iDCinfectados infectados por simulacros y HSV-1 muestran una fuerte acumulación de niveles de proteína LC3B-II, lo que indica una inhibición exitosa de la rotación autofágica mediante el bloqueo de la fusión autofagosoma-lisosoma tardía. De acuerdo con esto, el pretratamiento de spautina-1 y BA1 de los mDIC también da como resultado niveles estables de proteína p62 y aumento de LC3B-II, respectivamente.
En un segundo método para perjudicar el flujo autofágico, se examina la electroporación de siRNA dirigida a FIP200 en cuanto a su capacidad para bloquear el flujo autofágico en los iDC infectados por el VHS-1. Como se muestra en la Figura 4A,se detectaron niveles de proteína FIP200 fuertemente reducidos en iDCs 48 h después de la electroporación, en comparación con el control de siRNA. En este momento, los iCD no muestran signos de muerte celular(Figura 4B)y mantienen su fenotipo inmaduro(Figura 4C). La infección de iDCs silenciados por FIP200 con VHS-1 revela una fuerte disminución del flujo autofágico en comparación con sus homólogos tratados con siRNA de control(Figura 4D). Esto se acompaña de un aumento de los niveles proteicos de LC3B, así como de p62 cuando FIP200 se silencia en iDCs infectados por VHS-1.
En un intento inverso, estudiamos si la ablación mediada por siRNA de la expresión de proteína KIF1B y KIF2A permite la rotación autofagosomal-lisosomal también en los mDC infectados por vhs-1. Por lo tanto, los iCD se electroporataron utilizando siRNAs específicos dirigidos a una o ambas de estas proteínas, y las células fueron posteriormente maduradas(Figura 5). 2 días después de la electroporación, los mCD muestran una fuerte reducción en la expresión de proteína KIF1B y/o KIF2A, cuando se utilizaron siRNAs específicos(Figura 5A). Este método tampoco condujo a la muerte celular prominente(Figura 5B)ni a cambios en su estado de maduración fenotípica(Figura 5C). Apoyando la importancia de KIF1B y KIF2A durante la degradación autofagosomal-lisosomal, su agotamiento antes de la infección por VHS-1 facilita un aumento del flujo autofágico en los mDC. Esto se refleja en la disminución de los niveles residuales de proteína p62, en contraste con la condición de control respectiva(Figura 5D).
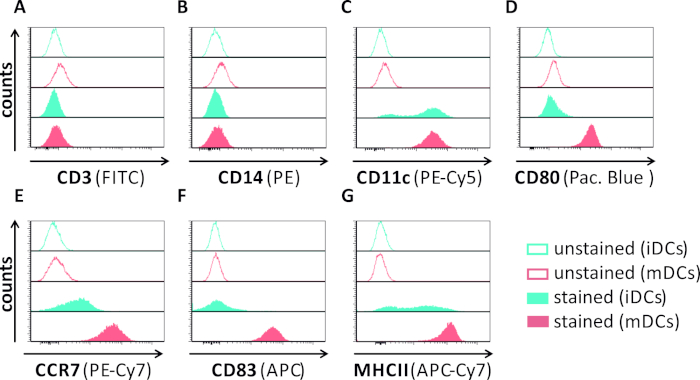
Figura 1: Caracterización fenotípica de iDCs y mDCs derivados de monocitos humanos utilizando citometría de flujo. Se generaron y se tiñieron los DC con anticuerpos específicos para verificar su pureza: (A) CD3 para excluir las contaminaciones de células T, (B) CD14 para excluir la contaminación con monocitos, y (C) CD11c como marcador de DC. Para evaluar su estado de maduración fenotípica se utilizaron los siguientes anticuerpos:(D) CD80, (E) CCR7, (F) CD83 y (G) MHCII. Estas moléculas están muy expresadas en los mDC y, por lo tanto, permiten la discriminación entre el fenotipo DC inmaduro y maduro. Los datos se analizaron utilizando FCS express 5.0. Haga clic aquí para ver una versión más grande de esta figura.
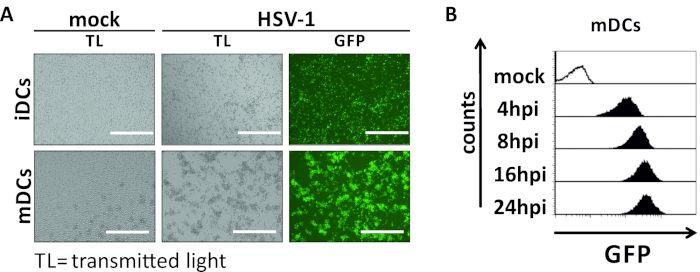
Figura 2: Análisis citométricos microscópicos y de flujo de iDCs y mDCs infectados por VHS-1. los iCC y los mCC se infectaron con una cepa HSV-1 que expresaba el EGFP (HSV-1 EGFP), para permitir la cuantificación de la tasa de infección basada en la señal GFP. (A) Análisis microscópicos de iDC infectados por El VHS-1 y mCC infectados a un MOI de 2, en comparación con sus homólogos no infectados, a 24 hpi. Para visualizar las células infectadas, se monitorizó la fluorescencia de la FPG. La barra de escala representa lamedición citométrica de flujo de los mDC infectados por el VHB o HSV-1 durante la cinética de la infección. Los paneles superiores (histogramas revestidos de negro) muestran la condición simulada, los paneles inferiores (histogramas rellenos negros) muestran células infectadas por El VHS-1 después de los puntos de tiempo indicados después de la infección. Los datos se analizaron utilizando FCS express 5.0. Haga clic aquí para ver una versión más grande de esta figura.
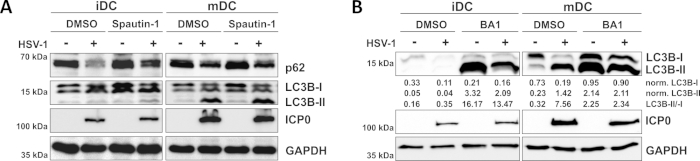
Figura 3: La espantina-1 y b la afilomicina-A1 modulan el flujo autofágico en los iDC infectados por vhs-1. los iCC y los mCC se trataron con (A) espautina-1 o (B) bafilomicina-A1 (BA1) durante 1 h antes de la infección. Las células fueron posteriormente inflamantes por el VHS-1 (HSV1-RFPVP26) utilizando un MOI de 2. Después de 16-18 h, los CC fueron cosechados y los lemulates proteicos fueron sometidos a la hincha occidental para determinar la expresión de p62 o LC3B-I/-II como marcadores autofágicos, ICP0 como control de infecciones, y GAPDH como control de carga. Los niveles de proteína LC3B-I y LC3B-II se cuantificaron y normalizaron a la proteína de referencia GAPDH utilizando Bio1D (densidad óptica). Se muestra la relación entre las señales LC3B-II normalizadas y lc3B-I normalizadas. Esta figura ha sido modificada y adaptada de ©2019 Turan et al. publicado originalmente en JCB. https://doi.org/10.1083/jcb.20180115110. Haga clic aquí para ver una versión más grande de esta figura.
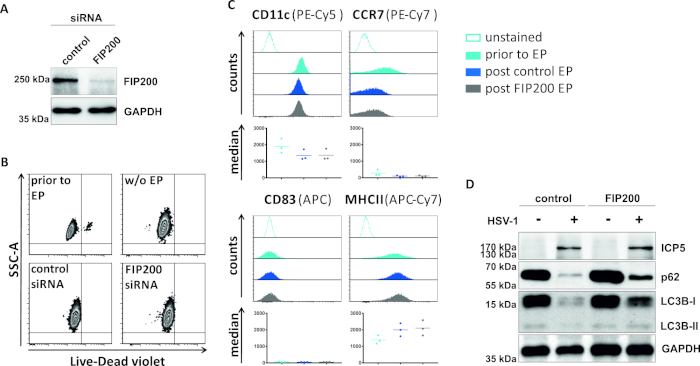
Figura 4: Análisis del flujo autofágico en iDCs infectados por vhs-1 sobre electroporación FIP200-siRNA. Los iDC se electroporaron con siRNA de control o siRNA específica de FIP200 utilizando el aparato de electroporación I. (A) se analizaron los DC con respecto a la eficiencia de FIP200 knockdown 48 h post electroporation, mediante la realización de análisis de manchas occidentales. (B) Se analizó la viabilidad celular, así como (C) el estado de maduración antes de la electroporación (histogramas azul claro) y la electroporación de poste de 48 h (histogramas azul oscuro y gris) por citometría de flujo. Se muestran los valores medios de tres donantes diferentes. Después de confirmar el derribo eficiente de FIP200 y el fenotipo inmaduro, las células fueron infectadas por VHS-1 (HSV-1 EGFP) usando un MOI de 2. Los datos se analizaron utilizando FCS express 5.0. (D) A las 20 h después de la infección, las células fueron sometidas a análisis de manchas occidentales para determinar la expresión de LC3B-I/-II y p62 como marcadores autofágicos. ICP5 se detectó como control de infecciones, y GAPDH como control de carga. Los paneles A y D han sido modificados y adaptados de ©2019 Turan et al. publicados originalmente en JCB. https://doi.org/10.1083/jcb.20180115110. Haga clic aquí para ver una versión más grande de esta figura.
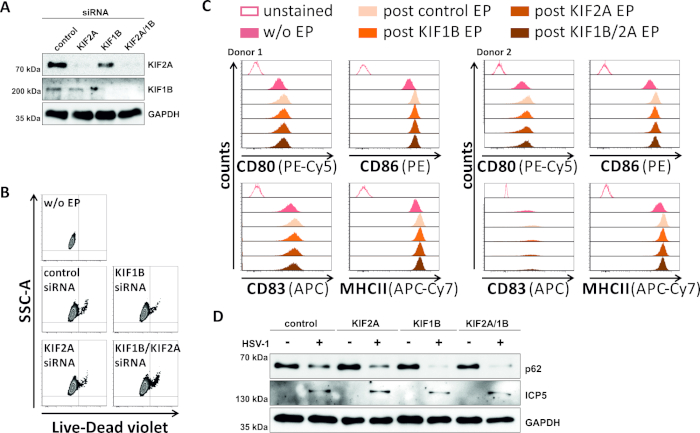
Figura 5: La ablación mediada por siRNA de KIF1B y/o KIF2A modula la rotación autofágica en los mCD infectados por VHS-1. Los iCD se electroporaron con siRNA específico sif1B y/o KIF2A, así como con siRNA de control, utilizando el aparato de electroporación II. A las 4 h después de la electroporación, la maduración fue inducida a través de la adición de un cóctel de maduración. A 48 h de electroporación, se analizaron los DC con respecto a (A) la eficiencia del derribo de KIF a través de la hinchada occidental, (B) viabilidad celular, así como su (C) estado de maduración fenotípica utilizando análisis citométricos de flujo (dos diferentes donantes). "sin EP" significa sin electroporación, pero después de la inducción de la maduración; "EP postcontrol": post electroporación utilizando siRNA de control; "post KIF1B, KIF2A, KIF1B/2A EP" significa siRNA específico de KIF1B y/o KIF2A. Después de confirmar el derribo eficiente de KIF1B y/o KIF2A y el fenotipo maduro, las células fueron infectadas por VHS-1 (HSV-1 EGFP) usando un MOI de 2. Los datos se analizaron utilizando FCS express 5.0. (D) Las células fueron sometidas a análisis de manchas occidentales 20 h después de la infección, con el fin de evaluar la expresión de p62 como un marcador autofágico. ICP5 se utilizó como control de infecciones, y GAPDH como control de carga. Las figuras A y D han sido modificadas y adaptadas de ©2019 Turan et al. publicadas originalmente en JCB. https://doi.org/10.1083/jcb.20180115110. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El alcance del presente protocolo incluye (i) el manejo de iDCs derivados de monocitos humanos, así como de los CPD, (ii) su infección por VHS-1, (iii) su tratamiento con compuestos conocidos por inhibir la autofagia, y (iv) su electroporación con siRNA utilizando dos diferentes configuraciones técnicas. Usando el presente protocolo, el flujo autofágico puede bloquearse en los iDC infectados por el VHS-1 o inducido en los mDC infectados por el VHS-1.
Dado que los dC, y especialmente los iDC, son células muy vulnerables, trabajar con estas células implica pasos bastante delicados. Para la generación de DC, recomendamos utilizar PBMC recién aislados, y para evitar su criopreservación, con el fin de obtener mayores rendimientos celulares. Además, al manipular iDCs durante los experimentos, incluyendo su posterior cultivo, evitar alteraciones de temperatura severas o prolongadas. De lo contrario, los iDC podrían sufrir cambios fenotípicos y, por lo tanto, es necesario verificar su fenotipo inmaduro mediante citometría de flujo. Tenga en cuenta que, a diferencia de sus homólogos maduros, los iDC carecen de marcadores distintos, como CD80, CD83 y CD8628,29. La infección de iDCs y mDCs con HSV-1 es un método bien establecido2,3,4,5,6,10. Nosotros y otros mostramos que los CC son altamente susceptibles para la infección por VHS-1, cuando se ha utilizado un MOI de 1 o 2(Figura 2). En nuestras manos, mantener el volumen del medio de infección en niveles bajos (1-3 x 106 células en 250-350 l) conducirá a una mejor eficiencia de la infección.
Un enfoque clásico para interferir con una determinada vía celular distinta es el uso de compuestos específicos. Una variedad de diferentes moduladores de la autofagia, es decir, activadores, así como inhibidores, están disponibles actualmente30. En lo que respecta a la autofagia inducida por el VHS-1 en los cc. estas condiciones, Turan et al., (2019) mostraron recientemente los efectos inhibitorios de la espantina-1 y la bafilomicina-A1 (BA1) en la rotación autofágica en los iDC10. Esta técnica para la inhibición de la autofagia es adecuada para la combinación con una infección posterior de VHS-1, ya que ni la tasa de infección ni el estado de maduración de los CC (especialmente los iDC) están deteriorados. En futuras aplicaciones, este enfoque basado en inhibidores podría aplicarse también en combinación con otros agentes infecciosos, condiciones de estrés, como el hambre, así como para diferentes tipos de células. Sin embargo, cuando se utilizan inhibidores, surgen limitaciones en la determinación de la concentración adecuada para la inhibición eficiente de la autofagia, sin afectar gravemente a la viabilidad celular. La principal limitación cuando se utilizan inhibidores es, sin embargo, la aparición de posibles efectos fuera del objetivo o adversos, que podrían conducir a resultados engañosos31,32.
El segundo enfoque para interferir con la autofagia, cubierto en el presente protocolo, es el derribo específico utilizando siRNA33,34,35. Por un lado, utilizamos el aparato de electroporación I para ablar específicamente la expresión de FIP200, inhibiendo así la rotación autofágica inducida por HSV-1 en iDCs. Por otro lado, silenciamos dos proteínas KIF diferentes (es decir, KIF1B y KIF2A), utilizando el aparato de electroporación II, para facilitar el flujo autofágico en los mCC infectados por el VHS-1. Tanto los protocolos de electroporación dieron lugar a una ablación casi completa de FIP200 en iDCs, como de KIF1B/KIF2A en mDCs, que se verificó mediante análisis de manchas occidentales(Figura 4A, Figura 5A). A diferencia del aparato de electroporación I, que no afecta a la viabilidad de los CC, la electroporación de los mCD utilizando el aparato de electroporación II da lugar a tasas ligeramente más altas de células muertas(Figura 4B, Figura 5B ). Por lo tanto, en futuras aplicaciones, el aparato de electroporación que debería utilizar preferentemente tanto para iDCs como para mDCs. Sorprendentemente, ambas técnicas basadas en siRNA, para modular el flujo autofágico, son compatibles con la infección posterior de HSV-1 de iDCs o mDCs. Además, ni el fenotipo inmaduro de los iDCniel o el fenotipo maduro de los mDCs se altera después de la electroporación.
La electroporación de iDCs que utilizan siRNA específica de FIP200 es un método eficiente y altamente específico para el derribo de genes, así como la inhibición del flujo autofágico sobre la infección por VHS-1. Además del silenciamiento específico de FIP200, este protocolo se puede adaptar para silenciar otros componentes autofágicos, participando en diferentes pasos durante la cascada autofágica. Sin embargo, la identificación del objetivo adecuado para la inhibición eficiente de la autofagia mediada por siRNA incluye varios aspectos de preocupación. En primer lugar, la eficiencia de derribo de genes relacionados con la autofagia (ATG) no necesariamente se correlaciona positivamente con la inhibición eficiente de la autofagia y es altamente dependiente de la proteína ATG específica que se silencia36. En segundo lugar, las proteínas ATG distintas están involucradas adicionalmente en vías distintas de la autofagia, por lo que su ablación también podría conducir a efectos secundarios adversos37,38,39. En tercer lugar, los diferentes ATG pueden tener funciones redundantes, por lo que el derribo de un componente puede no ser suficiente para inhibir la autofagia (porejemplo, beclin-1 y beclin-2)40.
Además, el aparato de electroporación I -basado en el protocolo de electroporación de dCs también es adecuado para ARNm, y podría ser utilizado para una variedad de tipos de células primarias adicionales, tales como PBMCs25. Este sistema proporciona así una estrategia general para entregar diferentes especies de ARN en diferentes tipos de células primarias. En conclusión, presentamos dos protocolos para inhibir el flujo autofágico, ya sea mediante el uso de un enfoque basado en inhibidores o siRNA combinado con la infección posterior de HSV-1 de los iDC. Además, describimos un enfoque de electroporación de siRNA para inducir el flujo autofágico en los mDCs sobre la infección por VHS-1.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por el Consejo Alemán de Investigación (DFG) a través del proyecto STE 432/11-1 otorgado a AS y por el Programa ELAN de la Facultad de Medicina (Friedrich-Alexander-Universitat Erlangen-Núremberg) a través del proyecto 18-12-21-1, otorgado a LG.
Materiales
| Name | Company | Catalog Number | Comments |
| 4D-Nucleofector Core Unit (electroporation apparatus II) | Lonza (Basel, Switzerland) | AAF-1002B | |
| AB-Serum | Sigma Aldrich Chemie GmbH (Steinheim, Germany) | H4522 | Dendritic cell cultivation |
| ACD-A | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | 9007281 | |
| Amaxa P3 Primary Cell 4D-Nucleofector X Kit L (electroporation kit apparatus II) | Lonza (Basel, Switzerland) | V4XP-3024 | |
| Amersham ECL Prime Western Blotting Detection Reagent | GE Healthcare (Solingen, Germany) | RPN2232 | Western Blot Detection |
| Ammonium persulfate (APS) | Sigma Aldrich Chemie GmbH (Steinheim, Germany) | A3678 | |
| anti-mouse-IgG (mouse, polyclonal, HRP) | Cell Signaling (Leiden, Netherlands) | 7076 | Western Blot detection |
| anti-rabbit-IgG (goat, polyclonal, HRP) | Cell Signaling (Leiden, Netherlands) | 7074 | Western Blot detection |
| Bafilomycin A1 | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | tlrl-baf1 | inhibition of autophagy and lysosomal degradation |
| BD FACS Canto II Flow Cytometer | BD Biosciences (Heidelberg, Germany) | 338962 | |
| Benzonase | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | E1014 | |
| Blotting Chamber Fastblot B44 | Biometra (Göttingen, Germany) | 846-015-100 | |
| CCR7 (mouse, Pe-Cy7) | BioLegend (Fell, Germany) | 557648 | Flow cytometry Dilution: 1:100 Clone: G043H7 |
| CD11c (mouse, Pe-Cy5) | BD Biosciences (Heidelberg, Germany) | 561692 | Flow cytometry Dilution: 1:100 Clone: B-ly6 |
| CD14 (mouse, PE) | BD Biosciences (Heidelberg, Germany) | 555398 | Flow cytometry Dilution: 1:100 Clone: M5E2 |
| CD3 (mouse, FITC) | BD Biosciences (Heidelberg, Germany) | 555332 | Flow cytometry Dilution: 1:100 Clone: UCHT1 |
| CD80 (mouse, V450) | BD Biosciences (Heidelberg, Germany) | 560442 | Flow cytometry Dilution: 1:100 Clone: L307.4 |
| CD83 (mouse, APC) | eBioscience Thermo Fisher Scientific (Langenselbold, Germany) | 17-0839-41 | Flow cytometry Dilution: 1:200 Clone: HB15e |
| CD86 (mouse, PE) | BD Biosciences (Heidelberg, Germany) | 553692 | Flow cytometry Dilution: 1:100 |
| EVOS FL Cell Imaging | System AMG/Life Technologies (Carlsbad, USA) | AMF4300 | |
| FIP200 (rabbit) | Cell Signaling (Leiden, Netherlands) | 12436 | Western Blot detection Dilution: 1:1000 Clone: D10D11 |
| GAPDH (mouse) | Merck Millipore (Massachusetts, USA) | AB2302 | Western Blot detection Dilution: 1:5000 Clone: MAB374 |
| Gene Pulser II apparatus (electroporation apparatus I) | BioRad Laboratories GmbH (München, Germany) | 165-2112 | |
| GM-CSF (4x104 U/mL) | Miltenyi Biotec (Bergisch Gladbach, Germany) | 130-093-868 | |
| HLA?DR (mouse, APC-Cy7) | BioLegend (Fell, Germany) | 307618 | Flow cytometry Dilution: 1:200 Clone: L243 |
| HSV-1/17+/CMV-EGFP/UL43 | BioVex | DC infection | |
| ICP0 (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-53070 | Western Blot detection Dilution: 1:1000 Clone: 11060 |
| ICP5 (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-56989 | Western Blot detection Dilution: 1:1000 Clone: 3B6 |
| IL-1β (0.1x106 U/mL) | Cell Genix GmbH (Freiburg, Germany) | 1411-050 | |
| IL-4 (1x106 U/mL) | Miltenyi Biotec (Bergisch Gladbach, Germany) | 130-093-924 | |
| IL-6 (1x106 U/mL) | Cell Genix GmbH (Freiburg, Germany) | 1404-050 | |
| ImageQuant LAS 4000 | GE Healthcare (Solingen, Germany) | 28955810 | |
| KIF1B (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-376246 | Western Blot detection Dilution: 1:1000 Clone: E-12 |
| KIF2A (mouse) | Santa Cruz Biotechnology (St. Cruz; Dallas, Texas, USA) | sc-271471 | Western Blot detection Dilution: 1:1000 Clone: D-7 |
| LC3B (rabbit) | Cell Signaling (Leiden, Netherlands) | 3868 | Western Blot detection Dilution: 1:1000 Clone: D11 |
| L-glutamine | Lonza (Basel, Switzerland) | 17-605E | |
| LIVE/DEAD Fixable Violet dead cell stain kit | Life Technologies (Carlsbad, CA, USA) | L34964 | L/D staining in Flow cytometry |
| Lymphoprep | Alere Technologies AS (Oslo, Norway) | 04-03-9391/01 | |
| Magnesiumchloride | Carl Roth GmbH (Karlsruhe, Germany) | A537.1 | |
| Megafuge 2.0 RS | Heraeus (Hanau, Germany) | 75015505 | |
| N, N, N', N'-Tetramethylethylendiamine (TEMED) | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | T9281 | |
| Neubauer counting chamber | Brand (Wertheim, Germany) | 717805 | |
| Nunc Cell culture flasks (175.0 cm2) | Thermo Scientific (Rockford, USA) | 159910 | |
| p62 (rabbit) | Cell Signaling (Leiden, Netherlands) | 88588 | Western Blot detection Dilution: 1:1000 Clone: D5L7G |
| PageRuler prestained protein ladder | Thermo Fisher Scientific (Langenselbold, Germany) | 26616 | |
| Paraformaldehyde, 16 % | Alfa Aesar, Haverhill, USA | 43368.9M | |
| PerfectSpin 24 Plus | Peqlab (Erlangen, Germany) | C2500-R-PL | |
| PGE2 (1 mg/mL) | Pfizer (Berlin, Germany) | BE130681 | |
| Phosphate buffered saline (PBS) | Lonza (Basel, Switzerland) | 17-512F | |
| Protein gel system MiniProtean II | Bio-Rad Laboratories GmbH (München, Germany) | 1652960 | |
| RestoreTM Western Blot Stripping Buffer | Thermo Scientific, Rockford, USA | 21059 | |
| Rocking Platform wt 15 | Biometra (Göttingen, Germany) | 042-590 | |
| RotiBlock | Carl Roth GmbH (Karlsruhe, Germany) | A151.4 | |
| Roti-Load 1 (4x) | Carl Roth GmbH (Karlsruhe, Germany) | K929.3 | |
| Rotiphorese Gel 30 (37.5:1) | Carl Roth GmbH (Karlsruhe, Germany) | 3029.1 | |
| RPMI 1640 | Lonza (Basel, Switzerland) | 12-167F | |
| Sodium dodecyl Sulfate (SDS) | Carl Roth GmbH (Karlsruhe, Germany) | 2326.2 | |
| Thermomixer comfort | Eppendorf (Hamburg, Germany) | 5355 000.011 | |
| TNF-α (10 μg/mL) | Peprotech (Hamburg, Germany) | 300-01A | |
| Tris | Carl Roth GmbH (Karlsruhe, Germany) | 4855.3 | |
| Trypan blue solution (0.4 %) | Sigma-Aldrich Chemie GmbH (Steinheim, Germany) | T8154 | |
| Tween 20 | Carl Roth GmbH (Karlsruhe, Germany) | 9127.1 | |
| Whatman 0.2 μm nitrocellulose membrane | GE Healthcare (Solingen, Germany) | 10600001 | |
| WhatmanTM Chromatography Paper 3 mm Chr | Fisher Scientific GmbH (Schwerte, Germany) | 3030917 |
Referencias
- Chapuis, F., Rosenzwajg, M., Yagello, M., Ekman, M., Biberfeld, P., Gluckman, J. C. Differentiation of human dendritic cells from monocytes in vitro. European Journal of Immunology. 27 (2), 431-441 (1997).
- Kummer, M., et al. Herpes simplex virus type 1 induces CD83 degradation in mature dendritic cells with immediate-early kinetics via the cellular proteasome. Journal of Virology. 81 (12), 6326-6338 (2007).
- Kruse, M., et al. Mature dendritic cells infected with herpes simplex virus type 1 exhibit inhibited T-cell stimulatory capacity. Journal of Virology. 74 (15), 7127-7136 (2000).
- Salio, M., Cella, M., Suter, M., Lanzavecchia, A. Inhibition of dendritic cell maturation by herpes simplex virus. European Journal of Immunology. 29 (10), 3245-3253 (1999).
- Prechtel, A. T., et al. Infection of mature dendritic cells with herpes simplex virus type 1 dramatically reduces lymphoid chemokine-mediated migration. Journal of General Virology. 86, 1645-1657 (2005).
- Theodoridis, A. A., Eich, C., Figdor, C. G., Steinkasserer, A. Infection of dendritic cells with herpes simplex virus type 1 induces rapid degradation of CYTIP, thereby modulating adhesion and migration. Blood. 118 (1), 107-115 (2011).
- Cohrs, R. J., Gilden, D. H. Human herpesvirus latency. Brain Pathology. 11 (4), 465-474 (2001).
- Grinde, B. Herpesviruses: latency and reactivation - viral strategies and host response. Journal of Oral Microbiology. 5, (2013).
- Whitley, R. J., Roizman, B. Herpes simplex virus infections. The Lancet. 357 (9267), 1513-1518 (2001).
- Turan, A., et al. Autophagic degradation of lamins facilitates the nuclear egress of herpes simplex virus type 1. The Journal of Cell Biology. 218 (2), 508-523 (2019).
- Takeshige, K., Baba, M., Tsuboi, S., Noda, T., Ohsumi, Y. Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction. The Journal of Cell Biology. 119 (2), 301-311 (1992).
- Yin, Z., Pascual, C., Klionsky, D. J. Autophagy: machinery and regulation. Microbial Cell. 3 (12), 588-596 (2016).
- Bodemann, B. O., et al. RalB and the exocyst mediate the cellular starvation response by direct activation of autophagosome assembly. Cell. 144 (2), 253-267 (2011).
- Bjorkoy, G., et al. p62/SQSTM1 forms protein aggregates degraded by autophagy and has a protective effect on huntingtin-induced cell death. The Journal of Cell Biology. 171 (4), 603-614 (2005).
- Kabeya, Y., et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing. The EMBO Journal. 19 (21), 5720-5728 (2000).
- Kabeya, Y., Mizushima, N., Yamamoto, A., Oshitani-Okamoto, S., Ohsumi, Y., Yoshimori, T. LC3, GABARAP and GATE16 localize to autophagosomal membrane depending on form-II formation. Journal of Cell Science. 117, 2805-2812 (2004).
- Pankiv, S., et al. p62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy. The Journal of Biological Chemistry. 282 (33), 24131-24145 (2007).
- Korolchuk, V. I., Rubinsztein, D. C. Regulation of autophagy by lysosomal positioning. Autophagy. 7 (8), 927-928 (2011).
- Li, Y., et al. A cell-based quantitative high-throughput image screening identified novel autophagy modulators. Pharmacological Research. 110, 35-49 (2016).
- Pampaloni, F., et al. A Novel Cellular Spheroid-Based Autophagy Screen Applying Live Fluorescence Microscopy Identifies Nonactin as a Strong Inducer of Autophagosomal Turnover. SLAS Discovery. 22 (5), 558-570 (2017).
- Deng, Y., Zhu, L., Cai, H., Wang, G., Liu, B. Autophagic compound database: A resource connecting autophagy-modulating compounds, their potential targets and relevant diseases. Cell Proliferation. 51 (3), 12403 (2018).
- Liu, J., et al. Beclin1 controls the levels of p53 by regulating the deubiquitination activity of USP10 and USP13. Cell. 147 (1), 223-234 (2011).
- Mauvezin, C., Neufeld, T. P. Bafilomycin A1 disrupts autophagic flux by inhibiting both V-ATPase-dependent acidification and Ca-P60A/SERCA-dependent autophagosome-lysosome fusion. Autophagy. 11 (8), 1437-1438 (2015).
- Yoshimori, T., Yamamoto, A., Moriyama, Y., Futai, M., Tashiro, Y. Bafilomycin A1, a specific inhibitor of vacuolar-type H(+)-ATPase, inhibits acidification and protein degradation in lysosomes of cultured cells. Journal of Biological Chemistry. 266 (26), 17707-17712 (1991).
- Gerer, K. F., Hoyer, S., Dorrie, J., Schaft, N. Electroporation of mRNA as Universal Technology Platform to Transfect a Variety of Primary Cells with Antigens and Functional Proteins. Methods in Molecular Biology. 1499, 165-178 (2017).
- Prechtel, A. T., Turza, N. M., Theodoridis, A. A., Steinkasserer, A. CD83 knockdown in monocyte-derived dendritic cells by small interfering RNA leads to a diminished T cell stimulation. The Journal of Immunology. 178 (9), 5454-5464 (2007).
- Pfeiffer, I. A., et al. Leukoreduction system chambers are an efficient, valid, and economic source of functional monocyte-derived dendritic cells and lymphocytes. Immunobiology. 218 (11), 1392-1401 (2013).
- Villadangos, J. A., Heath, W. R. Life cycle, migration and antigen presenting functions of spleen and lymph node dendritic cells: limitations of the Langerhans cells paradigm. Seminars in Immunology. 17 (4), 262-272 (2005).
- Lechmann, M., Berchtold, S., Hauber, J., Steinkasserer, A. CD83 on dendritic cells: more than just a marker for maturation. Trends in Immunology. 23 (6), 273-275 (2002).
- Yang, Y. P., et al. Application and interpretation of current autophagy inhibitors and activators. Acta Pharmacologica Sinica. 34 (5), 625-635 (2013).
- Redmann, M., et al. Inhibition of autophagy with bafilomycin and chloroquine decreases mitochondrial quality and bioenergetic function in primary neurons. Redox Biology. 11, 73-81 (2017).
- Yan, Y., et al. Bafilomycin A1 induces caspase-independent cell death in hepatocellular carcinoma cells via targeting of autophagy and MAPK pathways. Scientific Reports. 6, 37052 (2016).
- Hale, C. M., et al. Identification of modulators of autophagic flux in an image-based high content siRNA screen. Autophagy. 12 (4), 713-726 (2016).
- Lipinski, M. M., et al. A genome-wide siRNA screen reveals multiple mTORC1 independent signaling pathways regulating autophagy under normal nutritional conditions. Developmental Cell. 18 (6), 1041-1052 (2010).
- Orvedahl, A., et al. Image-based genome-wide siRNA screen identifies selective autophagy factors. Nature. 480 (7375), 113-117 (2011).
- Staskiewicz, L., Thorburn, J., Morgan, M. J., Thorburn, A. Inhibiting autophagy by shRNA knockdown: cautions and recommendations. Autophagy. 9 (10), 1449-1450 (2013).
- Lee, I. H., et al. Atg7 modulates p53 activity to regulate cell cycle and survival during metabolic stress. Science. 336 (6078), 225-228 (2012).
- Fremont, S., Gerard, A., Galloux, M., Janvier, K., Karess, R. E., Berlioz-Torrent, C. Beclin-1 is required for chromosome congression and proper outer kinetochore assembly. EMBO Reports. 14 (4), 364-372 (2013).
- Bestebroer, J., V'kovski, P., Mauthe, M., Reggiori, F. Hidden behind autophagy: the unconventional roles of ATG proteins. Traffic. 14 (10), 1029-1041 (2013).
- Galluzzi, L., Kroemer, G. Common and divergent functions of Beclin 1 and Beclin 2. Cell Research. 23 (12), 1341-1342 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados