需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
阿斯蒂亚纳克斯墨西哥最大育种和产卵的增量温度变化
摘要
本文概述了增加温度机制的基本实验室条件和协议,以刺激墨西哥四 阿斯蒂亚纳克斯墨西哥最大的产卵,这是一个新兴的模式,发展和进化研究。
摘要
墨西哥四重奏, 墨西哥阿斯蒂安娜克斯,是一个新兴的模型系统,用于研究发展和进化。该物种中存在眼表(表面鱼)和盲洞(洞穴鱼)形态,为探讨形态和行为进化背后的机制提供了机会。洞穴鱼已经进化出新的建设性和倒退性特征。建设性的变化包括味蕾和下颚、横向线感官器官和身体脂肪的增加。递减变化包括眼睛的丧失或减少。黑色素色素沉着,学校行为,侵略和睡眠。为了对这些变化进行实验性审讯,获得大量产卵胚胎至关重要。自20世纪90年代在德克萨斯和墨西哥采集了最初的 A.墨西哥 表面鱼类和洞穴鱼以来,它们的后代经常受到刺激,在杰弗瑞实验室两个月繁殖和产卵大量胚胎。虽然繁殖受食物丰度和质量、光暗周期和温度的控制,但我们发现增量温度变化在刺激最大产卵方面起着关键作用。在繁殖周的头三天,温度从72°F逐渐升高到78°F,这为连续两三个产卵日提供了数量最大的优质胚胎,随后在产卵周的最后三天,温度从78°F逐渐降至72°F。本视频中显示的程序概述了实验室育种周之前和期间的工作流程,以增加温度刺激产卵。
引言
电传阿斯蒂亚纳克斯墨西哥有一个眼睛表面居住(表面鱼)的形式和许多不同的盲洞居住(洞穴鱼)形成1,2。洞穴鱼在永久的黑暗和食物的限制下进化,导致新颖的建设性和倒退性状的出现3。建设性特征包括味蕾和下颚尺寸的增加、横向线的感官器官和脂肪储备。递减特征包括黑色素色素沉着、眼睛和行为(如睡眠、教育和攻击)的丧失或减少。Astyanax系统的一个属性是两种形式之间的完全生育能力,允许使用定量特征 (QTL) 映射来确定与建设性和倒退进化相关的基因组区域 4、5、6、7 。A. 墨西哥人为研究开发提供了一个有利的系统,因为它可以诱导在实验室中频繁产卵。A.墨西哥人的胚胎是半透明的,比斑马鱼的胚胎稍大,大量产生,并在大约8-12个月内发育成性成熟的成年人。他们最大的产卵能力期约为5年。该协议描述了典型的繁殖周期间A. mexicanus养殖设施所需的工作流程,并包括鱼类系统维护的细节和最大产卵的温度控制制度。
A. 墨西哥鱼 是一种热带鱼,生活在源自石灰岩高原(地表鱼)的河流中,生活在石灰岩洞穴(洞穴鱼)8的池中。石灰石溶解产生硬水, 墨西哥在 硬水中茁壮成长。适应硬水条件的鱼可以承受一系列咸味条件,但一般在特定条件下繁殖。产卵行为的诱导是由多种因素综合完成的。由于鱼是冷血的,依靠他们的环境来维持平衡,它们的新陈代谢对环境变化很敏感,它们对压力源的反应更快。 A. 墨西哥人 应在水流、pH、导电性、渗透压力、照明和水温等严格调节的条件下在水生系统中培养。
在杰弗瑞实验室,鱼类被维持在两个自来水系统中:(1) 性成熟前为年轻成年鱼建立"婴儿系统";(2) 性成熟、繁殖成人的成人(或主要)系统。"婴儿系统"由8L和15L水箱组成,提供自来水。"婴儿系统"由鱼苗和幼年变质幼虫在较小的(1-10升)水箱中生长,每周交换水。幼虫、鱼苗和幼鱼极度依赖食物,必须每天喂活食物(盐水虾)一次,以确保高存活率。"婴儿系统"的青少年在大约1-1.5年后被安置在成人系统。起初,他们被喂给粉碎的四片,进一步生长后,他们被转移到常规的成人喂养制度。性成熟度可以用女性的腹部体积来评估,确定性别的方法已经描述了11。在成人系统中,每 24 小时在 42 L 水箱中自动交换水 3 次。成人系统每天通过视觉检查和来自探头的自动温度、pH和导电读数进行监控。最佳pH度在7.4左右,范围在6.8-7.5之间,系统的基本温度为72/73°F,理想导电范围在600-800 mS之间。 自动读数显示在控制器屏幕上,在分布在整个系统的流量计上可视化水压检查。通过测试温度和使用色度测试测量pH值、氨和硝酸盐的水质参数,每周对水质进行独立检查。通过在系统中添加有益细菌(如 Nutafin 循环),氨和硝酸盐水平保持在或接近于零。房间照明由调至14小时光线和10小时黑暗时段的分时器控制。除了上述总体水质参数外,以下考虑在繁殖周期间需要特别注意。
第一个考虑是光周期,因为鱼(甚至在实验室中的洞穴鱼)依赖于光循环来设置他们的昼夜时钟。昼夜节律可以影响一切从繁殖和喂养到免疫系统健康12,13,必须保持一致,以获得最大的健康益处。鱼在14小时光和10小时暗光下保持在自来水系统中。表面鱼类通常在系统变暗一小时后开始产卵,在此期间引入的光线可能会干扰和终止产卵。盲洞鱼的产卵较少受到光线的干扰。与地表鱼类产卵相比,洞穴鱼类的产卵延迟,通常在系统变暗后四到五个小时开始。
第二个考虑因素是营养。成年鱼通常每天吃一次四片。在产卵之前,鱼类被喂养富含蛋白质的饮食,辅以额外的四片片和其他食物:蛋黄片和偶尔生活加州黑虫(Lumbriculus品种),以弥补在上一个产卵周期中因卵子生产而造成的蛋白质损失。在繁殖周期间,每天喂鱼两次,早上喂一次,下午/晚上再喂一次。鱼每天只喂一次,但与一个非常大的食物,应该避免,因为这可能导致营养不良14。
第三个考虑因素是空间。空间要求基于成人的平均身体质量以及行为考虑,例如鱼是否有上学行为或攻击行为。过度或拥挤的水箱可能导致更高的侵略性和持续的压力,使鱼容易受到伤害,从他们的坦克队友和不愿意参与产卵15。我们通常每42L水箱容纳10-20条鱼。
第四个考虑因素是温度。如上所述,鱼是冷血动物,依靠环境来维持体温。由于温度对代谢过程有直接影响,温度变化会引发鱼类的行为改变。此育种计划包括两周的温度周期:第一周将温度峰值引入 78 °F,下周保持 72 °F 的静态温度。 在第一个(育种)周,每天晚上将塑料边缘育种网放置在罐底。养殖网充当鱼缸中的鱼和产卵之间的屏障,否则这些卵子将被消耗掉。温度在本周中将每天提高 2 °F 至最高 78 °F,并根据本周前 2-3 个晚上的光周期诱发产卵。然后,在一周的剩余天数内,温度将降低 2 °F 增量至 72 °F,并将基本温度保持到下一个育种周的开始。繁殖通常每月刺激不超过两次,让鱼的时间恢复。
总的来说,这种方法允许在较长时间内大量产生高质量的胚胎。
研究方案
这一程序已得到马里兰大学学院公园机构动物护理指南的批准(目前IACUC 469#R-NOV-18-59;项目1241065-1)。
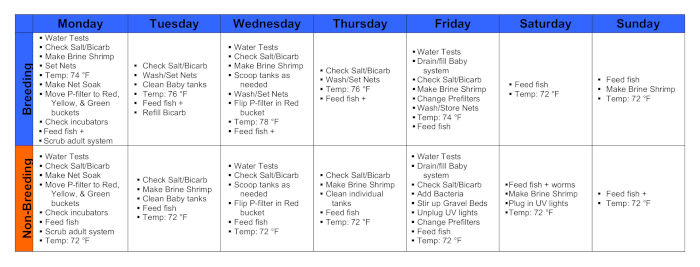
图1。育种周和非育种周的日历。请单击此处查看此图的较大版本。
1. 星期一
- 上午9时至10时,进行水测试,步骤1.1.1-4如下。
- 使用温度计记录房间、储罐和储层温度。
- 用彩色测试套件记录氨、硝酸盐和硝酸盐水平。
- 从监控系统以及色度测试套件记录 pH。
- 记录车童监视器和主系统监视器的导电性。
- 从上午10点开始,喂所有鱼。
- 用四片片在成人系统中喂养所有鱼类,用幼鱼粉碎鱼缸中的薄片。饲料只有尽可能多的片,因为鱼缸可以完全消耗在3-5分钟,约"手指捏"。
- 检查用于容纳发育胚胎的手指碗的孵化器,并在需要时更换水。
- 打开胚胎孵化器,检查所有水库的水位。如果他们的用水不足,就加入系统水。检查孵化器温度设置。以 73-77 °F (23-25 °C) 提高胚胎。
- 清洁实时源。
- 要清洁黑虫,请从活饲料冰箱中取出未覆盖的包含其培养物的 Tupperware 盆,并将蠕虫群上方多余的水倒入水槽中。使用蒸馏水,反复悬挂和冲洗蠕虫,直到倒出的水是明确的。
- 加入足够的清洁水,使蠕虫群被覆盖约一半。更换活饲料冰箱中剩余的蠕虫,未发现。
- 喂鱼。
- 第一次喂食后至少30分钟,在需要用蛋黄片、黑虫或两者兼有繁殖的鱼缸中喂鱼。每个罐子添加一个蛋黄片的"指针"。添加足够的黑虫群,使每个鱼在坦克消耗约5-10蠕虫。
- 上午10时至下午1时,将水温设定为74°F。
- 根据需要擦洗育种池并设置育种网。
- 清洁水箱,并在上次喂食后至少一小时放置网。事先清理网放入的所有储罐。小心设置育种网,以免干扰对油箱的空气供应。
2. 星期二
- 收集胚胎并清洗所有繁殖网。
- 上午9时至10时,从成人系统储罐底部取出繁殖网。用连接到车童的软管将胚胎轻轻冲洗成手持网,并将手持网倒入清洁系统水的指碗中,以排出胚胎。
- 收集和清洗每组胚胎,然后放在含有0.00003%甲基蓝(蓝色水)的清洁系统水中的指碗中。如果单个罐中胚胎数量特别多,则将其分离成多个碗。活胚胎的浓度应该是每个指碗中每200毫升蓝水中100个左右。
- 使用已公布的 A.墨西哥发育 时间表17在显微镜下分胎来估计受精时间。
- 经常监测含有胚胎的指碗。用巴斯德移液器去除死亡或畸形的胚胎和碎片,如未食用的食物或粪便。经常更换指碗中的蓝色水。
- 将指碗放在孵化器中5-7天。目前,蛋黄已经用完,用活盐水虾喂养养殖是进一步发展的必要手段。
- 以生成数据为例。
- 对于每个掉落胚胎的罐体,记录以下信息。
- 记录日期和油箱编号。
- 记录掉落的胚胎的大致数量(图2):
高 (500+)
中等 (200-500)
低(<200) - 记录胚胎质量下降(图2):
高(>75% 活着)
中等 (25-50% 活着)
低 (<25% 活着) - 通过咨询 阿斯蒂亚纳克斯墨西哥 分桌17估计原始产卵时间。
- 记录系统在鱼类产卵时设置的温度。
- 对于每个掉落胚胎的罐体,记录以下信息。
- 喂所有的鱼。
- 将水温设置为 76 °F。
- 准备实时馈送。
- 喂鱼#2。
- 在重置蚊帐之前,从储罐和擦洗中挖出多余的食物和碎屑。
3. 星期三
- 重复步骤 2.1-2.2。收集胚胎并清洗所有繁殖网。
- 像以前一样考虑生成数据。
- 像以前一样进行水测试。
- 喂所有的鱼。
- 将水温设置为 78 °F。
- 准备实时源。
- 检查孵化器中的胚胎。
- 清洁和改变手指碗中胚胎的水,最终将用于补充一般成人繁殖种群。使用甲基蓝处理系统水。
- 再喂鱼。
- 根据需要清洁储罐并重置网。
4. 星期四
- 重复步骤 2.1-2.2。收集胚胎,清洗和储存育种网。
- 像以前一样考虑生成数据。
- 将水温设置为 76°F。
- 清洁实时源。
- 清洁所有单独的储罐。
- 检查孵化器中的胚胎。
- 喂鱼#2。
5. 星期五
- 喂所有的鱼。
- 将水温设置为 74 °F。
- 清洁实时源。
- 检查孵化器中的胚胎。
6. 星期六
- 喂鱼。
7. 星期日
- 喂鱼。
结果
我们通常繁殖和产卵最初收集在圣路易斯波托西的里约乔伊的地表鱼的后代, 墨西哥(里奥乔伊表面鱼)和圣所罗门泉在巴尔莫希亚州立公园,得克萨斯州(得克萨斯州表面鱼)和洞穴鱼从奎瓦德帕坎(帕琼洞穴鱼)在塔毛利帕斯,墨西哥,奎瓦德洛斯萨比诺斯(洛斯萨比诺斯洞穴鱼)和索塔诺德拉蒂纳哈(蒂娜哈洞穴鱼)在圣路易斯波托西墨西哥。
在整个育种周中,收集?...
讨论
阿斯蒂安娜克斯墨西哥是一种新的生物模型,经常产卵,可以很容易地在实验室1,2繁殖。由于我们对A.墨西哥洞穴鱼进化变化的基础发展机制感兴趣,因此胚胎的产生和使用对于我们的研究目标至关重要。维持成年鱼类种群的主要目的是生产胚胎和幼鱼苗,用于发育实验和补充成人繁殖种群。有时,成人也可用于生理学、行为学或基因实?...
披露声明
作者没有什么可透露的。
致谢
我们感谢大卫·玛塔西安、迪德雷·海瑟、艾米·帕克赫斯特、克雷格·福特和曼迪·吴对杰弗瑞实验室 A.墨西哥 文化设施的宝贵贡献。杰弗瑞实验室的研究目前得到国家卫生研究院赠款EY024941的支持。
材料
| Name | Company | Catalog Number | Comments |
| Blackworms | Eastern Aquatics, Lancaster, PA | None | |
| Breeding Nets | Custom made | ||
| Brine shrimp eggs | AquaCave Lake Forest, IL. | None | |
| Colorimetric test kit | Petco | SKU:11916 | API Freshwater pH Test Kit |
| Egg yolk flakes | Pentair, Minneapolis, MN | None | |
| Fingerbowls | Carolina Biological Supply | 741004 | Culture dishes, 4.5 in, 250 mL |
| Hand held nets | Any Pet Store | ||
| Incubator for embryos | Fisher Scientific | 51-029-321HPM | 405 L |
| Instant Ocean sea salts | Spectrum Brands, Blacksburg, VA | None | |
| Methylene Blue | Sigma-Aldrich, St. Louis, MO | M9140 | |
| Pasteur Pipettes | Fisher Scientific | 13-678-20 | 5.75 in. |
| Net soaking solution | Any Pet Store | ||
| Nutrafin Cycle | Amazon | None | Bacterial boost |
| Refrigerator for live feed | Any source | ||
| Stereomicroscope | Any source | ||
| Thermometer | Any source | ||
| Tetra Tropical Crisps | Spectrum Brands, Blacksburg, VA | None |
参考文献
- Jeffery, W. R. Cavefish as a model system in evolutionary developmental biology. Developmental Biology. 231, 1-12 (2001).
- Jeffery, W. R. Emerging model systems in evo-devo: cavefish and mechanisms of microevolution. Evolution & Development. 10, 265-272 (2008).
- Jeffery, W. R. Evolution and development in the cavefish Astyanax. Current Topics in Developmental Biology. 86, 191-221 (2009).
- Protas, M. E., et al. Genetic analysis of cavefish reveals molecular convergence in the evolution of albinism. Nature Genetics. 38, 107-111 (2006).
- Protas, M., Conrad, M., Gross, J. B., Tabin, C. J., Borowsky, R. Regressive evolution in the Mexican cave tetra, Astyanax mexicanus. Current Biology. 17, 452-454 (2007).
- O'Quin, K. E., Yoshizawa, M., Doshi, P., Jeffery, W. R. Quantitative genetic analysis of retinal degeneration in the blind cavefish. PLoS ONE. 8 (2), 57281 (2013).
- Yoshizawa, M., et al. Distinct genetic architecture underlies the emergence of sleep loss and prey-seeking behavior in the Mexican cavefish. BMC Biology. 13, 15 (2015).
- Elliot, W. R. The Astyanax caves of Mexico. Cavefishes of Tamaulipas, San Luis Potosi, and Guerrero. Association for Mexican Cave Studies Bulletin. 26, 1 (2018).
- Luo, S., Wu, B., Xiong, X., Wang, J. Effects of total hardness and calcium:magnesium ratio of water during early stages of rare minnows (Gobiocypris rarus). Comparative Medicine. 66, 181-187 (2016).
- Balasch, J. C., Tort, L. Netting the stress responses in fish. Frontiers in Endocrinology. 10, 62 (2019).
- Borowsky, R. . Determining the sex of adult Astyanax mexicanus. , (2008).
- Paschos, G. Circadian clocks, feeding time, and metabolic homeostasis. Frontiers in Pharmacology. 6, 112 (2015).
- Scheiermann, C., Kunisaki, Y., Frenette, P. S. Circadian control of the immune system. Nature Reviews Immunology. 13, 190-198 (2013).
- Williams, M. B., Watts, S. A. Current basis and future directions of zebrafish nutrigenomics. Genes & Nutrition. 14, 34 (2009).
- Harper, C., Wolf, J. C. Morphologic effects of the stress response in fish. ILAR Journal. 50, 387-396 (2009).
- Neubauer, P., Andersen, K. H. Thermal performance in fish is explained by an interplay between physiology, behavior and ecology. Conservation Physiology. 7 (1), 025 (2019).
- Hinaux, H., et al. Developmental staging table for Astyanax mexicanus. Zebrafish. 8 (4), (2011).
- Borowsky, R. . In vitro fertilization of Astyanax mexicanus. , (2008).
- Simon, V., Hyacinthe, C., Rétaux, S. Breeding behavior in the blind Mexican cavefish and its river-dwelling conspecific. PLoS One. 14 (2), 0212591 (2019).
- Harvey, B. J., Carolsfield, J. Induced Breeding in Tropical Fish Culture. International Development Research Centre. , (1993).
- Ma, L., Parkhurst, A., Jeffery, W. R. The role of a lens survival pathway including sox2 and aA-crystallin in the evolution of cavefish eye degeneration. EvoDevo. 5, 28 (2014).
- Krishnan, J., Rohner, N. Cavefish and the basis for eye loss. Philosophical Transactions of the Royal Society B: Biological Sciences. 5 (372), 20150487 (2017).
- Bilandžija, H., Abraham, L., Ma, L., Renner, K., Jeffery, W. R. Behavioral changes controlled by catecholaminergic systems explain recurrent loss of pigmentation in cavefish. Proceedings of the Royal Society. 285, (2018).
- Ma, L., Jeffery, W. R., Essner, J. J., Kowalko, J. E. Genome editing using TALENs in blind Mexican cavefish. PLoS ONE. 1093, 0119370 (2015).
- Klaassen, H., Wang, Y., Adamski, K., Rohner, N., Kowalko, J. E. CRISPR mutagenesis confirms the role of oca2 in melanin pigmentation in Astyanax mexicanus. Developmental Biology. 441, 313-318 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。