JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
아스티야낙스 멕시코인의 막시달 번식과 산란에 대한 증분 온도 변화
요약
이 기사에서는 발달 및 진화 연구를 위한 새로운 모델인 멕시코 테트라 Astyanax mexicanus에서최대 산란을 자극하기 위한 증분 온도 정권에 대한 기본 실험실 조건 및 프로토콜을 설명합니다.
초록
멕시코 테트라, Astyanax 멕시코,개발 및 진화 연구를위한 새로운 모델 시스템입니다. 이 종에서 눈 표면 (표면 물고기)과 맹목적인 동굴 (동굴 물고기)의 존재는 형태학적 및 행동 진화의 기본 메커니즘을 심문 할 수있는 기회를 제공합니다. 동굴 물고기는 새로운 건설적이고 회귀적 특성을 진화했다. 건설적인 변화는 미각과 턱의 증가, 측면 선 감각 기관 및 체지방을 포함합니다. 회귀 적 변화는 눈의 손실 또는 감소를 포함한다. 멜라닌 색소 침착, 학교 행동, 침략, 수면. 이러한 변화를 실험적으로 심문하려면 많은 수의 산란 된 배아를 얻는 것이 중요합니다. 1990년대에 텍사스와 멕시코에서 원래 A. 멕시코 어류와 동굴 물고기가 수집된 이후, 그들의 후손들은 제프리 실험실에서 격월에 많은 배아를 번식하고 생성하기 위해 정기적으로 자극을 받았습니다. 사육은 음식의 풍요로움과 품질, 밝은 어두운 주기 및 온도에 의해 제어되지만, 우리는 증분 온도 변화가 최대 산란을 자극하는 데 중요한 역할을한다는 것을 발견했습니다. 사육 주 첫 3일 동안 72°F에서 78°F로 의 온도가 점진적으로 증가하면 고품질 배아의 최대 수로 2-3일 연속 산란일을 제공하며, 그 다음에산란 주간의 마지막 3일 동안 78°F에서 72°F로 점진적으로 온도가 감소합니다. 이 비디오에 표시된 절차는 증분 온도 자극 산란에 대한 실험실 사육 주 전과 동안 워크 플로우를 설명합니다.
서문
텔레OST Astyanax 멕시코는 눈 표면 주거 (표면 물고기) 형태와 많은 다른 블라인드 동굴 주거 (동굴 물고기) 형성1,2. 동굴 물고기는 영원한 어둠과 음식 의 한계에서 진화, 새로운 건설적이고 회귀 특성의 출현의결과로 3. 건설적인 특성에는 미각과 턱 크기, 측면 선의 감각 기관 및 지방 매장량이 포함됩니다. 회귀적 특성에는 멜라닌 색소 침착, 눈 및 수면, 학교 및 침략과 같은 행동의 손실 또는 감소를 포함합니다. Astyanax 시스템의 특성은 두 가지 형태 사이의 완전한 다산이며, 건설적이고 회귀적인 진화4,5,6,7과관련된 게놈 영역(들)을 결정하기 위해 정량적 특성 궤적 로시(QTL) 매핑을 사용할 수 있게 한다. A. 멕시코는 실험실에서 자주 생성하도록 유도 될 수 있기 때문에 개발을 연구하는 유리한 시스템을 제공합니다. A. 멕시코인의 배아는 반투명하며, 제브라피쉬보다 약간 더 크고, 대량으로 생산되며, 약 8-12개월 동안 성적으로 성숙한 성인으로 발전합니다. 최대 산란 용량의 그들의 기간은 약 5 년입니다. 이 프로토콜은 일반적인 번식 주간 동안 A. 멕시코 문화 시설에서 필요한 워크플로우를 설명하고 물고기 시스템 유지 보수 및 최대 산란을위한 온도 제어 체제의 세부 사항을 포함합니다.
A. 멕시코는 석회암 고원 (표면 물고기)과 석회암 동굴 (동굴 물고기)의 수영장에서 유래 한 강에 사는 열대 물고기입니다8. 석회암은 용해되어 딱딱한 물을 생산하며, A. 멕시코는 단단한 물속에서 번성합니다. 경수 조건에 적응된 물고기는 다양한 짠 조건을 견딜 수 있지만 일반적으로 특정 조건에서 번식합니다9. 산란 동작의 유도는 요인의 조합에 의해 수행됩니다. 물고기는 냉혈하고 항상성을 유지하기 위해 환경에 의존하기 때문에, 그들의 신진 대사는 환경 변화에 민감하고 스트레스10에더 빨리 반응한다. A. 멕시코는 물 흐름, pH, 전도도, 삼투압, 조명 및 수온의 신중하게 규제 된 조건하에서 수중 시스템에서 배양되어야합니다.
제프리 연구소에서 생선은 성성숙 이전에 젊은 성인 생선을 위한 "아기 시스템"과 (2) 성적으로 성숙하고 번식하는 성인을 위한 성인(또는 메인) 시스템이라는 두 개의 흐르는 물 시스템에서 유지됩니다. "베이비 시스템"은 흐르는 물과 함께 제공되는 8 L 및 15 L 탱크로 구성됩니다. "아기 시스템"은 매주 물을 교환하는 작은 (1-10 L) 탱크에서 애벌레에서 자란 튀김과 젊은 변신 청소년에 의해 시드됩니다. 애벌레, 튀김 및 청소년은 매우 음식에 의존하며 높은 생존율을 보장하기 위해 하루에 한 번 살아있는 음식 (소금물 새우)을 먹여야합니다. "아기 시스템"에서 젊은 청소년은 약 1-1.5 년 후 성인 시스템에 배치됩니다. 처음에, 그들은 분쇄 테트라 플레이크를 공급하고, 추가 성장 후 그들은 일반 성인 먹이 정권으로 전송됩니다. 성적 성숙도는 여성의 복부 부피에 의해 평가될 수 있으며, 성관계를 결정하는 방법은11을설명하였습니다. 성인 시스템에서는 24시간 동안 42L 탱크에서 자동으로 물을 교환합니다. 성인 시스템은 프로브의 육안 검사 및 자동 온도, pH 및 전도도 판독값으로 매일 모니터링됩니다. 최적 pH는 약 7.4이며 6.8-7.5 사이의 범위, 시스템의 기본 온도는 72/73 °F이며, 600-800 mS 사이의 이상적인 전도도 범위. 자동 판독은 컨트롤러 화면에 표시되며, 수압의 육안 검사는 시스템 전체에 분포된 유량계에서 판독된다. 수질에 대한 독립적인 점검은 색상을 측정하여 pH, 암모니아 및 질산염에 대한 온도를 테스트하고 수질 파라미터를 측정하여 매주 이루어집니다. 암모니아와 질산염 수준은 시스템에 유익한 박테리아 (예를 들면, Nutafin 주기)를 추가하여 0에 가깝게 유지됩니다. 실내 조명은 14시간 조명과 10시간 어두운 시간대로 조정된 타이머에 의해 제어됩니다. 위에서 언급한 전체 수질 매개 변수 외에도 다음 고려 사항은 번식 주간에 특별한 주의가 필요합니다.
첫 번째 고려 사항은 물고기 (실험실의 동굴 물고기조차도)가 circadian 시계를 설정하는 빛 주기에 따라 달라지므로 포토 기간입니다. Circadian 리듬은 번식과 먹이에서 면역 체계 건강12,13에 이르기까지 모든 것에 영향을 미칠 수 있으며 최대의 건강 상의 이점을 위해 일관성이 있어야합니다. 물고기는 14시간 빛과 10시간 어두운 광도에 흐르는 물 시스템에서 유지됩니다. 표면 물고기는 일반적으로 시스템이 어두워진 후 한 시간 후에 산란하기 시작하고,이 기간 동안 도입 된 빛은 산란을 방해하고 종료 할 수 있습니다. 맹목적인 동굴 물고기의 산란은 빛에 의해 덜 방해된다. 표면 물고기 산란에 비해, 동굴 물고기 산란은 일반적으로 시스템이 어두워진 후 4 ~ 5 시간 시작, 지연된다.
두 번째 고려 사항은 영양입니다. 성인 생선은 일반적으로 하루에 한 번 테트라 플레이크의 다이어트를 공급한다. 산란하기 전에, 생선은 테트라 플레이크와 다른 음식의 여분의 양으로 보충 단백질이 풍부한 다이어트를 공급한다 : 계란 노른자 플레이크와 때때로 살아 캘리포니아 흑벌레(Lumbriculus variegatus)이전 산란 주기 동안 계란 생산으로 인한 단백질 손실을 보상하기 위해. 번식 주간에는 하루에 두 번, 아침에 한 번, 오후/저녁에 다시 먹이를 주게 됩니다. 하루에 한 번만 먹이를 주는 물고기이지만 영양실조14를유발할 수 있으므로 매우 많은 양의 음식을 피해야 합니다.
세 번째 고려 사항은 공간입니다. 공간 요구 사항은 물고기가 학교 행동이나 공격적인 행동을 가지고 있는지 여부와 같은 행동 고려 사항뿐만 아니라 성인의 평균 신체 질량을 기반으로합니다. 오버 또는 언더 크라우드 탱크는 고조 된 침략과 지속적인 스트레스로 이어질 수 있습니다, 물고기는 탱크 동료에서 부상에 취약하고 산란에 참여하는 것을꺼려15. 우리는 일반적으로 42 L 탱크 당 10-20 물고기를 수용합니다.
네 번째 고려 사항은 온도입니다. 위에서 언급 했듯이, 물고기는 냉혈한 동물이며 체온을 유지하기 위해 환경에 의존합니다. 온도는 신진 대사 과정에 직접적인 영향을 미치기 때문에 온도의 변화는 물고기16의행동 변화를 유발할 수 있습니다. 이 번식 프로그램은 온도에서 2 주 주기로 구성되어 있습니다 : 첫 주에는 78 °F의 온도 스파이크를 도입하고 다음 주에는 72 ° F의 정적 온도를 유지합니다. 첫 번째 (번식) 주 동안, 플라스틱 가장자리 사육 그물은 매일 저녁 탱크의 바닥에 배치됩니다. 번식 그물은 탱크의 물고기와 산란 된 계란 사이의 장벽 역할을하며, 그렇지 않으면 소비 될 것입니다. 기온은 주중반까지 하루 2°F에서 최대 78°F까지 상승하며, 이번 주 첫 2-3저녁에 광사이클에 따라 산란이 유도된다. 그 후 남은 주 동안 온도가 2°F 증분하여 72°F로 낮아지고, 기초 온도는 다음 번식주의 시작까지 유지된다. 번식은 일반적으로 물고기 시간이 회복 할 수 있도록 한 달에 두 번 이상 자극되지 않습니다.
전반적으로, 이 방법은 더 긴 기간 동안 최고 품질의 배아의 대량의 산란을 허용합니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
이 절차는 메릴랜드 대학, 대학 공원의 기관 동물 관리 지침에 의해 승인되었습니다 (현재 IACUC 469 #R-NOV-18-59; 프로젝트 1241065-1).
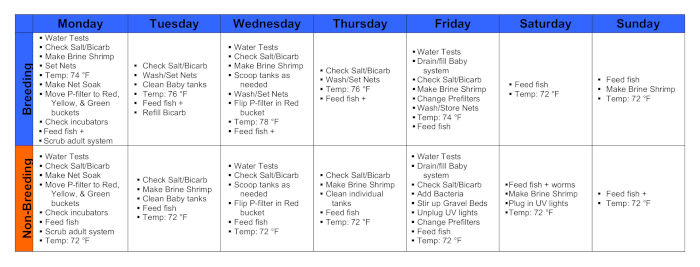
그림 1. 번식 주간과 비 번식 주간 달력. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
1. 월요일
- 오전 9-10시에 는 물 테스트를 수행하고 아래 1.1.1-4 단계를 수행합니다.
- 온도계를 사용하여 방, 탱크 및 저수지 온도를 기록합니다.
- 축색 테스트 키트로 암모니아, 질산염 및 질산염 수준을 기록합니다.
- 색검사 키트뿐만 아니라 모니터링 시스템에서 pH를 기록합니다.
- 카보이 모니터와 메인 시스템 모니터에서 전도도를 기록합니다.
- 오전 10시부터 모든 물고기를 먹이.
- 테트라 플레이크로 성인 시스템의 모든 물고기를 먹이고, 어린 물고기로 탱크의 조각을 분쇄하십시오. 물고기 의 탱크로 많은 조각을 공급3-5 분, 약 "손가락 핀치"에 대해.
- 배아 발달의 손가락 그릇을 수용하는 데 사용되는 인큐베이터를 확인하고 필요한 경우 물을 변경합니다.
- 배아 인큐베이터를 열고 모든 저수지의 수위를 확인합니다. 그들은 물에 낮은 실행하는 경우, 시스템 물을 추가합니다. 인큐베이터 온도 설정을 확인합니다. 배아를 73-77°F(23-25°C)로 올립니다.
- 깨끗한 라이브 피드.
- 검은 벌레를 청소하려면 라이브 피드 냉장고에서 배양물이 들어있는 발견 된 Tupperware 분지를 제거하고 웜 클러스터 위의 과도한 물을 싱크대에 붓습니다. 증류수를 사용하여 부어물이 맑을 때까지 벌레를 반복적으로 중단하고 헹구는 다.
- 웜 클러스터가 약 절반 정도 덮여 있도록 깨끗한 물을 충분히 추가합니다. 발견 된 라이브 피드 냉장고에 남아있는 웜을 교체하십시오.
- 물고기에게 먹이를 주시면 됩니다.
- 첫 번째 먹이 후 적어도 30 분, 계란 노른자 조각, 검은 벌레, 또는 둘 다와 함께 번식을 원하는 탱크에서 물고기를 공급. 탱크당 노른자 플레이크의 "손가락"을 추가합니다. 탱크의 각 물고기가 약 5-10 개의 벌레를 소비 할 수 있도록 충분한 블랙 웜 클러스터를 추가합니다.
- 오전 10시-오후 1시에 수온을 74°F로 설정합니다.
- 필요에 따라 번식 탱크를 스크럽하고 번식 그물을 설정합니다.
- 탱크를 청소하고 마지막 먹이 후 적어도 한 시간 그물을 배치합니다. 그물을 미리 배치하는 모든 탱크를 청소하십시오. 탱크에 공기 공급을 방해하지 않도록 조심스럽게 사육 그물을 설정합니다.
2. 화요일
- 배아를 수집하고 모든 번식 그물을 씻어.
- 오전 9-10시에 성인 시스템 탱크의 바닥에서 사육 그물을 제거하십시오. 카보이에 부착된 호스를 사용하여 배아를 핸드헬드 그물로 부드럽게 헹구고, 핸드헬드 그물을 깨끗한 시스템 물 손가락으로 뒤집어 배아를 추방합니다.
- 각 배아 세트를 수집하고 세척한 다음 0.00003 % 메틸렌 블루 (푸른 물)가 들어있는 깨끗한 시스템 물 손가락 그릇에 놓습니다. 단일 탱크에서 매우 많은 수의 배아가있는 경우 여러 그릇에 분리하십시오. 살아있는 배아의 농도는 각 핑거볼에 있는 청수의 200mL 당 대략 100이어야 합니다.
- 공표된 A. 멕시코 개발시간표(17)를 사용하여 현미경으로 배아를 준비하여 수정 시간을 추정한다.
- 배아를 포함하는 핑거볼을 자주 모니터링합니다. 파저 파이펫으로 죽거나 변형된 배아와 이물질을 먹지 않은 음식이나 대변과 같은 파편을 제거하십시오. 손가락 그릇에 푸른 물을 자주 변경합니다.
- 5-7 일 동안 인큐베이터에 손가락 그릇을 놓습니다. 이 때 노른자는 사용되어 왔으며, 살아있는 소금물 새우와 함께 문화를 먹이는 것은 추가 개발을 위해 필요합니다.
- 생성 데이터를 가져 가라.
- 배아를 떨어뜨리는 모든 탱크에 대해 다음 정보를 기록하십시오.
- 날짜와 탱크 번호를 기록합니다.
- 적중된 배아의 대략적인 수를기록(그림 2):
높음(500+)
중간(200-500)
로우(<200) - 배아의 품질이 떨어졌다기록(그림 2):
높음(>75% 살아 있음)
중간 크기(25-50% 살아 있음)
로우(<25% 살아 있음) - Astyanax 멕시코 스테이징 테이블17을참조하여 원래 산란 시간을 추정합니다.
- 물고기가 생성될 때 시스템이 설정된 온도를 기록합니다.
- 배아를 떨어뜨리는 모든 탱크에 대해 다음 정보를 기록하십시오.
- 모든 물고기를 먹이.
- 수온을 76°F로 설정합니다.
- 라이브 피드를 준비합니다.
- 생선 #2 먹이.
- 그물을 재설정하기 전에 탱크에서 과잉 음식과 파편을 국자하고 스크럽.
3. 수요일
- 2.1-2.2 단계를 반복합니다. 배아를 수집하고 모든 번식 그물을 씻어.
- 이전과 같이 생성 데이터를 가져 가라.
- 이전과 같이 물 테스트를 수행합니다.
- 모든 물고기를 먹이.
- 수온을 78°F로 설정합니다.
- 라이브 피드를 준비합니다.
- 인큐베이터에서 배아를 확인하십시오.
- 깨끗 하고 결국 일반 성인 사육 주식을 보충 하는 데 사용 됩니다 손가락 그릇에 배아의 물을 변경 합니다. 메틸렌 블루 처리 시스템 물을 사용하십시오.
- 물고기를 다시 먹이십시오.
- 필요에 따라 탱크를 청소하고 그물을 재설정합니다.
4. 목요일
- 2.1-2.2 단계를 반복합니다. 배아를 수집하고 사육 그물을 씻고 저장합니다.
- 이전과 같이 생성 데이터를 가져 가라.
- 수온을 76°F로 설정합니다.
- 라이브 피드를 청소합니다.
- 모든 개별 탱크를 청소합니다.
- 인큐베이터에서 배아를 확인하십시오.
- 생선 #2 먹이.
5. 금요일
- 모든 물고기를 먹이.
- 수온을 74°F로 설정합니다.
- 라이브 피드를 청소합니다.
- 인큐베이터에서 배아를 확인하십시오.
6. 토요일
- 물고기에게 먹이를 주시면 됩니다.
7. 일요일
- 물고기에게 먹이를 주시면 됩니다.
Access restricted. Please log in or start a trial to view this content.
결과
우리는 일반적으로 산 루이스 포토시의 나키미엔토 델 리오 초이에서 원래 수집 된 표면 물고기의 후손을 번식하고 산란합니다. 멕시코(리오 초이 표면 물고기)와 텍사스 주 발모헤아 주립공원의 샌 솔로몬 스프링스와 멕시코 타마울리파스, 쿠에바 데 로스 사비노스(로스 사비노스 동굴 물고기) 및 소타노 데 라 티나야(티나야 동굴 물고기)에서 추출한 동굴 물고기 멕시코.
사...
Access restricted. Please log in or start a trial to view this content.
토론
아스티아나엑스멕시카누스는 자주 생성되어 실험실1,2에서쉽게 사육할 수 있는 새로운 생물학적 모델이다. 우리는 A. 멕시코 동굴 물고기의 진화적 변화를 뒷받침하는 발달 메커니즘에 관심이 있기 때문에 배아의 생산과 사용은 연구 목표에 매우 중요합니다. 물고기의 성인 재고를 유지하는 주요 목적은 발달 실험에 사용 및 성인 사육 주?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 것이 없습니다.
감사의 말
데이비드 마르타시안, 디드레 헤이저, 에이미 파크허스트, 크레이그 푸트, 맨디 응에게 제프리 연구소 A. 멕시코 문화 시설에 귀중한 공헌을 해 주셔서 감사합니다. 제프리 연구소의 연구는 현재 NIH 보조금 EY024941에 의해 지원됩니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Blackworms | Eastern Aquatics, Lancaster, PA | None | |
| Breeding Nets | Custom made | ||
| Brine shrimp eggs | AquaCave Lake Forest, IL. | None | |
| Colorimetric test kit | Petco | SKU:11916 | API Freshwater pH Test Kit |
| Egg yolk flakes | Pentair, Minneapolis, MN | None | |
| Fingerbowls | Carolina Biological Supply | 741004 | Culture dishes, 4.5 in, 250 mL |
| Hand held nets | Any Pet Store | ||
| Incubator for embryos | Fisher Scientific | 51-029-321HPM | 405 L |
| Instant Ocean sea salts | Spectrum Brands, Blacksburg, VA | None | |
| Methylene Blue | Sigma-Aldrich, St. Louis, MO | M9140 | |
| Pasteur Pipettes | Fisher Scientific | 13-678-20 | 5.75 in. |
| Net soaking solution | Any Pet Store | ||
| Nutrafin Cycle | Amazon | None | Bacterial boost |
| Refrigerator for live feed | Any source | ||
| Stereomicroscope | Any source | ||
| Thermometer | Any source | ||
| Tetra Tropical Crisps | Spectrum Brands, Blacksburg, VA | None |
참고문헌
- Jeffery, W. R. Cavefish as a model system in evolutionary developmental biology. Developmental Biology. 231, 1-12 (2001).
- Jeffery, W. R. Emerging model systems in evo-devo: cavefish and mechanisms of microevolution. Evolution & Development. 10, 265-272 (2008).
- Jeffery, W. R. Evolution and development in the cavefish Astyanax. Current Topics in Developmental Biology. 86, 191-221 (2009).
- Protas, M. E., et al. Genetic analysis of cavefish reveals molecular convergence in the evolution of albinism. Nature Genetics. 38, 107-111 (2006).
- Protas, M., Conrad, M., Gross, J. B., Tabin, C. J., Borowsky, R. Regressive evolution in the Mexican cave tetra, Astyanax mexicanus. Current Biology. 17, 452-454 (2007).
- O'Quin, K. E., Yoshizawa, M., Doshi, P., Jeffery, W. R. Quantitative genetic analysis of retinal degeneration in the blind cavefish. PLoS ONE. 8 (2), 57281(2013).
- Yoshizawa, M., et al. Distinct genetic architecture underlies the emergence of sleep loss and prey-seeking behavior in the Mexican cavefish. BMC Biology. 13, 15(2015).
- Elliot, W. R. The Astyanax caves of Mexico. Cavefishes of Tamaulipas, San Luis Potosi, and Guerrero. Association for Mexican Cave Studies Bulletin. 26, 1(2018).
- Luo, S., Wu, B., Xiong, X., Wang, J. Effects of total hardness and calcium:magnesium ratio of water during early stages of rare minnows (Gobiocypris rarus). Comparative Medicine. 66, 181-187 (2016).
- Balasch, J. C., Tort, L. Netting the stress responses in fish. Frontiers in Endocrinology. 10, 62(2019).
- Borowsky, R. Determining the sex of adult Astyanax mexicanus. , Cold Spring Harbor Protocols. (2008).
- Paschos, G. Circadian clocks, feeding time, and metabolic homeostasis. Frontiers in Pharmacology. 6, 112(2015).
- Scheiermann, C., Kunisaki, Y., Frenette, P. S. Circadian control of the immune system. Nature Reviews Immunology. 13, 190-198 (2013).
- Williams, M. B., Watts, S. A. Current basis and future directions of zebrafish nutrigenomics. Genes & Nutrition. 14, 34(2009).
- Harper, C., Wolf, J. C. Morphologic effects of the stress response in fish. ILAR Journal. 50, 387-396 (2009).
- Neubauer, P., Andersen, K. H. Thermal performance in fish is explained by an interplay between physiology, behavior and ecology. Conservation Physiology. 7 (1), 025(2019).
- Hinaux, H., et al. Developmental staging table for Astyanax mexicanus. Zebrafish. 8 (4), (2011).
- Borowsky, R. In vitro fertilization of Astyanax mexicanus. , Cold Spring Harbor Protocols. (2008).
- Simon, V., Hyacinthe, C., Rétaux, S. Breeding behavior in the blind Mexican cavefish and its river-dwelling conspecific. PLoS One. 14 (2), 0212591(2019).
- Harvey, B. J., Carolsfield, J. Induced Breeding in Tropical Fish Culture. International Development Research Centre. , (1993).
- Ma, L., Parkhurst, A., Jeffery, W. R. The role of a lens survival pathway including sox2 and aA-crystallin in the evolution of cavefish eye degeneration. EvoDevo. 5, 28(2014).
- Krishnan, J., Rohner, N. Cavefish and the basis for eye loss. Philosophical Transactions of the Royal Society B: Biological Sciences. 5 (372), 20150487(2017).
- Bilandžija, H., Abraham, L., Ma, L., Renner, K., Jeffery, W. R. Behavioral changes controlled by catecholaminergic systems explain recurrent loss of pigmentation in cavefish. Proceedings of the Royal Society. 285, (2018).
- Ma, L., Jeffery, W. R., Essner, J. J., Kowalko, J. E. Genome editing using TALENs in blind Mexican cavefish. PLoS ONE. 1093, 0119370(2015).
- Klaassen, H., Wang, Y., Adamski, K., Rohner, N., Kowalko, J. E. CRISPR mutagenesis confirms the role of oca2 in melanin pigmentation in Astyanax mexicanus. Developmental Biology. 441, 313-318 (2018).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유