È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Variazioni incrementali di temperatura per l'allevamento massimo e la deposizione delle uova in Astyanax mexicanus
In questo articolo
Riepilogo
Questo articolo delinea le condizioni di laboratorio di base e i protocolli per un regime di temperatura incrementale per stimolare la deposizione massima nel tetra Astyanax mexicanus messicano, che è un modello emergente per gli studi di sviluppo ed evolutivi.
Abstract
Il tetra messicano Astyanax mexicanusè un sistema di modelli emergenti per studi sullo sviluppo e l'evoluzione. L'esistenza di superfici oculari (pesci di superficie) e di mormorii di caverne cieche (pesci delle caverne) in questa specie offre l'opportunità di interrogare i meccanismi alla base dell'evoluzione morfologica e comportamentale. I pesci delle caverne hanno sviluppato nuovi tratti costruttivi e regressivi. I cambiamenti costruttivi includono aumenti delle papille gustative e delle mascelle, organi sensoriali della linea laterale e grasso corporeo. I cambiamenti regressivi includono perdita o riduzione degli occhi. pigmentazione della melanina, comportamento scolastico, aggressività e sonno. Per interrogare sperimentalmente questi cambiamenti, è fondamentale ottenere un gran numero di embrioni generati. Da quando i pesci di superficie e i pesci delle caverne originali di A. mexicanus sono stati raccolti in Texas e Messico negli anni '90, i loro discendenti sono stati regolarmente stimolati a riprodursi e generare un gran numero di embrioni bimestà nel laboratorio di Jeffery. Sebbene l'allevamento sia controllato dall'abbondanza e dalla qualità degli alimenti, dai cicli luce-oscurità e dalla temperatura, abbiamo scoperto che i cambiamenti incrementali di temperatura svolgono un ruolo chiave nello stimolare la deposizione massima delle uova. Il graduale aumento della temperatura da 72 ° F a 78 ° F nei primi tre giorni di una settimana riproduttiva fornisce due-tre giorni consecutivi di deposizione delle uova con il numero massimo di embrioni di alta qualità, che viene poi seguito da una graduale diminuzione della temperatura da 78 ° F a 72 ° F durante gli ultimi tre giorni della settimana di deposizione delle uova. Le procedure mostrate in questo video delineano il flusso di lavoro prima e durante una settimana di allevamento in laboratorio per la deposizione delle uova stimolata dalla temperatura incrementale.
Introduzione
Il teleost Astyanax mexicanus ha una forma di superficie con gli occhi (pesci di superficie) e molte diverse abitazioni cieche (pesci delle caverne)formano 1,2. I pesci delle caverne si sono evoluti nell'oscurità perpetua e sotto i limiti alimentari, con conseguente comparsa di nuovi tratti costruttivi e regressivi3. I tratti costruttivi includono aumenti delle papille gustative e delle dimensioni della mascella, organi sensoriali della linea laterale e riserve di grasso. I tratti regressivi includono la perdita o la riduzione della pigmentazione della melanina, degli occhi e dei comportamenti, come sonno, scolarizzazione e aggressività. Un attributo del sistema Astyanax è la completa fertilità tra le due forme, consentendo l'uso della mappatura quantitativa dei loci dei trati (QTL) per determinare le regioni genomiche associate all'evoluzione costruttiva e regressiva4,5,6,7. A. mexicanus offre un sistema vantaggioso per studiare lo sviluppo perché può essere indotto a deporre frequentemente le uova in laboratorio. Gli embrioni di A. mexicanus sono traslucidi, leggermente più grandi di quelli di zebrafish, prodotti in grandi quantità, e si sviluppano in adulti sessualmente maturi in circa 8-12 mesi. Il loro periodo di massima capacità di deposizione delle uova è di circa 5 anni. Questo protocollo descrive il flusso di lavoro necessario in una struttura di coltura A. mexicanus durante una tipica settimana di riproduzione e include i dettagli della manutenzione del sistema ittico e il regime di controllo della temperatura per la deposizione massima delle uova.
A. mexicanus è un pesce tropicale che vive in fiumi originari di altipiani calcarei (pesci di superficie) e in piscine in grotte calcaree (pesci delle caverne)8. Il calcare si dissolve per produrre acqua dura e A. mexicanus prospera in acqua dura. I pesci adattati alle condizioni dell'acqua dura possono tollerare una serie di condizioni salate, ma generalmente si riproducono inquelli specifici 9. L'induzione del comportamento di deposizione delle uova è ottenuta da una combinazione di fattori. Poiché i pesci sono a sangue freddo e si affidano al loro ambiente per mantenere l'omeostasi, il loro metabolismo è sensibile ai cambiamenti ambientali e reagiscono più rapidamente aglistressanti 10. A. mexicanus deve essere coltivato in sistemi acquatici in condizioni attentamente regolate di flusso d'acqua, pH, conducibilità, pressione osmotica, illuminazione e temperature dell'acqua.
Nel laboratorio Jeffery, i pesci sono mantenuti in due sistemi di acqua corrente: (1) un "sistema per bambini" per giovani pesci adulti prima della maturità sessuale e (2) un sistema adulto (o principale) per adulti sessualmente maturi e riproduttori. Il "sistema baby" è costituito da serbatoi da 8 L e 15 L forniti con acqua corrente. Il "sistema bambino" viene seminato da avannotti e giovani giovani metamorfosi coltivati da larve in serbatoi più piccoli (1-10 L), in cui l'acqua viene scambiata settimanalmente. Larve, avannotti e giovani sono estremamente dipendenti dal cibo e devono essere nutriti con cibo vivo (gamberetti salati) una volta al giorno per garantire un alto tasso di sopravvivenza. I giovani giovani del "sistema bambino" vengono inseriti nel sistema degli adulti dopo circa 1-1,5 anni. All'inizio, vengono alimentati tetra flakes polverizzati e, dopo un'ulteriore crescita, vengono trasferiti al normale regime di alimentazione degli adulti. La maturità sessuale può essere valutata dal volume addominale nelle femmine e i metodi per determinare il sesso sono statidescritti 11. Nel sistema per adulti, l'acqua viene scambiata automaticamente in serbatoi da 42 L 3 volte per un periodo di 24 ore. Il sistema per adulti viene monitorato quotidianamente mediante ispezione visiva e letture automatiche di temperatura, pH e conducibilità dalle sonde. Il pH ottimale è di circa 7,4 e può variare tra 6,8-7,5, la temperatura di base del sistema è di 72/73 ° F e la conduttività ideale varia tra 600-800 mS. Le letture automatiche vengono visualizzate sullo schermo di un controller e i controlli visivi della pressione dell'acqua vengono letti ai misuratori di portata distribuiti in tutto il sistema. Controlli indipendenti sulla qualità dell'acqua vengono effettuati settimanalmente testando la temperatura e misurando i parametri di qualità dell'acqua per pH, ammoniaca e nitrato utilizzando un test colorimetrico. I livelli di ammoniaca e nitrati sono mantenuti a zero o vicini allo zero aggiungendo batteri benefici (ad esempio, ciclo nutafin) al sistema. L'illuminazione della stanza è controllata da un timer regolato su una luce di 14 ore e periodi di buio di 10 ore. Oltre ai parametri generali di qualità dell'acqua sopra menzionati, le seguenti considerazioni necessitano di particolare attenzione durante una settimana di riproduzione.
La prima considerazione è il fotoperiodo, poiché i pesci (anche i pesci delle caverne in laboratorio) dipendono dai cicli di luce per impostare il loro orologio circadiano. I ritmi circadiani possono influenzare tutto, dall'allevamento e dall'alimentazione alla salute del sistemaimmunitario 12,13 e devono essere coerenti per i massimi benefici per la salute. I pesci sono mantenuti in un sistema di acqua corrente con una luce di 14 ore e un fotoperiodo scuro di 10 ore. I pesci di superficie generalmente iniziano a deporre le uova un'ora dopo che il sistema è stato oscurato e la luce introdotta durante questo periodo può interferire e terminare la deposizione delle uova. La deposizione delle uova dei pesci delle caverne ciechi è meno disturbata dalla luce. Rispetto alla deposizione delle uova dei pesci di superficie, la deposizione delle uova dei pesci delle caverne è ritardata, di solito iniziando da quattro a cinque ore dopo che il sistema è stato oscurato.
La seconda considerazione è l'alimentazione. I pesci adulti vengono normalmente nutriti con una dieta di tetra flakes una volta al giorno. Prima della deposizione delle uova, i pesci vengono nutriti con una dieta ricca di proteine integrata con quantità extra di tetra flakes e altri alimenti: fiocchi di tuorlo d'uovo e vermi neri della California occasionalmente viventi (Lumbriculus variegatus) per compensare la perdita di proteine dovuta alla produzione di uova durante il precedente ciclo di deposizione delle uova. Durante la settimana di riproduzione, i pesci vengono nutriti due volte al giorno, una volta al mattino e di nuovo al pomeriggio / sera. Il pesce che si nutre solo una volta al giorno ma con una singola porzione molto grande di cibo dovrebbe essere evitato, in quanto ciò può causaremalnutrizione 14.
La terza considerazione è lo spazio. I requisiti di spazio si basano sulla massa corporea media di un adulto e su considerazioni comportamentali, ad esempio se i pesci hanno un comportamento scolastico o un comportamento aggressivo. Serbatoi sopra o sotto-affollamento possono portare a un'aggressività accresciuta e a uno stress costante, rendendo i pesci vulnerabili alle lesioni dei loro compagni di serbatoio e riluttanti a partecipare alla deposizionedelle uova 15. In genere ospitamo 10-20 pesci per serbatoio da 42 L.
La quarta considerazione è la temperatura. Come accennato in precedenza, i pesci sono animali a sangue freddo e si affidano all'ambiente per mantenere la temperatura corporea. Poiché la temperatura ha un effetto diretto sui processi metabolici, i cambiamenti di temperatura possono innescare alterazioni comportamentali neipesci 16. Questo programma di allevamento consiste in cicli di temperatura di due settimane: la prima settimana introduce un picco di temperatura a 78 ° F e la settimana successiva mantiene una temperatura statica di 72 ° F. Durante la prima settimana (riproduttiva), le reti da riproduzione bordate di plastica vengono posizionate sul fondo dei serbatoi ogni sera. Le reti da riproduzione fungono da barriera tra il pesce nei serbatoi e le uova deponete, che altrimenti sarebbero consumate. La temperatura viene innalzata di 2 ° F al giorno a un massimo di 78 ° F entro metà settimana e la deposizione delle uova è indotta in base al ciclo della luce nelle prime 2-3 serate di questa settimana. La temperatura viene quindi abbassata di 2 ° F incrementi a 72 ° F durante i restanti giorni della settimana e la temperatura di base viene mantenuta fino all'inizio della prossima settimana riproduttiva. L'allevamento viene solitamente stimolato non più di due volte al mese per consentire al pesce di riprendersi.
Nel complesso, questo metodo consente la deposizione delle uova di grandi quantità di embrioni di altissima qualità per un periodo di tempo più lungo.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Questa procedura è stata approvata dalle linee guida istituzionali per la cura degli animali dell'Università del Maryland, College Park (attualmente IACUC 469 #R-NOV-18-59; Progetto 1241065-1).
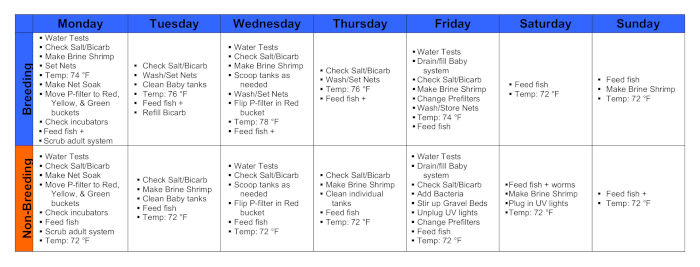
Figura 1. Calendari durante una settimana di riproduzione e una settimana non riproduttiva. Clicca qui per visualizzare una versione più grande di questa figura.
1. Lunedì
- Alle 9-10 del mattino, eseguire test dell'acqua e passaggi 1.1.1-4 di seguito.
- Registrare le temperature della stanza, del serbatoio e del serbatoio utilizzando un termometro.
- Registrare i livelli di ammoniaca, nitrato e nitrato con un kit di test colorimetrico.
- Registrare il pH dal sistema di monitoraggio e dal kit di test colorimetrico.
- Registrare la conducibilità dal monitor del carboy e dal monitor del sistema principale.
- A partire dalle 10:00, dai da mangiare a tutti i pesci.
- Nutrire tutti i pesci nel sistema per adulti con tetra flakes, schiacciando i fiocchi nelle vasche con pesci giovani. Nutrire solo tanti fiocchi quanti un serbatoio di pesce può consumare completamente in 3-5 minuti, circa un "pizzico dito".
- Controllare l'incubatore utilizzato per ospitare fingerbowls di embrioni in via di sviluppo e cambiare l'acqua se necessario.
- Aprire l'incubatore di embrioni e controllare i livelli dell'acqua in tutti i serbatoi. Se si stanno esaurendo sull'acqua, aggiungere acqua di sistema. Controllare le impostazioni della temperatura dell'incubatore. Allevare embrioni a 73-77 °F (23-25 °C).
- Pulire il feed vivo.
- Per pulire i blackworms, rimuovere i bacini Tupperware scoperti contenenti le loro colture dal frigorifero del mangime vivo e versare l'acqua in eccesso sopra i grappoli di vermi nel lavandino. Utilizzando acqua distillata, sospendere e risciacquare ripetutamente i vermi fino a quando l'acqua di versamento non è limpida.
- Aggiungere abbastanza acqua pulita in modo che i cluster di vermi siano circa la metà coperti. Sostituire i vermi rimanenti nel frigorifero del mangime vivo, scoperto.
- Dai da mangiare ai pesci.
- Almeno 30 minuti dopo la prima alimentazione, nutrire i pesci nei serbatoi in cui si desidera l'allevamento con fiocchi di tuorlo d'uovo, vermi neri o entrambi. Aggiungere una "punta di dito" di scaglie di tuorlo per serbatoio. Aggiungere abbastanza grappoli di blackworm per consentire a ogni pesce nel serbatoio di consumare circa 5-10 vermi.
- Alle 10:00 alle 13:00, impostare la temperatura dell'acqua a 74 ° F.
- Strofinare i serbatoi di riproduzione in base alle esigenze e impostare le reti da riproduzione.
- Pulire i serbatoi e posizionare le reti almeno un'ora dopo l'ultima alimentazione. Pulire tutti i serbatoi in cui sono posizionate le reti in anticipo. Impostare le reti da riproduzione con attenzione in modo da non interferire con l'alimentazione dell'aria al serbatoio.
2. Martedì
- Raccogliere gli embrioni e lavare tutte le reti da riproduzione.
- Alle 9-10 del mattino, rimuovere le reti da riproduzione dal fondo dei serbatoi del sistema per adulti. Risciacquare delicatamente gli embrioni in una rete strettae usando il tubo attaccato al carboy e invertire la rete stretta a mano in una fingerbowl di acqua pulita del sistema per espellere gli embrioni.
- Raccogliere e lavare ogni set di embrioni, quindi mettere in una fingerbowl di acqua pulita del sistema contenente lo 0,00003% blu di metilene (acqua blu). Se c'è un numero eccezionalmente grande di embrioni da un singolo serbatoio, separali in più ciotole. La concentrazione di embrioni viventi dovrebbe essere di circa 100 per 200 mL di acqua blu in ogni fingerbowl.
- Stimare il tempo di fecondazione mettendo in scena gli embrioni al microscopio utilizzando la tabella17dello sviluppo A. mexicanus pubblicata.
- Monitorare frequentemente le fingerbowl contenenti embrioni. Rimuovere embrioni e detriti morti o deformati, come cibo non consumato o feci, con una pipetta Pasteur. Cambiare frequentemente l'acqua blu nei fingerbowl.
- Posizionare i fingerbowl in un'incubatrice per 5-7 giorni. In questo momento, il tuorlo è stato utilizzato e nutrire le colture con gamberetti salamoia viventi è necessario per un ulteriore sviluppo.
- Prendi i dati di deposizione delle uova.
- Per ogni serbatoio che rilascia embrioni, registrare le seguenti informazioni.
- Registrare la data e il numero del serbatoio.
- Registrare il numero approssimativo di embrioni caduti (Figura 2):
Alto (500+)
Medio (200-500)
Basso (<200) - Registrare la qualità degli embrioni eliminati (Figura 2):
Alto (>75% vivo)
Medio (25-50% vivo)
Basso (<25% vivo) - Stimare il tempo di deposizione delle uova originale consultando la tabella di sosta Astyanax mexicanus 17.
- Registrare la temperatura impostata dal sistema al momento della deposizione delle uova dei pesci.
- Per ogni serbatoio che rilascia embrioni, registrare le seguenti informazioni.
- Dai da mangiare a tutti i pesci.
- Impostare la temperatura dell'acqua a 76 °F.
- Preparare il feed dal vivo.
- Dai da mangiare ai pesci #2.
- Raccogliere cibo in eccesso e detriti da serbatoi e pulire prima di ripristinare le reti.
3. Mercoledì
- Ripetere i passaggi da 2.1 a 2.2. Raccogliere embrioni e lavare tutte le reti da riproduzione.
- Prendi i dati di deposizione delle uova come prima.
- Eseguire test dell'acqua come prima.
- Dai da mangiare a tutti i pesci.
- Impostare la temperatura dell'acqua a 78 °F.
- Prepara il feed dal vivo.
- Controlla gli embrioni nell'incubatrice.
- Pulire e cambiare l'acqua degli embrioni in fingerbowl che alla fine saranno utilizzati per ricostituire il patrimonio riproduttivo generale degli adulti. Utilizzare acqua di sistema trattata con blu di metilene.
- Dai di nuovo da mangiare ai pesci.
- Pulire i serbatoi in base alle esigenze e ripristinare le reti.
4. Giovedì
- Ripetere i passaggi da 2.1 a 2.2. Raccogliere embrioni e lavare e conservare le reti da riproduzione.
- Prendi i dati di deposizione delle uova come prima.
- Impostare la temperatura dell'acqua a 76 ° F.
- Pulire il feed dal vivo.
- Pulire tutti i singoli serbatoi.
- Controlla gli embrioni nell'incubatrice.
- Dai da mangiare ai pesci #2.
5. Venerdì
- Dai da mangiare a tutti i pesci.
- Impostare la temperatura dell'acqua a 74 °F.
- Pulire il feed dal vivo.
- Controlla gli embrioni nell'incubatrice.
6. Sabato
- Dai da mangiare ai pesci.
7. Domenica
- Dai da mangiare ai pesci.
Access restricted. Please log in or start a trial to view this content.
Risultati
Generalmente alleviamo e devasiamo i discendenti di pesci di superficie originariamente raccolti a Nacimiento del Rio Choy a San Luis Potosi, Messico (pesce di superficie di Rio Choy) e San Solomon Springs nel Balmorhea State Park, Texas (pesce di superficie del Texas) e pesci delle caverne derivati da Cueva de El Pachón (pesce grotta di Pachón) a Tamaulipas, Messico, e Cueva de los Sabinos (pesce delle caverne di Los Sabinos) e Sotano de la Tinaja (pesce delle caverne di Tinaja) a San Luis Potosi Messico.
Access restricted. Please log in or start a trial to view this content.
Discussione
Astyanax mexicanus è un nuovo modello biologico che si genera frequentemente e può essere allevato facilmente nel laboratorio1,2. Poiché siamo interessati ai meccanismi di sviluppo che sono alla base dei cambiamenti evolutivi nel pesce delle caverne A. mexicanus, la produzione e l'uso di embrioni è vitale per i nostri obiettivi di ricerca. Lo scopo principale del mantenimento di uno stock adulto di pesce è la produzione di embrioni e giovan...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo David Martasian, Diedre Heyser, Amy Parkhurst, Craig Foote e Mandy Ng per i preziosi contributi al laboratorio Jeffery A. mexicanus culture facility. La ricerca nel laboratorio Jeffery è attualmente supportata dalla sovvenzione NIH EY024941.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Blackworms | Eastern Aquatics, Lancaster, PA | None | |
| Breeding Nets | Custom made | ||
| Brine shrimp eggs | AquaCave Lake Forest, IL. | None | |
| Colorimetric test kit | Petco | SKU:11916 | API Freshwater pH Test Kit |
| Egg yolk flakes | Pentair, Minneapolis, MN | None | |
| Fingerbowls | Carolina Biological Supply | 741004 | Culture dishes, 4.5 in, 250 mL |
| Hand held nets | Any Pet Store | ||
| Incubator for embryos | Fisher Scientific | 51-029-321HPM | 405 L |
| Instant Ocean sea salts | Spectrum Brands, Blacksburg, VA | None | |
| Methylene Blue | Sigma-Aldrich, St. Louis, MO | M9140 | |
| Pasteur Pipettes | Fisher Scientific | 13-678-20 | 5.75 in. |
| Net soaking solution | Any Pet Store | ||
| Nutrafin Cycle | Amazon | None | Bacterial boost |
| Refrigerator for live feed | Any source | ||
| Stereomicroscope | Any source | ||
| Thermometer | Any source | ||
| Tetra Tropical Crisps | Spectrum Brands, Blacksburg, VA | None |
Riferimenti
- Jeffery, W. R. Cavefish as a model system in evolutionary developmental biology. Developmental Biology. 231, 1-12 (2001).
- Jeffery, W. R. Emerging model systems in evo-devo: cavefish and mechanisms of microevolution. Evolution & Development. 10, 265-272 (2008).
- Jeffery, W. R. Evolution and development in the cavefish Astyanax. Current Topics in Developmental Biology. 86, 191-221 (2009).
- Protas, M. E., et al. Genetic analysis of cavefish reveals molecular convergence in the evolution of albinism. Nature Genetics. 38, 107-111 (2006).
- Protas, M., Conrad, M., Gross, J. B., Tabin, C. J., Borowsky, R. Regressive evolution in the Mexican cave tetra, Astyanax mexicanus. Current Biology. 17, 452-454 (2007).
- O'Quin, K. E., Yoshizawa, M., Doshi, P., Jeffery, W. R. Quantitative genetic analysis of retinal degeneration in the blind cavefish. PLoS ONE. 8 (2), 57281(2013).
- Yoshizawa, M., et al. Distinct genetic architecture underlies the emergence of sleep loss and prey-seeking behavior in the Mexican cavefish. BMC Biology. 13, 15(2015).
- Elliot, W. R. The Astyanax caves of Mexico. Cavefishes of Tamaulipas, San Luis Potosi, and Guerrero. Association for Mexican Cave Studies Bulletin. 26, 1(2018).
- Luo, S., Wu, B., Xiong, X., Wang, J. Effects of total hardness and calcium:magnesium ratio of water during early stages of rare minnows (Gobiocypris rarus). Comparative Medicine. 66, 181-187 (2016).
- Balasch, J. C., Tort, L. Netting the stress responses in fish. Frontiers in Endocrinology. 10, 62(2019).
- Borowsky, R. Determining the sex of adult Astyanax mexicanus. , Cold Spring Harbor Protocols. (2008).
- Paschos, G. Circadian clocks, feeding time, and metabolic homeostasis. Frontiers in Pharmacology. 6, 112(2015).
- Scheiermann, C., Kunisaki, Y., Frenette, P. S. Circadian control of the immune system. Nature Reviews Immunology. 13, 190-198 (2013).
- Williams, M. B., Watts, S. A. Current basis and future directions of zebrafish nutrigenomics. Genes & Nutrition. 14, 34(2009).
- Harper, C., Wolf, J. C. Morphologic effects of the stress response in fish. ILAR Journal. 50, 387-396 (2009).
- Neubauer, P., Andersen, K. H. Thermal performance in fish is explained by an interplay between physiology, behavior and ecology. Conservation Physiology. 7 (1), 025(2019).
- Hinaux, H., et al. Developmental staging table for Astyanax mexicanus. Zebrafish. 8 (4), (2011).
- Borowsky, R. In vitro fertilization of Astyanax mexicanus. , Cold Spring Harbor Protocols. (2008).
- Simon, V., Hyacinthe, C., Rétaux, S. Breeding behavior in the blind Mexican cavefish and its river-dwelling conspecific. PLoS One. 14 (2), 0212591(2019).
- Harvey, B. J., Carolsfield, J. Induced Breeding in Tropical Fish Culture. International Development Research Centre. , (1993).
- Ma, L., Parkhurst, A., Jeffery, W. R. The role of a lens survival pathway including sox2 and aA-crystallin in the evolution of cavefish eye degeneration. EvoDevo. 5, 28(2014).
- Krishnan, J., Rohner, N. Cavefish and the basis for eye loss. Philosophical Transactions of the Royal Society B: Biological Sciences. 5 (372), 20150487(2017).
- Bilandžija, H., Abraham, L., Ma, L., Renner, K., Jeffery, W. R. Behavioral changes controlled by catecholaminergic systems explain recurrent loss of pigmentation in cavefish. Proceedings of the Royal Society. 285, (2018).
- Ma, L., Jeffery, W. R., Essner, J. J., Kowalko, J. E. Genome editing using TALENs in blind Mexican cavefish. PLoS ONE. 1093, 0119370(2015).
- Klaassen, H., Wang, Y., Adamski, K., Rohner, N., Kowalko, J. E. CRISPR mutagenesis confirms the role of oca2 in melanin pigmentation in Astyanax mexicanus. Developmental Biology. 441, 313-318 (2018).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon