A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שינויי טמפרטורה מצטברים לרבייה מקסימלית והשריצה באסטיאנקס מקסיקו
In This Article
Summary
מאמר זה מתאר את תנאי המעבדה הבסיסיים ואת הפרוטוקולים למשטר טמפרטורה מצטבר כדי לעורר השרצה מקסימלית במקסיקו tetra Astyanax mexicanus, שהוא מודל מתפתח למחקרים התפתחותיים ואבולוציוניים.
Abstract
הטטרה המקסיקנית, אסטיאנקס מקסיקניוס, היא מערכת מודלים מתפתחת למחקרים בפיתוח ובאבולוציה. קיומם של משטח עיניים (דגי קרקע) ומערה עיוורת (דגי מערה) במין זה מהווה הזדמנות לחקור את המנגנונים שבבסיס האבולוציה המורפולוגית וההתנהגותית. דגי מערה פיתחו תכונות קונסטרוקטיביות ורגרסיביות חדשניות. השינויים הקונסטרוקטיביים כוללים עליות בלוטות הטעם והלסתות, איברי חישה קו לרוחב, ושומן הגוף. השינויים הרגרסיביים כוללים אובדן או הפחתת עיניים. פיגמנטציה מלנין, התנהגות חינוך, תוקפנות, ושינה. כדי לחקור שינויים אלה באופן ניסיוני, חיוני להשיג מספר רב של עוברים הולידו. מאז שדגי פני השטח ודגי המערה המקוריים של א. מקסיקו נאספו בטקסס ובמקסיקו בשנות התשעים, צאצאיהם מגורים באופן שגרתי להתרבות ולהוליד מספר רב של עוברים במעבדת ג'פרי. למרות הרבייה נשלטת על ידי שפע מזון ואיכות, מחזורים כהים בהירים, וטמפרטורה, מצאנו כי שינויי טמפרטורה מצטברים לשחק תפקיד מפתח בגירוי השרצה מקסימלית. העלייה ההדרגתית בטמפרטורה מ-72 מעלות צלזיוס ל-78 מעלות צלזיוס בשלושת הימים הראשונים של שבוע הרבייה מספקת שניים-שלושה ימי השרצה רצופים עם מספר מרבי של עוברים איכותיים, ולאחר מכן ירידה הדרגתית בטמפרטורה מ-78 מעלות צלזיוס ל-72 מעלות צלזיוס בשלושת הימים האחרונים של שבוע ההשרצה. ההליכים המוצגים בסרטון זה מתארים את זרימת העבודה לפני ובמהלך שבוע רבייה במעבדה עבור הצטברות טמפרטורה מגורה השרצה.
Introduction
למקסיקנים של הטלוסט אסטיאנקס יש צורת שטח (דגי שטח) עם עיניים, ורבים ושונים של מערות עיוורות שוכנות (דגי מערות) צורות1,2. דגי המערה התפתחו בחשיכה מתמדת ותחת מגבלות מזון, וכתוצאה מכך הופיעו תכונות קונסטרוקטיביות ורגרסיביותחדשניות 3. התכונות הקונסטרוקטיביות כוללות עליות בלוטות הטעם וגודל הלסת, איברי חישה של הקו לרוחב, עתודות שומן. התכונות הרגרסיביות כוללות אובדן או הפחתה של פיגמנטציה מלנין, עיניים, והתנהגויות, כגון שינה, חינוך, ותוקפנות. תכונה של מערכת Astyanax היא פוריות מלאה בין שתי הצורות, המאפשרת שימוש במיפוי לוקוסים של תכונות כמותיות (QTL) כדי לקבוע את האזורים הגנומיים הקשורים לאבולוציה בונה ורגרסיבית4,5,6,7. א. מקסיקניוס מציע מערכת יתרון ללמוד פיתוח כי זה יכול להיות המושרה להשריץ לעתים קרובות במעבדה. העוברים של א. מקסיקו הם שקופים, מעט גדולים יותר מאלה של דגי זברה, המיוצרים בכמויות גדולות, ומתפתחים למבוגרים בוגרים מינית בתוך כ 8-12 חודשים. תקופת יכולת ההשרצה המקסימלית שלהם היא כ-5 שנים. פרוטוקול זה מתאר את זרימת העבודה הדרושה במתקן תרבות A. mexicanus במהלך שבוע רבייה טיפוסי וכולל את הפרטים של תחזוקת מערכת הדגים ואת משטר בקרת הטמפרטורה להשרצה מקסימלית.
א. מקסיקני הוא דג טרופי החי בנהרות שמקורם במישורי אבן גיר (דגי קרקע) ובבריכות במערות גיר (דגי מערות)8. אבן גיר מתמוססת כדי לייצר מים קשים, ו- A. mexicanus משגשג במים קשים. דגים המותאמים לתנאי מים קשים יכולים לסבול מגוון של תנאים מלוחים, אבל בדרך כלל להתרבות אלה ספציפיים9. אינדוקציה של התנהגות השרצה מושגת על ידי שילוב של גורמים. בגלל דגים הם בדם קר להסתמך על הסביבה שלהם כדי לשמור על הומאוסטזיס, חילוף החומרים שלהם רגיש לשינויים סביבתיים והם מגיבים מהר יותר לחצים10. א. מקסיקני צריך להיות מתורבת במערכות מימיות בתנאים מוסדרים בקפידה של זרימת מים, pH, מוליכות, לחץ אוסמוטי, תאורה וטמפרטורות מים.
במעבדת ג'פרי, דגים מתוחזקים בשתי מערכות מים זורמים: (1) "מערכת תינוקות" לדגים צעירים לפני בגרות מינית ו-(2) מערכת למבוגרים (או עיקריים) למבוגרים בוגרים מבחינה מינית. "מערכת התינוק" מורכבת ממיכלי 8 L ו-15 ליטר המסופקים עם מים זורמים. "מערכת התינוקות" נזרעת על ידי קטינים מטמורפוזים צעירים הגדלים מזחלים במיכלים קטנים יותר (1-10 ליטר), שבהם מוחלפים מים מדי שבוע. זחלים, מטגנים וצעירים תלויים מאוד במזון ויש להאכילם במזון חי (שרימפס מלח) פעם ביום כדי להבטיח שיעור הישרדות גבוה. צעירים מ"מערכת התינוקות" מוצבים במערכת הבוגרת לאחר כשנה וחצי. בהתחלה, הם ניזונים פתיתי טטרה מרוסקים, ולאחר צמיחה נוספת הם מועברים למשטר האכלה למבוגרים רגילים. בגרות מינית ניתן להעריך על ידי נפח הבטן אצל נקבות, ושיטות לקביעת מין תוארו11. במערכת הבוגרת, מים מוחלף באופן אוטומטי 42 L מיכלים 3 פעמים לכל תקופה של 24 שעות. המערכת הבוגרת מנוטרת מדי יום על ידי בדיקה חזותית וטמפרטורה אוטומטית, קריאת pH ומוליכות מבדיקות. רמת ה- pH האופטימלית היא בסביבות 7.4 ויכולה לנוע בין 6.8-7.5, טמפרטורת הבסיס של המערכת היא 72/73 °F, ואת המוליכות האידיאלית נע בין 600-800 מ"ר. קריאות אוטומטיות מוצגות על מסך בקר, ובדיקות חזותיות של לחץ מים נקראים במוני זרימה המופצים ברחבי המערכת. בדיקות עצמאיות על איכות המים נעשות מדי שבוע על ידי בדיקת טמפרטורה ומדידת פרמטרים של איכות המים עבור pH, אמוניה וחנקה באמצעות בדיקה צבעונית. רמות האמוניה והחנקן נשמרות באפס או קרוב לו על ידי הוספת חיידקים מועילים (למשל, מחזור נוטפין) למערכת. תאורת החדר נשלטת על ידי טיימר המותאם לאור של 14 שעות ולתקופות חשוכות של 10 שעות. בנוסף לפרמטרים הכוללים של איכות המים שהוזכרו לעיל, השיקולים הבאים זקוקים לתשומת לב מיוחדת במהלך שבוע רבייה.
השיקול הראשון הוא photoperiod, כמו דגים (אפילו דגי מערה במעבדה) תלויים מחזורי אור כדי להגדיר את השעון הביולוגי שלהם. מקצבים צירקדיים יכולים להשפיע על כל דבר, החל רבייה והאכלה לבריאות המערכת החיסונית12,13 וחייב להיות עקבי עבור יתרונות בריאותיים מקסימליים. דגים נשמרים במערכת מים זורמים על אור 14 שעות ו 10 שעות כהה photoperiod. דגי פני השטח מתחילים בדרך כלל להשריץ שעה לאחר שהמערכת הוחשכה, ואור שהוצג בתקופה זו יכול להפריע ולהפסיק להשריץ. ההשרצה של דגי מערה עיוורים מופרעת פחות על ידי אור. בהשוואה להשרצת דגי קרקע, ההשרצה של דגי המערה מתעכבת, בדרך כלל מתחילה ארבע עד חמש שעות לאחר שהמערכת הוחשכה.
השיקול השני הוא תזונה. דגים בוגרים ניזונים בדרך כלל דיאטה של פתיתי טטרה פעם ביום. לפני ההשרצה, דגים ניזונים מתזונה עשירה בחלבון בתוספת כמויות נוספות של פתיתי טטרה ומזון אחר: פתיתי חלמון ביצה ומדי פעם תולעים שחורות חיות בקליפורניה (Lumbriculus variegatus) כדי לפצות על אובדן חלבון עקב ייצור ביצים במהלך מחזור ההשרצה הקודם. במהלך שבוע הרבייה, דגים ניזונים פעמיים ביום, פעם בבוקר ושוב אחר הצהריים / ערב. דגים להאכיל רק פעם ביום אבל עם חלק אחד גדול מאוד של מזון יש להימנע, כמו זה יכול לגרום תת תזונה14.
השיקול השלישי הוא החלל. דרישות החלל מבוססות על מסת הגוף הממוצעת של מבוגר, כמו גם שיקולים התנהגותיים, כגון האם לדגים יש התנהגות לימודית או התנהגות אגרסיבית. טנקים מעל או מתחת לצפיפות עלולים להוביל לתוקפנות מוגברת וללחץ מתמיד, מה שהופך דגים לפגיעים לפציעה של חבריהם לטנקים ואינם ששים להשתתף בהשרצה15. אנחנו בדרך כלל בית 10-20 דגים לכל מיכל 42 L.
השיקול הרביעי הוא הטמפרטורה. כפי שהוזכר לעיל, דגים הם בעלי חיים בדם קר להסתמך על הסביבה כדי לשמור על טמפרטורת הגוף. מכיוון שלטמפרטורה יש השפעה ישירה על תהליכים מטבוליים, שינויים בטמפרטורה יכולים לגרום לשינויים התנהגותיים בדגים16. תוכנית רבייה זו מורכבת ממחזורים של שבועיים בטמפרטורה: השבוע הראשון מציג עלייה בטמפרטורה ל 78 °F, והשבוע הבא שומר על טמפרטורה סטטית של 72 °F. במהלך השבוע הראשון (הרבייה), רשתות רבייה עם קצוות פלסטיק ממוקמות בתחתית המיכלים בכל ערב. רשתות הרבייה משמשות מחסום בין הדגים במיכלים לבין הביצים המושרות, שאחרת היו נצרכות. הטמפרטורה עולה ב 2 °F ליום למקסימום של 78 °F עד אמצע השבוע, ואת ההשרצה הוא המושרה על פי מחזור האור הראשון 2-3 ערבים של השבוע. הטמפרטורה יורדת לאחר מכן במרווחים של 2 מעלות צלזיוס ל-72 מעלות צלזיוס בימים הנותרים של השבוע, וטמפרטורת הבסיס נשמרת עד לתחילת שבוע הרבייה הבא. הרבייה מגורה בדרך כלל לא יותר מפעמיים בחודש כדי לאפשר לדגים זמן להתאושש.
בסך הכל, שיטה זו מאפשרת להשריץ כמויות גדולות של עוברים באיכות הגבוהה ביותר על פני תקופה ארוכה יותר של זמן.
Access restricted. Please log in or start a trial to view this content.
Protocol
הליך זה אושר על ידי הנחיות טיפול בבעלי חיים מוסדיים של אוניברסיטת מרילנד, קולג 'פארק (כיום IACUC 469 #R-NOV-18-59; פרוייקט 1241065-1).
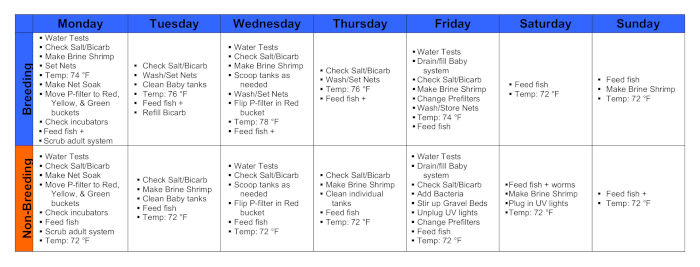
איור 1. לוחות שנה במהלך שבוע רבייה ושבוע ללא רבייה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
1. יום שני
- בין השעות 09:10-10:00, בצע בדיקות מים וצעדים 1.1.1-4 להלן.
- רשום את טמפרטורות החדר, המיכל והמאגר באמצעות מדחום.
- רשום את רמות האמוניה, החנקן והחנקה באמצעות ערכת בדיקה צבעונית.
- רשום את ה- pH ממערכת הניטור כמו גם את ערכת הבדיקה הצבעונית.
- הקלט את המוליכות מצג הקרבוי ומצג המערכת הראשי.
- החל מה-10 בבוקר, להאכיל את כל הדגים.
- להאכיל את כל הדגים במערכת הבוגרת עם פתיתי טטרה, מוחץ את הפתיתים במיכלים עם דגים צעירים. להאכיל רק פתיתים רבים כמו מיכל של דגים יכול לצרוך לחלוטין בתוך 3-5 דקות, על "קמצוץ אצבע".
- בדוק את האינקובטור המשמש לאכלס את האצבעות של עוברים מתפתחים ולשנות את המים במידת הצורך.
- פתח את חממת העובר ובדוק את מפלס המים בכל המאגרים. אם הם אוזלים על מים, להוסיף מים במערכת. בדוק את הגדרות טמפרטורת החממה. לגדל עוברים ב 73-77 °F (23-25 מעלות צלזיוס).
- נקה שידור חי.
- כדי לנקות את התולעים השחורות, הסירו את אגני טאפרוור שנחשפו המכילים את תרביותיהם מהמקרר בשידור חי ושפכו את המים העודפים מעל אשכולות התולעת לתוך הכיור. באמצעות מים מזוקקים, להשעות ולשטוף את התולעים שוב ושוב עד המים לשפוך את הוא ברור.
- מוסיפים מספיק מים נקיים כדי שאשכולות התולעת יהיו מכוסים בערך למחצה. החלף את התולעים הנותרות במקרר בשידור חי, חשופות.
- להאכיל דגים.
- לפחות 30 דקות לאחר האכלה הראשונה, להאכיל דגים במיכלים שבהם הרבייה רצויה עם פתיתי חלמון ביצה, תולעים שחורות, או שניהם. מוסיפים "אצבע" של פתיתי חלמון לכל מיכל. מוסיפים מספיק אשכולות תולעים שחורות כדי לאפשר לכל דג במיכל לצרוך כ-5-10 תולעים.
- בשעה 10:00-13:00, קבעו את טמפרטורת המים ל-74 מעלות צלזיוס.
- לשפשף את מיכלי הרבייה לפי הצורך ולהגדיר את רשתות הרבייה.
- נקו את המיכלים והניחו את הרשתות לפחות שעה לאחר ההאכלה האחרונה. נקה את כל הטנקים שהרשתות ממוקמות מראש. הגדר רשתות רבייה בזהירות כדי לא להפריע לאספקת האוויר למיכל.
2. יום שלישי
- לאסוף את העוברים ולשטוף את כל רשתות הרבייה.
- בשעה 9-10 בבוקר, להסיר את רשתות הרבייה מתחתית מיכלי מערכת למבוגרים. יש לשטוף בעדינות את העוברים לרשת ידנית באמצעות הצינור המחובר לקרבוי, ולהפוך את הרשת המוחזקת ביד לתוך קשת של מי מערכת נקייה כדי לגרש את העוברים.
- לאסוף ולשטוף כל קבוצה של עוברים, ולאחר מכן למקם ב אצבע של מים במערכת נקייה המכיל 0.00003% כחול מתילן (מים כחולים). אם יש מספר גדול במיוחד של עוברים ממיכל אחד, להפריד אותם לקערות מרובות. הריכוז של עוברים חיים צריך להיות כ 100 לכל 200 מ"ל של מים כחולים בכל קשת אצבע.
- להעריך את זמן ההפריה על ידי בימוי העוברים תחת מיקרוסקופ באמצעות שפורסם A. מקסיקניוס זמן התפתחותי טבלה17.
- נטר את קשתות האצבעות המכילות עוברים לעתים קרובות. הסר עוברים מתים או מעוותים ופסולת, כגון מזון או צואה שלא נאכלו, עם פיפטה פסטר. לשנות את המים הכחולים באצבעות לעתים קרובות.
- מניחים את האצבעות באינקובטור במשך 5-7 ימים. בשלב זה, החלמון כבר בשימוש עד תרבויות האכלה עם שרימפס מלח חי הכרחי להתפתחות נוספת.
- קח נתוני השרצה.
- עבור כל מיכל שמפיל עוברים, רשום את המידע הבא.
- רשום את התאריך ואת מספר הטנק.
- רשום את המספר המשוער של עוברים שנפלו (איור 2):
גבוה (500+)
בינוני (200-500)
נמוך(<200) - רשום את איכות העוברים שנפלו (איור 2):
גבוה (>75% בחיים)
בינוני (25-50% בחיים)
נמוך (<25% בחיים) - העריכו את זמן ההשרצה המקורי על ידי התייעצות עם שולחן ההיערכות המקסיקני של Astyanax 17.
- רשום את הטמפרטורה שהמערכת נקבעה כאשר הדג הוליד.
- עבור כל מיכל שמפיל עוברים, רשום את המידע הבא.
- להאכיל את כל הדגים.
- הגדר את טמפרטורת המים ל 76 °F.
- הכן שידור חי.
- להאכיל #2 דגים.
- אוספים עודפי מזון ופסולת ממיכלים ומשפשפים לפני איפוס הרשתות.
3. יום רביעי
- חזור על שלבים 2.1-2.2. לאסוף עוברים ולשטוף את כל רשתות הרבייה.
- קח נתוני השרצה כמו קודם.
- בצע בדיקות מים כבעבר.
- להאכיל את כל הדגים.
- הגדר את טמפרטורת המים ל 78 °F.
- הכינו את ההזנה החיה.
- בדוק את העוברים באינקובטור.
- לנקות ולשנות את המים של העוברים באצבעות כי בסופו של דבר ישמש כדי לחדש את מלאי הרבייה למבוגרים הכללי. השתמש במים מערכת כחולים טיפול במתילן.
- להאכיל דגים שוב.
- לנקות טנקים לפי הצורך ולאפס רשתות.
4. יום חמישי
- חזור על שלבים 2.1-2.2. לאסוף עוברים לשטוף ולאחסן רשתות רבייה.
- קח נתוני השרצה כמו קודם.
- הגדר את טמפרטורת המים ל 76 ° F.
- נקה את ההזנה החיה.
- נקו את כל הטנקים הבודדים.
- בדוק את העוברים באינקובטור.
- להאכיל #2 דגים.
5. יום שישי
- להאכיל את כל הדגים.
- הגדר את טמפרטורת המים ל 74 °F.
- נקה את ההזנה החיה.
- בדוק את העוברים באינקובטור.
6. יום שבת
- להאכיל דגים.
7. יום ראשון
- להאכיל דגים.
Access restricted. Please log in or start a trial to view this content.
תוצאות
אנחנו בדרך כלל מגדלים ומולידים צאצאים של דגי שטח שנאספו במקור בנסימיינטו דל ריו צ'וי בסן לואיס פוטוסי, מקסיקו (דגי פני השטח של ריו צ'וי) ומעיינות סן שלמה בפארק המדינה בלמורהה, טקסס (דגי שטח מטקסס) ודגי מערות שמקורם בקואבה דה אל פצ'ון (דג מערת פצ'ון) בטמאוליפס, מקסיקו וקואבה דה לוס סביוס (דג המער...
Access restricted. Please log in or start a trial to view this content.
Discussion
Astyanax mexicanus הוא מודל ביולוגי חדשני כי שרצים לעתים קרובות ניתן גידלו בקלות במעבדה1,2. מכיוון שאנו מעוניינים במנגנונים ההתפתחותיים העומדים ביסוד שינויים אבולוציוניים בדגי המערה של א. מקסיקו, הייצור והשימוש בעוברים חיוניים למטרות המחקר שלנו. המטרה הע?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים לדיוויד מרטסיאן, דידרה הייזר, איימי פארקהרסט, קרייג פוט ומנדי נג על תרומות יקרות ערך למתקן התרבות של מעבדת ג'פרי א. מקסיקו. המחקר במעבדת ג'פרי נתמך כיום על ידי מענק NIH EY024941.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Blackworms | Eastern Aquatics, Lancaster, PA | None | |
| Breeding Nets | Custom made | ||
| Brine shrimp eggs | AquaCave Lake Forest, IL. | None | |
| Colorimetric test kit | Petco | SKU:11916 | API Freshwater pH Test Kit |
| Egg yolk flakes | Pentair, Minneapolis, MN | None | |
| Fingerbowls | Carolina Biological Supply | 741004 | Culture dishes, 4.5 in, 250 mL |
| Hand held nets | Any Pet Store | ||
| Incubator for embryos | Fisher Scientific | 51-029-321HPM | 405 L |
| Instant Ocean sea salts | Spectrum Brands, Blacksburg, VA | None | |
| Methylene Blue | Sigma-Aldrich, St. Louis, MO | M9140 | |
| Pasteur Pipettes | Fisher Scientific | 13-678-20 | 5.75 in. |
| Net soaking solution | Any Pet Store | ||
| Nutrafin Cycle | Amazon | None | Bacterial boost |
| Refrigerator for live feed | Any source | ||
| Stereomicroscope | Any source | ||
| Thermometer | Any source | ||
| Tetra Tropical Crisps | Spectrum Brands, Blacksburg, VA | None |
References
- Jeffery, W. R. Cavefish as a model system in evolutionary developmental biology. Developmental Biology. 231, 1-12 (2001).
- Jeffery, W. R. Emerging model systems in evo-devo: cavefish and mechanisms of microevolution. Evolution & Development. 10, 265-272 (2008).
- Jeffery, W. R. Evolution and development in the cavefish Astyanax. Current Topics in Developmental Biology. 86, 191-221 (2009).
- Protas, M. E., et al. Genetic analysis of cavefish reveals molecular convergence in the evolution of albinism. Nature Genetics. 38, 107-111 (2006).
- Protas, M., Conrad, M., Gross, J. B., Tabin, C. J., Borowsky, R. Regressive evolution in the Mexican cave tetra, Astyanax mexicanus. Current Biology. 17, 452-454 (2007).
- O'Quin, K. E., Yoshizawa, M., Doshi, P., Jeffery, W. R. Quantitative genetic analysis of retinal degeneration in the blind cavefish. PLoS ONE. 8 (2), 57281(2013).
- Yoshizawa, M., et al. Distinct genetic architecture underlies the emergence of sleep loss and prey-seeking behavior in the Mexican cavefish. BMC Biology. 13, 15(2015).
- Elliot, W. R. The Astyanax caves of Mexico. Cavefishes of Tamaulipas, San Luis Potosi, and Guerrero. Association for Mexican Cave Studies Bulletin. 26, 1(2018).
- Luo, S., Wu, B., Xiong, X., Wang, J. Effects of total hardness and calcium:magnesium ratio of water during early stages of rare minnows (Gobiocypris rarus). Comparative Medicine. 66, 181-187 (2016).
- Balasch, J. C., Tort, L. Netting the stress responses in fish. Frontiers in Endocrinology. 10, 62(2019).
- Borowsky, R. Determining the sex of adult Astyanax mexicanus. , Cold Spring Harbor Protocols. (2008).
- Paschos, G. Circadian clocks, feeding time, and metabolic homeostasis. Frontiers in Pharmacology. 6, 112(2015).
- Scheiermann, C., Kunisaki, Y., Frenette, P. S. Circadian control of the immune system. Nature Reviews Immunology. 13, 190-198 (2013).
- Williams, M. B., Watts, S. A. Current basis and future directions of zebrafish nutrigenomics. Genes & Nutrition. 14, 34(2009).
- Harper, C., Wolf, J. C. Morphologic effects of the stress response in fish. ILAR Journal. 50, 387-396 (2009).
- Neubauer, P., Andersen, K. H. Thermal performance in fish is explained by an interplay between physiology, behavior and ecology. Conservation Physiology. 7 (1), 025(2019).
- Hinaux, H., et al. Developmental staging table for Astyanax mexicanus. Zebrafish. 8 (4), (2011).
- Borowsky, R. In vitro fertilization of Astyanax mexicanus. , Cold Spring Harbor Protocols. (2008).
- Simon, V., Hyacinthe, C., Rétaux, S. Breeding behavior in the blind Mexican cavefish and its river-dwelling conspecific. PLoS One. 14 (2), 0212591(2019).
- Harvey, B. J., Carolsfield, J. Induced Breeding in Tropical Fish Culture. International Development Research Centre. , (1993).
- Ma, L., Parkhurst, A., Jeffery, W. R. The role of a lens survival pathway including sox2 and aA-crystallin in the evolution of cavefish eye degeneration. EvoDevo. 5, 28(2014).
- Krishnan, J., Rohner, N. Cavefish and the basis for eye loss. Philosophical Transactions of the Royal Society B: Biological Sciences. 5 (372), 20150487(2017).
- Bilandžija, H., Abraham, L., Ma, L., Renner, K., Jeffery, W. R. Behavioral changes controlled by catecholaminergic systems explain recurrent loss of pigmentation in cavefish. Proceedings of the Royal Society. 285, (2018).
- Ma, L., Jeffery, W. R., Essner, J. J., Kowalko, J. E. Genome editing using TALENs in blind Mexican cavefish. PLoS ONE. 1093, 0119370(2015).
- Klaassen, H., Wang, Y., Adamski, K., Rohner, N., Kowalko, J. E. CRISPR mutagenesis confirms the role of oca2 in melanin pigmentation in Astyanax mexicanus. Developmental Biology. 441, 313-318 (2018).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved