Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Cambios incrementales de temperatura para la cría y el desove máximos en Astyanax mexicanus
En este artículo
Resumen
Este artículo describe las condiciones básicas de laboratorio y los protocolos para un régimen de temperatura incremental para estimular el desove máximo en el tetra mexicano Astyanax mexicanus,que es un modelo emergente para los estudios de desarrollo y evolutivos.
Resumen
El tetra mexicano, Astyanax mexicanus, es un sistema modelo emergente para estudios en desarrollo y evolución. La existencia de morfos de superficie ocular (peces de superficie) y de cueva ciega (peces de cueva) en esta especie presenta una oportunidad para interrogar los mecanismos subyacentes a la evolución morfológica y conductual. Los peces de las cavernas han desarrollado nuevos rasgos constructivos y regresivos. Los cambios constructivos incluyen aumentos en las papilas gustativas y mandíbulas, órganos sensoriales de línea lateral, y la grasa corporal. Los cambios regresivos incluyen pérdida o reducción de los ojos. pigmentación de la melanina, comportamiento de la escolaridad, agresión, y sueño. Para interrogar experimentalmente estos cambios, es crucial obtener un gran número de embriones desovados. Desde que los peces de superficie originales de A. mexicanus y los peces de cueva se recolectaron en Texas y México en la década de 1990, sus descendientes han sido estimulados rutinariamente para reproducir y desovar grandes cantidades de embriones bimestralmente en el laboratorio Jeffery. Aunque la cría está controlada por la abundancia y calidad de los alimentos, los ciclos claros y oscuros y la temperatura, hemos encontrado que los cambios incrementales de temperatura juegan un papel clave en la estimulación del desove máximo. El aumento gradual de la temperatura de 72 ° F a 78 ° F en los primeros tres días de una semana de reproducción proporciona dos o tres días consecutivos de desove con un número máximo de embriones de alta calidad, que luego es seguido por una disminución gradual de la temperatura de 78 ° F a 72 ° F durante los últimos tres días de la semana de desove. Los procedimientos que se muestran en este video describen el flujo de trabajo antes y durante una semana de cría de laboratorio para el desove estimulado por la temperatura incremental.
Introducción
El teleósteo Astyanax mexicanus tiene una forma de vivienda superficial ocular (peces de superficie) y muchas formas diferentes de viviendas de cuevas ciegas (peces de cueva)1,2. Los peces de las cavernas han evolucionado en la oscuridad perpetua y bajo limitaciones alimentarias, dando lugar a la aparición de nuevos rasgos constructivos y regresivos3. Los rasgos constructivos incluyen aumentos en las papilas gustativas y el tamaño de la mandíbula, los órganos sensoriales de la línea lateral y las reservas de grasa. Los rasgos regresivos incluyen la pérdida o reducción de la pigmentación de melanina, los ojos y los comportamientos, como el sueño, la escolarización y la agresión. Un atributo del sistema Astyanax es la fertilidad completa entre las dos formas, lo que permite el uso de mapeo cuantitativo de loci de rasgos (QTL) para determinar la(s) región(es) genómica(s) asociada(s) con la evolución constructiva y regresiva4,5,6,7. A. mexicanus ofrece un sistema ventajoso para estudiar el desarrollo porque puede ser inducido a desovar con frecuencia en el laboratorio. Los embriones de A. mexicanus son translúcidos, ligeramente más grandes que los del pez cebra, producidos en grandes cantidades, y se convierten en adultos sexualmente maduros en aproximadamente 8-12 meses. Su período de máxima capacidad de desove es de aproximadamente 5 años. Este protocolo describe el flujo de trabajo necesario en una instalación de cultivo de A. mexicanus durante una semana de reproducción típica e incluye los detalles del mantenimiento del sistema de peces y el régimen de control de temperatura para el desove máximo.
A. mexicanus es un pez tropical que vive en ríos que se originan en mesetas calizas (peces de superficie) y en piscinas en cuevas de piedra caliza (peces de cueva)8. La piedra caliza se disuelve para producir agua dura, y A. mexicanus prospera en agua dura. Los peces adaptados a las condiciones de las aguas duras pueden tolerar una serie de condiciones saladas, pero generalmente se reproducen en condiciones específicas9. La inducción del comportamiento de desove se logra mediante una combinación de factores. Debido a que los peces son de sangre fría y dependen de su entorno para mantener la homeostasis, su metabolismo es sensible a los cambios ambientales y reaccionan más rápidamente a los factores estresantes10. A. mexicanus debe cultivarse en sistemas acuáticos bajo condiciones cuidadosamente reguladas de flujo de agua, pH, conductividad, presión osmótica, iluminación y temperaturas del agua.
En el laboratorio Jeffery, los peces se mantienen en dos sistemas de agua corriente: (1) un "sistema bebé" para peces adultos jóvenes antes de la madurez sexual y (2) un sistema adulto (o principal) para adultos sexualmente maduros, reproductores. El "sistema para bebés" consta de tanques de 8 L y 15 L suministrados con agua corriente. El "sistema bebé" es sembrado por alevines y juveniles metamorfoseados jóvenes cultivados a partir de larvas en tanques más pequeños (1-10 L), en los que el agua se intercambia semanalmente. Las larvas, alevines y juveniles son extremadamente dependientes de los alimentos y deben ser alimentados con alimentos vivos (camarones de salmuera) una vez al día para garantizar una alta tasa de supervivencia. Los jóvenes del "sistema del bebé" se colocan en el sistema adulto después de aproximadamente 1-1,5 años. Al principio, se alimentan con tetra escamas pulverizadas, y después de un mayor crecimiento se transfieren al régimen regular de alimentación de adultos. La madurez sexual puede ser evaluada por el volumen abdominal en las hembras, y se han descrito métodos para determinar el sexo11. En el sistema adulto, el agua se intercambia automáticamente en tanques de 42 L 3 veces por período de 24 horas. El sistema adulto es monitoreado diariamente por inspección visual y lecturas automáticas de temperatura, pH y conductividad de las sondas. El pH óptimo es de alrededor de 7.4 y puede oscilar entre 6.8-7.5, la temperatura base del sistema es de 72/73 ° F, y la conductividad ideal oscila entre 600-800 mS. Las lecturas automáticas se muestran en una pantalla del controlador y las comprobaciones visuales de la presión del agua se leen en los medidores de flujo distribuidos por todo el sistema. Semanalmente se realizan controles independientes de la calidad del agua mediante pruebas de temperatura y la medición de los parámetros de calidad del agua para el pH, el amoníaco y el nitrato mediante una prueba colorimétrica. Los niveles de amoníaco y nitrato se mantienen en o cerca de cero mediante la adición de bacterias beneficiosas (por ejemplo, ciclo de Nutafin) al sistema. La iluminación de la habitación se controla mediante un temporizador ajustado a los períodos de luz de 14 horas y oscuridad de 10 horas. Además de los parámetros generales de calidad del agua mencionados anteriormente, las siguientes consideraciones necesitan especial atención durante una semana de cría.
La primera consideración es el fotoperiodo, ya que los peces (incluso los peces de cueva en el laboratorio) dependen de los ciclos de luz para establecer su reloj circadiano. Los ritmos circadianos pueden afectar a todo, desde la cría y la alimentación hasta la salud del sistema inmunológico12,13 y deben ser consistentes para obtener los máximos beneficios para la salud. Los peces se mantienen en un sistema de agua corriente en un fotoperiodo de luz de 14 horas y 10 horas de oscuridad. Los peces de superficie generalmente comienzan a desovar una hora después de que el sistema se ha oscurecido, y la luz introducida durante este período puede interferir y terminar el desove. El desove de peces ciegos de cueva es menos perturbado por la luz. En comparación con el desove de peces de superficie, el desove de peces de cueva se retrasa, generalmente comenzando de cuatro a cinco horas después de que el sistema se haya oscurecido.
La segunda consideración es la nutrición. Los peces adultos normalmente son alimentados con una dieta de tetra escamas una vez al día. Antes del desove, los peces son alimentados con una dieta rica en proteínas complementada con cantidades adicionales de tetra copos y otros alimentos: copos de yema de huevo y ocasionalmente gusanos negros de California vivos(Lumbriculus variegatus)para compensar la pérdida de proteínas debido a la producción de huevos durante el ciclo de desove anterior. Durante la semana de reproducción, los peces son alimentados dos veces al día, una vez por la mañana y otra vez por la tarde/noche. Se debe evitar que los peces se alimenten una sola vez al día pero con una sola porción muy grande de alimento, ya que esto puede causar desnutrición14.
La tercera consideración es el espacio. Los requisitos de espacio se basan en la masa corporal promedio de un adulto, así como en consideraciones de comportamiento, como si los peces tienen un comportamiento escolar o agresivo. Los tanques que están sobre o poco hacinados pueden conducir a una mayor agresión y estrés constante, lo que hace que los peces sean vulnerables a las lesiones de sus compañeros de tanque y reacios a participar en el desove15. Normalmente albergamos 10-20 peces por tanque de 42 L.
La cuarta consideración es la temperatura. Como se mencionó anteriormente, los peces son animales de sangre fría y dependen del medio ambiente para mantener la temperatura corporal. Debido a que la temperatura tiene un efecto directo en los procesos metabólicos, los cambios de temperatura pueden desencadenar alteraciones de comportamiento en los peces16. Este programa de reproducción consiste en ciclos de temperatura de dos semanas: la primera semana introduce un pico de temperatura a 78 ° F, y la semana siguiente mantiene una temperatura estática de 72 ° F. Durante la primera semana (de cría), las redes de cría con bordes de plástico se colocan en el fondo de los tanques cada noche. Las redes de cría sirven como una barrera entre los peces en los tanques y los huevos desovados, que de otro modo se consumirían. La temperatura se eleva en 2 ° F por día a un máximo de 78 ° F a mediados de semana, y el desove se induce de acuerdo con el ciclo de luz en las primeras 2-3 noches de esta semana. La temperatura se reduce en incrementos de 2 ° F a 72 ° F durante los días restantes de la semana, y la temperatura base se mantiene hasta el comienzo de la próxima semana de reproducción. La cría generalmente se estimula no más de dos veces al mes para permitir que los peces se recuperen.
En general, este método permite el desove de grandes cantidades de embriones de la más alta calidad durante un período de tiempo más largo.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Este procedimiento ha sido aprobado por las directrices Institucionales de Cuidado animal de la Universidad de Maryland, College Park (Actualmente IACUC 469 #R-NOV-18-59; Proyecto 1241065-1).
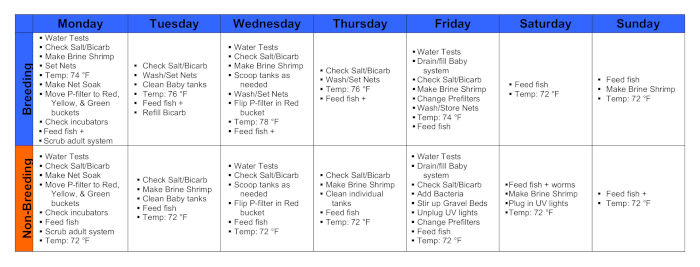
Figura 1. Calendarios durante una semana de cría y una semana no reproductiva. Haga clic aquí para ver una versión más amplia de esta figura.
1. Lunes
- A las 9-10 AM, realice pruebas de agua y los pasos 1.1.1-4 a continuación.
- Registre las temperaturas de la habitación, el tanque y el depósito con un termómetro.
- Registre los niveles de amoníaco, nitrato y nitrato con un kit de prueba colorimétrico.
- Registre el pH del sistema de monitoreo, así como el kit de prueba colorimétrica.
- Registre la conductividad desde el monitor de carboy y el monitor del sistema principal.
- A partir de las 10 AM, alimente a todos los peces.
- Alimente a todos los peces en el sistema adulto con tetra escamas, aplastando las escamas en los tanques con peces jóvenes. Alimentar sólo tantas escamas como un tanque de pescado puede consumir completamente en 3-5 minutos, alrededor de un "pellizco de dedo".
- Revise la incubadora utilizada para albergar las uñas de los embriones en desarrollo y cambie el agua si es necesario.
- Abra la incubadora de embriones y compruebe los niveles de agua en todos los depósitos. Si se están quedando sin agua, agregue agua del sistema. Compruebe los ajustes de temperatura de la incubadora. Criar embriones a 73-77 °F (23-25 °C).
- Alimentación limpia en vivo.
- Para limpiar los gusanos negros, retire los lavabos de Tupperware descubiertos que contienen sus cultivos del refrigerador de alimentación vivo y vierta el exceso de agua por encima de los grupos de gusanos en el fregadero. Con agua destilada, suspenda y enjuague los gusanos repetidamente hasta que el agua de vertido esté clara.
- Agregue suficiente agua limpia para que los grupos de gusanos estén aproximadamente medio cubiertos. Reemplace los gusanos restantes en el refrigerador de alimentación viva, descubiertos.
- Alimentar a los peces.
- Al menos 30 minutos después de la primera alimentación, alimente a los peces en los tanques en los que se desea reproducir con escamas de yema de huevo, gusanos negros o ambos. Agregue un "fingerpinch" de escamas de yema por tanque. Agregue suficientes grupos de gusanos negros para permitir que cada pez en el tanque consuma alrededor de 5-10 gusanos.
- A las 10 AM- 1 PM, establezca la temperatura del agua en 74 ° F.
- Frote los tanques de cría según sea necesario y establezca las redes de cría.
- Limpie los tanques y coloque las redes al menos una hora después de la última alimentación. Limpie todos los tanques en los que se colocan las redes de antemano. Coloque las redes de cría cuidadosamente para no interferir con el suministro de aire al tanque.
2. Martes
- Recoger los embriones y lavar todas las redes de cría.
- A las 9-10 AM, retire las redes de cría del fondo de los tanques del sistema para adultos. Enjuague suavemente los embriones en una red de mano usando la manguera conectada a la vajillas, e invierta la red de mano en un dedo de agua limpia del sistema para expulsar los embriones.
- Recoger y lavar cada conjunto de embriones, y luego colocar en un fingerbowl de agua limpia del sistema que contiene 0.00003% azul de metileno (agua azul). Si hay un número excepcionalmente grande de embriones de un solo tanque, sepárelos en múltiples cuencos. La concentración de embriones vivos debe ser de aproximadamente 100 por 200 mL de agua azul en cada fingerbowl.
- Estimar el tiempo de fecundación estacionándose los embriones bajo un microscopio utilizando la tabla de tiempo de desarrollo de A. mexicanus publicada17.
- Vigile las uñas de los dedos que contienen embriones con frecuencia. Retire los embriones y desechos muertos o deformados, como alimentos o heces no insendidos, con una pipeta Pasteur. Cambie el agua azul en fingerbowls con frecuencia.
- Coloque las uñas en una incubadora durante 5-7 días. En este momento, la yema se ha agotado y la alimentación de los cultivos con camarones vivos de salmuera es necesaria para un mayor desarrollo.
- Tomemos los datos de desove.
- Para cada tanque que deja caer embriones, registre la siguiente información.
- Registre la fecha y el número de tanque.
- Registre el número aproximado de embriones caídos (Figura 2):
Alto (500+)
Medio (200-500)
Bajo(<200) - Registrar la calidad de los embriones caídos (Figura 2):
Alta (>75% vivo)
Medio (25-50% vivo)
Bajo (<25% vivo) - Estimar el tiempo de desove original consultando la tabla de ensayo Astyanax mexicanus 17.
- Registre la temperatura a la que se estableció el sistema cuando los peces desovaron.
- Para cada tanque que deja caer embriones, registre la siguiente información.
- Alimente a todos los peces.
- Ajuste la temperatura del agua a 76 ° F.
- Preparar alimentación en vivo.
- Alimentar a los peces #2.
- Saque el exceso de alimentos y escombros de los tanques y matorrales antes de restablecer las redes.
3. Miércoles
- Repita los pasos 2.1-2.2. Recoger embriones y lavar todas las redes de cría.
- Tome los datos de desove como antes.
- Realice pruebas de agua como antes.
- Alimente a todos los peces.
- Ajuste la temperatura del agua a 78 ° F.
- Prepare la transmisión en vivo.
- Compruebe los embriones en la incubadora.
- Limpie y cambie el agua de los embriones en uñas que eventualmente se utilizarán para reponer el stock de reproducción general de adultos. Use agua del sistema tratada con azul de metileno.
- Alimentar a los peces de nuevo.
- Limpie los tanques según sea necesario y restablezca las redes.
4. Jueves
- Repita los pasos 2.1-2.2. Recoger embriones y lavar y almacenar redes de cría.
- Tome los datos de desove como antes.
- Ajuste la temperatura del agua a 76 ° F.
- Limpie la transmisión en vivo.
- Limpie todos los tanques individuales.
- Compruebe los embriones en la incubadora.
- Alimentar a los peces #2.
5. Viernes
- Alimente a todos los peces.
- Ajuste la temperatura del agua a 74 ° F.
- Limpie la transmisión en vivo.
- Compruebe los embriones en la incubadora.
6. Sábado
- Alimentar a los peces.
7. Domingo
- Alimentar a los peces.
Access restricted. Please log in or start a trial to view this content.
Resultados
Generalmente criamos y desovamos a los descendientes de peces de superficie recolectados originalmente en Nacimiento del Río Choy en San Luis Potosí, México (peces de superficie de Río Choy) y San Solomon Springs en el Parque Estatal Balmorhea, Texas (peces de superficie de Texas) y peces de cueva derivados de la Cueva de El Pachón en Tamaulipas, México, y la Cueva de los Sabinos y Sotano de la Tinaja en San Luis Potosí. México.
A lo largo de una semana de cría, se recopilan datos de ...
Access restricted. Please log in or start a trial to view this content.
Discusión
Astyanax mexicanus es un nuevo modelo biológico que desova con frecuencia y se puede criar fácilmente en el laboratorio1,2. Debido a que estamos interesados en los mecanismos de desarrollo que subyacen a los cambios evolutivos en los peces de la cueva de A. mexicanus, la producción y el uso de embriones es vital para nuestros objetivos de investigación. El objetivo principal del mantenimiento de una población adulta de peces es la producci?...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a David Martasian, Diedre Heyser, Amy Parkhurst, Craig Foote y Mandy Ng por sus valiosas contribuciones a las instalaciones de cultura A. mexicanus del laboratorio Jeffery. La investigación en el laboratorio Jeffery está actualmente respaldada por la subvención EY024941 de los NIH.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Blackworms | Eastern Aquatics, Lancaster, PA | None | |
| Breeding Nets | Custom made | ||
| Brine shrimp eggs | AquaCave Lake Forest, IL. | None | |
| Colorimetric test kit | Petco | SKU:11916 | API Freshwater pH Test Kit |
| Egg yolk flakes | Pentair, Minneapolis, MN | None | |
| Fingerbowls | Carolina Biological Supply | 741004 | Culture dishes, 4.5 in, 250 mL |
| Hand held nets | Any Pet Store | ||
| Incubator for embryos | Fisher Scientific | 51-029-321HPM | 405 L |
| Instant Ocean sea salts | Spectrum Brands, Blacksburg, VA | None | |
| Methylene Blue | Sigma-Aldrich, St. Louis, MO | M9140 | |
| Pasteur Pipettes | Fisher Scientific | 13-678-20 | 5.75 in. |
| Net soaking solution | Any Pet Store | ||
| Nutrafin Cycle | Amazon | None | Bacterial boost |
| Refrigerator for live feed | Any source | ||
| Stereomicroscope | Any source | ||
| Thermometer | Any source | ||
| Tetra Tropical Crisps | Spectrum Brands, Blacksburg, VA | None |
Referencias
- Jeffery, W. R. Cavefish as a model system in evolutionary developmental biology. Developmental Biology. 231, 1-12 (2001).
- Jeffery, W. R. Emerging model systems in evo-devo: cavefish and mechanisms of microevolution. Evolution & Development. 10, 265-272 (2008).
- Jeffery, W. R. Evolution and development in the cavefish Astyanax. Current Topics in Developmental Biology. 86, 191-221 (2009).
- Protas, M. E., et al. Genetic analysis of cavefish reveals molecular convergence in the evolution of albinism. Nature Genetics. 38, 107-111 (2006).
- Protas, M., Conrad, M., Gross, J. B., Tabin, C. J., Borowsky, R. Regressive evolution in the Mexican cave tetra, Astyanax mexicanus. Current Biology. 17, 452-454 (2007).
- O'Quin, K. E., Yoshizawa, M., Doshi, P., Jeffery, W. R. Quantitative genetic analysis of retinal degeneration in the blind cavefish. PLoS ONE. 8 (2), 57281(2013).
- Yoshizawa, M., et al. Distinct genetic architecture underlies the emergence of sleep loss and prey-seeking behavior in the Mexican cavefish. BMC Biology. 13, 15(2015).
- Elliot, W. R. The Astyanax caves of Mexico. Cavefishes of Tamaulipas, San Luis Potosi, and Guerrero. Association for Mexican Cave Studies Bulletin. 26, 1(2018).
- Luo, S., Wu, B., Xiong, X., Wang, J. Effects of total hardness and calcium:magnesium ratio of water during early stages of rare minnows (Gobiocypris rarus). Comparative Medicine. 66, 181-187 (2016).
- Balasch, J. C., Tort, L. Netting the stress responses in fish. Frontiers in Endocrinology. 10, 62(2019).
- Borowsky, R. Determining the sex of adult Astyanax mexicanus. , Cold Spring Harbor Protocols. (2008).
- Paschos, G. Circadian clocks, feeding time, and metabolic homeostasis. Frontiers in Pharmacology. 6, 112(2015).
- Scheiermann, C., Kunisaki, Y., Frenette, P. S. Circadian control of the immune system. Nature Reviews Immunology. 13, 190-198 (2013).
- Williams, M. B., Watts, S. A. Current basis and future directions of zebrafish nutrigenomics. Genes & Nutrition. 14, 34(2009).
- Harper, C., Wolf, J. C. Morphologic effects of the stress response in fish. ILAR Journal. 50, 387-396 (2009).
- Neubauer, P., Andersen, K. H. Thermal performance in fish is explained by an interplay between physiology, behavior and ecology. Conservation Physiology. 7 (1), 025(2019).
- Hinaux, H., et al. Developmental staging table for Astyanax mexicanus. Zebrafish. 8 (4), (2011).
- Borowsky, R. In vitro fertilization of Astyanax mexicanus. , Cold Spring Harbor Protocols. (2008).
- Simon, V., Hyacinthe, C., Rétaux, S. Breeding behavior in the blind Mexican cavefish and its river-dwelling conspecific. PLoS One. 14 (2), 0212591(2019).
- Harvey, B. J., Carolsfield, J. Induced Breeding in Tropical Fish Culture. International Development Research Centre. , (1993).
- Ma, L., Parkhurst, A., Jeffery, W. R. The role of a lens survival pathway including sox2 and aA-crystallin in the evolution of cavefish eye degeneration. EvoDevo. 5, 28(2014).
- Krishnan, J., Rohner, N. Cavefish and the basis for eye loss. Philosophical Transactions of the Royal Society B: Biological Sciences. 5 (372), 20150487(2017).
- Bilandžija, H., Abraham, L., Ma, L., Renner, K., Jeffery, W. R. Behavioral changes controlled by catecholaminergic systems explain recurrent loss of pigmentation in cavefish. Proceedings of the Royal Society. 285, (2018).
- Ma, L., Jeffery, W. R., Essner, J. J., Kowalko, J. E. Genome editing using TALENs in blind Mexican cavefish. PLoS ONE. 1093, 0119370(2015).
- Klaassen, H., Wang, Y., Adamski, K., Rohner, N., Kowalko, J. E. CRISPR mutagenesis confirms the role of oca2 in melanin pigmentation in Astyanax mexicanus. Developmental Biology. 441, 313-318 (2018).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados