Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Постепенные изменения температуры для максимального размножения и нереста у Astyanax mexicanus
В этой статье
Резюме
В данной статье изложены основные лабораторные условия и протоколы для инкрементального температурного режима для стимуляции максимального нереста у мексиканской тетра Astyanax mexicanus,которая является формирующейся моделью для исследований развития и эволюции.
Аннотация
Мексиканская тетра, Astyanax mexicanus,является формирующейся модельной системой для исследований в области развития и эволюции. Существование глазных поверхностных (поверхностных рыб) и слепых пещерных (пещерных рыб) морфов у этого вида дает возможность исследовать механизмы, лежащие в основе морфологической и поведенческой эволюции. Пещерные рыбы развили новые конструктивные и регрессивные черты. Конструктивные изменения включают увеличение вкусовых рецепторов и челюстей, органов чувств боковой линии и жира в организме. Регрессивные изменения включают потерю или уменьшение глаз. пигментация меланина, школьное поведение, агрессия и сон. Чтобы экспериментально исследовать эти изменения, крайне важно получить большое количество порожденных эмбрионов. С тех пор, как оригинальные поверхностные рыбы A. mexicanus и пещерные рыбы были собраны в Техасе и Мексике в 1990-х годах, их потомков регулярно стимулировали к размножению и нересту большого количества эмбрионов два раза в год в лаборатории Джеффри. Хотя размножение контролируется изобилием и качеством пищи, светло-темными циклами и температурой, мы обнаружили, что постепенные изменения температуры играют ключевую роль в стимулировании максимального нереста. Постепенное повышение температуры с 72 ° F до 78 ° F в первые три дня недели размножения обеспечивает два-три последовательных нерестовых дня с максимальным количеством высококачественных эмбрионов, за которым следует постепенное снижение температуры с 78 ° F до 72 ° F в течение последних трех дней нерестовой недели. Процедуры, показанные в этом видео, описывают рабочий процесс до и во время недели лабораторной селекции для стимуляции нереста с добавочной температурой.
Введение
Телеост Astyanax mexicanus имеет глазкую поверхностно-обитую (поверхностную рыбу) форму и множество различных слепых пещерных (пещерных рыб) форм1,2. Пещерные рыбы эволюционировали в вечной темноте и под ограничениями пищи, что привело к появлению новых конструктивных и регрессивных черт3. Конструктивные черты включают увеличение вкусовых рецепторов и размера челюсти, органов чувств боковой линии и жировых запасов. Регрессивные черты включают потерю или уменьшение пигментации меланина, глаз и поведения, таких как сон, школьное образование и агрессия. Атрибутом системы Astyanax является полная фертильность между двумя формами, позволяющая использовать количественное отображение локусов признаков (QTL) для определения геномной области (областей), связанной с конструктивной и регрессивной эволюцией4,5,6,7. A. mexicanus предлагает выгодную систему для изучения развития, потому что его можно заставить часто нереститься в лаборатории. Эмбрионы A. mexicanus полупрозрачные, немного крупнее, чем у рыбок данио, производятся в больших количествах и развиваются в половозрелых взрослых особей примерно через 8-12 месяцев. Их период максимальной нерестоспособности составляет около 5 лет. Этот протокол описывает рабочий процесс, необходимый на объекте культивирования A. mexicanus в течение типичной недели размножения, и включает в себя детали обслуживания рыбной системы и режима контроля температуры для максимального нереста.
A. mexicanus - тропическая рыба, которая живет в реках, берущих начало на известняковых плато (поверхностные рыбы) и в бассейнах в известняковых пещерах (пещерные рыбы)8. Известняк растворяется, производя жесткую воду, и A. mexicanus процветает в жесткой воде. Рыбы, адаптированные к условиям жесткой воды, могут переносить целый ряд соленых условий, но обычно размножаются в конкретных9. Индукция нерестового поведения осуществляется сочетанием факторов. Поскольку рыбы хладнокровны и полагаются на окружающую среду для поддержания гомеостаза, их метаболизм чувствителен к изменениям окружающей среды, и они быстрее реагируют на стрессоры10. A. mexicanus следует культивируем в водных системах в тщательно регулируемых условиях потока воды, рН, проводимости, осмотического давления, освещения и температуры воды.
В лаборатории Джеффри рыбы поддерживаются в двух системах проточной воды: (1) «детская система» для молодых взрослых рыб до половой зрелости и (2) взрослая (или основная) система для половозрелых, размножающихся взрослых особей. «Детская система» состоит из резервуаров на 8 л и 15 л, снабженных проточной водой. «Детская система» засеивается мальками и молодыми метаморфизованными молодыми особями, выращенными из личинок в меньших (1-10 л) резервуарах, в которых еженедельно обменивается водой. Личинки, мальки и молодь чрезвычайно зависят от пищи и должны питаться живым кормом (солеными креветками) один раз в день, чтобы обеспечить высокий уровень выживаемости. Молодых особей из «детской системы» помещают во взрослую систему примерно через 1-1,5 года. Сначала их кормят измельченными тетрахлопьями, а после дальнейшего роста переводят в обычный режим кормления взрослых особей. Половую зрелость можно оценить по объему живота у самок, а методы определения пола были описаны11. Во взрослой системе вода автоматически обменивается в резервуарах по 42 л 3 раза за 24-часовой период. Система для взрослых ежедневно контролируется визуальным осмотром и автоматическими показаниями температуры, рН и проводимости с помощью датчиков. Оптимальный pH составляет около 7,4 и может варьироваться между 6,8-7,5, базовая температура системы составляет 72/73 ° F, а идеальная проводимость колеблется между 600-800 мС. Автоматические показания отображаются на экране контроллера, а визуальные проверки давления воды считываются на расходомерах, распределенных по всей системе. Независимые проверки качества воды проводятся еженедельно путем тестирования температуры и измерения параметров качества воды для pH, аммиака и нитрата с использованием колориметрического теста. Уровни аммиака и нитратов удерживаются на уровне или близко к нулю путем добавления полезных бактерий (например, цикла нутафинов) в систему. Освещение помещения управляется таймером, настроенным на 14-часовой световой и 10-часовой темные периоды. В дополнение к общим параметрам качества воды, упомянутым выше, следующие соображения требуют особого внимания в течение недели размножения.
Первым соображением является фотопериод, так как рыбы (даже пещерные рыбы в лаборатории) зависят от световых циклов, чтобы установить свои циркадные часы. Циркадные ритмы могут влиять на все, от размножения и кормления до здоровья иммунной системы12,13 и должны быть последовательными для максимальной пользы для здоровья. Рыбы поддерживаются в системе проточной воды на 14-часовом свете и 10-часовом темном фотопериоде. Поверхностные рыбы обычно начинают нерест через час после того, как система потемнела, и свет, введенный в этот период, может мешать и прекращать нерест. Нерест слепых пещерных рыб меньше нарушается светом. По сравнению с нерестом поверхностных рыб, нерест пещерной рыбы задерживается, обычно начиная через четыре-пять часов после того, как система потемнела.
Второе соображение – это питание. Взрослых рыб обычно кормят рационом из тетрахлопьев один раз в день. Перед нерестом рыбу кормят богатой белком диетой, дополненной дополнительным количеством тетрахлопьев и другой пищи: яичными желтковыми хлопьями и иногда живыми калифорнийскими черными червями(Lumbriculus variegatus),чтобы компенсировать потерю белка из-за производства яиц во время предыдущего нерестового цикла. В течение недели размножения рыб кормят два раза в день, один раз утром и снова днем / вечером. Рыб, кормящихся только один раз в день, но с одной очень большой порцией пищи, следует избегать, так как это может вызвать недоедание14.
Третье соображение – это пространство. Требования к пространству основаны на средней массе тела взрослой особи, а также на поведенческих соображениях, таких как наличие у рыб стайного поведения или агрессивного поведения. Переполненные или недонаселенные аквариумы могут привести к повышенной агрессии и постоянному стрессу, что делает рыб уязвимыми к травмам от своих товарищей по аквариуму и неохотно участвует в нересте15. Обычно мы размещаем 10-20 рыб на 42 л аквариума.
Четвертое соображение – это температура. Как упоминалось выше, рыбы являются хладнокровными животными и полагаются на окружающую среду для поддержания температуры тела. Поскольку температура оказывает непосредственное влияние на метаболические процессы, изменения температуры могут вызвать поведенческие изменения у рыб16. Эта программа разведения состоит из двухнедельных циклов температуры: первая неделя вводит скачок температуры до 78 ° F, а следующая неделя поддерживает статическую температуру 72 ° F. В течение первой (племенной) недели на дно резервуаров каждый вечер помещаются гнездовые сети с пластиковыми краями. Гнездовые сети служат барьером между рыбой в аквариумах и нерестяными яйцами, которые в противном случае были бы съедены. Температура повышается на 2 ° F в день до максимума 78 ° F к середине недели, и нерест индуцируется в соответствии с световым циклом в первые 2-3 вечера этой недели. Затем температура понижается на 2 ° F с шагом до 72 ° F в течение оставшихся дней недели, а базовая температура поддерживается до начала следующей недели размножения. Размножение обычно стимулируется не чаще двух раз в месяц, чтобы дать рыбе время на восстановление.
В целом, этот метод позволяет нерестить большое количество эмбрионов самого высокого качества в течение более длительного периода времени.
протокол
Эта процедура была одобрена руководящими принципами институционального ухода за животными Университета Мэриленда, Колледж-Парк (в настоящее время IACUC 469 #R-NOV-18-59; Проект 1241065-1).
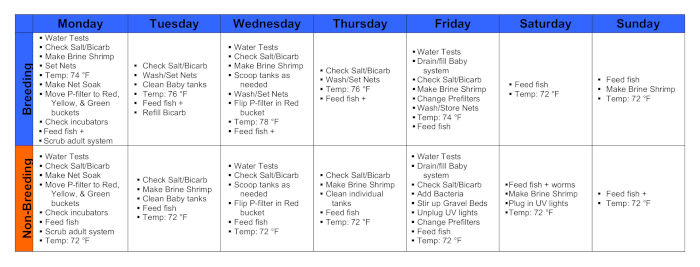
Рисунок 1. Календари в течение недели размножения и недели без разведения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
1. Понедельник
- В 9-10 утра выполните испытания воды и шаги 1.1.1-4 ниже.
- Запишите температуру в помещении, резервуаре и резервуаре с помощью термометра.
- Запишите уровни аммиака, нитратов и нитратов с помощью колориметрического испытательного набора.
- Запишите pH из системы мониторинга, а также из набора колориметрических тестов.
- Регистрируйте проводимость с монитора carboy и монитора основной системы.
- Начиная с 10 утра, кормите всех рыб.
- Кормите всех рыб во взрослой системе тетрахлопьями, измельчая хлопья в аквариумах с молодыми рыбами. Кормите только столько хлопьев, сколько аквариум с рыбой может съесть полностью за 3-5 минут, примерно «пощипывая пальцем».
- Проверьте инкубатор, используемый для размещения чаш для пальцев развивающихся эмбрионов, и при необходимости замените воду.
- Откройте инкубатор эмбрионов и проверьте уровень воды во всех водоемах. Если у них заканчиваются воды, добавьте системную воду. Проверьте настройки температуры инкубатора. Растить эмбрионы при 73-77 °F (23-25 °C).
- Чистый живой корм.
- Чтобы очистить черных червей, извлеките непокрытые бассейны Tupperware, содержащие их культуры, из холодильника с живым кормом и вылейте лишнюю воду над скоплениями червей в раковину. Используя дистиллированную воду, суспендировать и промыть червей несколько раз, пока вода не прольется.
- Добавьте достаточно чистой воды, чтобы скопления червей были покрыты примерно наполовину. Замените оставшихся червей в холодильнике с живым кормом, непокрытым.
- Корм для рыб.
- По крайней мере, через 30 минут после первого кормления кормите рыбу в аквариумах, в которых желательно разведение, хлопьями яичного желтка, черными червями или и тем, и другим. Добавьте «палецовый хлопья» из желтковых хлопьев на бак. Добавьте достаточное количество скоплений черных червей, чтобы каждая рыба в аквариуме съела около 5-10 червей.
- В 10:00 - 13:00 установите температуру воды на уровне 74 °F.
- Очистите резервуары для размножения по мере необходимости и установите гнездовые сети.
- Очистите резервуары и положите сетки не менее чем через час после последнего кормления. Заранее очистите все резервуары, в которые помещены сетки. Установите селекционные сети осторожно, чтобы не мешать подаче воздуха в резервуар.
2. Вторник
- Соберите эмбрионы и промыть все племенные сетки.
- В 9-10 утра снимите сетки для размножения со дна резервуаров взрослой системы. Осторожно промойте эмбрионы в ручную сетку, используя шланг, прикрепленный к карбою, и перевернуть ручную сетку в чашу с чистой системной водой, чтобы изгнать эмбрионы.
- Соберите и вымойте каждый набор эмбрионов, а затем поместите в чашу с чистой системой воды, содержащей 0,00003% метиленового синего (синей воды). Если из одного резервуара находится исключительно большое количество эмбрионов, разделите их на несколько чаш. Концентрация живых эмбрионов должна составлять около 100 на 200 мл голубой воды в каждом чаше.
- Оцените время оплодотворения, поразвив эмбрионы под микроскопом, используя опубликованную таблицу времени развития A. mexicanus 17.
- Часто контролируйте чаши с эмбрионами. Удалите мертвые или деформированные эмбрионы и мусор, такие как несъединая пища или фекалии, с помощью пипетки Пастера. Часто меняйте синюю воду в чашах.
- Поместите чаши в инкубатор на 5-7 дней. В это время желток был изношен и для дальнейшего развития необходимо подкормление культур живыми солеными креветками.
- Возьмем данные о нересте.
- Для каждого резервуара, в который сбрасывают эмбрионы, запишите следующую информацию.
- Запишите дату и номер резервуара.
- Запишите приблизительное количество выпавших эмбрионов(рисунок 2):
Высокий (500+)
Средний (200-500)
Низкий(<200) - Запишите качество выпавших эмбрионов(рисунок 2):
Высокий (>75% живого)
Средний (25-50% живой)
Низкий (<25% живого) - Оцените первоначальное время нереста, обратившись к промежуточной таблице17 Astyanax mexicanus.
- Запишите температуру, при которую система была установлена, когда рыба нерестилась.
- Для каждого резервуара, в который сбрасывают эмбрионы, запишите следующую информацию.
- Кормите всех рыб.
- Установите температуру воды на 76 °F.
- Приготовьте живой корм.
- Кормовые рыбные #2.
- Зачерпните излишки пищи и мусора из резервуаров и очистите перед сбросом сетей.
3. Среда
- Повторите шаги 2.1-2.2. Соберите эмбрионы и промыть все племенные сетки.
- Берите данные о нересте, как и раньше.
- Выполняйте тесты воды, как и раньше.
- Кормите всех рыб.
- Установите температуру воды на 78 °F.
- Подготовьте живую ленту.
- Проверьте эмбрионы в инкубаторе.
- Очистите и измените воду эмбрионов в пальчиковых чашах, которые со временем будут использоваться для пополнения общего взрослого племенного поголовья. Используйте системную воду, обработанную метиленовым синим цветом.
- Снова покормите рыбу.
- Очищайте резервуары по мере необходимости и сбрасывайте сетки.
4. Четверг
- Повторите шаги 2.1-2.2. Собирайте эмбрионы, мойте и храните сетки для размножения.
- Берите данные о нересте, как и раньше.
- Установите температуру воды на 76 ° F.
- Очистите живую ленту.
- Очистите все отдельные резервуары.
- Проверьте эмбрионы в инкубаторе.
- Кормовые рыбные #2.
5. Пятница
- Кормите всех рыб.
- Установите температуру воды на 74 °F.
- Очистите живую ленту.
- Проверьте эмбрионы в инкубаторе.
6. Суббота
- Корм для рыб.
7. Воскресенье
- Корм для рыб.
Результаты
Как правило, мы разводим и нерестим потомков поверхностных рыб, первоначально собранных в Насимиенто-дель-Рио-Чой в Сан-Луис-Потоси, Мексика (поверхностная рыба Рио-Чой) и Сан-Соломон-Спрингс в государственном парке Балморхеа, штат Техас (техасская поверхностная рыба), и пещерных рыб, по?...
Обсуждение
Astyanax mexicanus - это новая биологическая модель, которая часто нерестится и может быть легко выведена в лаборатории1,2. Поскольку мы заинтересованы в механизмах развития, лежащих в основе эволюционных изменений в пещерных рыбах A. mexicanus, производство ?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим Дэвида Мартасяна, Дидре Хейзера, Эми Паркхерст, Крейга Фута и Мэнди Нг за ценный вклад в культурный центр лаборатории Джеффри A. mexicanus. Исследования в лаборатории Джеффри в настоящее время поддерживаются грантом NIH EY024941.
Материалы
| Name | Company | Catalog Number | Comments |
| Blackworms | Eastern Aquatics, Lancaster, PA | None | |
| Breeding Nets | Custom made | ||
| Brine shrimp eggs | AquaCave Lake Forest, IL. | None | |
| Colorimetric test kit | Petco | SKU:11916 | API Freshwater pH Test Kit |
| Egg yolk flakes | Pentair, Minneapolis, MN | None | |
| Fingerbowls | Carolina Biological Supply | 741004 | Culture dishes, 4.5 in, 250 mL |
| Hand held nets | Any Pet Store | ||
| Incubator for embryos | Fisher Scientific | 51-029-321HPM | 405 L |
| Instant Ocean sea salts | Spectrum Brands, Blacksburg, VA | None | |
| Methylene Blue | Sigma-Aldrich, St. Louis, MO | M9140 | |
| Pasteur Pipettes | Fisher Scientific | 13-678-20 | 5.75 in. |
| Net soaking solution | Any Pet Store | ||
| Nutrafin Cycle | Amazon | None | Bacterial boost |
| Refrigerator for live feed | Any source | ||
| Stereomicroscope | Any source | ||
| Thermometer | Any source | ||
| Tetra Tropical Crisps | Spectrum Brands, Blacksburg, VA | None |
Ссылки
- Jeffery, W. R. Cavefish as a model system in evolutionary developmental biology. Developmental Biology. 231, 1-12 (2001).
- Jeffery, W. R. Emerging model systems in evo-devo: cavefish and mechanisms of microevolution. Evolution & Development. 10, 265-272 (2008).
- Jeffery, W. R. Evolution and development in the cavefish Astyanax. Current Topics in Developmental Biology. 86, 191-221 (2009).
- Protas, M. E., et al. Genetic analysis of cavefish reveals molecular convergence in the evolution of albinism. Nature Genetics. 38, 107-111 (2006).
- Protas, M., Conrad, M., Gross, J. B., Tabin, C. J., Borowsky, R. Regressive evolution in the Mexican cave tetra, Astyanax mexicanus. Current Biology. 17, 452-454 (2007).
- O'Quin, K. E., Yoshizawa, M., Doshi, P., Jeffery, W. R. Quantitative genetic analysis of retinal degeneration in the blind cavefish. PLoS ONE. 8 (2), 57281 (2013).
- Yoshizawa, M., et al. Distinct genetic architecture underlies the emergence of sleep loss and prey-seeking behavior in the Mexican cavefish. BMC Biology. 13, 15 (2015).
- Elliot, W. R. The Astyanax caves of Mexico. Cavefishes of Tamaulipas, San Luis Potosi, and Guerrero. Association for Mexican Cave Studies Bulletin. 26, 1 (2018).
- Luo, S., Wu, B., Xiong, X., Wang, J. Effects of total hardness and calcium:magnesium ratio of water during early stages of rare minnows (Gobiocypris rarus). Comparative Medicine. 66, 181-187 (2016).
- Balasch, J. C., Tort, L. Netting the stress responses in fish. Frontiers in Endocrinology. 10, 62 (2019).
- Borowsky, R. . Determining the sex of adult Astyanax mexicanus. , (2008).
- Paschos, G. Circadian clocks, feeding time, and metabolic homeostasis. Frontiers in Pharmacology. 6, 112 (2015).
- Scheiermann, C., Kunisaki, Y., Frenette, P. S. Circadian control of the immune system. Nature Reviews Immunology. 13, 190-198 (2013).
- Williams, M. B., Watts, S. A. Current basis and future directions of zebrafish nutrigenomics. Genes & Nutrition. 14, 34 (2009).
- Harper, C., Wolf, J. C. Morphologic effects of the stress response in fish. ILAR Journal. 50, 387-396 (2009).
- Neubauer, P., Andersen, K. H. Thermal performance in fish is explained by an interplay between physiology, behavior and ecology. Conservation Physiology. 7 (1), 025 (2019).
- Hinaux, H., et al. Developmental staging table for Astyanax mexicanus. Zebrafish. 8 (4), (2011).
- Borowsky, R. . In vitro fertilization of Astyanax mexicanus. , (2008).
- Simon, V., Hyacinthe, C., Rétaux, S. Breeding behavior in the blind Mexican cavefish and its river-dwelling conspecific. PLoS One. 14 (2), 0212591 (2019).
- Harvey, B. J., Carolsfield, J. Induced Breeding in Tropical Fish Culture. International Development Research Centre. , (1993).
- Ma, L., Parkhurst, A., Jeffery, W. R. The role of a lens survival pathway including sox2 and aA-crystallin in the evolution of cavefish eye degeneration. EvoDevo. 5, 28 (2014).
- Krishnan, J., Rohner, N. Cavefish and the basis for eye loss. Philosophical Transactions of the Royal Society B: Biological Sciences. 5 (372), 20150487 (2017).
- Bilandžija, H., Abraham, L., Ma, L., Renner, K., Jeffery, W. R. Behavioral changes controlled by catecholaminergic systems explain recurrent loss of pigmentation in cavefish. Proceedings of the Royal Society. 285, (2018).
- Ma, L., Jeffery, W. R., Essner, J. J., Kowalko, J. E. Genome editing using TALENs in blind Mexican cavefish. PLoS ONE. 1093, 0119370 (2015).
- Klaassen, H., Wang, Y., Adamski, K., Rohner, N., Kowalko, J. E. CRISPR mutagenesis confirms the role of oca2 in melanin pigmentation in Astyanax mexicanus. Developmental Biology. 441, 313-318 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены