需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
模拟早期椎间盘疾病的发炎性、退行性器官培养模型。
* 这些作者具有相同的贡献
摘要
该协议提出了一种新的实验模型的发炎,退化牛器官培养,以模拟早期椎间盘退化。
摘要
症状性椎间盘 (IVD) 退化 (IDD) 是一个主要的社会经济负担,其特征是炎症和组织退化。由于缺乏因果疗法,迫切需要创新的实验器官培养模型,以研究疾病进展中涉及的机制,寻找治疗目标,减少对动物模型的需求。我们在这里展示一个新的,三维的器官培养模型协议,模仿发炎和催化微环境,这是在DD期间存在。
最初,牛的静脉注射器在组织培养介质中被解剖、清洁和培养。动态生理或病理负荷应用于定制生物反应器,每天2小时。IVDs被分配给一个对照组(高葡萄糖介质,生理负荷,磷酸盐缓冲盐水注射)和病理组(低葡萄糖介质,病理负荷,肿瘤坏死因子-阿尔法注射)四天。对IVD采集的细胞核细胞进行基因表达分析,对条件器官培养介质进行酶相关免疫分析。
我们的数据表明,与对照组相比,在病理组加载后,炎症标记的表达更高,圆盘高度降低。此协议是可靠的模拟IVD炎症和退化,可以进一步扩大其应用范围。
引言
背痛 (LBP) 可以影响所有年龄段的个人,是全世界残疾的主要原因1,2,3.与LBP相关的总成本每年超过1000亿美元4,5。症状性椎间盘 (IVD) 退化 (IDD), 一种以炎症和组织退化为特征的疾病, 是 LBP6,7的主要原因 .具体来说,IDD 的特点是 IVD 的细胞外基质 (ECM) 逐渐分解,由导致加速病理学、神经紊乱并最终残疾的多种因素诱导和触发。此外,IDD与释放发炎细胞因子、改变脊柱生物力学、血管生成和神经内生有关,这增加了疼痛感,共引起慢性LBP(主动不和谐)6,8。迄今为止,治疗方案包括切除术和随后融合相邻的椎骨,植入IVD假肢,或非手术方法,如非类固醇抗炎药物,阿片类药物,和肌肉松弛剂的IDD9患者。目前的标准治疗方案,外科和非手术,只是部分有效,未能解决潜在的生物学问题9,10。早期退行性椎间盘疾病的特点是初始炎症组织反应,特别是肿瘤坏死因子-阿尔法(TNF-阿尔法)表达11的增加。这些早期的椎间盘变化主要发生在细胞水平,而不会破坏光盘架构,以前可以模仿营养缺乏在亲炎症条件下12。因此,精确模拟体内情况,以调查这些退化机制,并找到合适的治疗目标至关重要。此外,在这些分子特性的模拟中,光盘的机械加载环境在IVD的病理和生理变化中起着关键作用。因此,结合这些方法将使我们向前迈出一步,以模拟体内静脉注射器的复杂微环境。目前没有研究考虑动态加载的方面,以及亲炎症和营养设置,以最好的我们所知。
虽然大型动物模型允许调查潜在的相关体内相互作用,他们是昂贵和工作密集型。此外,由于动物模型在研究中的使用长期以来一直是一个有争议的问题,因此减少回答重要研究问题所需的动物数量是人们非常感兴趣的。最后,目前还没有理想的动物模型模仿IDD在IVD研究13,14。因此,有必要建立一个具有成本效益和可靠的替代方法,例如一种器官培养模型,以模拟 IDD 以及相关的炎症和退行性过程。最近,本议定书的应用,建立一个发炎和退行性器官培养模型,以模拟早期椎间盘疾病,使我们能够研究抗炎药物在DD器官培养15的影响。
在这里,我们描述了如何获得牛椎间盘,并通过直接 α在低营养介质条件下在生物反应器中产生催化和增生微环境诱导早期 IDD 状态。 图1 说明了实验模型,并显示了用于模拟退行性和生理负荷条件的生物反应器。
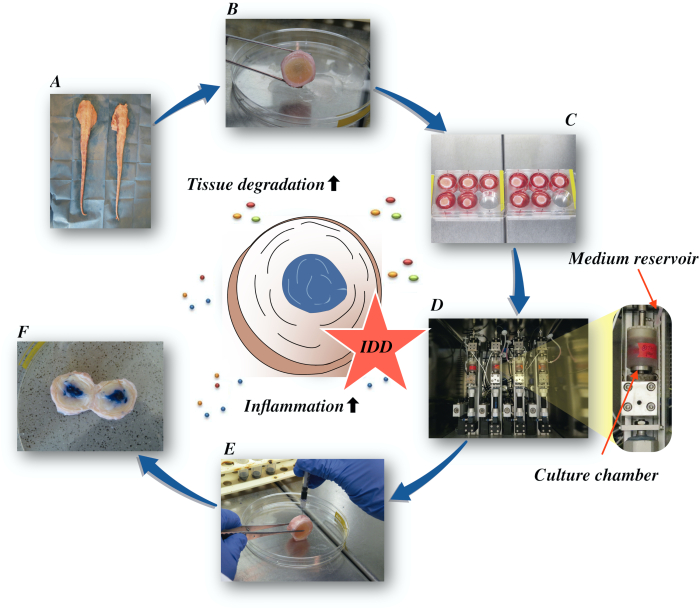
图1:实验设置的插图。A:牛尾巴: B:解剖牛间椎间盘: C:将光盘转移到具有文化媒介的井板: D:在生物反应器中加载模拟: E:静脉注射技术: F: 注射PBS/三潘蓝色染料后IVD显示分布。IDD:椎间盘退化。 请单击此处查看此图的较大版本。
Access restricted. Please log in or start a trial to view this content.
研究方案
实验是使用从当地屠宰场获得的牛尾巴进行的。本研究中使用的生物材料取自食物链,无需瑞士和欧洲法律的道德批准。
1. 牛椎间盘解剖
- 用自来水彻底冲洗整个尾巴,去除表面上的污垢和头发。
注:具有完好的解剖端,每尾最多可使用 9 IVD(共管 1-9)用于实验,具体取决于 IVD 的预期大小。考虑到所需的直径在15-20毫米之间,我们使用12条牛尾,每尾5IVD进行实验。 - 将整个尾巴浸入包含 1% 贝他丁溶液的盒子中 10 分钟。用无菌纱布短暂干燥尾巴,并将其放在无菌窗帘上。
注意:在解剖光盘时,用林格溶液湿纱布加湿尾部,以防止脱水。将用湿纱布包裹的尾部(或剩余部分)存放,直到完成整个解剖过程。 - 使用手术刀(第20号)尽可能从脊柱上完全切除软组织,以方便IVD的识别。用骨去除钳子去除椎骨的旋转和横向过程。
注:选择直径所需的 IVD。在目前的研究中使用了直径为15-20毫米的IVD。 - 用骨钳横向切割,穿过每个椎体的中间,以获得单独的运动段。将运动段放入带纱布的培养皿中,用林格的溶液湿润。
- 通过触觉定位IVD和椎骨,并通过轻轻地移动运动段。与 IVD 生长板中的带锯平行切割,IVD 每侧各一个。通过触摸和查找与圆盘(软)相邻的骨端板部分(硬)的凸形部位(从 IVD 向椎骨方向的安全距离约为 0.5-1 mm),确定生长板的位置。在切割椎骨时,确保带锯的叶片用林格的溶液冷却。
- 将IVD转移到干净的培养皿中,用干净的纱布与林格的溶液湿润。
注意:纱布应保湿,不要太湿,以防止IVD肿胀, - 使用手术刀刀片刮掉椎体(红/粉骨)、生长板(白色软骨),使末板完好无损(黄粉色)。使两个表面平整并行,用于加载过程。将刮过的 IVD 转移到新鲜的培养皿中,用林格的溶液将纱布弄湿。
注意:戴上链式邮件手套,在握住 IVD 和刮擦时保护手。 - 用卡钳测量圆盘的高度和直径。使用喷气式熔岩系统使用林格溶液清洁椎骨中的血块。
- 将 IVD 转移到 50 mL 塑料管,每管一个 IVD。每 IVD 添加 25 mL 磷酸盐缓冲盐水 (PBS) + 10% 青霉素/链霉素 (P/S),在室温下在轨道摇床上摇晃 15 分钟。
- 吸气超自然,并添加10毫升的PBS +1%P/S每IVD2分钟冲洗IVD。
2. IVD 培养和装载
- 将光盘转移到 IVD 腔室并添加 IVD 培养介质(杜尔贝科的改性鹰介质( DMEM , 4 . 5 g / L 高血糖 DMEM 用于生理组和 2 g / L 低血糖 DMEM 用于病理组) = 1% P / S = 2% 胎儿小腿血清 + 1% ITS (包含 5 μg / mL 胰岛素, 6 微克 / mL 转移素和 5 微克 / mL 酸) + 50 微克 / mL 阿斯焦酸盐 - 2 - 磷酸盐 + 1% 非必需氨基酸 + 50 微克 / mL 抗菌剂用于原细胞),并放置在孵化器中,在37°C, 85% 湿度和 5% CO2 。
- 根据实验组16,在生物反应器系统内培养光盘4天。在病理组中,将退行性装载条件维持在 0.32-0.5 MPa,5 Hz 为 2 小时/天。在生理控制组中,使用 0.02-0.2 MPa 的加载协议,0.2 Hz 为 2 小时/天。
注意:在装载过程中将 IVD 放置在包含 5 mL IVD 介质的腔室中。体积取决于生物反应器装载室的大小。在加载程序之间,将 IVD 放在六井板中,并配有 7 mL IVD 培养介质,以进行自由膨胀恢复。 - 用于分析实验期间光盘高度的变化,请在 IVD 解剖(基线)后用卡钳测量光盘高度,然后在自由膨胀期后和实验持续时间的动态加载后每天测量光盘高度。
3. 内分膜肿瘤坏死因子-阿尔法(TNF-α)注射
- 在第 1 天的第一个动态加载周期之后,将 IVD 放在垂直位置的培养皿中,然后用钳子稳定 IVD。
- 用30口径胰岛素针将重组TNF-α(每IVD70μL中的100 ng)注射到病理组17的细胞核纸浆组织中。在1分钟内以大约70μL的速度缓慢注射。
- 注射后,将注射器拉回 IVD 的中途,然后拉注射器柱塞,以创建一个真空,防止注射溶液向后泄漏,然后从 IVD 中完全取出针头和注射器。
注意:通过注射含有试锅蓝色染料的PBS进行试验,以评估加载后和隔夜培养后注射溶液的分布。
4. 基因表达
- 在第4天收获试管婴儿。用活检冲床收集细胞核纸浆 (NP) 组织(IVD 中间的凝胶部分)。用手术刀刀片(第20号)收集外环纤维(AF)。
注意:对于第 0 天的基线参考,解剖后立即收集组织以提取 RNA。 - 根据实验设计,使用基因表达分析所需的NP或AF组织量。
注:在目前的实验中,使用了大约150毫克的组织。RNA 分离溶液与组织质量的比例应至少为每 100-150 毫克组织 2 mL,以便高效提取。 - 用消化溶液(DMEM中的 0.2% 蛋白酶,过滤灭菌)消化 NP 或 AF 组织,在 37 °C 处孵育 1 小时,磁搅拌18。
- 使用液氮将组织样本闪冻,粉碎成细粉末。将粉碎的组织粉末均等地分成两个 2 mL 管,每个管子在单相溶液(RNA 隔离溶液)中含有 1 mL 的瓜尼丁硫氰酸酯和酚。
- 在包含RNA隔离溶液和粉碎组织粉的2mL管中执行均质化。将组织粉末同质化 5 倍,使用 8 毫米不锈钢球和 30 Hz 的组织解压器 3 分钟。离心机在12,000 x g,4 °C 10 分钟,并将超自然体转移到一个新的管子.超自然人可以储存在-80°C至少一个月。
- 每 1 mL RNA 隔离溶液添加 0.1 mL 的 1-溴-3-氯氯烷 (BCP),并大力摇动 15 秒。在室温下将产生的混合物存放在轨道摇床上15分钟,在4°C时将离心机储存在12,000 x g 上15分钟。
注:RNA仅停留在上部注明阶段。 - 将水相转移到一个新的管子中,用0.25毫升的异丙酚和0.25mL的高盐降水溶液沉淀RNA沉淀RNA,每1mLRNA隔离溶液用于初始同质化。在室温下将样品存放在轨道摇床和离心机上 15 分钟,在 4 °C 下 储存 8 分钟。
注:或者,使用基于列的RNA提取方法,通常会导致RNA纯度更高,但RNA产量较低。 - 去除超自然体,用用于初始同质化的 1 mL 75% 乙醇洗净 RNA 颗粒。离心机在7,500 x g 5分钟在4°C。
- 取出乙醇洗涤,并短暂地空气干燥RNA颗粒3-5分钟。通过几次通过移液器尖端传递溶液,并在 55-60 °C 下孵育 10-15 分钟,将 RNA 溶解在 20μL 的二乙基碳酸氢酸酯 (DEPC) 处理水中。
- 测量吸收度分别为230纳米、260纳米和280纳米(A230、A260和A280)。1.0 的 A260 对应于 40μg/mL RNA。预计A260/A280比为1.6-1.9,而污染导致A260/A280比<1.6。
- 为 20 μL 反应量准备反向转录酶 (RT) 反应组合。该混合物包含RT酶混合物、核糖核蛋白(RgCl)和0.4μg的RNA样品。
- 简要离心机 RT 管混合管底部的所有组件。
- 将样品放在恒温器仪器中。为 RT 选择适当的程序。 在 25 °C 下运行 RT 10 分钟,然后在 42 °C 时反向转录步骤 120 分钟,在 85 °C 时停止使用反向转录酶 5 分钟,最后冷却至 4 °C。
- 用三聚氰胺(羟基甲基)氨基甲烷(三聚氰胺)-乙酰胺乙酰酸(EDTA)缓冲(10米三聚氰胺和1m EDTA)稀释产生的cDNA,最终浓度为0.4微克RNA,用于每100μL cDNA溶液的RT。将 cDNA 样品存储在 -20 °C。
- 使用 10 μL 反应量执行实时聚合酶链反应 (PCR)。反应量包含主混合物(包含DNA聚合酶、尿素-DNA糖酶、 dNTP 具有 dUTP、被动参考和优化缓冲组件)、前置物 45μM、反向引物 45 μM、探头 12.5 μM(包含与探头 5' 端相连的记者染料、探头 3' 端的轻微凹槽粘合剂以及探头 3' 端的无荧光淬火器),2μL cDNA和DEPC处理的水。
- 使用 2-ΔΔCT 方法19运行内源控制 (RPLP0) 进行相对定量。
- 将样品添加重复,通过添加TE缓冲区而不是cDNA运行无模板控制。在标准条件下运行 PCR(2 分钟在 50 °C,10 分钟在 95 °C,40 周期 15 秒在 95 °C,1 分钟在 60 °C)。
- 按照比较CT方法对mRNA目标进行相对定量。将mRNA规范化到基线样本的量计算为2-ΔΔCT,而ΔΔCT是样本的ΔCT(CT靶点-CT内源性控制)与基线样本的ΔCT(CT靶点和CT内源性控制)之间的差值。
5. IVD介质中蛋白质含量的定量
- 收集由 IVD 样本调节的介质,以测量介质中的蛋白质含量。根据目标蛋白质的协议执行酶相关免疫分析 (ELISA)。
- 根据制造商的指示,牛间白血病-8 (IL-8) 由抗牛 IL8 ELISA 套件进行量化。
Access restricted. Please log in or start a trial to view this content.
结果
低血糖介质的退行性负荷与TNF-α注射相结合,导致蛋白标记物的基因表达显著增加,白细胞介质6(IL-6)和白细胞介质8(IL-8)与NP细胞中的生理对照组相比,经过4天的培养(图2)。相比之下,我们没有观察到NP细胞中蛋白1+(IL-1+)和TNF-α的发炎基因发生显著变化(未显示数据)。此外,退化培养条件并没有改变IL-6和IL-8在AF细胞中的基因表达。
Access restricted. Please log in or start a trial to view this content.
讨论
我们在这里提供了一个详细的协议,以模拟退行性和炎症性IVDD。此协议可用于对导致对光盘的破坏性影响的炎症通路进行详细检查。此外,该协议可以帮助确定在疾病进展中涉及的有希望的治疗目标。
我们最近发现,人类重组TNF-α可诱发牛和人类NP细胞21的炎症,这是根据该领域的其他研究证实,TNF-α可用于炎症模拟IVD细胞22,23。...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
这项工作得到了 AO 基金会和 AO 斯平国际的支持。巴巴克·萨拉维得到了德国脊柱基金会和德国骨关节炎基金会的奖学金支持。格诺特·朗得到了德国弗赖堡大学医学院高级临床科学家贝尔塔-奥滕斯坦方案的支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 1-Bromo-3-chloropropane(BCP) | Sigma-Aldrich, St. Louis, USA | B9673 | |
| Ascorbate-2-phosphate | Sigma-Aldrich, St. Louis, USA | A8960 | |
| Band saw | Exakt Apparatebau, Norderstedt, Germany | model 30/833 | |
| Betadine | Munndipharma, Frankfurt, Germany | ||
| Bovine IL-8 Do.it-Yourself ELISA | Kingfisher Biotech, St. Paul, USA | DIY1028B-003 | |
| Corning ITS Premix | Corning Inc., New York, USA | 354350 | |
| DMEM high glucose | Gibco by life technologies, Carlsbad, USA | 10741574 | |
| DMEM low glucose | Gibco by life technologies, Carlsbad, USA | 11564446 | |
| Ethanol for molecular biology | Sigma-Aldrich, St. Louis, USA | 09-0851 | |
| Fetal Bovine Serum (FBS) | Gibco by life technologies, Carlsbad, USA | A4766801 | |
| Non-essential amino acid solution | Gibco by life technologies, Carlsbad, USA | 11140050 | |
| Penicillin/Streptomycin(P/S) | gibco by life technologies, Carlsbad, USA | 11548876 | |
| Phosphate Buffer Solution, tablet | Sigma-Aldrich, St. Louis, USA | P4417 | |
| Pronase | Sigma-Aldrich, St. Louis, USA | 10165921001 | |
| Primocin | InvivoGen, Sandiego, USA | ant-pm-05 | |
| Pulsavac Jet Lavage System | Zimmer, IN,USA | ||
| TissueLyser II | Quiagen, Venlo, Netherlands | 85300 | |
| Streptavidinn-HRP | Kingfisher Biotech, St. Paul, USA | AR0068-001 | |
| Superscript VILO | Invitrogen by life Technologies, Carlsbad, USA | 10704274 | |
| cDNA Synthesis Kit | Applied Biosystems by life technologies | 10400745 | |
| TaqMan Universal Master Mix | Applied Biosystems by life technologies | ||
| TNF-alpha, recombinant human protein | R&D systems, Minnesota, USA | 210-TA-005 | |
| TRI Reagent | Molecular Research Center, Cincinnati, USA | TR 118 | |
| Tris-EDTA buffer solution | sigma-Aldrich, St. Louis, USA | 93283 | |
| Gene bIL-6 | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTC CAA AAA TGG AGG AAA AGG A Primer rev (5′–3′) TCC AGA AGA CCA GCA GTG GTT Probe (5′FAM/3′TAMRA) CTT CCA ATC TGG GTT CAA TCA GGC GATT |
| Gene bIL8 | Applied Biosystems by life technologies | Bt03211906_m1 | |
| Gene bTNF-alpha | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) CCT CTT CTC AAG CCT CAA GTA ACA A Primer rev (5′–3′) GAG CTG CCC CGG AGA GTT Probe (5′FAM/3′TAMRA) ATG TCG GCT ACA ACG TGG GCT ACC G |
| GENE bIL1beta | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTA CTA CAG TGA CGA GAA TGA GCT GTT Primer rev (5′–3′) GGT CCA GGT GTT GGA TGC A Probe (5′FAM/3′TAMRA) CTC TTC ATC TGT TTA GGG TCA TCA GCC TCA A |
| RPLP0 | Applied Biosystems by life technologies | Bt03218086_m1 |
参考文献
- Vos, T., et al. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet. 390 (10100), 1211-1259 (2017).
- Hoy, D., et al. Measuring the global burden of low back pain. Best Practice & Research Clinical Rheumatology. 24 (2), 155-165 (2010).
- Thiese, M. S., et al. Prevalence of low back pain by anatomic location and intensity in an occupational population. BMC Musculoskeletal Disorders. 15 (1), 283(2014).
- Katz, J. N. Lumbar Disc Disorders and Low-Back Pain: Socioeconomic Factors and Consequences. The Journal of Bone and Joint Surgery (American). 88, suppl_2 21(2006).
- Vlaeyen, J. W. S., et al. Low back pain. Nature Reviews Disease Primers. 4 (1), 52(2018).
- Khan, A. N., et al. Inflammatory biomarkers of low back pain and disc degeneration: a review: Biomarkers of disc degeneration and back pain. Annals of the New York Academy of Sciences. 1410 (1), 68-84 (2017).
- Kim, H. S., Wu, P. H., Jang, I. T. Lumbar Degenerative Disease Part 1: Anatomy and Pathophysiology of Intervertebral Discogenic Pain and Radiofrequency Ablation of Basivertebral and Sinuvertebral Nerve Treatment for Chronic Discogenic Back Pain: A Prospective Case Series and Review of Literature. International Journal of Molecular Sciences. 21 (4), 1483(2020).
- Adams, M. A., Roughley, P. J. What is Intervertebral Disc Degeneration, and What Causes It. Spine. 31 (18), 2151-2161 (2006).
- Wu, P. H., Kim, H. S., Jang, I. T. Intervertebral Disc Diseases Part 2: A Review of the Current Diagnostic and Treatment Strategies for Intervertebral Disc Disease. International Journal of Molecular Sciences. 21 (6), 2135(2020).
- Lurie, J. D., et al. Surgical Versus Nonoperative Treatment for Lumbar Disc Herniation: Eight-Year Results for the Spine Patient Outcomes Research Trial. Spine. 39 (1), 3-16 (2014).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews Rheumatology. 10 (1), 44-56 (2014).
- Ponnappan, R. K., et al. An organ culture system to model early degenerative changes of the intervertebral disc. Arthritis Research & Therapy. 13 (5), 171(2011).
- O'Connell, G. D., Vresilovic, E. J., Elliott, D. M. Comparison of Animals Used in Disc Research to Human Lumbar Disc Geometry. Spine. 32 (3), 328-333 (2007).
- Stannard, J. T., et al. Development of a whole organ culture model for intervertebral disc disease. Journal of Orthopaedic Translation. 5, 1-8 (2016).
- Li, Z., et al. Preclinical ex-vivo Testing of Anti-inflammatory Drugs in a Bovine Intervertebral Degenerative Disc Model. Frontiers in Bioengineering and Biotechnology. 8, 583(2020).
- Li, Z., et al. Development of an ex vivo cavity model to study repair strategies in loaded intervertebral discs. European Spine Journal. 25 (9), 2898-2908 (2016).
- Kazezian, Z., Li, Z., Alini, M., Grad, S., Pandit, A. Injectable hyaluronic acid down-regulates interferon signaling molecules, IGFBP3 and IFIT3 in the bovine intervertebral disc. Acta Biomaterialia. 52, 118-129 (2017).
- Caprez, S., Menzel, U., Li, Z., Grad, S., Alini, M., Peroglio, M. Isolation of high-quality RNA from intervertebral disc tissue via pronase predigestion and tissue pulverization. JOR Spine. 1 (2), 1017(2018).
- Lopa, S., Ceriani, C., Cecchinato, R., Zagra, L., Moretti, M., Colombini, A. Stability of housekeeping genes in human intervertebral disc, endplate and articular cartilage cells in multiple conditions for reliable transcriptional analysis. European Cells & Materials. 31, 395-406 (2016).
- Lang, G., et al. An intervertebral disc whole organ culture system to investigate proinflammatory and degenerative disc disease condition. Journal of Tissue Engineering and Regenerative Medicine. 12 (4), 2051-2061 (2018).
- Du, J., et al. Proinflammatory intervertebral disc cell and organ culture models induced by tumor necrosis factor alpha. JOR Spine. 3, 1104(2020).
- Purmessur, D., Walter, B. A., Roughley, P. J., Laudier, D. M., Hecht, A. C., Iatridis, J. A role for TNFα in intervertebral disc degeneration: A non-recoverable catabolic shift. Biochemical and Biophysical Research Communications. 433 (1), 151-156 (2013).
- Walter, B. A., Likhitpanichkul, M., Illien-Junger, S., Roughley, P. J., Hecht, A. C., Iatridis, J. C. TNFα Transport Induced by Dynamic Loading Alters Biomechanics of Intact Intervertebral Discs. PLOS One. 10 (3), 0118358(2015).
- Gullbrand, S. E., et al. A large animal model that recapitulates the spectrum of human intervertebral disc degeneration. Osteoarthritis and Cartilage. 25 (1), 146-156 (2017).
- Willems, N., et al. Safety of intradiscal injection and biocompatibility of polyester amide microspheres in a canine model predisposed to intervertebral disc degeneration: intradiscal application of pea microspheres. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 105 (4), 707-714 (2017).
- Michalek, A. J., Buckley, M. R., Bonassar, L. J., Cohen, I., Iatridis, J. C. The effects of needle puncture injury on microscale shear strain in the intervertebral disc annulus fibrosus. The Spine Journal. 10 (12), 1098-1105 (2010).
- Illien-Jünger, S., et al. The combined effects of limited nutrition and high-frequency loading on intervertebral discs with endplates. Spine. 35 (19), 1744-1752 (2010).
- Gantenbein, B., et al. Organ culture bioreactors--platforms to study human intervertebral disc degeneration and regenerative therapy. Current Stem Cell Research & Therapy. 10 (4), 339-352 (2015).
- Boubriak, O. A., Watson, N., Sivan, S. S., Stubbens, N., Urban, J. P. G. Factors regulating viable cell density in the intervertebral disc: blood supply in relation to disc height. Journal of Anatomy. 222 (3), 341-348 (2013).
- Maroudas, A., Stockwell, R. A., Nachemson, A., Urban, J. Factors involved in the nutrition of the human lumbar intervertebral disc: cellularity and diffusion of glucose in vitro. Journal of Anatomy. 120, Pt 1 113-130 (1975).
- Beckstein, J. C., Sen, S., Schaer, T. P., Vresilovic, E. J., Elliott, D. M. Comparison of Animal Discs Used in Disc Research to Human Lumbar Disc: Axial Compression Mechanics and Glycosaminoglycan Content. Spine. 33 (6), 166-173 (2008).
- Walter, B. A., Illien-Jünger, S., Nasser, P. R., Hecht, A. C., Iatridis, J. C. Development and validation of a bioreactor system for dynamic loading and mechanical characterization of whole human intervertebral discs in organ culture. Journal of Biomechanics. 47 (9), 2095-2101 (2014).
- Rajan, N. E., et al. Toll-Like Receptor 4 (TLR4) Expression and Stimulation in a Model of Intervertebral Disc Inflammation and Degeneration. Spine. 38 (16), 1343-1351 (2013).
- vanden Akker, G. G., Rorije, A. J., Davidson, E. N. B., vander Kraan, P. M. Phenotypic marker genes distinguish inner and outer annulus fibrosus from nucleus pulposus tissue in the bovine intervertebral disc. Osteoarthritis and Cartilage. 25, 402(2017).
- Du, J., et al. Functional cell phenotype induction with TGF-β1 and collagen-polyurethane scaffold for annulus fibrosus rupture repair. European Cells & Materials. 39, 1-17 (2020).
- Risbud, M. V., et al. Defining the phenotype of young healthy nucleus pulposus cells: recommendations of the Spine Research Interest Group at the 2014 annual ORS meeting. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 33 (3), 283-293 (2015).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。