Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
A Proinflammatory, Degenerative Organ Culture Model to Simulate Early-Stage Intervertebral Disc Disease.
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo presenta un modelo experimental nuevo de la cultura proinflamatoria, degenerativa del órgano bovino para simular la degeneración intervertebral del disco de la temprano-etapa.
Resumen
La degeneración intervertebral sintomática del disco (IVD) (IDD) es una carga socioeconómica importante y es caracterizada por la inflamación y la degradación del tejido. Debido a la falta de terapias causales, existe una necesidad urgente de modelos experimentales innovadores de cultivo de órganos para estudiar los mecanismos involucrados en la progresión de la enfermedad, encontrar dianas terapéuticas y reducir la necesidad de modelos animales. Aquí presentamos una novela, protocolo tridimensional del modelo de la cultura del órgano mímico el microambiente proinflammatory y catabólico, que está presente durante IDD.
Inicialmente, IVDs caudal bovino fue diseccionado, limpiado, y cultivado en el medio de cultivo del tejido. El cargamento fisiológico o patológico dinámico fue aplicado en un biorreactor a medida por 2 horas por día. Ivds fue asignado a un grupo de control (alto medio de la glucosa, cargamento fisiológico, inyección salina fosfato-tamponada) y a un grupo patológico (medio bajo de la glucosa, cargamento patológico, inyección de la factor-alfa de la necrosis de tumor) por cuatro días. El análisis de la expresión génica de las células pulposus recogidas del núcleo del IVDs y del análisis enzima-ligado del inmunosorbente de los medios condicionados de la cultura del órgano fue realizado.
Nuestros datos revelaron una mayor expresión de marcadores inflamatorios y alturas de disco reducidas después de la carga en el grupo patológico en comparación con el grupo control. Este protocolo es confiable para simular la inflamación y la degeneración de IVD y se puede ampliar más a fondo para ampliar su alcance del uso.
Introducción
El dolor lumbar (LUMB) puede afectar a individuos de todas las edades y es una de las principales causas de discapacidad en todo el mundo1,2,3. El costo total asociado con la lumbalgia supera los $100 mil millones por año4,5. La degeneración intervertebral sintomática del disco (IVD), una condición caracterizada por la inflamación y la degradación del tejido, es una causa importante de LBP6,7. Específicamente, idd es caracterizado por una avería gradualmente de evolución de la matriz extracelular de IVD (ECM), inducida y accionada por los factores múltiples que llevan a una patología acelerada, a los desordenes neurológicos, y eventual a la inhabilidad. Además, la IDD se asocia con la liberación de citoquinas proinflamatorias, biomecánica de columna alterada, angiogénesis y crecimiento nervioso, lo que aumenta la sensación de dolor, causando en conjunto LBP crónica (discopatía activa)6,8. Hasta la fecha, las opciones de tratamiento incluyen discectomía y posterior fusión de las vértebras adyacentes, implantación de una prótesis de IVD o enfoques no quirúrgicos, como fármacos antiinflamatorios no esteroideos, opioides y relajantes musculares para pacientes con IDD9. Las dos opciones terapéuticas estándar actuales, quirúrgicas y no quirúrgicas, son sólo parcialmente eficaces y no abordan el problema biológico subyacente9,10. La enfermedad degenerativa del disco en estadio temprano se caracteriza por una respuesta tisular inflamatoria inicial, especialmente un aumento en la expresión del factor de necrosis tumoral alfa (TNF-alfa)11. Estos cambios tempranos en el disco ocurren principalmente a nivel celular sin interrumpir la arquitectura del disco y previamente podrían ser imitados por la deficiencia nutricional en condiciones proinflamatorias12. Por lo tanto, la simulación precisa de la situación in vivo para investigar estos mecanismos de degeneración y encontrar dianas terapéuticas adecuadas es crucial. Además, para estas simulaciones de propiedades moleculares, el entorno de carga mecánica de los discos juega un papel clave en los cambios patológicos y fisiológicos de la IVD. En consecuencia, la combinación de estos enfoques nos traería un paso adelante para imitar el complejo microambiente de los IVDs in vivo. Actualmente no hay estudios que consideren el aspecto de la carga dinámica junto con el ajuste favorable-inflamatorio y alimenticio al mejor de nuestro conocimiento.
Aunque los modelos animales grandes permiten la investigación de posibles interacciones in vivo relevantes, son costosos y requieren mucho trabajo. Además, dado que el uso de modelos animales en la investigación ha sido durante mucho tiempo un tema de controversia, la reducción del número de animales necesarios para responder a importantes preguntas de investigación es de gran interés. Por último, actualmente no existe un modelo animal ideal para imitar el IDD en la investigacióndel IVD 13,14. Por lo tanto, es necesario establecer un reemplazo rentable y confiable, como un modelo de cultivo de órganos para simular la IDD y los procesos inflamatorios y degenerativos asociados. Recientemente, la aplicación del presente protocolo sobre el establecimiento de un modelo de cultivo de órganos proinflamatorios y degenerativos para simular la enfermedad del disco intervertebral en estadio temprano nos permitió investigar el efecto de los fármacos antiinflamatorios en el cultivo de órganos IDD15.
Aquí, describimos cómo obtener los discos intervertebrales bovinos e inducir el estado de idd de la temprano-etapa vía un microambiente catabólico y proinflammatory causado por la inyección intradiscal directa de la factor-alfa de la necrosis de tumor (TNF-α) y del cargamento degenerativo en un biorreactor bajo condiciones medias nutritivas bajas. La Figura 1 ilustra el modelo experimental y muestra el biorreactor utilizado para simular condiciones de carga degenerativas y fisiológicas.
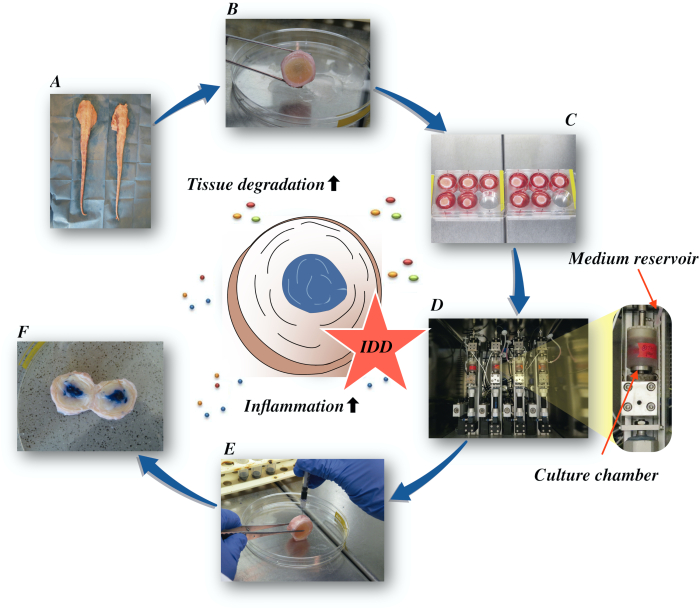
Figura 1:Ilustración de la configuración experimental. A: cola de bovino; B: discos intervertebrales bovinos disecados; C: transferencia del disco a un pozo-plato con medio de cultivo; D: carga de la simulación en un biorreactor; E: técnica de inyección intradiscal; F: IVD después de la inyección de PBS/tinte azul tripano para revelar la distribución. IDD: degeneración del disco intervertebral. Haga clic aquí para ver una versión más amplia de esta figura.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Los experimentos se realizaron utilizando colas de bovino obtenidas de mataderos locales. Los materiales biológicos utilizados en el presente estudio se toman de la cadena alimentaria y no requieren aprobación ética en la legislación suiza y europea.
1. Disección del disco intervertebral bovino
- Enjuague bien toda la cola con agua del grifo para eliminar la suciedad y el vello en la superficie.
NOTA: Con los extremos intactos, distales, un máximo de 9 IVDs (coccygeal 1-9) por cola se puede utilizar para los experimentos dependiendo del tamaño deseado de los IVDs. Teniendo en cuenta el diámetro deseado entre 15-20 mm, se utilizaron 12 colas bovinas con 5 IVDs por cola para los experimentos. - Sumergir toda la cola en una caja que contenga una solución de betadina al 1% durante 10 min. Seque brevemente la cola con gasa estéril y colóquela en una cortina estéril.
NOTA: Durante la disección del disco, humidifique las colas con la gasa humedeceda en solución de Ringer para evitar la deshidratación. Guarde las colas (o los segmentos sobrantes) envueltos en gasa húmeda hasta que se complete todo el procedimiento de disección. - Use un bisturí (No. 20) para eliminar el tejido blando lo más completamente posible de la columna vertebral caudal para facilitar la identificación de los IVDs. Retire los procesos espinosos y transversales de las vértebras con alicates de extracción ósea.
NOTA: Seleccione ivds con el diámetro deseado. Ivds con una gama del diámetro de 15-20 milímetros fue utilizado en el estudio actual. - Cortar transversalmente con alicates óseos a través de la mitad de cada cuerpo vertebral para obtener segmentos de movimiento individuales. Coloque segmentos de movimiento en una placa de Petri con gasa mojada con la solución de Ringer.
- Localice la IVD y la vértebra por palpación y moviendo los segmentos de movimiento suavemente. Haga dos cortes paralelos con la sierra de banda en la placa de crecimiento de los IVDs, uno a cada lado del IVD. Identifique la ubicación de la placa de crecimiento tocando y encontrando el sitio convexo de la parte ósea del endplate (dura) adyacente al disco (suave) con una distancia de seguridad de aproximadamente 0.5-1 mm desde la IVD hacia la vértebra. Asegúrese de que la hoja de la sierra de banda se enfríe con la solución de Ringer mientras corta las vértebras.
- Transfiera ivds en una placa de Petri limpia con la gasa limpia mojada con la solución del campanero.
NOTA: La gasa debe estar humedeceda y no demasiado húmeda para prevenir la hinchazón de los IVDs, - Use la hoja del bisturí para raspar el cuerpo vertebral (hueso rojo/rosado), la placa de crecimiento (cartílago blanco), deje el endplate intacto (amarillo-rosado). Haga que las dos superficies sean planas y paralelas para el procedimiento de carga. Transfiera los IVDs raspados a una placa de Petri fresca con la gasa mojada con la solución del campanero.
NOTA: Use un guante de correo de cadena para proteger la mano mientras sostiene el IVD y raspa. - Mida la altura y el diámetro del disco con una pinza. Limpie los coágulos de sangre en el hueso de las vértebras con la solución de Ringer usando un sistema de lavado a chorro.
- Transfiera los IVDs a 50 mL de tubos de plástico, un IVD por tubo. Agregue 25 mL de solución salina tamponada con fosfato (PBS) + 10% de penicilina/estreptomicina (P/S) por IVD y déjela temblando durante 15 minutos en una coctelera orbital a temperatura ambiente.
- Aspirar el sobrenadante y añadir 10 mL de PBS + 1% P/S por IVD durante 2 min para enjuagar los IVDs.
2. Cultivo y carga de IVD
- Transferir discos a cámaras de IVD y añadir medio de cultivo de IVD (Dulbecco's Modified Eagle Medium (DMEM, 4.5 g/L de DMEM de alta glucosa para el grupo fisiológico y 2 g/L de DMEM de glucosa baja para el grupo patológico) + 1% P/S + 2% suero de ternero fetal + 1% ITS (contiene 5 μg/mL de insulina, 6 μg/mL de transferrina y 5 ng/mL de ácido selenious) + 50 μg/mL de ascorbato-2-fosfato + 1% de aminoácido no esencial + 50 μg/mL de agente antimicrobiano para células primarias) y colocarlos en una incubadora a 37 °C, 85% y humedad 5% CO2.
- Cultivo de los discos durante 4 días dentro de un sistema biorreactor según grupos experimentales16. En el grupo patológico, mantener condiciones de carga degenerativas a 0.32-0.5 MPa, 5 Hz durante 2 h/día. En el grupo de control fisiológico, utilice un protocolo de carga de 0.02-0.2 MPa, 0.2 Hz durante 2 h/día.
NOTA: Coloque los IVDs en cámaras que contengan 5 mL de medio IVD durante los procedimientos de carga. El volumen depende del tamaño de las cámaras de carga del biorreactor. Entre los procedimientos de carga, coloque los IVDs en placas de seis pozos con 7 mL de medio de cultivo de IVD para la recuperación de hinchazón libre. - Para analizar los cambios en la altura del disco durante el período experimental, mida la altura del disco con una pinza después de la disección ivd (línea de base) y luego diariamente después del período de hinchazón libre y después de la carga dinámica durante la duración experimental.
3. Inyección intradiscal del factor-alfa de la necrosis de tumor (TNF-α)
- Directamente después del primer ciclo de carga dinámica en el día 1, coloque los IVDs en una placa de Petri en una posición vertical y estabilice los IVDs con una pinza.
- Inyecte TNF-α recombinante (100 ng en 70 μL de PBS por IVD) con una aguja de insulina de calibre 30 en el tejido pulposo del núcleo del grupo patológico17. Inyecte lentamente a una velocidad de aproximadamente 70 μL en 1 min.
- Después de la inyección, tire de la jeringa a la mitad del IVD y tire del émbolo de la jeringa para crear un vacío que evite que la solución inyectada se escape hacia atrás, antes de retirar la aguja y la jeringa completamente del IVD.
NOTA: Realice un experimento piloto inyectando PBS que contiene tinte azul tripano para evaluar la distribución de la solución inyectada después de la carga y el cultivo nocturno.
4. Expresión génica
- Cosechar los IVDs el día 4. Recoja el tejido pulposo del núcleo (NP) (parte gelly en el medio de IVD) con un punzón de la biopsia. Recoger el anillo externo fibroso (AF) con una hoja de bisturí (No.20).
NOTA: Para la referencia basal en el día 0, recoger los tejidos inmediatamente después de la disección para la extracción de ARN. - Utilice la cantidad de tejido NP o AF necesaria para el análisis de expresión génica, dependiendo del diseño experimental.
NOTA: Para los actuales experimentos, el tejido del magnesio aproximadamente 150 fue utilizado. La proporción de solución de aislamiento de ARN a la masa tisular debe ser de al menos 2 mL por tejido de 100-150 mg para una extracción eficiente. - Digerir el tejido NP o AF con la solución de digestión (pronasa al 0,2% en DMEM, filtro esterilizado) e incubar durante 1 h a 37 °C con agitación magnética18.
- Flash-congelar las muestras de tejido utilizando nitrógeno líquido y pulverizar a un polvo fino. Divida el polvo de tejido pulverizado por igual en dos tubos de 2 mL cada uno que contenga 1 mL de tiocianato de guanidina y fenol en una solución monofásica (solución de aislamiento de ARN).
- Realizar la homogeneización en tubos de 2 mL que contengan la solución de aislamiento de ARN y el polvo de tejido pulverizado. Homogeneizar el polvo de tejido 5x con una bola de acero inoxidable de 8 mm y un lyzer de tejido a 30 Hz durante 3 min. Centrífuga a 12.000 x g,4 °C durante 10 min y transferir el sobrenadante a un tubo fresco. Los sobrenadantes se pueden almacenar a -80 °C durante al menos un mes.
- Añadir 0,1 mL de 1-bromo-3-cloropropano (BCP) por 1 mL de solución de aislamiento de ARN y agitar vigorosamente durante 15 s. Guarde la mezcla resultante a temperatura ambiente en una coctelera orbital durante 15 min y la centrífuga a 12.000 x g durante 15 min a 4 °C.
NOTA: El ARN permanece exclusivamente en la fase acuosa superior. - Transfiera la fase acuosa a un tubo fresco y precipite el ARN con 0,25 mL de isopropanol y 0,25 mL de solución de alta precipitación salina por 1 mL de solución de aislamiento de ARN utilizada para la homogeneización inicial. Guarde las muestras a temperatura ambiente durante 15 minutos en una coctelera orbital y la centrifugadora a 12.000 x g durante 8 min a 4 °C.
NOTA: Alternativamente, utilice el método de extracción de ARN basado en columnas que generalmente conduce a una mayor pureza de ARN pero un menor rendimiento de ARN. - Retire el sobrenadante y lave el pellet de ARN con 1 mL de etanol al 75% por 1 mL de solución de aislamiento de ARN utilizada para la homogeneización inicial. Centrífuga a 7.500 x g durante 5 min a 4 °C.
- Retire el lavado de etanol y seque brevemente al aire pellet de ARN durante 3-5 min. Disuelva el ARN en 20 μL de agua tratada con dietilpirocarbonato (DEPC) pasando la solución unas cuantas veces a través de una punta de pipeta e incubando durante 10-15 min a 55-60 °C.
- Mida la absorbancia a 230 nm, 260 nm y 280 nm (A230, A260 y A280 respectivamente). A260 de 1,0 corresponde a 40 μg/mL de ARN. Se espera una relación A260/A280 de 1,6-1,9, mientras que la contaminación da lugar a una relación A260/A280 de <1,6.
- Prepare una mezcla de reacción de transcriptasa inversa (RT) para un volumen de reacción de 20 μL. La mezcla contiene mezcla de enzimas RT, inhibidor de la ribonucleasa, proteína ayudante, cebadores, dNTPs, MgCl2,agua libre de ARNasa y 0,4 μg de muestra de ARN.
- Centrifugar brevemente los tubos RT para mezclar todos los componentes en la parte inferior del tubo.
- Coloque las muestras en el instrumento termociclor. Seleccione el programa apropiado para el RT. Ejecute el RT durante 10 min a 25 °C, seguido del paso de transcripción inversa durante 120 min a 42 °C y la inactivación de la transcriptasa inversa durante 5 min a 85 °C, enfriándola hasta 4 °C al final.
- Diluir el ADNc resultante con tampón tris(hidroximetil)aminometano (Tris)-ácido etilendiaminotetraacético (EDTA) (TE) (10 mM Tris con 1 mM EDTA) hasta una concentración final de 0,4 μg de ARN utilizado para RT por 100 μL de solución de ADNc. Almacene las muestras de ADNc a -20 °C.
- Realizar la reacción en cadena de la polimerasa (PCR) en tiempo real utilizando un volumen de reacción de 10 μL. El volumen de reacción contiene la mezcla maestra (que contiene ADN polimerasa, uracilo-ADN glicosilasa, dNTPs con dUTP, referencia pasiva y componentes tampón optimizados), cebador delantero 45 μM, cebador inverso 45 μM, sonda 12,5 μM (que contiene un tinte reportero vinculado al extremo 5' de la sonda, un aglutinante de ranura menor en el extremo 3' de la sonda y un quencher no fluorescente en el extremo 3' de la sonda) , 2 μL de ADNc y agua tratada con DEPC.
- Ejecutar un control endógeno (RPLP0) para la cuantificación relativa con el método 2-ΔΔCT 19.
- Agregue muestras por duplicados y ejecute un control sin plantilla agregando TE-buffer en lugar de cDNA. Ejecutar PCR en condiciones estándar (2 min a 50 °C, 10 min a 95 °C, 40 ciclos de 15 s a 95 °C y 1 min a 60 °C).
- Realizar la cuantificación relativa de los objetivos de ARNm siguiendo el método comparativo de TC. La cantidad de ARNm normalizada a la muestra basal se calcula como 2-ΔΔCT, mientras que ΔΔCT es la diferencia entre el ΔCT (CT target- CT control endógeno) de la muestra y ΔCT (CT target y CT endógeno control) de la muestra basal.
5. Cuantificación del contenido de proteínas en el medio ivd
- Recoger el medio condicionado por las muestras de IVD para medir el contenido de proteína en el medio. Realizar ensayos de inmunoabsorción ligados a enzimas (ELISA) según el protocolo de la proteína diana.
- La interleucina-8 bovina (IL-8) se cuantifica mediante el kit ELISA IL8 anti-bovino de acuerdo con las instrucciones del fabricante.
Access restricted. Please log in or start a trial to view this content.
Resultados
La carga degenerativa en medio de glucosa baja combinada con la inyección de TNF-α provocó un aumento significativo de la expresión génica de los marcadores proinflamatorios interleucina 6 (IL-6) e interleucina 8 (IL-8) en comparación con el grupo control fisiológico en células NP después de 4 días de cultivo(Figura 2). Por el contrario, no se observaron cambios significativos para los genes proinflamatorios interleucina 1β (IL-1β) y TNF-α en las células NP (datos no mostrados)...
Access restricted. Please log in or start a trial to view this content.
Discusión
Aquí proporcionamos un protocolo detallado para simular IVDD degenerativo e inflamatorio. Este protocolo se puede aplicar para las examinaciones detalladas de los caminos inflamatorios que llevan a los efectos destructivos sobre el disco. Además, el protocolo puede ayudar a determinar dianas terapéuticas prometedoras implicadas en la progresión de la enfermedad.
Recientemente demostramos que el TNF-α recombinante humano podría inducir inflamación tanto en células NP bovinas como humana...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la Fundación AO y AOSpine International. Babak Saravi recibió apoyo de becas de la Fundación Alemana de la Columna Vertebral y la Fundación Alemana de Osteoartritis. Gernot Lang recibió el apoyo del Programa Berta-Ottenstein para Científicos Clínicos Avanzados de la Facultad de Medicina de la Universidad de Friburgo (Alemania).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 1-Bromo-3-chloropropane(BCP) | Sigma-Aldrich, St. Louis, USA | B9673 | |
| Ascorbate-2-phosphate | Sigma-Aldrich, St. Louis, USA | A8960 | |
| Band saw | Exakt Apparatebau, Norderstedt, Germany | model 30/833 | |
| Betadine | Munndipharma, Frankfurt, Germany | ||
| Bovine IL-8 Do.it-Yourself ELISA | Kingfisher Biotech, St. Paul, USA | DIY1028B-003 | |
| Corning ITS Premix | Corning Inc., New York, USA | 354350 | |
| DMEM high glucose | Gibco by life technologies, Carlsbad, USA | 10741574 | |
| DMEM low glucose | Gibco by life technologies, Carlsbad, USA | 11564446 | |
| Ethanol for molecular biology | Sigma-Aldrich, St. Louis, USA | 09-0851 | |
| Fetal Bovine Serum (FBS) | Gibco by life technologies, Carlsbad, USA | A4766801 | |
| Non-essential amino acid solution | Gibco by life technologies, Carlsbad, USA | 11140050 | |
| Penicillin/Streptomycin(P/S) | gibco by life technologies, Carlsbad, USA | 11548876 | |
| Phosphate Buffer Solution, tablet | Sigma-Aldrich, St. Louis, USA | P4417 | |
| Pronase | Sigma-Aldrich, St. Louis, USA | 10165921001 | |
| Primocin | InvivoGen, Sandiego, USA | ant-pm-05 | |
| Pulsavac Jet Lavage System | Zimmer, IN,USA | ||
| TissueLyser II | Quiagen, Venlo, Netherlands | 85300 | |
| Streptavidinn-HRP | Kingfisher Biotech, St. Paul, USA | AR0068-001 | |
| Superscript VILO | Invitrogen by life Technologies, Carlsbad, USA | 10704274 | |
| cDNA Synthesis Kit | Applied Biosystems by life technologies | 10400745 | |
| TaqMan Universal Master Mix | Applied Biosystems by life technologies | ||
| TNF-alpha, recombinant human protein | R&D systems, Minnesota, USA | 210-TA-005 | |
| TRI Reagent | Molecular Research Center, Cincinnati, USA | TR 118 | |
| Tris-EDTA buffer solution | sigma-Aldrich, St. Louis, USA | 93283 | |
| Gene bIL-6 | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTC CAA AAA TGG AGG AAA AGG A Primer rev (5′–3′) TCC AGA AGA CCA GCA GTG GTT Probe (5′FAM/3′TAMRA) CTT CCA ATC TGG GTT CAA TCA GGC GATT |
| Gene bIL8 | Applied Biosystems by life technologies | Bt03211906_m1 | |
| Gene bTNF-alpha | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) CCT CTT CTC AAG CCT CAA GTA ACA A Primer rev (5′–3′) GAG CTG CCC CGG AGA GTT Probe (5′FAM/3′TAMRA) ATG TCG GCT ACA ACG TGG GCT ACC G |
| GENE bIL1beta | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTA CTA CAG TGA CGA GAA TGA GCT GTT Primer rev (5′–3′) GGT CCA GGT GTT GGA TGC A Probe (5′FAM/3′TAMRA) CTC TTC ATC TGT TTA GGG TCA TCA GCC TCA A |
| RPLP0 | Applied Biosystems by life technologies | Bt03218086_m1 |
Referencias
- Vos, T., et al. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet. 390 (10100), 1211-1259 (2017).
- Hoy, D., et al. Measuring the global burden of low back pain. Best Practice & Research Clinical Rheumatology. 24 (2), 155-165 (2010).
- Thiese, M. S., et al. Prevalence of low back pain by anatomic location and intensity in an occupational population. BMC Musculoskeletal Disorders. 15 (1), 283(2014).
- Katz, J. N. Lumbar Disc Disorders and Low-Back Pain: Socioeconomic Factors and Consequences. The Journal of Bone and Joint Surgery (American). 88, suppl_2 21(2006).
- Vlaeyen, J. W. S., et al. Low back pain. Nature Reviews Disease Primers. 4 (1), 52(2018).
- Khan, A. N., et al. Inflammatory biomarkers of low back pain and disc degeneration: a review: Biomarkers of disc degeneration and back pain. Annals of the New York Academy of Sciences. 1410 (1), 68-84 (2017).
- Kim, H. S., Wu, P. H., Jang, I. T. Lumbar Degenerative Disease Part 1: Anatomy and Pathophysiology of Intervertebral Discogenic Pain and Radiofrequency Ablation of Basivertebral and Sinuvertebral Nerve Treatment for Chronic Discogenic Back Pain: A Prospective Case Series and Review of Literature. International Journal of Molecular Sciences. 21 (4), 1483(2020).
- Adams, M. A., Roughley, P. J. What is Intervertebral Disc Degeneration, and What Causes It. Spine. 31 (18), 2151-2161 (2006).
- Wu, P. H., Kim, H. S., Jang, I. T. Intervertebral Disc Diseases Part 2: A Review of the Current Diagnostic and Treatment Strategies for Intervertebral Disc Disease. International Journal of Molecular Sciences. 21 (6), 2135(2020).
- Lurie, J. D., et al. Surgical Versus Nonoperative Treatment for Lumbar Disc Herniation: Eight-Year Results for the Spine Patient Outcomes Research Trial. Spine. 39 (1), 3-16 (2014).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews Rheumatology. 10 (1), 44-56 (2014).
- Ponnappan, R. K., et al. An organ culture system to model early degenerative changes of the intervertebral disc. Arthritis Research & Therapy. 13 (5), 171(2011).
- O'Connell, G. D., Vresilovic, E. J., Elliott, D. M. Comparison of Animals Used in Disc Research to Human Lumbar Disc Geometry. Spine. 32 (3), 328-333 (2007).
- Stannard, J. T., et al. Development of a whole organ culture model for intervertebral disc disease. Journal of Orthopaedic Translation. 5, 1-8 (2016).
- Li, Z., et al. Preclinical ex-vivo Testing of Anti-inflammatory Drugs in a Bovine Intervertebral Degenerative Disc Model. Frontiers in Bioengineering and Biotechnology. 8, 583(2020).
- Li, Z., et al. Development of an ex vivo cavity model to study repair strategies in loaded intervertebral discs. European Spine Journal. 25 (9), 2898-2908 (2016).
- Kazezian, Z., Li, Z., Alini, M., Grad, S., Pandit, A. Injectable hyaluronic acid down-regulates interferon signaling molecules, IGFBP3 and IFIT3 in the bovine intervertebral disc. Acta Biomaterialia. 52, 118-129 (2017).
- Caprez, S., Menzel, U., Li, Z., Grad, S., Alini, M., Peroglio, M. Isolation of high-quality RNA from intervertebral disc tissue via pronase predigestion and tissue pulverization. JOR Spine. 1 (2), 1017(2018).
- Lopa, S., Ceriani, C., Cecchinato, R., Zagra, L., Moretti, M., Colombini, A. Stability of housekeeping genes in human intervertebral disc, endplate and articular cartilage cells in multiple conditions for reliable transcriptional analysis. European Cells & Materials. 31, 395-406 (2016).
- Lang, G., et al. An intervertebral disc whole organ culture system to investigate proinflammatory and degenerative disc disease condition. Journal of Tissue Engineering and Regenerative Medicine. 12 (4), 2051-2061 (2018).
- Du, J., et al. Proinflammatory intervertebral disc cell and organ culture models induced by tumor necrosis factor alpha. JOR Spine. 3, 1104(2020).
- Purmessur, D., Walter, B. A., Roughley, P. J., Laudier, D. M., Hecht, A. C., Iatridis, J. A role for TNFα in intervertebral disc degeneration: A non-recoverable catabolic shift. Biochemical and Biophysical Research Communications. 433 (1), 151-156 (2013).
- Walter, B. A., Likhitpanichkul, M., Illien-Junger, S., Roughley, P. J., Hecht, A. C., Iatridis, J. C. TNFα Transport Induced by Dynamic Loading Alters Biomechanics of Intact Intervertebral Discs. PLOS One. 10 (3), 0118358(2015).
- Gullbrand, S. E., et al. A large animal model that recapitulates the spectrum of human intervertebral disc degeneration. Osteoarthritis and Cartilage. 25 (1), 146-156 (2017).
- Willems, N., et al. Safety of intradiscal injection and biocompatibility of polyester amide microspheres in a canine model predisposed to intervertebral disc degeneration: intradiscal application of pea microspheres. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 105 (4), 707-714 (2017).
- Michalek, A. J., Buckley, M. R., Bonassar, L. J., Cohen, I., Iatridis, J. C. The effects of needle puncture injury on microscale shear strain in the intervertebral disc annulus fibrosus. The Spine Journal. 10 (12), 1098-1105 (2010).
- Illien-Jünger, S., et al. The combined effects of limited nutrition and high-frequency loading on intervertebral discs with endplates. Spine. 35 (19), 1744-1752 (2010).
- Gantenbein, B., et al. Organ culture bioreactors--platforms to study human intervertebral disc degeneration and regenerative therapy. Current Stem Cell Research & Therapy. 10 (4), 339-352 (2015).
- Boubriak, O. A., Watson, N., Sivan, S. S., Stubbens, N., Urban, J. P. G. Factors regulating viable cell density in the intervertebral disc: blood supply in relation to disc height. Journal of Anatomy. 222 (3), 341-348 (2013).
- Maroudas, A., Stockwell, R. A., Nachemson, A., Urban, J. Factors involved in the nutrition of the human lumbar intervertebral disc: cellularity and diffusion of glucose in vitro. Journal of Anatomy. 120, Pt 1 113-130 (1975).
- Beckstein, J. C., Sen, S., Schaer, T. P., Vresilovic, E. J., Elliott, D. M. Comparison of Animal Discs Used in Disc Research to Human Lumbar Disc: Axial Compression Mechanics and Glycosaminoglycan Content. Spine. 33 (6), 166-173 (2008).
- Walter, B. A., Illien-Jünger, S., Nasser, P. R., Hecht, A. C., Iatridis, J. C. Development and validation of a bioreactor system for dynamic loading and mechanical characterization of whole human intervertebral discs in organ culture. Journal of Biomechanics. 47 (9), 2095-2101 (2014).
- Rajan, N. E., et al. Toll-Like Receptor 4 (TLR4) Expression and Stimulation in a Model of Intervertebral Disc Inflammation and Degeneration. Spine. 38 (16), 1343-1351 (2013).
- vanden Akker, G. G., Rorije, A. J., Davidson, E. N. B., vander Kraan, P. M. Phenotypic marker genes distinguish inner and outer annulus fibrosus from nucleus pulposus tissue in the bovine intervertebral disc. Osteoarthritis and Cartilage. 25, 402(2017).
- Du, J., et al. Functional cell phenotype induction with TGF-β1 and collagen-polyurethane scaffold for annulus fibrosus rupture repair. European Cells & Materials. 39, 1-17 (2020).
- Risbud, M. V., et al. Defining the phenotype of young healthy nucleus pulposus cells: recommendations of the Spine Research Interest Group at the 2014 annual ORS meeting. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 33 (3), 283-293 (2015).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados