このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
初期段階の椎間板疾患をシミュレートする炎症性の退行性臓器培養モデル。
* これらの著者は同等に貢献しました
要約
このプロトコルは、初期段階の椎間板変性をシミュレートする炎症誘発性、変性ウシ器官培養の新しい実験モデルを提示する。
要約
症候性椎間板(IVD)変性(IDD)は、主要な社会経済的負担であり、炎症および組織の劣化を特徴とする。原因治療の欠如のために、疾患の進行に関与するメカニズムを研究し、治療目標を見つけ、動物モデルの必要性を減らすために、革新的な実験的臓器培養モデルが緊急に必要とされています。ここでは、IDD中に存在する炎症誘発性および同化微小環境を模倣した新しい3次元臓器培養モデルプロトコルを紹介する。
最初に、ウシのカウダルIVDを、組織培養培地で解剖、洗浄、培養した。動的生理学的または病理学的負荷を、1日2時間のカスタムメイドのバイオリアクターに適用した。IVDは、コントロール群(高グルコース培地、生理的負荷、リン酸緩衝生理食塩水注射)および病理学的群(低グルコース培地、病理学的負荷、腫瘍壊死因子α注射)に4日間割り当てられた。IVDsの採取されたパルポスス細胞および酵素結合免疫吸着剤アッセイから遺伝子発現解析を行った。
我々のデータは、対照群と比較して病理学群に負荷を与えた後、炎症性マーカーの高い発現と椎間板高の低下を明らかにした。このプロトコルは、IVDの炎症や変性をシミュレートするために信頼性が高く、さらにアプリケーションの範囲を広げるために拡大することができます。
概要
腰痛(LBP)は、すべての年齢の個人に影響を与えることができ、障害の主な原因は、世界1、2、3。LBP に関連する総コストは、年間 1,000 億ドルを超える4,5.症候性椎間板(IVD)変性(IDD)は、炎症および組織劣化を特徴とする状態であり、LBP6、7の主要な原因である。具体的には、IDDは、加速病理、神経疾患、および最終的に障害につながる複数の要因によって誘発され、誘発されるIVDの細胞外マトリックス(ECM)の徐々に進化する内訳によって特徴付けられる。さらに、IDDは、炎症性サイトカインの放出に関連しており、脊椎バイオメカニクス、血管新生、および神経の成長は、痛みの感覚を増加させ、慢性LBP(活動性ディスコパシー)6,8を完全に引き起こす。現在までに、治療の選択肢には、隣接する椎骨の椎間剥離およびそれに続く融合、IVD人工関節の移植、または非ステロイド性抗炎症薬、オピオイド、およびIDD9患者に対する筋弛緩剤などの非外科的アプローチが含まれる。外科的および非外科的な両方の現在の標準的な治療オプションは、部分的にしか有効であり、根本的な生物学的問題9,10に対処することができない。初期の退行性ディスク疾患は、初期の炎症性組織応答、特に腫瘍壊死因子α(TNF-α)発現11の増加を特徴とする。これらの初期のディスク変化は、主にディスクアーキテクチャを破壊することなく細胞レベルで起こり、以前は炎症促進条件12の下で栄養不足によって模倣され得る。したがって、これらの変性機構を調査し、適切な治療標的を見つけるためにin vivo状況の精密なシミュレーションが重要である。さらに、これらの分子特性のシミュレーションでは、ディスクの機械的負荷環境は、IVDの病理学的および生理学的変化において重要な役割を果たす。したがって、これらのアプローチを組み合わせることで、生体内のIVDの複雑な微小環境を模倣する一歩前進を生み出します。現在、私たちの知識を最大限に活用するために、炎症促進と栄養の設定と共に動的ローディングの側面を考慮した研究はありません。
大規模な動物モデルは、インビボ相互作用に関連する潜在的な調査を可能にしますが、コストがかかり、作業集約的です。また、研究における動物モデルの使用は長い間論争の問題であったため、重要な研究課題に答えるために必要な動物の数の減少は大きな関心事です。最後に、IVD研究13,14においてIDDを模倣する理想的な動物モデルは現在存在しない。したがって、IDDおよび関連する炎症および変性プロセスをシミュレートする臓器培養モデルのような費用対効果の高い、信頼性の高い置換を確立する必要がある。近年、初期段階の椎間板疾患をシミュレートする炎症誘発性および退行性臓器培養モデルの確立に本プロトコルを適用して、IDD臓器培養15における抗炎症薬の効果を調べ得た。
ここでは、低栄養性の培地条件下での腫瘍壊死因子α(TNF-α)の直接の日の注入とバイオリアクターでの変性負荷によって引き起こされる、異化および炎症誘発性微小環境を介して、牛椎間板を取得し、早期IDDの状態を誘導する方法を説明する。 図1 は実験モデルを示し、変性および生理的負荷条件をシミュレートするために使用されるバイオリアクターを示す。
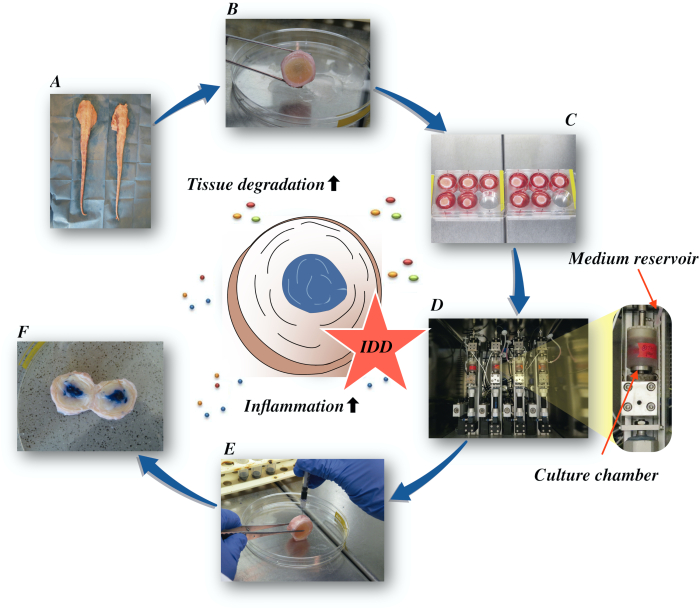
図1: 実験用セットアップの図A: 牛の尾; B: 牛の椎間板を解剖; C: ディスクを培養培地と共にウェルプレートに移す。 D: バイオリアクターでシミュレーションをロードする。 E: 椎間板内注射技術; F: PBS/トリパンブルー染料を注入した後のIVDが分布を明らかにする。IDD:椎間板変性。 この図の大きなバージョンを表示するには、ここをクリックしてください。
Access restricted. Please log in or start a trial to view this content.
プロトコル
実験は、局所アバトワールから得られた牛の尾を用いて行った。現在の研究で使用されている生物学的材料は食物連鎖から採取され、スイスとヨーロッパの法律では倫理的な承認を必要としません。
1. 牛椎間板の解剖
- 表面の汚れや髪を取り除くために水道水で尾全体を十分に洗い流します。
注: 無傷で遠位端、1 つの尾翼あたりの 9 個の IVD (尾骨 1- 9) の目的のサイズに応じて実験に使用できます。15~20mmの所望の直径を考慮し、実験には1個の12個のウシの尾部を使用し、1尾あたり5IVDを使用しました。 - 1%ベタジン溶液を含む箱に尾全体を10分間浸します。尾を滅菌ガーゼで短時間乾燥させ、滅菌ドレープの上に置きます。
注:ディスクの解剖中に、脱水を防ぐためにリンガーの溶液湿潤ガーゼで尾を加湿します。全体の解剖手順が完了するまで、濡れたガーゼで包まれた尾(または残りのセグメント)を保管します。 - メス(20)を使用して軟部組織を尾背脊椎からできるだけ完全に取り除き、IVDの同定を容易にします。骨の除去ペンチで椎骨の棘および横のプロセスを取除く。
注: 希望の直径の IvD を選択します。15-20のmmの直径の範囲のIvDは、現在の研究で使用されました。 - 各椎体の中央を通って骨ペンチで横断的に切断し、個々のモーションセグメントを得ます。リンガーの溶液で濡れたガーゼでペトリ皿にモーションセグメントを入れます。
- 触診とモーションセグメントを穏やかに移動させることによって、IVDと椎骨を見つけます。IVDの成長プレートにバンドソーを2つ平行にカットし、IVDの両側に1つずつ行います。IVDから椎骨に向かう約0.5-1mmの安全距離で、円盤(ソフト)に隣接する骨エンドプレート部分(硬)の凸部位に触れて見つけることで、成長板の位置を特定します。バンドソーのブレードが、椎骨を切断しながらRingerの溶液で冷却されていることを確認します。
- リンガーの溶液で濡れたきれいなガーゼできれいなペトリ皿にIVDを移す。
注:ガーゼは湿らせ、IVDの腫れを防ぐために濡れすぎないようにする必要があります。 - 頭皮の刃を使用して椎体(赤/ピンクの骨)、成長プレート(白い軟骨)を削り取り、エンドプレートをそのままにしておきます(黄色-ピンク)。2 つのサーフェスを平坦にして、荷重手順を平行にします。掻き取ったIVDをリンガーの溶液で濡らしたガーゼで新鮮なペトリ皿に移します。
注:IVDを保持し、擦り傷しながら手を保護するためにチェーンメール手袋を着用してください。 - ディスクの高さと直径をキャリパーで測定します。ジェットラベージシステムを使用して、リンガーの溶液で椎骨の血栓をきれいにします。
- IVDを50 mLプラスチックチューブ(チューブあたり1個のIVD)に移します。リン酸緩衝生理食塩水(PBS)+10%ペニシリン/ストレプトマイシン(P/S)をIVDあたり25mL加え、室温で軌道シェーカーで15分間揺れ動かします。
- 上清を吸引し、IVDあたり10mL+1%P/Sを2分間添加してIVDをすすいます。
2. IVDの培養と荷重
- IVDチャンバーにディスクを移し、IVD培養培地(DMEM、生理学的群の場合は4.5g/L高グルコースDMEM、病理学的群の場合は2g/L低グルコースDMEM)+1%P/S+ 2%胎児血清+1%ITS(5μg/mLインスリンを含む) 6 μg/mLトランスフェリン、および5 ng/mLセレニシャス酸)+50 μg/mLのアスコルビン酸-2リン酸+1%非必須アミノ酸+1%非必須アミノ酸+10μg/mL抗菌剤)を37°C、85%の湿度および5%CO2でインキュベーターに入れる。
- 実験グループ16に従ってバイオリアクターシステム内で4日間ディスクを培養する。病理群では、変性負荷条件を0.32-0.5 MPa、5 Hzで2時間/日に維持します。生理学的制御群では、0.02-0.2 MPa、0.2Hzの2時間/日の負荷プロトコルを使用する。
注:荷重手順中にIVD媒体の5 mLを含むチャンバーにIVDを配置します。容積はバイオリアクターの負荷室の大きさに依存する。荷重手順の間に、IVD を 7 mL の IVD 培養培地で 6 ウェルプレートに入れ、フリー膨潤回復を行います。 - 実験期間中のディスク高さの変化を解析するために、IVD解剖後のキャリパー(ベースライン)でディスクの高さを測定し、その後、自由な膨潤期間の後、そして実験期間の動的ローディング後に毎日測定します。
3. 椎間板内腫瘍壊死因子α(TNF-α)注射
- 1日目の最初のダイナミックローディングサイクルの直後に、垂直位置のペトリ皿にIVDを配置し、トゥイーザでIVDを安定させます。
- 組換えTNF-α(IVD当たりPBSの70μLで100ng)を病理学グループ17の核果体組織に30ゲージのインスリン針で注入する。約70μLの速度で1分ほどゆっくりと注入します。
- 注射後、注射器をIVD内で途中まで引き戻し、注射器プランジャーを引っ張って、注射液が漏れるのを防ぐ真空を作り、針と注射器をIVDから完全に取り除きます。
注:トリパンブルー染料を含むPBSを注入して試験実験を行い、負荷および夜間培養後に注入された溶液の分布を評価します。
4. 遺伝子発現
- 4日目にIVDを収穫します。生検パンチで、核パルポス(NP)組織(IVDの真ん中にゲル状の部分)を収集します。メスの刃(No.20)で外環状繊維(AF)を集める。
注: 0日目のベースライン基準については、RNA抽出のために解剖した直後に組織を採取します。 - 実験計画に応じて、遺伝子発現解析に必要なNPまたはAF組織の量を使用してください。
注:本実験では約150mgの組織が用いられました。組織質量に対するRNA単離溶液の比率は、効率的な抽出のために100〜150mgの組織あたり少なくとも2 mLでなければなりません。 - 消化液(DMEMでは0.2%プロナーゼ、フィルター滅菌)でNPまたはAF組織を消化し、磁気撹拌18で37°Cで1時間インキュベートする。
- 液体窒素を用いて組織サンプルをフラッシュフリーズし、微粉に粉砕します。粉砕された組織粉末を、単相溶液(RNA分離溶液)に1mLのグアニジンチオシアネートとフェノールをそれぞれ含む2つの2mLチューブに均等に分割する。
- RNA分離溶液と粉砕した組織粉末を含む2mLチューブで均質化を行います。30 Hzで30Hzで、組織粉末5xを30Hzで均質化します。遠心分離機は12,000xg、4°Cで10分間、上清を新鮮なチューブに移します。 上清は、少なくとも1ヶ月間-80°Cで保存することができます。
- RNA分離溶液1 mLあたり1-ブロモ-3-クロロプロパン(BCP)の0.1 mLを加え、15秒激しく振る。得られた混合物を15分間軌道シェーカーの室温で保存し、遠心分離機を12,000 x g で4°Cで15分間保存します。
注:RNAは上の水相に排他的に残ります。 - 新鮮なチューブに水相を移し、イソプロパノールの0.25 mLと、初期均質化に使用されるRNA分離液1 mL当たり0.25 mLの高塩沈殿液でRNAを沈殿させます。サンプルを15分間室温で、軌道シェーカーに、遠心分離機を12,000 x g で4°Cで8分間保存します。
注: あるいは、カラムベースの RNA 抽出方法を使用すると、一般的に RNA の純度は高くなりますが、RNA の収率は低下します。 - 上清を取り除き、初期均質化に使用するRNA分離溶液1mL当たり75%エタノールの1mLでRNAペレットを洗浄します。遠心分離機 7,500 x g で 5 分 4 °C.
- エタノール洗浄を取り除き、3〜5分間の空気乾燥RNAペレットを取り除きます。20 μLのジエチルピロカーボネート(DEPC)処理水にRNAを溶解し、ピペットチップを通して溶液を数回通過させ、55〜60°Cで10〜15分間インキュベートします。
- 230 nm、260 nm、および 280 nm (それぞれ A230、A260、A280) で吸光度を測定します。A260の1.0は40 μg/mL RNAに相当する。A260/A280比は1.6~1.9と予想され、汚染の結果としてA260/A280の比率は<1.6となります。
- 20 μL 反応量に対して逆転写酵素 (RT) 反応ミックスを準備します。この混合液には、RT酵素ミックス、リボヌクレアーゼ阻害剤、ヘルパータンパク質、プライマー、dNTP、MgCl2、RNase遊離水、および0.4μgのRNAサンプルが含まれています。
- RTチューブを簡単に遠心分離して、チューブの下部にあるすべてのコンポーネントを混合します。
- サンプルをサーモサイクラー装置に入れます。RTに適したプログラムを選択し、RTを25°Cで10分間実行し、続いて42°Cで120分間の逆転写ステップを実行し、85°Cで5分間逆転写酵素を不活性化し、最後に4°Cまで冷却します。
- 得られたcDNAをトリス(ヒドロキシメチル)アミノメタン(トリス)エチレンアミンテア酢酸(EDTA)(TE)バッファー(10 mM EDTAで10 mMトリス)で希釈し、100 μL cDNA溶液当たりRTに使用する0.4 μgのRNAの最終濃度にします。cDNAサンプルを-20°Cに保存します。
- 10 μL反応量を使用してリアルタイムポリメラーゼ連鎖反応(PCR)を実行します。反応量は、マスターミックス(DNAポリメラーゼを含む)を含む、 ウラシルDNAグリコシラーゼ、dUTP付dNT、パッシブリファレンスおよび最適化バッファコンポーネント付きdMP、フォワードプライマー45μM、リバースプライマー45μM、プローブ12.5μM(プローブの5'末端に連結されたレポーター色素、プローブの3'末端のマイナーグルーブバインダー、プローブの3'末端の非蛍光クオンチャーを含む)、2 μL cDNAおよびDEPC処理水。
- 2-ΔΔCT 法19で相対定量を行う内因性制御(RPLP0)を実行します。
- 重複するサンプルを追加し、cDNA の代わりに TE バッファを追加して、テンプレートなしコントロールを実行します。PCR は標準条件で実行します (50 °C で 2 分、95 °Cで 10 分、95 °Cで 15 s の 40 サイクル、60 °C で 1 分)
- 比較CT法に従ってmRNA標的の相対定量を行う。ベースライン試料に正規化されたmRNAの量は、2-ΔΔCTとして計算され、ΔΔCTは、ベースラインサンプルのΔCT(CT標的−CT内因性対照)とΔCT(CT標的およびCT内因性対照)との差である。
IVD培地中のタンパク質含有量の定量化
- IVDサンプルで調整された培地を収集し、培地中のタンパク質含有量を測定します。標的タンパク質のプロトコルに従って酵素結合免疫吸着アッセイ(ELISA)を行う。
- ウシインターロイキン-8(IL-8)は、製造業者の指示に従って抗牛IL8 ELISAキットによって定量化されます。
Access restricted. Please log in or start a trial to view this content.
結果
TNF-α注射と組み合わせた低グルコース培地における退行性負荷は、培養4日後のNP細胞における生理学的対照群と比較して、炎症促進マーカーインターロイキン6(IL-6)およびインターロイキン8(IL-8)の遺伝子発現の有意な増加を引き起こした(図2)。これに対し、NP細胞におけるインターロイキン1β(IL-1β)およびTNF-αの炎症促進性遺伝子に対して有意な変化を観察しなかった(デ...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
我々はここで変性および炎症性IVDDをシミュレートするための詳細なプロトコルを提供した。このプロトコルは、ディスクに破壊的な影響をもたらす炎症経路の詳細な検査に適用することができる。さらに、このプロトコルは、疾患の進行に関与する有望な治療標的を決定するのに役立つ。
我々は最近、ヒト組換えTNF-αがウシおよびヒトNP細胞21の両方に...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは開示するものは何もない。
謝辞
この作品は、AO財団とアオスパイン・インターナショナルによって支援されました。ババク・サラヴィは、ドイツ脊椎財団とドイツ変形性関節症財団からフェローシップ支援を受けました。ゲルト・ラングは、ドイツのフライブルク大学医学部先端臨床医のためのベルタ・オッテンシュタイン・プログラムの支援を受けました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 1-Bromo-3-chloropropane(BCP) | Sigma-Aldrich, St. Louis, USA | B9673 | |
| Ascorbate-2-phosphate | Sigma-Aldrich, St. Louis, USA | A8960 | |
| Band saw | Exakt Apparatebau, Norderstedt, Germany | model 30/833 | |
| Betadine | Munndipharma, Frankfurt, Germany | ||
| Bovine IL-8 Do.it-Yourself ELISA | Kingfisher Biotech, St. Paul, USA | DIY1028B-003 | |
| Corning ITS Premix | Corning Inc., New York, USA | 354350 | |
| DMEM high glucose | Gibco by life technologies, Carlsbad, USA | 10741574 | |
| DMEM low glucose | Gibco by life technologies, Carlsbad, USA | 11564446 | |
| Ethanol for molecular biology | Sigma-Aldrich, St. Louis, USA | 09-0851 | |
| Fetal Bovine Serum (FBS) | Gibco by life technologies, Carlsbad, USA | A4766801 | |
| Non-essential amino acid solution | Gibco by life technologies, Carlsbad, USA | 11140050 | |
| Penicillin/Streptomycin(P/S) | gibco by life technologies, Carlsbad, USA | 11548876 | |
| Phosphate Buffer Solution, tablet | Sigma-Aldrich, St. Louis, USA | P4417 | |
| Pronase | Sigma-Aldrich, St. Louis, USA | 10165921001 | |
| Primocin | InvivoGen, Sandiego, USA | ant-pm-05 | |
| Pulsavac Jet Lavage System | Zimmer, IN,USA | ||
| TissueLyser II | Quiagen, Venlo, Netherlands | 85300 | |
| Streptavidinn-HRP | Kingfisher Biotech, St. Paul, USA | AR0068-001 | |
| Superscript VILO | Invitrogen by life Technologies, Carlsbad, USA | 10704274 | |
| cDNA Synthesis Kit | Applied Biosystems by life technologies | 10400745 | |
| TaqMan Universal Master Mix | Applied Biosystems by life technologies | ||
| TNF-alpha, recombinant human protein | R&D systems, Minnesota, USA | 210-TA-005 | |
| TRI Reagent | Molecular Research Center, Cincinnati, USA | TR 118 | |
| Tris-EDTA buffer solution | sigma-Aldrich, St. Louis, USA | 93283 | |
| Gene bIL-6 | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTC CAA AAA TGG AGG AAA AGG A Primer rev (5′–3′) TCC AGA AGA CCA GCA GTG GTT Probe (5′FAM/3′TAMRA) CTT CCA ATC TGG GTT CAA TCA GGC GATT |
| Gene bIL8 | Applied Biosystems by life technologies | Bt03211906_m1 | |
| Gene bTNF-alpha | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) CCT CTT CTC AAG CCT CAA GTA ACA A Primer rev (5′–3′) GAG CTG CCC CGG AGA GTT Probe (5′FAM/3′TAMRA) ATG TCG GCT ACA ACG TGG GCT ACC G |
| GENE bIL1beta | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTA CTA CAG TGA CGA GAA TGA GCT GTT Primer rev (5′–3′) GGT CCA GGT GTT GGA TGC A Probe (5′FAM/3′TAMRA) CTC TTC ATC TGT TTA GGG TCA TCA GCC TCA A |
| RPLP0 | Applied Biosystems by life technologies | Bt03218086_m1 |
参考文献
- Vos, T., et al. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet. 390 (10100), 1211-1259 (2017).
- Hoy, D., et al. Measuring the global burden of low back pain. Best Practice & Research Clinical Rheumatology. 24 (2), 155-165 (2010).
- Thiese, M. S., et al. Prevalence of low back pain by anatomic location and intensity in an occupational population. BMC Musculoskeletal Disorders. 15 (1), 283(2014).
- Katz, J. N. Lumbar Disc Disorders and Low-Back Pain: Socioeconomic Factors and Consequences. The Journal of Bone and Joint Surgery (American). 88, suppl_2 21(2006).
- Vlaeyen, J. W. S., et al. Low back pain. Nature Reviews Disease Primers. 4 (1), 52(2018).
- Khan, A. N., et al. Inflammatory biomarkers of low back pain and disc degeneration: a review: Biomarkers of disc degeneration and back pain. Annals of the New York Academy of Sciences. 1410 (1), 68-84 (2017).
- Kim, H. S., Wu, P. H., Jang, I. T. Lumbar Degenerative Disease Part 1: Anatomy and Pathophysiology of Intervertebral Discogenic Pain and Radiofrequency Ablation of Basivertebral and Sinuvertebral Nerve Treatment for Chronic Discogenic Back Pain: A Prospective Case Series and Review of Literature. International Journal of Molecular Sciences. 21 (4), 1483(2020).
- Adams, M. A., Roughley, P. J. What is Intervertebral Disc Degeneration, and What Causes It. Spine. 31 (18), 2151-2161 (2006).
- Wu, P. H., Kim, H. S., Jang, I. T. Intervertebral Disc Diseases Part 2: A Review of the Current Diagnostic and Treatment Strategies for Intervertebral Disc Disease. International Journal of Molecular Sciences. 21 (6), 2135(2020).
- Lurie, J. D., et al. Surgical Versus Nonoperative Treatment for Lumbar Disc Herniation: Eight-Year Results for the Spine Patient Outcomes Research Trial. Spine. 39 (1), 3-16 (2014).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews Rheumatology. 10 (1), 44-56 (2014).
- Ponnappan, R. K., et al. An organ culture system to model early degenerative changes of the intervertebral disc. Arthritis Research & Therapy. 13 (5), 171(2011).
- O'Connell, G. D., Vresilovic, E. J., Elliott, D. M. Comparison of Animals Used in Disc Research to Human Lumbar Disc Geometry. Spine. 32 (3), 328-333 (2007).
- Stannard, J. T., et al. Development of a whole organ culture model for intervertebral disc disease. Journal of Orthopaedic Translation. 5, 1-8 (2016).
- Li, Z., et al. Preclinical ex-vivo Testing of Anti-inflammatory Drugs in a Bovine Intervertebral Degenerative Disc Model. Frontiers in Bioengineering and Biotechnology. 8, 583(2020).
- Li, Z., et al. Development of an ex vivo cavity model to study repair strategies in loaded intervertebral discs. European Spine Journal. 25 (9), 2898-2908 (2016).
- Kazezian, Z., Li, Z., Alini, M., Grad, S., Pandit, A. Injectable hyaluronic acid down-regulates interferon signaling molecules, IGFBP3 and IFIT3 in the bovine intervertebral disc. Acta Biomaterialia. 52, 118-129 (2017).
- Caprez, S., Menzel, U., Li, Z., Grad, S., Alini, M., Peroglio, M. Isolation of high-quality RNA from intervertebral disc tissue via pronase predigestion and tissue pulverization. JOR Spine. 1 (2), 1017(2018).
- Lopa, S., Ceriani, C., Cecchinato, R., Zagra, L., Moretti, M., Colombini, A. Stability of housekeeping genes in human intervertebral disc, endplate and articular cartilage cells in multiple conditions for reliable transcriptional analysis. European Cells & Materials. 31, 395-406 (2016).
- Lang, G., et al. An intervertebral disc whole organ culture system to investigate proinflammatory and degenerative disc disease condition. Journal of Tissue Engineering and Regenerative Medicine. 12 (4), 2051-2061 (2018).
- Du, J., et al. Proinflammatory intervertebral disc cell and organ culture models induced by tumor necrosis factor alpha. JOR Spine. 3, 1104(2020).
- Purmessur, D., Walter, B. A., Roughley, P. J., Laudier, D. M., Hecht, A. C., Iatridis, J. A role for TNFα in intervertebral disc degeneration: A non-recoverable catabolic shift. Biochemical and Biophysical Research Communications. 433 (1), 151-156 (2013).
- Walter, B. A., Likhitpanichkul, M., Illien-Junger, S., Roughley, P. J., Hecht, A. C., Iatridis, J. C. TNFα Transport Induced by Dynamic Loading Alters Biomechanics of Intact Intervertebral Discs. PLOS One. 10 (3), 0118358(2015).
- Gullbrand, S. E., et al. A large animal model that recapitulates the spectrum of human intervertebral disc degeneration. Osteoarthritis and Cartilage. 25 (1), 146-156 (2017).
- Willems, N., et al. Safety of intradiscal injection and biocompatibility of polyester amide microspheres in a canine model predisposed to intervertebral disc degeneration: intradiscal application of pea microspheres. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 105 (4), 707-714 (2017).
- Michalek, A. J., Buckley, M. R., Bonassar, L. J., Cohen, I., Iatridis, J. C. The effects of needle puncture injury on microscale shear strain in the intervertebral disc annulus fibrosus. The Spine Journal. 10 (12), 1098-1105 (2010).
- Illien-Jünger, S., et al. The combined effects of limited nutrition and high-frequency loading on intervertebral discs with endplates. Spine. 35 (19), 1744-1752 (2010).
- Gantenbein, B., et al. Organ culture bioreactors--platforms to study human intervertebral disc degeneration and regenerative therapy. Current Stem Cell Research & Therapy. 10 (4), 339-352 (2015).
- Boubriak, O. A., Watson, N., Sivan, S. S., Stubbens, N., Urban, J. P. G. Factors regulating viable cell density in the intervertebral disc: blood supply in relation to disc height. Journal of Anatomy. 222 (3), 341-348 (2013).
- Maroudas, A., Stockwell, R. A., Nachemson, A., Urban, J. Factors involved in the nutrition of the human lumbar intervertebral disc: cellularity and diffusion of glucose in vitro. Journal of Anatomy. 120, Pt 1 113-130 (1975).
- Beckstein, J. C., Sen, S., Schaer, T. P., Vresilovic, E. J., Elliott, D. M. Comparison of Animal Discs Used in Disc Research to Human Lumbar Disc: Axial Compression Mechanics and Glycosaminoglycan Content. Spine. 33 (6), 166-173 (2008).
- Walter, B. A., Illien-Jünger, S., Nasser, P. R., Hecht, A. C., Iatridis, J. C. Development and validation of a bioreactor system for dynamic loading and mechanical characterization of whole human intervertebral discs in organ culture. Journal of Biomechanics. 47 (9), 2095-2101 (2014).
- Rajan, N. E., et al. Toll-Like Receptor 4 (TLR4) Expression and Stimulation in a Model of Intervertebral Disc Inflammation and Degeneration. Spine. 38 (16), 1343-1351 (2013).
- vanden Akker, G. G., Rorije, A. J., Davidson, E. N. B., vander Kraan, P. M. Phenotypic marker genes distinguish inner and outer annulus fibrosus from nucleus pulposus tissue in the bovine intervertebral disc. Osteoarthritis and Cartilage. 25, 402(2017).
- Du, J., et al. Functional cell phenotype induction with TGF-β1 and collagen-polyurethane scaffold for annulus fibrosus rupture repair. European Cells & Materials. 39, 1-17 (2020).
- Risbud, M. V., et al. Defining the phenotype of young healthy nucleus pulposus cells: recommendations of the Spine Research Interest Group at the 2014 annual ORS meeting. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 33 (3), 283-293 (2015).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved