Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un modèle pro-inflammatoire et dégénératif de culture d’organe pour simuler la maladie de disque intervertébral de tôt-étape.
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole présente un modèle expérimental original de culture proinflammatory et dégénérative d’organe bovin pour simuler la dégénération intervertébrale de disque de tôt-étape.
Résumé
La dégénérescence symptomatique du disque intervertébral (IVD) (IDD) est un fardeau socio-économique majeur et se caractérise par une inflammation et une dégradation tissulaire. En raison du manque de thérapies causales, il est urgent de disposer de modèles expérimentaux novateurs de culture d’organes pour étudier les mécanismes impliqués dans la progression de la maladie, trouver des cibles thérapeutiques et réduire le besoin de modèles animaux. Nous présentons ici un nouveau, protocole tridimensionnel de modèle de culture d’organe imitant le microenvironnement proinflammatory et catabolique, qui est présent pendant IDD.
Au commencement, des IVDs caudaux bovins ont été disséqués, nettoyés, et cultivés dans le milieu de culture de tissu. La charge physiologique ou pathologique dynamique a été appliquée dans un bioréacteur fait sur mesure pendant 2 heures par jour. Des IVDs ont été assignés à un groupe témoin (milieu élevé de glucose, charge physiologique, injection saline phosphate-tamponnée) et à un groupe pathologique (milieu bas de glucose, charge pathologique, injection de facteur-alpha de nécrose tumorale) pendant quatre jours. L’analyse d’expression génique des cellules rassemblées de pulposus de noyau des IVDs et de l’analyse enzyme-liée d’immunosorbant des milieux conditionnés de culture d’organe a été exécutée.
Nos données ont indiqué une expression plus élevée des marqueurs inflammatoires et ont réduit des hauteurs de disque après chargement dans le groupe pathologique comparé au groupe témoin. Ce protocole est fiable pour simuler l’inflammation et la dégénérescence d’IVD et peut être encore élargi pour élargir son champ d’application.
Introduction
La lombalgie (LBP) peut affecter des personnes de tous âges et est l’une des principales causes d’invalidité dans le monde1,2,3. Le coût total associé au LBP dépasse 100 milliards de dollars par an4,5. La dégénérescence symptomatique du disque intervertébral (IVD) (IDD), une condition caractérisée par l’inflammation et la dégradation des tissus, est une cause majeure de LBP6,7. Plus précisément, la DDI est caractérisée par une dégradation progressive de la matrice extracellulaire (ECM) de l’IVD, induite et déclenchée par de multiples facteurs qui conduisent à une pathologie accélérée, à des troubles neurologiques et, éventuellement, à une invalidité. En outre, idd est associé à la libération de cytokines proinflammatory, biomécanique de colonne vertébrale altérée, angiogenèse, et l’ingrowth de nerf, qui augmente la sensation de douleur, tout à fait causer chronique LBP (discopathie active)6,8. À ce jour, les options de traitement comprennent la discectomie et la fusion subséquente des vertèbres adjacentes, l’implantation d’une prothèse de DDIV ou des approches non chirurgicales, telles que des anti-inflammatoires non stéroïdiens, des opioïdes et des relaxants musculaires pour les patients atteints de DDI9. Les deux options thérapeutiques standard actuelles, chirurgicales et non chirurgicales, ne sont que partiellement efficaces et ne parviennent pas à résoudre le problème biologique sous-jacent9,10. La discopathie dégénérative à un stade précoce est caractérisée par une réponse initiale des tissus inflammatoires, en particulier une augmentation de l’expression11du facteur-alpha de nécrose tumorale (TNF-alpha). Ces changements précoces de disque se produisent principalement au niveau cellulaire sans perturber l’architecture de disque et pourraient précédemment être imités par insuffisance nutritionnelle dans des conditions pro-inflammatoires12. Par conséquent, une simulation précise de la situation in vivo pour étudier ces mécanismes de dégénérescence et trouver des cibles thérapeutiques appropriées est cruciale. De plus, pour ces simulations de propriétés moléculaires, l’environnement de charge mécanique des disques joue un rôle clé dans les changements pathologiques et physiologiques des IDIV. Par conséquent, la combinaison de ces approches nous permettrait d’avancer d’un pas en avant pour imiter le microenvironnement complexe des IDIV in vivo. Il n’y a actuellement aucune étude considérant l’aspect du chargement dynamique avec le cadre pro-inflammatoire et nutritionnel au meilleur de nos connaissances.
Bien que les grands modèles animaux permettent d’enquêter sur les interactions in vivo pertinentes potentielles, ils sont coûteux et exigent beaucoup de travail. En outre, étant donné que l’utilisation de modèles animaux dans la recherche fait l’objet de controverses depuis longtemps, la réduction du nombre d’animaux nécessaires pour répondre à d’importantes questions de recherche est d’un grand intérêt. Enfin, il n’existe actuellement aucun modèle animal idéal pour imiter les IDD dans la recherche sur lesIDIV 13,14. Par conséquent, il est nécessaire d’établir un remplacement rentable et fiable, tel qu’un modèle de culture d’organes pour simuler les MDI et les processus inflammatoires et dégénératifs associés. Récemment, l’application du protocole actuel sur l’établissement d’un modèle proinflammatory et dégénératif de culture d’organe pour simuler la maladie de disque intervertébral de tôt-étape nous a permis pour étudier l’effet des drogues anti-inflammatoires dans la culture d’organe d’IDD15.
Ici, nous décrivons comment obtenir les disques intervertébraux bovins et induire l’état de la partie IDD par l’intermédiaire d’un microenvironnement catabolique et proinflammatory provoqué par l’injection intradiscal directe du facteur-alpha de nécrose tumorale (TNF-α) et du chargement dégénératif dans un bioréacteur dans de basses conditions nutritives moyennes. La figure 1 illustre le modèle expérimental et montre le bioréacteur utilisé pour simuler les conditions de charge dégénératives et physiologiques.
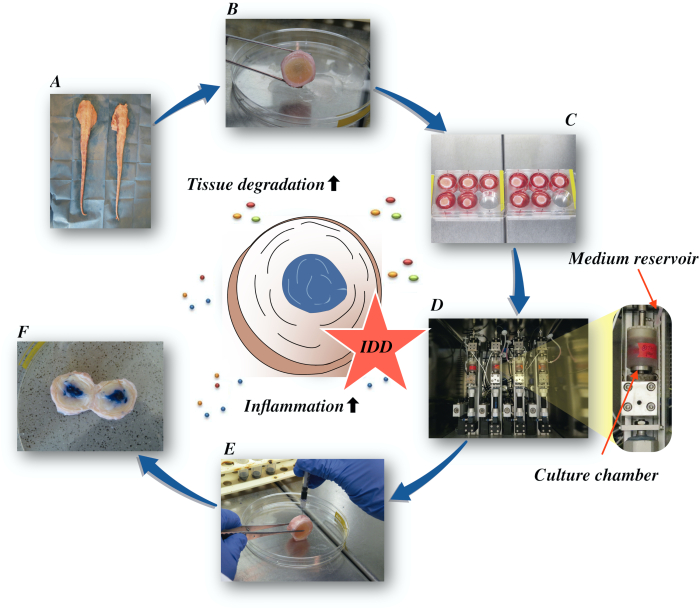
Figure 1: Illustration de la configuration expérimentale. A: queue bovine; B: disques intervertébraux bovins disséqués ; C: transfert du disque sur une plaque de puits avec milieu de culture ; D: chargement de la simulation dans un bioréacteur ; E: technique d’injection intradiscal; F: IVD après injection de PBS/trypan colorant bleu pour révéler la distribution. IDD : dégénérescence de disque intervertébral. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Access restricted. Please log in or start a trial to view this content.
Protocole
Les expériences ont été réalisées à l’aide de queues de bovins obtenues dans des abattoirs locaux. Les matières biologiques utilisées dans la présente étude sont extraites de la chaîne alimentaire et ne nécessitent aucune approbation éthique en droit suisse et européen.
1. Dissection du disque intervertébral bovin
- Rincez soigneusement toute la queue avec de l’eau du robinet pour enlever la saleté et les poils à la surface.
REMARQUE: Avec des extrémités distales intactes, un maximum de 9 IVD (coccygageal 1-9) par queue peut être utilisé pour les expériences en fonction de la taille souhaitée des IVDs. Compte tenu du diamètre souhaité entre 15-20 mm, nous avons utilisé 12 queues bovines avec 5 IDIV par queue pour les expériences. - Plongez toute la queue dans une boîte contenant une solution de bétadine à 1% pendant 10 min. Séchez brièvement la queue avec de la gaze stérile et placez-la sur un rideau stérile.
REMARQUE: Pendant la dissection du disque, humidifier les queues avec de la solution de Ringer de gaze mouillée pour prévenir la déshydratation. Conservez les queues (ou les segments restants) enveloppées dans de la gaze humide jusqu’à ce que toute la procédure de dissection soit terminée. - Utilisez un scalpel (no 20) pour enlever les tissus mous aussi complètement que possible de la colonne vertébrale caudale afin de faciliter l’identification des IDIV. Retirez les processus épineux et transversaux des vertèbres avec une pince d’enlèvement des os.
REMARQUE: Sélectionnez les IDIV avec le diamètre souhaité. Des IDIV d’un diamètre compris entre 15 et 20 mm ont été utilisés dans l’étude actuelle. - Couper transversalement avec une pince osseuse à travers le milieu de chaque corps vertébral pour obtenir des segments de mouvement individuels. Mettez des segments de mouvement dans une boîte de Petri avec de la gaze mouillée avec la solution de Ringer.
- Localisez l’IDIV et la vertèbre par palpation et en déplaçant doucement les segments de mouvement. Faire deux coupes parallèles avec la scie à bande dans la plaque de croissance des IDIV, une de chaque côté de l’IVD. Identifier l’emplacement de la plaque de croissance en touchant et en trouvant le site convexe de la partie osseuse de la plaque d’extrémité (dure) adjacente au disque (mou) avec une distance de sécurité d’environ 0,5-1 mm de l’IVD vers la vertèbre. Assurez-vous que la lame de la scie à bande est refroidie avec la solution de Ringer tout en coupant les vertèbres.
- Transférer les IVD dans une boîte de Petri propre avec de la gaze propre mouillée avec la solution de Ringer.
REMARQUE: La gaze doit être humidifiée et pas trop humide pour éviter le gonflement des IDIV, - Utilisez la lame du scalpel pour gratter le corps vertébral (os rouge / rose), la plaque de croissance (cartilage blanc), laissez la plaque d’extrémité intacte (jaune-rose). Rendez les deux surfaces planes et parallèles pour la procédure de chargement. Transférer les IVD grattés dans une boîte de Petri fraîche avec de la gaze mouillée avec la solution de Ringer.
REMARQUE: Portez un gant de cotte de mailles pour protéger la main tout en tenant l’IVD et en grattant. - Mesurez la hauteur et le diamètre du disque avec un étrier. Nettoyez les caillots sanguins dans l’os des vertèbres avec la solution de Ringer à l’aide d’un système de lavage par jet.
- Transférer les IDIV dans des tubes en plastique de 50 mL, un IDIV par tube. Ajouter 25 mL de solution saline tamponnée au phosphate (PBS) + 10 % de pénicilline/streptomycine (P/S) par IVD et laisser trembler pendant 15 min sur un agitateur orbital à température ambiante.
- Aspirer le surnageant et ajouter 10 mL de PBS + 1% P/S par IVD pendant 2 min pour rincer les IVDs.
2. Culture et chargement des IDIV
- Transférer des disques dans des chambres d’IVD et ajouter un milieu de culture d’IVD (milieu Eagle modifié de Dulbecco (DMEM, 4,5 g/L de DMEM à haute teneur en glucose pour le groupe physiologique et 2 g/L de DMEM à faible teneur en glucose pour le groupe pathologique) + 1 % P/S + 2 % de sérum de veau fœtal + 1 % d’ITS (contient 5 μg/mL d’insuline, 6 μg/mL de transferrine et 5 ng/mL d’acide séléneux) + 50 μg/mL d’ascorbate-2-phosphate + 1 % d’acide aminé non essentiel + 50 μg/mL d’agent antimicrobien pour les cellules primaires) et placez-les dans un incubateur à 37 °C, 85 % d’humidité et 5 % deCO2.
- Culture des disques pendant 4 jours au sein d’un système bioréacteur selon des groupes expérimentaux16. Dans le groupe pathologique, maintenir des conditions de charge dégénératives à 0,32-0,5 MPa, 5 Hz pendant 2 h/jour. Dans le groupe témoin physiologique, utilisez un protocole de chargement de 0,02-0,2 MPa, 0,2 Hz pendant 2 h/jour.
NOTA : Placer les IDIV dans des chambres contenant 5 mL de milieu IDIV pendant les procédures de chargement. Le volume dépend de la taille des chambres de chargement du bioréacteur. Entre les procédures de chargement, placez les IDIV dans des plaques de six puits avec 7 mL de milieu de culture IVD pour une récupération de gonflement libre. - Pour analyser les changements de hauteur du disque pendant la période expérimentale, mesurer la hauteur du disque avec un étrier après dissection IVD (ligne de base), puis quotidiennement après la période de gonflement libre et après la charge dynamique pendant la durée expérimentale.
3. Injection intradiscal de facteur-alpha de nécrose tumorale (TNF-α)
- Directement après le premier cycle de chargement dynamique le jour 1, placez les IDIV dans une boîte de Petri en position verticale et stabilisez les IDIV avec une pince à épiler.
- Injecter du TNF-α recombinant (100 ng dans 70 μL de PBS par IVD) avec une aiguille d’insuline de calibre 30 dans le tissu pulpeux du noyau du groupe pathologique17. Injecter lentement à une vitesse d’environ 70 μL en 1 min.
- Après l’injection, tirez la seringue à mi-chemin dans l’IDIV et tirez sur le piston de la seringue pour créer un vide qui empêche la solution injectée de fuir vers l’arrière, avant de retirer complètement l’aiguille et la seringue de l’IDIV.
NOTA : Effectuer une expérience pilote en injectant du PBS contenant du colorant bleu trypan pour évaluer la distribution de la solution injectée après le chargement et la culture pendant la nuit.
4. Expression génique
- Récoltez les IDIV le jour 4. Recueillir le tissu pulpeux du noyau (NP) (partie gélifiante au milieu de la MIIV) avec un poinçon de biopsie. Recueillir l’anneau externe fibreux (AF) avec une lame de scalpel (No.20).
REMARQUE: Pour la référence de référence au jour 0, recueillir des tissus immédiatement après la dissection pour l’extraction de l’ARN. - Utilisez la quantité de tissu NP ou AF nécessaire pour l’analyse de l’expression génique, selon le plan expérimental.
REMARQUE: Pour les présentes expériences, environ 150 mg de tissu ont été utilisés. Le rapport entre la solution d’isolement de l’ARN et la masse tissulaire doit être d’au moins 2 mL par 100 à 150 mg de tissu pour une extraction efficace. - Digérer le tissu NP ou AF avec la solution de digestion (0,2% de pronase dans DMEM, filtre stérilisé) et incuber pendant 1 h à 37°C sous agitation magnétique18.
- Congeler instantanément les échantillons de tissus à l’aide d’azote liquide et pulvériser en une poudre fine. Diviser la poudre tissulaire pulvérisée également en deux tubes de 2 mL contenant chacun 1 mL de thiocyanate de guanidine et de phénol dans une solution de monophase (solution d’isolement de l’ARN).
- Effectuer l’homogénéisation dans des tubes de 2 mL contenant la solution d’isolement d’ARN et la poudre tissulaire pulvérisée. Homogénéiser la poudre tissulaire 5x avec une bille en acier inoxydable de 8 mm et un tissue-lyzer à 30 Hz pendant 3 min. Centrifuger à 12 000 x g,4 °C pendant 10 min et transférer le surnageant dans un tube frais. Les surnageants peuvent être conservés à -80 °C pendant au moins un mois.
- Ajouter 0,1 mL de 1-bromo-3-chloropropane (BCP) par 1 mL de solution d’isolement d’ARN et agiter vigoureusement pendant 15 s. Conserver le mélange obtenu à température ambiante sur un agitateur orbital pendant 15 min et centrifuger à 12 000 x g pendant 15 min à 4 °C.
REMARQUE: L’ARN reste exclusivement dans la phase aqueuse supérieure. - Transférer la phase aqueuse dans un tube frais et précipiter l’ARN avec 0,25 mL d’isopropanol et 0,25 mL de solution à forte précipitation de sel par 1 mL de solution d’isolement d’ARN utilisée pour l’homogénéisation initiale. Conserver les échantillons à température ambiante pendant 15 min sur un agitateur orbital et centrifuger à 12 000 x g pendant 8 min à 4 °C.
REMARQUE: Alternativement, utilisez la méthode d’extraction de l’ARN basée sur une colonne qui conduit généralement à une pureté d’ARN plus élevée mais à un rendement en ARN plus faible. - Retirer le surnageant et laver la pastille d’ARN avec 1 mL d’éthanol à 75 % par 1 mL de solution d’isolement d’ARN utilisée pour l’homogénéisation initiale. Centrifuger à 7 500 x g pendant 5 min à 4 °C.
- Retirez le lavage à l’éthanol et brièvement la pastille d’ARN sèche à l’air pendant 3 à 5 min. Dissoudre l’ARN dans 20 μL d’eau traitée au diéthylpyrocarbonate (DEPC) en faisant passer la solution plusieurs fois à travers une pointe de pipette et en incubant pendant 10 à 15 min à 55-60 °C.
- Mesurer l’absorbance à 230 nm, 260 nm et 280 nm (A230, A260 et A280 respectivement). A260 de 1,0 correspond à 40 μg/mL d’ARN. Un rapport A260/A280 de 1,6-1,9 est attendu, tandis que la contamination entraîne un rapport A260/A280 de <1,6.
- Préparer un mélange de réaction par transcriptase inverse (RT) pour un volume de réaction de 20 μL. Le mélange contient un mélange d’enzymes RT, un inhibiteur de la ribonucléase, une protéine auxiliaire, des amorces, des dNTPs, du MgCl2,de l’eau sans RNase et 0,4 μg d’échantillon d’ARN.
- Centrifuger brièvement les tubes RT pour mélanger tous les composants au fond du tube.
- Placez les échantillons dans l’instrument thermocycleur. Sélectionnez le programme approprié pour le RT. Exécutez le RT pendant 10 min à 25 °C, suivi de l’étape de transcription inverse pendant 120 min à 42 °C et de l’inactivation de la transcriptase inverse pendant 5 min à 85 °C, en la refroidissant à 4 °C à la fin.
- Diluer l’ADNc résultant avec du tampon d’acide tris(hydroxyméthyl)aminométhane (tris)-éthylènediaminetétraacétique (EDTA) (TE) (tris 10 mM avec 1 mM d’EDTA) à une concentration finale de 0,4 μg d’ARN utilisée pour la RT par solution d’ADNc à 100 μL. Conserver les échantillons d’ADNc à -20 °C.
- Effectuer une réaction en chaîne de la polymérase (PCR) en temps réel à l’aide d’un volume de réaction de 10 μL. Le volume de réaction contient le mélange maître (contenant de l’ADN polymérase, de l’uracile-ADN glycosylase, des dNTPs avec dUTP, des composants tampons passifs et optimisés), l’amorce avant 45 μM, l’amorce inverse 45 μM, la sonde 12,5 μM (contenant un colorant rapporteur lié à l’extrémité 5' de la sonde, un liant de rainure mineur à l’extrémité 3' de la sonde et un quencher non fluorescent à l’extrémité 3' de la sonde) , 2 μL d’ADNc et d’eau traitée au DEPC.
- Exécuter un témoin endogène (RPLP0) pour la quantification relative avec la méthode 2-ΔΔCT 19.
- Ajoutez des exemples en double et exécutez un contrôle sans modèle en ajoutant TE-buffer au lieu de cDNA. Exécuter la PCR aux conditions standard (2 min à 50 °C, 10 min à 95 °C, 40 cycles de 15 s à 95 °C et 1 min à 60 °C).
- Effectuer une quantification relative des cibles d’ARNm en suivant la méthode de TDM comparative. La quantité d’ARNm normalisée à l’échantillon de base est calculée comme 2-ΔΔCT, tandis que ΔΔCT est la différence entre le ΔCT (CT cible - CT contrôle endogène) de l’échantillon et ΔCT (CT cible et CT contrôle endogène) de l’échantillon de base.
5. Quantification de la teneur en protéines dans le milieu IVD
- Prélever le milieu conditionné par les échantillons d’IDIV pour mesurer la teneur en protéines dans le milieu. Effectuer un dosage immunoenzymatique (ELISA) selon le protocole de la protéine cible.
- L’interleukine bovine-8 (IL-8) est quantifiée par le kit ELISA IL8 anti-bovin conformément aux instructions du fabricant.
Access restricted. Please log in or start a trial to view this content.
Résultats
La charge dégénérative dans le milieu à faible teneur en glucose combinée à l’injection de TNF-α a provoqué une augmentation significative de l’expression génique des marqueurs pro-inflammatoires interleukine 6 (IL-6) et interleukine 8 (IL-8) par rapport au groupe témoin physiologique dans les cellules NP après 4 jours de culture(Figure 2). En revanche, nous n’avons pas observé de changements significatifs pour les gènes pro-inflammatoires interleukine 1β (IL-1β) et TNF-...
Access restricted. Please log in or start a trial to view this content.
Discussion
Nous avons ici fourni un protocole détaillé pour simuler l’IVDD dégénératif et inflammatoire. Ce protocole peut être appliqué pour des examens détaillés des voies inflammatoires menant aux effets destructeurs sur le disque. De plus, le protocole peut aider à déterminer des cibles thérapeutiques prometteuses impliquées dans la progression de la maladie.
Nous avons récemment montré que le TNF-α recombinant humain pouvait induire une inflammation dans les cellules NP bovines et ...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par la Fondation AO et AOSpine International. Babak Saravi a reçu le soutien de la Fondation allemande de la colonne vertébrale et de la Fondation allemande de l’arthrose. Gernot Lang a été soutenu par le Berta-Ottenstein-Programme for Advanced Clinician Scientists, Faculté de médecine, Université de Fribourg, Allemagne.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 1-Bromo-3-chloropropane(BCP) | Sigma-Aldrich, St. Louis, USA | B9673 | |
| Ascorbate-2-phosphate | Sigma-Aldrich, St. Louis, USA | A8960 | |
| Band saw | Exakt Apparatebau, Norderstedt, Germany | model 30/833 | |
| Betadine | Munndipharma, Frankfurt, Germany | ||
| Bovine IL-8 Do.it-Yourself ELISA | Kingfisher Biotech, St. Paul, USA | DIY1028B-003 | |
| Corning ITS Premix | Corning Inc., New York, USA | 354350 | |
| DMEM high glucose | Gibco by life technologies, Carlsbad, USA | 10741574 | |
| DMEM low glucose | Gibco by life technologies, Carlsbad, USA | 11564446 | |
| Ethanol for molecular biology | Sigma-Aldrich, St. Louis, USA | 09-0851 | |
| Fetal Bovine Serum (FBS) | Gibco by life technologies, Carlsbad, USA | A4766801 | |
| Non-essential amino acid solution | Gibco by life technologies, Carlsbad, USA | 11140050 | |
| Penicillin/Streptomycin(P/S) | gibco by life technologies, Carlsbad, USA | 11548876 | |
| Phosphate Buffer Solution, tablet | Sigma-Aldrich, St. Louis, USA | P4417 | |
| Pronase | Sigma-Aldrich, St. Louis, USA | 10165921001 | |
| Primocin | InvivoGen, Sandiego, USA | ant-pm-05 | |
| Pulsavac Jet Lavage System | Zimmer, IN,USA | ||
| TissueLyser II | Quiagen, Venlo, Netherlands | 85300 | |
| Streptavidinn-HRP | Kingfisher Biotech, St. Paul, USA | AR0068-001 | |
| Superscript VILO | Invitrogen by life Technologies, Carlsbad, USA | 10704274 | |
| cDNA Synthesis Kit | Applied Biosystems by life technologies | 10400745 | |
| TaqMan Universal Master Mix | Applied Biosystems by life technologies | ||
| TNF-alpha, recombinant human protein | R&D systems, Minnesota, USA | 210-TA-005 | |
| TRI Reagent | Molecular Research Center, Cincinnati, USA | TR 118 | |
| Tris-EDTA buffer solution | sigma-Aldrich, St. Louis, USA | 93283 | |
| Gene bIL-6 | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTC CAA AAA TGG AGG AAA AGG A Primer rev (5′–3′) TCC AGA AGA CCA GCA GTG GTT Probe (5′FAM/3′TAMRA) CTT CCA ATC TGG GTT CAA TCA GGC GATT |
| Gene bIL8 | Applied Biosystems by life technologies | Bt03211906_m1 | |
| Gene bTNF-alpha | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) CCT CTT CTC AAG CCT CAA GTA ACA A Primer rev (5′–3′) GAG CTG CCC CGG AGA GTT Probe (5′FAM/3′TAMRA) ATG TCG GCT ACA ACG TGG GCT ACC G |
| GENE bIL1beta | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTA CTA CAG TGA CGA GAA TGA GCT GTT Primer rev (5′–3′) GGT CCA GGT GTT GGA TGC A Probe (5′FAM/3′TAMRA) CTC TTC ATC TGT TTA GGG TCA TCA GCC TCA A |
| RPLP0 | Applied Biosystems by life technologies | Bt03218086_m1 |
Références
- Vos, T., et al. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet. 390 (10100), 1211-1259 (2017).
- Hoy, D., et al. Measuring the global burden of low back pain. Best Practice & Research Clinical Rheumatology. 24 (2), 155-165 (2010).
- Thiese, M. S., et al. Prevalence of low back pain by anatomic location and intensity in an occupational population. BMC Musculoskeletal Disorders. 15 (1), 283(2014).
- Katz, J. N. Lumbar Disc Disorders and Low-Back Pain: Socioeconomic Factors and Consequences. The Journal of Bone and Joint Surgery (American). 88, suppl_2 21(2006).
- Vlaeyen, J. W. S., et al. Low back pain. Nature Reviews Disease Primers. 4 (1), 52(2018).
- Khan, A. N., et al. Inflammatory biomarkers of low back pain and disc degeneration: a review: Biomarkers of disc degeneration and back pain. Annals of the New York Academy of Sciences. 1410 (1), 68-84 (2017).
- Kim, H. S., Wu, P. H., Jang, I. T. Lumbar Degenerative Disease Part 1: Anatomy and Pathophysiology of Intervertebral Discogenic Pain and Radiofrequency Ablation of Basivertebral and Sinuvertebral Nerve Treatment for Chronic Discogenic Back Pain: A Prospective Case Series and Review of Literature. International Journal of Molecular Sciences. 21 (4), 1483(2020).
- Adams, M. A., Roughley, P. J. What is Intervertebral Disc Degeneration, and What Causes It. Spine. 31 (18), 2151-2161 (2006).
- Wu, P. H., Kim, H. S., Jang, I. T. Intervertebral Disc Diseases Part 2: A Review of the Current Diagnostic and Treatment Strategies for Intervertebral Disc Disease. International Journal of Molecular Sciences. 21 (6), 2135(2020).
- Lurie, J. D., et al. Surgical Versus Nonoperative Treatment for Lumbar Disc Herniation: Eight-Year Results for the Spine Patient Outcomes Research Trial. Spine. 39 (1), 3-16 (2014).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews Rheumatology. 10 (1), 44-56 (2014).
- Ponnappan, R. K., et al. An organ culture system to model early degenerative changes of the intervertebral disc. Arthritis Research & Therapy. 13 (5), 171(2011).
- O'Connell, G. D., Vresilovic, E. J., Elliott, D. M. Comparison of Animals Used in Disc Research to Human Lumbar Disc Geometry. Spine. 32 (3), 328-333 (2007).
- Stannard, J. T., et al. Development of a whole organ culture model for intervertebral disc disease. Journal of Orthopaedic Translation. 5, 1-8 (2016).
- Li, Z., et al. Preclinical ex-vivo Testing of Anti-inflammatory Drugs in a Bovine Intervertebral Degenerative Disc Model. Frontiers in Bioengineering and Biotechnology. 8, 583(2020).
- Li, Z., et al. Development of an ex vivo cavity model to study repair strategies in loaded intervertebral discs. European Spine Journal. 25 (9), 2898-2908 (2016).
- Kazezian, Z., Li, Z., Alini, M., Grad, S., Pandit, A. Injectable hyaluronic acid down-regulates interferon signaling molecules, IGFBP3 and IFIT3 in the bovine intervertebral disc. Acta Biomaterialia. 52, 118-129 (2017).
- Caprez, S., Menzel, U., Li, Z., Grad, S., Alini, M., Peroglio, M. Isolation of high-quality RNA from intervertebral disc tissue via pronase predigestion and tissue pulverization. JOR Spine. 1 (2), 1017(2018).
- Lopa, S., Ceriani, C., Cecchinato, R., Zagra, L., Moretti, M., Colombini, A. Stability of housekeeping genes in human intervertebral disc, endplate and articular cartilage cells in multiple conditions for reliable transcriptional analysis. European Cells & Materials. 31, 395-406 (2016).
- Lang, G., et al. An intervertebral disc whole organ culture system to investigate proinflammatory and degenerative disc disease condition. Journal of Tissue Engineering and Regenerative Medicine. 12 (4), 2051-2061 (2018).
- Du, J., et al. Proinflammatory intervertebral disc cell and organ culture models induced by tumor necrosis factor alpha. JOR Spine. 3, 1104(2020).
- Purmessur, D., Walter, B. A., Roughley, P. J., Laudier, D. M., Hecht, A. C., Iatridis, J. A role for TNFα in intervertebral disc degeneration: A non-recoverable catabolic shift. Biochemical and Biophysical Research Communications. 433 (1), 151-156 (2013).
- Walter, B. A., Likhitpanichkul, M., Illien-Junger, S., Roughley, P. J., Hecht, A. C., Iatridis, J. C. TNFα Transport Induced by Dynamic Loading Alters Biomechanics of Intact Intervertebral Discs. PLOS One. 10 (3), 0118358(2015).
- Gullbrand, S. E., et al. A large animal model that recapitulates the spectrum of human intervertebral disc degeneration. Osteoarthritis and Cartilage. 25 (1), 146-156 (2017).
- Willems, N., et al. Safety of intradiscal injection and biocompatibility of polyester amide microspheres in a canine model predisposed to intervertebral disc degeneration: intradiscal application of pea microspheres. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 105 (4), 707-714 (2017).
- Michalek, A. J., Buckley, M. R., Bonassar, L. J., Cohen, I., Iatridis, J. C. The effects of needle puncture injury on microscale shear strain in the intervertebral disc annulus fibrosus. The Spine Journal. 10 (12), 1098-1105 (2010).
- Illien-Jünger, S., et al. The combined effects of limited nutrition and high-frequency loading on intervertebral discs with endplates. Spine. 35 (19), 1744-1752 (2010).
- Gantenbein, B., et al. Organ culture bioreactors--platforms to study human intervertebral disc degeneration and regenerative therapy. Current Stem Cell Research & Therapy. 10 (4), 339-352 (2015).
- Boubriak, O. A., Watson, N., Sivan, S. S., Stubbens, N., Urban, J. P. G. Factors regulating viable cell density in the intervertebral disc: blood supply in relation to disc height. Journal of Anatomy. 222 (3), 341-348 (2013).
- Maroudas, A., Stockwell, R. A., Nachemson, A., Urban, J. Factors involved in the nutrition of the human lumbar intervertebral disc: cellularity and diffusion of glucose in vitro. Journal of Anatomy. 120, Pt 1 113-130 (1975).
- Beckstein, J. C., Sen, S., Schaer, T. P., Vresilovic, E. J., Elliott, D. M. Comparison of Animal Discs Used in Disc Research to Human Lumbar Disc: Axial Compression Mechanics and Glycosaminoglycan Content. Spine. 33 (6), 166-173 (2008).
- Walter, B. A., Illien-Jünger, S., Nasser, P. R., Hecht, A. C., Iatridis, J. C. Development and validation of a bioreactor system for dynamic loading and mechanical characterization of whole human intervertebral discs in organ culture. Journal of Biomechanics. 47 (9), 2095-2101 (2014).
- Rajan, N. E., et al. Toll-Like Receptor 4 (TLR4) Expression and Stimulation in a Model of Intervertebral Disc Inflammation and Degeneration. Spine. 38 (16), 1343-1351 (2013).
- vanden Akker, G. G., Rorije, A. J., Davidson, E. N. B., vander Kraan, P. M. Phenotypic marker genes distinguish inner and outer annulus fibrosus from nucleus pulposus tissue in the bovine intervertebral disc. Osteoarthritis and Cartilage. 25, 402(2017).
- Du, J., et al. Functional cell phenotype induction with TGF-β1 and collagen-polyurethane scaffold for annulus fibrosus rupture repair. European Cells & Materials. 39, 1-17 (2020).
- Risbud, M. V., et al. Defining the phenotype of young healthy nucleus pulposus cells: recommendations of the Spine Research Interest Group at the 2014 annual ORS meeting. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 33 (3), 283-293 (2015).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon