Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Провоспалительная, дегенеративная модель культуры органов для моделирования ранней стадии заболевания межпозвоночных дисков.
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол представляет собой новую экспериментальную модель провоспалительной, дегенеративной культуры органов крупного рогатого потребления для имитации дегенерации межпозвоночных дисков на ранней стадии.
Аннотация
Симптоматическая дегенерация межпозвоночных дисков (IVD) (IDD) является основным социально-экономическим бременем и характеризуется воспалением и деградацией тканей. Из-за отсутствия причинно-следственной терапии существует острая необходимость в инновационных экспериментальных моделях культуры органов для изучения механизмов, участвующих в прогрессировании заболевания, поиска терапевтических целей и снижения потребности в животных моделях. Здесь мы представляем новый трехмерный протокол модели культуры органов, имитирующий провоспалительное и катаболическое микросредование, которое присутствует во время IDD.
Первоначально каудальные IVD крупного рогатого готья были рассечены, очищены и культивированы в тканевой культуральной среде. Динамическая физиологическая или патологическая нагрузка применялась в специально изготовленном биореакторе в течение 2 часов в день. IVD были отнесены к контрольной группе (высокая глюкозная среда, физиологическая нагрузка, инъекция фосфатно-буферного физиологического раствора) и патологической группе (низкая глюкозная среда, патологическая нагрузка, фактор некроза опухоли-альфа-инъекция) в течение четырех дней. Проведен анализ экспрессии генов из собранных клеток пульпозного ядра IVD и иммуноферментный анализ кондиционированной культуры органов.
Наши данные выявили более высокую экспрессию воспалительных маркеров и снижение высоты диска после нагрузки в патологической группе по сравнению с контрольной группой. Этот протокол надежен для моделирования воспаления и дегенерации IVD и может быть дополнительно расширен для расширения сферы его применения.
Введение
Боль в пояснице (LBP) может поражать людей всех возрастов и является основной причиной инвалидности во всем мире1,2,3. Общая стоимость, связанная с LBP, превышает $100 млрд в год4,5. Симптоматическая дегенерация межпозвоночного диска (IVD), состояние, характеризующееся воспалением и деградацией тканей, является основной причиной LBP6,7. В частности, IDD характеризуется постепенно развивающимся распадом внеклеточного матрикса IVD (ECM), индуцированным и вызванным несколькими факторами, которые приводят к ускоренной патологии, неврологическим расстройствам и, в конечном итоге, инвалидности. Кроме того, IDD связан с высвобождением провоспалительных цитокинов, измененной биомеханикой позвоночника, ангиогенезом и враставанием нервов, что увеличивает болевые ощущения, в совокупности вызывая хронический LBP (активная дископатия)6,8. На сегодняшний день варианты лечения включают дискэктомию и последующее сращение соседних позвонков, имплантацию протеза IVD или нехирургические подходы, такие как нестероидные противовоспалительные препараты, опиоиды и миорелаксанты для пациентов с IDD9. Оба современных стандартных терапевтических варианта, хирургические и нехирургические, эффективны лишь частично и не решают основную биологическую проблему9,10. Ранняя стадия дегенеративного заболевания диска характеризуется начальной воспалительной реакцией тканей, особенно увеличением экспрессии фактора некроза опухоли-альфа (TNF-альфа)11. Эти ранние изменения диска в основном происходят на клеточном уровне без нарушения архитектуры диска и ранее могли имитироваться дефицитом питательных веществ при провоспалительных состояниях12. Поэтому точное моделирование ситуации in vivo для исследования этих механизмов дегенерации и поиска подходящих терапевтических целей имеет решающее значение. Кроме того, к этим симуляциям молекулярных свойств механическая нагрузочная среда дисков играет ключевую роль в патологических и физиологических изменениях IVD. Следовательно, объединение этих подходов принесло бы нам один шаг вперед, чтобы имитировать сложную микросреду IVD in vivo. В настоящее время нет исследований, рассматривающих аспект динамической нагрузки наряду с провоспалительными и питательными настройками, насколько нам известно.
Хотя модели крупных животных позволяют иследовать потенциальные релевантные взаимодействия in vivo, они являются дорогостоящими и трудоемкими. Более того, поскольку использование животных моделей в исследованиях уже давно является предметом споров, сокращение числа животных, необходимых для ответа на важные исследовательские вопросы, представляет большой интерес. Наконец, в настоящее время не существует идеальной модели животных для имитации IDD в исследованиях IVD13,14. Поэтому необходимо установить экономически эффективную и надежную замену, такую как модель культуры органов для моделирования IDD и связанных с ним воспалительных и дегенеративных процессов. В последнее время применение настоящего протокола по созданию провоспалительной и дегенеративной модели культуры органов для моделирования ранней стадии заболевания межпозвоночных дисков позволило исследовать действие противовоспалительных препаратов в культуре органов IDD15.
Здесь мы описываем, как получить бычьи межпозвоночные диски и индуцировать состояние ранней стадии IDD через катаболическую и провоспалительную микросреду, вызванную прямой внутридискальной инъекцией фактора некроза опухоли-альфа (TNF-α) и дегенеративной нагрузкой в биореакторе в условиях низкопитательной среды. Рисунок 1 иллюстрирует экспериментальную модель и показывает биореактор, используемый для моделирования дегенеративных и физиологических условий нагрузки.
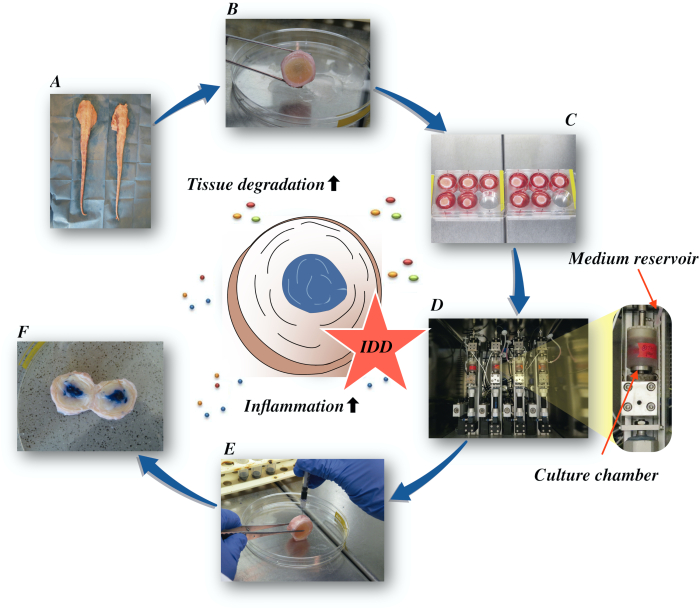
Рисунок 1:Иллюстрация экспериментальной установки. A: хвост крупного рогатого готья; В:рассеченные межпозвоночные диски крупного рогатого готья; C:перенос диска на хорошо известняковую пластину с питательной средой; D:загрузка моделирования в биореактор; E:техника внутридискальных инъекций; F:IVD после инъекции красителя PBS/трипан синего цвета для выявления распределения. IDD: дегенерация межпозвоночных дисков. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
Эксперименты проводились с использованием хвостов крупного рогатого готья, полученных с местных скотоотворь. Биологические материалы, используемые в текущем исследовании, взяты из пищевой цепи и не требуют этического одобрения в швейцарском и европейском законодательстве.
1. Рассечение межпозвоночного диска крупного рогатого готья
- Тщательно промойте весь хвост водопроводной водой, чтобы удалить грязь и волосы на поверхности.
ПРИМЕЧАНИЕ: С неповрежденными, дистальными концами, максимум 9 IVD (копчик 1-9) на хвост могут быть использованы для экспериментов в зависимости от желаемого размера IVD. Учитывая желаемый диаметр между 15-20 мм, мы использовали для экспериментов 12 хвостов крупного рогатого лова с 5 IVD на хвост. - Погрузите весь хвост в коробку, содержащую 1% раствор бетадина, на 10 мин. Ненадолго высушите хвост стерильной марлей и положите его на стерильную драпировку.
ПРИМЕЧАНИЕ: Во время рассечения диска увлажните хвосты смоченной марлей раствора Рингера, чтобы предотвратить обезвоживание. Храните хвосты (или оставшиеся сегменты), завернутые во влажную марлю, до тех пор, пока не будет завершена вся процедура рассечения. - Используйте скальпель (No 20), чтобы удалить мягкие ткани как можно полнее из каудального отдела позвоночника, чтобы облегчить идентификацию IVD. Удалить остистые и поперечные отростки позвонков плоскогубцами.
ПРИМЕЧАНИЕ: Выберите IVD с нужным диаметром. В текущем исследовании использовались IVD с диапазоном диаметров 15-20 мм. - Разрезайте поперечно плоскогубцами через середину каждого тела позвонка, чтобы получить отдельные сегменты движения. Положите сегменты движения в чашку Петри марлей, смоченную раствором Рингера.
- Найдите IVD и позвонок путем пальпации и мягкого перемещения сегментов движения. Сделайте два параллельных разреза ленточной пилой в пластине роста IVD, по одному с каждой стороны IVD. Определите расположение пластины роста, коснувшись и найдя выпуклое место костной концевой части (твердой), прилегающей к диску (мягкой) с предохранительный путь примерно 0,5-1 мм от IVD по направлению к позвонку. Убедитесь, что лезвие ленточной пилы охлаждается раствором Рингера при резке позвонков.
- Переложите IVD в чистую чашку Петри с чистой марлей, смочещенной раствором Рингера.
ПРИМЕЧАНИЕ: Марля должна быть увлажнена и не слишком влажной, чтобы предотвратить отек IVD, - Используйте лезвие скальпеля, чтобы соскоблить тело позвонка (красная / розовая кость), пластину роста (белый хрящ), оставить концевую пластину нетронутой (желто-розовый). Сделайте две поверхности плоскими и параллельными для процедуры загрузки. Переложите соскобленные капельницы в свежую чашку Петри с марлей, смоченной раствором Рингера.
ПРИМЕЧАНИЕ: Наденьте перчатку для кольчуга, чтобы защитить руку, удерживая IVD и соскребая. - Измерьте высоту и диаметр диска с помощью суппорта. Очистите сгустки крови в кости позвонков раствором Рингера с помощью струйной системы промывки.
- Перенесите IVD в пластиковые трубки объемом 50 мл, по одной IVD на трубку. Добавьте 25 мл фосфатно-буферного физиологического раствора (PBS) + 10% пенициллина / стрептомицина (P / S) на IVD и оставьте его трясущимся в течение 15 минут на орбитальном шейкере при комнатной температуре.
- Аспирировать супернатант и добавить 10 мл PBS + 1% P/S на IVD в течение 2 мин для промывки IVD.
2. Культура и загрузка IVD
- Перенесите диски в камеры IVD и добавьте культуральную среду IVD (модифицированная орлиная среда Dulbecco (DMEM, 4,5 г / л высокоуглекового DMEM для физиологической группы и 2 г / л низкой глюкозы DMEM для патологической группы) + 1% P / S + 2% сыворотки для телят плода + 1% ITS (содержит 5 мкг / мл инсулина, 6 мкг / мл трансферрина и 5 нг / мл селеновой кислоты) + 50 мкг / мл аскорбат-2-фосфат + 1% незаменяемой аминокислоты + 50 мкг / мл антимикробного агента для первичных клеток) и поместить в инкубатор при 37 °C, 85% влажности и 5% CO2.
- Культивируйте диски в течение 4 дней в системе биореактора по экспериментальным группам16. В патологической группе поддерживают дегенеративные нагрузочные условия на уровне 0,32-0,5 МПа, 5 Гц в течение 2 ч/сут. В физиологической контрольной группе используют протокол нагрузки 0,02-0,2 МПа, 0,2 Гц в течение 2 ч/сут.
ПРИМЕЧАНИЕ: Поместите IVD в камеры, содержащие 5 мл среды IVD во время процедур загрузки. Объем зависит от размера загрузочных камер биореактора. Между процедурами загрузки поместите IVD в шестилунные пластины с 7 мл питательной среды IVD для восстановления свободного отека. - Для анализа изменений высоты диска в течение экспериментального периода измеряют высоту диска суппортом после рассечения IVD (исходный уровень), а затем ежедневно после периода свободного набухания и после динамической нагрузки в течение экспериментальной продолжительности.
3. Внутридисковый фактор некроза опухоли-альфа (TNF-α) инъекция
- Непосредственно после первого динамического цикла загрузки в день 1 поместите IVD в чашку Петри в вертикальном положении и стабилизируем IVD пинцетем.
- Вводят рекомбинантную TNF-α (100 нг в 70 мкл PBS на IVD) инсулиновой иглой 30-го калибра в пульпозное ядро ткани патологической группы17. Вводят медленно со скоростью примерно 70 мкл через 1 мин.
- После инъекции потяните шприц на полпути назад в IVD и потяните плунжер шприца, чтобы создать вакуум, который предотвращает утечку введенного раствора обратно, прежде чем полностью удалить иглу и шприц из IVD.
ПРИМЕЧАНИЕ: Выполните пилотный эксперимент путем инъекции PBS, содержащего краситель трипан синего цвета, для оценки распределения введенного раствора после загрузки и ночной культуры.
4. Экспрессия генов
- Соберите урожай IVD на 4-й день. Соберите ткань пульпозного ядра (NP) (гелевая часть в середине IVD) с помощью биопсийного пунша. Соберите наружное волокнистое кольцо (ФП) лезвием скальпеля (No20).
ПРИМЕЧАНИЕ: Для исходного значения в день 0 соберите ткани сразу после рассечения для экстракции РНК. - Используйте количество NP или AF ткани, необходимое для анализа экспрессии генов, в зависимости от экспериментального дизайна.
ПРИМЕЧАНИЕ: Для настоящих экспериментов использовалось приблизительно 150 мг ткани. Отношение раствора для выделения РНК к массе ткани должно составлять не менее 2 мл на 100-150 мг ткани для эффективной экстракции. - Переварить NP или AF ткань с раствором для пищеварения (0,2% проназа в ДМЭМ, фильтр стерилизовать) и инкубировать в течение 1 ч при 37 °C с магнитным перемешиванием18.
- Мгновенно заморозьте образцы тканей с использованием жидкого азота и измельчите до мелкого порошка. Разделите измельченный тканевый порошок поровну поровну на две пробирки по 2 мл, каждая из которых содержит 1 мл гуанидина тиоцианата и фенола в монофазном растворе (раствор для выделения РНК).
- Выполняют гомогенизацию в пробирках по 2 мл, содержащих раствор для выделения РНК и измельченный тканевый порошок. Гомогенизируйте тканевый порошок 5x шариком из нержавеющей стали толщиной 8 мм и тканевым лизером при 30 Гц в течение 3 мин. Центрифуга при 12 000 х г,4 °C в течение 10 мин и перенесите супернатант в свежую трубку. Супернатанты могут храниться при -80 °C в течение, по меньшей мере, одного месяца.
- Добавьте 0,1 мл 1-бром-3-хлорпропана (BCP) на 1 мл раствора для выделения РНК и энергично встряхивайте в течение 15 с. Хранить полученную смесь при комнатной температуре на орбитальном шейкере в течение 15 мин и центрифуге при 12 000 х г в течение 15 мин при 4 °C.
ПРИМЕЧАНИЕ: РНК остается исключительно в верхней водной фазе. - Перенесите водный раствор в свежую пробирку и осадите РНК с 0,25 мл изопропанола и 0,25 мл раствора с высоким содержанием осадков соли на 1 мл раствора для выделения РНК, используемого для первоначальной гомогенизации. Храните образцы при комнатной температуре в течение 15 мин на орбитальном шейкере и центрифуге при 12 000 х г в течение 8 мин при 4 °C.
ПРИМЕЧАНИЕ: В качестве альтернативы, используйте метод экстракции РНК на основе колонки, который обычно приводит к более высокой чистоте РНК, но более низкому выходу РНК. - Удалить супернатант и промыть гранулу РНК 1 мл 75% этанола на 1 мл раствора для выделения РНК, используемого для первоначальной гомогенизации. Центрифуга при 7 500 х г в течение 5 мин при 4 °C.
- Удалите промывку этанолом и ненадолго высушите гранулы РНК на воздухе в течение 3-5 мин. Растворяют РНК в 20 мкл воды, обработанной диэтилпирокарбонатом (DEPC), пропуская раствор несколько раз через наконечник пипетки и инкубируя в течение 10-15 мин при 55-60 °C.
- Измерьте поглощение при 230 нм, 260 нм и 280 нм (A230, A260 и A280 соответственно). A260 из 1,0 соответствует 40 мкг/мл РНК. Ожидается, что соотношение A260/A280 составит 1,6-1,9, тогда как загрязнение приводит к соотношению A260/A280 <1,6.
- Приготовьте реакционную смесь обратной транскриптазы (RT) для реакционного объема 20 мкл. Смесь содержит смесь ферментов RT, ингибитор рибонуклеазы, хелперный белок, праймеры, dNTP, MgCl2,воду без РНКазы и 0,4 мкг образца РНК.
- Кратковременно центрифугировать трубки RT, чтобы смешать все компоненты в нижней части трубки.
- Поместите образцы в термоциклер. Выберите подходящую программу для RT. Запустите RT в течение 10 мин при 25 °C, затем этап обратной транскрипции в течение 120 мин при 42 °C и инактивация обратной транскриптазы в течение 5 мин при 85 °C, охлаждая ее до 4 °C в конце.
- Разбавляют полученную кДНК с буфером Трис(гидроксиметил)аминометан (Трис)-этилендиаминтетрауксусной кислоты (ЭДТА) (ТЭ) (10 мМ Трис с 1 мМ ЭДТА) до конечной концентрации 0,4 мкг РНК, используемой для РТ на 100 мкл раствора кДНК. Храните образцы кДНК при -20 °C.
- Выполняйте полимеразную цепную реакцию (ПЦР) в режиме реального времени, используя реакционный объем 10 мкл. Реакционный объем содержит мастер-микс (содержащий ДНК-полимеразу, урацил-ДНК-гликозилазу, dNTP с dUTP, пассивные эталонные и оптимизированные буферные компоненты), форвардный праймер 45 мкМ, обратный праймер 45 мкМ, зонд 12,5 мкМ (содержащий репортерный краситель, связанный с 5'-концом зонда, связующее с незначительными канавками на 3'-конце зонда и флуоресцентный гаситель на 3'-конце зонда) , 2 мкл кДНК и вода, обработанная DEPC.
- Запустите эндогенный контроль (RPLP0) для относительной количественной оценки с помощью метода 2-ΔΔCT 19.
- Добавьте образцы в дубликатах и запустите элемент управления без шаблона, добавив TE-буфер вместо кДНК. Проводите ПЦР в стандартных условиях (2 мин при 50 °C, 10 мин при 95 °C, 40 циклов по 15 с при 95 °C и 1 мин при 60 °C).
- Выполнение относительной количественной оценки мишеней мРНК по методу сравнительной КТ. Количество мРНК, нормализованного к исходному образцу, рассчитывается как 2-ΔΔCT, тогда как ΔΔCT - это разница между ΔCT (мишень КТ - эндогенный контроль КТ) образца и ΔCT (мишень КТ и эндогенный контроль КТ) исходного образца.
5. Количественная оценка содержания белка в среде IVD
- Соберите среду, обусловленную образцами IVD, чтобы измерить содержание белка в среде. Выполняют иммуноферментный анализ (ИФА) по протоколу белка-мишени.
- Бытий интерлейцин-8 (IL-8) количественно определяется антибольбийским комплектом IL8 ELISA в соответствии с инструкцией производителя.
Результаты
Дегенеративная нагрузка в низкоглюконусной среде в сочетании с инъекцией TNF-α вызывала значительное повышение экспрессии генов провоспалительных маркеров интерлейкина 6 (IL-6) и интерлейкина 8 (IL-8) по сравнению с физиологической контрольной группой в NP-клетках после 4 дней культивирован?...
Обсуждение
Здесь мы предоставили подробный протокол для моделирования дегенеративного и воспалительного IVDD. Этот протокол может применяться для детального обследования воспалительных путей, приводящих к разрушительному воздействию на диск. Более того, протокол может помочь определить перспек...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана Фондом АО и АОСпайн Интернэшнл. Бабак Сарави получил стипендию от Немецкого фонда позвоночника и Немецкого фонда остеоартрита. Программа Берты-Оттенштайна для ученых-клиницистов, медицинский факультет Фрайбургского университета, Германия.
Материалы
| Name | Company | Catalog Number | Comments |
| 1-Bromo-3-chloropropane(BCP) | Sigma-Aldrich, St. Louis, USA | B9673 | |
| Ascorbate-2-phosphate | Sigma-Aldrich, St. Louis, USA | A8960 | |
| Band saw | Exakt Apparatebau, Norderstedt, Germany | model 30/833 | |
| Betadine | Munndipharma, Frankfurt, Germany | ||
| Bovine IL-8 Do.it-Yourself ELISA | Kingfisher Biotech, St. Paul, USA | DIY1028B-003 | |
| Corning ITS Premix | Corning Inc., New York, USA | 354350 | |
| DMEM high glucose | Gibco by life technologies, Carlsbad, USA | 10741574 | |
| DMEM low glucose | Gibco by life technologies, Carlsbad, USA | 11564446 | |
| Ethanol for molecular biology | Sigma-Aldrich, St. Louis, USA | 09-0851 | |
| Fetal Bovine Serum (FBS) | Gibco by life technologies, Carlsbad, USA | A4766801 | |
| Non-essential amino acid solution | Gibco by life technologies, Carlsbad, USA | 11140050 | |
| Penicillin/Streptomycin(P/S) | gibco by life technologies, Carlsbad, USA | 11548876 | |
| Phosphate Buffer Solution, tablet | Sigma-Aldrich, St. Louis, USA | P4417 | |
| Pronase | Sigma-Aldrich, St. Louis, USA | 10165921001 | |
| Primocin | InvivoGen, Sandiego, USA | ant-pm-05 | |
| Pulsavac Jet Lavage System | Zimmer, IN,USA | ||
| TissueLyser II | Quiagen, Venlo, Netherlands | 85300 | |
| Streptavidinn-HRP | Kingfisher Biotech, St. Paul, USA | AR0068-001 | |
| Superscript VILO | Invitrogen by life Technologies, Carlsbad, USA | 10704274 | |
| cDNA Synthesis Kit | Applied Biosystems by life technologies | 10400745 | |
| TaqMan Universal Master Mix | Applied Biosystems by life technologies | ||
| TNF-alpha, recombinant human protein | R&D systems, Minnesota, USA | 210-TA-005 | |
| TRI Reagent | Molecular Research Center, Cincinnati, USA | TR 118 | |
| Tris-EDTA buffer solution | sigma-Aldrich, St. Louis, USA | 93283 | |
| Gene bIL-6 | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTC CAA AAA TGG AGG AAA AGG A Primer rev (5′–3′) TCC AGA AGA CCA GCA GTG GTT Probe (5′FAM/3′TAMRA) CTT CCA ATC TGG GTT CAA TCA GGC GATT |
| Gene bIL8 | Applied Biosystems by life technologies | Bt03211906_m1 | |
| Gene bTNF-alpha | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) CCT CTT CTC AAG CCT CAA GTA ACA A Primer rev (5′–3′) GAG CTG CCC CGG AGA GTT Probe (5′FAM/3′TAMRA) ATG TCG GCT ACA ACG TGG GCT ACC G |
| GENE bIL1beta | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTA CTA CAG TGA CGA GAA TGA GCT GTT Primer rev (5′–3′) GGT CCA GGT GTT GGA TGC A Probe (5′FAM/3′TAMRA) CTC TTC ATC TGT TTA GGG TCA TCA GCC TCA A |
| RPLP0 | Applied Biosystems by life technologies | Bt03218086_m1 |
Ссылки
- Vos, T., et al. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet. 390 (10100), 1211-1259 (2017).
- Hoy, D., et al. Measuring the global burden of low back pain. Best Practice & Research Clinical Rheumatology. 24 (2), 155-165 (2010).
- Thiese, M. S., et al. Prevalence of low back pain by anatomic location and intensity in an occupational population. BMC Musculoskeletal Disorders. 15 (1), 283 (2014).
- Katz, J. N. Lumbar Disc Disorders and Low-Back Pain: Socioeconomic Factors and Consequences. The Journal of Bone and Joint Surgery (American). 88, 21 (2006).
- Vlaeyen, J. W. S., et al. Low back pain. Nature Reviews Disease Primers. 4 (1), 52 (2018).
- Khan, A. N., et al. Inflammatory biomarkers of low back pain and disc degeneration: a review: Biomarkers of disc degeneration and back pain. Annals of the New York Academy of Sciences. 1410 (1), 68-84 (2017).
- Kim, H. S., Wu, P. H., Jang, I. T. Lumbar Degenerative Disease Part 1: Anatomy and Pathophysiology of Intervertebral Discogenic Pain and Radiofrequency Ablation of Basivertebral and Sinuvertebral Nerve Treatment for Chronic Discogenic Back Pain: A Prospective Case Series and Review of Literature. International Journal of Molecular Sciences. 21 (4), 1483 (2020).
- Adams, M. A., Roughley, P. J. What is Intervertebral Disc Degeneration, and What Causes It. Spine. 31 (18), 2151-2161 (2006).
- Wu, P. H., Kim, H. S., Jang, I. T. Intervertebral Disc Diseases Part 2: A Review of the Current Diagnostic and Treatment Strategies for Intervertebral Disc Disease. International Journal of Molecular Sciences. 21 (6), 2135 (2020).
- Lurie, J. D., et al. Surgical Versus Nonoperative Treatment for Lumbar Disc Herniation: Eight-Year Results for the Spine Patient Outcomes Research Trial. Spine. 39 (1), 3-16 (2014).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews Rheumatology. 10 (1), 44-56 (2014).
- Ponnappan, R. K., et al. An organ culture system to model early degenerative changes of the intervertebral disc. Arthritis Research & Therapy. 13 (5), 171 (2011).
- O'Connell, G. D., Vresilovic, E. J., Elliott, D. M. Comparison of Animals Used in Disc Research to Human Lumbar Disc Geometry. Spine. 32 (3), 328-333 (2007).
- Stannard, J. T., et al. Development of a whole organ culture model for intervertebral disc disease. Journal of Orthopaedic Translation. 5, 1-8 (2016).
- Li, Z., et al. Preclinical ex-vivo Testing of Anti-inflammatory Drugs in a Bovine Intervertebral Degenerative Disc Model. Frontiers in Bioengineering and Biotechnology. 8, 583 (2020).
- Li, Z., et al. Development of an ex vivo cavity model to study repair strategies in loaded intervertebral discs. European Spine Journal. 25 (9), 2898-2908 (2016).
- Kazezian, Z., Li, Z., Alini, M., Grad, S., Pandit, A. Injectable hyaluronic acid down-regulates interferon signaling molecules, IGFBP3 and IFIT3 in the bovine intervertebral disc. Acta Biomaterialia. 52, 118-129 (2017).
- Caprez, S., Menzel, U., Li, Z., Grad, S., Alini, M., Peroglio, M. Isolation of high-quality RNA from intervertebral disc tissue via pronase predigestion and tissue pulverization. JOR Spine. 1 (2), 1017 (2018).
- Lopa, S., Ceriani, C., Cecchinato, R., Zagra, L., Moretti, M., Colombini, A. Stability of housekeeping genes in human intervertebral disc, endplate and articular cartilage cells in multiple conditions for reliable transcriptional analysis. European Cells & Materials. 31, 395-406 (2016).
- Lang, G., et al. An intervertebral disc whole organ culture system to investigate proinflammatory and degenerative disc disease condition. Journal of Tissue Engineering and Regenerative Medicine. 12 (4), 2051-2061 (2018).
- Du, J., et al. Proinflammatory intervertebral disc cell and organ culture models induced by tumor necrosis factor alpha. JOR Spine. 3, 1104 (2020).
- Purmessur, D., Walter, B. A., Roughley, P. J., Laudier, D. M., Hecht, A. C., Iatridis, J. A role for TNFα in intervertebral disc degeneration: A non-recoverable catabolic shift. Biochemical and Biophysical Research Communications. 433 (1), 151-156 (2013).
- Walter, B. A., Likhitpanichkul, M., Illien-Junger, S., Roughley, P. J., Hecht, A. C., Iatridis, J. C. TNFα Transport Induced by Dynamic Loading Alters Biomechanics of Intact Intervertebral Discs. PLOS One. 10 (3), 0118358 (2015).
- Gullbrand, S. E., et al. A large animal model that recapitulates the spectrum of human intervertebral disc degeneration. Osteoarthritis and Cartilage. 25 (1), 146-156 (2017).
- Willems, N., et al. Safety of intradiscal injection and biocompatibility of polyester amide microspheres in a canine model predisposed to intervertebral disc degeneration: intradiscal application of pea microspheres. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 105 (4), 707-714 (2017).
- Michalek, A. J., Buckley, M. R., Bonassar, L. J., Cohen, I., Iatridis, J. C. The effects of needle puncture injury on microscale shear strain in the intervertebral disc annulus fibrosus. The Spine Journal. 10 (12), 1098-1105 (2010).
- Illien-Jünger, S., et al. The combined effects of limited nutrition and high-frequency loading on intervertebral discs with endplates. Spine. 35 (19), 1744-1752 (2010).
- Gantenbein, B., et al. Organ culture bioreactors--platforms to study human intervertebral disc degeneration and regenerative therapy. Current Stem Cell Research & Therapy. 10 (4), 339-352 (2015).
- Boubriak, O. A., Watson, N., Sivan, S. S., Stubbens, N., Urban, J. P. G. Factors regulating viable cell density in the intervertebral disc: blood supply in relation to disc height. Journal of Anatomy. 222 (3), 341-348 (2013).
- Maroudas, A., Stockwell, R. A., Nachemson, A., Urban, J. Factors involved in the nutrition of the human lumbar intervertebral disc: cellularity and diffusion of glucose in vitro. Journal of Anatomy. 120, 113-130 (1975).
- Beckstein, J. C., Sen, S., Schaer, T. P., Vresilovic, E. J., Elliott, D. M. Comparison of Animal Discs Used in Disc Research to Human Lumbar Disc: Axial Compression Mechanics and Glycosaminoglycan Content. Spine. 33 (6), 166-173 (2008).
- Walter, B. A., Illien-Jünger, S., Nasser, P. R., Hecht, A. C., Iatridis, J. C. Development and validation of a bioreactor system for dynamic loading and mechanical characterization of whole human intervertebral discs in organ culture. Journal of Biomechanics. 47 (9), 2095-2101 (2014).
- Rajan, N. E., et al. Toll-Like Receptor 4 (TLR4) Expression and Stimulation in a Model of Intervertebral Disc Inflammation and Degeneration. Spine. 38 (16), 1343-1351 (2013).
- vanden Akker, G. G., Rorije, A. J., Davidson, E. N. B., vander Kraan, P. M. Phenotypic marker genes distinguish inner and outer annulus fibrosus from nucleus pulposus tissue in the bovine intervertebral disc. Osteoarthritis and Cartilage. 25, 402 (2017).
- Du, J., et al. Functional cell phenotype induction with TGF-β1 and collagen-polyurethane scaffold for annulus fibrosus rupture repair. European Cells & Materials. 39, 1-17 (2020).
- Risbud, M. V., et al. Defining the phenotype of young healthy nucleus pulposus cells: recommendations of the Spine Research Interest Group at the 2014 annual ORS meeting. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 33 (3), 283-293 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены