Method Article
三维类器官和球状体模型的染色和高分辨率成像
* 这些作者具有相同的贡献
摘要
在这里,我们提供了详细、稳健和互补的方案,对从 100 μm 到几毫米的固定三维细胞培养模型进行染色和亚细胞分辨率成像,从而能够可视化它们的形态、细胞类型组成和相互作用。
摘要
体外三维 (3D) 细胞培养模型(如类器官和球状体)是许多应用的宝贵工具,包括开发和疾病建模、药物发现和再生医学。为了充分利用这些模型,在细胞和亚细胞水平上研究它们至关重要。然而,表征这种体外3D细胞培养模型在技术上可能具有挑战性,并且需要特定的专业知识来执行有效的分析。在这里,本文提供了详细、稳健和互补的方案,用于对 100 μm 至几毫米的固定体外 3D 细胞培养模型进行染色和亚细胞分辨率成像。这些方案适用于各种在细胞起源、形态和培养条件方面不同的类器官和球状体。从3D结构收集到图像分析,这些方案可以在4-5天内完成。简而言之,收集,固定3D结构,然后可以通过石蜡包埋和组织学/免疫组织化学染色进行处理,或者直接免疫标记并通过共聚焦显微镜制备用于光学清除和3D重建(200μm深度)。
引言
在过去的几十年里,干细胞生物学和体外3D培养技术的进步预示着生物学和医学的一场革命。3D中更高复杂性的细胞模型已经变得非常流行,因为它们允许细胞生长并与周围的细胞外框架相互作用,密切概括活组织的各个方面,包括它们的结构,细胞组织和相互作用,甚至扩散特性。因此,3D细胞培养模型可以为体外发育或患病组织中细胞的行为提供独特的见解。类器官和球状体都是多细胞3D结构,范围从几微米到毫米,是最突出的体外3D结构。两者都可以在支撑支架内培养,包括(i)来源于动物(基底膜提取物,胶原蛋白),植物(藻酸盐/琼脂糖)的水凝胶,或由化学品合成,或(ii)含有孔的惰性基质以促进细胞增殖和生长。
类器官和球状体也可以在没有支撑支架的情况下通过依靠细胞自组装成簇来发育。这依赖于不同的技术,例如使用非粘性材料来抑制细胞附着、表面张力和重力(例如,悬挂液滴技术)或容器的恒定圆周旋转(例如,旋转器培养)。在所有情况下,这些技术都促进了细胞间和细胞间基质的相互作用,以克服传统单层细胞培养的局限性1。术语"类器官"和"球状体"在过去可以互换使用,但这两种3D细胞培养模型之间存在关键差异。类器官是源自多能干细胞或组织特异性干细胞的体外3D细胞簇,其中细胞自发地自组织成祖细胞和分化细胞类型,并且至少概括了感兴趣器官的某些功能2。球状体包括在非贴壁条件下形成的更广泛的多细胞3D结构,并且可以产生于多种细胞类型,例如永生化细胞系或原代细胞3。因此,类器官固有于其固有的干细胞起源,比球状体具有更高的自组装、活力和稳定性。
然而,从本质上讲,这两个模型是由多个细胞组成的3D结构,因此为研究它们而开发的技术非常相似。例如,单细胞分辨率水平的强大成像方法对于探测类器官和球状体的细胞复杂性是必要的。在这里,通过总结该小组和类器官4领域领导者的专业知识,本文描述了对类器官和球状体的细胞和亚细胞组成以及空间组织进行二维(2D)和3D全安装染色,成像和分析的详细程序,范围从100μm到几毫米。实际上,该程序提供了两种不同且互补的染色和成像采集类型,以分析各种尺寸和类型的体外3D细胞培养模型。使用一种(3D整体安装分析)或另一种(2D截面分析)将取决于所研究的模型和所寻求的答案。例如,无论3D结构的整体尺寸如何,共聚焦显微镜的3D全安装分析都可以用于可视化深度达200μm的3D培养中的细胞,而2D切片的分析可以深入了解任何尺寸的样品,尽管是在2D级别。该程序已成功应用于源自不同胚胎胚层的各种类器官4,5 和源自人和鼠细胞的微球。该过程的概述如图 1 所示。指出了主要阶段、它们之间的关系、决定性步骤和预期时间。
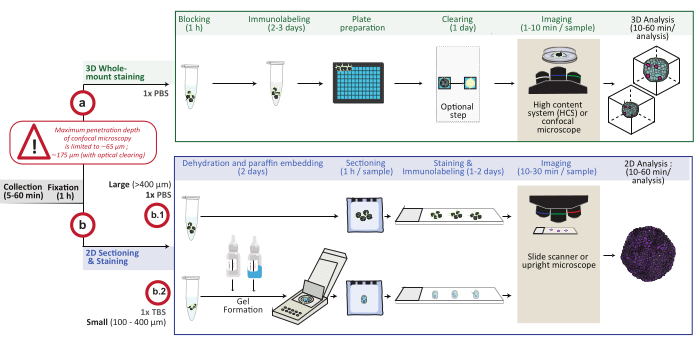
图 1:该过程的示意图概述。收集并固定体外3D细胞培养模型,然后制备用于3D全封片染色(选项a)或嵌入石蜡中进行2D切片和染色(选项b)。对于 3D 全安装染色实验,固定 3D 结构在固定步骤后进行免疫标记。可以执行可选的光学清除步骤,通过减少图像处理过程中的光散射来提高光学显微镜的成像质量和深度。图像在倒置共聚焦显微镜或共聚焦高内涵系统上捕获,并使用适当的软件进行分析。对于石蜡包埋,直接处理3D结构(≥400 μm的大型结构为选项b.1)或包含在凝胶(b.2;小型结构≤400 μm)中,用于脱水和石蜡包埋。然后切割石蜡块并进行染色(组织学或免疫化学染色)。2D切片的图像在数字载玻片扫描仪或正置显微镜上获得,并使用快速数字定量分析在图像分析平台上进行分析。请点击此处查看此图的大图。
研究方案
注意:在涉及试剂更换和以下过程中洗涤的步骤中,预计初始数量的3D结构损失≤25%。计划在每个测试条件下使用至少十个尺寸从 100 到 500 μm 的最终数量的 3D 结构来执行定性和定量图像分析。如有必要,对于较大的结构,切开 1 mL 移液器吸头的末端,以避免破坏结构。对于所有步骤,如果3D结构沉降时间过长,则可以在室温(RT)下以50× g 轻轻旋转细胞5分钟。根据所研究的问题,应考虑这种纺丝步骤的优缺点,因为离心会影响3D结构的形状。避免以 >100 × g 的速度旋转。
1. 3D细胞培养模型的收集和固定
注意:注意不要吸出3D结构,这些结构只会松散地连接到管壁上。
- 收获嵌入基质中的 3D 细胞培养模型
注意:本节描述了从鼠Engelbreth-Holm-Swarm肉瘤(BME)的基底膜提取物滴中生长的3D结构的回收,但可能适用于其他基质。有关 ECM 的关键点,请参阅讨论。- 在不破坏3D基质的情况下从孔中取出培养基。将吸头的整个长度浸入磷酸盐缓冲盐水 (PBS)(以下简称 PBS-BSA 0.1% 溶液)中的 0.1% 牛血清白蛋白 (BSA) 中,然后将 1 mL 该溶液上下移液两次,用蛋白质(以下称为预包被的 1 mL 吸头)预涂 1 mL 移液器吸头的内部和外部。
注意:此预涂层将防止细胞粘附在尖端上,并最大限度地减少任何损失。 - 通过反复填充PBS-BSA 0.1%溶液并清空试管,用蛋白质(以下称为预 包被离心 管)预涂离心机(15 mL)管的内部。
注意:这将防止细胞粘附在试管上并最大限度地减少任何损失。 - 使用预包被的 1 mL 吸头,使用 1 mL 冰冷的 1x PBS 小心地重悬孔的 3D 结构,然后将含有 3D 结构的悬浮液轻轻转移到预包被离心管中。
- 轻轻加入 13 mL 冰冷的 1x PBS,让 3D 结构在冰上沉淀至少 10 分钟。
注意:如果需要,在4°C下以50 ×g 旋转5分钟。 避免旋转> 100 × g,因为这会影响 3D 结构的形状。 - 除去上清液。使用预包被的 1 mL 吸头,将 3D 结构轻轻重悬于 1 mL 冰冷的 1x PBS 中。重复步骤1.1.4至1.1.5以获得没有任何3D基质残留物的均匀沉淀。
注意:有效的基质去除受基质类型、3D 结构的数量和大小的影响,需要针对不同的培养条件进行优化。对于在BME中生长的3D结构,从基质去除中恢复通常需要45-60分钟。 - 使用预包被的 1 mL 吸头,将包含 3D 结构的 1 mL 1x PBS 悬浮液转移到预包被的 1.5 mL 离心管中,然后继续第 1.3 节。
- 在不破坏3D基质的情况下从孔中取出培养基。将吸头的整个长度浸入磷酸盐缓冲盐水 (PBS)(以下简称 PBS-BSA 0.1% 溶液)中的 0.1% 牛血清白蛋白 (BSA) 中,然后将 1 mL 该溶液上下移液两次,用蛋白质(以下称为预包被的 1 mL 吸头)预涂 1 mL 移液器吸头的内部和外部。
- 收获浮动3D细胞培养模型
- 使用预包被的 1 mL 吸头,小心地收集 3D 结构并将其转移到预包被的 1.5 mL 离心管中。让3D结构沉淀,或在室温下以50× g 旋转5分钟。
- 除去上清液。使用预包被的 1 mL 吸头,将 3D 结构重悬于 1 mL 的 1x PBS 中。继续第 1.3 节。
- 3D细胞培养模型的固定
- 允许 3D 结构沉积。小心地除去上清液;在通风橱下,使用预包被的 1 mL 吸头将 3D 结构轻轻重悬于 1 mL 福尔马林中。
注意:福尔马林含有甲醛,这是危险的。在化学罩中操作化学品。戴橡胶手套和安全护目镜。 - 在室温下孵育3D结构30分钟。
注意:需要福尔马林30分钟的固定步骤才能对各种3D结构(大小,形状和来源不同)进行免疫染色。然而,一般来说,较长的固定时间(>3小时)更适合保存报告蛋白的荧光。 - 让 3D 结构沉淀,或在室温下以 50 × g 离心 5 分钟。 轻轻取出福尔马林,并用 1 mL 的 1x PBS 代替。在1x PBS中重复此洗涤步骤两次。将样品储存在4°C,然后继续第2节或第3节。
注意:该方案可以在此处暂停,细胞可以保持在4°C以进行长期储存(>1年)。
- 允许 3D 结构沉积。小心地除去上清液;在通风橱下,使用预包被的 1 mL 吸头将 3D 结构轻轻重悬于 1 mL 福尔马林中。
2.3D 3D细胞培养模型的全贴片染色、成像和分析
注意:由于类器官松散地附着在管壁上,请轻柔地处理它们,因为以下所有试剂更换都可能导致样品损失。在开始之前,请确保有正确的染色对照。阳性和阴性对照可以是细胞,其中已知感兴趣的蛋白质分别过度表达或不存在。孵育不含一抗的样品,以确定观察到的信号是否是由于二抗的非特异性结合引起的。由于某些细胞倾向于显示高水平的自发荧光,因此使用没有二抗的对照来确定观察到的荧光是否来自背景自发荧光。免疫标记和荧光报告基因可视化可以结合使用。
- 3D 全封片染色
- 通过补充1x PBS与0.1%-1%的非离子表面活性剂(参见 材料表),1%二甲基亚砜,1%BSA和1%驴血清(或来自饲养二抗的动物)来制备透化封闭(PB)溶液。
注意:根据靶标的定位仔细优化非离子表面活性剂的浓度:膜(0-0.5%),细胞质(0.5-1%)和细胞核(1%)。该溶液可在 4°C 下储存长达 1 个月。BSA通常适用于阻断步骤,但在高背景噪声的情况下,请进行经验测试,以获得给定抗体组合的最佳结果。 - 使用预包被的 1 mL 吸头将类器官从 1.5 mL 离心管转移到 0.5 mL 管中。让类器官沉淀,轻轻取出 1x PBS,然后用 0.5 mL PB 溶液代替。在室温下以温和的水平搅拌(30-50rpm)孵育类器官1小时。
- 让类器官沉淀,轻轻除去PB溶液,并在1mL PBS-BSA 0.1%中洗涤两次3分钟。
注意:等待3分钟会使结构在管底部沉淀。 - 轻轻除去 PBS-BSA 0.1%,并加入 250 μL 以适当浓度稀释在 PB:1x PBS (1:10) 溶液中的一抗。要制备 10 mL PB:1x PBS (1:10) 溶液,请将 1 mL PB 溶液稀释在 9 mL 1x PBS 中。在4°C下温和的水平搅拌(30-50rpm)孵育2-3天。
注意:适当的抗体孵育时间对于合适的抗体渗透至关重要,因为3D结构有时会达到大尺寸。 - 让类器官沉淀,并轻轻去除一抗溶液。每次洗涤在PBS-BSA 0.1%中洗涤5次3分钟,然后在1 mL PBS-BSA 0.1%中洗涤2次,每次洗涤15分钟,轻轻水平搅拌。
- 在 PB:1x PBS (1:10) 溶液中加入 250 μL 以 1:250 稀释的二抗。在4°C下温和水平搅拌(30-50rpm)孵育24小时。对于此步骤,保护样品免受光照。
- 加入250μL在PB:1x PBS(1:10)溶液中以1:1000稀释的Hoechst 33342(20μM储备溶液),并在4°C下温和水平搅拌(30-50rpm)再孵育2小时。
- 让类器官沉淀,并轻轻除去含有二抗+Hoechst 33342的溶液。在 1 mL 的 1x PBS 中洗涤类器官 5 次,每次洗涤 3 分钟,然后在 1 mL 的 1x PBS 中洗涤 2 次,每次洗涤 15 分钟,轻轻搅拌 (30-50 rpm)。
注意:广泛清洗样品以避免背景噪音或信号丢失至关重要。 - 将样品储存在4°C的PBS中,直到图像采集。继续第 2.2 节。
注意:协议可以在此处暂停,样品可以在4°C下储存数月,避光。
- 通过补充1x PBS与0.1%-1%的非离子表面活性剂(参见 材料表),1%二甲基亚砜,1%BSA和1%驴血清(或来自饲养二抗的动物)来制备透化封闭(PB)溶液。
- 共聚焦成像的样品制备
- 使用预包被的 1 mL 吸头,小心地将类器官转移到 96 孔黑色聚苯乙烯微孔板中每孔 50 μL 的 1x PBS 中。继续执行步骤 2.2.3 或第 2.3 节。
注意:在此阶段,样品可以避光并在4°C下储存数周。 - 空地
注意:清除步骤是可选的,可用于免疫标记类器官或检测内源性荧光。清除可引起3D结构收缩,但除具有大腔的球形单层类器官4外,不会改变一般形态。对于这些囊性类器官,跳过清除步骤,并进行深层组织成像6。- 通过在磁力搅拌器上混合至少过夜,制备含有 50% v/v 甘油、11% v/v 蒸馏水和 45% w/v 果糖的 2.5 M 甘油-果糖清除溶液,直到溶液完全溶解并均匀。在4°C黑暗中储存长达1个月。
- 在不接触类器官的情况下尽可能多地去除 1x PBS。取下末端后,使用 1 mL 移液器吸头加入 200 μL 的澄清溶液,并轻轻重悬以防止形成气泡。在室温下孵育至少12小时,然后继续第3节。
注意:由于清除溶液是粘性的,因此难以处理少量。为便于处理,请确保溶液处于室温状态,然后缓慢移液。为了获得最佳清除效果,在成像前让样品在澄清溶液中沉淀至少24小时。如果在采集时3D结构是漂浮的,请在室温下以<100× g 进行可选的旋转10分钟,或留出更多时间(一到几天)让它们沉淀。如果方案避光并在4°C(数周)或-20°C(数月)下储存,则可以在此步骤中暂停,然后再进行成像。
- 使用预包被的 1 mL 吸头,小心地将类器官转移到 96 孔黑色聚苯乙烯微孔板中每孔 50 μL 的 1x PBS 中。继续执行步骤 2.2.3 或第 2.3 节。
- 图像采集和分析
注意:对 3D 结构进行成像需要图像切片技术。- 使用共聚焦显微镜,并且与空气相比,更喜欢具有更高数值孔径(NA)的浸没物镜。根据3D结构的大小、图像重建(拼接)和用于分析的解决方案选择放大物镜(10x、20x、40x)。
- 选择采集模式时,请考虑用于定义Z轴堆叠步骤的物镜的焦深;允许最佳 3D 渲染。
注意:图像分析解决方案各不相同,需要根据所使用的软件调整分析。例如,该分析协议是在高内涵分析软件上建立的(有关详细信息,请参见 材料表 和 补充图1 ),并提供有关3D重建对象中的对象分割,属性计算和细胞群选择的数据。
3. 3D 细胞培养模型的 2D 切片、染色、成像和分析
注意:3D细胞培养模型的大小各不相同。继续执行第 3.1 或 3.2 节以实现高效的石蜡包埋(图 2)。在进行任何洗涤和试剂更换之前,留出足够的时间进行 3D 结构沉降。小心不要吸出漂浮在管底部的类器官。有关石蜡包埋,请参阅 图 2 以获取指导。
- 大 (Ø ≥ 400 μm) 3D 细胞培养模型的石蜡包埋
- 在包埋前一天,将两个装有石蜡(石蜡浴)的150 mL烧瓶预热,每个样品一个小的金属包埋模具,并将细镊子预热至65°C。
- 使用预包被的 1 mL 吸头,小心地将 1x PBS 中的类器官转移到带有聚四氟乙烯内衬瓶盖的平底玻璃管中。让类器官沉淀,小心地去除 1x PBS,并用 70% 乙醇代替。孵育至少30分钟。
- 让类器官沉淀,并小心地除去70%的乙醇。用 1 mL 即用型伊红 Y 溶液替换。轻弹试管,染色至少30分钟。小心地除去伊红溶液,并在三次连续洗涤中用 1 mL 100% 乙醇脱水类器官,每次 ~30 分钟。
注意:乙醇是一种易燃易挥发的液体,会引起严重的眼睛和呼吸道刺激。在通风橱中操作它,并戴上防护眼镜。 - 小心地除去 100% 乙醇,并在化学罩下,用 1 mL 二甲苯连续洗涤 3 次清除类器官,每次 ~30 分钟。
注意:二甲苯是一种有毒的液体易燃物,其蒸气可能会引起刺激。在通风橱中操作它。避免直接接触皮肤,并戴橡胶手套和护目镜。 - 在化学罩下,通过将一块活检垫(先前浸泡在二甲苯中)放入盒式磁带的一个隔室内来准备白色微孪生组织盒。使用预包被的 2 mL 塑料巴斯德移液器小心地将 3D 结构转移到活检垫上。用另一个浸泡在二甲苯中的活检垫覆盖它们以防止类器官移动,然后关闭盒式磁带。
- 如果处理了多个样品,请将暗盒放入二甲苯浴中以等待进一步处理。将所有样品转移到盒中后,将盒式磁带置于预热的石蜡浴中,在65°C下30分钟。 将盒式磁带转移到新鲜的预热石蜡浴中过夜。
- 石蜡浸渍后,取预热的包埋模具,将加热的石蜡加入其中。将包含3D结构的活检垫放入模具中,轻轻搅拌直至所有类器官落到模具底部。使用预热的细镊子非常小心地将3D结构放置在模具的中心。继续第 3.3 节。
注意:注意不要用镊子破坏 3D 结构;推,但不要捏它们。
- 小 (Ø ≤ 400 μm) 3D 细胞培养模型的石蜡包埋
- 在包埋前一天,将两个装有石蜡(石蜡浴)的150 mL烧瓶预热,每个样品一个小的金属包埋模具,并将细镊子预热至65°C。
- 小心地从类器官悬浮液中取出 1x PBS。在 1 mL 的 1x Tris 缓冲盐水 (TBS) 中轻轻洗涤 3 次。在不接触类器官的情况下尽可能多地去除 1x TBS。
注意:小心不要吸出样品。如有必要,在室温下以50 x g 进行5分钟的旋转。 剩余的磷酸盐痕迹会干扰以下步骤,特别是阻止凝胶聚合。因此,在任何处理步骤中都不要使用PBS溶液。对于此步骤,使用包含盒、试剂#1(透明液体)和试剂#2(有色液体)的商业试剂盒来促进石蜡包埋程序,而不会丢失微小片段(参见 材料表)。按照套件说明进行操作。盒式磁带预先组装了已经就位的衬纸和电路板插件。 - 将 2 滴试剂 #2 加入试管中,轻敲试管轻轻混合。加入 2 滴试剂 #1,再次轻拍混合,使凝胶凝固。使用细镊子,从管中取出凝胶,然后将其放入盒的孔中。
- 在通风橱下,通过将暗盒置于连续的浴中使样品脱水,如下所示(使用150mL烧瓶,每次浴使用新鲜乙醇或二甲苯):乙醇70%,30分钟;乙醇96%,30分钟;乙醇100%,洗涤三次,每次30分钟;二甲苯,洗涤三次,每次30分钟。
- 将盒式磁带置于65°C的预热石蜡浴中30分钟,然后将它们转移到新鲜的预热石蜡浴中过夜。石蜡浸渍后,取预热的包埋模具,加入加热的石蜡。打开凝胶盒,用细镊子小心地取出凝胶,然后将含有3D结构的凝胶放在包埋模具的中心。继续第 3.3 节。
- 石蜡包埋的常见步骤
- 轻轻地将模具转移到冷区,让石蜡凝固成薄层,这将保持3D结构在适当的位置。在模具顶部添加组织盒,并添加热石蜡以覆盖此塑料盒。完全凝固后取下模具,然后继续第 3.4 节。
注意:石蜡块可以在室温下储存多年。
- 轻轻地将模具转移到冷区,让石蜡凝固成薄层,这将保持3D结构在适当的位置。在模具顶部添加组织盒,并添加热石蜡以覆盖此塑料盒。完全凝固后取下模具,然后继续第 3.4 节。

图 2:大型和小型体外 3D 细胞培养模型的石蜡包埋程序概述。
(A)石蜡包埋的标准程序。固定和脱水后,用伊红染色3D结构以方便其可视化(左上和左下)。使用 2 mL 巴斯德移液管(中间)小心地将 3D 结构放置在盒中的活检垫(蓝色)上。石蜡浸渍后,使用镊子将3D结构轻轻地放入液体石蜡中,并在活检垫中轻轻搅拌。在此步骤中,小型3D结构会丢失,因为它们无法从焊盘中释放(右下角:嵌入失败)。仅嵌入大型 3D 结构(右上:成功嵌入)。箭头指向 3D 文化。(B)标准石蜡包埋方案的替代方案。在固定小的3D结构后,使用商业试剂盒将细胞保持在凝胶中,并促进它们在石蜡浸渍后转移到模具中(右:成功包埋)。 请点击此处查看此图的大图。
- 块切片和染色
- 使用标准切片机切割 4 μm 切片,并进行标准的组织学和免疫组织化学技术。继续第 3.5 节。
注意:使用特定的滑块(见 材料表)以获得更好的截面附着力。载玻片可以在室温或4°C下储存多年。
- 使用标准切片机切割 4 μm 切片,并进行标准的组织学和免疫组织化学技术。继续第 3.5 节。
- 图像采集和分析
- 使用数字玻片扫描仪或正置显微镜进行成像,并使用快速数字定量分析平台分析数据,该平台可逐个细胞报告整个3D结构切片的形态学和多重表达数据(详见 补充图2 )。
注意:该组常规使用20倍物镜。
- 使用数字玻片扫描仪或正置显微镜进行成像,并使用快速数字定量分析平台分析数据,该平台可逐个细胞报告整个3D结构切片的形态学和多重表达数据(详见 补充图2 )。
结果
该协议概述了2D和3D全安装染色的关键步骤,以及3D细胞培养模型的成像和定量分析(图3和图4)。它适用于广泛的3D细胞培养模型 - 从球状体到来自不同宿主物种或组织的类器官 - 并且能够在细胞和亚细胞水平上获取有关结构,细胞组织和相互作用的准确定量信息(图3和图4)。实验室可能需要根据自身需要优化二维组织学和免疫组织化学技术以及抗体浓度。
这两种方法都能产生有价值的生物学信息。3D 全安装染色和共聚焦显微镜提供有关细胞组成和空间位置的视觉信息,深度可达 200 μm(图 3B)。然而,2D 切片对于较大的 3D 结构来说很方便,可以揭示整个 3D 结构部分中的详细细胞形态特征,否则由于光散射会影响较大样品的分辨率,因此很难原位观察。此外,这两种技术都可以提供定量数据。实际上,获得的分辨率允许应用细胞和亚细胞分割算法来量化细胞数量并检测不同细胞亚型中各种细胞标志物的存在(图3F和图4)。总之,这里描述的成像技术是可重复的、简单的和互补的,是研究细胞异质性的宝贵工具。
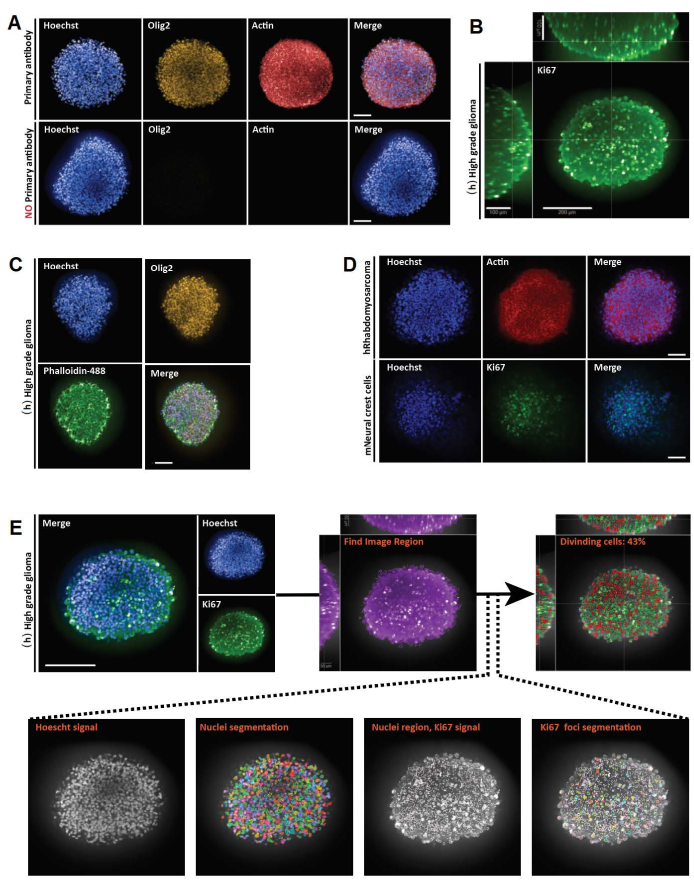
图 3:3D 和 2D 光学切片的 3D 整体安装、成像和分析的代表性结果。 (A) 人类 (h) 高级别胶质瘤球状体的共聚焦图像,培养一周并用 Hoechst(蓝色)、Olig2(黄色)和肌动蛋白(红色)(20 倍水镜)标记。对于所有采集的图像,使用阳性对照(顶部)建立显微镜设置,然后使用相同的设置对阴性对照进行成像,以控制在没有一抗的情况下缺乏荧光(下图)。(B) 在 (h) 培养一周的高级胶质瘤球体中进行 Ki67 染色的正交 3D 全安装表示(甘油-果糖清除;20x 水物镜,共聚焦)。(C)(h)高级胶质瘤球状体的共聚焦图像,培养一周并用Hoechst(蓝色),Olig2(黄色)和鬼笔碱-488(绿色)(甘油 - 果糖清除;20倍水物镜)标记。(D)人(h)横纹肌肉瘤(顶部)和小鼠(m)神经嵴细胞(底部)球状体的共聚焦图像,培养一周并分别用Hoechst(蓝色),肌动蛋白(红色)和Ki67(绿色)标记(甘油 - 果糖清除;20倍干物镜)。(E)培养一周并用Hoechst(蓝色)和Ki67(绿色)标记的高级胶质瘤球状体的共聚焦图像(甘油 - 果糖清除;40倍水物镜)(左上角)。使用高内涵分析软件生成Hoechst通道上的分割图像和绿色通道上的Ki67阳性(+)核区域(见补充图1和材料表)(底部)。给出的输出是每个分段 3D 结构的 Ki67+ 原子核的百分比(右上)。比例尺 = 100 μm。 请点击此处查看此图的大图。
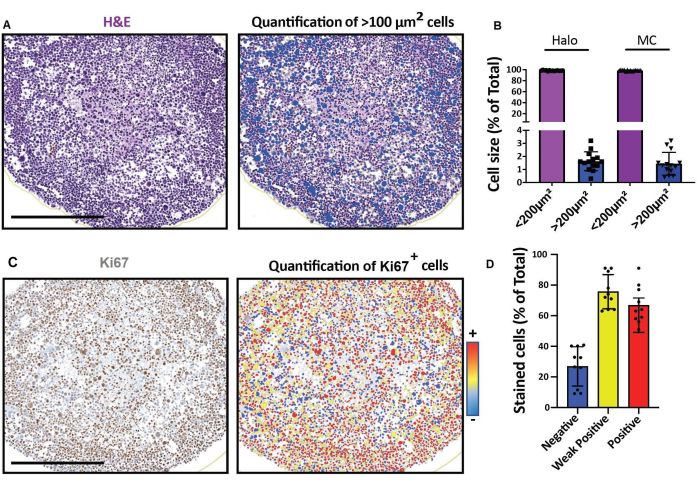
图 4:2D 光学切片成像和分析的代表性结果。 (A,D)使用数字载玻片扫描仪获得的3D细胞模型(培养一个月的人横纹肌肉瘤球状体)的2D切片图像,并在平台上进行分析以进行快速数字定量分析。(A)H&E染色并根据细胞大小检测细胞。比例尺 = 500 μm。 (B) 直方图显示使用软件检测到的 100 μm 2 和 100 μm2 <>细胞的百分比,用于快速数字定量分析(左:光环)或手动计数(右:MC)。(C)Ki67染色并根据细胞的3,3'-二氨基联苯胺(DAB)信号的强度进行检测。负(蓝色)、弱阳性(黄色)、阳性(红色)。比例尺 = 500 μm。 (D) 直方图显示 Ki67 阴性、弱阳性和阳性细胞的百分比。缩写:H&E = 苏木精和伊红;MC = 手动计数。请点击此处查看此图的大图。
补充图1:成像分析软件中的步骤概述。 分析基于构建基块的关联。每个构建块对应于一个功能分割、计算、关联、输出定义,并提供多种算法和变量选择,以匹配正在成像的生物样品。该软件提供了多种RMS(现成解决方案)分析协议,可以轻松使用和修改。可以保存集成的图像分析协议,将其应用于不同的数据集,并在用户之间共享。简而言之,分析协议意味着顺序对象分割:球体,细胞核,最后是Ki67口袋(A488)。然后,计算Ki67口袋的平均强度以进一步区分阳性事件。最后,正选择包含Ki67正口袋的细胞核。 请点击此处下载此文件。
补充图2:定量分析软件的程序步骤概述。 第 1 步。使用"研究"选项卡上传文件。文件将在"图像操作"部分中打开。第 2 步。打开"注释"选项卡,然后单击"图层操作",使用工具栏的圆形工具在结构周围设计一个新图层。对于非圆形结构,可以改用钢笔工具。第 3 步。工具栏可用于设计注释并使用该工具可视化 量化。第 4 步。打开"分析"选项卡,然后选择样品分析的最佳条件(此处可能需要进行多次试验)。步骤 4.1.使用"染色选择"部分设置染色条件。如果出现多个污渍,可以添加和重命名这些污渍,并且可以修改虚拟颜色。定位检测可以指定 - 细胞核或细胞质染色。步骤 4.2.使用"细胞检测"部分设置细胞检测。本节对于分析最为重要。核对比阈值部分将能够检测所有原子核。如果有多个群体大小,则必须注意,该软件可以检测多个细胞而不是一个独特的大细胞。核大小和核分割侵袭性部分可用于量化细胞大小群体范围。第5步。有关如何运行样品分析的说明。按照图中所示的步骤操作。"注记图层"部分将仅在此幻灯片上运行该设置。可以使用该工具
量化。第 4 步。打开"分析"选项卡,然后选择样品分析的最佳条件(此处可能需要进行多次试验)。步骤 4.1.使用"染色选择"部分设置染色条件。如果出现多个污渍,可以添加和重命名这些污渍,并且可以修改虚拟颜色。定位检测可以指定 - 细胞核或细胞质染色。步骤 4.2.使用"细胞检测"部分设置细胞检测。本节对于分析最为重要。核对比阈值部分将能够检测所有原子核。如果有多个群体大小,则必须注意,该软件可以检测多个细胞而不是一个独特的大细胞。核大小和核分割侵袭性部分可用于量化细胞大小群体范围。第5步。有关如何运行样品分析的说明。按照图中所示的步骤操作。"注记图层"部分将仅在此幻灯片上运行该设置。可以使用该工具 可视化量化。重复步骤4.1-5,直到达到适当的定量。步骤 6-6.1.这些步骤使您能够使用软件绘制图形。步骤 7.可以保存通过软件获得的量化图形。第8步。可以导出数据。请点击此处下载此文件。
可视化量化。重复步骤4.1-5,直到达到适当的定量。步骤 6-6.1.这些步骤使您能够使用软件绘制图形。步骤 7.可以保存通过软件获得的量化图形。第8步。可以导出数据。请点击此处下载此文件。
讨论
细胞培养是揭示涉及组织和器官发育、功能、再生和破坏以及疾病的基本生物学机制的不可或缺的工具。尽管单层2D细胞培养占主导地位,但最近的研究已转向产生更能反映体内细胞反应的3D结构的培养物,这主要是由于额外的空间组织和细胞间接触影响基因表达和细胞行为,因此可以提供更具预测性的数据7。然而,仍然存在许多挑战,包括需要用户友好的染色和成像技术,以便在细胞和亚细胞水平上对复杂的3D结构进行详细的显微镜可视化和评估。在这种情况下,已经提供了详细、稳健和互补的方案,用于对尺寸从 100 μm 到几毫米的固定体外 3D 细胞培养模型进行染色以及细胞和亚细胞分辨率成像。
该程序提供了两种不同的策略来处理各种尺寸和类型的体外3D细胞培养模型。选择一种(3D 整体安装分析)或另一种(2D 切片分析)将取决于所使用的模型和所调查的问题。通过共聚焦显微镜进行 3D 全安装分析,无论 3D 结构的整体尺寸如何,都可以对深度高达 200 μm 的细胞进行可视化,而 2D 切片适用于任何尺寸的样品,但可视化仍然是 2D 维的。以下是有关故障排除和技术注意事项的一些建议。
工作流程中3D结构的损失是最常见的缺点。它们可以保持粘附在吸头和管子上,这就是为什么用PBS-BSA 0.1%溶液预涂吸头和管子是关键的原因。此外,让3D结构在试剂更换之间沉淀并非常小心地进行所有移液至关重要。如程序中所述,对于所有步骤,如果3D结构沉降时间过长,则可以在室温下以50× g 轻轻旋转细胞5分钟。 根据研究的目的,应考虑这种旋转步骤的优点/缺点,因为离心会损害3D结构的形状。此外,在固定步骤中应注意保留这种形态,因为囊性类器官容易塌陷。固定尺寸小于400μm的结构应防止结构变化。
为了获得最佳免疫标记,从其3D基质中回收类器官是至关重要的一步。由于与基质的非特异性结合,3D基质会阻碍足够的抗体渗透或导致高背景染色。ECM去除可能会改变类器官外段的形态(特别是在从研究的3D结构延伸的小细胞突起的情况下)并部分阻碍分析。对于这种3D结构,基质可以在整个过程中保留;然而,应仔细调整培养条件,以在最少量的基质中培养细胞,以防止溶液和抗体的充分渗透,并避免旨在减少过度背景噪音的连续洗涤步骤6,8。
本协议中描述的3D全封口染色部分中的光学清除步骤适用于深度达150-200μm的3D结构成像,而不是未清除的50-80μm。与其他通常需要数周时间并使用有毒清除剂的清除方法相比,该协议中使用了先前发布的快速安全的清除步骤4,9。此外,该清除步骤是可逆的,并且可以将新的抗体添加到初始染色中,而不会损失分辨率或亮度4。然而,根据所研究的3D细胞培养模型,150-200μm的深度可能不足以以信息方式对3D结构进行成像,并且这种清除方案可能导致具有大腔的球形单层类器官的一般形态发生变化4。用户应仔细设计他们的实验,并在必要时优化透化/封闭步骤(以允许抗体和溶液渗透)、清除步骤(穿透深度超过 200 μm,样品应完全清除)和图像采集的时间。核心设施中可用的两种最普遍的技术是光片和共聚焦显微镜。用户需要根据其3D结构的大小和生物学问题10仔细选择技术。然而,与共聚焦显微镜相比,为这种深层结构获得的光片显微镜分辨率对于获得亚细胞分辨率仍然不是最佳的。
在这里,已经报道了一种详细而稳健的工艺,专门用于单个样品的石蜡包埋。有趣的是,Gabriel等人最近开发了一种方案,将3D细胞培养物嵌入石蜡中,并提高了通量。他们使用聚二甲基硅氧烷(PDMS)模具将96个3D结构限制在一个块中的微阵列图案中,为3D肿瘤模型的研究提供了新的视角,包括更多的组,时间点,治疗条件和重复11。然而,这种方法需要广泛的技能和机械,特别是用于制造用于创建PDMS模具的预模。
总之,本文描述了两种不同的、互补的和适应性强的方法,能够获取有关3D细胞模型的结构和细胞组成的准确和定量信息。这两个参数对于研究肿瘤内细胞异质性及其在治疗耐药性中的作用等生物过程至关重要。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了St Baldrick的Robert J. Arceci创新奖#604303的支持。
材料
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Biopsy pad Q Path blue | VWR | 720-2254 | |
| Cassettes macrostar III Blc couv. Char. x1500 | VWR | 720-2233 | |
| Cassette microtwin white | VWR | 720-2183 | |
| Chemical hood | Erlab | FI82 5585-06 | |
| Filter tips 1000 µL | Star lab Tip-One | S1122-1730 | |
| Fine forceps | Pyramid innovation | R35002-E | |
| Flat-bottom glass tubes with PTFE lined 2 mL | Fisher Scientific | 11784259 | Excellent for environmental samples, pharmaceuticals and diagnostic reagents. PTFE is designed for the ultimate in product safety. PTFE provides totally inert inner seal and surface facing the sample or product. |
| Glass bottom dish plate 35 mm | Ibedi | 2018003 | |
| Horizontal agitation | N-BIOTEK | NB-205 | |
| Incubator prewarmed to 65 °C | Memmert Incubator | LAB129 | |
| Inox molds 15x15 | VWR | 720-1918 | |
| Microscope Slides Matsunami TOMO-11/90 | Roche diagnostics | 8082286001 | these slides are used for a better adhesion of sections |
| Microtome | Microm Microtech France | HM340E | |
| Panoramic scan II | 3dhistech | 2397612 | |
| Paraffin embedding equipment | Leica | EG1150C | |
| Plastic pipette Pasteur 2 mL | VWR | 612-1681 | |
| Q Path flacon 150mL cape blanc x250 | VWR | 216-1308 | Good for environmental samples, pharmaceuticals and diagnostic reagents. Polypropylene (PP) are rigid, solid, provide excellent stress crack and impact resistance and have a good oil and alcohol barrier and chemical resistance. PE-lined cap is stress crack resistant and offers excellent sealing characteristics. |
| Set of micropipettors (p200, p1000) | Thermo Scientific | 11877351 (20-200) 11887351(p1000) | |
| OPERA PHENIX | PerkinElmer | HH14000000 | |
| SP5 inverted confocal microscope | Leica | LSM780 | |
| Tissue cassette | VWR | 720-0228 | |
| Zeiss Axiomager microscope | Leica | SIP 60549 | |
| Reagent | |||
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A7030-100G | |
| Cytoblock (kit) | Thermofisher Scientific | 10066588 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 57648266 | CAUTION: toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Eosin aqueous 1% | Sigma-Aldrich | HT110316 | |
| Ethanol 96% | VWR | 83804.360 | CAUTION: Causes severe eye irritation. Flammable liquid and vapor. Causes respiratory tract irritation. Manipulate in a fume hood. Wear protective eye goggles. |
| Ethanol 100% | VWR | 20821.365 | CAUTION: Causes severe eye irritation. Flammable liquid and vapor. Causes respiratory tract irritation. Manipulate in a fume hood. Wear protective eye goggles. |
| Formalin 4% | Microm Microtech France | F/40877-36 | CAUTION: Formalin contains formaldehyde which is hazardous. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves and protective eye goggles. |
| Fructose | Sigma-Aldrich | F0127 | |
| Gill hematoxylin type II | Microm Microtech France | F/CP813 | |
| Glycerol | Sigma-Aldrich | G5516 | 500 mL |
| Hoechst 33342 | Life Technologies | H3570 | CAUTION: Suspected of causing genetic defects. Avoid direct contact with skin. Wear rubber gloves and protective eye goggles. |
| Normal donkey serum | Sigma-Aldrich | D9663 | 10 mL |
| Paraffin Wax tek III | Sakura | 4511 | |
| Phosphate Buffer Saline (PBS) 1 X | Gibco | 14190-094 | |
| Tris-Buffered Saline (TBS) 10X | Microm Microtech France | F/00801 | 100 mL |
| Triton X-100 | Sigma-Aldrich | T8532 | CAUTION: Triton X100 is hazardous. Avoid contact with skin and eyes. |
| Xylene | Sigma-Aldrich | 534056 | CAUTION: Xylene is toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Solutions | |||
| Clearing solution | Glycerol-Fructose clearing solution is 60% (vol/w) glycerol and 2.5 M fructose. To prepare 10 mL of this solution, mix 6 mL of glycerol and 4.5 g of fructose. Complete to 10 mL with dH2O. Use a magnetic stirrer overnight. Refractive index = 1.4688 at room temperature (RT: 19–23 °C). Store at 4 °C in dark for up to 1 month. | ||
| PBS-BSA 0,1% solution | To prepare 0,1% (vol/wt) PBS-BSA 0,1% solution, dissolve 500 mg of BSA in 50 mL of PBS-1X (store at 4°C for up to 2 weeks). And dilute 1mL of this solution into 9mL of PBS-1X. This solution can be used to precoat the tip and centrifugation tube. | ||
| Permeabilisation-blocking solution (PB solution) | The PBSDT blocking solution is PBS-1X supplemented with 0.1% – 1% Tritonx-100 (depending on the protein localization membrane/nucleus), 1% DMSO, 1% BSA and 1% donkey serum (or from the animal in which the secondary antibodies were raised). This solution can be stored at 4°C for up to 1 month. | ||
| PB:PBS-1X (1:10) solution | PB:PBS-1X (1:10) solution is a 10 time diluted PB solution. To prepare 10 mL of this solution dilute 1 mL of PB solution in 9 mL of PBS-1X. | ||
| Software | |||
| Halo software | Indicalabs | NM 87114 | |
| Harmony software | PerkinElmer | HH17000010 |
参考文献
- Ryu, N. E., Lee, S. H., Park, H. Spheroid culture system methods and applications for mesenchymal stem cells. Cells. 8 (12), 1-13 (2019).
- Bartfeld, S., Clevers, H. Stem cell-derived organoids and their application for medical research and patient treatment. Journal of Molecular Medicine. 95 (7), 729-738 (2017).
- Cui, X., Hartanto, Y., Zhang, H. Advances in multicellular spheroids formation. Journal of the Royal Society, Interface. 14 (127), (2017).
- Dekkers, J. F., et al. High-resolution 3D imaging of fixed and cleared organoids. Nature Protocols. 14, 1756-1771 (2019).
- Broutier, L., et al. Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation. Nature Protocols. 11 (9), 1724-1743 (2016).
- Rezanejad, H., Lock, J. H., Sullivan, B. A., Bonner-Weir, S. Generation of pancreatic ductal organoids and whole-mount immunostaining of intact organoids. Current Protocols in Cell Biology. 83 (1), 82 (2019).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. Assay and Drug Development Technologies. 12 (4), 207-218 (2014).
- McCray, T., Richards, Z., Marsili, J., Prins, G. S., Nonn, L. Handling and assessment of human primary prostate organoid culture. Journal of Visualized Experiments: JoVE. (143), e59051 (2019).
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nature Reviews: Neuroscience. 21 (2), 61-79 (2020).
- Lazzari, G., et al. Light sheet fluorescence microscopy versus confocal microscopy: in quest of a suitable tool to assess drug and nanomedicine penetration into multicellular tumor spheroids. European Journal of Pharmaceutics and Biopharmaceutics. 142, 195-203 (2019).
- Gabriel, J., Brennan, D., Elisseeff, J. H., Beachley, V. Microarray embedding/sectioning for parallel analysis of 3D cell spheroids. Scientific Reports. 9, 16287 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。