Method Article
Üç Boyutlu Organoid ve Küresel Modellerin Boyama ve Yüksek Çözünürlüklü Görüntülenmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, 100 μm'den birkaç milimetreye kadar değişen sabit üç boyutlu hücre kültürü modellerinin boyama ve hücre altı çözünürlükte görüntülenmesini gerçekleştirmek için ayrıntılı, sağlam ve tamamlayıcı protokoller sunuyoruz, böylece morfolojilerinin, hücre tipi bileşimlerinin ve etkileşimlerinin görselleştirilmesini sağlıyoruz.
Özet
Organoidler ve sferoidler gibi in vitro üç boyutlu (3D) hücre kültürü modelleri, geliştirme ve hastalık modellemesi, ilaç keşfi ve rejeneratif tıp dahil olmak üzere birçok uygulama için değerli araçlardır. Bu modellerden tam olarak yararlanmak için, onları hücresel ve hücre altı seviyelerde incelemek çok önemlidir. Bununla birlikte, bu tür in vitro 3D hücre kültürü modellerini karakterize etmek teknik olarak zor olabilir ve etkili analizler yapmak için özel uzmanlık gerektirir. Burada, bu makale, 100 μm ila birkaç milimetre arasında değişen sabit in vitro 3D hücre kültürü modellerinin boyama ve hücre altı çözünürlükte görüntülenmesini gerçekleştirmek için ayrıntılı, sağlam ve tamamlayıcı protokoller sunmaktadır. Bu protokoller, menşe hücreleri, morfolojileri ve kültür koşullarında farklılık gösteren çok çeşitli organoidlere ve sferoidlere uygulanabilir. 3D yapı hasadından görüntü analizine kadar bu protokoller 4-5 gün içinde tamamlanabilir. Kısaca, 3D yapılar toplanır, sabitlenir ve daha sonra parafin gömme ve histolojik / immünohistokimyasal boyama yoluyla işlenebilir veya doğrudan immüno-etiketlenebilir ve konfokal mikroskopi ile optik temizleme ve 3D rekonstrüksiyon (200 μm derinlik) için hazırlanabilir.
Giriş
Son yıllarda, kök hücre biyolojisindeki ve in vitro 3D kültür teknolojilerindeki ilerlemeler, biyoloji ve tıpta bir devrimin habercisidir. 3B'deki daha yüksek karmaşıklıktaki hücre modelleri, hücrelerin büyümesine ve çevredeki hücre dışı bir çerçeveyle etkileşime girmesine, mimarileri, hücre organizasyonu ve etkileşimleri ve hatta difüzyon özellikleri de dahil olmak üzere canlı dokuların yönlerini yakından özetlemesine izin verdiği için çok popüler hale gelmiştir. Bu nedenle, 3D hücre kültürü modelleri, hücrelerin in vitro olarak gelişmekte olan veya hastalıklı dokulardaki davranışları hakkında benzersiz bilgiler sağlayabilir. Organoidler ve sferoidler, birkaç mikrometreden milimetreye kadar değişen çok hücreli 3D yapılardır ve en belirgin in vitro 3D yapılardır. Her ikisi de (i) hayvanlardan (bazal membran ekstresi, kollajen), bitkilerden (aljinat / agaroz) türetilen hidrojeller veya kimyasallardan sentezlenen hidrojeller veya (ii) hücre çoğalmasını ve büyümesini teşvik etmek için gözenekler içeren inert matrisler dahil olmak üzere destekleyici bir iskele içinde kültürlenebilir.
Organoidler ve sferoidler, kümeler halinde kendi kendine bir araya gelmek için hücrelere güvenerek destekleyici bir iskelenin varlığı olmadan da gelişebilir. Bu, hücre tutturmasını, yüzey gerilimini ve yerçekimi kuvvetini (örneğin, asılı damla teknikleri) veya damarların sürekli dairesel dönüşünü (örneğin, iplikçi kültürü) inhibe etmek için yapışkan olmayan malzemelerin kullanılması gibi farklı tekniklere dayanır. Her durumda, bu teknikler geleneksel tek katmanlı hücre kültürünün sınırlamalarının üstesinden gelmek için hücre-hücre ve hücre-matris etkileşimlerini kolaylaştırır1. "Organoidler" ve "sferoidler" terimleri geçmişte birbirinin yerine kullanılmıştır, ancak bu iki 3D hücre kültürü modeli arasında önemli farklılıklar vardır. Organoidler, pluripotent kök hücrelerden veya dokuya özgü kök hücrelerden türetilen, hücrelerin kendiliğinden progenitörlere ve farklılaşmış hücre tiplerine organize olduğu ve ilgilenilen organın en azından bazı işlevlerini özetlediği in vitro 3D hücresel kümelerdir2. Sferoidler, yapışkan olmayan koşullar altında oluşan çok hücreli 3D yapıların daha geniş bir yelpazesini içerir ve ölümsüzleştirilmiş hücre hatları veyabirincil hücreler 3 gibi çok çeşitli hücre tiplerinden kaynaklanabilir. Bu nedenle, içsel kök hücre kökenlerine özgü olarak, organoidler sferoidlerden daha yüksek bir kendi kendine montaj, canlılık ve stabilite eğilimine sahiptir.
Bununla birlikte, özünde, bu iki model çoklu hücrelerden oluşan 3B yapılardır ve bunları incelemek için geliştirilen teknikler bu nedenle çok benzerdir. Örneğin, hem organoidlerin hem de sferoidlerin hücresel karmaşıklığını araştırmak için tek hücreli çözünürlük düzeyinde güçlü görüntüleme yaklaşımları gereklidir. Burada, bu grubun uzmanlığını ve organoidler4 alanındaki liderlerin uzmanlığını özetleyerek, bu makalede, 100 μm ila birkaç milimetre arasında değişen organoidlerin ve sferoidlerin hücresel ve hücre altı bileşiminin ve mekansal organizasyonunun iki boyutlu (2D) ve 3D tam montajlı boyama, görüntüleme ve analizlerini gerçekleştirmek için ayrıntılı prosedürler açıklanmaktadır. Gerçekten de, bu prosedür, in vitro 3D hücre kültürü modellerinin çok çeşitli boyutlarını ve türlerini analiz etmek için iki farklı ve tamamlayıcı tipte boyama ve görüntüleme kazanımı sunar. Birinin (3D tam montaj analizi) veya diğerinin (2D kesit analizi) kullanımı, çalışılan modele ve aranan cevaplara bağlı olacaktır. Konfokal mikroskopi ile 3D tam montaj analizi, örneğin, 3D yapının genel boyutuna bakılmaksızın, 3D kültürdeki hücreleri 200 μm derinliğe kadar görselleştirmek için uygulanabilirken, 2D bölümlerin analizi, 2D seviyesinde de olsa herhangi bir boyuttaki örnekler hakkında fikir verir. Bu prosedür, farklı embriyonik germ katmanlarından kaynaklanan, insan ve murin hücrelerinden türetilen çeşitli organoidler 4,5 ve sferoidler arasında başarıyla uygulanmıştır. Prosedüre genel bakış Şekil 1'de gösterilmiştir. Ana aşamalar, aralarındaki ilişkiler, belirleyici adımlar ve beklenen zamanlama belirtilir.
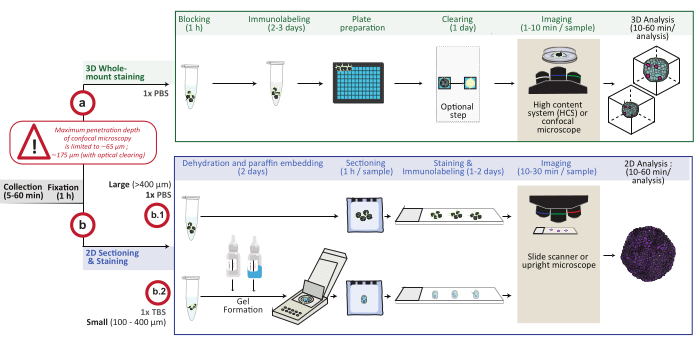
Şekil 1: Prosedüre şematik genel bakış. In vitro 3D hücre kültürü modelleri toplanır ve sabitlenir, daha sonra 3D tam montaj boyama için hazırlanır (seçenek a) veya 2D kesitleme ve boyama için parafine gömülür (seçenek b). 3D tam montajlı boyama deneyleri için, sabit 3D yapılar, fiksasyon adımını takiben immüno-etiketlidir. Görüntü işleme sırasında ışık saçılımını azaltarak görüntüleme kalitesini ve optik mikroskopinin derinliğini artırmak için isteğe bağlı bir optik temizleme adımı gerçekleştirilebilir. Görüntüler ters çevrilmiş bir konfokal mikroskopta veya konfokal yüksek içerikli bir sistemde yakalanır ve uygun yazılım kullanılarak analiz edilir. Parafin gömme için, 3D yapılar doğrudan işlenir (400 μm'≥ büyük yapılar için seçenek b.1) veya dehidrasyon ve parafin gömme için bir jele (b.2; 400 μm'≤ küçük yapılar) dahil edilir. Parafin blokları daha sonra kesilir ve boyanır (histolojik veya immünokimyasal boyama). 2D kesitlerin görüntüleri dijital slayt tarayıcı veya dik mikroskop üzerinde elde edilir ve hızlı dijital kantitatif analiz kullanılarak bir görüntü analiz platformunda analiz edilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protokol
NOT: Aşağıdaki prosedürde reaktif değişiklikleri ve yıkamayı içeren adımlar sırasında başlangıçtaki 3D yapı sayısının% ≤25'lik bir kaybı beklenmelidir. Kalitatif ve nicel görüntü analizleri gerçekleştirmek için test edilen koşul başına 100 ila 500 μm arasında değişen boyutlarda en az on 3B yapıdan oluşan son bir sayı kullanmayı planlayın. Gerekirse, daha büyük yapılar için, yapıların kırılmasını önlemek için 1 mL pipet uçlarının uçlarını kesin. Tüm adımlar için, 3D yapı çökelmesi çok uzunsa, hücreler oda sıcaklığında (RT) 5 dakika boyunca 50 × g'da hafifçe döndürülebilir. İncelenen konuya bağlı olarak, santrifüjleme 3D yapıların şeklini tehlikeye atabileceğinden, böyle bir eğirme adımının avantajları / dezavantajları göz önünde bulundurulmalıdır. >100 × g'da dönmekten kaçının.
1. 3D hücre kültürü modellerinin toplanması ve sabitlenmesi
NOT: Tüp duvarına sadece gevşek bir şekilde tutturulacak olan 3D yapıları aspire etmemeye dikkat edin.
- Bir matrise gömülü 3D hücre kültürü modellerinin toplanması
NOT: Bu bölümde, murin Engelbreth-Holm-Swarm sarkomundan (BME) bir bazal membran ekstraktının damlalarında yetiştirilen 3D yapıların geri kazanımı açıklanmaktadır, ancak diğer matrislere uyarlanabilir. ECM ile ilgili önemli noktalar için tartışmaya bakınız.- 3B matrisi bozmadan kültür ortamını kuyucuklardan çıkarın. 1 mL'lik pipet ucunun içini ve dışını proteinle (bundan böyle önceden kaplanmış 1 mL uç olarak anılacaktır) önceden kaplayın ve ucun tam uzunluğunu fosfat tamponlu salin (PBS-BSA bundan sonra %0,1 çözelti olarak anılacaktır) içinde %0,1 sığır serum albüminine (BSA) batırın ve bu çözeltinin 1 mL'sini iki kez yukarı ve aşağı pipetleyin.
NOT: Bu ön kaplama, hücrelerin uca yapışmasını önleyecek ve herhangi bir kaybı en aza indirecektir. - Bir santrifüj (15 mL) tüpünün içini protein (bundan böyle önceden kaplanmış santrifüj tüpü olarak anılacaktır) ile tekrar tekrar PBS-BSA% 0.1 çözeltisi ile doldurarak ve tüpü boşaltarak ön kat edin.
NOT: Bu, hücrelerin tüpe yapışmasını önleyecek ve herhangi bir kaybı en aza indirecektir. - Önceden kaplanmış 1 mL ucu kullanarak, 1 mL buz gibi soğuk 1x PBS kullanarak kuyunun 3D yapılarını dikkatlice yeniden askıya alın ve 3D yapıları içeren süspansiyonu önceden kaplanmış santrifüj tüpüne yavaşça aktarın.
- Yavaşça 13 mL buz gibi soğuk 1x PBS ekleyin ve 3D yapıların en az 10 dakika boyunca buz üzerinde tortu oluşturmasına izin verin.
NOT: Gerekirse, 4 °C'de 50 × g'de 5 dakika boyunca döndürün. >100 × g döndürmekten kaçının, çünkü bu 3B yapıların şeklini tehlikeye atacaktır. - Süper natantı çıkarın. Önceden kaplanmış 1 mL'lik bir uç kullanarak, 3D yapıları 1 mL buz gibi soğuk 1x PBS'de nazikçe yeniden askıya alın. Herhangi bir 3B matris kalıntısı olmadan homojen bir pelet elde etmek için 1.1.4 ile 1.1.5 arasındaki adımları tekrarlayın.
NOT: Verimli matris kaldırma, matris türünden, 3B yapıların sayısından ve boyutundan etkilenir ve farklı kültür koşulları için optimizasyon gerektirir. BME'de yetiştirilen 3D yapılar için, matris kaldırma işleminden kurtarma tipik olarak 45-60 dakika sürer. - Önceden kaplanmış 1 mL'lik bir uç kullanarak, 3D yapıları içeren 1 mL 1x PBS süspansiyonu önceden kaplanmış 1,5 mL'lik bir santrifüj tüpüne aktarın ve bölüm 1.3 ile devam edin.
- 3B matrisi bozmadan kültür ortamını kuyucuklardan çıkarın. 1 mL'lik pipet ucunun içini ve dışını proteinle (bundan böyle önceden kaplanmış 1 mL uç olarak anılacaktır) önceden kaplayın ve ucun tam uzunluğunu fosfat tamponlu salin (PBS-BSA bundan sonra %0,1 çözelti olarak anılacaktır) içinde %0,1 sığır serum albüminine (BSA) batırın ve bu çözeltinin 1 mL'sini iki kez yukarı ve aşağı pipetleyin.
- Yüzen 3D hücre kültürü modellerinin toplanması
- Önceden kaplanmış 1 mL'lik bir uç kullanarak, 3D yapıları dikkatlice toplayın ve önceden kaplanmış 1,5 mL'lik bir santrifüj tüpüne aktarın. 3B yapıların tortu oluşturmasına izin verin veya RT'de 50 × g'de 5 dakika boyunca döndürün.
- Süper natantı çıkarın. Önceden kaplanmış 1 mL'lik bir uç kullanarak, 3B yapıları 1 mL'lik 1x PBS'de yeniden askıya alın. Bölüm 1.3 ile devam edin.
- 3D hücre kültürü modellerinin sabitlenmesi
- 3B yapıların tortu oluşturmasına izin verin. Süper natantı dikkatlice çıkarın; Bir duman başlığının altında, önceden kaplanmış 1 mL'lik bir uç kullanarak 3D yapıları 1 mL formalin içinde yavaşça yeniden askıya alın.
NOT: Formalin, tehlikeli olan formaldehit içerir. Kimyasalı kimyasal bir başlıkta manipüle edin. Lastik eldiven ve güvenlik gözlüğü kullanın. - RT'de 3D yapıları 30 dakika boyunca inkübe edin.
NOT: Çok çeşitli 3B yapıların (boyut, şekil ve köken bakımından değişen) immünoboyaması için formalin içeren 30 dakikalık bir fiksasyon adımı gereklidir. Bununla birlikte, genel olarak, daha uzun fiksasyon süreleri (>3 saat), muhabir proteinlerin floresansını korumak için daha uygundur. - 3D yapıların tortu yapmasına izin verin veya RT'de 50 × g'de 5 dakika boyunca döndürün. formalini yavaşça çıkarın ve 1 mL 1x PBS ile değiştirin. Bu yıkama adımını 1x PBS'de iki kez tekrarlayın. Numuneleri 4 °C'de saklayın ve bölüm 2 veya bölüm 3 ile devam edin.
NOT: Protokol burada duraklatılabilir ve hücreler uzun süreli depolama için 4 ° C'de tutulabilir (>1 yıl).
- 3B yapıların tortu oluşturmasına izin verin. Süper natantı dikkatlice çıkarın; Bir duman başlığının altında, önceden kaplanmış 1 mL'lik bir uç kullanarak 3D yapıları 1 mL formalin içinde yavaşça yeniden askıya alın.
2.3D 3D hücre kültürü modellerinin tüm montaj boyaması, görüntülenmesi ve analizi
NOT: Organoidler tüp duvarına gevşek bir şekilde tutturulduklarından, aşağıdaki tüm reaktif değişiklikleri numune kaybına neden olabileceğinden bunları nazikçe kullanın. Başlamadan önce, boyama için doğru kontrollerin mevcut olduğundan emin olun. Pozitif ve negatif kontroller, ilgilenilen proteinin sırasıyla aşırı eksprese edildiği veya bulunmadığı bilinen hücreler olabilir. Gözlenen sinyalin sekonder antikorun spesifik olmayan bağlanmasından kaynaklanıp kaynaklanmadığını belirlemek için birincil antikoru olmayan örnekleri inkübe edin. Bazı hücreler yüksek düzeyde otofloresan gösterme eğiliminde olduğundan, gözlenen floresanın arka plan otofloresansından gelip gelmediğini belirlemek için ikincil antikordan yoksun kontroller kullanın. İmmünoetiketleme ve floresan muhabir görselleştirmesi birleştirilebilir.
- 3D tam montaj boyama
- 1x PBS'yi, iyonik olmayan bir yüzey aktif maddenin% 0.1 -% 1'i ( Malzeme Tablosuna bakınız),% 1 dimetilsülfoksit,% 1 BSA ve% 1 eşek serumu (veya ikincil antikorların yükseldiği hayvandan) ile destekleyerek geçirgenlik bloke edici (PB) çözeltiyi hazırlayın.
NOT: Hedefin lokalizasyonuna bağlı olarak iyonik olmayan yüzey aktif maddenin konsantrasyonunu dikkatlice optimize edin: membran (% 0-0.5), sitoplazma (% 0.5-1) ve çekirdek (% 1). Bu çözelti 4°C'de 1 aya kadar saklanabilir. BSA genellikle blokaj adımı için iyi çalışır, ancak yüksek arka plan gürültüsü durumunda, belirli bir antikor kombinasyonu için mümkün olan en iyi sonuçları elde etmek için ampirik bir test yapın. - Önceden kaplanmış 1 mL'lik bir uç kullanarak organoidleri 1,5 mL santrifüj tüpünden 0,5 mL'lik bir tüpe aktarın. Organoidlerin tortu oluşturmasına izin verin, 1x PBS'yi yavaşça çıkarın ve 0,5 mL PB çözeltisi ile değiştirin. RT'de 1 saat boyunca organoidleri hafif yatay ajitasyonla (30-50 rpm) inkübe edin.
- Organoidlerin tortu oluşturmasına izin verin, PB çözeltisini nazikçe çıkarın ve 1 mL PBS-BSA'da 3 dakika boyunca% 0.1'de iki kez yıkayın.
NOT: 3 dakika beklemek, yapıların tüpün dibinde tortu oluşturmasına izin verir. - PBS-BSA'yı% 0.1 oranında yavaşça çıkarın ve PB: 1x PBS (1:10) çözeltisinde uygun konsantrasyonda seyreltilmiş 250 μL birincil antikor ekleyin. 10 mL PB:1x PBS (1:10) çözeltisi hazırlamak için 1 mL PB çözeltisini 9 mL 1x PBS'de seyreltin. 4 ° C'de hafif yatay ajitasyon (30-50 rpm) ile 2-3 gün boyunca kuluçkaya yatın.
NOT: Uygun bir antikor inkübasyon süresi, uygun bir antikor penetrasyonu için çok önemlidir, çünkü 3D yapılar bazen büyük boyutlara ulaşabilir. - Organoidlerin tortu oluşturmasına izin verin ve birincil antikor çözeltisini yavaşça çıkarın. PBS-BSA'da 5x'i yıkama başına 3 dakika boyunca %0,1 ve daha sonra 1 mL PBS-BSA'da 2x'i 15 dakika boyunca %0,1 oranında nazik yatay ajitasyonla yıkayın.
- PB:1x PBS (1:10) çözeltisinde 1:250'de seyreltilmiş 250 μL sekonder antikor ekleyin. Nazik yatay ajitasyonla (30-50 rpm) 4°C'de 24 saat inkübe edin. Bu adım için örnekleri ışıktan koruyun.
- PB:1x PBS (1:10) çözeltisinde 1:1000'de seyreltilmiş 250 μL Hoechst 33342 (20 μM stok çözeltisi) ekleyin ve nazik yatay ajitasyonla (30-50 rpm) 4 °C'de 2 saat daha inkübe edin.
- Organoidlerin çökelmesine izin verin ve ikincil antikor + Hoechst 33342 içeren çözeltiyi yavaşça çıkarın. Organoidleri yıkama başına 3 dakika boyunca 1 mL'lik 1x PBS'de 5x ve daha sonra yumuşak yatay ajitasyonla (30-50 rpm) yıkama başına 15 dakika boyunca 1 mL'de 2x 1x PBS'de 2x yıkayın.
NOT: Arka plan gürültüsünü veya sinyal kaybını önlemek için numunelerin kapsamlı bir şekilde yıkanması çok önemlidir. - Görüntü elde edilene kadar örnekleri PBS'de 4 °C'de saklayın. Bölüm 2.2 ile devam edin.
NOT: Protokol burada duraklatılabilir ve örnekler ışıktan korunarak birkaç ay boyunca 4 ° C'de saklanabilir.
- 1x PBS'yi, iyonik olmayan bir yüzey aktif maddenin% 0.1 -% 1'i ( Malzeme Tablosuna bakınız),% 1 dimetilsülfoksit,% 1 BSA ve% 1 eşek serumu (veya ikincil antikorların yükseldiği hayvandan) ile destekleyerek geçirgenlik bloke edici (PB) çözeltiyi hazırlayın.
- Konfokal görüntüleme için numune hazırlama
- Önceden kaplanmış 1 mL'lik bir uç kullanarak, organoidleri 96 delikli siyah polistiren mikro plakada kuyucuk başına 1x PBS'nin 50 μL'sine dikkatlice aktarın. Adım 2.2.3 veya bölüm 2.3 ile devam edin.
NOT: Bu aşamada, numune ışıktan korunabilir ve haftalarca 4 ° C'de saklanabilir. - Temizleme
NOT: Temizleme adımı isteğe bağlıdır ve organoidleri immünoetiketlemek veya endojen floresanı tespit etmek için kullanılabilir. Temizleme, 3D yapı büzülmesine neden olabilir, ancak büyük lümenli küresel tek katmanlı organoidler dışında genel morfolojiyi değiştirmez4. Bu kistik organoidler için temizleme adımını atlayın ve derin doku görüntülemeyapın 6.- %50 v/v gliserol, %11 v/v damıtılmış su ve %45 w/v fruktoz içeren 2,5 M gliserol-fruktoz temizleme solüsyonunu, çözelti tamamen çözünene ve homojen hale gelene kadar manyetik bir karıştırıcı üzerinde en az gece boyunca karıştırarak hazırlayın. Karanlıkta 4 °C'de 1 aya kadar saklayın.
- Organoidlere dokunmadan mümkün olduğunca fazla 1x PBS çıkarın. Ucu çıkardıktan sonra 1 mL'lik pipet ucu kullanarak 200 μL temizleme çözeltisi ekleyin ve kabarcık oluşumunu önlemek için yavaşça yeniden askıya alın. RT'de en az 12 saat inkübe edin ve bölüm 3 ile devam edin.
NOT: Temizleme çözeltisi viskoz olduğundan, küçük hacimlerin işlenmesi zordur. Kullanımı kolaylaştırmak için çözeltinin RT'de olduğundan ve pipetin yavaşça olduğundan emin olun. Optimum temizleme için, görüntülemeden önce numunenin temizleme çözeltisinde en az 24 saat boyunca tortu oluşturmasına izin verin. 3B yapılar edinme sırasında yüzüyorsa, RT'de <100 × g'de 10 dakika boyunca isteğe bağlı bir dönüş yapın veya tortu bırakmaları için daha fazla zaman (bir ila birkaç gün) bekleyin. Protokol, ışıktan korunuyorsa ve 4 ° C'de (haftalarca) veya -20 ° C'de (aylarca) saklanıyorsa, görüntülemeye geçmeden önce bu adımda duraklatılabilir.
- Önceden kaplanmış 1 mL'lik bir uç kullanarak, organoidleri 96 delikli siyah polistiren mikro plakada kuyucuk başına 1x PBS'nin 50 μL'sine dikkatlice aktarın. Adım 2.2.3 veya bölüm 2.3 ile devam edin.
- Görüntü yakalama ve analiz
NOT: 3B yapıları görüntülemek için görüntü bölümleme teknolojisi gerekecektir.- Konfokal mikroskoplar kullanın ve havaya kıyasla daha yüksek sayısal diyafram açıklığına (NA) sahip daldırma hedeflerini tercih edin. 3B yapıların boyutuna, görüntü yeniden yapılandırmaya (dikiş) ve analiz için kullanılan çözümlere göre büyütme hedeflerini (10x, 20x, 40x) seçin.
- Edinme modunu seçerken, Z istifleme adımını tanımlamak için kullanılan hedefin odak derinliğini dikkate alın; optimum 3D render için izin verin.
NOT: Görüntü analizi çözümleri değişiklik gösterir ve analizin kullanılan yazılıma göre ayarlanması gerekir. Örneğin, bu analiz protokolü yüksek içerikli bir analiz yazılımı üzerinde kurulmuştur (ayrıntılar için Malzeme Tablosu ve Ek Şekil 1'e bakınız) ve nesne segmentasyonu, özelliklerin hesaplanması ve 3B yeniden yapılandırılmış bir nesne içindeki hücre popülasyonu seçimi hakkında veri sağlar.
3. 2D kesitleme, boyama, görüntüleme ve 3D hücre kültürü modellerinin analizi
NOT: 3B hücre kültürü modelleri boyut olarak farklılık gösterir. Verimli parafin gömme için bölüm 3.1 veya 3.2 ile devam edin (Şekil 2). Herhangi bir yıkama ve reaktif değişikliğinden önce 3D yapı çökeltmesi için yeterli zaman tanıyın. Tüpün dibinde yüzecek organoidleri aspire etmemeye dikkat edin. Parafin gömme için, rehberlik için Şekil 2'ye bakın.
- Büyük (Ø ≥ 400 μm) 3D hücre kültürü modellerinin parafin gömülmesi
- Gömmeden önceki gün, parafin (parafin banyoları), numune başına küçük bir metal gömme kalıbı ve ince forseps ile doldurulmuş iki adet 150 mL şişeyi 65 ° C'ye kadar ısıtın.
- Önceden kaplanmış 1 mL'lik bir uç kullanarak, organoidleri 1x PBS'de politetrafloroetilen astarlı şişe kapağına sahip düz tabanlı bir cam tüpe dikkatlice aktarın. Organoidlerin tortu oluşturmasına izin verin, 1x PBS'yi dikkatlice çıkarın ve% 70 etanol ile değiştirin. En az 30 dakika kuluçkaya yatırın.
- Organoidlerin tortu oluşturmasına izin verin ve% 70 etanolünü dikkatlice çıkarın. 1 mL kullanıma hazır eozin Y çözeltisi ile değiştirin. Tüpe hafifçe vurun ve en az 30 dakika boyunca lekeleyin. Eozin çözeltisini dikkatlice çıkarın ve organoidleri, her biri ~ 30 dakika boyunca 1 mL% 100 etanol ile üç ardışık yıkamada dehidre edin.
NOT: Yanıcı ve uçucu bir sıvı olan etanol, ciddi göz ve solunum yolu tahrişine neden olur. Bir duman başlığında manipüle edin ve koruyucu göz gözlükleri takın. - % 100 etanol'ü dikkatlice çıkarın ve kimyasal bir başlık altında, organoidleri her biri ~ 30 dakika boyunca 1 mL ksilen ile 3 ardışık yıkamada temizleyin.
NOT: Ksilen toksik, sıvı yanıcıdır ve buharları tahrişe neden olabilir. Bir duman başlığında manipüle edin. Cilt ile doğrudan temastan kaçının ve lastik eldiven ve koruyucu göz gözlüğü takın. - Kimyasal bir kaputun altında, kasetin bölmelerinden birinin içine bir parça biyopsi pedi (daha önce ksilenle batırılmış) yerleştirerek beyaz bir mikroikiz doku kaseti hazırlayın. Önceden kaplanmış 2 mL plastik Pasteur pipet kullanarak 3D yapıları dikkatlice biyopsi pedine aktarın. Organoidlerin hareket etmesini önlemek için ksilen'e batırılmış başka bir biyopsi pedi ile örtün ve kaseti kapatın.
- Birkaç numune işlenirse, daha fazla işlem yapılmasını beklemek için kaseti bir ksilen banyosuna yerleştirin. Tüm numuneler kasetlere aktarıldıktan sonra, kasetleri 65 ° C'de 30 dakika boyunca önceden ısıtılmış bir parafin banyosuna yerleştirin. Kasetleri gece boyunca taze ısıtılmış bir parafin banyosuna aktarın.
- Parafin emprenye işleminden sonra, önceden ısıtılmış bir gömme kalıbı alın ve ısıtılmış parafini ekleyin. 3D yapıları içeren biyopsi pedini kalıba yerleştirin ve tüm organoidler kalıbın dibine düşene kadar hafifçe çalkalayın. Önceden ısıtılmış ince forseps kullanarak 3D yapıları kalıbın merkezine çok dikkatli bir şekilde yerleştirin. Bölüm 3.3 ile devam edin.
NOT: Forseps ile 3B yapıları bozmamaya dikkat edin; itin, ama onları çimdiklemeyin.
- Küçük (Ø ≤ 400 μm) 3D hücre kültürü modellerinin parafin gömülmesi
- Gömmeden önceki gün, parafin (parafin banyoları), numune başına küçük bir metal gömme kalıbı ve ince forseps ile doldurulmuş iki adet 150 mL şişeyi 65 ° C'ye kadar ısıtın.
- 1x PBS'yi organoid süspansiyondan dikkatlice çıkarın. 1 mL 1x Tris tamponlu salin (TBS) içinde nazikçe 3 yıkama yapın. Organoidlere dokunmadan mümkün olduğunca fazla 1x TBS çıkarın.
NOT: Numuneyi aspire etmemeye dikkat edin. Gerekirse, RT'de 50 x g'de 5 dakikalık bir spin yapın. Kalan fosfat izleri, özellikle jel polimerizasyonunu önleyerek aşağıdaki adımlara müdahale edecektir. Bu nedenle, herhangi bir işleme adımı sırasında PBS çözümlerini kullanmayın. Bu adım için, kasetler, Reaktif #1 (berrak sıvı ) ve Reaktif #2 (renkli sıvı) içeren ticari bir kit, potansiyel olarak küçük parçaları kaybetmeden parafine gömülü prosedürü kolaylaştırmak için kullanılmıştır (bkz. Kit talimatlarını izleyin. Kasetler, destek kağıtları ve tahta ekleri zaten yerinde olacak şekilde önceden monte edilmiştir. - Tüpe 2 damla Reaktif #2 ekleyin ve tüpe dokunarak hafifçe karıştırın. 2 damla Reaktif #1 ekleyin ve jelin katılaşmasını sağlamak için dokunarak tekrar karıştırın. İnce forsepsleri kullanarak, jeli tüpten çıkarın ve kasetin kuyucuğuna yerleştirin.
- Duman başlığının altında, kaseti aşağıdaki gibi ardışık banyolara yerleştirerek numuneyi kurutun (150 mL şişeleri kullanın ve her banyo için taze etanol veya ksilen kullanın): etanol% 70, 30 dakika; etanol% 96, 30 dakika; etanol% 100, üç yıkama, her biri 30 dakika; ksilen, üç yıkama, her biri 30 dakika.
- Kasetleri 65 ° C'de 30 dakika boyunca önceden ısıtılmış bir parafin banyosuna yerleştirin ve gece boyunca taze ısıtılmış bir parafin banyosuna aktarın. Parafin emprenye işleminden sonra, önceden ısıtılmış bir gömme kalıbı alın ve içine ısıtılmış parafin ekleyin. Kaseti açın, jeli ince forsepslerle dikkatlice yerinden çıkarın ve 3D yapıları içeren jeli gömme kalıbının ortasına yerleştirin. Bölüm 3.3 ile devam edin.
- Parafin gömme için yaygın adımlar
- Parafinin ince bir tabaka halinde katılaşmasını sağlamak için kalıbı yavaşça soğuk bir alana aktarın, bu da 3D yapıları uygun konumda tutacaktır. Kalıbın üzerine bir doku kaseti ekleyin ve bu plastik kaseti örtmek için sıcak parafin ekleyin. Tamamen katılaştıktan sonra kalıbı çıkarın ve bölüm 3.4 ile devam edin.
NOT: Parafin bloklar oda sıcaklığında yıllarca saklanabilir.
- Parafinin ince bir tabaka halinde katılaşmasını sağlamak için kalıbı yavaşça soğuk bir alana aktarın, bu da 3D yapıları uygun konumda tutacaktır. Kalıbın üzerine bir doku kaseti ekleyin ve bu plastik kaseti örtmek için sıcak parafin ekleyin. Tamamen katılaştıktan sonra kalıbı çıkarın ve bölüm 3.4 ile devam edin.

Şekil 2: Büyük ve küçük in vitro 3D hücre kültürü modellerinin parafin gömülmesi prosedürüne genel bakış.
(A) Parafin gömme için standart prosedür. Fiksasyon ve dehidrasyondan sonra, 3D yapılar görselleştirmelerini kolaylaştırmak için eozin ile boyanır (sol üst ve alt kısım). 3D yapılar, 2 mL Pasteur pipet (ortada) kullanılarak kasetteki biyopsi pedine (mavi) dikkatlice yerleştirilir. Parafin emprenyesinden sonra, 3D yapılar forseps kullanılarak sıvı parafin içine yavaşça bırakılır ve biyopsi pedinde hafifçe çalkalanır. Küçük 3B yapılar, pedden serbest bırakılamadıkları için bu adım sırasında kaybolur (sağ altta: başarısız gömme). Yalnızca büyük 3B yapılar gömülür (sağ üst: başarılı gömme). Ok uçları 3B kültürlere işaret eder. (B) Standart parafin gömme protokolüne alternatif. Küçük 3D yapıları sabitledikten sonra, hücreleri bir jelde tutmak ve parafin emprenyesinden sonra kalıba transferlerini kolaylaştırmak için ticari bir kit kullanılır (sağda: başarılı bir şekilde gömülür). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Blok kesitleme ve boyama
- Standart bir mikrotom kullanarak 4 μm kesiti kesin ve standart histolojik ve immünohistokimyasal teknikler uygulayın. Bölüm 3.5 ile devam edin.
NOT: Bölümlerin daha iyi yapışması için belirli slaytlar (bkz. Malzeme Tablosu) kullanılmıştır. Slaytlar oda sıcaklığında veya 4 °C'de yıllarca saklanabilir.
- Standart bir mikrotom kullanarak 4 μm kesiti kesin ve standart histolojik ve immünohistokimyasal teknikler uygulayın. Bölüm 3.5 ile devam edin.
- Görüntü yakalama ve analiz
- Dijital slayt tarayıcı veya dik mikroskop kullanarak görüntüleme gerçekleştirin ve tüm 3B yapı bölümlerinde morfolojik ve çoklanmış ifade verilerini hücre bazında raporlayan hızlı dijital nicel analiz için bir platform kullanarak verileri analiz edin (ayrıntılar için Ek Şekil 2'ye bakın).
NOT: 20x hedefi bu grup tarafından rutin olarak kullanılır.
- Dijital slayt tarayıcı veya dik mikroskop kullanarak görüntüleme gerçekleştirin ve tüm 3B yapı bölümlerinde morfolojik ve çoklanmış ifade verilerini hücre bazında raporlayan hızlı dijital nicel analiz için bir platform kullanarak verileri analiz edin (ayrıntılar için Ek Şekil 2'ye bakın).
Sonuçlar
Bu protokol, 2D ve 3D tam montajlı boyama için kritik adımların yanı sıra 3D hücre kültürü modellerinin görüntüleme ve kantitatif analizlerine genel bir bakış sağlar (Şekil 3 ve Şekil 4). Sferoidlerden farklı konakçı türlerden veya dokulardan organoidlere kadar çok çeşitli 3D hücre kültürü modellerine uygulanabilir ve mimari, hücre organizasyonu ve hücresel ve hücre altı düzeylerdeki etkileşimler hakkında doğru ve nicel bilgilerin edinilmesini sağlar (Şekil 3 ve Şekil 4). Laboratuvarların 2D histolojik ve immünohistokimyasal teknikleri ve antikor konsantrasyonlarını kendi ihtiyaçlarına göre optimize etmeleri gerekebilir.
Her iki yöntem de değerli biyolojik bilgiler verir. 3D tam montajlı boyama ve konfokal mikroskopi, 200 μm'ye kadar derinlik alanına sahip hücresel kompozisyon ve uzamsal konum hakkında görsel bilgi sağlar (Şekil 3B). Bununla birlikte, 2B bölümleme, daha büyük 3B yapıların tüm bölümünde, daha büyük örneklerde çözünürlüğü tehlikeye atan ışık saçılması nedeniyle yerinde gözlemlemek zor olabilecek ayrıntılı hücresel morfolojik özellikleri ortaya çıkarmak için daha büyük 3B yapılar için uygundur. Dahası, her iki teknik de nicel veriler sağlayabilir. Gerçekten de, elde edilen çözünürlük, hücre sayısının ölçülmesi ve farklı hücresel alt tiplerde çeşitli hücre belirteçlerinin varlığının tespiti için hücresel ve hücre altı segmentasyon algoritmalarının uygulanmasına izin verir (Şekil 3F ve Şekil 4). Özetle, burada açıklanan görüntüleme teknikleri tekrarlanabilir, basit ve tamamlayıcıdır ve hücresel heterojenliği incelemek için değerli araçları temsil eder.
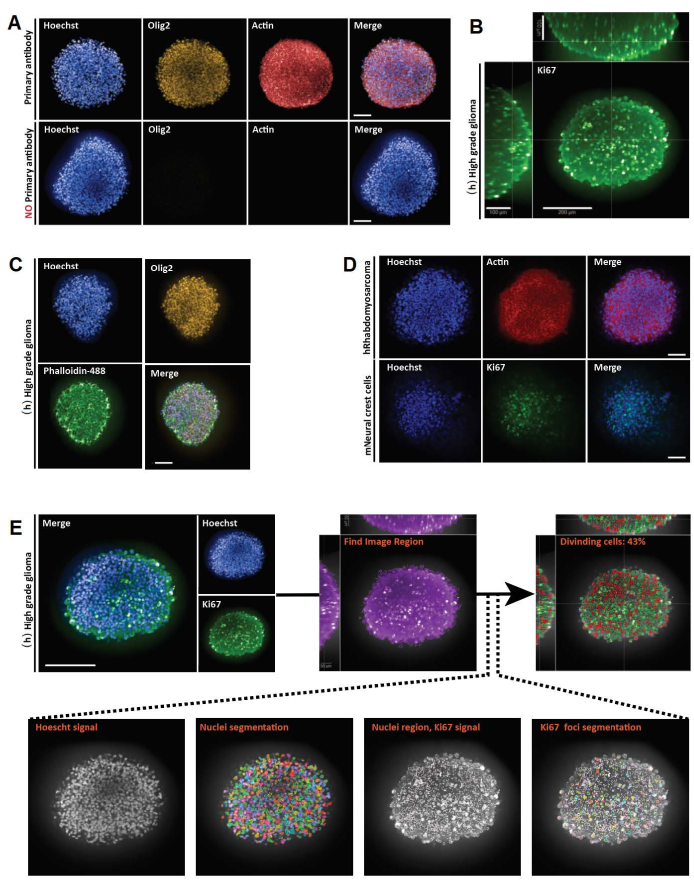
Şekil 3: 3D tüm montaj, görüntüleme ve 3D ve 2D optik kesitlerin analizleri için temsili sonuçlar . (A) Bir hafta boyunca kültürlenmiş ve Hoechst (mavi), Olig2 (sarı) ve Aktin (kırmızı) (20x su hedefi) ile etiketlenmiş insan (h) yüksek dereceli glioma sferoidinin konfokal görüntüleri. Elde edilen tüm görüntüler için, mikroskop ayarları pozitif bir kontrol (üstte) kullanılarak oluşturuldu ve daha sonra negatif kontrol, birincil antikor yokluğunda (altta) floresan eksikliğini kontrol etmek için aynı ayarlar kullanılarak görüntülendi. (B) Bir hafta boyunca kültürlenmiş (h) yüksek dereceli glioma sferoidinde gerçekleştirilen Ki67 boyamasının ortogonal 3D tam montajlı gösterimi (gliserol-fruktoz temizleme; 20x su hedefi, konfokal). (C) Bir hafta boyunca kültürlenmiş ve Hoechst (mavi), Olig2 (sarı) ve Phalloidine-488 (yeşil) (gliserol-fruktoz temizleme; 20x su hedefi) ile etiketlenmiş (h) yüksek dereceli glioma sferoidinin konfokal görüntüleri. (D) İnsan (h) rabdomiyosarkom (üstte) ve fare (m) nöral krest hücresi (altta) sferoidlerinin bir hafta boyunca kültürlenmiş ve sırasıyla Hoechst (mavi), Aktin (kırmızı) ve Ki67 (yeşil) ile etiketlenmiş konfokal görüntüleri (gliserol-fruktoz temizleme; 20x kuru hedef). (E) Bir hafta boyunca kültürlenmiş ve Hoechst (mavi) ve Ki67 (yeşil) (gliserol-fruktoz temizleme; 40x su hedefi) (sol üstte) ile etiketlenmiş (h) yüksek dereceli glioma sferoidinin konfokal görüntüleri. Hoechst kanalındaki bölümlere ayrılmış görüntüler ve yeşil kanaldaki Ki67-pozitif (+) nükleer bölgeler, yüksek içerikli analiz yazılımı kullanılarak oluşturulmuştur (Ek Şekil 1 ve Malzeme Tablosuna bakınız) (altta). Verilen çıktı, segmente edilmiş 3D yapı başına Ki67+ çekirdeğinin yüzdesidir (sağ üstte). Ölçek çubuğu = 100 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
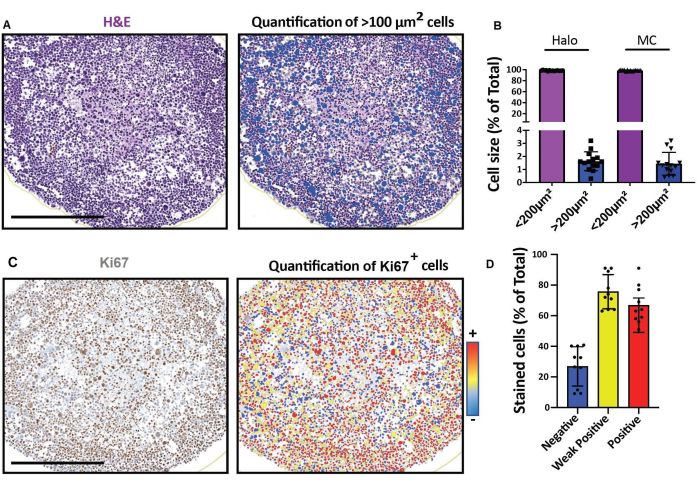
Şekil 4: Dijital slayt tarayıcı ile elde edilen ve hızlı dijital kantitatif analiz için bir platformda analiz edilen bir 3D hücre modelinin (bir ay boyunca kültürlenmiş insan rabdomiyosarkom sferoidleri) 2D kesit görüntüleri. (A, D) 2D kesit görüntüleri. (A) H&E boyama ve hücrelerin boyutlarına göre tespiti. Ölçek çubuğu = 500 μm. (B) Histogram, hızlı dijital kantitatif analiz (solda: Halo) veya manuelsayım (sağda: MC) için yazılım kullanılarak tespit edilen 100 μm2 ve < 100μm2'> hücrelerin yüzdesini gösterir. (C) Ki67 boyama ve hücrelerin 3,3'-diaminobenzidin (DAB) sinyallerinin yoğunluğuna göre tespiti. Negatif (mavi), zayıf pozitif (sarı), pozitif (kırmızı). Ölçek çubuğu = 500 μm. (D) Histogram, Ki67-negatif, zayıf pozitif ve pozitif hücrelerin yüzdesini gösterir. Kısaltmalar: H & E = hematoksilin ve eozin; MC = manuel sayma. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Görüntüleme analiz yazılımındaki adımlara genel bakış. Analizler yapı taşlarının ilişkisine dayanmaktadır. Bir fonksiyon segmentasyonuna, hesaplamaya, ilişkilendirmeye, çıktı tanımına karşılık gelen her yapı taşı ve görüntülenen biyolojik numuneyle eşleşmesi için çoklu algoritmalar ve değişken seçimleri sunar. Yazılım, kolayca kullanılabilen ve değiştirilebilen birden fazla RMS (Hazır Çözüm) analiz protokolü sağlar. Entegre görüntü analizi protokolleri kaydedilebilir, farklı veri kümelerine uygulanabilir ve kullanıcılar arasında paylaşılabilir. Kısaca, analiz protokolü sıralı nesne segmentasyonu anlamına gelir: küresel, çekirdekler ve son olarak Ki67 cepleri (A488). Daha sonra, olumlu olayları daha da ayırt etmek için Ki67 ceplerinin ortalama yoğunluğu hesaplanır. Son olarak, Ki67 pozitif ceplerini kapsayan çekirdekler pozitif olarak seçilir. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Şekil 2: Kantitatif analiz yazılımının prosedür adımlarına genel bakış. 1. Adım. Etütler sekmesini kullanarak dosyaları yükleyin. Dosyalar Görüntü Eylemleri bölümünde açılacaktır. 2. Adım. Ek Açıklamalar sekmesini açın, ardından araç çubuğunun daire aracını kullanarak yapının her yerinde yeni bir katman tasarlamak için Katman Eylemleri'ne tıklayın. Dairesel olmayan yapılar için, bunun yerine kalem aleti kullanılabilir. 3. Adım. Araç çubuğu, ek açıklamalar tasarlamak ve araçla nicelemeyi görselleştirmek için  kullanılabilir. 4. Adım. Analiz sekmesini açın ve numunenin analizi için en iyi koşulları seçin (burada birkaç deneme gerekebilir). Adım 4.1. Boyama durumunu ayarlamak için Leke Seçimi bölümünü kullanın. Birkaç leke olması durumunda, bunlar eklenebilir ve yeniden adlandırılabilir ve sanal renk değiştirilebilir. Lokalizasyon tespiti belirtilebilir - nükleer veya sitoplazma boyaması. Adım 4.2. Hücre algılamayı ayarlamak için Hücre Algılama bölümünü kullanın. Bu bölüm analiz için en önemli bölüm olacaktır. Nükleer Kontrast Eşiği bölümü, tüm çekirdeklerin algılanmasını sağlayacaktır. Birden fazla popülasyon büyüklüğü olması durumunda dikkat edilmelidir, yazılım benzersiz bir büyük hücre yerine birkaç hücreyi tespit edebilir. Nükleer Boyut ve Nükleer segmentasyon agresiflik bölümleri, hücre büyüklüğü popülasyon aralıklarını ölçmek için kullanılabilir. 5. Adım. Örnek analizin nasıl çalıştırılacağına ilişkin açıklama. Şekilde gösterilen adımları izleyin. Ek Açıklama Katmanı bölümü, ayarı yalnızca bu slaytta çalıştırır. Niceliklendirme, araç kullanılarak
kullanılabilir. 4. Adım. Analiz sekmesini açın ve numunenin analizi için en iyi koşulları seçin (burada birkaç deneme gerekebilir). Adım 4.1. Boyama durumunu ayarlamak için Leke Seçimi bölümünü kullanın. Birkaç leke olması durumunda, bunlar eklenebilir ve yeniden adlandırılabilir ve sanal renk değiştirilebilir. Lokalizasyon tespiti belirtilebilir - nükleer veya sitoplazma boyaması. Adım 4.2. Hücre algılamayı ayarlamak için Hücre Algılama bölümünü kullanın. Bu bölüm analiz için en önemli bölüm olacaktır. Nükleer Kontrast Eşiği bölümü, tüm çekirdeklerin algılanmasını sağlayacaktır. Birden fazla popülasyon büyüklüğü olması durumunda dikkat edilmelidir, yazılım benzersiz bir büyük hücre yerine birkaç hücreyi tespit edebilir. Nükleer Boyut ve Nükleer segmentasyon agresiflik bölümleri, hücre büyüklüğü popülasyon aralıklarını ölçmek için kullanılabilir. 5. Adım. Örnek analizin nasıl çalıştırılacağına ilişkin açıklama. Şekilde gösterilen adımları izleyin. Ek Açıklama Katmanı bölümü, ayarı yalnızca bu slaytta çalıştırır. Niceliklendirme, araç kullanılarak  görselleştirilebilir. Uygun niceleme elde edilene kadar 4.1-5 arasındaki adımları tekrarlayın. Adım 6-6.1. Bu adımlar, yazılımı kullanarak bir şekil çizmenizi sağlar. 7. Adım. Yazılım aracılığıyla elde edilen niceleme grafikleri kaydedilebilir. 8. Adım. Veriler dışa aktarılabilir. Bu Dosyayı indirmek için lütfen tıklayınız.
görselleştirilebilir. Uygun niceleme elde edilene kadar 4.1-5 arasındaki adımları tekrarlayın. Adım 6-6.1. Bu adımlar, yazılımı kullanarak bir şekil çizmenizi sağlar. 7. Adım. Yazılım aracılığıyla elde edilen niceleme grafikleri kaydedilebilir. 8. Adım. Veriler dışa aktarılabilir. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Hücre kültürü, doku ve organ gelişimi, fonksiyonu, yenilenmesi ve bozulması ve hastalıkta rol oynayan temel biyolojik mekanizmaları ortaya çıkarmak için vazgeçilmez bir araçtır. Tek katmanlı 2D hücre kültürü baskın olmasına rağmen, son araştırmalar, özellikle gen ekspresyonunu ve hücresel davranışı etkileyen ve böylece daha öngörücü veriler sağlayabilen ek mekansal organizasyon ve hücre-hücre temasları nedeniyle, in vivo hücresel tepkileri daha fazla yansıtan 3D yapılar üreten kültürlere doğru kaymıştır7. Bununla birlikte, ayrıntılı mikroskobik görselleştirme ve hücresel ve hücre altı seviyelerde karmaşık 3D yapıların değerlendirilmesi için kullanıcı dostu boyama ve görüntüleme tekniklerine duyulan ihtiyaç da dahil olmak üzere birçok zorluk devam etmektedir. Bu bağlamda, 100 μm ila birkaç milimetre arasında değişen sabit in vitro 3D hücre kültürü modellerinin boyama ve hücresel ve hücre altı çözünürlüklü görüntülemesini gerçekleştirmek için ayrıntılı, sağlam ve tamamlayıcı protokoller sağlanmıştır.
Bu prosedür, in vitro 3D hücre kültürü modellerinin çok çeşitli boyut ve tipleriyle başa çıkmak için iki farklı strateji sunar. Birinin (3B tam montaj analizi) veya diğerinin (2B kesit analizi) seçimi, kullanılan modele ve araştırılan konuya bağlı olacaktır. Konfokal mikroskopi ile 3D tam montajlı analiz, 3D yapının genel boyutuna bakılmaksızın 200 μm'ye kadar derinlik alanına sahip hücrelerin görselleştirilmesini sağlarken, 2D kesitleme herhangi bir boyuttaki örneklere uygulanabilir, ancak görselleştirme 2D boyutlu kalır. Aşağıda, sorun giderme ve teknik hususlarla ilgili bazı öneriler verilmiştir.
İş akışı sırasında 3D yapıların kaybı en yaygın dezavantajdır. Uçlara ve tüplere yapışkan kalabilirler, bu nedenle PBS-BSA% 0.1 çözeltisi ile ön kaplama uçları ve tüpleri anahtardır. Ayrıca, reaktif değişimleri arasındaki 3D yapıların tortu oluşturmasına izin vermek ve tüm pipetlemeyi çok dikkatli bir şekilde gerçekleştirmek çok önemlidir. Prosedürde de belirtildiği gibi, tüm adımlar için, 3D yapı çökeltmesi çok uzunsa, hücreler RT'de 5 dakika boyunca 50 × g'da hafifçe döndürülebilir. çalışmanın amacına bağlı olarak, böyle bir eğirme adımının avantajları / dezavantajları, santrifüjlemenin 3D yapıların şeklini tehlikeye atabileceği düşünülmelidir. Ayrıca, fiksasyon aşamasında bu morfolojiyi korumaya özen gösterilmelidir, çünkü kistik organoidler çökme eğilimindedir. 400 μm boyutunun altındaki yapıların sabitlenmesi yapısal değişiklikleri önlemelidir.
Optimal immünoetiketleme için, organoidlerin 3D matrislerinden geri kazanılması çok önemli bir adımdır. 3D matris, yeterli antikor penetrasyonunu engelleyebilir veya matrise spesifik olmayan bağlanma nedeniyle yüksek arka plan boyamasına neden olabilir. ECM'nin çıkarılması, organoidlerin dış segmentlerinin morfolojisini değiştirebilir (özellikle çalışılan 3D yapılardan uzanan küçük hücresel çıkıntılar durumunda) ve kısmen analizleri engelleyebilir. Bu tür 3D yapılar için, matris prosedür boyunca korunabilir; Bununla birlikte, çözeltilerin ve antikorların yetersiz penetrasyonunu önlemek ve aşırı arka plan gürültüsünü azaltmayı amaçlayan ardışık yıkama adımlarından kaçınmak için kültür koşulları, hücrelerin minimum miktarda matriste büyümesine dikkatlice uyarlanmalıdır 6,8.
3D tam montaj boyama bölümünde bu protokolde açıklanan optik temizleme adımı, 3D yapıların temizlenmeden 50-80 μm yerine 150-200 μm derinliğe kadar görüntülenmesi için uygundur. Genellikle birkaç hafta süren ve toksik temizleme ajanları kullanan diğer takas metodolojileriyle karşılaştırıldığında, bu protokolde daha önce yayınlanmış hızlı ve güvenli bir temizleme adımı kullanılmıştır 4,9. Ek olarak, bu temizleme adımı geri dönüşümlüdür ve çözünürlük veya parlaklık kaybı olmadan ilk boyamaya yeni antikorlar eklenebilir4. Bununla birlikte, incelenen 3D hücre kültürü modeline bağlı olarak, 3D yapıyı bilgilendirici bir şekilde görüntülemek için 150-200 μm'lik bir derinlik yeterli olmayabilir ve bu temizleme protokolü, büyük lümenli küresel, tek katmanlı organoidlerin genel morfolojisinde değişikliklere neden olabilir4. Kullanıcılar deneylerini dikkatlice tasarlamalı ve gerekirse, geçirgenleştirme / blokaj adımının zamanlamasını optimize etmeli (antikorların ve çözeltinin penetrasyonuna izin vermek için), temizleme adımı (200 μm'den daha derine nüfuz etmek için, örnekler tamamen temizlenmelidir) ve görüntü elde edilmelidir. Çekirdek tesislerde mevcut olan en yaygın iki teknoloji, ışık tabakası ve konfokal mikroskopi olacaktır. Kullanıcıların 3D yapılarının büyüklüğüne ve biyolojik soru10'a göre dikkatlice bir teknoloji seçmeleri gerekecektir. Bununla birlikte, konfokal mikroskopi ile karşılaştırıldığında, bu tür derin yapılar için elde edilen ışık tabakası mikroskobu çözünürlüğü, hücre altı çözünürlük elde etmek için yetersiz kalmaktadır.
Burada, tek numunelerin parafin gömülmesine adanmış ayrıntılı ve sağlam bir süreç bildirilmiştir. İlginçtir ki, Gabriel ve ark. yakın zamanda 3D hücre kültürlerini parafine artan bir verimle gömen bir protokol geliştirdiler. 96 3D yapıyı bir mikroarray deseninde bir blokta sınırlamak için bir polidimetilsiloksan (PDMS) kalıbı kullandılar ve daha fazla grubu, zaman noktasını, tedavi koşullarını kapsayan 3D tümör modelleri üzerindeki çalışmalar için yeni perspektifler sağladılar ve11'i kopyaladılar. Bununla birlikte, bu yöntem, özellikle PDMS kalıpları oluşturmak için kullanılan ön kalıbın imalatı için kapsamlı beceriler ve makineler gerektirir.
Özetle, bu makalede, 3D hücresel modellerin mimari ve hücresel bileşimi hakkında doğru ve nicel bilgilerin edinilmesini sağlayan iki farklı, tamamlayıcı ve uyarlanabilir yaklaşım açıklanmaktadır. Her iki parametre de intratümöral hücresel heterojenite ve tedavilere dirençteki rolü gibi biyolojik süreçleri incelemek için çok önemlidir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu çalışma, St Baldrick'in Robert J. Arceci İnovasyon Ödülü #604303 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Biopsy pad Q Path blue | VWR | 720-2254 | |
| Cassettes macrostar III Blc couv. Char. x1500 | VWR | 720-2233 | |
| Cassette microtwin white | VWR | 720-2183 | |
| Chemical hood | Erlab | FI82 5585-06 | |
| Filter tips 1000 µL | Star lab Tip-One | S1122-1730 | |
| Fine forceps | Pyramid innovation | R35002-E | |
| Flat-bottom glass tubes with PTFE lined 2 mL | Fisher Scientific | 11784259 | Excellent for environmental samples, pharmaceuticals and diagnostic reagents. PTFE is designed for the ultimate in product safety. PTFE provides totally inert inner seal and surface facing the sample or product. |
| Glass bottom dish plate 35 mm | Ibedi | 2018003 | |
| Horizontal agitation | N-BIOTEK | NB-205 | |
| Incubator prewarmed to 65 °C | Memmert Incubator | LAB129 | |
| Inox molds 15x15 | VWR | 720-1918 | |
| Microscope Slides Matsunami TOMO-11/90 | Roche diagnostics | 8082286001 | these slides are used for a better adhesion of sections |
| Microtome | Microm Microtech France | HM340E | |
| Panoramic scan II | 3dhistech | 2397612 | |
| Paraffin embedding equipment | Leica | EG1150C | |
| Plastic pipette Pasteur 2 mL | VWR | 612-1681 | |
| Q Path flacon 150mL cape blanc x250 | VWR | 216-1308 | Good for environmental samples, pharmaceuticals and diagnostic reagents. Polypropylene (PP) are rigid, solid, provide excellent stress crack and impact resistance and have a good oil and alcohol barrier and chemical resistance. PE-lined cap is stress crack resistant and offers excellent sealing characteristics. |
| Set of micropipettors (p200, p1000) | Thermo Scientific | 11877351 (20-200) 11887351(p1000) | |
| OPERA PHENIX | PerkinElmer | HH14000000 | |
| SP5 inverted confocal microscope | Leica | LSM780 | |
| Tissue cassette | VWR | 720-0228 | |
| Zeiss Axiomager microscope | Leica | SIP 60549 | |
| Reagent | |||
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A7030-100G | |
| Cytoblock (kit) | Thermofisher Scientific | 10066588 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 57648266 | CAUTION: toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Eosin aqueous 1% | Sigma-Aldrich | HT110316 | |
| Ethanol 96% | VWR | 83804.360 | CAUTION: Causes severe eye irritation. Flammable liquid and vapor. Causes respiratory tract irritation. Manipulate in a fume hood. Wear protective eye goggles. |
| Ethanol 100% | VWR | 20821.365 | CAUTION: Causes severe eye irritation. Flammable liquid and vapor. Causes respiratory tract irritation. Manipulate in a fume hood. Wear protective eye goggles. |
| Formalin 4% | Microm Microtech France | F/40877-36 | CAUTION: Formalin contains formaldehyde which is hazardous. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves and protective eye goggles. |
| Fructose | Sigma-Aldrich | F0127 | |
| Gill hematoxylin type II | Microm Microtech France | F/CP813 | |
| Glycerol | Sigma-Aldrich | G5516 | 500 mL |
| Hoechst 33342 | Life Technologies | H3570 | CAUTION: Suspected of causing genetic defects. Avoid direct contact with skin. Wear rubber gloves and protective eye goggles. |
| Normal donkey serum | Sigma-Aldrich | D9663 | 10 mL |
| Paraffin Wax tek III | Sakura | 4511 | |
| Phosphate Buffer Saline (PBS) 1 X | Gibco | 14190-094 | |
| Tris-Buffered Saline (TBS) 10X | Microm Microtech France | F/00801 | 100 mL |
| Triton X-100 | Sigma-Aldrich | T8532 | CAUTION: Triton X100 is hazardous. Avoid contact with skin and eyes. |
| Xylene | Sigma-Aldrich | 534056 | CAUTION: Xylene is toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Solutions | |||
| Clearing solution | Glycerol-Fructose clearing solution is 60% (vol/w) glycerol and 2.5 M fructose. To prepare 10 mL of this solution, mix 6 mL of glycerol and 4.5 g of fructose. Complete to 10 mL with dH2O. Use a magnetic stirrer overnight. Refractive index = 1.4688 at room temperature (RT: 19–23 °C). Store at 4 °C in dark for up to 1 month. | ||
| PBS-BSA 0,1% solution | To prepare 0,1% (vol/wt) PBS-BSA 0,1% solution, dissolve 500 mg of BSA in 50 mL of PBS-1X (store at 4°C for up to 2 weeks). And dilute 1mL of this solution into 9mL of PBS-1X. This solution can be used to precoat the tip and centrifugation tube. | ||
| Permeabilisation-blocking solution (PB solution) | The PBSDT blocking solution is PBS-1X supplemented with 0.1% – 1% Tritonx-100 (depending on the protein localization membrane/nucleus), 1% DMSO, 1% BSA and 1% donkey serum (or from the animal in which the secondary antibodies were raised). This solution can be stored at 4°C for up to 1 month. | ||
| PB:PBS-1X (1:10) solution | PB:PBS-1X (1:10) solution is a 10 time diluted PB solution. To prepare 10 mL of this solution dilute 1 mL of PB solution in 9 mL of PBS-1X. | ||
| Software | |||
| Halo software | Indicalabs | NM 87114 | |
| Harmony software | PerkinElmer | HH17000010 |
Referanslar
- Ryu, N. E., Lee, S. H., Park, H. Spheroid culture system methods and applications for mesenchymal stem cells. Cells. 8 (12), 1-13 (2019).
- Bartfeld, S., Clevers, H. Stem cell-derived organoids and their application for medical research and patient treatment. Journal of Molecular Medicine. 95 (7), 729-738 (2017).
- Cui, X., Hartanto, Y., Zhang, H. Advances in multicellular spheroids formation. Journal of the Royal Society, Interface. 14 (127), (2017).
- Dekkers, J. F., et al. High-resolution 3D imaging of fixed and cleared organoids. Nature Protocols. 14, 1756-1771 (2019).
- Broutier, L., et al. Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation. Nature Protocols. 11 (9), 1724-1743 (2016).
- Rezanejad, H., Lock, J. H., Sullivan, B. A., Bonner-Weir, S. Generation of pancreatic ductal organoids and whole-mount immunostaining of intact organoids. Current Protocols in Cell Biology. 83 (1), 82 (2019).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. Assay and Drug Development Technologies. 12 (4), 207-218 (2014).
- McCray, T., Richards, Z., Marsili, J., Prins, G. S., Nonn, L. Handling and assessment of human primary prostate organoid culture. Journal of Visualized Experiments: JoVE. (143), e59051 (2019).
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nature Reviews: Neuroscience. 21 (2), 61-79 (2020).
- Lazzari, G., et al. Light sheet fluorescence microscopy versus confocal microscopy: in quest of a suitable tool to assess drug and nanomedicine penetration into multicellular tumor spheroids. European Journal of Pharmaceutics and Biopharmaceutics. 142, 195-203 (2019).
- Gabriel, J., Brennan, D., Elisseeff, J. H., Beachley, V. Microarray embedding/sectioning for parallel analysis of 3D cell spheroids. Scientific Reports. 9, 16287 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır