Method Article
צביעה והדמיה ברזולוציה גבוהה של מודלים תלת מימדיים של אורגנואידים וכדוריים
* These authors contributed equally
In This Article
Summary
כאן, אנו מספקים פרוטוקולים מפורטים, חזקים ומשלימים לביצוע הדמיית צביעה ורזולוציה תת-תאית של מודלים קבועים של תרביות תאים תלת-ממדיות בטווח של 100 מיקרומטר עד מספר מילימטרים, ובכך מאפשרים הדמיה של המורפולוגיה, הרכב סוג התא והאינטראקציות ביניהם.
Abstract
מודלים תלת-ממדיים של תרביות תאים במבחנה (3D), כגון אורגנואידים וספרואידים, הם כלים רבי ערך עבור יישומים רבים, כולל פיתוח ומידול מחלות, גילוי תרופות ורפואה רגנרטיבית. כדי לנצל מודלים אלה במלואם, חיוני לחקור אותם ברמה התאית והתת-תאית. עם זאת, אפיון מודלים כאלה של תרביות תאים תלת-ממדיות במבחנה יכול להיות מאתגר מבחינה טכנית ודורש מומחיות ספציפית לביצוע ניתוחים יעילים. כאן, מאמר זה מספק פרוטוקולים מפורטים, חזקים ומשלימים לביצוע דימות צביעה ורזולוציה תת-תאית של מודלים קבועים של תרביות תאים תלת-ממדיות במבחנה בטווח של 100 מיקרומטר עד מספר מילימטרים. פרוטוקולים אלה ישימים למגוון רחב של אורגנואידים וספרואידים הנבדלים זה מזה בתנאי המוצא של התא, המורפולוגיה והתרבית שלהם. מקצירת מבנה תלת-ממדית ועד ניתוח תמונות, ניתן להשלים פרוטוקולים אלה תוך 4-5 ימים. בקצרה, מבנים תלת-ממדיים נאספים, קבועים, ולאחר מכן ניתן לעבד אותם באמצעות הטבעה של פרפין וצביעה היסטולוגית/אימונוהיסטוכימית, או באמצעות סימון חיסוני ישיר והכנה לניקוי אופטי ושחזור תלת-ממדי (עומק 200 מיקרומטר) במיקרוסקופ קונפוקלי.
Introduction
במהלך העשורים האחרונים, ההתקדמות בביולוגיה של תאי גזע ובטכנולוגיות תרביות תלת-ממד במבחנה בישרו על מהפכה בביולוגיה וברפואה. מודלים של תאים בעלי מורכבות גבוהה יותר בתלת-ממד הפכו פופולריים מאוד מכיוון שהם מאפשרים לתאים לגדול ולקיים אינטראקציה עם מסגרת חוץ-תאית הסובבת אותם, תוך שחזור הדוק של היבטים של רקמות חיות, כולל הארכיטקטורה שלהם, ארגון התא והאינטראקציות שלהם, או אפילו מאפייני הדיפוזיה. ככאלה, מודלים תלת-ממדיים של תרביות תאים יכולים לספק תובנות ייחודיות על התנהגות תאים ברקמות מתפתחות או חולות במבחנה. אורגנואידים וספרואידים הם שניהם מבנים תלת-ממדיים רב-תאיים, הנעים בין מספר מיקרומטרים למילימטרים, והם הבולטים ביותר במבנים תלת-ממדיים במבחנה. שניהם יכולים להיות מתורבתים בתוך פיגום תומך, כולל (i) הידרוג'ל שמקורו בבעלי חיים (תמצית קרום מרתף, קולגן), צמחים (alginate/agarose), או מסונתז מכימיקלים, או (ii) מטריצות אינרטיות המכילות נקבוביות כדי לקדם שגשוג תאים וצמיחה.
אורגנואידים וספרואידים יכולים גם להתפתח ללא נוכחות של פיגום תומך על ידי הסתמכות על תאים להרכבה עצמית לאשכולות. זה מסתמך על טכניקות שונות כגון שימוש בחומרים לא דביקים כדי לעכב התקשרות תאים, מתח פני השטח וכוח הכבידה (למשל, טכניקות נפילה תלויה), או סיבוב מעגלי קבוע של כלי דם (למשל, תרבית ספינר). בכל המקרים, טכניקות אלה מקלות על אינטראקציות תא-תא ומטריצת תאים כדי להתגבר על המגבלות של תרבית תאים חד-שכבתית מסורתית1. המונחים "אורגנואידים" ו"ספרואידים" שימשו לסירוגין בעבר, אך ישנם הבדלים מרכזיים בין שני מודלים אלה של תרביות תאים תלת-ממדיות. אורגנואידים הם צבירי תאים תלת-ממדיים במבחנה שמקורם בתאי גזע פלוריפוטנטיים או תאי גזע ספציפיים לרקמות, שבהם תאים מתארגנים באופן ספונטני לאבות ולסוגי תאים ממוינים ואשר משחזרים לפחות חלק מהפונקציות של האיבר המעניין2. ספרואידים מהווים טווח רחב יותר של מבנים תלת-ממדיים רב-תאיים הנוצרים בתנאים לא נצמדים ויכולים לנבוע ממגוון גדול של סוגי תאים כגון קווי תאים אימורטליים או תאים ראשוניים3. לפיכך, הטבועים במקורם הפנימי של תאי גזע, לאורגנואידים יש נטייה גבוהה יותר להרכבה עצמית, כדאיות ויציבות מאשר ספרואידים.
עם זאת, למעשה, שני מודלים אלה הם מבנים תלת-ממדיים המורכבים מתאים מרובים, ולכן הטכניקות שפותחו כדי לחקור אותם דומות מאוד. לדוגמה, גישות הדמיה חזקות ברמת הרזולוציה של תא בודד נחוצות כדי לחקור את המורכבות התאית הן של אורגנואידים והן של ספרואידים. כאן, על ידי סיכום המומחיות של קבוצה זו ושל מובילים בתחום האורגנואידים4, מאמר זה מתאר הליכים מפורטים לביצוע צביעה דו-ממדית (דו-ממדית) ותלת-ממדית של הרכבה מלאה, הדמיה וניתוח של ההרכב התאי והתת-תאי והארגון המרחבי של אורגנואידים וכדורואידים בטווח שבין 100 מיקרומטר למספר מילימטרים. ואכן, הליך זה מציג שני סוגים שונים ומשלימים של צביעה ורכישת הדמיה כדי לנתח מגוון רחב של גדלים וסוגים של מודלים תלת ממדיים של תרביות תאים במבחנה. השימוש באחד (3D whole-mount analysis) או השני (2D section analysis) יהיה תלוי במודל שנלמד ובתשובות המבוקשות. ניתוח תלת-ממדי של כל הרכבה באמצעות מיקרוסקופ קונפוקלי יכול, למשל, להיות מיושם כדי להמחיש תאים בתרבית תלת-ממדית בעומק של עד 200 מיקרומטר, ללא קשר לגודל הכולל של המבנה התלת-ממדי, ואילו ניתוח של חתכים דו-ממדיים מספק תובנות לגבי דגימות בכל גודל, אם כי ברמה הדו-ממדית. הליך זה יושם בהצלחה במגוון אורגנואידים4,5 וספרואידים שמקורם בתאי אדם ומורין, שמקורם בשכבות נבט עובריות שונות. הסקירה הכללית של ההליך מוצגת באיור 1. מצוינים השלבים העיקריים, היחסים ביניהם, הצעדים המכריעים והעיתוי הצפוי.
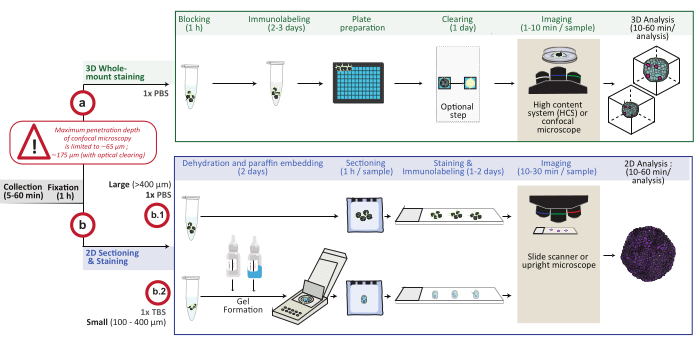
איור 1: סקירה סכמטית של ההליך. מודלים של תרביות תאים תלת-ממדיות במבחנה נאספים וקבועים, ולאחר מכן מוכנים לצביעה תלת-ממדית של הר שלם (אפשרות א) או מוטמעים בפרפין עבור חתך וצביעה דו-ממדיים (אפשרות ב). עבור ניסויי צביעה תלת-ממדיים בהרכבה שלמה, מבנים תלת-ממדיים קבועים מסומנים כבעלי תווית חיסונית לאחר שלב הקיבוע. ניתן לבצע שלב ניקוי אופטי אופציונלי לשיפור איכות ההדמיה והעומק של מיקרוסקופ אופטי על ידי הפחתת פיזור האור במהלך עיבוד תמונה. התמונות נלכדות במיקרוסקופ קונפוקלי הפוך או במערכת תוכן קונפוקלית גבוהה ומנותחות באמצעות התוכנה המתאימה. עבור הטבעה פרפין, מבנים תלת ממדיים מעובדים ישירות (אפשרות b.1 עבור מבנים גדולים ≥ 400 מיקרומטר) או כלולים בג'ל (b.2; מבנים קטנים ≤ 400 מיקרומטר) עבור התייבשות והטבעה פרפין. לאחר מכן גושי פרפין נחתכים ומוכתמים (צביעה היסטולוגית או אימונוכימית). תמונות של מקטעים דו-ממדיים מתקבלות בסורק שקופיות דיגיטלי או במיקרוסקופ זקוף ומנותחות על פלטפורמת ניתוח תמונות באמצעות ניתוח כמותי דיגיטלי מהיר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Protocol
הערה: יש לצפות לאובדן של ≤25% מהמספר הראשוני של מבנים תלת-ממדיים במהלך השלבים הכוללים שינויים מגיבים ושטיפה בהליך הבא. תכנן להשתמש במספר סופי של לפחות עשרה מבנים תלת-ממדיים, בגודל הנע בין 100 ל-500 מיקרומטר, לכל תנאי נבדק כדי לבצע ניתוחי תמונה איכותיים וכמותיים. במידת הצורך, עבור מבנים גדולים יותר, לחתוך את הקצוות של 1 מ"ל פיפטה טיפים כדי למנוע שבירת המבנים. עבור כל השלבים, אם שקיעת המבנה התלת-ממדי ארוכה מדי, ניתן לסובב תאים בעדינות במהירות של 50 × גרם למשך 5 דקות בטמפרטורת החדר (RT). בהתאם לנושא הנחקר, יש לשקול יתרונות/חסרונות של צעד מסתובב כזה, שכן צנטריפוגה יכולה לסכן את צורת המבנים התלת-ממדיים. הימנע מסתובב ב >100 × גרם.
1. איסוף וקיבוע מודלים תלת ממדיים של תרביות תאים
הערה: היזהר לא לשאוף את המבנים התלת-ממדיים, שיהיו מחוברים רק באופן רופף לקיר הצינור.
- קצירת מודלים תלת ממדיים של תרביות תאים המשובצים במטריצה
הערה: סעיף זה מתאר את ההתאוששות של מבנים תלת-ממדיים שגדלו בטיפות של תמצית קרום מרתף מסרקומה של נחיל אנגלברט-הולם (BME), אך עשויים להיות מותאמים למטריצות אחרות. ראה את הדיון לנקודות מכריעות לגבי ECM.- הסר את מדיום התרבית מהבארות מבלי להפריע למטריצה התלת-ממדית. צפו מראש את החלק הפנימי והחיצוני של קצה פיפטה במינון 1 מ"ל בחלבון (הנקרא להלן קצה מ"ל 1 מ "ל מצופה מראש ) על ידי טבילת הקצה לכל אורכו באלבומין סרום בקר 0.1% (BSA) במי מלח חוצצי פוספט (PBS) (הנקרא תמיסה PBS-BSA 0.1% להלן) ופיפטוף 1 מ"ל של תמיסה זו למעלה ולמטה פעמיים.
הערה: ציפוי מקדים זה ימנע מהתאים להידבק לקצה וימזער כל אובדן. - מצפים מראש את החלק הפנימי של צינור צנטריפוגה (15 מ"ל) בחלבון (נקרא להלן צינור צנטריפוגה מצופה מראש ) על ידי מילוי חוזר ונשנה בתמיסת PBS-BSA 0.1% וריקון הצינור.
הערה: פעולה זו תמנע מהתאים להידבק לצינור ותמזער כל אובדן. - באמצעות קצה 1 מ"ל המצופה מראש, בזהירות להשעות מחדש את המבנים התלת-ממדיים של הבאר באמצעות 1 מ"ל של PBS 1x קר כקרח, ולהעביר בעדינות את המתלה המכיל את המבנים התלת-ממדיים לצינור הצנטריפוגה המצופה מראש.
- הוסיפו בעדינות 13 מ"ל של PBS 1x קר כקרח, ואפשרו למבנים התלת-ממדיים לשקוע על קרח למשך 10 דקות לפחות.
הערה: במידת הצורך, סחור במשך 5 דקות ב- 50 × גרם ב- 4 ° C. הימנע מסתובב >100 × גרם, כמו זה יפגע את הצורה של מבנים 3D. - הסר את supernatant. בעזרת קצה מ"ל 1 מ"ל מצופה מראש, השהה מחדש בעדינות את המבנים התלת-ממדיים ב-1 מ"ל של PBS 1x קר כקרח. חזור על שלבים 1.1.4 עד 1.1.5 כדי לקבל גלולה הומוגנית ללא שאריות מטריצה תלת-ממדית.
הערה: הסרת מטריצה יעילה מושפעת מסוג המטריצה, המספר והגודל של מבנים תלת-ממדיים ודורשת אופטימיזציה לתנאי תרבות שונים. עבור מבנים תלת-ממדיים הגדלים ב-BME, ההתאוששות מהסרת המטריצה אורכת בדרך כלל 45-60 דקות. - באמצעות קצה מצופה מראש של 1 מ"ל, העבר את מתלה PBS 1 מ"ל 1x המכיל את המבנים התלת-ממדיים לצינור צנטריפוגה מצופה מראש של 1.5 מ"ל, והמשך עם סעיף 1.3.
- הסר את מדיום התרבית מהבארות מבלי להפריע למטריצה התלת-ממדית. צפו מראש את החלק הפנימי והחיצוני של קצה פיפטה במינון 1 מ"ל בחלבון (הנקרא להלן קצה מ"ל 1 מ "ל מצופה מראש ) על ידי טבילת הקצה לכל אורכו באלבומין סרום בקר 0.1% (BSA) במי מלח חוצצי פוספט (PBS) (הנקרא תמיסה PBS-BSA 0.1% להלן) ופיפטוף 1 מ"ל של תמיסה זו למעלה ולמטה פעמיים.
- קצירת מודלים צפים של תרביות תאים תלת-ממדיות
- באמצעות קצה מצופה מראש 1 מ"ל, בזהירות לאסוף ולהעביר את המבנים 3D לצינור צנטריפוגה 1.5 מ"ל מצופה מראש. אפשר למבנים התלת-ממדיים לשקוע, או להסתובב במשך 5 דקות ב-50 × גרם ב-RT.
- הסר את supernatant. באמצעות קצה מ"ל 1 מ"ל מצופה מראש, להשעות מחדש את המבנים התלת-ממדיים ב-1 מ"ל של 1x PBS. המשך עם סעיף 1.3.
- קיבוע מודלים תלת ממדיים של תרביות תאים
- אפשרו למבנים התלת-ממדיים לשקוע. בזהירות להסיר את supernatant; מתחת למכסה מנוע, יש להשהות מחדש בעדינות את המבנים התלת-ממדיים ב-1 מ"ל פורמלין באמצעות קצה מצופה מראש של 1 מ"ל.
הערה: פורמלין מכיל פורמלדהיד, שהוא מסוכן. לתפעל את הכימיקל במכסה מנוע כימי. יש ללבוש כפפות גומי ומשקפי בטיחות. - דגרו על המבנים התלת-ממדיים למשך 30 דקות ב-RT.
הערה: שלב קיבוע של 30 דקות עם פורמלין נדרש עבור immunostaining של מגוון רחב של מבנים 3D (משתנה בגודל, צורה, ומקור). עם זאת, באופן כללי, זמני קיבוע ארוכים יותר (>3 שעות) מתאימים יותר לשימור הפלואורסצנטיות של חלבוני כתב. - אפשרו למבנים התלת-ממדיים לשקוע, או להסתובב במשך 5 דקות ב-50 × גרם ב-RT. הסירו בעדינות את הפורמלין והחליפו אותו ב-1 מ"ל של 1x PBS. חזור על שלב כביסה זה ב- PBS 1x פעמיים. אחסן את הדגימות ב -4 מעלות צלזיוס, והמשך עם סעיף 2 או סעיף 3.
הערה: ניתן להשהות את הפרוטוקול כאן, ולשמור על התאים ב- 4 ° C לאחסון לטווח ארוך (> שנה).
- אפשרו למבנים התלת-ממדיים לשקוע. בזהירות להסיר את supernatant; מתחת למכסה מנוע, יש להשהות מחדש בעדינות את המבנים התלת-ממדיים ב-1 מ"ל פורמלין באמצעות קצה מצופה מראש של 1 מ"ל.
2.3D צביעה של הר שלם, הדמיה וניתוח של מודלים תלת-ממדיים של תרביות תאים
הערה: מכיוון שהאורגנואידים מחוברים באופן רופף לדופן הצינור, טפל בהם בעדינות מכיוון שכל השינויים הבאים מגיבים עלולים לגרום לאובדן דגימה. לפני שתתחיל, ודא את הזמינות של הפקדים הנכונים עבור צביעה. בקרות חיוביות ושליליות יכולות להיות תאים, שבהם החלבון המעניין ידוע כמתבטא יתר על המידה או נעדר, בהתאמה. דגירה על דגימות ללא הנוגדן הראשוני כדי לקבוע אם האות שנצפה נובע מקשירה לא ספציפית של הנוגדן המשני. מכיוון שתאים מסוימים נוטים להציג רמות גבוהות של אוטופלואורסצנטיות, השתמש בפקדים נטולי נוגדנים משניים כדי לקבוע אם הפלואורסצנטיות שנצפתה מגיעה מאוטופלואורסצנטיות ברקע. ניתן לשלב תיוג חיסוני והדמיית כתב פלואורסצנטי.
- צביעה תלת ממדית של הר שלם
- הכינו את תמיסת חסימת החדירה (PB) על ידי תוספת PBS 1x עם 0.1%-1% של חומר פעילי שטח לא יוני (ראו טבלת חומרים), 1% דימתיל-סולפוקסיד, 1% BSA ו-1% נסיוב חמורים (או מהחיה שבה גידלו את הנוגדנים המשניים).
הערה: מטב בזהירות את ריכוז חומר פעילי השטח הלא יוני בהתאם למיקום של המטרה: ממברנה (0-0.5%), ציטופלסמה (0.5-1%) וגרעין (1%). ניתן לאחסן תמיסה זו בטמפרטורה של 4°C למשך עד חודש אחד. BSA בדרך כלל עובד טוב עבור שלב החסימה, אבל במקרה של רעשי רקע גבוהים, לבצע בדיקה אמפירית כדי לקבל את התוצאות הטובות ביותר האפשריות עבור שילוב נתון של נוגדנים. - העבר את האורגנואידים מצינור הצנטריפוגה של 1.5 מ"ל לצינור של 0.5 מ"ל באמצעות קצה מצופה מראש של 1 מ"ל. תן למשקעים אורגנואידים, להסיר בעדינות את PBS 1x, ולהחליף אותו עם 0.5 מ"ל של תמיסת PB. דגרו על האורגנואידים בתסיסה אופקית עדינה (30-50 סל"ד) למשך שעה אחת ב-RT.
- תנו לאורגנואידים לשקוע, הסירו בעדינות את תמיסת ה-PB ושטפו פעמיים ב-1 מ"ל PBS-BSA 0.1% למשך 3 דקות.
הערה: המתנה של 3 דקות מאפשרת למבנים לשקוע בתחתית הצינור. - הסר בעדינות את PBS-BSA 0.1%, והוסף 250 μL של נוגדן ראשוני מדולל בריכוז המתאים בתמיסת PB:1x PBS (1:10). כדי להכין 10 מ"ל של תמיסת PB:1x PBS (1:10), יש לדלל 1 מ"ל של תמיסת PB ב-9 מ"ל של 1x PBS. יש לדגור במשך 2-3 ימים עם תסיסה אופקית עדינה (30-50 סל"ד) ב-4°C.
הערה: זמן דגירה מתאים של נוגדנים הוא קריטי לחדירת נוגדנים מתאימה מכיוון שמבנים תלת ממדיים יכולים לפעמים להגיע לגדלים גדולים. - הניחו לאורגנואידים לשקוע, והסירו בעדינות את תמיסת הנוגדנים העיקרית. יש לכבס 5x ב-PBS-BSA 0.1% למשך 3 דקות לכביסה ולאחר מכן פעמיים ב-1 מ"ל PBS-BSA 0.1% למשך 15 דקות לכביסה בתסיסה אופקית עדינה.
- הוסף 250 μL של נוגדן משני מדולל ב 1:250 בתמיסת PB:1x PBS (1:10). יש לדגור במשך 24 שעות ב-4°C עם תסיסה אופקית עדינה (30-50 סל"ד). בשלב זה, הגן על הדגימות מפני אור.
- הוסף 250 μL של Hoechst 33342 (20 μM תמיסת מלאי) מדולל ב 1:1000 בתמיסת PB:1x PBS (1:10), ודגור עוד שעתיים ב 4 ° C עם תסיסה אופקית עדינה (30-50 סל"ד).
- תן לאורגנואידים משקעים, והסר בעדינות את התמיסה המכילה נוגדן משני + Hoechst 33342. שטפו את האורגנואידים 5x ב-1 מ"ל של 1x PBS במשך 3 דקות לכל כביסה ולאחר מכן 2x ב-1 מ"ל של 1x PBS למשך 15 דקות לכל כביסה עם תסיסה אופקית עדינה (30-50 סל"ד).
הערה: חיוני לשטוף באופן נרחב את הדגימות כדי למנוע רעשי רקע או אובדן אות. - אחסן את הדגימות ב- PBS ב- 4 °C עד לרכישת תמונה. המשך עם סעיף 2.2.
הערה: ניתן להשהות את הפרוטוקול כאן, וניתן לאחסן את הדגימות ב -4 מעלות צלזיוס למשך מספר חודשים, מוגן מפני אור.
- הכינו את תמיסת חסימת החדירה (PB) על ידי תוספת PBS 1x עם 0.1%-1% של חומר פעילי שטח לא יוני (ראו טבלת חומרים), 1% דימתיל-סולפוקסיד, 1% BSA ו-1% נסיוב חמורים (או מהחיה שבה גידלו את הנוגדנים המשניים).
- הכנת דגימה להדמיה קונפוקלית
- באמצעות קצה מ"ל 1 מ"ל מצופה מראש, בזהירות להעביר את האורגנואידים לתוך 50 μL של 1x PBS לכל באר microplate פוליסטירן שחור 96 באר. המשך לשלב 2.2.3 או סעיף 2.3.
הערה: בשלב זה, הדגימה יכולה להיות מוגנת מפני אור ומאוחסנת ב 4 ° C במשך שבועות רבים. - ניקוי
הערה: שלב הניקוי הוא אופציונלי וניתן להשתמש בו כדי לתייג אורגנואידים חיסוניים או לזהות פלואורסצנטיות אנדוגנית. ניקוי יכול לגרום להתכווצות מבנה תלת-ממדית, אך אינו משנה את המורפולוגיה הכללית למעט אורגנואידים חד-שכבתיים כדוריים עם לומןגדול 4. עבור אורגנואידים ציסטיים אלה, דלג על שלב הסליקה, ובצע הדמיה של רקמות עמוקות6.- הכינו תמיסת ניקוי גליצרול-פרוקטוז בנפח 2.5 מ' המכילה 50% גליצרול v/v, 11% v/v מים מזוקקים ו-45% פרוקטוז w/v על ידי ערבוב על מערבל מגנטי לפחות למשך הלילה עד שהתמיסה תהיה מסיסה והומוגנית לחלוטין. יש לאחסן בטמפרטורה של 4°C בחושך למשך עד חודש אחד.
- הסר כמה שיותר PBS 1x מבלי לגעת באורגנואידים. הוסף 200 μL של תמיסת הניקוי באמצעות קצה פיפטה 1 מ"ל לאחר הסרת הקצה, והשהה מחדש בעדינות כדי למנוע היווצרות של בועות. לדגור ב- RT לפחות 12 שעות, ולהמשיך עם סעיף 3.
הערה: מכיוון שפתרון הסליקה צמיג, קשה לטפל בנפחים קטנים. כדי להקל על הטיפול, ודא שהפתרון נמצא ב- RT, ופיפטה לאט. לניקוי מיטבי, יש לאפשר לדגימה לשקוע בתמיסת הניקוי לפחות 24 שעות לפני ההדמיה. אם מבנים תלת-ממדיים צפים בזמן הרכישה, בצע סיבוב אופציונלי למשך 10 דקות ב- <100 × גרם ב- RT, או המתן זמן רב יותר (יום עד מספר ימים) כדי לאפשר להם לשקוע. ניתן להשהות את הפרוטוקול בשלב זה לפני שתמשיך להדמיה אם הוא מוגן מפני אור ומאוחסן ב -4 ° C (במשך שבועות) או -20 ° C (במשך חודשים).
- באמצעות קצה מ"ל 1 מ"ל מצופה מראש, בזהירות להעביר את האורגנואידים לתוך 50 μL של 1x PBS לכל באר microplate פוליסטירן שחור 96 באר. המשך לשלב 2.2.3 או סעיף 2.3.
- רכישה וניתוח של תמונות
הערה: טכנולוגיית חתך תמונות תידרש כדי לצלם מבנים תלת-ממדיים.- השתמש במיקרוסקופ קונפוקלי, והעדיף מטרות טבילה עם צמצם מספרי גבוה יותר (NA) בהשוואה לאוויר. בחר מטרות הגדלה (10x, 20x, 40x) בהתאם לגודל מבנים תלת ממדיים, שחזור תמונה (תפירה) ופתרונות המשמשים לניתוח.
- בעת בחירת מצב הרכישה, קח בחשבון את עומק המיקוד של המטרה המשמשת להגדרת השלב עבור ערימת Z; לאפשר עיבוד תלת-ממדי אופטימלי.
הערה: פתרונות ניתוח תמונה משתנים, ויהיה צורך להתאים את הניתוח לתוכנה שבה נעשה שימוש. לדוגמה, פרוטוקול ניתוח זה התבסס על תוכנת ניתוח תוכן גבוהה (ראו טבלת חומרים ואיור משלים 1 לפרטים) ומספק נתונים על פילוח אובייקטים, חישוב תכונות ובחירת אוכלוסיית תאים בתוך אובייקט משוחזר תלת-ממדי.
3. חתך דו-ממדי, צביעה, הדמיה וניתוח של מודלים תלת-ממדיים של תרביות תאים
הערה: מודלים תלת-ממדיים של תרביות תאים משתנים בגודלם. המשך עם סעיף 3.1 או 3.2 להטמעת פרפין יעילה (איור 2). יש להקדיש מספיק זמן לשיקוע מבנה תלת-ממדי לפני שטיפות ושינויים מגיבים. היזהר לא לשאוף את האורגנואידים כי יהיה צף בתחתית הצינור. להטמעת פרפין, עיינו באיור 2 לקבלת הדרכה.
- שיבוץ פרפין של מודלים גדולים (Ø ≥ 400 μm) של תרביות תאים תלת-ממדיות
- ביום שלפני ההטבעה, חממו מראש שתי צלוחיות של 150 מ"ל מלאות בפרפין (אמבטיות פרפין), תבנית הטבעה מתכתית קטנה לכל דגימה, ומלקחיים עדינים ל -65 מעלות צלזיוס.
- בעזרת קצה מ"ל 1 מ"ל מצופה מראש, מעבירים בזהירות את האורגנואידים ב-PBS 1x לשפופרת זכוכית שטוחה עם פקק בקבוק מרופד פוליטטרה-פלואורואתילן. תן למשקעים אורגנואידים, להסיר בזהירות את PBS 1x, ולהחליף אותו עם 70% אתנול. יש לדגור במשך 30 דקות לפחות.
- תן אורגנואידים משקעים, בזהירות להסיר את 70% אתנול. החלף אותו עם 1 מ"ל של פתרון eosin Y מוכן לשימוש. יש להעיף את הצינור ולהכתים למשך 30 דקות לפחות. בזהירות להסיר את תמיסת eosin, ולייבש את אורגנואידים בשלוש שטיפות רצופות עם 1 מ"ל של 100% אתנול במשך ~ 30 דקות כל אחד.
הערה: אתנול, נוזל דליק ונדיף, גורם לגירוי חמור בעיניים ובדרכי הנשימה. תמרנו אותו במכסה מנוע מנדף, והרכיבו משקפי מגן לעיניים. - בזהירות להסיר את 100% אתנול, ותחת מכסה מנוע כימי, לנקות את האורגנואידים ב 3 שטיפות רצופות עם 1 מ"ל של xylene במשך ~ 30 דקות כל אחד.
הערה: קסילן הוא נוזל רעיל דליק שאדיו עלולים לגרום לגירוי. תמרנו אותו במכסה מנוע. יש להימנע ממגע ישיר עם העור, וללבוש כפפות גומי ומשקפי מגן לעיניים. - מתחת למכסה מנוע כימי, הכינו קלטת רקמת מיקרו-טווין לבנה על ידי הנחת חתיכת כרית ביופסיה (שהייתה ספוגה בעבר בקסילן) בתוך אחד התאים של הקלטת. מעבירים בזהירות את המבנים התלת-ממדיים באמצעות פיפטת פסטר פלסטיק 2 מ"ל מצופה מראש לכרית הביופסיה. כסו אותם בכרית ביופסיה נוספת ספוגה בקסילן כדי למנוע מהאורגנואידים לזוז, וסגרו את הקלטת.
- אם מעובדים מספר דגימות, הניחו את הקלטת באמבט קסילן כדי להמתין לעיבוד נוסף. לאחר שכל הדגימות מועברות לקלטות, הניחו את הקלטות באמבט פרפין שחומם מראש למשך 30 דקות בטמפרטורה של 65 מעלות צלזיוס. מעבירים את הקלטות לאמבט פרפין טרי שחומם מראש למשך הלילה.
- לאחר הספגת פרפין, לוקחים תבנית הטבעה שחוממה מראש, ומוסיפים לה את הפרפין המחומם. הכניסו את כרית הביופסיה המכילה את המבנים התלת-ממדיים לתבנית, ועוררו אותה בעדינות עד שכל האורגנואידים צונחים לתחתית התבנית. בזהירות רבה מניחים את המבנים התלת-ממדיים במרכז התבנית באמצעות מלקחיים עדינים שחוממו מראש. המשך עם סעיף 3.3.
הערה: היזהר לא להפריע למבנים התלת-ממדיים עם המלקחיים; לדחוף, אבל לא לצבוט אותם.
- שיבוץ פרפין של מודלים קטנים (Ø ≤ 400 μm) של תרביות תאים תלת-ממדיות
- ביום שלפני ההטבעה, חממו מראש שתי צלוחיות של 150 מ"ל מלאות בפרפין (אמבטיות פרפין), תבנית הטבעה מתכתית קטנה לכל דגימה, ומלקחיים עדינים ל -65 מעלות צלזיוס.
- הסר בזהירות את PBS 1x ממתלה האורגנואידים. בצעו בעדינות 3 שטיפות ב-1 מ"ל של 1x Tris-buffered salt (TBS). הסר כמה שיותר 1x TBS מבלי לגעת באורגנואידים.
הערה: היזהר לא לשאוף את המדגם. במידת הצורך, בצע סיבוב של 5 דקות ב- 50 x g ב- RT. עקבות פוספט שנותרו יפריעו לשלבים הבאים, בעיקר מניעת פילמור ג'ל. לכן, אל תשתמש בפתרונות PBS במהלך כל שלב עיבוד. עבור שלב זה, ערכה מסחרית, המכילה קלטות, מגיב #1 (נוזל שקוף), ומגיב #2 (נוזל צבעוני), שימשה כדי להקל על הליך משובץ פרפין מבלי לאבד שברים זעירים (ראה טבלה של חומרים). יש לפעול בהתאם להוראות הערכה. הקלטות מורכבות מראש עם ניירות גיבוי ותוספות לוח כבר במקום. - הוסף 2 טיפות של מגיב #2 לתוך הצינור, וערבב בעדינות על ידי הקשה על הצינור. הוסף 2 טיפות של מגיב #1, וערבב שוב על ידי הקשה כדי להפוך את הג'ל להתמצק. בעזרת המלקחיים העדינים, מוציאים את הג'ל מהצינור ומניחים אותו בבאר הקלטת.
- מתחת למכסה המנוע, יש לייבש את הדגימה על ידי הצבת הקלטת באמבטיות עוקבות כדלקמן (השתמש בצלוחיות 150 מ"ל, והשתמש באתנול טרי או קסילן לכל אמבטיה): אתנול 70%, 30 דקות; אתנול 96%, 30 דקות; אתנול 100%, שלוש כביסות, 30 דקות כל אחת; קסילן, שלוש כביסות, 30 דקות כל אחת.
- הניחו את הקלטות באמבט פרפין שחומם מראש למשך 30 דקות בחום של 65°C, והעבירו אותן לאמבט פרפין טרי שחומם מראש למשך הלילה. לאחר הספגת פרפין, לוקחים תבנית הטבעה שחוממה מראש, ומוסיפים אליה פרפין מחומם. פתחו את הקלטת, עקרו בזהירות את הג'ל בעזרת מלקחיים עדינים, והניחו את הג'ל המכיל את המבנים התלת ממדיים על מרכז תבנית ההטבעה. המשך עם סעיף 3.3.
- שלבים נפוצים להטמעת פרפין
- מעבירים בעדינות את התבנית לאזור קר כדי לאפשר לפרפין להתמצק בשכבה דקה, שתשמור על המבנים התלת ממדיים במיקום המתאים. מוסיפים קסטת טישו על גבי התבנית, ומוסיפים פרפין חם כדי לכסות את קסטת הפלסטיק הזו. הסר את התבנית ברגע שהיא מוצקה לחלוטין, והמשך בסעיף 3.4.
הערה: קוביות פרפין ניתן לאחסן בטמפרטורת החדר במשך שנים.
- מעבירים בעדינות את התבנית לאזור קר כדי לאפשר לפרפין להתמצק בשכבה דקה, שתשמור על המבנים התלת ממדיים במיקום המתאים. מוסיפים קסטת טישו על גבי התבנית, ומוסיפים פרפין חם כדי לכסות את קסטת הפלסטיק הזו. הסר את התבנית ברגע שהיא מוצקה לחלוטין, והמשך בסעיף 3.4.

איור 2: סקירה כללית של הליך הטמעת פרפין של מודלים תלת-ממדיים של תרביות תאים תלת-ממדיות גדולות וקטנות במבחנה.
(A) הליך סטנדרטי לשיבוץ פרפין. לאחר קיבוע והתייבשות, מבנים תלת ממדיים מוכתמים עם eosin כדי להקל על הדמיה שלהם (למעלה ולמטה משמאל). מבנים תלת ממדיים ממוקמים בזהירות על כרית הביופסיה (כחול) בקלטת באמצעות צינור פסטר 2 מ"ל (באמצע). לאחר ספיגת פרפין, המבנים התלת-ממדיים מושלכים בעדינות לתוך הפרפין הנוזלי באמצעות מלקחיים ונסערים בעדינות בכרית הביופסיה. מבנים תלת-ממדיים קטנים הולכים לאיבוד במהלך שלב זה מכיוון שלא ניתן לשחרר אותם מהפד (מימין למטה: הטבעה כושלת). רק מבנים תלת-ממדיים גדולים יוטמעו (מימין למעלה: הטבעה מוצלחת). ראשי חץ מצביעים על תרבויות תלת-ממדיות. (B) חלופה לפרוטוקול שיבוץ פרפין סטנדרטי. לאחר קיבוע מבנים תלת ממדיים קטנים, ערכה מסחרית משמשת לשמירה על תאים בג'ל ולהקל על העברתם לתבנית לאחר ספיגת פרפין (מימין: הטבעה מוצלחת). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- חתך בלוקים וצביעה
- חתכו חתכים של 4 מיקרומטר באמצעות מיקרוטום סטנדרטי, ובצעו טכניקות היסטולוגיות ואימונוהיסטוכימיות סטנדרטיות. המשך עם סעיף 3.5.
הערה: שקופיות ספציפיות (ראה טבלת חומרים) שימשו להדבקה טובה יותר של מקטעים. ניתן לאחסן את המגלשות בטמפרטורת החדר או ב -4 מעלות צלזיוס במשך שנים.
- חתכו חתכים של 4 מיקרומטר באמצעות מיקרוטום סטנדרטי, ובצעו טכניקות היסטולוגיות ואימונוהיסטוכימיות סטנדרטיות. המשך עם סעיף 3.5.
- רכישה וניתוח של תמונות
- בצע הדמיה באמצעות סורק שקופיות דיגיטלי או מיקרוסקופ זקוף, ונתח נתונים באמצעות פלטפורמה לניתוח כמותי דיגיטלי מהיר המדווח על נתוני ביטוי מורפולוגיים ומרובבים על בסיס תא אחר תא על פני חלקים שלמים של מבנה תלת-ממדי (ראה איור משלים 2 לפרטים).
הערה: המטרה 20x נמצאת בשימוש שגרתי על-ידי קבוצה זו.
- בצע הדמיה באמצעות סורק שקופיות דיגיטלי או מיקרוסקופ זקוף, ונתח נתונים באמצעות פלטפורמה לניתוח כמותי דיגיטלי מהיר המדווח על נתוני ביטוי מורפולוגיים ומרובבים על בסיס תא אחר תא על פני חלקים שלמים של מבנה תלת-ממדי (ראה איור משלים 2 לפרטים).
תוצאות
פרוטוקול זה מספק סקירה כללית של השלבים הקריטיים לצביעה דו-ממדית ותלת-ממדית של הרכבה מלאה, כמו גם הדמיה וניתוח כמותי של מודלים תלת-ממדיים של תרביות תאים (איור 3 ואיור 4). הוא ישים למגוון רחב של מודלים תלת-ממדיים של תרביות תאים – מספרואידים ועד אורגנואידים ממינים או רקמות מארחים שונים – ומאפשר קבלת מידע מדויק וכמותי על ארכיטקטורה, ארגון תאים ואינטראקציות ברמה התאית והתת-תאית (איור 3 ואיור 4). מעבדות עשויות להזדקק לאופטימיזציה של טכניקות היסטולוגיות ואימונוהיסטוכימיות דו-ממדיות וריכוזי נוגדנים בהתאם לצרכים שלהן.
שתי השיטות מניבות מידע ביולוגי רב ערך. צביעה תלת-ממדית בהרכבה מלאה ומיקרוסקופ קונפוקלי מספקים מידע חזותי על הרכב התאים והמיקום המרחבי עם שדה עומק של עד 200 מיקרומטר (איור 3B). עם זאת, חתך דו-ממדי נוח למבנים תלת-ממדיים גדולים יותר לחשוף תכונות מורפולוגיות תאיות מפורטות בכל החלק של מבנים תלת-ממדיים שאחרת יכול להיות מאתגר לצפות בהן באתרן עקב פיזור אור שפוגע ברזולוציה בדגימות גדולות יותר. יתר על כן, שתי הטכניקות יכולות לספק נתונים כמותיים. ואכן, הרזולוציה המתקבלת מאפשרת יישום של אלגוריתמי סגמנטציה תאיים ותת-תאיים לכימות מספר התאים ולזיהוי נוכחות של סמנים תאיים שונים בתת-סוגים תאיים שונים (איור 3F ואיור 4). לסיכום, טכניקות ההדמיה המתוארות כאן ניתנות לשחזור, פשוטות ומשלימות ומייצגות כלים רבי ערך לחקר הטרוגניות תאית.
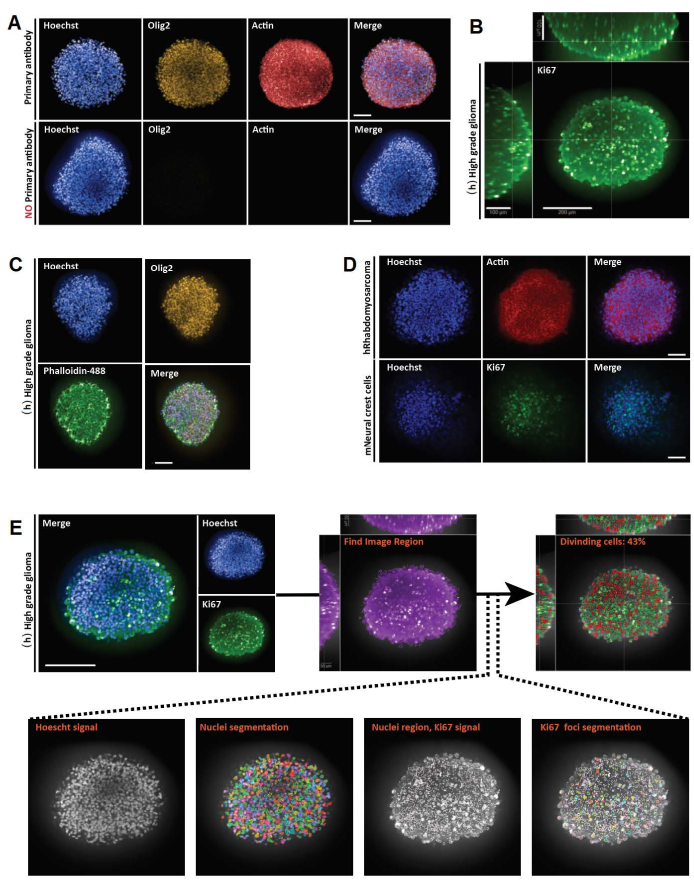
איור 3: תוצאות מייצגות עבור הרכבה שלמה תלת-ממדית, הדמיה וניתוח של מקטעים אופטיים תלת-ממדיים ודו-ממדיים. (A) תמונות קונפוקליות של גליומה ספרואיד בדרגה גבוהה (h) אנושיים שגודלו בתרבית במשך שבוע וסומנו עם Hoechst (כחול), Olig2 (צהוב) ו-Actin (אדום) (20x מטרת מים). עבור כל התמונות שנרכשו, הגדרות המיקרוסקופ נקבעו באמצעות בקרה חיובית (למעלה), ולאחר מכן הבקרה השלילית צולמה באמצעות הגדרות זהות כדי לשלוט בחוסר פלואורסצנטיות בהיעדר נוגדן ראשוני (למטה). (B) ייצוג תלת-ממדי אורתוגונלי של צביעת Ki67 המבוצע ב-(h) גליומה ספרואיד בדרגה גבוהה בתרבית במשך שבוע (ניקוי גליצרול-פרוקטוז; 20x מטרת מים, קונפוקל). (C) תמונות קונפוקליות של (h) גליומה ספרואיד ברמה גבוהה שגודלו בתרבית במשך שבוע וסומנו עם Hoechst (כחול), Olig2 (צהוב) ו-Phalloidine-488 (ירוק) (ניקוי גליצרול-פרוקטוז; יעד מים פי 20). (D) תמונות קונפוקליות של ספרואידים אנושיים (h) רבדומיוסרקומה (למעלה) ועכבר (m) תאי פסגה עצביים (למטה) שגודלו בתרבית במשך שבוע וסומנו ב-Hoechst (כחול), Actin (אדום) ו-Ki67 (ירוק), בהתאמה (ניקוי גליצרול-פרוקטוז; 20x מטרה יבשה). (E) תמונות קונפוקליות של (h) גליומה ספרואיד ברמה גבוהה שגודלו בתרבית במשך שבוע וסומנו עם Hoechst (כחול) ו-Ki67 (ירוק) (ניקוי גליצרול-פרוקטוז; 40x מטרת מים) (למעלה משמאל). תמונות מקוטעות בערוץ Hoechst ובאזורים גרעיניים חיוביים ל-Ki67 (+) בערוץ הירוק נוצרו באמצעות תוכנת ניתוח תוכן גבוה (ראו איור משלים 1 וטבלת חומרים) (למטה). הפלט הנתון הוא אחוז גרעיני Ki67+ לכל מבנה תלת-ממדי מקוטע (למעלה מימין). סרגל קנה מידה = 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
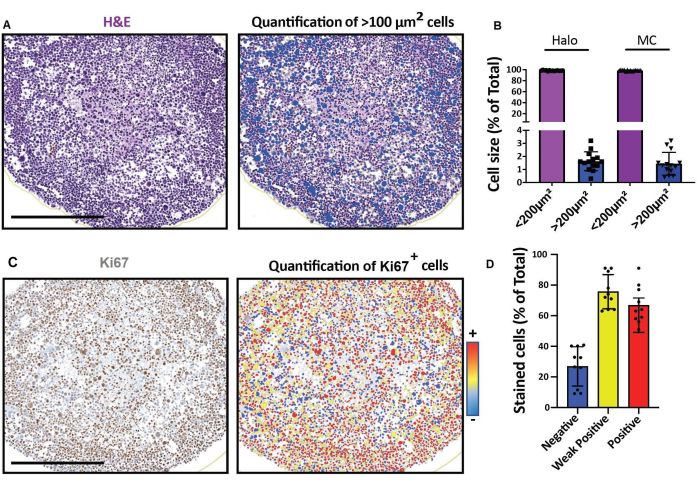
איור 4: תוצאות מייצגות עבור הדמיה וניתוח של מקטעים אופטיים דו-ממדיים. (A, D) תמונות חתך דו-ממדיות של מודל תא תלת-ממדי (ספרואידים אנושיים מסוג rhabdomyosarcoma שגודלו בתרבית במשך חודש) שהתקבלו באמצעות סורק שקופיות דיגיטלי ונותחו על פלטפורמה לניתוח כמותי דיגיטלי מהיר. (A) צביעת H&E ואיתור תאים בהתאם לגודלם. סרגל קנה מידה = 500 מיקרומטר. (B) היסטוגרמה מראה אחוז התאים < 100 מיקרומטר 2 ו- > 100 מיקרומטר2 שזוהו באמצעות תוכנה לניתוח כמותי דיגיטלי מהיר (משמאל: Halo) או ספירה ידנית (מימין: MC). (C) צביעת Ki67 וזיהוי תאים בהתאם לעוצמת האות 3,3'-diaminobenzidine (DAB) שלהם. שלילי (כחול), חיובי חלש (צהוב), חיובי (אדום). סרגל קנה מידה = 500 מיקרומטר. (D) היסטוגרמה מציגה אחוז של תאים שליליים מסוג Ki67, חיוביים חלשים וחיוביים. קיצורים: H&E = hematoxylin ו eosin; MC = ספירה ידנית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תרשים משלים 1: סקירה כללית של השלבים בתוכנת ניתוח ההדמיה. הניתוחים מבוססים על שיוך אבני בניין. כל אבן בניין מתאימה לפונקציה - סגמנטציה, חישוב, שיוך, הגדרת פלט - ומציעה אלגוריתמים מרובים ובחירות משתנים כדי להתאים למדגם הביולוגי המצולם. התוכנה מספקת פרוטוקולי ניתוח RMS מרובים (Ready Made Solution) שניתן להשתמש בהם ולשנות בקלות. ניתן לשמור פרוטוקולי ניתוח תמונה משולבים, להחיל אותם על ערכות נתונים שונות ולשתף אותם בין משתמשים. בקצרה, פרוטוקול הניתוח מרמז על פילוח אובייקטים רציף: ספרואידים, גרעינים ולבסוף, כיסי Ki67 (A488). לאחר מכן, העוצמה הממוצעת של כיסי Ki67 מחושבת כדי להפלות עוד יותר את האירועים החיוביים. לבסוף, גרעינים המקיפים כיסים חיוביים Ki67 נבחרים באופן חיובי. אנא לחץ כאן כדי להוריד קובץ זה.
תרשים משלים 2: סקירה כללית של שלבי הפרוצדורה של תוכנת הניתוח הכמותי. שלב 1. העלה את הקבצים באמצעות הכרטיסיה מחקרים . הקבצים ייפתחו במקטע פעולות תמונה . שלב 2. פתחו את הכרטיסייה ' ביאורים ' ולחצו על 'פעולות שכבה ' כדי לעצב שכבה חדשה מסביב למבנה באמצעות הכלי עיגול של סרגל הכלים. למבנים שאינם עגולים, ניתן להשתמש בכלי העט במקום זאת. שלב 3. ניתן להשתמש בסרגל הכלים כדי לעצב ביאורים ולהמחיש את הכימות באמצעות הכלי  . שלב 4. פתח את הכרטיסייה ניתוח ובחר את התנאים הטובים ביותר לניתוח המדגם (ייתכן שיהיה צורך במספר ניסויים כאן). שלב 4.1. השתמשו באזור 'בחירת כתמים ' כדי להגדיר את מצב הצביעה. במקרה של מספר כתמים, ניתן להוסיף אותם ולשנות את שמם, וניתן לשנות את הצבע הווירטואלי . זיהוי הלוקליזציה יכול להיות מוגדר - צביעה גרעינית או ציטופלסמה. שלב 4.2. השתמש במקטע זיהוי תאים כדי להגדיר את זיהוי התא. סעיף זה יהיה החשוב ביותר לניתוח. סעיף סף הניגודיות הגרעינית יאפשר גילוי של כל הגרעינים. יש לשים לב במקרה שיש מספר גדלי אוכלוסייה, התוכנה יכולה לזהות מספר תאים במקום תא גדול ייחודי. ניתן להשתמש במדורי גודל גרעיני ותוקפנות פילוח גרעיני כדי לכמת טווחי אוכלוסייה של גודל תאים. שלב 5. תיאור כיצד להפעיל ניתוח לדוגמה. בצע את השלבים המוצגים באיור. המקטע שכבת ביאור יפעיל את ההגדרה רק בשקופית זו. ניתן להמחיש את הכימות באמצעות הכלי
. שלב 4. פתח את הכרטיסייה ניתוח ובחר את התנאים הטובים ביותר לניתוח המדגם (ייתכן שיהיה צורך במספר ניסויים כאן). שלב 4.1. השתמשו באזור 'בחירת כתמים ' כדי להגדיר את מצב הצביעה. במקרה של מספר כתמים, ניתן להוסיף אותם ולשנות את שמם, וניתן לשנות את הצבע הווירטואלי . זיהוי הלוקליזציה יכול להיות מוגדר - צביעה גרעינית או ציטופלסמה. שלב 4.2. השתמש במקטע זיהוי תאים כדי להגדיר את זיהוי התא. סעיף זה יהיה החשוב ביותר לניתוח. סעיף סף הניגודיות הגרעינית יאפשר גילוי של כל הגרעינים. יש לשים לב במקרה שיש מספר גדלי אוכלוסייה, התוכנה יכולה לזהות מספר תאים במקום תא גדול ייחודי. ניתן להשתמש במדורי גודל גרעיני ותוקפנות פילוח גרעיני כדי לכמת טווחי אוכלוסייה של גודל תאים. שלב 5. תיאור כיצד להפעיל ניתוח לדוגמה. בצע את השלבים המוצגים באיור. המקטע שכבת ביאור יפעיל את ההגדרה רק בשקופית זו. ניתן להמחיש את הכימות באמצעות הכלי  . חזור על שלבים 4.1-5 עד להשגת כימות מתאים. שלבים 6-6.1. שלבים אלה מאפשרים לך לצייר דמות באמצעות התוכנה. שלב 7. ניתן לשמור גרפיקה לכימות המתקבלת באמצעות תוכנה. שלב 8. ניתן לייצא נתונים. אנא לחץ כאן כדי להוריד קובץ זה.
. חזור על שלבים 4.1-5 עד להשגת כימות מתאים. שלבים 6-6.1. שלבים אלה מאפשרים לך לצייר דמות באמצעות התוכנה. שלב 7. ניתן לשמור גרפיקה לכימות המתקבלת באמצעות תוכנה. שלב 8. ניתן לייצא נתונים. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
תרבית תאים היא כלי חיוני לחשיפת מנגנונים ביולוגיים בסיסיים המעורבים בהתפתחות רקמות ואיברים, תפקוד, התחדשות ושיבוש ומחלות. למרות שתרבית תאים דו-ממדית חד-שכבתית שלטה, המחקר האחרון עבר לתרביות המייצרות מבנים תלת-ממדיים המשקפים יותר תגובות תאיות in vivo, בעיקר בשל ארגון מרחבי נוסף ומגעים בין תאים המשפיעים על ביטוי גנים והתנהגות תאית ולכן יכולים לספק נתונים מנבאים יותר7. עם זאת, נותרו אתגרים רבים, כולל הצורך בטכניקות צביעה והדמיה ידידותיות למשתמש לצורך הדמיה מיקרוסקופית מפורטת והערכה של מבנים תלת-ממדיים מורכבים ברמה התאית והתת-תאית. בהקשר זה, ניתנו פרוטוקולים מפורטים, חזקים ומשלימים לביצוע צביעה והדמיה ברזולוציה תאית ותת-תאית של מודלים קבועים של תרביות תאים תלת-ממדיות במבחנה שגודלם נע בין 100 מיקרומטר למספר מילימטרים.
הליך זה מציג שתי אסטרטגיות שונות להתמודדות עם מגוון רחב של גדלים וסוגים של מודלים תלת-ממדיים של תרביות תאים במבחנה. הבחירה של אחד (3D All-mount analysis) או השני (2D sectioning analysis) יהיה תלוי במודל שבו נעשה שימוש והנושא נחקר. ניתוח תלת-ממדי של כל ההרכבה על ידי מיקרוסקופ קונפוקלי מאפשר הדמיה של תאים עם שדה עומק של עד 200 מיקרומטר, ללא קשר לגודל הכולל של המבנה התלת-ממדי, בעוד שחתך דו-ממדי חל על דגימות בכל גודל, אך ויזואליזציה נשארת דו-ממדית. להלן כמה הצעות לפתרון בעיות ולשיקולים טכניים.
אובדן מבנים תלת-ממדיים במהלך זרימת העבודה הוא החיסרון הנפוץ ביותר. הם יכולים להישאר דבקים בקצוות וצינורות, ולכן טיפים וצינורות ציפוי מראש עם פתרון PBS-BSA 0.1% הוא המפתח. יתר על כן, חיוני לתת למבנים התלת-ממדיים לשקוע בין שינויים מגיבים ולבצע את כל הפיפטינג בזהירות רבה. כפי שהוזכר בהליך, עבור כל השלבים, אם שקיעת מבנה תלת מימד ארוכה מדי, ניתן לסובב תאים בעדינות ב 50 × גרם במשך 5 דקות ב- RT. בהתאם למטרת המחקר, יש לשקול את היתרונות / חסרונות של צעד מסתובב כזה מכיוון שצנטריפוגה יכולה לסכן את צורת המבנים התלת-ממדיים. יתר על כן, יש להקפיד לשמר מורפולוגיה זו במהלך שלב הקיבוע מכיוון שאורגנואידים ציסטיים נוטים לקרוס. תיקון מבנים שגודלם מתחת ל-400 מיקרומטר אמור למנוע שינויים מבניים.
עבור תיוג חיסוני אופטימלי, התאוששות של אורגנואידים מהמטריצות התלת-ממדיות שלהם היא צעד מכריע. המטריצה התלת-ממדית יכולה לעכב חדירת נוגדנים נאותה או להוביל לצביעת רקע גבוהה בגלל קשירה לא ספציפית למטריצה. הסרת ECM עשויה לשנות את המורפולוגיה של המקטעים החיצוניים של אורגנואידים (במיוחד במקרה של בליטות תאיות קטנות המשתרעות ממבנים תלת-ממדיים נחקרים) ולעכב חלקית ניתוחים. עבור מבנים תלת ממדיים כאלה, המטריצה יכולה להישמר לאורך כל ההליך; עם זאת, יש להתאים בקפידה את תנאי התרבית לגידול תאים בכמות מינימלית של מטריצה כדי למנוע חדירה לא מספקת של תמיסות ונוגדנים ולהימנע מצעדי שטיפה רצופים שמטרתם להפחית רעשי רקע מוגזמים 6,8.
שלב הניקוי האופטי המתואר בפרוטוקול זה בסעיף צביעת ההרכבה התלת-ממדית הרלוונטית להדמיה של מבנים תלת-ממדיים בעומק של עד 150-200 מיקרומטר במקום 50-80 מיקרומטר ללא ניקוי. בהשוואה למתודולוגיות סליקה אחרות הדורשות לעתים קרובות מספר שבועות ושימוש בחומרי סליקה רעילים, בפרוטוקול 4,9 זה נעשה שימוש בשלב סליקה מהיר ובטוח שפורסם בעבר. בנוסף, שלב ניקוי זה הפיך, וניתן להוסיף נוגדנים חדשים לצביעה הראשונית ללא אובדן רזולוציה או בהירות4. עם זאת, בהתאם למודל תרבית התאים התלת-ממדי שנחקר, עומק של 150-200 מיקרומטר עשוי שלא להספיק כדי לדמות את המבנה התלת-ממדי בצורה אינפורמטיבית, ופרוטוקול ניקוי זה יכול לגרום לשינויים במורפולוגיה הכללית של אורגנואידים חד-שכבתיים כדוריים עם לומןגדול 4. על המשתמשים לתכנן בקפידה את הניסוי שלהם, ובמידת הצורך, לייעל את העיתוי של שלב החדירה/חסימה (כדי לאפשר חדירה של נוגדנים ותמיסה), שלב הניקוי (כדי לחדור עמוק יותר מ-200 מיקרומטר, הדגימות צריכות להיות מנוקות לחלוטין) ורכישת תמונה. שתי הטכנולוגיות הנפוצות ביותר הזמינות במתקני הליבה יהיו יריעות אור ומיקרוסקופ קונפוקלי. המשתמשים יצטרכו לבחור בקפידה טכנולוגיה המבוססת על גודל המבנים התלת-ממדיים שלהם והשאלה הביולוגית שלהם10. עם זאת, בהשוואה למיקרוסקופ קונפוקלי, רזולוציית מיקרוסקופ יריעות האור המתקבלת עבור מבנים עמוקים כאלה נותרה תת-אופטימלית לקבלת רזולוציה תת-תאית.
כאן דווח על תהליך מפורט וחזק המוקדש להטמעת פרפין של דגימות בודדות. מעניין לציין כי גבריאל ועמיתיו פיתחו לאחרונה פרוטוקול להטמעת תרביות תאים תלת-ממדיות בפרפין עם תפוקה מוגברת. הם השתמשו בתבנית פולידימתילסילוקסאן (PDMS) כדי לכלוא 96 מבנים תלת-ממדיים בתבנית מיקרו-מערך בבלוק אחד, וסיפקו פרספקטיבות חדשות למחקרים על מודלים תלת-ממדיים של גידולים שהקיפו יותר קבוצות, נקודות זמן, תנאי טיפול ושכפול11. עם זאת, שיטה זו דורשת מיומנויות ומכונות נרחבות, בעיקר לייצור התבנית המוקדמת המשמשת ליצירת תבניות PDMS.
לסיכום, מאמר זה מתאר שתי גישות שונות, משלימות וניתנות להתאמה המאפשרות קבלת מידע מדויק וכמותי על ההרכב האדריכלי והתאי של מודלים סלולריים תלת-ממדיים. שני הפרמטרים חיוניים לחקר תהליכים ביולוגיים כגון הטרוגניות תאית תוך-גידולית ותפקידה בעמידות לטיפולים.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי פרס רוברט ג'יי ארצ'י לחדשנות #604303 של סנט בולדריק.
Materials
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Biopsy pad Q Path blue | VWR | 720-2254 | |
| Cassettes macrostar III Blc couv. Char. x1500 | VWR | 720-2233 | |
| Cassette microtwin white | VWR | 720-2183 | |
| Chemical hood | Erlab | FI82 5585-06 | |
| Filter tips 1000 µL | Star lab Tip-One | S1122-1730 | |
| Fine forceps | Pyramid innovation | R35002-E | |
| Flat-bottom glass tubes with PTFE lined 2 mL | Fisher Scientific | 11784259 | Excellent for environmental samples, pharmaceuticals and diagnostic reagents. PTFE is designed for the ultimate in product safety. PTFE provides totally inert inner seal and surface facing the sample or product. |
| Glass bottom dish plate 35 mm | Ibedi | 2018003 | |
| Horizontal agitation | N-BIOTEK | NB-205 | |
| Incubator prewarmed to 65 °C | Memmert Incubator | LAB129 | |
| Inox molds 15x15 | VWR | 720-1918 | |
| Microscope Slides Matsunami TOMO-11/90 | Roche diagnostics | 8082286001 | these slides are used for a better adhesion of sections |
| Microtome | Microm Microtech France | HM340E | |
| Panoramic scan II | 3dhistech | 2397612 | |
| Paraffin embedding equipment | Leica | EG1150C | |
| Plastic pipette Pasteur 2 mL | VWR | 612-1681 | |
| Q Path flacon 150mL cape blanc x250 | VWR | 216-1308 | Good for environmental samples, pharmaceuticals and diagnostic reagents. Polypropylene (PP) are rigid, solid, provide excellent stress crack and impact resistance and have a good oil and alcohol barrier and chemical resistance. PE-lined cap is stress crack resistant and offers excellent sealing characteristics. |
| Set of micropipettors (p200, p1000) | Thermo Scientific | 11877351 (20-200) 11887351(p1000) | |
| OPERA PHENIX | PerkinElmer | HH14000000 | |
| SP5 inverted confocal microscope | Leica | LSM780 | |
| Tissue cassette | VWR | 720-0228 | |
| Zeiss Axiomager microscope | Leica | SIP 60549 | |
| Reagent | |||
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A7030-100G | |
| Cytoblock (kit) | Thermofisher Scientific | 10066588 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 57648266 | CAUTION: toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Eosin aqueous 1% | Sigma-Aldrich | HT110316 | |
| Ethanol 96% | VWR | 83804.360 | CAUTION: Causes severe eye irritation. Flammable liquid and vapor. Causes respiratory tract irritation. Manipulate in a fume hood. Wear protective eye goggles. |
| Ethanol 100% | VWR | 20821.365 | CAUTION: Causes severe eye irritation. Flammable liquid and vapor. Causes respiratory tract irritation. Manipulate in a fume hood. Wear protective eye goggles. |
| Formalin 4% | Microm Microtech France | F/40877-36 | CAUTION: Formalin contains formaldehyde which is hazardous. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves and protective eye goggles. |
| Fructose | Sigma-Aldrich | F0127 | |
| Gill hematoxylin type II | Microm Microtech France | F/CP813 | |
| Glycerol | Sigma-Aldrich | G5516 | 500 mL |
| Hoechst 33342 | Life Technologies | H3570 | CAUTION: Suspected of causing genetic defects. Avoid direct contact with skin. Wear rubber gloves and protective eye goggles. |
| Normal donkey serum | Sigma-Aldrich | D9663 | 10 mL |
| Paraffin Wax tek III | Sakura | 4511 | |
| Phosphate Buffer Saline (PBS) 1 X | Gibco | 14190-094 | |
| Tris-Buffered Saline (TBS) 10X | Microm Microtech France | F/00801 | 100 mL |
| Triton X-100 | Sigma-Aldrich | T8532 | CAUTION: Triton X100 is hazardous. Avoid contact with skin and eyes. |
| Xylene | Sigma-Aldrich | 534056 | CAUTION: Xylene is toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Solutions | |||
| Clearing solution | Glycerol-Fructose clearing solution is 60% (vol/w) glycerol and 2.5 M fructose. To prepare 10 mL of this solution, mix 6 mL of glycerol and 4.5 g of fructose. Complete to 10 mL with dH2O. Use a magnetic stirrer overnight. Refractive index = 1.4688 at room temperature (RT: 19–23 °C). Store at 4 °C in dark for up to 1 month. | ||
| PBS-BSA 0,1% solution | To prepare 0,1% (vol/wt) PBS-BSA 0,1% solution, dissolve 500 mg of BSA in 50 mL of PBS-1X (store at 4°C for up to 2 weeks). And dilute 1mL of this solution into 9mL of PBS-1X. This solution can be used to precoat the tip and centrifugation tube. | ||
| Permeabilisation-blocking solution (PB solution) | The PBSDT blocking solution is PBS-1X supplemented with 0.1% – 1% Tritonx-100 (depending on the protein localization membrane/nucleus), 1% DMSO, 1% BSA and 1% donkey serum (or from the animal in which the secondary antibodies were raised). This solution can be stored at 4°C for up to 1 month. | ||
| PB:PBS-1X (1:10) solution | PB:PBS-1X (1:10) solution is a 10 time diluted PB solution. To prepare 10 mL of this solution dilute 1 mL of PB solution in 9 mL of PBS-1X. | ||
| Software | |||
| Halo software | Indicalabs | NM 87114 | |
| Harmony software | PerkinElmer | HH17000010 |
References
- Ryu, N. E., Lee, S. H., Park, H. Spheroid culture system methods and applications for mesenchymal stem cells. Cells. 8 (12), 1-13 (2019).
- Bartfeld, S., Clevers, H. Stem cell-derived organoids and their application for medical research and patient treatment. Journal of Molecular Medicine. 95 (7), 729-738 (2017).
- Cui, X., Hartanto, Y., Zhang, H. Advances in multicellular spheroids formation. Journal of the Royal Society, Interface. 14 (127), (2017).
- Dekkers, J. F., et al. High-resolution 3D imaging of fixed and cleared organoids. Nature Protocols. 14, 1756-1771 (2019).
- Broutier, L., et al. Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation. Nature Protocols. 11 (9), 1724-1743 (2016).
- Rezanejad, H., Lock, J. H., Sullivan, B. A., Bonner-Weir, S. Generation of pancreatic ductal organoids and whole-mount immunostaining of intact organoids. Current Protocols in Cell Biology. 83 (1), 82 (2019).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. Assay and Drug Development Technologies. 12 (4), 207-218 (2014).
- McCray, T., Richards, Z., Marsili, J., Prins, G. S., Nonn, L. Handling and assessment of human primary prostate organoid culture. Journal of Visualized Experiments: JoVE. (143), e59051 (2019).
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nature Reviews: Neuroscience. 21 (2), 61-79 (2020).
- Lazzari, G., et al. Light sheet fluorescence microscopy versus confocal microscopy: in quest of a suitable tool to assess drug and nanomedicine penetration into multicellular tumor spheroids. European Journal of Pharmaceutics and Biopharmaceutics. 142, 195-203 (2019).
- Gabriel, J., Brennan, D., Elisseeff, J. H., Beachley, V. Microarray embedding/sectioning for parallel analysis of 3D cell spheroids. Scientific Reports. 9, 16287 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved